ISOLASI SENYAWA FLAVONOIDA DARI ALBEDO JERUK
BALI MERAH ( Citrus maxima Merr. )
SKRIPSI
MELDA DAMAYANTI LUBIS
090802019
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI ALBEDO JERUK BALI MERAH (Citrus maxima MERR.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
MELDA DAMAYANTI LUBIS
090802019
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI
ALBEDO JERUK BALI MERAH
(Citrus maxima Merr.)
Kategori : SKRIPSI
Nama Mahasiswa : MELDA DAMAYANTI LUBIS Nomor Induk Mahasiswa : 090802019
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, September 2013
Komisi Pembimbing
Pembimbing 2 Pembimbing 1
Dra. Frida Simanjuntak Lamek Marpaung, M.Phil, Ph.D NIP: 1958 0509 1986 012001 NIP: 1952 0828 1982 031001
Diketahui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI ALBEDO JERUK BALI MERAH
(Citrus maxima Merr.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2013
MELDA DAMAYANTI LUBIS
PENGHARGAAN
Segala Puji dan syukur saya ucapkan kepada Tuhan Yesus Kristus atas kasih dan anugerahNya yang begitu besar, sehingga saya mampu menyelesaikan skripsi ini dalam waktu yang indah yang telah ditetapkanNya.
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada albedo jeruk bali merah (Citrus maxima Merr.) telah dilakukan secara maserasi dengan pelarut metanol.
Ekstrak pekat metanol dilarutkan dengan etil asetat sampai larutan etil asetat bening. Ekstrak pekat etil asetat dilarutkan dengan metanol. Ekstrak metanol pekat kemudian dihidrolisa dengan HCl 2 N, kemudian filtratnya diekstraksi dengan kloroform. Ekstrak pekat kloroform dianalisis dengan KLT, kemudian dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan fasa gerak n-heksana : etil asetat dengan perbandingan (90:10)v/v, (80:20)v/v, (70:30)v/v dan (60:40)v/v. Fraksi dari perbandingan (80:20)v/v selanjutnya dilakukan kromatografi lapis tipis preparatif dan direkristalisasi untuk mendapatkan senyawa murni. Senyawa murni yang diperoleh
dari hasil isolasi berbentuk kristal jarum, berwarna kuning kecoklatan dengan massa = 9,2 mg, titik lebur 146-148o C dan Rf = 0,72. Selanjutnya senyawa yang
ISOLATION OF FLAVONOID COMPOUNDS FROM ALBEDO OF RED
BALI CITRUS ( Citrus maxima Merr.)
ABSTRACT
Isolation of flavonoid compound from albedo of red bali citrus (Citrus maximaMerr.) has been done with maceration by methanol solvent. The concentrated extract then dissolved with aethyl acetate until the solution clear. The concentrated extract of aethyl acetate then dissolved with methanol. The concentrated extract of methanol then hydrolized by HCl 2 N. Then, the filtrate was extracted with chloroform to get the flavonoid compound. The concentrated chloroform extract was analysed with thin layer chromatography, then separated with column chromatography with silica gel as the stationary phase and n-hexane : ethyl acetate (90:10)v/v, (80:20)v/v, (70:30)v/v dan (60:40)v/v as the mobile phase. The fractions from n-hexane : ethyl acetate (80:20)v/v were purified with TLC preparative and recrystallization to get a pure
coumpound. The pure coumpound is tawny crystal with weight = 9,2, melting point = 146-1480 C and Rf = 0,72 . The compound further identified analysis
DAFTAR ISI
Halaman
Persetujuan ii Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Lampiran ix
Daftar Gambar x
Daftar Tabel xi
Bab 1 Pendahuluan 1
1.1 Latar Belakang 3
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
1.5 Lokasi Penelitian 4
1.6 Metodologi Penelitian 5
Bab 2 Tinjauan Pustaka 5
2.1 Tumbuhan Jeruk Bali Merah 5
2.1.1 Morfologi Tumbuhan Jeruk Bali Merah 5 2.1.2 Manfaat Buah Jeruk Bali Merah 6 2.1.3 Sistematika Tumbuhan Jeruk Bali Merah 6
2.2 Tumbuhan Jeruk Bali 6
2.3 Klasifikasi Bahan Alam 8 2.3.1 Senyawa Metabolit Primer 8
2.3.2 Senyawa Metabolit Sekunder 9
2.4 Senyawa Flavonoida 9
2.4.1 Struktur Dasar Flavonoida 11
2.4.2 Kegunaan Senyawa Flavonoida 12
2.4.3 Klasifikasi Senyawa Flavonoida 13 2.4.4 Sifat Kelarutan Senyawa Flavonoida 21
2.5 Teknik Pemisahan 22
2.5.1 Ekstraksi 22
2.5.2 Kromatografi 23
2.5.2.1 Kromatografi Lapis Tipis 23 2.5.2.2 Kromatografi Kolom 25 2.5.2.3 Kromatografi Lapis Tipis Preparatif 26
2.6 Teknik Spektroskopi 27
2.6.1 Spektrofotometer Ultra-Violet (UV-Vis) 27 2.6.2 Spektrofotometer Inframerah (FT-IR) 29 2.6.3 Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) 30
Bab 3 Metedologi Penelitian 32
3.2 Bahan-bahan 33
3.3 Prosedur Penelitian 33
3.3.1 Penyediaan Sampel 33
3.3.2 Uji Pendahuluan Terhadap Ekstrak Albedo Jeruk Bali Merah 33 3.3.2.1 Skrining Fitokimia 34 3.3.2.2 Analisis Kromatografi Lapis Tipis 34
3.3.3 Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol dari 35 Albedo Jeruk Bali
3.3.4 Pemblokan Tanin 35
3.3.5 Hidrolisis Gula 35
3.3.6 Ekstraksi Partisi dengan Kloroform 36 3.3.7 Isolasi Senyawa Flavonoida dengan kromatografi Kolom 36 3.3.8 Pemurnian Hasil Isolasi 37 3.3.8.1 Pemurnian Hasil Isolasi dengan 37 Kromatografi Lapis Tipis
3.3.8.2 Rekristalisasi 38 3.3.9 Uji Kemurnian Hasil Isolasi 38 3.3.9.1 Uji Kemurnian Hasil Isolasi dengan 38 Kromatografi Lapis Tipis 3.3.9.2 Uji Kemurnian Hasil Isolasi dengan 38
Penentuan Titik Lebur
3.3.10 Identifikasi Senyawa Hasil Isolasi 39 3.3.10.1 Identifikasi dengan Spektrofotometer 39 Ultraviolet-Visibel (UV-Vis)
3.3.10.2 Identifikasi dengan Spektrofotometer 39 Inframerah (FT-IR)
3.3.10.3 Identifikasi dengan Spektrofotometer 39 Resonansi Magnetik Inti Proton ( 1H-NMR)
3.4 Bagan Skrining Fitokimia 40 3.4.1 Bagan Skrining Fitokimia dengan Metanol 40 3.4.2 bagan Skrining Fitokima dengan Etil Asetat 41 3.5 Bagan Penelitian 42
Bab 4 Hasil dan Pembahasan 44
4.1 Hasil 44
4.2 Pembahasan 49
Bab 5 Kesimpulan dan saran 52
5.1 Kesimpulan 52
5.2 Saran 52
DAFTAR PUSTAKA 53
LAMPIRAN 56
DAFTAR LAMPIRAN
Halaman
Lampiran A. Determinasi Buah Jeruk Bali Merah 57 (Citrus maximaMerr.)
Lampiran B. Gambar Albedo dan Buah Jeruk Bali Merah 58 (Citrus maximaMerr.)
Lampiran C. Kromatogram Lapisan Tipis Ekstrak Pekat Lapisan Metanol 59 Albedo Jeruk Bali Merah (Citrus maximaMerr.)
Lampiran D. Kromatogram Lapis Tipis Senyawa Hasil Isolasi 61 Penampakan Noda FeCl3 5% setelah kromatografi Kolom Lampiran E. Kromatogram Lapisan Tipis Senyawa Hasil Isolasi 62
Penampakan Noda FeCl3 dengan Uji Kemurnian
Lampiran F. Spektrum Ultra-Tampak (UV-Visible) Senyawa Pembanding 63 Lampiran G. Spektrum 1H-NMR Senyawa Hasil Isolasi 64 Lampiran H. Lampiran H. Spektrum Ekspansi 1H-NMR Senyawa Hasil Isolasi 65
Pada δ = 7,3-7,4 dan Pada δ = 6,8-6,9
Lampiran I. Spektrum Ekspansi 1H-NMR Senyawa Hasil Isolasi Pada 66 δ = 3,1483-3,1742 ppm dan δ = 2,7514-2,7449 ppm
DAFTAR GAMBAR
Halaman
Gambar 2.1 Kerangka Dasar Senyawa Flavonoida 12
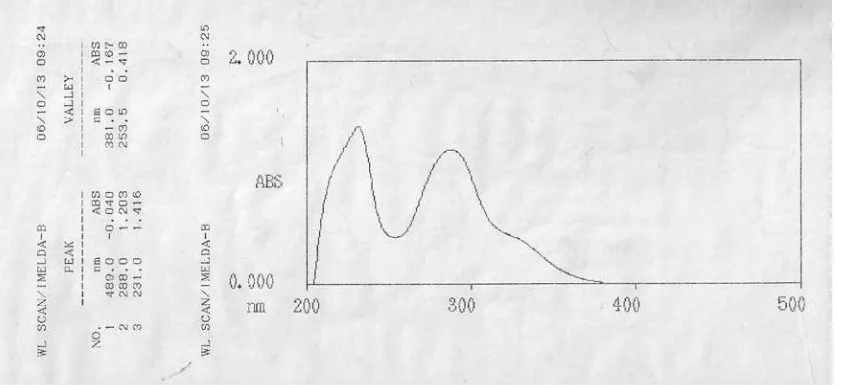
Gambar 4.1 Spektrum UV-Visible Senyawa hasil Isolasi 45
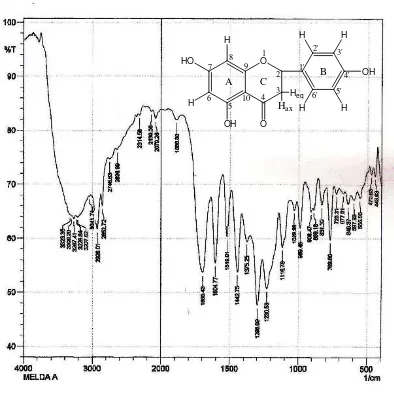
Gambar 4.2 Spektrum FT-IR Senyawa Hasil Isolasi 46
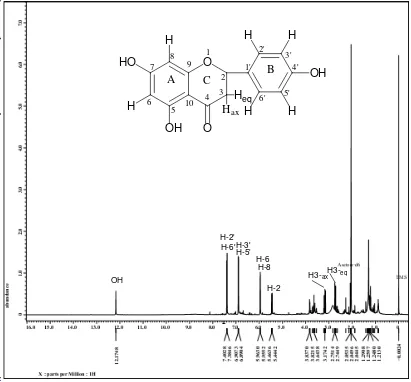
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi 48
DAFTAR TABEL
Halaman
Tabel 2.1 Golongan-golongan flavonoida menurut Harborne 20 Tabel 2.2 Tabel Rentang serapan spektrum UV-tampak flavonoida 28
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada albedo jeruk bali merah (Citrus maxima Merr.) telah dilakukan secara maserasi dengan pelarut metanol.
Ekstrak pekat metanol dilarutkan dengan etil asetat sampai larutan etil asetat bening. Ekstrak pekat etil asetat dilarutkan dengan metanol. Ekstrak metanol pekat kemudian dihidrolisa dengan HCl 2 N, kemudian filtratnya diekstraksi dengan kloroform. Ekstrak pekat kloroform dianalisis dengan KLT, kemudian dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan fasa gerak n-heksana : etil asetat dengan perbandingan (90:10)v/v, (80:20)v/v, (70:30)v/v dan (60:40)v/v. Fraksi dari perbandingan (80:20)v/v selanjutnya dilakukan kromatografi lapis tipis preparatif dan direkristalisasi untuk mendapatkan senyawa murni. Senyawa murni yang diperoleh
dari hasil isolasi berbentuk kristal jarum, berwarna kuning kecoklatan dengan massa = 9,2 mg, titik lebur 146-148o C dan Rf = 0,72. Selanjutnya senyawa yang
ISOLATION OF FLAVONOID COMPOUNDS FROM ALBEDO OF RED
BALI CITRUS ( Citrus maxima Merr.)
ABSTRACT
Isolation of flavonoid compound from albedo of red bali citrus (Citrus maximaMerr.) has been done with maceration by methanol solvent. The concentrated extract then dissolved with aethyl acetate until the solution clear. The concentrated extract of aethyl acetate then dissolved with methanol. The concentrated extract of methanol then hydrolized by HCl 2 N. Then, the filtrate was extracted with chloroform to get the flavonoid compound. The concentrated chloroform extract was analysed with thin layer chromatography, then separated with column chromatography with silica gel as the stationary phase and n-hexane : ethyl acetate (90:10)v/v, (80:20)v/v, (70:30)v/v dan (60:40)v/v as the mobile phase. The fractions from n-hexane : ethyl acetate (80:20)v/v were purified with TLC preparative and recrystallization to get a pure
coumpound. The pure coumpound is tawny crystal with weight = 9,2, melting point = 146-1480 C and Rf = 0,72 . The compound further identified analysis
BAB I
PENDAHULUAN
1.1 Latar Belakang
Flavonoida merupakan salah satu golongan fenol alam yang terbesar. Menurut
perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah
menjadi flavonoida atau senyawa yang berkaitan erat dengannya. Senyawa flavonoid
terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari,
bunga, buah dan biji. Kebanyakan flavonoida ini berada dalam tumbuhan, kecuali
alga. Flavonoida yang terdapat didalam tumbuhan dapat digunakan sebagai pelindung
tubuh manusia dari radikal bebas dan dapat mengurangi resiko penyakit kanker dan
peradangan (Markham,1988).
Flavonoid juga disebut sebagai bioflavonoid, yang merupakan anggota terbesar
dari suatu grup polifenol dan merupakan metabolit sekunder yang diekstraksi dari
tanaman dan ditemukan paling banyak pada makanan anggur merah, teh hitam,
bawang dan apel. Secara umum ditemukan pada tumbuhan dari bunga-bunga dan
buah untuk melindungi diri dari predator. Pada buah jeruk juga terdapat senyawa
flavonoida. Bagian terpenting senyawa flavonoida juga mempunyai aktivitas untuk
mengobati rekasi alergi, antikanker, mengobati diabetes dan infeksi virus. Flavonoid
juga mencegah oksidasi, stimulasi sistem imun, mencegah pembentukan dari
karsinogenik dan melindungi dari bakteri dan virus (Yongping, 2004).
Menurut buku The Handbook of Natural Flavonoids bahwa tumbuhan jeruk
(Citrus) ini mengandung senyawa golongan flavonoida yang mempunyai aktivitas.
Harbone dan Herber Baxter melaporkan bahwa beberapa jenis jeruk (Citrus)
mengandung beberapa jenis senyawa flavonoida yaitu: C.funadoko, C.limettioide,
Menurut K.Heyne dan J.B.Harborne bahwa ada beberapa jenis jeruk (Citrus)
yang telah dikenal yaitu : C.aurantifolia, C.Hystrix DC, C.Japonica Thunb,
C.Maxima Merr, C.Medica Linn, C.nobilis Lour (Heyne, 1950). Dari genus Citrus terdapat 16 spesies anggota Citrus, salah satunya adalah Citrus maxima Merr.
(Setiawan, 2000). Pada buku The Handbook of Natural Flavonoids dikatakan bahwa
jenis Citrus ini memiliki manfaat sebagai antiperoksidatif, antioksidan, antibakteri,
antivirus (Harborne,1999) dan antikanker (Evans, 1998).
C. maxima Merr. adalah jenis jeruk besar yang tanamannya berbentuk pohon dan berkayu. Tingginya bergantung pada varietas dan umur tanaman. Jeruk ini
berumur 16 tahun tingginya sekitar 5 m. Batangnya ada yang berduri dan ada yang
mulus tidak berduri. Daun berbentuk bulat telur dan lebih besar dari jenis jeruk lain.
Tepi daunnya agak rata, sedang dekat ujungnya agak berombak dan ujungnya tumpul.
Bunganya merupakan bunga tunggal atau majemuk yang bertandan. Berat buahnya
bervariasi antara 0,75-1,5 kg per buah dengan diameter 10-20 cm. Kulit buah jeruk
terdiri menjadi tiga lapisan, yaitu kulit luar, kulit bagian tengah dan kulit bagian dalam
(Ade, 2000).
Albedo, lapisan spon di bawah kulit, terdiri dari selulosa, karbohidrat yang
mudah larut, pektin, flavonoid dan asam amino. Flavonoid pada albedo disebut
naringin ditemukan oleh De Vry pada tahun 1886 pada tanaman buah grape dari Jawa
dan pada bunga dan kulit buah C. decumana (Midian, 2007).
Kandungan metabolit sekunder dari kulit (peel) dari jeruk bali merah
(C.maximaMerr.) ini telah pernah diteliti oleh Teng bersama rekan-rekannya, mereka memperoleh senyawa kumarin dengan metode ekstraksi cairan supercritical dan
HPLC ( Teng et all , 2005).
O
O O
O
O O
OMe
Dari uraian diatas dan beberapa literatur penelitian yang telah dilakukan
terhadap buah jeruk bali merah maka peneliti tertarik untuk meneliti albedo jeruk bali
merah (Citrus maxima Merr.) yang merupakan salah satu Genus Citrus, khususnya mengenai senyawa flavonoida yang terkandung dalam tumbuhan ini.
1.2. Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa
flavonoida yang terdapat pada albedo jeruk bali merah.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui senyawa flavonoida yang terdapat
dalam albedo jeruk bali merah.
1.4. Manfaat Penelitian
Dari hasil penelitian dapat memberikan informasi ilmiah pada bidang Kimia Bahan
Alam bahwa dari albedo jeruk bali merah terkandung senyawa flavonoida.
1.5. Lokasi penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diperoleh dari daerah Rambung Baru, Sembahe, Kecamatan
Sibolangit, Kabupaten Deliserdang, Sumatera Utara.
2. Tempat melakukan penelitian
Penelitian dilakukan di laboratorium Kimia Bahan Alam Hayati FMIPA Universitas
3. Lokasi Identifikasi Kristal Hasil Isolasi
Analisis Spektrofotometer Inframerah (FT-IR), Spektrofotometer Ultraviolet-Visibel
(UV-Vis) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di Pusat Penelitian Kimia – LIPI, kawasan PUSPITEK Serpong, Tangerang.
1.6. Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap albedo jeruk bali
merah (C. maximaMerr.) berupa serbuk halus yang kering sebanyak 1030 gram. Tahap awal dilakukan uji skrining fitokimia untuk senyawa flavonoida, yaitu dengan
menggunakan pereaksi FeCl3 5 %, NaOH 10%, Mg-HCl dan H2SO 4(p) . Tahap isolasi yang dilakukan :
1. Ekstraksi Maserasi
2. Pemisahan Tanin
3. Ekstraksi Partisi
4. Hidrolisa
5. Analisis Kromatografi Lapis Tipis
6. Analisis Kromatografi Kolom
7. Analisis Kromatografi Preparatif
8. Rekristalisasi
9. Analisis Senyawa Hasil Isolasi
Tahap analisis senyawa hasil isolasi yang dilakukan adalah :
1. Analisis Kromatografi Lapis tipis
2. Pengukuran Titik Lebur
3. Identifikasi dengan menggunakan spektrofotometer Infra Merah (FT-IR),
spektrofotometer Ultraviolet-Visible (UV-Vis) dan spektrofotometer Resonansi
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Jeruk Bali Merah
2.1.1 Morfologi Jeruk Bali Merah (Citrus maximaMerr.)
Tanaman jeruk bali merah berbentuk pohon dan berkayu. Tingginya tergantung
varietas dan umur tanaman. Jeruk ini yang berumur 16 tahun tingginya sekitar 5 m.
Batang tanaman keras, kuat dan bengkok-bengkok. Diameternya sekitar 10-15 cm.
Batang diselimuti oleh oleh kulit batang yang cukup tebal. Batangnya ada yang
berduri dan ada yang mulus tidak berduri. Daun berbentuk bulat telur dan lebih besar
dari jenis lain. Tepi daunnya agak rata, sedang dekat ujungnya agak berombak dan
ujungnya tumpul. Bunganya merupakan bunga tunggal atau majemuk yang bertandan.
Tiap tangkai jeruk bali menghasilkan satu buah dan bakal buah berkerucut. Setelah tua
buah berubah menjadi bulat besar. Berat buahnya bervariasi antara 0,75-1,5 kg per
buah dengan diameter 10-20 cm. Ketebalan kulit buah bergantung pada varietasnya.
Kulit buah jeruk ini terbagi menjadi tiga lapisan, yaitu kulit luar, kulit bagian tengah
dan kulit bagian dalam. Kulit luar ada yang berwarna hijau, hijau kekuningan atau
kuning. Sedang kulit buah bagian tengah berwarna putih bersih dan kulit bagian dalam
berwarna pink muda. Tiap buah jeruk ini biasanya berisi 11-16 ruang atau sisir. Di
dalam kulit buah bagian dalam inilah bias dijumpai daging buahnya yang segar dan
banyak mengandung air. Daging buah ada yang putih, merah muda dan merah
2.1.2 Manfaat Jeruk Bali Merah
Manfaat dari jeruk bali merah pada beberapa literatur yaitu dinyatakan memiliki
kandungan flavonoida yang mempunyai aktivitas sebagai poliferation, sitotoksik dan
apoptosis terhadap kanker colon (Daniel et all, 1999). Literatur lain juga melaporkan
bahwa flavonoida yang terkandung dalam tumbuhan jeruk (Citrus) mempunyai
aktivitas sebagai antikanker (Evans, 1998).
2.1.3 Sistematika Jeruk Bali Merah (Citrus maximaMerr.)
Sistematika buah jeruk bali merah adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Rutales
Genus : Citrus
Spesies : Citrus maxima Merr. Nama Lokal : Jeruk Bali Merah
2.2 Tumbuhan Jeruk Bali
Jeruk Besar dalam bahasa Inggris disebut pummelos, bahasa Indonesia jeruk besar dan bahasa Jawa jeruk gulung. Jenis jeruk ini dapat tumbuh dengan baik didataran rendah hingga ketinggian 1.000 meter di atas permukaan laut. Jenis jeruk ini lebih menyukai
daerah yang bertopografi datar (tidak bervariasi), permukaan air tanahnya dalam dan
tidak tergenang air. Jenis jeruk berasal daerah kepulauan Polynesia sampai
semenanjung Malaka. Berarti jenis jeruk ini asli berasal dari Indonesia. Setiap pohon
yang besar dapat menghasilkan buah sebanyak 200 buah dalam satu musim. Waktu
berbunga sama seperti jenis jeruk lain. Waktu pembentukan bunga sampai buah masak
membutuhkan waktu sekitar 7-8 bulan. Jeruk besar terdiri dari berbagai macam jenis,
Jeruk Silempang, Jeruk Oyod Gondong, Jeruk Delima Kepyar (Kanisius, 1994), Jeruk Nambangan-Madiun, Jeruk Bali, Jeruk Gulung, Jeruk Pandanwangi (Soelarso, 1996).
Pomelo adalah sebutan untuk jeruk besar. Di Indonesia lebih dikenal sebagai
jeruk bali atau jeruk gulung. Meskipun popular dengan sebutan jeruk bali, sentra jeruk
ini bukan dipulau Bali, melainkan di Nambangan, Magetan (Jawa Timur). Tanaman
jeruk bali tidak hanya terdapat di Nambangan. Tanaman asli Indonesia sudah
menyebar di Iran, Pakistan, India, Malaysia, RRC dan Australia. Salah satu
varietasnya, yaitu pomelo sudah dikembangkan di Negara-negara subtropis dan
popular dengan sebutan grapefruit. Ukuran grapefruit sedikit lebih kecil dari jeruk bali
dan kegunaannya hanya untuk konsentrat. Konsentrat grapefruit yang didinginkan
biasa diminum pada pagi hari sebelum masyarakat menyantap roti, kentang, daging
dan sarapan lainnya.
Jeruk bali merupakan terna pohon dengan pertumbuhan cabang mulai dari
pangkal batang. Ketinggian tajuk hanya sekitar 10 m. Batang jeruk bali berkayu keras
dan liat. Daun jeruk bali berbentuk jorong dengan ujung meruncing dan bersayap pada
bagian tangkainya. Warna daun hijau muda, tebal dan mengilap. Bunga berwarna
putih dan dan beraroma sangat harum, tumbuh pada ujung ranting. Bentuk buah
bervariasi mulai dari bundar agak pipih hingga bundar sempurna. Warna kulit buah
bervariasi dari hijau gelap sampai hijau kekuningan setelah masak. Diameter buah
rata-rata sekitar 20 cm. Biji berukuran sekitar 1 cm. Daging buah mudah diurai,
berwarna mulai dari putih, kekuningan merah jambu dan merah tua. Rasanya
bervariasi dari masam, manis masam, manis sampai manis bercampur getir (agak
pahit). Menteri pertanian RI melepas tujuh varietas jeruk bali. Ketujuh varietas
tersebut adalah nambangan, nambangan merah, nambangan putih, nagetan tanpa biji,
2.3 Klasifikasi Bahan Alam
Bahan alam didefenisikan di sini sebagai senyawa organik dengan bobot molekul
antara 100 hingga 2000. Dalam arti yang lebih luas, istilah bahan alam juga dapat
digunakan untuk senyawa ruahan dari alam, seperti bahan tanaman mentah, bahan
makanan, resin dan eksudat tanaman atau ekstrak bahan tanaman (Heinrich, 2005).
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ
tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur
tanaman (selulosa, kitin, lignin dan pektin), sebagai cadangan makanan amilum,
protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya
(protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat disari
dengan pelarut umum; berupa senyawa kimia tanaman dengan molekul kecil.
Sejumlah kelompok bahan alam dapat dibuat dari asam amino fenilalanin, terutama
fenilpropana, lignin, kumarin dan flavonoid, semuanya memiliki substruktur umum
yang berbasis cincin 6-karbon aromati (unit C6) dengan rantai 3-karbon (unit C3)
yang melekat pada cincin aromatik. Dengan meningkatnya jenis dan tipe senyawa
yang ditentukan didalam berbagai bahan alam, senyawa yang terdapat dalam
tumbuhan adalah senyawa metabolit primer dan senyawa metabolit sekunder
(Heinrich, 2005).
2.3.1 Senyawa Metabolit Primer
Polisakarida, protein, lemak dan asam nukleat merupakan penyusun utama dari
makhluk hidup, karena itu disebut metabolit primer. Keseluruhan proses sintesis dan
perombakan zat-zat ini, yang dilakukan oleh organisme untuk kelangsungan hidupnya,
disebut proses-proses metabolisme primer. Metabolisme primer dari semua organisme
2.3.2 Senyawa Metabolit Sekunder
Proses-proses kimia jenis lain terjadi hanya pada spesies tertentu sehingga
memberikan produk yang berlainan, sesuai dengan spesiesnya. Reaksi yang demikian
nampaknya tidak merupakan proses yang terpenting bagi eksistensi dari suatu
organisme, karena itu disebut proses metabolisme sekunder. Produk-produk
metabolisme sekunder, serupa dengan yang semula disebut sebagai produk alami oleh
para ahli kimia organik (Manitto, 1981).
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ
tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur
tanaman ( selulosa, kitin, lignin dan pektin), sebagai cadangan makanan amilum,
protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya
(protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat disari
dengan pelarut umum; berupa senyawa kimia tanaman dengan molekul kecil. Di
antara senyawa kimia tanaman bermolekul kecil ini terdapat sekelompok senyawa
kimia yang banyak dijumpai dalam semua tanaman; dan kelompok senyawa kimia
yang khas untuk tanaman tertentu. Senyawa kimia molekul kecil dari kelompok yang
disebut terakhir dengan penyebaran terbatas; selanjutnya kelompok ini disebut sebagai
metabolit sekunder. Berikut ini beberapa penggolongan metabolit sekunder ; minyak
atsiri, alkaloid, flavonoid, tanin, resin, glikosida, kumarin, terpenoid dan steroid
(Midian, 2007).
Metabolit sekunder meskipun tidak sangat penting bagi eksistensi suatu
individu, sering berperan pada kelangsungan hidup suatu spesies dalam perjuangan
menghadapi spesies-spesies lain. Misalnya: zat kimia untuk pertahanan, penarik seks
dan feromon (Manitto, 1981).
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15
atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh
rantai linear yang terdiri dari tiga atom karbon. Kerangka ini dapat ditulis sebagai C6 -C3-C6. Jadi senyawa flavonoida adalah senyawa 1,3 diarilpropana, senyawa isoflavonoida adalah senyawa 1,2 biarilpropana, sedang senyawa-senyawa
neoflavonoida adalah senyawa 1,1 diarilpropana (Manitto, 1992).
Senyawa flavonoid diturunkan dari unit C6 – C3 (fenilpropana) yang bersumber dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA, yang
bergabung dengan unit C6 – C3 ( sebagai KoA tioester) untuk membentuk unit awal triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas
unit-unit yang diturunkan dari asam sikimat dan jalur poliketida.
Unit awal triketida mengalami siklisasi oleh enzim kalkon sintase untuk
membentuk gugus kalkon pada flavonoid. Kemudian terjadi siklisasi untuk
menghasilkan cincin piranon yang mengandung inti flavanon, yang dapat memiliki
ikatan C2 – C3 teroksidasi (tak jenuh) untuk menghasilkan gugus flavon, atau dihidroksilasi pada posisi C3 cincin piranon untuk menghasilkan gugus flavanol pada
flavonoid. Flavanol ini selanjutnya dioksidasi untuk menghasilkan antosianin, yang
memberikan warna biru terang pada bunga dan anggur merah gelap (Heinrich, 2005).
Adapun struktur dari flavonoida adalah struktur yang mempunyai dua cincin
aromatik yang dihubungkan dengan tiga karbon yang membentuk suatu cincin yang
terdapat gugus eter (C-O-C) dan satu karbonil (C=O) yang dinotasikan cincin C.
Kedua cincin aromatik ini dinotasikan cincin A dan B. Pada cincin A dan B ada
dijumpai atau terdapat substituent hidroksil (OH) atau metoksi, juga gugus gula yang
bentuk C-glikosida atau O-glikosida. Tapi ada juga senyawa flavonoida tanpa adanya
gugus C=O yang disebut senyawa flavan (Ikan, 1969).
Flavonoid merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga.
Flavonoid sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar,
melaporkan adanya flavonoid pada hewan, misalnya dalam kelenjar bau
berang-berang, ‘propopolis’ (sekresi lebah) dan didalam sayap kupu-kupu ; itupun dengan
anggapan bahwa flavonoid tersebut berasal dari tumbuhan yang menjadi makanan
hewan tersebut dan tidak dibiosintesis didalam tubuh mereka (Markham, 1988).
Flavonoid mengandung sistem aromatik yang terkonyugasi dan karena itu
menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum tampak.
Akhirnya flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai
glikosida dan aglikon flavonoida yang mana pun mungkin saja terdapat dalam satu
tumbuhan dalam beberapa bentuk kombinasi glikosida. Flavonoid terdapat dalam
semua tumbuhan berpembuluh, tetapi beberapa kelas lebih tersebar daripada yang
lainnya : flavon dan flavonol terdapat disemesta, sedangkan isoflavon dan biflavon
hanya terdapat pada beberapa suku tumbuhan (Harborne, 1996).
Struktur cincin flavonoid dan isoflavonoid berasal dari biosintesis campuran,
cincin A yang berasal dari tiga unit asetat dari kepala ke ekor, sedangkan cincin b dan
tiga karbon dari cincin pusat yang berasal dari asam sinamat. Sebagai unit asetat
terlebih dahulu dikonversikan ke malonyl CoA kedua asetat-malonat dan jalur asam
sikimat berkontribusi terhadap biosintesis flavonoid (Vickery, 1981).
Dalam tubuh manusia, flavonoid dapat berguna untuk mengobati gangguan
sirkulasi perifer, menurunkan tekanan darah dan meningkatkan aquaresis. Banyak juga
obat-obat mengandung flavonoid yang dipasarkan di berbagai negara sebagai obat
anti-inflamasi, antispasmodik, antialergi dan antivirus ( Catherine, 1998).
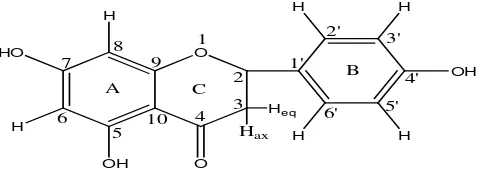
2.4.1 Struktur Dasar senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti
fenolat yang dihubungkan dengan tiga satuan karbon yang dapat atau tidak dapat
membentuk cincin ketiga. Struktur dasar flavonoida dapat digambarkan sebagai
C C C
A B
Gambar 2.1 Kerangka dasar senyawa flavonoida
( Sastrohamidjojo, 1988)
2.4.2 Kegunaan Flavonoida
Bagi tumbuhan untuk menarik serangga, yang membantu proses penyerbukan dan
untuk menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia
dalam dosis kecil, flavon bekerja sebagai stimulan pada jantung, hesperidin
mempengaruhi pembuluh darah kapiler. Flavon terhidroksilasi bekerja sebagai
diuretik dan sebagai antioksidan pada lemak (Midian,2007).
Senyawa flavonoid juga berperan dalam memberikan banyak warna lain di
alam, terutama daun mahkota kuning dan jingga, bahkan flavonoid tidak berwarna
mengabsorb cahaya pada spektrum UV (karena banyak memiliki gugus kromofor) dan
dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi
yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk
membantu penyerbukan tanaman. Flavonoid tertentu juga mempengaruhi rasa
makanan secara signifikan; misalnya beberapa tanaman memiliki rasa pahit dan kesat
seperti flavanon naringin, pada kulit grapefruit ( Citrus paradisi ). Senyawa flavonoid diduga sangat bermanfaat dalam makanan karena, berupa senyawa fenolik, senyawa
ini yang bersifat antioksidan kuat. Banyak kondisi penyakit yang diketahui bertambah
parah oleh adanya radikal bebas seperti superoksida dan hidroksil. Dan flavonoid
memiliki kemampuan untuk menghilangkan dan secara efektif ‘menyapu’ spesies
pengoksidasi yang merusak ini. Oleh karena itu, makanan yang kaya flavonoid
dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit
Ada juga beberapa literatur melaporkan bahwa senyawa flavonoida ini
mempunyai aktivitas sebagai antioksidan (Nessa et all, 2004), sebagai inhibitor
aktivitas cyclcooxcigenase-2 (Dae et all, 2002), sebagai anti mikroba (Leo et all,
2004), sebagai sitotoksi (Shi et all, 2001), memiliki aktivitas sebagai anti HIV (
Meralgeman et all, 2001 ), sebagai poliferation, sitotoksik dan apoptosis terhadap
kanker colon (Daniel et all, 1999).
2.4.3 Klasifikasi Senyawa Flavonoida
1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-glikosida; pada senyawa tersebut satu gugus hidroksil flavonoid (atau lebih) terikat pada satu gula (atau
lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi
menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam
air (cairan),misalnya 7-hidroksil pada flavon, isoflavon dan dihidroflavon.
2. Flavonoida C-glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula
tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon
yang tahan asam. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam
inti flavonoid. Misalnya galaktosa, ramnosa, xilosa dan arabinosa.
3. Flavonoida Sulfat
Golongan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan
hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih
yang terikat padahidroksil fenol atau gula. Secara teknis senyawa ini
sebenarnya bisulfat karena terdapat sebagai garam. Banyak yang berupa
glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja
yang masih bebas atau pada suatu gula.
4. Biflavonoida
Biflavonoid adalah flavonoid dimer walaupun prosianidin dimer biasanya
tidak dimasukkan kedalam golongan ini. Flavonoid yang biasanya terlibat
sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan karbon-karbon atau
ikatan eter. Monomer flavonoid yang digabungkan menjadi golongan
biflavonoid yang satu jenis atau berbeda dan letak ikatannya berbeda-beda.
Banyak sifat fisika dan kimia biflavonoid menyerupai sifat monoflavonoid
pembentuknya misalnya spektrum UV-tampak, uji warna dan lain-lain.
Biflavonoid jarang ditemukan sebagai glikosida dan penyebarannya terbatas,
terdapat terutama pada gimnospermae.
5. Aglikon Flavonoida
Sejumlah aglikon flavonoid mempunyai atom karbon asimetrik dan dengan
demikian menunjukkan keaktifan optik. Yang termasuk dalam golongan
flavonoid ini ialah flavanon, dihidroflavonol , katekin, pterokarpan, rotenoid
dan beberapa biflavonoid (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman
pada rantai C3 yaitu flavonol, flavon, isoflavon, flavanon, dihidrofavonol, katekin, leukoantosianidin, antosianidin, khalkon dan auron (Robinson, 1995).
1. Flavanon
Struktur senyawa ini terdiri dari 2 cincin aromatik (A dan B), cincin ini dihubungkan
dengan satu cincin siklis yang memiliki gugus eter dan keton dan pada atom C-2 dan
C-3 tidak terdapat ikatan rangkap (jenuh) yang disebut dengan cincin C. Spektrum UV
dari flavanon pada metanol terletak pada panjang gelombang band I 300-303 nm dan
band II 270-295 nm.
Flavanon biasanya sebagai glikosida, terdapat dalam kayu, daun dan bunga.
Flavanon glikosida merupakan konstituen utama dari tanaman genus Prunus dan buah
jeruk , dua glikosida yang paling lazim adalah naringin dan hesperetin, terdapat dalam
buah anggur dan jeruk (Sastrohamidjojo, 1996).
2. Flavon
Struktur senyawa ini juga terdiri dari 2 cincin aromatik (A dan B) dan dihubungkan
dengan cincin C, strukturnya cincin C nya sama dengan flavanon kecuali pada atom
C-2 dan C-3 terdapat ikatan rangkap yang disebut cincin tak jenuh. Senyawa flavon
ini mempunyai panjang gelombang (λmax) pada metanol dimana band I 304 nm dan
band II 240-285 nm.
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8 FlavonA
B
C
(Bhat, 2005)Flavon merupakan senyawa yang paling tersebar luas dari semua pigmen
tumbuhan kuning, beberapa flavon secara ekonomi masih penting dan luteolin
barangkali zat warna pertama yang dipakai di Eropa. Kuersetin adalah salah satu
senyawa yang paling umum pada tumbuhan berpembuluh, diikuti oleh kamferol
(Robinson, 1991).
3. Flavonol
Struktur senyawa ini mirip dengan struktur dari struktur flavon, kecuali dibedakan
dari cincin C pada atom C-3 adanya gugus hidroksil (OH) atau disebut juga
Flavon-3-O-l. Senyawa Flavonol ini mempunyai serapan UV pada metanol (λmax) pada band I
352 nm dan band II pada 240-285 nm.
O
O
1 2 3 4 5 6 1' 2' 3' 4' 5' 6' 7 8OH
FlavonolA
C
B
(Bhat, 2005)Flavonol lazim sebagi konstituen tanaman tinggi dan terdapat dalam berbagai
bentuk terhidroksilasi. Flavonol alami yang paling sederhana adalah galangin, 3, 5, 7-
tri-hidroksiflavon, sedangkan yang paling rumit, hibissetin adalah 3, 5, 7, 8, 3’, 5’-
heptahidrosiflavon. Dua flavonol yang paling lazim yaitu kaempferol dan quersetin.
Flavanon pada umumnya terdistribusi melalui famili tanaman tinggi, genus melicope
mengandung melisimpleksin dan ternatin. Dan genus Citrus mengandung nobiletin,
tangeretin dan 3’, 4’, 5, 6, 7-pentametoksiflavon (Sastrohamijdojo, 1996).
4. Dihidroflavanol
Struktur dari senyawa ini mirip dengan struktur dari flavanon, kecuali pada cincin C
pada atom C-3 ada gugus hidroksil (-OH). Senyawa ini memberikan absorbsi pada
UV dengan (λmax) dalam metanol pada band I 300-320 nm band 270-295 nm. Senyawa
ini disebut juga Flavanon 3-O-1 ( Bhat, 2005).
5. Isoflavon
Struktur senyawa ini sama dengan struktur flavon kecuali pada cincin B terikat pada
cincin C pada atom C-3. Ini mungkin terjadi proses migrasi dari gugus aril dan ini
juga sebagai isomer dari senyawa Flavon. Senyawa ini menunjukkan serapan UV (λmax) pada metanol dimana band I 300-340 nm dan band II 245-270 nm (Bhat,2005).
O
O
1
2
3 4 5
6 1'
2' 3'
4'
5' 6' 7
8
Isoflavon
A
C
B
Senyawa-senyawa isoflavon terutama terdapat dalam spesies-spesies dari
famili Leguminosae, mereka tidak bewarna. Mereka semua menunjukkan daya
estrogenik lemah, karena terdapat bagian struktur stilbena fenolik. Ada dua senyawa
isoflavonoid yaitu senyawa-senyawa rotenoid dan senyawa homoisoflavonoid. Gugus
hidroksil pada kedudukan 2’ pada struktur isoflavon menyebabkan organisme mampu
untuk merubah struktur isoflavon menjadi lebih lanjut, misalnya senyawa-senyawa
pterokarpana seringkali dihasilkan sebgai fitoaleksin, yaitu senyawa anti fungi yang
dihasilkan oleh tumbuhan akibat serangan virus atau zat-zat jamur (Manitto, 1981).
Isoflavon menunjukkan aktivitas sebagai estrogeni, insektisida, beberapa diantaranya
6. Auron
Senyawa ini terdiri dari cincin aromatik (A dan B) tetapi dihubungkan dengan satu
cincin yang mengandung gugus eter dan karbonil juga dengan satu ikatan rangkap.
Senyawa ini memberikan serapan pada UV dengan λmax pada metanol dengan band I
370-430 nm dan band II 240-300 nm (Bhat, 2005).
1 2 3 5 6 1' 2' 3' 4' 5' 6' 7 8 O O C H Auron
A
C
B
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita.
Dikenal hanya lima aglikon, tetapi pola hidroksilasi senyawa ini umumnya serupa
dengan pola pada flavonoid lain begitu pula bentuk yang dijumpai ialah bentuk
glikosida dan eter metal. Dalam larutan basa senyawa ini menjadi merah ros
(Robinson, 1991).
7. Kalkon
Kalkon ini juga turunan dari senyawa fenolik dan ini adalah sebagai prekursor
metabolisme untuk senyawa flavonoid. Struktur ini tidak terdiri dari sebuah cincin γ – pyron dan terdapat cincin terbuka yang terdiri dari 3 atom karbon α, β karbonil tak jenuh yang menghubungkan cincin aromatik. Senyawa ini menunjukkan serapan UV
pada (λmax) dalam metanol pada band I 340-390 nm band II 220-270 nm (Bhat, 2005).
Polihidroksi kalkon terdapat dalam sejumlah tanaman, namun terdistribusi
dialam tidak lazim. Alasan pokok bahwa kalkon cepat mengalami isomerisasi menjadi
flavanon dalam satuan keseimbangan. Kalkon terdapat dalam tanaman terutama
sebagai pigmen daun bunga bewarna kuning, dalam kebanyakan terdapat dalam
tanaman Heliantheaetribe, Coreopsidinae subtribe dan family Compositae
(Sastrohamidjojo, 1996).
8. Katekin
Katekin adalah senyawa flavon-3-ol yang paling banyak terdapat dalam alam dan
mudah sekali didapatkan dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering mengandung senyawa ini sekitar 30%, 60 % nya mengandung
epigalokatekin-3-galat, 15% adalah epikatekin 3-galat dan epikatekin. Dalam
kebanyakan buah, hanya satu flavan-3-ol yang sering ditemukan (Manitto, 1981).
O HO
OH
OH OH
OHO
9. Leukoantosianidin
Leukoantosianidin merupakan senyawa tanpa warna, terutama terdapat pada
tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya
melaksidin, apiferol.
O
HO OH
OH
Leukoantosianidin
10. Antosianidin
Antosianin ialah pigmen daun bunga merah samapi biru yang biasa, banyaknya
bagian lain tumbuhan tinggi dan diseluruh dunia tumbuhan kecuali fungi. Antosianin
paku-pakuan dan lumut, khas berupa glukosida apigeninidin dan luteolinidin.
Stafnorubin adalah antosianin yang tidak biasa yang terdapat dalam dinding sel
membran sphagnum dalam musim gugur (Robinson, 1991).
O
OH
Antosianin
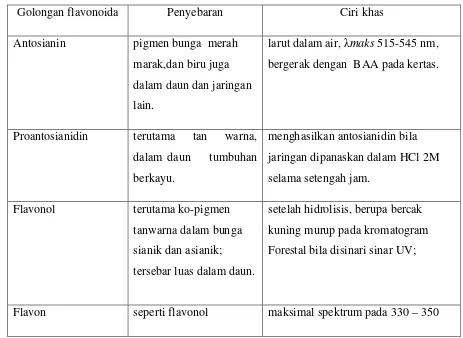
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua
flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan
[image:34.595.95.558.427.765.2]semuanya mempunyai sejumlah sifat yang sama yakni:
Tabel 2.1. Golongan-golongan flavonoida menurut Harborne
Golongan flavonoida Penyebaran Ciri khas
Antosianin pigmen bunga merah
marak,dan biru juga
dalam daun dan jaringan
lain.
larut dalam air, λmaks 515-545 nm, bergerak dengan BAA pada kertas.
Proantosianidin terutama tan warna,
dalam daun tumbuhan
berkayu.
menghasilkan antosianidin bila
jaringan dipanaskan dalam HCl 2M
selama setengah jam.
Flavonol terutama ko-pigmen
tanwarna dalam bunga
sianik dan asianik;
tersebar luas dalam daun.
setelah hidrolisis, berupa bercak
kuning murup pada kromatogram
Forestal bila disinari sinar UV;
setelah hidrolisis, berupa bercak coklat
redup pada kromatogram Forestal;
Glikoflavon seperti flavonol maksimal spektrum pada 330-350 nm.
mengandung gula yang terikat melalui
ikatan C-C; bergerak dengan
pengembang air, tidak seperti flavon
biasa.
pada kromatogram BAA beupa bercak
redup dengan RF tinggi .
dengan amonia berwarna merah,
maksimal spektrum 370-410 nm.
Biflavonil tanwarna; hampir
seluruhnya terbatas pada
gimnospermae
pada kromatogram BAA beupa bercak
redup dengan RF tinggi .
dengan amonia berwarna merah,
Khalkon dan auron pigmen bunga kuning,
kadang-kadang terdapat
juga dalam jaringan lain
maksimal spektrum 370-410 nm.
berwarna merah kuat dengan Mg/HCl;
kadang – kadang sangat pahit .
Flavanon tanwarna; dalam daun
dan buah( terutama
dalam Citrus )
bergerak pada kertas dengan
pengembang air;
Isoflavon tanwarna; sering kali
dalam akar.
2.4.4 Sifat Kelarutan Senyawa Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia seperti
fenol yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi bila didiamkan
dalam larutan basa dan disamping itu terdapat banyak oksigen maka akan banyak
yang terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih atau suatu
gula, flavonoid merupakan senyawa polar maka pada umumnya flavonoida larut
dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida,
dimetilformadida, air dan lain-lain. Adanya gula yang terikat pada flavonoida
cenderung menyebabkan flavonoida lebih mudah larut dalam air. Dengan demikian
campuran pelarut diatas dengan air merupakan pelarut yang lebih baik untuk
glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon
serta flavanol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti
eter dan kloroform (Markham, 1988).
2.5 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang diinginkan
dalam keadaan murni, agar tidak bercampur dengan komponen-komponen lainnya
(Muldja, 1995).
2.5.1 Ekstraksi
Ekstraksi adalah suatu proses pemisahan substansi atau zat dari campurannya dengan
menggunakan pelarut yang sesuai. Ekstraksi dapat digolongkan berdasarkan bentuk
campuran yang diekstraksi dan proses pelaksanaanya.
a. Bentuk campurannya
Berdasarkan bentuk campuran yang diekstraksi, suatu ekstraksi dibedakan menjadi
1. Ekstraksi Padat-cair ; zat yang diekstraksi terdapat didalam campuran yang berbentuk padatan. Ekstraksi jenis ini banyak dilakukan didalam usaha mengisolasi
zat berkhasiat yang terkandung didalam bahan alam seperti steroid, hormon,
antibiotika dan lipida pada biji-bijian.
2. Ekstraksi Cair-cair ; zat yang diekstraksi terdapat didalam campuran yang berbentuk cair. Ekstraksi cair-cair sering juga disebut ekstraksi pelarut banyak untuk
memisahkan zat seperti iod atau logam-logam tertentu dalam larutan air.
b.Proses pelaksanaannya
Menurut proses pelaksanaannya ekstraksi dibedakan menjadi ekstraksi
berkesinambungan (kontinyu) dan ekstraksi bertahap.
1. Ekstraksi kontinyu (Continues Extraction)
Pada ekstraksi kontinyu, pelarut yang sama digunakan secara berulang-ulang sampai
proses ekstraksi selesai. Tersedia berbagai alat dari jenis ekstraksi seperti ini seperti
alat soklet atau Craig Countercurent.
2. Ekstraksi Bertahap (Batch)
Pada ekstraksi bertahap, setiap kali ekstraksi selalu digunakan pelarut yang baru
sampai proses ekstraksi selesai. Alat yang biasa digunakan adalah berupa corong pisah
(Estien, 2005).
2.5.2 Kromatografi
Kromatografi merupakan suatu proses pemisahan yang mana analit-analit dalam
sampel terdistribusi antara dua fase, yaitu fase diam dan fase gerak. Fase diam dapat
berupa bahan padat atau porus dalam bentuk molekul kecil, atau dalam bentuk cairan
yang dilapiskan pada pendukung padat atau dilapiskan pada dinding kolom. Fase
gerak dapat berupa gas atau cairan. Jika gas digunakan sebagai fase gerak, maka
prosesnya dikenal sebagai kromatografi gas. Dalam kromatografi cair dan juga
kromatografi lapis tipis, fase gerak yang digunakan selalu cair (Rohman, 2009).
Pemisahan secara kromatografi dilakukan dengan cara melihat langsung beberapa sifat
1) kecenderungan molekul untuk melarut dalam cairan, 2) kecenderungan molekul
untuk melekat pada permukaan serbuk halus dan 3) kecenderungan molekul untuk
menguap atau berubah kekeadaan uap (Gritter, 1991).
2.5.2.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis adalah kromatografi cair yang paling sederhana, yang mana
fase geraknya berupa zat cair dan fase padatnya berupa padatan yang disokong pada
sebuah penyangga (Gritter, 1991). KLT merupakan salah satu metode yang paling
banyak digunakan dan paling mudah untuk memurnikan sejumlah kecil komponen.
Metode ini menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan
penyerap (misalnya silika gel) dengan ketebalan tertentu tergantung pada jumlah
bahan yang akan dimuat kedalam lempeng. Pelapisan ke dalam lempeng analis
biasanya memiliki ketebalan 0,2 mm. Campuran senyawa diisikan 1-2 cm dari tepi
dasar lempeng berupa bercak ataupun pita memanjang. Lempeng kemudian
dimasukkan ke dalam bejana kromatografi berisi pelarut yang telah ditentukan
sebelumnya yang akan meresap naik di dalam lempeng dan memisahkan campuran
senyawa berdasarkan polaritas komponennya (Heinrich, 2005).
Kelebihan KLT ialah keserbagunaan, kecepatan dan kepekaannya. Keserbagunaannya
dapat menggunakan sejumlah penyerap yang berbeda-beda yang disapitkan pada pelat
kaca atau penyangga lain seperti, silika gel, aluminium oksida, kalium hidroksida,
magnesium pospat dan lain sebagainya. Kecepatan KLT yang lebih besar disebabkan
oleh sifat penyerap yang lebih padat bila disaputkan pada plat dan merupakan
keuntungan apabila kita menelaah senyawa labil. Kepekaan dari KLT adalah dapat
memisahkan bahan yang jumlahnya lebih sedikit dari ukuran µg (Harborne, 1973).
Metode ini memiliki sejumlah keuntungan untuk analisis dan isolasi bahan alam yang
aktif secara biologis :
• Biayanya murah dibandingkan metode instrumental dan hanya butuh sedikit
pelatihan atau pengetahuan tentang kromatografi.
dengan isolasi cepat bahan alam dalam jumlah milligram hingga gram.
• Fleksibilitas pilihan fase gerak dan fase diam.
• Pemisahan mudah dioptimalisasi dengan ‘membidik’ satu komponen dan
metode dapat segera dikembangkan.
• Secara praktis semua pemisahan dapat dicapai dengan fase gerak dan fase
diam yang tepat.
• Sejumlah besar sampel dapat dianalisis atau dipisahkan secara simultan
(Heinrich, 2005).
Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat
dibandingkan dengan harga Rf senyawa pembanding, yang mana harga Rf
diidentifikasikan sebgai perbandingan antara jarak perambatan suatu zat dengan jarak
perambatan pelarut yang dihitung dari titik penotolan pelarut zat
(Sastrohamidjojo,1985).
Laju pergerakan linarut
Rf =
Laju pergerakan pelarut (Gritter, 1991)
Faktor-faktor yang mempengaruhi gerakan noda dalam KLT yang juga mempengaruhi
harga Rf (Sastrohamijdojo, 1985) :
1. Struktur kimia dari senyawa yang dipisahkan
2. Sifat dari penyerap dan derajat aktivasi
3. Tebal kerataan dan lapisan penyerap
4. Pelarut dan derajat kemurnian fase gerak
5. Derajat kejenuhan dari uap
6. Jumlah cuplikan yang digunakan
7. Suhu
8. Kesetimbangan
2.5.2.2 Kromatografi Kolom
Dengan menggunakan cara ini skala isolasi flavonoid dapat ditingkatkan hampir ke
(berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulosa, silika atau
poliamida), dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang
cocok (Markham, 1988).
Kromatografi cair yang dilakukan didalam kolom besar merupakan metode
kromatografi terbaik untuk pemisahan campuran dalam jumlah besar. Pada
kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada
bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam atau
bahkan tabung plastik. Pelarut (fase gerak) dibiarkan mengalir melalui kolom karena
aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa
linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan
berupa fraksi ketika keluar dari atas kolom. Fase diam yang digunakan adalah silika
gel. Penyerap dapat dikemas kedalam tabung, baik dengan cara basah maupun dengan
cara kering. Pada umumnya, cara basah lebih mudah dan lebih sering dipakai untuk
silika gel, sedangkan cara kering lebih baik untuk alumina.
Pada cara basah, selapisan kapas dimasukkan ke dalam kolom dan tabung diisi
sepertiganya dengan pelarut. Pelarut yang dipakai dalam proses pengemasan mungkin
sama dengan pelarut yang akan dipakai untuk kromatografi atau mungkin pelarut yang
kepolarannya lebih rendah. Pelarut itu tidak boleh polar. Penyerap lumpuran dengan
bagian lain dari pelarut dan lumpuran ini dituangkan ke dalam pelarut dalam tabung.
Selama proses pengendapan, tabung dapat diketuk-ketuk pada semua sisi secara
perlahan-lahan agar diperoleh lapisan yang seragam. Lumpuran dapat dimasukkan
bagian demi bagian atau sekaligus. Keran dapat dibuka dan ditutup selama
penambahan asal permukaan pelarut tetap diatas permukaan penyerap (Gritter, 1991).
2.5.2.3 Kromatografi Lapis Tipis Preparatif
Pada KLT preparatif, cuplikan yang akan dipisahkan ditotolkan berupa garis pada
salah satu sisi pelat lapisan besar (Gritter, 1991), ketebalan yang paling sering dipakai
Penotolan Cuplikan
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat KLTP. Pelarut
yang yang baik ialah pelarut atsiri, karena jika pelarut kurang atsiri terjadi pelebaran
pita. Konsentrasi cuplikan harus sekitar 5-10%. Cuplikan ditotolkan berupa pita yang
harus sesempit mungkin karena pemisahan bergantung pada lebar pita. Penotolan
dapat dilakukan dengan tangan (pipet) tetapi lebih baik dengan penotol otomatis.
Untuk pita yang terlalu lebar, dapat dilakukan pemekatan dengan cara pengembangan
memakai pelarut polar sampai kira-kira 2 cm diatas tempat penotolan. Kemudian pelat
dikeringkan dan dielusi dengan pelarut yang diinginkan (Marston, 1986) dan dapat
dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan
terpisah menjadi beberapa pita. Pita ditampakkan dengan cara yang tidak merusak jika
senyawa itu tanpa warna, dan penyerap yang mengandung pita dikerok dari pelat kaca.
Kemudian cuplikan dielusi dari penyerap dengan pelarut polar (Gritter, 1991).
Penyerap yang paling umum ialah silika gel (Marston, 1986).
Cara ini berguna untuk memisahkan campuran reaksi sehingga diperoleh senyawa
murni untuk telaah pendahuluan, untuk menyiapkan cuplikan analisis, untuk meneliti
bahan alam yang lazimnya berjumlah kecil dan campurannya rumit dan untuk
memperoleh cuplikan yang murni untuk mengkalibrasi KLT kuantitatif
(Gritter, 1991).
2.6 Teknik Spektroskopi
Penentuan struktur kimia senyawa organik secara spektroskopi dapat dilakukan jika
senyawa organik tersebut diperoleh dalam keadaan murni, adanya pengotor akan
dihasilkan spektra yang lebih kompleks sehingga akan menyulitkan dalam interpretasi
spektra. Selanjutnya dari spektra massa dan NMR akan diperoleh rumus formula dan
derajat ketidakjenuhan atau juga dikenal dengan ekuivalensi ikatan rangkap. Spektra
NMR, infra merah dan UV-Vis akan memberikan informasi adanya gugus fungsional,
selain itu dari spektra NMR akan memberikan adanya bagian-bagian struktur
2.6.1 Spektrofotometer Ultraviolet- Visibel (UV-Vis)
Asas
Radiasi ultraviolet dan sinar tampak diabsorpsi oleh molekul organik aromatik,
molekul yang mengandung elektron-π terkoyugasi dan atom yang mengadung elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat enersi
elektron dasar ke tingkat enersi elektron tereksitasi lebih tinggi (Satiadarma, 2004).
Penyerapan sinar ultraviolet dan tampak oleh suatu molekul organik akan
menghasilkan transisi diantara tingkat energi elektronik pada molekul tersebut , dan
karenanya sering dinamakan Spektrometri elektronik. Transisi tersebut pada umumnya
antara orbital ikatan atau orbital pasangaan elektron bebas ke orbital anti ikatan.
Supaya elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi
dan akan memberikan serapan pada panjang gelombang 120-200 nm. Panjang
gelombang di atas 200 nm merupakan daerah eksitasi elektron dari orbital π dan orbital d ,terutama untuk sistem ikatan π terkonyugasi, pengukurannya relatif mudah dan spektrumnya memberikan banyak keterangan, maka spektrometri ultraviolet
tampak biasa dilakukan pada α di atas 200 nm. Kegunaan spektrofotometer ini terletak
pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik
didalam suatu molekul (Unang, 2010).
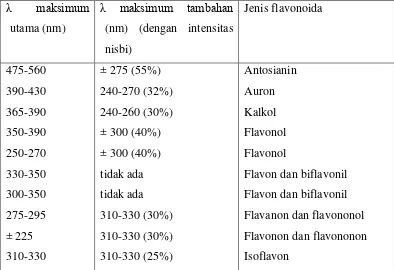
Cara Spektroskopi Ultraviolet- Visibel (UV-Vis) merupakan cara tunggal yang paling
berguna untuk menganalisis struktur flavonoid, untuk membantu mengidentifikasi
jenis flavonoid dan menentukan pola oksigenasinya. Spektrum flavonoid biasanya
ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum khas terdiri
atas dua maksima pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I).
Kedudukan yang tepat dan kekuatan nisbi maksima tersebut memberikan informasi
yang berharga mengenai sifat dan pola oksigenasinya. Ciri khas spektrum adalah
kekuatan nisbi yang rendah pada pita I dalam dihidroflavon, dihidroflavonol dan
isoflavon serta kedudukan pita I pada spektrum khalkon, auron dan antosianin yang
terdapat pada panjang gelombang yang tinggi. Petunjuk mengenai rentang maksima
Tabel 2.2 Rentang serapan spektrum UV-tampak flavonoida
λ maksimum
utama (nm)
λ maksimum tambahan (nm) (dengan intensitas
nisbi) Jenis flavonoida 475-560 390-430 365-390 350-390 250-270 330-350 300-350 275-295 ± 225 310-330
± 275 (55%)
240-270 (32%)
240-260 (30%)
± 300 (40%)
± 300 (40%)
tidak ada tidak ada 310-330 (30%) 310-330 (30%) 310-330 (25%) Antosianin Auron Kalkol Flavonol Flavonol
Flavon dan biflavonil
Flavon dan biflavonil
Flavanon dan flavononol
Flavonon dan flavononon
Isoflavon
(Markham,1988)
2.6.2 Spektrofotometer Infra Merah (FT-IR)
Asas
Apabila radiasi inframerah tengah mengenai molekul organik, frekuensi tertentu yang
enersinya sesuai dengan frekuensi energi vibrasi dan rotasi atom/gugus atom dalam
molekul, akan diabsorpsi dan digunakan untuk eksitasi pada tingkat enersi vibrasi dan
rotasi khas dari molekul. Spektrum absorpsi radiasi yang terbentuk, khas untuk
molekul senyawa organik yang bersangkutan (Satiadarma, 2004).
Spektrum Infra Merah hasil dari penyerapan energi yang mempengaruhi mode getaran
atom yang terikat satu sama lain. Untuk molekul organik yang khas, harus ada banyak
pita penyerapan, masing-masing dihasilkan oleh salah satu dari banyak kelompok
yang berbeda dari atom. karena hampir semua senyawa organik mengandung obligasi
substansi dan karena itu tidak informatif. Spektroskopi IR sangat berguna untuk
mengetahui kelompok gugus fungsional yang terdapat dalam molekul
(Thomas, 1998).
Pancaran infra-merah di julat antara 10.000-10 / cm (1-100µm), diserap oleh sebuah
molekul organik dan diubah menjadi energi getaran molekul. Penyerapan ini juga
tercatu , namun spektrum getaran tampak bukan sebagai garis melainkan berupa
pita-pita. Hal itu disebabkan perubahan energi getaran tunggal selalu disertai sejumlah
energi putaran. Terdapat dua macam getaran molekul, yaitu getaran ulur dan getaran
tekuk. Getaran ulur adalah suatu getaran berirama di sepanjang sumbu ikatan sehingga
jarak antar atom bertambah atau berkurang. Getaran tekuk dapat terjadi karena
perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau karena
gerakan sebuah gugusan atom terhadap sisa molekul tanpa gerakan nisbi atom-atom
didalam gugusan (Silverstein, 1986).
2.6.3 Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektroskopi RMI proton pada hakikatnya merupakan sarana untuk menentukan
struktur senyawa organik dengan mengukur momen magnet atom hidrogennya. Pada
kebanyakan senyawa, atom hidrogen terikat pada gugus yang berlainan dan spektrum
RMI proton merupakan rekaman sejumlah atom hidrogen yang berada dalam keadaan
lingkungan yang berlainan tersebut. Tetapi, tidak dapat memberikan keterangan
langsung mengenai sifat kerangka karbon molekul tersebut. Pelarut untuk pengukuran
RMI harus lembam dan tanpa proton.
Dalam praktek, larutan cuplikan dalam pelarut lembam ditempatkan diantara kutub
magnet yang kuat, dan proton mengalami geser kimia yang berlainan sesuai dengan
lingkungan molekulnya didalam molekul, biasanya menggunakan tetrametilsilan
(TMS), yaitu senyawa lembam yang dapat ditambahkan kedalam larutan cuplikan
Spektroskopi NMR didasarkan pada penerapan gelombang radio oleh inti tertentu
dalam molekul organik, bila molekul ini berada dalam magnet yang sangat kuat dan
homogen . Dari spektra resonansi magnet inti proton akan diperoleh informasi tentang
jenis hidrogen, jumlah hidrogen dan lingkungan hidrogen dalam suatu senyawa
(Unang, 2010)
Terperisai dan tak terperisai merupakan istilah relatif. Untuk memperoleh pengukuran
yang kuantitatif diperlukan suatu titik rujukan. Senyawa yang dipilih untuk rujukan
adalah Tetrametilsilana (CH3)4Si, yang proton-protonnya menyerap pada ujung kanan spektrum NMR (Fessenden, 1982).
Pada beberapa apektrum NMR akan terlihat sinyal TMS pada angka nol sehingga
sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena :
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai
lingkungan kimia yang sama, sehingga menghasilkan singlet yang kuat karena banyak mengandung atom hidrogen
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan
hidrogen jika dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat
terlindungi dari medan magnet eksternal sehingga dibutuhkan medan magnet
yang besar untuk membawa atom hidrogen ke kondisi resonansi
BAB 3
METODOLOGI PENELITIAN
3.1 Alat – Alat
1. Gelas ukur 50 ml/100 ml Pyrex
2. Gelas Beaker 250 ml/1000ml Pyrex
3. Gelas Erlenmeyer 250 ml Pyrex
4. Corong kaca
5. Corong pisah 500 ml Pyrex
6. Kolom kromatografi Pyrex
7. Tabung reaksi Pyrex
8. Bejana maserasi 10 L Schott/Duran
9. Rotari evaporator Buchi R-114
10. Kertas aluminium 7,6 m x 300 mm Total Wrap
11. Statif dan klem
12. Lampu UV 254 nm/356 nm UVGL 58
13. Spatula
14. Neraca analitis Mettler AE 200
15. Pipet tetes
16. Penangas air Buchi B-480
17. Botol vial
18. Vakum Buchi B-169
19. Bejana Kromatografi Lapis Tipis
20. Spektrofotometer FT-IR Shimadzu
21. Spektrofotometer ‘H-NMR Jeol/Delta2NMR-500MHz
22. Spektrofotometer UV-Visible
3.2 Bahan – Bahan
1. Albedo jeruk bali merah ( Citrus maxima.Merr )
2. Metanol Teknis
3. n-Heksana Teknis
4. Etil asetat Teknis
5. Aquadest
6. Aseton Merck
7. Kloroform
8. Silika gel 40 (70-230 mesh) ASTM E.Merck. KGaA
9. FeCl3 5% 10. NaOH 10%
11. Mg-HCl
12. H2SO4(p)
13. Pelat KLT silika gel 60 F254
3.3 Prosedur Penelitian
3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah albedo jeruk bali merah yang diperoleh dari daerah
Rambung Baru, Sembahe, Kecamatan Sibolangit, Kabupaten Deliserdang , Sumatera
Utara. Albedo jeruk bali merah dikeringkan di udara terbuka, lalu dihaluskan sampai
diperoleh serbuk albedo jeruk bali merah sebanyak 1030 gram.
3.3.2. Uji Pendahuluan Terhadap Ekstrak Albedo Jeruk Bali Merah
Serbuk albedo jeruk bali merah diidentifikasi dengan menggunakan cara :
1. Skrining fitokimia
3.3.2.1 Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada albedo jeruk bali merah, maka
dilakukan uji pendahuluan secara kualitatif sebagai berikut :
- Dimasukkan ± 10 gram serbuk albedo jeruk bali merah (C Maxima Merr.) yang telah dikeringkan dan dipotong-potong kecil ke dalam Erlenmeyer
- Ditambahkan metanol ± 100 ml
- Didiamkan
- Disaring
- Dibagi ekstrak metanol kedalam 4 tabung reaksi
- Ditambahkan masing-masing pereaksi
a. Tabung I : dengan FeCl3 5 % menghasilkan larutan berwarna hitam. b. Tabung II : dengan H2SO49p) menghasilkan larutan berwarna orange
kekuningan.
c. Tabung III : dengan Mg-HCl menghasilkan larutan bewarna merah muda.
d. Tabung IV : dengan NaOH 10 % menghasilkan larutan bewarna biru violet.
3.3.2.2 Analisis Kromatografi Lapis Tipis
Analisis Kromatografi lapis tipis dilakukan terhadap ekstrak kloroform dengan
menggunakan fasa diam silika gel 60F254 Merck. Analisis ini dimaksudkan untuk mencari pelarut yang sesuai untuk kromatografi kolom. Fasa gerak yang digunakan
(90:10 ; 80:20 ; 70:30 ; 60:40 v/v).
Dimasukkan 10 ml larutan fase gerak n-heksana : etil asetat (90:10 v/v) ke dalam
bejana kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat kloroform pada
plat KLT yang telah diaktifkan. Dimasukkan plat kedalam bejana yang telah berisi
pelarut yang telah dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi
dikeluarkan dari bejana, lalu dikeringkan dan difiksasi dengan perekasi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Perlakuan
yang sama dilakukan untuk perbandingan pelarut n-heksana : etil asetat dengan
perbandingan ( 80:20; 70:30; 60:40 v/v). Dari hasil analisis KLT menunjukkan bahwa
yang baik diberikan pada fase gerak n-heksana : etil asetat ( 80:20 v/v) LAMPIRAN
C.
3.3.3. Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol dari Albedo Jeruk
Bali Merah
Serbuk albedo jeruk bali merah ditimbang sebanyak 1030 g, kemudian dimaserasi
dengan metanol sebanyak 9 L sampai semua sampel terendam dan dibiarkan selama ±
72 jam. Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator
sehingga diperoleh ekstrak pekat metanol. Kemudian diuapkan hingga semua pelarut
metanol menguap.
3.3.4. Pemisahan Tanin
Ekstrak pekat metanol dari serbuk albedo jeruk bali merah di diuapkan sampai pelarut
metanol menguap habis, kemudian dilarutkan dengan pelarut etil asetat untuk
memisahkan tanin dengan flavonoida, yang mana tanin tidak larut dalam pelarut etil
asetat. Kemudian disaring dan filtrat yang didapatkan dirotarievaporator dan diuapkan
sehingga diperoleh ekstrak pekat metanol bebas tanin.
3.3.5. Hidrolisa
Ekstrak pekat metanol bebas tanin dihidrolisa yang bertujuan untuk memutuskan
ikatan gula pada senyawa flavonoida dengan menggunakan HCl 6%. Ekstrak pekat
metanol bebas tanin dilarutkan dengan HCL 6% dengan perbandingan sampel dan
HCl 2:5, dipanaskan diatas penangas air selama ± 30-40 menit, kemudian disaring dan
3.3.6. Ekstraksi Partisi dengan Kloroform
Filtrat yang sudah bebas gula diekstraksi partisi dengan kloroform secara
berulang-ulang, sehingga didapatkan ekstrak kloroform dan dipekatkan kembali dan dipanaskan
sampai kering sehingga diperoleh ekstrak pekat kloroform sebanyak 1,575 gr.
3.3.7. Pemisahan Komponen dengan Kromatografi Kolom
Pemisahan komponen secara kolom dilakukan terhadap ekstrak pekat kloroform yang
telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM
dan fasa gerak yaitu n-heksana 100%, campuran pelarut n-heksana : etil asetat dengan
perbandingan (90:10 v/v, 80:20 v/v, 70:30 v/v dan 60:40 v/v). Dirangkai alat kolom
kromatografi. Terlebih dahulu dibuburkan silika gel 40 (70-230 mesh) ASTM dengan
menggunakan n-heksan, diaduk-aduk hingga homogen lalu dimasukkan dalam kolom
kromatografi. Kemudian dielusi dengan menggunakan n-heksan 100% hingga silika
gel padat dan homogen. Dimasukkan 1,575 g ekstrak metanol albedo jeruk bali merah
kedalam kolom kromatografi yang telah berisi bubur silika gel, lalu ditambahkan fasa
gerak n-heksan: etil asetat ( 90:10) v/v secara perlahan-lahan dan diatur sehingga
aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak
dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n-heksana : etil
asetat dengan perbandingan (80:20v/v,70:30v/v dan 60:40 v/v). Hasil yang diperoleh
ditampung dalam botol vial setiap 8 ml, lalu di KLT dan digabung fraksi dengan harga
Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk Kristal. Kristal yang diperoleh dari isolasi dengan kromatografi kolom dilarutkan
kembali dengan Me-OH lalu dianalisis KLT untuk mengetahui apakah senyawa yang
diperoleh sudah murni atau belum sekaligus mencari fasa gerak yang sesuai untuk
preparatif KLT.
Kristal yang telah dilarutkan tadi ditotolkan secara perlahan-lahan dan sama rata
disepanjang tepi bawah plat KLT yang berukuran 20x20 yang telah dibuat garis batas
bawah dan batas atas sepanjang 2 cm, plat yang digunakan harus sudah diaktifkan
kemudian ditutup. Setelah dielusi plat dikeluarkan dari bejana, dikeringkan dan
hasilnya diperiksa dibawah sinar UV. Tiap zona diberi tanda dan dikeruk lalu dielusi
dengan perbandingan pelarut metanol dan etil asetat 1:1. Hasil elusi diuapkan
sehingga diperoleh kristal.
3.3.8Pemurnian Hasil Isolasi
3.3.8.1 Pemurnian Hasil Isolasi Dengan Kromatografi L