ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN PIDADA MERAH
(
Soneratia caseolaris
(L) )
SKRIPSI
BETNIA LETARE TAMBUNAN
070802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI FLAVONOIDA DARI DAUN TUMBUHAN PIDADA MERAH ( Soneratia caseolaris (L) Engler)
SKRIPSI
BETNIA LETARE TAMBUNAN 070802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN PIDADA MERAH
(Soneratia caseolaris (L) ) Kategori : SKRIPSI
Nama : BETNIA LETARE TAMBUNAN Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Juni 2012 Komisi pembimbing :
Pembimbing 2 Pembimbing 1
Prof.Dr.Tonel Barus Drs.Albert Pasaribu,MSc NIP:1945 0801 1974 121001 NIP:1964 0810 1991 031002
Diketahui oleh
Dr. Rumondang Bulan Nst.MS NIP:195408301985032001
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN PIDADA MERAH (Soneratia caseolaris (L) )
SKRIPSI
Saya mengetahui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2012
PENGHARGAAN
Puji dan syukur saya ucapkan kepada Tuhan Yesus Kristus Juruselamat Manusia oleh karena kasihNya lah saya mampu menyelesaikan tugas akhir ini.
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam daun tumbuhan Pidada merah (Soneratia caseolaris (L) ) dilakukan dengan ekstraksi maserasi dengan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dengan menggunakan rotarievaporator, kemudian diekstraksi partisi dengan pelarut n-heksan, Lapisan metanol lalu diuapkan dengan rotarievaporator sampai seluruh metanol habis menguap. Ekstrak pekat metanol tersebut lalu dilarutkan dengan etil asetat dan disaring. Filtrat yang diperoleh kemudian diuapkan. Ekstrak pekat etil asetat yang merupakan flavonoida total kemudian dianalisis KLT, lalu dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan berturut-turut dengan fasa gerak campuran n-heksana : etil asetat 50:50 v/v. Hasil yang didapatkan kemudian dimurnikan
THE ISOLATION OF FLAVONOID FROM THE LEAVES OF PIDADA MERAH ( Soneratia caseolaris ( L) )
ABSTRACT
Isolation of flavonoid compound contained in the leaves of pidada merah ( Soneratia caseolaris (L) ) has been done by maceration technique with methanol solvent. Methanol extract obtained was concentrated by rotaryevaporator and partitioned with n-hexane. The dried methanol layer was then concentrated until all of methanol vapored.Then the methanol was added with ethyl acetate and filtered. The ethyl acetate extract which was the total amount of flavonoid was analyzed with TLC, and separated with column chromatography using silica gel as stationary phase and n-hexane : ethyl acetate 50:50 v/v as the mobile
DAFTAR ISI
Daftar Lampiran ix
Daftar Tabel x
1.6. Metodologi Penelitian 3
Bab 2 Tinjauan Pustaka 4
2.1. Tumbuhan Nussaindah 4
2.1.1. Morfologi Tumbuhan Pidada Merah 4 2.1.2. Sistematika Tumbuhan Pidada Merah 5 2.1.3. Manfaat Tumbuhan Pidada Merah 5 2.1.4. Kandungan Kimia Tumbuhan Pidada Merah 6
2.2. Senyawa Flavonoida 6
2.2.1. Struktur Dasar Senyawa Flavonoida 8 2.2.2. Klasifikasi Senyawa Flavonoida 9 2.2.3. Sifat Kelarutan Flavonoida 16
2.3. Teknik Pemisahan 16
2.3.1. Kromatografi 16
2.3.1.1. Kromatografi Lapis Tipis 17 2.3.1.2. Kromatografi Kolom 18 2.3.1.3. Harga Rf (Retardation Factor) 18
2.3.2. Ekstraksi 19
2.4.3.Spektrometri Resonansi Magnetik Inti Proton 22 ( Nucleic Magnetic Resonance Proton/1H-NMR )
Bab 3 Bahan dan Metodologi Penelitian 24
3.1. Alat-Alat 24
3.2. Bahan 25
3.3. Prosedur Penelitian 25 3.3.1. Penyediaan Sampel 25 3.3.2. Uji Pendahuluan terhadap Ekstrak daun Pidada Merah 25 3.3.2.1. Skrining Fitokimia 26 3.3.2.2. Analisis Kromatografi Lapis Tipis 26 3.3.3. Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol
dari Daun Pidada Merah 27 3.3.4. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom 27 3.3.5. Pemurnian (Rekristalisasi) 28 3.3.6. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis
(KLT) 28
3.3.7. Penentuan Titik Lebur 28 3.3.8. Identifikasi Senyawa Hasil Isolasi 29 3.3.8.1. Identifikasi dengan Spektrofotometer UV-Visible 29 3.3.8.2. Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton(1
3.3.8.3. Identifikasi dengan Spektrofotometer
H-NMR) 29
Infra Merah (FT-IR) 29 3.4. Bagan Skrining Fitokimia 30
3.5. Bagan Penelitian 31
DAFTAR PUSTAKA 34
DAFTAR LAMPIRAN
Halaman
Lampiran A. Gambar Daun Tumbuhan Pidada Merah (Soneratia caseolaris L.) 40 Lampiran B. Hasil Determinasi Daun Tumbuhan Pidada Merah 41
(Soneratia caseolaris L.)
Lampiran C. Kromatografi Lapisan Tipis Ekstrak Pekat Lapisan Metanol 42 Daun Tumbuhan Pidada Merah (Soneratia caseolaris L.)
Lampiran D. Kromatografi Lapisan Tipis senyawa Hasil Isolasi Penampakan 43 Noda FeCl3
Lampiran D.1. Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Penampakan 44 5%
Noda FeCl3
Lampiran E. Spektrum UV-Visible Beberapa senyawa Pembanding Flavonoida 45 5% dengan Uji Kemurnian
Lampiran F. Ekspansi Spektrum 1 Lampiran G. Ekspansi Spektrum
H-NMR Senyawa Hasil Isolasi 46
1
Lampiran H. Ekspansi Spektrum
H-NMR Senyawa Hasil Isolasi 47
1
Lampiran I. Spektrum
H-NMR Senyawa Hasil Isolasi 48
1
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
PENGHARGAAN
Puji dan syukur saya ucapkan kepada Tuhan Yesus Kristus Juruselamat Manusia oleh karena kasihNya lah saya mampu menyelesaikan tugas akhir ini.
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam daun tumbuhan Pidada merah (Soneratia caseolaris (L) ) dilakukan dengan ekstraksi maserasi dengan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dengan menggunakan rotarievaporator, kemudian diekstraksi partisi dengan pelarut n-heksan, Lapisan metanol lalu diuapkan dengan rotarievaporator sampai seluruh metanol habis menguap. Ekstrak pekat metanol tersebut lalu dilarutkan dengan etil asetat dan disaring. Filtrat yang diperoleh kemudian diuapkan. Ekstrak pekat etil asetat yang merupakan flavonoida total kemudian dianalisis KLT, lalu dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan berturut-turut dengan fasa gerak campuran n-heksana : etil asetat 50:50 v/v. Hasil yang didapatkan kemudian dimurnikan
BAB 1 PENDAHULUAN
1.1Latar Belakang:
Tumbuhan –tumbuhan termasuk salah satu sumber senyawa bahan alam hayati yang memegang peranan penting dalam pemanfaatan zat kimia berkhasiat yang dapat digunakan.
Salah satu yang digunakan sebagai obat adalah tumbuhan pidada merah. Secara tradisional tumbuhan pidada merah ini digunakan sebagai ramuan bedak dingin. Tumbuhan pidada merah (Soneratia caseolaris L. ) terdapat di hutan-hutan bakau bagian yang berlumpur, biasanya ditemui disepanjang tepian sungai dan rawa-rawa yang masih dipengaruhi pasang-surut air laut. Secara umum bunga pidada merah mekar dimalam hari, sehingga bunga ini mengandung banyak nektar, yang disukai oleh kelawar. (Heyne, K. 1987)
Dari studi literatur, peneliti telah menguji ekstrak tumbuhan pidada merah sebagai aktivitas antioksidan dengan menggunakan 1,1-difenil-2-picrylhyldrazyl (DPPH) pada kromatografi lapis tipis.Dari hasil penelitian tersebut, diketahui terdapat 2 komponen senyawa flavonoida, yaitu luteolin dan luteolin 7-O-beta glukosida. Kedua senyawa ini juga bersifat aktivitas antioksidan. (Kumar,S.2005)
Peneliti juga telah melakukan penelitian untuk mengetahui peranan ekstrak kelopak dan buah mangrove Soneratia caseolaris (L) yang berperan untuk pencegahan dan pengobatan terhadap infeksi bakteri Vibrio harveyi pada udang windu (Penaeus monodon
Fab.). Pemberian ekstrak mangrove juga meningkatkan ketahanan hidup udang windu setelah diinfeksi dengan bakteri V. harveyi dan penurunan jumlah bakteri yang terdapat pada tubuh udang.( Maryani,2002)
Tumbuhan ini mengandung senyawa bioaktif seperti flavonoid, steroid, fenol hidrokuinon dan tanin yang aktif sebagai bahan antimikroba.( Naiborhu ,2002)
Dari uji pendahuluan yang peneliti lakukan, yaitu dengan uji skrining fitokimia dengan pereaksi H2SO4(p), FeCl3
Dari uraian diatas dan berdasarkan literatur mengenai kandungan kimia yang terdapat pada daun tumbuhan pidada merah, maka peneliti tertarik melakukan penelitian terhadap tumbuhan tersebut, khususnya mengenai senyawa flavonoida yang terkandung di dalam tumbuhan ini. Metode yang digunakan adalah dengan mengekstraksi daun tumbuhan dengan metanol, kemudian dilakukan analisa KLT dan kolom kromatografi. Selanjutnya komponen atau senyawa murni yang diperoleh dianalisis dengan menggunakan Spektrofotometri UV-Visible, Infra Merah (FT-IR), Spektrometri Resonansi Magnetik Inti Proton (
1%, dan MgHCl menunjukkan bahwa ekstrak metanol daun tumbuhan pidada merah mengandung senyawa flavonoida.
1
H-NMR), dan penentuan titik lebur.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa flavonoida yang terdapat dalam daun tumbuhan pidada merah.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalahuntuk mengisolasi senyawa flavonoida dari daun tumbuhan pidada merah.
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam khususnya tentang golongan senyawa flavonoida yang terkandung dalam daun tumbuhan pidada merah.
1.5 Lokasi Penelitian
• Lokasi Pengambilan Sampel : Sampel yang digunakan dalam penelitian ini diperoleh dari
Desa Bagan Pekan, Kecamatan Tanjung Balai, Asahan Sumatera Utara.
• Lokasi Penelitian : Penelitian dilakukan di laboratorium Kimia Bahan Alam FMIPA Universitas
Sumatera Utara (USU).
• Identifikasi kristal Senyawa Hasil Isolasi : Kristal senyawa hasil isolasi dianalisis secara
Spektrofotometrim UV-Visible, Spektrofotometri Infra Merah (FT-IR), Spektrofotometri Resonansi Magnetik Inti Proton (H-NMR) dilakukan di Pusat Penelitian Kimia LIPI, Serpong- Tangerang.
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun tumbuhan pidada merah berupa serbuk halus yang kering sebanyak 1500 gram. Tahap awal dilakukan uji skrining fitokimia untuk senyawa flavonoida, yaitu dengan menggunakan pereaksi FeCl3 1%,
NaOH 10%, Mg-HCl dan H2SO4(p)
Kemudian dilakukan tahapan isolasi, yaitu : .
- Ekstraksi Maserasi - Ekstraksi Partisi
- Analisis Kromatografi Lapis Tipis - Analisis Kromatografi Kolom - Analisis Kristal hasil isolasi
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Pidada Merah
2.1.1 Morfologi Tumbuhan Pidada Merah
Tumbuhan pidada (Soneratia) adalah sejenis pohon penghuni rawa-rawa tepi sungai, dan bagian dari vegetasi mangrove. Secara lokal pohon ini sering disebut dengan sebutan perapat. Secara ekologi tumbuhan ini hidup di daerah yang pasang surut yang berlumpur, dan rawa-rawa.
Menghadapi lingkungan yang ekstrim di hutan bakau, tumbuhan beradaptasi dengan berbagai cara. Secara fisik, kebanyakan vegetasi mangrove menumbuhkan organ khas untuk bertahan hidup. Seperti aneka bentuk akar dan kelenjar garam di daun. Namun ada pula bentuk-bentuk adaptasi fisiologis seperti halnya pidada (Soneratia), menumbuhkan akar napas (pneumatophore) yang muncul dari pekatnya lumpur untuk mengambil oksigen dari udara. Sehingga tumbuhan ini tetap dapat berkembang di daerah hutan yang berlumpur.(Santoso N, 2005.)
dari akarnya sendiri adalah kerucut normal. Pola adaptasi pada daun adalah bentuk daun yang elips dengan ujung membulat, susunan daun yang menjari.
Tumbuhan ini mampu tumbuh hingga ketinggian dengan 5-20 Meter, dengan struktur batang terdiri dari, akar, batang, ranting, daun, bunga dan buah. Batang berukuran kecil hingga besar, di ujung batang terdapat ranting yang tumbuh menyebar. Daun-daunnya tunggal, berhadapan, bundar telur terbalik atau memanjang, 5–13 cm × 2–5 cm, dengan pangkal bentuk baji dan ujung membulat atau tumpul. Tangkai daun pendek dan seringkali kemerahan. Bunga sendirian atau berkelompok hingga 3 kuntum di ujung ranting. Kelopak bertaju 6 (jarang 7–8), runcing, panjang 3–4,5 cm dengan tabung kelopak serupa cawan dangkal di bawahnya, hijau di bagian luar dan putih kehijauan atau kekuningan di dalamnya. Daun mahkota merah, sempit, 17-35 mm × 1,5-3,5 mm. Benangsari sangat banyak, panjang 2,5–3,5 cm, putih dengan pangkal kemerahan yang cepat rontok. Tangkai putik besar dan panjang, tetap tinggal sampai lama. Buah berbiji banyak berbentuk bola pipih, hijau, 5–7,5 cm diameternya dan tinggi 3–4 cm, terletak di atas taju kelopak yang hampir datar. Daging buahnya kekuningan, masam asin, dan berbau busuk.(Sukmadi R, dkk.2008).
2.1.2 Sistematika Tumbuhan Pidada Merah
Sistematika tumbuhan Pidada Merah adalah sebagai berikut :
Kingdom : Plantea
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Soneratiaceae
Genus : Soneratia
Spesies : Soneratia caseolaris L.
Tumbuhan pidada dapat di manfaatkan untuk bahan makanan, daun-daunnya yang masih muda dapat diolah menjadi makanan dan campuran masakan, dan buahnya yang sudah tua dapat di manfaatkan sebagai minuman, dengan cara diambil sari buahnya dan menjadikannya bahan baku sirup pidada. Selain itu kayu dari pohon pidada ini juga dapat di manfaatkan sebagai kayu bakar, karena kayunya berkualitas rendah dan memiliki serat yang padat, jadi sulit untuk memanfaatkan kayu pohon pidada sebagai bahan baku mebel.
Tumbuhan pidada memiliki manfaat yang besar tehadap lingkungan sekitar, terutama lingkungan pesisir. Secara tidak langsung tumbuhan pidada maupun tumbuhan bakau lainya dapat mencegah erosi dan abrasi pantai dari pasang surut air laut, selain itu tumbuhan ini akan menjadi tempat tinggal hewan-hewan rawa, seperti kepiting, udang, kerang ikan, dan lain-lain. Namun jika hutan pidada atau hutan bakau lebih di kelola dengan baik maka akan memberikan nilai ekonomis untuk warga sekitar, dengan cara menjadikan hutan bakau salah satu tampat wisata.Daun pada buah pedada berfungsi untuk ekskresi garam.
Salah satu tumbuhan yang digunakan sebagai obat adalah tumbuhan pidada merah.Secara tradisional tumbuhan pidada merah ini digunakan sebagai ramuan bedak dingin. (Heyne,K.1987)
2.1.4.Kandungan Kimia Pidada merah
Menurut penggunaan obat tradisonal tumbuhan pidada merah, para peneliti menguji ekstrak tumbuhan pidada merah untuk aktivitas antioksidan dengan menggunakan 1,1-difenil-2-picrylhydrazyl (DPPH) pada kromatografi lapis tipis. Dari hasil pemisahan tersebut dapat disimpulkan bahwa ada dua flavonoid yang terkandung, yaitu: luteolin dan luteolin7-O-beta-glukosida. Kedua senyawa ini juga memiliki aktivitas antioksidan. (Kumar,S.2005).
2.2.Senyawa Flavonoida
Istilah flavonoida diberikan pada suatu golongan besar senyawa yang berasal dari kelompok senyawa yang paling umum, yaitu senyawa flavon; suatu jembatan oksigen terdapat diantara cincin A dalam kedudukan orto, dan atom karbon benzil yang terletak disebelah cincin B. Senyawa heterosiklik ini, pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan tingkat oksidasi paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa-senyawa ini. (Manitto, 1981)
Lebih dari 800 jenis flavonoid telah teridentifikasi. Banyak di antaranya terdapat bersama vitamin C. Contoh flavonoid
Flavonoid relatif stabil dan tahan terhadap panas, oksigen, dan kekeringan walaupun dapat rusak karena cahaya. Oleh karena itu, buah atau sayuran berwarna cerah sebaiknya disimpan ditempat yang teduh dan dingin untuk mempertahankan zat-zat gizinya yang amat berharga. Jadi, warna buah-buahan dan sayuran tak hanya membuat penampilannnya menarik, tetapi juga rasa yang enak serta kandungan gizi yang dapat melindungi sel saraf dan
ialah kuersitin dalam cranberry, rutin dalam buckwheat, hisperidin dalam jeruk, dan picnogenol dalam pine bark. Zat ini dipercaya bekerja bersama vitamin C dengan cara tertentu untuk mencegah kerusakan struktur sel akibat radikal bebas.
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini berada di dalam tumbuh – tumbuhan kecuali alga. Namun ada juga flavonoida yang terdapat dalam hewan. Dalam sayap kupu – kupu dengan anggapan bahwa flavonoida berasal dari tumbuh – tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh mereka. Penyebaran jenis flavonoida pada golongan tumbuhan yang tersebar yaitu angiospermae, klorofita, fungi, briofita (Markham, 1988).
Senyawa-senyawa flavonoida terdiri dari beberapa jenis,tergantung pada tingkat oksidasi dari rantai propana dari sistem1,3-diarilpropana. Antosianin, flavonol, dan flavon adalah jenis yang banyak ditemukan dialam sehingga sering disebut sebagai flavonoida utama.(Lenny,S.2006)
terdapat di berbagai bagian tumbuhan lain, misalnya buah tertentu, batang, daun, dan bahkan akar. Sering flavonoida terikat di sel epidermis. Warna sebagian besar buah dan banyak bunga adalah akibat dari antosianin, walaupun beberapa warna tumbuhan lainnya, seperti buah tomat dan beberapa bunga kuning, karena karotenoid. Warna cerah daun pada musim gugur disebabkan oleh timbulnya antosianin pada hari cerah dan dingin, walaupun karotenoid kuning atau jingga merupakan pigmen terbesar di daun musim gugur pada beberapa spesies. Antosianin umumnya tidak terdapat di lumut hati, ganggang, dan tumbuhan
tingkat rendah lainnya, walaupun beberapa antosianin dan flavonoida ada di lumut tertentu. Antosianin jarang ditemui di gimnospermae, walaupun gimnospermae mengandung jenis lain dari flavonoida. Beberapa macam antosianin terdapat di tumbuhan tingkat tinggi, dan sering lebih dari satu macam terdapat di bunga tertentu atau organ lain. Mereka dijumpai dalam bentuk glikosida, biasanya mengandung satu atau dua unit glukosa atau galaktosa yang tertempel pada gugus hidroksil di cincin tengah, atau pada gugus hidroksil di posisi 5 cincin A. Bila gula dihilangkan, maka bagian sisa molekul, yang masih berwarna, dinamakan antosianidin. (Salisbury, 1995).
2.2.1 Struktur Dasar Senyawa Flavonoida
Masing-masing jenis senyawa flavonoida mempunyai struktur dasar tertentu. Flavonoida mempunyai beberapa ciri struktur yaitu :
C C C
A B
Kerangka dasar senyawa flavonoida
Cincin A adalah karakteristik phloroglusinol atau bentuk resorsinol tersubstitusi.
O
O
2.2.2 Klasifikasi Senyawa Flavonoida
Sebagian besara senyawa flavonoida alam ditemukan dalam bentuk glikosida, dimana unit flavonoida terikat pada suatu gula.Glikosida adalah kombinasi antara suatu gula dan suatu alkohol yang saling berikatan melalui ikatan glikosida. Pada prinsipnya ikatan glikosida terbentuk apabila ikatan hidroksil dari alkohol beradisi kepada gugus karbonil dari gula, sama seperti adisi alkohol kepada aldehida yang dikatalisasi oleh asam menghasilkan suatu asetat. (Lenny,S.2006)
Pada flavonoida O-glikosida, satu gugus hidroksil flavonoida (atau lebih) terikat pada satu gula (lebih) dengan ikatan yang tahan asam. Glukosa merupakan gula yang paling umum terlibat dan gula lain yang sering juga terdapat adalah galaktosa, ramnosa, silosa, arabinosa, dan rutinosa. Waktu yang diperlukan untuk memutuskan suatu gula dari suatu flavonoida O-glukosida dengan hidrolisis asam ditentukan oleh sifat gula tersebut.
Pada flavonoida C-glikosida, gula terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoida, misalnya pada orientin.
Pada flavonoida sulfat, senyawa ini mengandung satu ion sulfat atau lebih yang terikat pada hidroksil fenol atau gula. Senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3
Pada Biflavonoida, yaitu flavonoida dimer. Flavonoida yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan-ikatan karbon atau kadang-kadang eter. Monomer flavonoida yang digabungkan menjadi biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda. Biflavonoida jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, tetapi terdapat pada gimnospermae.
K. Banyak yang berupa glikosida bisulfat, dimana bagian bisulfat terikat pada hidroksil fenol yang masih bebas atau pada gula.
Pada Aglikon flavonoida yang aktif-optik mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoida ini adalah flavanon, dihidroflavonol, katekin, rotenoid, dan lain-lain. (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3
1. Flavonol
yaitu :
dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
O O
OH
flavonol
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Flavon yang paling umum adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon - karbonya. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
O O
flavon
3. Isoflavon
O O
isoflavon
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O O
flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O O OH
Flavanonol
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
Leukoantosianidin merupakan senyawa tidak berwarna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab dari semua warna merah jambu, merah marak , ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
OH
9.Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya, karena hanya
pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air. (Harborne, 1996).
O kalkon
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap amonia. (Robinson, 1995).
HC
O
O
Auron
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama yakni:
Tabel 1.Turunan Senyawa Induk Flavon menurut Harbone.
Antonsianin
Proantosianidin
pigmen bunga merah marak,dan biru juga dalam daun dan jaringan lain. terutama tan warna, dalam daun tumbuhan berkayu.
larut dalam air, λmaks 515-545 nm, bergerak dengan BAA pada kertas.
Flavonol dalam bunga sianik dan asianik; tersebar luas dalam daun.
seperti flavonol
seperti flavonol
tanwarna; hampir seluruhnya terbatas pada gimnospermae.
pigmen bunga kuning, kadang-kadang terdapat juga dalam jaringan lain
tanwarna; dalam daun dan buah ( terutama dalam Citrus )
tanwarna; sering kali dalam akar; hanya terdapat dalam satu suku,Leguminosae
setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari dengan sinar UV;
maksimal spektrum pada 330 – 350
setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal; maksimal spektrum pada 330-350 nm.
mengandung gula yang terikat melalui ikatan C-C; bergerak dengan pengembang air, tidak seperti flavon biasa.
pada kromatogram BAA beupa bercak redup dengan RF
dengan amonia berwarna merah, maksimal spektrum 370-410 nm.
tinggi .
berwarna merah kuat dengan Mg / HCl; kadang – kadang sangat pahit .
bergerak pada kertas dengan pengembang air; tak ada uji warna yang khas.
2.2.3 Metoda isolasi senyawa flavonoida menurut Harbone
Dalam metoda ini, daun yang segar dimaserasi dengan MeOH, lalu disaring. Ekstrak MeOH dipekatkan dengan rotari evaporator. Lalu ekstrak pekat yang dihasilkan, diasamkan dengan H2SO4 2M, didiamkan, lalu diesktraksi dengan Kloroform. Lapisan Kloroform
2.2.4 Sifat Kelarutan Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila dibiarkan dalam larutan basa, dan dalam udara terbuka, maka banyak yang akan terurai. Karena mempunyai sejumlah gugus hidroksil, atau suatu gula, flavonoida merupakan senyawa polar, sehingga flavonoida cukup larut dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol (BuOH), aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain. Adanya gula yang terikat pada flavonoida (bentuk yang umum ditemukan) cenderung menyebabkan flavonoida lebih mudah larut dalam air dan dengan demikian campuran pelarut yang disebut diatas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform.
2.3 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan. 2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam suatu golongan. (Muldja, 1995).
2.3.1.Kromatografi
Kromatografi merupakan suatu cara pemisahan fisik dengan unsur-unsur yang akan dipisahkan terdistribusikan antara dua fasa, satu dari fasa-fasa ini membentuk lapisan stasioner dengan luas permukaan yang besar dan yang lainnya merupakan cairan yang mampu dilewati. Fasa stasioner mungkin suatu zat padat atau suatu cairan dan fasa yang bergerak mungkin suatu cairan atau gas. (Underwood, 1981).
kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fasa gerak dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi yaitu:
1) Fasa gerak cair–fasa diam padat (kromatografi serapan): a.kromatografi lapis tipis
b.kromatografi penukar ion
2) Fasa gerak gas–fasa diam padat, yakni kromatografi gas padat
3) Fasa gerak cair–fasa diam cair (kromatografi partisi), yakni kromatografi kertas. 4) Fasa gerak gas–fasa diam zat cair, yakni :
a. kromatografi gas–cair b. kromatografi kolom kapiler
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa – senyawa yang dipisahkan terdistribusi diantara fasa gerak dan fasa diam dalam perbandingan yang sangat berbeda – beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1991).
2.3.1.1 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis pada plat berlapis yang berukuran lebih besar, biasanya 5x20 cm, 10x20 cm, atau 20x20 cm. Biasanya memerlukan waktu pengembangan 30 menit sampai satu jam. Pada hakikatnya KLT melibatkan dua fase yaitu fase diam atau sifat lapisan, dan fase gerak atau campuran pelarut. Fase diam dapat berupa serbuk halus yang berfungsi sebagai permukaan penyerap atau penyangga untuk lapisan zat cair. Fase gerak dapat berupa hampir segala macam pelarut atau campuran pelarut. (Sudjadi, 1986).
Nilai utama Kromatografi Lapis Tipis pada penelitian senyawa flavonoida ialah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Menurut Markham, Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
2. Analisis fraksi yang diperoleh dari kromatografi kolom 3. Identifikasi flavonoida secara ko-kromatografi.
4. Isolasi flavonoida murni skala kecil
5. Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap dan pengembang pada kromatografi kolom dan kromatografi kertas. (Markham, 1988).
2.3.1.2 Kromatografi Kolom
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, dan tabung plastik. Pelarut atau fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoida (berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulose, silika atau poliamida), dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang cocok. Kolom hanya berupa tabung kaca yang dilengkapi dengan keran pada salah satu ujung. (Markham, 1988).
2.3.1.3 Harga Rf (Retardation Factor)
perambatan pelarut yang dihitung dari titik penotolan pelarut zat. Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembanding.
Jarak perambatan bercak dari titik penotolan
Rf =
Jarak perambatan pelarut dari titik penotolan
(Sastrohamidjojo, 1991).
2.3.2 Ekstraksi
Ekstraksi dapat dilakukan dengan metoda maserasi, sokletasi, dan perkolasi. Sebelum ekstraksi dilakukan, biasanya serbuk tumbuhan dikeringkan lalu dihaluskan dengan derajat kehalusan tertentu, kemudian diekstraksi dengan salah satu cara di atas. Ekstraksi dengan metoda sokletasi dapat dilakukan secara bertingkat dengan berbagai pelarut berdasarkan kepolarannya, misalnya n-heksana, eter, benzena, kloroform, etil asetat, etanol, metanol, dan air.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak yang pekat biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator. (Harborne, 1996).
2.4 Teknik Spektroskopi
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa kadang-kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa memberikan penaikan menjadi puncak absorbsi tunggal dalam spektrum NMR. Di dalam medan magnet, perputaran elektron-elektron valensi dari proton menghasilkan medan magnet yang melawan medan magnet yang digunakan. Hingga setiap proton dalam molekul dilindungi dari medan magnet yang digunakan dan bahwa besarnya perlindungan ini tergantung pada kerapatan elektron yang mengelilinginya. Makin besar kerapatan elektron yang mengelilingi inti, maka makin besar pula medan yang dihasilkan yang melawan medan yang digunakan (Bernasconi,1995).
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah tetrametilsilana (TMS). Beberapa keuntungan dari pemakaian standar internal TMS yaitu :
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrum puncak tunggal yang kuat.
CH3
CH3 Si CH3
CH
2. TMS merupakan cairan yang mudah menguap, dapat ditambahkan kedalam larutan sampel dalam pelarut CDCl
3
3 atau CCl4. (Silverstein, 1986)
Pada spektrometri RMI integrasi sangat penting. Harga integrasi menunjukkan daerah atau luas puncak dari tiap – tiap proton . Sedangkan luas daerah atau luas puncak tersebut sesuai dengan jumlah proton. Dengan demikian perbandingan tiap integrasi proton sama dengan perbandingan jumlah proton dalam molekul. (Muldja,1995).
2.4.1 Spektrofotometri Ultra Violet
Serapan molekul di dalam daerah ultra violet dan terlihat dari spektrum bergantung pada struktur ultra elektronik dari molekul. Penyerapan sejumlah energi menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi di dalam keadaan tereskitasi (Silverstein, 1986).
Spektrum Flavonoida biasanya ditentukan dalam larutan dengan pelarut Metanol (MeOH) atau Etanol (EtOH). Spektrum khas terdiri atas dua maksimal pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan kekuatan nisbi maksimal tersebut memberikan informasi yang berharga mengenai sifat flavonoida dan pola oksigenasinya. Ciri khas spektrum tersebut ialah kekuatan nisbi yang rendah pada pita I dalam dihidroflavon, dihidroflavonol, dan isoflavon serta kedudukan pita I pada spektrum khalkon, auron dan antosianin yang terdapat pada panjang gelombang yang tinggi.
Tabel 2. Ciri spektrum golongan flavonoida utama dapat ditunjukkan sebagai berikut : ( Markham, 1988)
λ maksimum
utama (nm)
2.4.2 Spektrofotometri Infra Merah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm -1 (panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi putaran energi molekul. Penyerapan ini tercantum, namun spektrum getaran terlihat bukan sebagai garis – garis melainkan berupa pita – pita. Hal ini disebabkan perubahan energi getaran tunggal selalu disertai sejumlah perubahan energi putaran (Silverstein, 1986).
2.5.3 Spektrometri Resonansi Magnetik Inti Proton (1
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul.. Struktur NMR memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidroge (Cresswell, 1982).
H-NMR)
Spektrometri Resonansi Magnetik Inti ( Nuclear Magnetic Resonance, NMR ) dan umumnya digunakan untuk :
1. Menentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu senyawa organik.
2. Mengetahui informasi mengenai struktur suatu senyawa organik. ( Dachriyanus, 2004 )
BAB 3 7. Kolom kromatografi Pyrex
8. Tabung reaksi Pyrex 9. Plat tetes
10.Rotari evaporator Büchi R-114 11.Labu alas 1 L Schott/ Duran 12.Alat pengukur titik lebur Fisher
13.Kapas
14.Kertas aluminium 7,6 m x 300 mm Total Wrap 15.Statif dan klem
16.Spatula
17.Batang pengaduk
18.Neraca analitis Mettler AE 200 19.Pipet tetes
20.Penangas air Büchi B-480 21.Botol vial
22.Vakum Büchi B-169
23.Bejana Kromatografi Lapis Tipis
24.Spektrofotometer FT-IR Shimadzu 25.Spektrometer 1
26.Spektrofotometer UV-Visible
H-NMR Jeol/Delta2NMR-500MHz
27.Kertas Saring
3.2 Bahan-Bahan
1. Daun Tumbuhan Pidada Merah (Soneratia caseolaris L. )
2. Metanol Destilasi
3. N-heksana Teknis
4. Etil asetat Teknis 5. Aquadest
6. Silika gel 40 (70-230 mesh) ASTM untuk k.kolom E.Merck. KGaA 7. FeCl3
8. NaOH 10% 5%
9. Mg-HCl 10. H2SO4(p)
3.3 Prosedur Penelitian 3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun tumbuhan pidada merah yang diperoleh dari desa bagan pekan, Kec.Tanjung Balai,Kab.Asahan. Daun tumbuhan pidada merah ini dikeringkan di udara terbuka, lalu dihaluskan sampai diperoleh serbuk daun tumbuhan pidada merah sebanyak 1500 gram.
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun tumbuhan Pidada Merah Serbuk daun pidada merah diidentifikasi dengan menggunakan cara:
1. Skrining fitokimia
3.3.2.1 Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada daun tumbuhan pidada merah, maka dilakukan uji pendahuluan secara kualitatif sebagai berikut :
- Dimasukkan ± 10 gram daun tumbuhan pidada merah (Soneratia caseolaris L.) yang telah dikeringkan dan dipotong-potong kecil ke dalam erlenmeyer
- Ditambahkan metanol ± 100 ml - Didiamkan
- Disaring
- Dibagi ekstrak metanol ke dalam 4 tabung reaksi - Ditambahkan masing-masing pereaksi
a. Tabung I : dengan FeCl3
b. Tabung II : dengan H
5% menghasilkan larutan berwarna hitam
2SO4(p)
c. Tabung III : dengan Mg-HCl menghasilkan larutan berwarna merah muda menghasilkan larutan orange kekuningan
d. Tabung IV : dengan NaOH 10% menghasilkan larutan berwarna biru violet
3.3.2.2 Analisis Kromatografi Lapis Tipis (KLT)
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak metanol dengan menggunakan fasa diam silika gel 60(0,063-0,200 mm)
- Dimasukkan 10 ml larutan fase gerak n-heksana : etil asetat (90:10)v/v ke dalam bejana kromatografi, kemudian dijenuhkan.
Merck. Analisis ini dimaksudkan untuk mencari pelarut yang sesuai didalam analisis kromatografi kolom. Pelarut yang digunakan adalah campuran pelarut n-heksana : etil asetat. Fasa gerak yang digunakan adalah campuran n-heksana : etil asetat dengan perbandingan (90:10 ; 80:20 ; 70:30 ; 60:40 ; 50:50 v/v ).Cara menganalisis kromatografi Lapis tipis sebagai berikut:
- Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut n-heksana : etil asetat dengan perbandingan (80 :20)v/v; (70:30)v/v; 60:40)v/v ; dan 50:50 v/v.
Dari hasil analisis KLT menunjukkan bahwa di dalam daun pidada merah terkandung senyawa flavonoida. Hasil pemisahan yang baik diberikan pada fase gerak n-heksana : etil asetat (50:50)v/v
3.3.3 Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol dari Daun Tumbuhan Pidada Merah (Soneratia caseolaris L.)
Serbuk daun tumbuhan pidada merah ditimbang sebanyak 1500 g, kemudian dimaserasi dengan metanol sebanyak ± 10 L sampai semua sampel terendam dan dibiarkan selama ± 4 hari. Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol. Kemudian diuapkan hingga semua pelarut metanol menguap. Lalu dilakukan pemblokan tannin dengan cara melarutkan fraksi metanol dengan etil asetat, dan disaring. Filtrat kemudian dirotarievaporator lalu diuapkan hingga semua pelarut etil asetat menguap. Lalu fraksi etil asetat dilarutkan dengan metanol dan dipartisi berulang-ulang dengan n-heksana. Lapisan metanol dipisahkan dari lapisan n-heksana, lalu dipekatkan kembali dengan rotarievaporator dan diuapkan sehingga diperoleh ekstrak pekat lapisan metanol sebanyak 18,96 g.
3.3.4 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kolom dilakukan terhadap ekstrak pekat metanol yang telah diperoleh. Fasa diam yang digunakan adalah silika gel 60G (0,063-0,200 mm) dan fasa gerak yaitu n-heksana 100%, campuran pelarut n-heksana : etil asetat dengan perbandingan (90:10)v/v, (80:20)v/v, (70:30)v/v, (60:40)v/v, dan (50:50)v/v. Cara mengisolasi senyawa flavonoida dengan Kromatografi kolom sebagai berikut:
- Dirangkai alat kolom kromatografi. Terlebih dahulu dibuburkan silika gel 60G (0,063-0,200 mm) dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu dimasukkan ke dalam kolom kromatografi.-
- Dimasukkan18.96 g ekstrak pekat metanol daun pidada merah ke dalam kolom kromatografi yang telah berisi bubur silika gel, lalu ditambahkan fasa gerak n-heksana : etil asetat (90 : 10) v/v secara perlahan – lahan, dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas.
- Ditingkatkan kepolaran dengan menambahkan fasa gerak n – heksana : etil asetat dengan perbandingan ( (50:50)v/v. Hasil yang diperoleh ditampung dalam botol vial setiap 5 ml , lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3
- Diuapkan sampai terbentuk kristal. 5%.
3.3.5 Pemurnian (Rekristalisasi)
Kristal yang diperoleh dari isolasi dilarutkan kembali dengan etil asetat,diaduk hingga
semua kristal larut sempurna. Kemudian ditambahkan etil asetat(pa)
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
secara perlahan–lahan hingga terjadi pengendapan zat-zat pengotor di dasar wadah. Kemudian didekantasi larutan bagian atas wadah, lalu diuapkan sisa pelarut dari kristal hingga diperoleh kristal yang benar – benar bebas dari pelarut.
Dimasukkan 10 ml larutan fasa gerak ke dalam bejana kromatografi, lalu dijenuhkan. Ditotolkan kristal yang diperoleh dari fraksi 51-60 dengan fase gerak n-heksana : etil asetat (50:50) v/v pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, dan difiksasi dengan menggunakan pereaksi FeCl3
3.3.7 Penentuan Titik Lebur
5% dalam metanol menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.8 Identifikasi Senyawa Hasil Isolasi
3.3.8.1 Identifikasi dengan Spektrofotometer UV-Visible
Analisis dengan alat Spektrofotometer UV-Visible diperoleh dari Laboratorium Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang dengan menggunakan metanol sebagai pelarut. (Gambar 1).
3.3.8.2. Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
Analisis dengan alat Spektrofotometer FT-IR diperoleh dari Laboratorium Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang. (Gambar 2).
3.3.8.3 Identifikasi dengan Spektrofotometer Resonansi Magnetik Inti Proton (1
Analisis dengan alat Spektrometer H-NMR)
1
3.4 Bagan Skrining Fitokimia
diekstraksi maserasi dengan metanol
disaring
dipekatkan
dibagi ke dalam 4 tabung reaksi
ditambahkan ditambahkan ditambahkan ditambahkan (Soneratia caseolarisL.)
3.5 Bagan Penelitian
1500 g serbuk daun tumbuhan pidada merah (Soneratia caseolaris L) Diskrining fitokima
Dimaserasi dengan metanol selama + 48 jam Diulangi sebanyak 4 kali
Diuji KLT untuk mengetahui sistem eluent yang sesuai pada kromatografi kolom Dikolom kromatografi dengan fasa diam silika gel 60 G(0,063-0,200) dan fase gerak n-heksana :etil asetat (50:50 ) v/v
Ditampung tiap fraksi sebanyak 5 ml dalam botol vial Diuji KLT untuk mengetahui harga Rf
Digabung fraksi dengan harga Rf yang sama
Fraksi 1-50
diuji kemurnian dengan perbandingan 70:30,60:40,50:50 kristal jarum kuning
dikarakterisasi
Titik lebur UV-Visible FT-IR 1H-NMR
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil penelitian
Hasil skrining fitokimia terhadap ekstrak metanol dari daun tumbuhan Pidada Merah (Soneratia caseolaris L.) menunjukkan bahwa daun tumbuhan pidada merah mengandung senyawa flavonoida. Dimana pereaksi-pereaksi yang digunakan adalah :
1. FeCl3
2. Mg-HCl menghasilkan warna merah muda 1% menghasilkan warna hitam
3. H2SO4(p)
4. NaOH 10% menghasilkan warna biru violet
mengahasilkan warna orange kekuningan
Hasil isolasi senyawa flavonoida dari daun tumbuhan Pidada merah (Soneratia caseolaris L.) diperoleh dengan menggunakan fase gerak n-heksana : Etil asetat (50/50) v/v pada fraksi 51-60 sebanyak 32 mg berwarna kuning, berbentuk jarum dengan titik lebur = 135oC- 137o
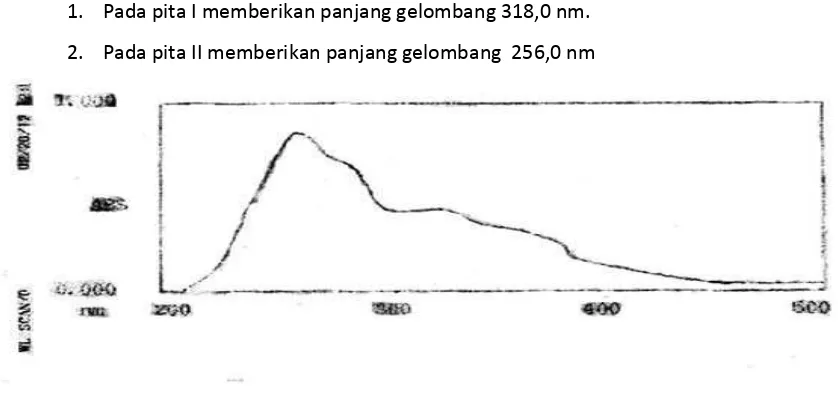
Hasil analisis Spektrofotometer Ultra Violet- Visible (UV) dengan pelarut metanol memberikan serapan sebagai berikut : (Gambar 1).
C dan Rf = 0,6
1. Pada pita I memberikan panjang gelombang 318,0 nm. 2. Pada pita II memberikan panjang gelombang 256,0 nm
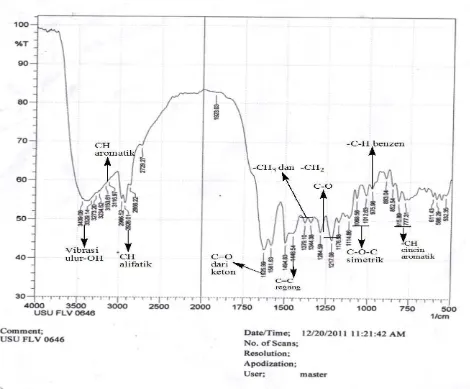
Hasil analisa Spektrofotometer Infra Merah (FT-IR) dari kristal hasil isolasi memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) (Gambar 2) :
Gambar 2.Spektrum FT-IR Senyawa Hasil Isolasi
Dari hasil analisa Spektrofotometer Infra Merah (FT-IR) memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1
1. Pada bilangan gelombang 3439,08 – 3234,62 cm ) sebagai berikut :
2. Pada bilangan gelombang 3153,61 – 3116,97 cm
-1
3. Pada bilangan gelombang 2966,52 – 2866,22 cm
-1
4. Pada bilangan gelombang 1625,99 cm
-1
5. Pada bilangan gelombang 1448,38 cm
-1
6. Pada bilangan gelombang 1379,10 – 1344,38 cm
-1
7. Pada bilangan gelombang 1284,59 – 1217,08 cm
-1
8. Pada bilangan gelombang 1068,56 – 1012,63 cm
-1
9. Pada bilangan gelombang 975,98 cm
10.Pada bilangan gelombang 893,04 – 777,31 cm
-1
-1
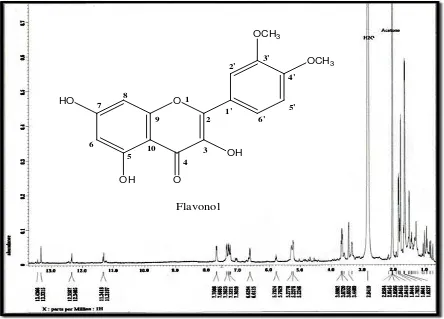
Hasil analisis spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) memberikan pergeseran kimia pada daerah (ppm) (Gambar 3) :
Gambar 3. Spektrum 1
Dari hasil analisis spektrofotometer Resonansi Magnetik Inti Proton (
H-NMR Senyawa Hasil Isolasi
1
1. Pergeseran kimia pada daerah δ = 5,2246 – 5,2778 ppm
H-NMR) memberikan pergeseran kimia pada daerah (ppm) sebagai berikut :
2. Pergeseran kimia pada daerah δ = 5,7629 – 5,7824 ppm 3. Pergeseran kimia pada daerah δ = 6,6125 – 6,6294 ppm 4. Pergeseran kimia pada daerah δ =7,2416 – 7,2728 ppm 5. Pergeseran kimia pada daerah δ = 7,3039 – 7,3221 ppm 6. Pergeseran kimia pada daerah δ = 7,3623 – 7,3765 ppm 7. Pergeseran kimia pada daerah δ = 7,6865 – 7,7008 ppm 8. Pergeseran kimia pada daerah δ = 11,3197 – 13,4366 ppm
2.2 Pembahasan
Dari hasil uji skrining fitokimia yang dilakukan terhadap ekstrak metanol daun tumbuhan pidada merah menunjukkan bahwa tumbuhan tersebut positif mengandung senyawa flavonoida.
Dari hasil kromatografi lapis tipis, diketahui bahwa perbandingan pelarut yang baik untuk mengisolasi senyawa flavonoida dari daun tumbuhan pidada merah adalah n-heksana : etil asetat (50:50 v/v), yang menunjukkan banyak noda yang dihasilkan.
Dari uji titik lebur yang dilakukan dengan menggunakan alat Fisher Johns terhadap kristal hasil isolasi dari 3 kali perlakuan menunjukkan titik lebur kristal yang sama yaitu 135-137 o
Dari data spektrum UV-Vis dengan mengunakan pelarut metanol menghasilkan
panjang gelombang (λ maks) pada pita I 318,0 nm dan pita II dengan panjang gelombang 256 nm. Hal ini menunjukkan bahwa senyawa hasil isolasi sesuai dengan penampakan spektrum serapan pembanding Ultraviolet-Visible dari beberapa Senyawa Flavonoida.
C. Hal ini menunjukkan bahwa kristal yang diperoleh sudah murni. Hal ini juga dibuktikan dengan analisis KLT yang menunjukkan hanya satu noda tunggal pada kristal.
Dari hasil interpretasi Spektrum Infra Merah diperoleh pita serapan sebagai berikut (Gambar 2) :
1. Pada bilangan gelombang 3439,08 – 3234,62 cm-1
2. Pada bilangan gelombang 3153,61 – 3116,97 cm
puncak melebar menunjukkan vibrasi ulur -OH
-1
3. Pada bilangan gelombang 2966,52 – 2866,22 cm
puncak melebar menunjukkan adanya vibrasi ulur –CH aromatik
-1
4. Pada bilangan gelombang 1625,99 cm
puncak tajam menunjukkan adanya vibrasi ulur –CH alifatik
-1
5. Pada bilangan gelombang 1448,38 cm
puncak sedang menunjukkan adanya vibrasi ulur
ikatan rangkap C=O dari keton
-1
6. Pada bilangan gelombang 1379,10 – 1344,38 cm
puncak sedang menunjukkan adanya vibrasi ulur
ikatan rangkap dari C=C .
-1
puncak sedang menunjukkan adanya vibrasi ulur dari –CH3 dan –CH2
7. Pada bilangan gelombang 1284,59 – 1217,08 cm .
-1
8. Pada bilangan gelombang 1068,56 – 1012,63 cm
puncak sedang menunjukkan adanya vibrasi ulur C-O.
-1
9. Pada bilangan gelombang 975,98 cm-1
10. Pada bilangan gelombang 893,04 – 777,31 puncak sedang menunjukkan adanya vibrasi ulur –CH cincin aromatik.
puncak sedang menunjukkan adanya vibrasi ulur dari –C-H benzen.
Dari Hasil interpretasi Spektrum Resonansi Magnetik Inti Proton (1
1. Pergeseran kimia pada daerah δ = 3.4489 – 3,6902 ppm puncak singlet menunjukkan proton – proton O-CH
H-NMR) senyawa hasil isolasi dengan menggunakan pelarut aseton diperoleh data :
3 pada H-3 ’
dan H-4’
2. Pergeseran kimia pada daerah δ = 6,6125 – 6,6294 ppm menunjukkan proton-proton pada H-6 coupling dengan proton H-8 yang terdapat pada cincin A struktur flavonol.
(Lampiran I.2)
yang terdapat pada cincin B struktur Flavonol.
(Lampiran I.1)
3. Pergeseran kimia pada daerah δ = 7,2416 – 7,3765 ppm puncak doblet menunjukkan proton pada H-5’ yang terdapat pada cincin B struktur Flavonol.(Lampiran I.3)
4. Pergeseran kimia pada daerah δ = 7,6865 – 7,7008 ppm puncak doblet menunjukkan proton-proton coupling pada H-2’ dan H-6’ yang terdapat pada cincin B struktur flavonol.(Lampiran I.3)
5. Pergeseran kimia pada daerah δ = 11,3197 – 13,4366 ppm doblet menunjukkan adanya proton OH pada C-3 cincin C, serta C-5 dan C-7 pada cincin A.
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum UV, Spektrum Infra Merah (FT-IR) dan spektrum Resonansi Magnetik Inti Proton (1
H-NMR) bahwa kristal hasil isolasi adalah suatu senyawa flavonoida flavonol.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dari hasil uji skrining fitokimia dengan pereaksi dengan flavonoida menunjukkan bahwa daun tumbuhan pidada merah (Soneratia caseolaris L.) mengandung senyawa flavonoida. 2. Isolasi senyawa dari ekstrak metanol daun tumbuhan pidada merah (Soneratia caseolaris L.)
yang diperoleh dari fraksi n-heksana- etil asetat ( 50:50 ) v/v sebanyak 32 mg kristal murni, berbentuk jarum berwarna kuning dengan titik lebur 135-137 o
3. Dari data dan pembahasan hasil identifikasi spektrofotometri UV, Spektrofotometri FT-IR, spektrofotometri
C.
1
H-NMR menunjukkan bahwa kristal hasil isolasi dari daun tumbuhan pidada merah (Soneratia caseolaris L.) adalah senyawa flavonoida jenis flavonol.
5.2. Saran
DAFTAR PUSTAKA
Bernasconi, G. 1995. Teknologi Kimia. Jilid 2. Edisi Pertama. Jakarta: PT. Pradaya Paramita.
Cresswell, C.J., dkk. 1982. Analisis Spektrum Senyawa Organik. Edisi kedua. Bandung: Penerbit ITB.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektroskopi. Padang: Andalas University Press.
Gritter, R. J. 1991. Pengantar Kromatografi. Terbitan ke-2. Terjemahan Kosasih
Padmawinata. Bandung: Penerbit ITB.
Heyne, K. 1987. Tumbuhan Berguna Indonesia, jil. 3. Yay. Sarana Wana Jaya, Jakarta.
Harborne, J. B. 1987. Metoda Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terbitan ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB.
Kumar,S.T.dkk. Oleanic acid-an α-Glucosidase inhibitory and antihyperglycemic active compound from the friuts of Soneratia caseolaris.Open Access Journal of Medicinal and Aromatic Plants Vol 1(1):19-23
Manitto, P. 1992. Biosintesis Produk Alami. Cetakan Pertama. Terjemahan Koensoemardiyah. Semarang: Penerbit IKIP Press.
Mabry, T. J. dkk. 1970. The Systematic Identification of Flavonoids.New York: Springer Verlag
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasih Padmawinata. Bandung: ITB Press.
Muldja, M.H. 1995. Analisis Instrumental. Cetakan Pertama. Surabaya: Universitas Airlangga Press.
Noerdin, D.1985.Elusidasi Struktur Senyawa Organik dengan Cara SpektroskopiUltra Lembayung dan Inframerah. Edisi Pertama. Bandung: Penerbit Angkasa.
Pavia, L. D. 1979. Introduction to Spectroscopy a Guide for Students of Organic Chemistry. Philladelphia: Saunders College.
Santoso N, Nurcahya BC, Siregar AF, Farida I. 2005. Resep Makanan Berbahan Baku Mangrove dan Pemanfaatan Nipah
Sastrohamidjojo, H. 1985.Kromatografi . Edisi Pertama. Cetakan Pertama Yogyakarta: Penerbit Liberty.
. Jakarta: Lembaga Pengkajian dan Pengembangan Mangrove.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Yogyakarta: Penerbit Gadjah Mada University Press.
Silverstein, R. M. 1986. Penyidikan Spektrometrik Senyawa Organik. Terjemahan A. J. Hatomo dan Anny Viktor Purba. Edisi ke-4. Jakarta: Penerbit Erlangga.
Sudjadi. 1986. Metode Pemisahan. Yogyakarta: Penerbit Kanisius.
Sukmadi R. Dkk.2008. Ekologi tumbuhan pidada (Sonneratia caseolaris (L) Engler 1987) pada kawasan muara angke propinsi daerah khusus ibu kota jakarta. Jurnal KKMN
Underwood, A. L. 1981. Analisa Kimia Kuantitatif. Edisi ke-4. Jakarta: Erlangga.
LAMPIRAN C. Kromatografi Lapisan Tipis Ekstrak Pekat Lapisan Metanol Daun Tumbuhan Pidada Merah (Soneratia caseolaris L.)
I II III IV V
E E E E E
Keterangan :
Fasa diam : Kieselgel 60 F
I : Fasa gerak n-heksana : etil asetat (90:10 v/v)
254
II : Fasa gerak n-heksana : etil asetat (80:20 v/v) III : Fasa gerak n-heksana : etil asetat (70:30 v/v) IV : Fasa gerak n-heksana : etil asetat (60:40 v/v) V : Fasa gerak n-heksana : etil asetat (50:50 v/v)
No Fasa gerak Jumlah Noda Rf
LAMPIRAN D: Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Penampakan Noda FeCl3 5%
Fase gerak : n-heksana : etil asetat (50:50 v/v)
8 n-heksan : etil asetat (50:50) 1 0,4
LAMPIRAN D.1: Kromatografi Lapisan Tipis Senyawa Hasil Isolasi Penampakan Noda FeCl3 dengan
uji Kemurnian.
Fraksi 51-60
(70:30) Fraksi 51-60 (60:40)
Fraksi 51-60 (50:50)
Rf = 0,38 Rf = 0,45 Rf = 0,6
Keterangan :
Fase diam : Silika Gel 60 F
Fase gerak : n-heksana : etil asetat ( 70:30 v/v, 60:40 v/v dan 50:50 v/v )
254
Lampiran I. Spektrum 1H-NMR Senyawa Pembanding Flavonoida (Markham, 1988)
2.Spektrum NMR of TMS Ether of Robinetin in CCl4