Bahan Seminar Hasil Departemen Kimia
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
JAMBU MONYET
( Anacardium occidentale L.)
SKRIPSI
TRIA NOVITA TAMPUBOLON
070802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN JAMBU MONYET
( Anacardium occidentale L. )
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
TRIA NOVITA TAMPUBOLON
070802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI
DAUN TUMBUHAN JAMBU MONYET
(Anacardium occidentale L.)
Kategori : SKRIPSI
Nama : TRIA NOVITA TAMPUBOLON
Nomor Induk Mahasiswa : 070802029
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (MIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Mei 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Lamek Marpaung, M.Phil, Ph.D Dra Sudestry Manik, MSi
NIP. 1952 0828 1982 031001 NIP. 1953 0201 1981 032001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU
Ketua,
Dr. Rumondang Bulan Nst., MS
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN JAMBU MONYET (Anacardium occidentale L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2011
PENGHARGAAN
Segala puji serta ucapan syukur saya panjatkan pada Tuhan Yesus Kristus, karena melalui berkat dan penyertaannya skripsi ini dapat diselesaikan dalam waktu yang ditetapkan.
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam daun tumbuhan jambu monyet (Anacardium occidentale L.) dilakukan dengan ekstraksi maserasi dengan metanol. Fraksi metanol diuapkan lalu dilarutkan kembali dengan etil asetat kemudian dipekatkan dan diuapkan. Fraksi etil asetat dilarutkan dengan metanol dan diekstraksi partisi dengan n-heksana. Lapisan metanol dipisahkan dengan kolom kromatografi dengan fasa diam silika gel dan berturut-turut dengan fasa gerak campuran n-heksana : etil asetat 80:20 v/v ,
70:30 v/v, 60:40 v/v. Senyawa murni yang diperoleh dari hasil isolasi berbentuk jarum,
berwarna kuning muda, massa=510 mg, Rf=0,34, dan titik lebur=175-178oC. Kristal tersebut juga bereaksi positif terhadap pereaksi-pereaksi senyawa flavonoida. Hasil identifikasi Spektroskopi FT-IR dan 1H-NMR menunjukkan bahwa kristal merupakan senyawa golongan flavonoida.
. .
THE ISOLATION OF FLAVONOID FROM THE LEAF OF JAMBU MONYET ( Anacardium occidentale L. )
ABSTRACT
The isolation of flavonoid compound which contained in the leaf of jambu monyet ( Anacardium occidentale L. ) was done by maceration technique with methanol solvent. Methanol fraction evaporated, dissolved with ethyl acetate solvent, concentrated and evaporated. Ethyl acetate fraction was dissolved with methanol and partitioned with n-hexane solvent. Methanol layer was separated using Column Chromatography with silica gel as the stationary phase and n-hexane : ethyl acetate 80:20 v/v , 70:30 v/v, 60:40 v/v, as
DAFTAR ISI
Daftar Lampiran ix
Bab 1 Pendahuluan 1
1.6. Metodologi Penelitian 3
Bab 2 Tinjauan Pustaka 5
2.1. Tumbuhan Jambu Monyet 5
2.1.1. Morfologi Tumbuhan Jambu Monyet 6
2.1.2. Sistematika Tumbuhan Jambu Monyet 6
2.1.3. Manfaat Tumbuhan Jambu Monyet 7
2.1.4. Sifat dan Khasiat Jambu Monyet 7
2.1.5. Kandungan Kimia Jambu Monyet 8
2.1.6. Efek Farmakologis dan Hasil Penelitian 9
2.2. Senyawa Organik Bahan Alam 10
2.3. Senyawa Flavonoida 15
2.3.1. Struktur Dasar Senyawa Flavonoida 17
2.3.2. Klasifikasi Senyawa Flavonoida 18
2.3.3. Sifat Kelarutan Flavonoida 24
2.4. Teknik Pemisahan 26
2.4.1. Kromatografi 26
2.4.1.1. Kromatografi Lapis Tipis 27
2.4.1.2. Kromatografi Kolom 28
2.4.1.3. Harga Rf (Retardation Factor) 28
2.4.2. Ekstraksi 29
2.5. Teknik Spektroskopi 29
2.5.1. Spektrofotometri Ultra-Violet 30
2.5.2. Spektrofotometri Infra Merah (FT-IR) 31
2.5.3.Spektrometri Resonansi Magnetik Inti Proton
Bab 3 Bahan dan Metodologi Penelitian 34
3.1. Alat-Alat 34
3.2. Bahan 35
3.3. Prosedur Penelitian 35
3.3.1. Penyediaan Sampel 35
3.3.2. Uji Pendahuluan terhadap Ekstrak Daun Jambu Monyet 36
3.3.2.1. Skrining Fitokimia 36
3.3.2.2. Analisis Kromatografi Lapis Tipis 36
3.3.3. Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol
dari Daun Jambu Monyet (Anacardium occidentale L.) 37
3.3.4. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom 38
3.3.5. Pemurnian (Rekristalisasi) 38
3.3.6. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT) 39
3.3.7. Penentuan Titik Lebur 39
3.3.8. Identifikasi Senyawa Hasil Isolasi 39
3.3.8.1. Identifikasi dengan Spektrofotometer UV-Visible 39 3.3.8.2. Identifikasi dengan Spektrometer Resonansi Magnetik
Inti Proton(1H-NMR) 40
3.3.8.3. Identifikasi dengan Spektrofotometer
Infra Merah (FT-IR) 40
3.4. Bagan Skrining Fitokimia 41
3.5. Bagan Penelitian 42
DAFTAR PUSTAKA 49
DAFTAR LAMPIRAN
Halaman
Lampiran A. Determinasi Tumbuhan Jambu Monyet 52
(Anacardium occidentale L.)
Lampiran B. Gambar Tumbuhan Tumbuhan Jambu Monyet 53
(Anacardium occidentale L.)
Lampiran C. Kromatogram Lapisan Tipis Ekstrak Pekat Lapisan Metanol 54
Daun Jambu Monyet (Anacardium occidentale L.)
Lampiran D. Spektrum UV-Visible Senyawa Hasil Isolasi 55
Lampiran E. Spektrum FT-IR Senyawa Hasil Isolasi 56
Lampiran F. Spektrum 1H-NMR Senyawa Hasil Isolasi 57
Lampiran G. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi 58
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam daun tumbuhan jambu monyet (Anacardium occidentale L.) dilakukan dengan ekstraksi maserasi dengan metanol. Fraksi metanol diuapkan lalu dilarutkan kembali dengan etil asetat kemudian dipekatkan dan diuapkan. Fraksi etil asetat dilarutkan dengan metanol dan diekstraksi partisi dengan n-heksana. Lapisan metanol dipisahkan dengan kolom kromatografi dengan fasa diam silika gel dan berturut-turut dengan fasa gerak campuran n-heksana : etil asetat 80:20 v/v ,
70:30 v/v, 60:40 v/v. Senyawa murni yang diperoleh dari hasil isolasi berbentuk jarum,
berwarna kuning muda, massa=510 mg, Rf=0,34, dan titik lebur=175-178oC. Kristal tersebut juga bereaksi positif terhadap pereaksi-pereaksi senyawa flavonoida. Hasil identifikasi Spektroskopi FT-IR dan 1H-NMR menunjukkan bahwa kristal merupakan senyawa golongan flavonoida.
. .
THE ISOLATION OF FLAVONOID FROM THE LEAF OF JAMBU MONYET ( Anacardium occidentale L. )
ABSTRACT
The isolation of flavonoid compound which contained in the leaf of jambu monyet ( Anacardium occidentale L. ) was done by maceration technique with methanol solvent. Methanol fraction evaporated, dissolved with ethyl acetate solvent, concentrated and evaporated. Ethyl acetate fraction was dissolved with methanol and partitioned with n-hexane solvent. Methanol layer was separated using Column Chromatography with silica gel as the stationary phase and n-hexane : ethyl acetate 80:20 v/v , 70:30 v/v, 60:40 v/v, as
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Flavonoida merupakan salah satu golongan fenol alam yang terbesar. Menurut perkiraan,
kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi
flavonoida atau senyawa yang berkaitan erat dengannya. (Markham, 1988). Flavonoida
adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan
dengan tiga satuan karbon. (Sastrohamidjojo, 1996). Flavonoida yang terdapat di dalam
tumbuhan dapat digunakan sebagai pelindung tubuh manusia dari radikal bebas dan
dapat mengurangi resiko penyakit kanker dan peradangan. (Nessa, 2003). Salah satu
contoh flavonoida adalah antosianin yang berperan dalam pewarnaan bunga-bunga (biru,
ungu dan merah). (Manitto, 1992).
Salah satu tumbuhan yang sering digunakan sebagai sumber obat adalah
tumbuhan jambu monyet
(
Anacardium occidentale L.). Bagian yang digunakan sebagaiobat adalah daun, kulit kayu, biji, minyak biji, kulit biji. Banyak masyarakat Indonesia
yang telah mengembangbiakkan tumbuhan ini sebagai obat. Keseluruhan tanaman ini
dapat digunakan sebagai sumber bahan obat-obatan tradisional. Daun tumbuhan jambu
monyet berkhasiat sebagai obat tekanan darah tinggi (hipertensi), kencing manis
(diabetes mellitus, malaria, rematik, sarawan, ruam kulit. (Dalimartha, 2000). Dari
penelitian terdahulu diketahui bahwa pernah diisolasi senyawa steroida/triterpenoida,
tannin, saponin, kuinon dari daun tumbuhan jambu monyet
Selain itu peneliti terdahulu juga menemukan bahwa ekstrak daun jambu monyet
dapat menekan penyerapan glukosa pada usus, dan bertindak sebagai antioksidan yang
diteliti oleh Mary Khoo Gaik Hong (2004). Selain itu penelitian lain menunjukkan
ekstrak metanol buah jambu monyet mengandung antosianin, 13 glikosida flavonol,
yaitu, galaktosida, glukosida, xylopiranosida, arabinopiranosida,
3-O-arabinofuranosida dan 3-O-ramnosida dari myricetin dan quercetin, penelitian ini
dilakukan oleh Edy Sousa de Brito (2007). Infus daun jambu monyet juga dapat
memperlihatkan efek antiinflamasi yang diteliti oleh Yanti Mariana (1993). Infus daun
jambu monyet ini juga diketahui memiliki pengaruh analgesik yang sama kuat dengan
parasetamol yang diteliti oleh Dewi F (1992).
Oleh karena itu, peneliti tertarik melakukan penelitian terhadap daun tumbuhan
jambu monyet tersebut, khususnya mengenai senyawa flavonoida yang terkandung di
dalamnya. Metode yang digunakan adalah dengan mengekstraksi daun tumbuhan dengan
metanol, kemudian dilakukan analisa KLT dan kolom kromatografi. Selanjutnya
komponen atau senyawa murni yang diperoleh ditentukan strukturnya berdasarkan hasil
analisis Spektrofotometri Infra Merah (FT-IR), Spektrometri Resonansi Magnetik Inti
Proton (1H-NMR), Spektrofotometri UV-Visible, dan penentuan titik lebur.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa
flavonoida yang terdapat dalam daun tumbuhan jambu monyet
(
A. occidentale L.).1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dari daun
1.4 Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan sumber informasi ilmiah pada
bidang kimia bahan alam hayati dan farmasi dalam pengembangan ilmu kimia flavonoida
di dalam daun tumbuhan jambu monyet
(
A. occidentale L.).1.5 Lokasi Penelitian
1. Lokasi Pengambilan Sampel
Sampel yang digunakan diperoleh dari jalan Pasar 4 ujung, Desa Sempali. Kelurahan
Sempali. Kecamatan Percut Sei Tuan.
2. Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Bahan Alam FMIPA, Universitas Sumatera
Utara.
3. Lokasi Identifikasi Kristal Hasil Iisolasi
Analisis Spektrofotometri Inframerah (FT-IR), Spektrofotometri UV-Visible, dan
Spektrometri Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di Pusat Penelitian
Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang.
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun jambu monyet
(
A. occidentale L.) berupa serbuk halus yang kering 1000 gram. Tahap awal dilakukanuji skrining fitokimia untuk senyawa flavonoida, yaitu dengan menggunakan pereaksi
FeCl3 5%, NaOH 10%, Mg-HCl dan H2SO4(p).
1. Ekstraksi Maserasi
2. Ekstraksi Partisi
3. Analisis Kromatografi Lapis Tipis
4. Analisis Kromatografi Kolom
5. Rekristalisasi
6. Analisis Kristal Hasil Isolasi
Analisis kristal hasil isolasi meliputi:
1. Analisis Kromatografi Lapis Tipis
2. Pengukuran Titik Lebur
3. Identifikasi dengan menggunakan Spektrofotometer Infra Merah
(FT-IR), Spektrofotometer UV-Visible, dan Spektrometer Resonansi
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Jambu Monyet
Jambu monyet berasal dari Brazil, tersebar di daerah tropik dan ditemukan pada
ketinggian antara 1-1.200 m dpl. Jambu monyet akan berbuah lebih baik di daerah
beriklim kering dengan curah hujan kurang dari 500 mm per tahun. Tanaman ini dapat
tumbuh di segala macam tanah, asalkan jangan di tanah lempung yang pekat dan
tergenang air.
Pohon, tinggi 8-12 m, memiliki cabang dan ranting yang banyak. Batang
melengkung, berkayu, bergetah, percabangan mulai dari bagian pangkalnya. Daun
tunggal, bertangkai, panjang 4-22,5 cm, lebar 2,5 -15 cm. Helaian daun berbentuk bulat
telur sungsang, tepi rata, pangkal runcing, ujung membulat dengan lekukan kecil di
bagian tengah, pertulangan menyirip, berwarna hijau. Bunga berumah satu memiliki
bunga betina dan bunga jantan, tersusun bentuk malai, keluar di ketiak daun atau di ujung
percabangan. Buahnya batu, keras, melengkung. Tangkai buahnya lama kelamaan akan
menggelembung menjadi buah semu yang lunak, seperti buah peer, berwarna kuning,
kadang-kadang bernoda merah, rasanya manis agak sepat, banyak mengandung air, dan
berserat. Biji bulat panjang, melengkung, pipih, warnanya cokelat tua.
Kayunya dapat dijadikan bahan bangunan, peralatan rumah tangga, dan kerajinan
tangan. Kulit kayu digunakan pada industri batik atau untuk bahan penyamak. Daun muda
bisa dimakan sebagai lalap (mentah atau dikukus terlebih dahulu). Buah semu rasanya
sepat dan bisa dimakan rujak, dibuat minuman, anggur atau selai. Jika sudah diolah, harga
cashew nut shell liquid (CNSL). Jika cairan tersebut mengenai mulut dapat menimbulkan
peradangan. Setelah diolah, CNSL dapt digunakan untuk bahan pelumas, insektida,
pernis, plastik, dan lain-lain. Jambu monyet dapat diperbanyak dengan biji, cangkokan,
enten, atau okulasi.
2.1.1 Morfologi Tumbuhan Jambu Monyet
Jambu monyet termasuk jenis dikotil atau tumbuhan yang berdaun lembaga dua. Jambu
monyet termasuk tumbuhan yang berkeping biji dua atau juga disebut tumbuhan berbiji
belah. Jambu monyet mempunyai batang pohon yang tidak rata dan berwarna cokelat tua.
Daunnya bertangkai pendek dan berbentuk lonjong (bulat telur) dengan tepian
berlekuk-lekuk, dan guratan rangka daunnya terlihat jelas. Bunganya berwarna putih. Bagian
buahnya yang membesar, berdaging lunak, berair, dan berwarna kuning
kemerah-merahan adalah buah semu.
Bagian itu bukan buah sebenarnya, tetapi merupakan tangkai buah yang
membesar. Buah jambu monyet yang sebenarnya biasa disebut mete (mente), yaitu buah
batu yang berbentuk ginjal dengan kulit keras dan bijinya yang berkeping dua yang
mengandung getah. (Yuniarti,2008).
2.1.2 Sistematika Tumbuhan Jambu Monyet
Sistematika tumbuhan jambu monyet adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Anacardiales
Famili : Anacardiaceae
Spesies : Anacardium occidentale L.
Nama umum tumbuhan adalah jambu monyet. Tumbuhan ini dikenal masyarakat
Indonesia dengan nama daerah yaitu: jambu erang, jambu monyet, gaju (Sumatera),
jambu mede, jambu mete (Jawa), jambu jipang, jambu dwipa (Nusa Tenggara), jambu
parang, jambu sepal, jambu gayus, jambu seran, janggus, gayus (Kalimantan), jambu
dare, jambu sereng (Sulawesi), kanoke, masapana,buwa yakis, buwa jaki (Maluku).
(Dalimartha, 2000).
2.1.3 Manfaat Tumbuhan Jambu Monyet
(A. occidentale L.)
Kayunya dapat dijadikan bahan bangunan, peralatan rumah tangga, dan kerajinan tangan.
Kulit kayunya digunakan pada industri batik atau untuk bahan penyamak. Daun muda
bisa dimakan sebagai lalap (mentah atau dikukus terlebih dahulu). Buah semu rasanya
sepat bisa dimakan sebagai rujak, dibuat minuman, anggur atau selai. Jika sudah diolah
harga biji jambu monyet cukup mahal, dikenal dengan nama kacang mete. Kulit bijinya
mengandung cashew nut shell liquid (CNSL). Jika cairan tersebut mengenai mulut dapat
menimbulkan peradangan. Setelah diolah, CNSL dapat digunakan untuk bahan pelumas,
insektisida, pernis, plastik, dan lain-lain. Jambu monyet dapat diperbanyak dengan biji,
cangkokan, enten, atau okulasi.
2.1.4 Sifat dan Khasiat Jambu Monyet
Kulit kayu berbau lemah, rasanya kelat, dan lama-kelamaan menimbulkan rasa tebal di
lidah. Khasiatnya sebagai pencahar, astringen, dan memacu aktivitas enzim pencernaan.
Daun berbau aromatik, rasanya kelat, berkhasiat antiradang dan penurun kadar
(analgesik). Tangkai daun berfungsi sebagai pengelat dan akar berkhasiat sebagai
pencahar (laksatif).
Penyakit-penyakit yang dapat diobati antara lain :
a. diabetes insipidus (sering buang air kecil)
b. diabetes mellitus (kencing manis)
c. sembelit
d. sariawan
e. jerawat
f. radang mulut rahim (servikitis)
g. radang gusi, sakit gigi
h. gigitan ular berbisa
i. ruam kulit, borok, psoriasis
j. keracunan makanan
k. kanker kulit
l. tekanan darah tinggi (hipertensi)
m. malaria
n. rematik
(Dalimartha, 2000).
2.1.5 Kandungan Kimia Jambu Monyet
Kulit kayu mengandung tanin yang cukup banyak, zat samak, asam galat, dan gingkol
katekin. Daun mengandung tanin-galat, flavonol, asam anakardiol, asam elagat, senyawa
fenol, kardol, dan metil kardol. Buah mengandung protein, lemak, vitamin (A,B dan C),
kalsium, fosfor, besi, dan belerang. Pericarp mengandung zat samak, asam anakardat, dan
asam elagat. Biji mengandung 40-45% minyak dan 21% protein. Minyaknya mengandung
asam oleat, asam linoleat, dan vitamin E. Getah mengandung furufural. Asam anakardat
Selain itu daun jambu monyet yang masih mudamempunyai komposisi kandungan
kimia seperti vitamin A sebesar 2.689 SI per 100 gram, vitamin C sebesar 65 gram per
100 gram, kalori 73 gram per 100 gram, protein 4,6 gram per 100 gram, lemak 0,5 gram
per 100 gram, hidrat arang sebesar 16,3 gram per 100 gram, kalsium 33 miligram per 100
gram, fosfor 64 miligram per 100 gram, besi 8,9 gram per 100 gram, dan air 78 gram per
100 gram. (Yuniarti, 2008).
2.1.6 Efek Farmakologis dan Hasil Penelitian
1. Ekstrak alkohol daun jambu monyet menunjukkan :
a. Efek hipoglemik pada tikus albino
b. Keaktifan antikanker terhadap hepatoma pada mencit (vademikum bahan obat
alam)
2. Infusum 10% daun jambu monyet menunjukkan :
a. Efek seperti yang ditimbulkan oleh morfin dan fenotiazin pada tikus albino.
b. Efek perpanjangan waktu reaksi pada mencit. Efek ini timbul pada dosis 30
ml/kg bb. Kemungkinan besar, keadaan ini diakibatkan oleh zat aktif yang
berkhasiat analgetik seperti morfin atau metamizol.
3. Secara spesifik infus daun jambu monyet dengan takaran 50 cc/kg bb yang
diberikan secara intra peritoneal pada tikus putih dapat menghambat conditional
avoidance escape response pada 87% binatang percobaan. Di lain pihak tikus
kontrol yang diberi garam faal tidak menghalangi hambatan.
4. Infus daun jambu monyet dengan dosis 6 dan 12 g/kg bb tidak menunjukkan
adanya efek antiinflamasi yang nyata, tetapi memperlihatkan penghambatan
terhadap udem yang ditimbulkan oleh pemberian karagenin pada telapak kaki
tikus putih, Infus dengan dosis 14g/kg bb memperlihatkan efek antiinflamasi yang
nyata (p<0,05), pada jam kedua setelah pemberian karagenin. Persentase
penghambatan udem daun jambu monyet (26,86%) jauh lebih kecil dibandingkan
5. Infus daun jambu monyet muda mempunyai pengaruh analgesik yang sama kuat
dengan parasetamol pada kasus periodontitis akut. Efek samping berupa mual dan
pusing. (Dalimartha, 2000)
2.2 Senyawa Organik Bahan Alam
Kimia organik mengalami kemajuan yang sejajar dengan kemajuan cara pemisahan dan
penelitian bahan alam. Karena sangat beranekaragam, molekul yang berasal dari makhluk
hidup mempunyai arti yang sangat penting bagi para ahli kimia organik, yaitu untuk
memperluas dan memperdalam pengetahuan tentang reaksi-reaksi organik, dan terutama
dapat untuk menguji hipotesis-hipotesis tertentu, misalnya hipotesis tentang mekanisme
reaksi. Pada mulanya, biogenesis dari produk alami berkaitan dengan kimia organik dan
biokimia, tetapi mempunyai tujuan yang berlainan. (Manitto, 1992).
Senyawa organik bahan alam dapat diklasifikasikan berdasarkan sifat-sifat kimia
yang dimilikinya. Ada empat cara klasifikasi yang diusulkan, yaitu:
1. Klasifikasi Berdasarkan Struktur Kimiawi
Klasifikasi ini berdasarkan pada kerangka molekuler dari senyawa yang bersangkutan.
Menurut sistem ini, ada 4 kelas yaitu:
a. Senyawa alifatik rantai terbuka atau lemak dan minyak.
Contoh: asam-asam lemak, gula, dan asam-asam amino pada umumnya
b. Senyawa alisiklik atau sikloalifatik
Contoh: terpenoida, steroida, dan beberapa alkaloida
c. Senyawa aromatik atau benzenoid
Contohnya: golongan fenolat dan golongan kuinon
d. Senyawa heterosiklik
Contoh: alkaloida, flavonoida, golongan basa asam inti
Karena klasifikasi ini hanyalah superfisial, maka tidak mengherankan jika suatu
Contohnya: geraniol, farsenol, dan skualen, termasuk kelas senyawa alifatik rantai
terbuka, timol termasuk senyawa aromatik. Namun, keempat senyawa tersebut
merupakan anggota dari kelas terpenoida dan steroida.
OH
2. Klasifikasi Berdasarkan Sifat Fisiologik
Setelah penelitian yang lebih mendalam dilakukan terhadap morfin (1806), penisilin
(1939) dan prostaglandin (1963), maka perhatian para ahli sering ditujukan kepada isolasi
dan penentuan fungsi fisiologis dari senyawa organik bahan alam tertentu. Hampir
separoh dari obat-obatan yang digunakan sehari-hari merupakan bahan alam, misalnya
alkaloida dan antibiotik, atau golongan-golongan sintetik. Oleh karena itu, senyawa
organik bahan alam dapat juga diklasifikasikan segi aktivitas fisiologik dari bahan yang
bersangkutan. Misalnya kelas hormon, vitamin, antibiotik dan mikotoksin.
Meskipun asal usul biogenetik sangat bervariasi, namun ada kalanya terdapat
korelasi yang dekat antara aspek tersebut dengan kegiatannya. Misalnya, meskipun
struktur sangat bervariasi, namun senyawa-senyawa yang menunjukkan aktivitas
kardiotik (kardenolid dan bufadienolid) hanyalah struktur yang memiliki komposisi
sebagai berikut: (a) cincin A/B terpadu secara cis, (b) memiliki residu berupa gula pada
C3 dan (c) memiliki lakton suku -5 atau -6 yang terkonjugasi pada C17, lihat struktur (1)
dan (2) di bawah ini.
3. Klasifikasi Berdasarkan Taksonomi
Pengklasifikasian ini didasarkan pada penyelidikan morfologi komparatif dari
tumbuh-tumbuhan yaitu taksonomi tumbuh-tumbuhan. Pada hewan dan sebagian mikroorganisme,
metabolit terakhir bisanya dibuang ke luar tubuh, sedangkan pada tumbuh-tumbuhan,
metabolit tersimpan dalam tumbuhan itu sendiri. Pada mulanya, beberapa metabolit
dianggap hanya berasal dari tumbuh-tumbuhan tertentu. Kemudian diketahui bahwa
beberapa metabolit tersebar pada berbagai tumbuhan dan ternyata bahwa banyak
konstituen tumbuhan (seperti alkaloida dan terpenoida) yang dapat diisolasi dari spesies,
genera, suku atau family tumbuhan tertentu. Dalam satu spesies tunggal, dapat ditemukan
sejumlah konstituen yang strukturnya berhubungan erat satu sama lain. Misalnya,
“opium” dari Papaver somniferum mengandung dua puluhan alkaloida, termasuk morfin,
tebain, kodein dan narkotin, yang kesemuanya dibiosintesis dari precursor
alkaloida-alkaloida tersebut yang strukturnya mirip satu sama lain dan berasal dari genus
tumbuhan tertentu, disebut alkaloida opium.
O
4. Klasifikasi Berdasarkan Biogenesis
Semua konstituen tumbuhan dan binatang dibiosintesis dalam organisme melalui
reaksi-reaksi yang dibantu oleh enzim tertentu. (istilah “biosintesis” dan “biogenesis”
mempunyai arti yang sama: pembentukan bahan alam oleh organisme hidup.
“Biosintesis” mengacu kepada perolehan data eksperimental dalam membuktikan jalur
sintesis yang berlangsung, sedangkan “biogenesis” masih bersifat hipotetik dan lebih
menekankan aspek spekulatif dari fakta).
Setelah pengetahuan tentang kimia organik bahan alam semakin berkembang
senyawa organik bahan alam yang berlangsung dalam organisme hidup. “Aturan isopren”
yang diusulkan oleh Ruzicka menyatakan bahwa semua senyawa terpenoida terbentuk
dari “unit isopren” C5.
“Teori poliketometilen” diusulkan oleh Robinson menyatakan bahwa senyawa
golongan fenolat terbentuk melalui biosintesis asetogenin (poliketida).
Teori lain dengan nama “jalur asam sikimat” diusulkan oleh Davis, yang
menyatakan bahwa biosintesis dari asam-asam amino aromatik dan senyawa aromatik
yang bertalian. Robinson juga menemukan hubungan di antara alkaloida dengan asam
amino prekursornya.
Dari semua teori biogenesis itu dapat disimpulkan adanya 4 kelas senyawa
organik bahan alam, yakni:
a. Poliketida (asetogenin)
b. Fenolat (fenilpropanoida)
c. Isoprenoida
d. Alkaloida (Tobing, 1989)
2.3 Senyawa Flavonoida
Senyawa-senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15
atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai
linier yang terdiri dari tiga atom karbon. Senyawa-senyawa flavonoida adalah senyawa
1,3 diaril propana, senyawa isoflavonoida adalah senyawa 1,2 diaril propana, sedangkan
senyawa-senyawa neoflavonoida adalah 1,1 diaril propana.
Istilah flavonoida diberikan pada suatu golongan besar senyawa yang berasal dari
kelompok senyawa yang paling umum, yaitu senyawa flavon, suatu jembatan oksigen
terdapat diantara cincin A dalam kedudukan orto, dan atom karbon benzil yang terletak
disebelah cincin B. Senyawa heterosoklik ini, pada tingkat oksidasi yang
berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai
cincin C dengan tingkat oksidasi paling rendah dan dianggap sebagai struktur induk
dalam nomenklatur kelompok senyawa-senyawa ini. (Manitto, 1981).
Sekitar 2% dari seluruh karbon yang difotosintesis oleh tumbuhan (atau kira-kira
Sebagian besar tanin pun berasal dari flavonoida. Jadi flavonoida merupakan salah satu
golongan fenol alam yang terbesar.
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk
daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini
berada di dalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoida yng
terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah.
Dalam sayap kupu - kupu dengan anggapan bahwa flavonoida berasal dari
tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh
mereka. Penyebaran jenis flavonoida pada golongan tumbuhan yang tersebar yaitu
angiospermae, klorofita, fungi, briofita. (Markham, 1988).
Flavonoida merupakan senyawa 15-karbon yang umumnya tersebar di seluruh
dunia tumbuhan. Lebih dari 2000 flavonoid yang berasal dari tumbuhan telah
diidentifikasi. Kerangka dasar flavonoida biasanya diubah sedemikian rupa sehingga
terdapat lebih banyak ikatan rangkap, menyebabkan senyawa itu menyerap cahaya
tampak, dan ini membuatnya berwarna.
Ada tiga kelompok flavonoida yang amat menarik perhatian dalam fisiologi
tumbuhan, yaitu antosianin, flavonol, dan flavon. Antosianin (dari bahasa Yunani anthos,
bunga dan kyanos, biru-tua) adalah pigmen berwarna yang umunya terdapat di bunga
berwarna merah, ungu, dan biru. Pigmen ini juga terdapat di berbagai bagian tumbuhan
lain, misalnya buah tertentu, batang, daun, dan bahkan akar. Sering flavonoida terikat di
sel epidermis. Warna sebagian besar buah dan banyak bunga adalah akibat dari
antosianin, walaupun beberapa warna tumbuhan lainnya, seperti buah tomat dan beberapa
bunga kuning, karena karotenoid. Warna cerah daun musim gugur disebabkan terutama
oleh timbunan antosianin pada hari cerah dan dingin, walaupun karotenoid kuning atau
jingga merupakan pigmen terbesar di daun musim gugur pada beberapa spesies.
Antosianin umumnya tidak terdapat di lumut hati, ganggang, dan tumbuhan
tertentu. Antosianin jarang ditemui di gimnospermae, walaupun gimnospermae
mengandung jenis lain dari flavonoida. Beberapa macam antosianin terdapat di tumbuhan
tingkat tinggi, dan sering lebih dari satu macam terdapat di bunga tertentu atau organ lain.
Mereka dijumpai dalam bentuk glikosida, biasanya mengandung satu atau dua unit
glukosa atau galaktosa yang tertempel pada gugus hidroksil di cincin tengah, atau pada
gugus hidroksil di posisi 5 cincin A. Bila gula dihilangkan, maka bagian sisa molekul,
yang masih berwarna, dinamakan antosianidin. (Salisbury, 1995).
2.3.1 Struktur Dasar Senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat
yang dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat
digambarkan sebagai berikut :
C C C
A B
Kerangka dasar senyawa flavonoida
Cincin A adalah karakteristik phloroglusinol atau bentuk resorsinol tersubstitusi.
O Namun sering terhidroksilasi lebih lanjut :
O
C3
2.3.2 Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita
serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak,
umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida. (Harborne,
1996).
1. Flavonoida O-glikosida, satu gugus hidroksil flavonoida (atau lebih) terikat pada
satu gula (lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh
glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut
dalam air. Glukosa merupakan gula yang paling umum terlibat dan gula lain yang
sering juga terdapat adalah galaktosa, ramnosa, xilosa, dan arabinosa. Gula lain
yang kadang-kadang ditemukan adalah alosa, manosa, fruktosa, apiosa, dan asam
glukoronat serta galakturonat.
2. Flavonoida C-glikosida, gula terikat pada atom karbon flavonoida dan dalam hal
ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan
karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Jenis gula
yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glukosa,
biasanya dari jenis glukosa yang paling umum, dan juga galaktosa, ramnosa,
xilosa, dan arabinosa.
3. Flavonoida sulfat, senyawa ini mengandung satu ion sulfat, atau lebih, yang
terdapat sebagai garam, yaitu flavon-O-SO3K. Banyak yang berupa glikosida
bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja yang masih
bebas atau pada gula.
4. Biflavonoida, yaitu flavonoida dimer. Flavonoida yang biasanya terlibat adalah
flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang
sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan-ikatan karbon atau
kadang-kadang eter. Monomer flavonoida yang digabungkan menjadi
biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda.
Biflavonoida jarang ditemukan sebagai glikosida, dan penyebarannya terbatas,
terdapat terutama pada gimnospermae.
5. Aglikon flavonoida yang aktif-optik, sejumlah aglikon flavonoida mempunyai
atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu
memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoida
ini adalah flavanon, dihidroflavonol, katekin, rotenoid, dan lain-lain. (Markham,
1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan
keragaman pada rantai C3 yaitu :
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon
flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai
antioksidan dan antiimflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan
merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana basa
dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada
O O
OH
flavonol
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi.
Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon
terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol.
Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat
warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida
dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon-karbon. Contohnya
luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok
senyawa flavonoida.
O O
flavon
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai
fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan
terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan
pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein) memberikan warna
biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan yang lain
O O
isoflavon
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga.
Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah
jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam
buah anggur dan jeruk.
O O
flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika
dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena
konsentrasinya rendah dan tidak berwarna.
O O OH
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu.
Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir
dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat
sebagai antioksidan.
O HO
OH OH
OH OH
katekin
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna, terutama terdapat pada tumbuhan
berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
O
OH
HO OH
Leukoantosianidin
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam
tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah penyebab hampir
semua warna merah jambu, merah marak , ungu, dan biru dalam daun, bunga, dan buah
pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur
aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan
O
OH
Antosianin
9.Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila
dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya, karena hanya
pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam
pengembang air. (Harborne, 1996).
O kalkon
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita.
Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas
berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah
jingga bila diberi uap amonia. (Robinson, 1995).
HC
O
O
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua
flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan
semuanya mempunyai sejumlah sifat yang sama yakni:
Golongan
flavonoida
Penyebaran Ciri khas
Antosianin
Proantosianidin
Flavonol
Flavon
Glikoflavon
pigmen bunga merah
marak,dan biru juga dalam
daun dan jaringan lain.
terutama tan warna, dalam
daun tumbuhan berkayu.
terutama ko-pigmen
tanwarna dalam bunga
sianik dan asianik;
tersebar luas dalam daun.
seperti flavonol
seperti flavonol
larut dalam air, λmaks 515-545 nm,
bergerak dengan BAA pada kertas.
menghasilkan antosianidin bila
jaringan dipanaskan dalam HCl 2M
selama setengah jam.
setelah hidrolisis, berupa bercak
kuning murup pada kromatogram
Forestal bila disinari sinar UV;
maksimal spektrum pada 330 – 350
setelah hidrolisis, berupa bercak
coklat redup pada kromatogram
Forestal; maksimal spektrum pada
Biflavonil
juga dalam jaringan lain
tanwarna; dalam daun dan
buah( terutama dalam
Citrus )
tanwarna; sering kali
dalam akar; hanya
terdapat dalam satu suku,
Leguminosae
mengandung gula yang terikat
melalui ikatan C-C; bergerak dengan
pengembang air, tidak seperti flavon
biasa.
pada kromatogram BAA beupa
bercak redup dengan RF tinggi .
dengan amonia berwarna merah,
maksimal spektrum 370-410 nm.
berwarna merah kuat dengan
Mg/HCl; kadang – kadang sangat
pahit .
bergerak pada kertas dengan
pengembang air; tak ada uji warna
yang khas.
2.3.3 Sifat Kelarutan Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa
fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila
dibiarkan dalam larutan basa, dan disamping itu terdapat oksigen, banyak yang akan
terurai. Karena mempunyai sejumlah gugus hidroksil, atau suatu gula, flavonoida
merupakan senyawa polar, maka umumnya flavonoida cukup larut dalam pelarut polar
seperti etanol (EtOH), metanol (MeOH), butanol (BuOH), aseton, dimetilsulfoksida
(DMSO), dimetilformamida (DMF), air dan lain-lain. Adanya gula yang terikat pada
flavonoida (bentuk yang umum ditemukan) cenderung menyebabkan flavonoida lebih
air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang
polar seperti isoflavon, flavanon dan flavon serta flavonol yang termetoksilasi cenderung
lebih mudah larut dalam pelarut seperti eter dan kloroform.
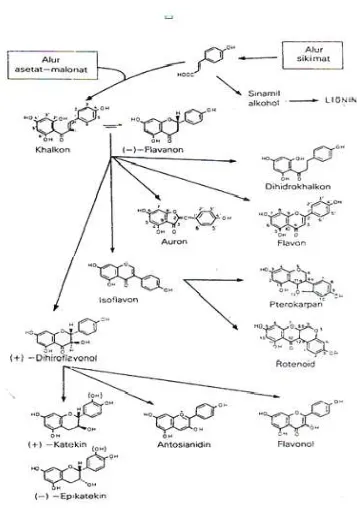
Biosintesis hubungan antara jenis monomer flavonoida dari alur asetat-malonat
dan alur sikimat (Markham, 1988).
2.4 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan ditentukan
berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada
2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan
dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk
dalam suatu golongan. (Muldja, 1995).
2.4.1 Kromatografi
Kromatografi merupakan suatu cara pemisahan fisik dengan unsur-unsur yang akan
dipisahkan terdistribusikan antara dua fasa, satu dari fasa-fasa ini membentuk lapisan
stasioner denagn luas permukaan yang besar dan yang lainnya merupakan cairan yang
merembes lewat. Fasa stasioner mungkin suatu zat padat atau suatu cairan dan fasa yang
bergerak mungkin suatu cairan atau suatu gas. (Underwood, 1981).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat – sifat dari fasa
diam, yang dapat berupa zat padat atau zat cair. Jika fasa diam berupa zat padat disebut
kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fasa gerak
dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi yaitu:
1) Fasa gerak cair–fasa diam padat (kromatografi serapan):
a.kromatografi lapis tipis
b.kromatografi penukar ion
2) Fasa gerak gas–fasa diam padat, yakni kromatografi gas padat
3) Fasa gerak cair–fasa diam cair (kromatografi partisi), yakni kromatografi kertas.
a. kromatografi gas–cair
b. kromatografi kolom kapiler
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa –
senyawa yang dipisahkan terdistribusi diantara fasa gerak dan fasa diam dalam
perbandingan yang sangat berbeda – beda dari satu senyawa terhadap senyawa yang lain
(Sastrohamidjojo, 1991).
2.4.1.1 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis pada plat berlapis yang berukuran lebih besar, biasanya 5x20
cm, 10x20 cm, atau 20x20 cm. Biasanya memerlukan waktu pengembangan 30 menit
sampai satu jam. Pada hakikatnya KLT melibatkan dua fase yaitu fase diam atau sifat
lapisan, dan fase gerak atau campuran pelarut pengembang. Fase diam dapat berupa
serbuk halus yang berfungsi sebagai permukaan penyerap atau penyangga untuk lapisan
zat cair. Fase gerak dapat berupa hampir segala macam pelarut atau campuran pelarut.
(Sudjadi, 1986).
Pemisahan senyawa dengan Kromatografi Lapis Tipis seperti senyawa organik
alam dan senyawa organik sintetik dapat dilakukan dalam beberapa menit dengan alat
yang harganya tidak terlalu mahal. Jumlah cuplikan beberapa mikrogram atau sebanyak 5
g dapat ditangani. Kelebihan KLT yang lain ialah pemakaian jumlah pelarut dan jumlah
cuplikan yang sedikit. Kromatografi Lapis Tipis (KLT) merupakan salah satu metode
pemisahan yang cukup sederhana yaitu dengan menggunakan plat kaca yang dilapisi
silika gel dengan menggunakan pelarut tertentu. (Gritter,1991).
Nilai utama Kromatografi Lapis Tipis pada penelitian senyawa flavonoida ialah
sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Menurut Markham,
Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
3. Identifikasi flavonoida secara ko-kromatografi.
4. Isolasi flavonoida murni skala kecil
5. Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap
dan pengembang pada kromatografi kolom dan kromatografi kertas. (Markham,
1988).
2.4.1.2 Kromatografi Kolom
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode kromatografi
terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada kromatografi kolom,
campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap
yang berada dalam tabung kaca, tabung logam, dan tabung plastik. Pelarut atau fasa gerak
dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau
didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang
berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter,
1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan hampir
ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoida
(berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulose, silika atau
poliamida), dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang
cocok. Kolom hanya berupa tabung kaca yang dilengkapi dengan keran pada salah satu
ujung. (Markham, 1988).
2.4.1.3 Harga Rf (Reterdation Factor)
Mengidentifikasi noda-noda dalam lapisan tipis lazim menggunakan harga Rf yang
diidentifikasikan sebagai perbandingan antara jarak perambatan suatu zat dengan jarak
oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk mengidentifikasi
suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf
senyawa pembanding.
Jarak perambatan bercak dari titik penotolan
Rf =
Jarak perambatan pelarut dari titik penotolan (Sastrohamidjojo, 1991).
2.4.2 Ekstraksi
Ekstraksi dapat dilakukan dengan metoda maserasi, sokletasi, dan perkolasi. Sebelum
ekstraksi dilakukan, biasanya serbuk tumbuhan dikeringkan lalu dihaluskan dengan
derajat kehalusan tertentu, kemudian diekstraksi dengan salah satu cara di atas. Ekstraksi
dengan metoda sokletasi dapat dilakukan secara bertingkat dengan berbagai pelarut
berdasarkan kepolarannya, misalnya n-heksana, eter, benzena, kloroform, etil asetat,
etanol, metanol, dan air.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak yang pekat
biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator. (Harborne,
1996).
2.5 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia–fisika yang mengamati
tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam
instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen
spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat
fotoelektrik maka disebut spektrofotometer (Muldja, 1955).
Informasi Spektroskopi Inframerah menunjukkan tipe – tipe dari adanya gugus
fungsi dalam satu molekul dan Resonansi Magnetik Inti yang memberikan informasi
tentang bilangan dari setiap tipe dari atom hidrogen dan juga memberikan informasi yang
menyatakan tentang lingkungan dari setiap tipe dari atom hidrogen. Kombinasinya dan
data yang ada kadang – kadang menentukan struktur yang lengkap dari molekul yang
tidak diketahui. (Pavia, 1979).
2.5.1 Spektrofotometri Ultra Violet
Serapan molekul di dalam derah ultra violet dan terlihat dari spektrum bergantung pada
struktur ultra elektronik dari molekul. Penyerapan sejumlah energi, menghasilkan
percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi
di dalam keadaan tereskitasi (Silverstein, 1986).
Spektrum Flavonoida biasanya ditentukan dalam larutan dengan pelarut Metanol
(MeOH) atau Etanol (EtOH). Spektrum khas terdiri atas dua maksima pada rentang
240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan kekuatan nisbi
maksima tersebut memberikan informasi yang berharga mengenai sifat flavonoida dan
pola oksigenasinya. Ciri khas spektrum tersebut ialah kekuatan nisbi yang rendah pada
pita I dalam dihidroflavon, dihidroflavonol, dan isoflavon serta kedudukan pita I pada
spektrum khalkon, auron dan antosianin yang terdapat pada panjang gelombang yang
tinggi.
Ciri spektrum golongan flavonoida utama dapat ditunjukkan sebagai berikut :
λ maksimum
utama (nm)
λ maksimum tambahan
(nm) (dengan intensitas
nisbi)
2.5.2 Spektrofotometri Infra Merah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran
yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm -1 (panjang
gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah
menjadi putaran energi molekul.
Penyerapan ini tercantum, namun spektrum getaran terlihat bukan sebagai garis –
garis melainkan berupa pita – pita. Hal ini disebabkan perubahan energi getaran tunggal
selalu disertai sejumlah perubahan energi putaran (Silverstein, 1986).
Dalam molekul sederhana beratom dua atau beratom tiga tidak sukar untuk
menentukan jumlah dan jenis vibrasinya dan menghubungkan vibrasi-vibrasi tersebut
dengan energi serapan. Tetapi untuk molekul-molekul beratom banyak, analisis jumlah
saja disebabkan besarnya jumlah pusat – pusat vibrasi, melainkan karena juga harus
diperhitungkan terjadinya saling mempengaruhi (inter-aksi) beberapa pusat vibrasi.
Vibrasi molekul dapat dibagi dalam dua golongan , yaitu vibrasi regang dan
vibrasi lentur.
1. Vibrasi regang
Di sini terjadi terus menerus perubahan jarak antara dua atom di didalam suatu
molekul. Vibrasi regang ini ada dua macam yaitu vibrasi regang simetris dan tak
simetri.
2.Vibrasi lentur
Di sini terjadi perubahan sudut antara dua ikatan kimia. Ada empat macam vibrasi
lentur yaitu vibrasi lentur dalam bidang yang dapat berupa vibrasi scissoring atau
vibrasi rocking dan vibrasi keluar bidang yang dapat berupa waging atau berupa
twisting (Noerdin, 1985).
2.5.3 Spektrometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan
alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan
informasi mengenai berbagai jenis atom hidrogen dalam molekul.. Struktur NMR
memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen
dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom
hidroge (Cresswell, 1982).
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) pada
umumnya digunakan untuk :
1. Menentukan jumlah proton yang memiliki lingkungan kimia yang sama pada
2. Mengetahui informasi mengenai struktur suatu senyawa organik. (Dachriyanus,
2004).
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua
proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa kadang-kadang
menunjukkan pergeseran kimia yang sama. Setiap senyawa memberikan penaikan
menjadi puncak absorbsi tunggal dalam spektrum NMR. Di dalam medan magnet,
perputaran elektron-elektron valensi dari proton menghasilkan medan magnet yang
melawan medan magnet yang digunakan. Hingga setiap proton dalam molekul dilindungi
dari medan magnet yang digunakan dan bahwa besarnya perlindungan ini tergantung
pada kerapatan elektron yang mengelilinginya. Makin besar kerapatan elektron yang
mengelilingi inti, maka makin besar pula medan yang dihasilkan yang melawan medan
yang digunakan (Bernasconi,1995).
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah
tetrametilsilana (TMS). Beberapa keuntungan dari pemakaian standar internal TMS yaitu
:
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrum
puncak tunggal yang kuat.
CH3
CH3 Si CH3
CH3
2. TMS merupakan cairan yang mudah menguap, dapat ditambahkan kedalam
larutan sampel dalam pelarut CDCl3 atau CCl4. (Silverstein, 1986)
Pada spektrometri RMI integrasi sangat penting. Harga integrasi menunjukkan
daerah atau luas puncak dari tiap – tiap proton . Sedangkan luas daerah atau luas puncak
tersebut sesuai dengan jumlah proton. Dengan demikian perbandingan tiap integrasi
BAB 3
METODOLOGI PENELITIAN
3.1 Alat – Alat
1. Gelas ukur 50 ml/100 ml Pyrex
2. Gelas Beaker 250 ml/1000 ml Pyrex
3. Gelas Erlenmeyer 250 ml Pyrex
4. Corong kaca
5. Corong pisah 500 ml Pyrex
6. Ekstraktor 2,5 l Schott/ Duran
7. Kolom kromatografi Pyrex
8. Tabung reaksi Pyrex
9. Plat tetes
10.Rotari evaporator Büchi R-114
11.Labu alas 1 l Schott/ Duran
12.Alat pengukur titik lebur Fisher
13.Kapas
14.Kertas aluminium 7,6 m x 300 mm Total Wrap
15.Statif dan klem
16.Lampu UV 254 nm/ 356 nm UVGL 58
17.Spatula
18.Batang pengaduk
19.Neraca analitis Mettler AE 200
20.Pipet tetes
21.Penangas air Büchi B-480
23.Vakum Büchi B-169
24.Bejana Kromatografi Lapis Tipis
25.Spektrofotometer FT-IR Shimadzu
26.Spektrometer 1H-NMR Jeol/Delta2NMR-500MHz
27.Spektrofotometer UV-Visible
28.Kertas Saring
29.Pelat KLT Merck/ Kieselgel 60 F254
3.2 Bahan-Bahan
1. Daun jambu monyet (A. occidentale L.)
2. Metanol (Me-OH) Destilasi
3. N-heksana Teknis
4. Etil asetat (EtOAc) Teknis
5. Aquadest
6. Silika gel 40 (70-230 mesh) ASTM untuk k.kolom E.Merck. KGaA
7. FeCl3 5%
8. NaOH 10%
9. Mg-HCl
10.H2SO4(p)
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun jambu monyet yang diperoleh dari jalan Pasar 4 ujung,
Desa Sempali. Kelurahan Sempali. Kecamatan Percut Sei Tuan. Daun jambu monyet
dikeringkan di udara terbuka, lalu dihaluskan sampai diperoleh serbuk daun jambu
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Jambu Monyet
Serbuk daun jambu monyet diidentifikasi dengan menggunakan cara:
1. Skrining fitokimia
2. Analisis Kromatografi Lapis Tipis
3.3.2.1 Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada daun jambu monyet, maka dilakukan
uji pendahuluan secara kualitatif sebagai berikut :
Prosedur :
- Dimasukkan ± 10 gram serbuk daun jambu monyet (A. occidentale L.) yang telah
dikeringkan dan dipotong-potong kecil ke dalam erlenmeyer
- Ditambahkan metanol ± 100 ml
- Didiamkan
- Disaring
- Dibagi ekstrak metanol ke dalam 4 tabung reaksi
- Ditambahkan masing-masing pereaksi
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam
b. Tabung II : dengan H2SO4(p) menghasilkan larutan orange kekuningan
c. Tabung III : dengan Mg-HCl menghasilkan larutan berwarna merah muda
d. Tabung IV : dengan NaOH 10% menghasilkan larutan berwarna biru violet
3.3.2.2 Analisis Kromatografi Lapis Tipis (KLT)
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak metanol dengan
pelarut yang sesuai didalam analisis kromatografi kolom. Pelarut yang digunakan adalah
campuran pelarut heksana : etil asetat. Fasa gerak yang digunakan adalah campuran
n-heksana : etil asetat dengan perbandingan (90:10 ; 80:20 ; 70:30 ; 60:40) v/v.
Prosedur:
Dimasukkan 10 ml larutan fase gerak n-heksana : etil asetat (90:10)v/v ke dalam bejana
kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat metanol pada plat KLT
yang telah diaktifkan. Dimasukkan plat ke dalam bejana yang telah berisi pelarut yang
telah dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana,
lalu dikeringkan dan difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang
timbul dan dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk
perbandingan pelarut n-heksana : etil asetat dengan perbandingan (80 :20)v/v; (70:30)v/v;
dan 60:40)v/v.
Dari hasil analisis KLT menunjukkan bahwa di dalam daun jambu monyet
terkandung senyawa flavonoida. Hasil pemisahan yang baik diberikan pada fase gerak
n-heksana : etil asetat (60:40)v/v (LAMPIRAN C).
3.3.3 Prosedur Memperoleh Ekstrak Pekat Lapisan Metanol dari Daun Jambu
Monyet (A. occidentale L.)
Serbuk daun jambu monyet ditimbang sebanyak 1000 g, kemudian dimaserasi dengan
metanol sebanyak ± 5,5 L sampai semua sampel terendam dan dibiarkan selama ± 3 hari.
Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga
diperoleh ekstrak pekat metanol. Kemudian diuapkan hingga semua pelarut metanol
menguap. Lalu dilakukan pemblokan tannin dengan cara melarutkan fraksi metanol
dengan etil asetat, dan disaring. Filtrat kemudian dirotarievaporator lalu diuapkan hingga
semua pelarut etil asetat menguap. Lalu fraksi etil asetat dilarutkan dengan metanol dan
n-heksana, lalu dipekatkan kembali dengan rotarievaporator dan diuapkan sehingga
diperoleh ekstrak pekat lapisan metanol sebanyak 38,31 g.
3.3.4 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kolom dilakukan terhadap ekstrak pekat metanol yang
telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan
fasa gerak yaitu n-heksana 100%, campuran pelarut n-heksana : etil asetat dengan
perbandingan (80 : 20) v/v, (70:30)v/v dan (60:40)v/v.
Prosedur :
Dirangkai alat kolom kromatografi. Terlebih dahulu dibuburkan silika gel 40 (70-230
mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu
dimasukkan ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan
n-heksan 100% hingga silika gel padat dan homogen. Dimasukkan 14,73 g ekstrak metanol
daun jambu monyet ke dalam kolom kromatografi yang telah berisi bubur silika gel, lalu
ditambahkan fasa gerak n-heksana : etil asetat (80 : 20) v/v secara perlahan – lahan, dan
diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan
fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n –
heksana : etil asetat dengan perbandingan (70:30)v/v dan (60:40)v/v. Hasil yang diperoleh
ditampung dalam botol vial setiap 12 ml , lalu di KLT dan digabung fraksi dengan harga
Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk kristal.
3.3.5 Pemurnian (Rekristalisasi)
Senyawa yang diperoleh dari hasil isolasi kromatografi kolom harus dimurnikan.
Kristal yang diperoleh dari isolasi dilarutkan kembali dengan etil asetat, diaduk hingga
semua kristal larut sempurna. Kemudian ditambahkan n – heksana secara perlahan–lahan
hingga terjadi pengendapan zat-zat pengotor di dasar wadah. Kemudian didekantasi
larutan bagian atas wadah, lalu diuapkan sisa pelarut dari kristal hingga diperoleh kristal
yang benar – benar bebas dari pelarut.
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian kristal dilakukan dengan kromatografi lapis tipis dengan menggunakan
fasa diam silika gel 60 F254 dengan fasa gerak n-heksana : etil asetat (60:40) v/v.
Prosedur :
Dimasukkan 10 ml larutan fasa gerak ke dalam bejana kromatografi, lalu dijenuhkan.
Ditotolkan kristal yang sebelumnya dilarutkan dengan etil asetat pada plat KLT.
Dimasukkan plat KLT tersebut ke dalam bejana kromatografi yang telah jenuh. Setelah
pelarut fasa gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana,
dikeringkan, dan difiksasi dengan menggunakan pereaksi FeCl3 5% dalam metanol
menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.7 Penentuan Titik Lebur
Kristal hasil isolasi yang telah murni dimasukkan ke dalam alat pengukur titik lebur,
diatur suhu. Lalu diamati suhu sampai kristal melebur.
3.3.8 Identifikasi Senyawa Hasil Isolasi
Analisis dengan alat Spektrofotometer UV-Visible diperoleh dari Laboratorium Pusat
Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang dengan
menggunakan metanol sebagai pelarut. (LAMPIRAN D).
3.3.8.2. Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton
(1H-NMR)
Analisis dengan alat Spektrometer 1H-NMR diperoleh dari Laboratorium Pusat Penelitian
Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang dengan menggunakan aseton
sebagai pelarut.
(LAMPIRAN F).
3.3.8.3 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
Analisis dengan alat Spektrofotometer FT-IR diperoleh dari Laboratorium Pusat
Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang.
3.4 Bagan Skrining Fitokimia
diekstraksi maserasi dengan metanol
disaring
dipekatkan
dibagi ke dalam 4 tabung reaksi
3.5 Bagan Penelitian
diskrining fitokimia
dimaserasi dengan metanol sebanyak 5,5 L didiamkan selama 3 hari
diulangi sebanyak 3 kali
diskrining fitokimia
dipekatkan dengan rotari-evaporator
diuapkan hingga semua metanol menguap dilarutkan dengan etil asetat
disaring
dipekatkan dengan rotarievaporator diuapkan hingga semua etil asetat menguap dilarutkan dengan metanol
diekstraksi partisi dengan n-heksana sampai bening
diskrining fitokimia
dipekatkan dengan rotarievaporator
di-KLT untuk mengetahui sistem eluen yang sesuai pada kromatografi kolom
dipisahkan tiap fraksi melalui kromatagrafi kolom dengan fasa gerak yaitu campuran pelarut n-heksana : etil asetat dengan perbandingan 80:20 v/v, 70:30 v/v dan 60:40v/v
ditampung tiap fraksi sebanyak 12 ml dalam botol vial di-KLT untuk mengetahi harga Rf
digabung fraksi dengan harga Rf yang sama
ditentukan nilai Rf nya diuapkan
direkristalisasi diukur massa diuji titik lebur
dianalisis dengan Spektrofotometer UV-Visible, spektrofotometer FT-IR, spektrometer 1H-NMR 1000 g serbuk daun tumbuhan jambu monyet
(A. occidentale L.)
Ekstrak metanol
Kristal kuning muda
Ekstrak pekat metanol
Lapisan metanol Lapisan n-heksana
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil skrining fitokimia terhadap ekstrak metanol dari daun jambu monyet (A.
Occidentale L.) menunjukkan bahwa sampel positif terhadap pereaksi – pereaksi
flavonoida.
Hasil isolasi senyawa flavonoida dari daun tumbuhan jambu monyet diperoleh
dengan menggunakan fase gerak n-heksana : etil asetat (60/40)v/v, berwarna cream,
berbentuk kristal jarum, massa = 510 mg, positif terhadap pereaksi flavonoida, Rf = 0,34,
dan titik lebur = 175-178oC
Dari hasil analisis Spektrofotometer Ultraviolet – Visible ( UV – Visible ) dengan pelarut
metanol memberikan panjang gelombang maksimum (λ maks) 216.5 dan 271.5 nm
(LAMPIRAN D).
Hasil analisis Spektrofotometer FT-IR pada kristal hasil isolasi menghasilkan
pita–pita serapan pada daerah bilangan gelombang sebagai berikut :
1. Pada bilangan gelombang 1049,28–1265,03 cm-1 menunjukkan adanya vibrasi C–
O dari gugus eter.
2. Pada bilangan gelombang 1049,28–1265,03 cm-1 menunjukkan adanya vibrasi C–
O dari gugus alkohol.
3. Pada bilangan gelombang 1371,39–1458,18 cm-1 dan 2854,65–2922,16 cm-1
4. Pada bilangan gelombang 756,10; 1371,39–1458,18 dan 2854,65–2922,16 cm-1
menunjukkan adanya vibrasi CH2.
5. Pada bilangan gelombang 1535,34 cm-1 menunjukkan adanya vibrasi ikatan
rangkap C=C dari sistem aromatik.
6. Pada bilangan gelombang 1689,64 cm-1 menunjukkan adanya vibrasi ikatan
rangkap C=O dari keton.
7. Pada bilangan gelombang 3350,35–3520,09 cm-1 puncak melebar menunjukkan
adanya serapan ikatan OH.
(LAMPIRAN E).
Hasil analisis Spektroskopi Resonansi Magnetik Inti Proton (H1-NMR) senyawa
hasil isolasi dengan menggunakan pelarut aseton-d6 dan TMS sebagai standar yang
memberikan signal – signal pergeseran kimia pada daerah sebagai berikut :
1. 0.8757 ppm menunjukkan puncak singlet
2. 1.2899 ppm menunjukkan puncak singlet
3. 3.7813 ppm menunjukkan puncak singlet
4. 7.1072 ppm menunjukkan puncak singlet
5. 8.2092 ppm menunjukkan puncak singlet melebar
(LAMPIRAN F).
4.2 Pembahasan
Dari hasil kromatografi lapis tipis, diketahui bahwa perbandingan pelarut yang baik untuk
mengisolasi senyawa flavonoida dari daun jambu monyet adalah n-heksana : etil asetat
(60 : 40)v/v yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan. Hal
ini juga dibuktikan dengan analisis KLT yang menunjukkan hanya satu noda tunggal pada
Hasil interpretasi spektrum Infra Merah (FT-IR) dan Spektrum Resonansi
Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut
aseton-d6 dalam standar TMS diperoleh :
1. Pergeseran kimia pada daerah δ=0,8696–0,8757 ppm terdapat puncak singlet
menunjukkan adanya proton-proton –CH3. Hal ini didukung oleh data
spektrofotometer FT-IR pada bilangan gelombang 1371,39–1458,18; 2854,65–
2922,16 cm-1 yang menunjukkan adanya vibrasi –CH3.
2. Pergeseran kimia pada daerah δ=1.2899 ppm terdapat puncak singlet
menunjukkan adanya proton-proton –CH2 dan –CH2 ini tidak mempunyai tetangga
yaitu gugus –CH3 karena tidak menunjukkan adanya puncak kwartet atau triplet.
Hal ini didukung oleh data spektrofotometer FT-IR pada bilangan gelombang
756,10; 1371,39–1458,18 cm-1 dan 2854,65–2922,16 yang menunjukkan adanya
vibrasi –CH2.
3. Pergeseran kimia pada daerah δ=3,7813–3,7874 ppm terdapat puncak singlet
yang menunjukkan adanya proton–proton –CH3 yang dipengaruhi oleh atom yang
mempunyai elektronegatifitas yang yaitu atom O, sehingga menjauhi TMS. Hal
ini didukung oleh data spektrofotometer FT–IR pada bilangan gelombang
1049,28–1265,03 cm-1 menunjukkan adanya vibrasi C–O dari gugus eter.
4. Pergeseran kimia pada daerah δ=7,1072–7,1133 ppm terdapat puncak singlet yang
menunjukkan adanya proton aromatis. Hal ini didukung oleh data
spektrofotometer FT–IR pada bilangan gelombang 1535,34 cm-1 menunjukkan
adanya vibrasi ikatan rangkap C=C dari sistem aromatik.
5. Pergeseran kimia pada daerah δ=8,2092 ppm terdapat puncak melebar dari gugus
–OH yang terikat pada cincin aromatis yang menjauhi TMS. Hal ini didukung
oleh data spektrofotometer FT-IR pada bilangan gelombang 3350,35–3520,09 cm
-1
puncak melebar menunjukkan adanya serapan ikatan –OH.
Dari hasil pembahasan diatas, berdasarkan skrining fitokimia, data spektrum
FT-IR dan (1H-NMR) dapat disimpulkan bahwa besar kemungkinan kristal berbentuk jarum
golongan Flavon. Tetapi bila dilihat dari data spektrum UV-Visible terjadi penyimpangan
dari literatur, dalam hal ini terjadi pergeseran absorbsi maksimum ke daerah yang panjang
gelombang yang rendah (hipsokromik). Kemungkinan hal ini terjadi karena adanya
pengaruh posisi substituent yang diikatnya. (Mabry, 1970). Kemungkinan subsituten yang
mempengaruhi pergeseran ke panjang gelombang lebih rendah adalah gugus hidroksil
(OH) yang terikat pada atom C6. (Dirk, 2003).
O O