UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. MERCK TBK.
JL. TB. SIMATUPANG NO. 8 PASAR REBO
JAKARTA TIMUR
PERIODE 3 FEBRUARI – 28 MARET 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DEWI YUNIARSIH, S.Farm.
1306343460
ANGKATAN LXXVIII
PROGRAM PROFESI APOTEKER
FAKULTAS FARMASI
UNIVERSITAS INDONESIA
DEPOK
ii
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. MERCK TBK.
JL. TB. SIMATUPANG NO. 8 PASAR REBO
JAKARTA TIMUR
PERIODE 3 FEBRUARI – 28 MARET 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar ApotekerDEWI YUNIARSIH, S.Farm.
1306343460
ANGKATAN LXXVIII
PROGRAM PROFESI APOTEKER
FAKULTAS FARMASI
UNIVERSITAS INDONESIA
DEPOK
Laporan Praktek Kerja Profesi ini diajukan oleh :
Nama : Dewi Yuniarsih, S.Farm.
NPM : 1306343460
Program Studi : Profesi Apoteker Universitas Indonesia
Judul Laporan : Laporan Praktek Kerja Profesi Apoteker di PT. Merck Tbk. Jl. TB Simatupang No. 8 Pasar Rebo Jakarta Timur Periode 3 Februari – 28 Maret 2014
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Apoteker pada Program Studi Apoteker, Fakultas Farmasi Universitas Indonesia.
DEWAN PENGUJI
Pembimbing I : Dra. Leni Liedarsino, Apt. (……….)
Pembimbing II : Dr. Hayun, M.Si., Apt. (……….)
Penguji I : (……….)
Penguji II : (……….)
Penguji III : (……….)
Ditetapkan di : Depok
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya, penulis dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT. Merck Tbk. Jl. TB Simatupang No 8. Pasar Rebo Jakarta Timur. Penulisan laporan ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Apoteker pada Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia.
Penulis menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, sangatlah sulit bagi penulis untuk menyelesaikan laporan praktek kerja ini. Oleh karena itu, penulis menyampaikan terima kasih kepada:
1. Dr. Mahdi Jufri, S.Si, Apt., selaku Dekan Fakultas Farmasi Universitas Indonesia
2. Dr. Hayun, M.Si., Apt., selaku Ketua Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia dan pembimbing dari Fakultas Farmasi Universitas Indonesia
3. Dra. Leni Liedarsino, Apt selaku Product Development Senior Manager dan pembimbing atas kesempatan yang telah diberikan kepada penulis untuk belajar dan memperoleh banyak pengalaman di Departemen Product
Development PT Merck Tbk.
4. Henry Sujatmiko, S.Kom sebagai Packaging Development Supervisor, atas bantuan, bimbingan dan ilmu yang diberikan kepada penulis selama menjalankan praktek kerja di PT Merck Tbk.
5. Segenap PD staf di PT. Merck Tbk. yang tidak dapat disebutkan satu persatu atas kerja sama, bantuan dan pengetahuan yang telah dibagikan kepada penulis 6. Seluruh manajer dan karyawan di PT. Merck Tbk. yang tidak dapat disebutkan satu persatu atas kesediaannya membantu dan memberikan pengarahan selama praktek kerja berlangsung
7. Segenap staf pengajar dan tata usaha Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia atas bantuan yang telah diberikan kepada penulis
vi
8. Keluarga tercinta atas dukungan moril maupun materil, kasih sayang, perhatian, semangat dan kesabaran yang tiada habisnya
9. Teman-teman Apoteker Angkatan
LXXVIII
atas dukungan dan kerja sama selama setahun terakhir10. Seluruh pihak yang telah membantu selama pelaksanaan PKPA dan penyusunan laporan ini yang tidak dapat disebutkan satu per satu.
Oleh karena itu, penulis dengan senang hati menerima segala kritik dan saran demi perbaikan di masa yang akan datang. Tak ada yang penulis harapkan selain sebuah keinginan agar laporan PKPA ini dapat bermanfaat bagi pengembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
viii
ABSTRAK
Nama : Dewi Yuniarsih
NPM : 1306343460
Program Studi : Profesi Apoteker
Judul : Laporan Praktek Kerja Profesi Apoteker di PT. Merck Tbk., Periode 3 Februari – 28 Maret 2014
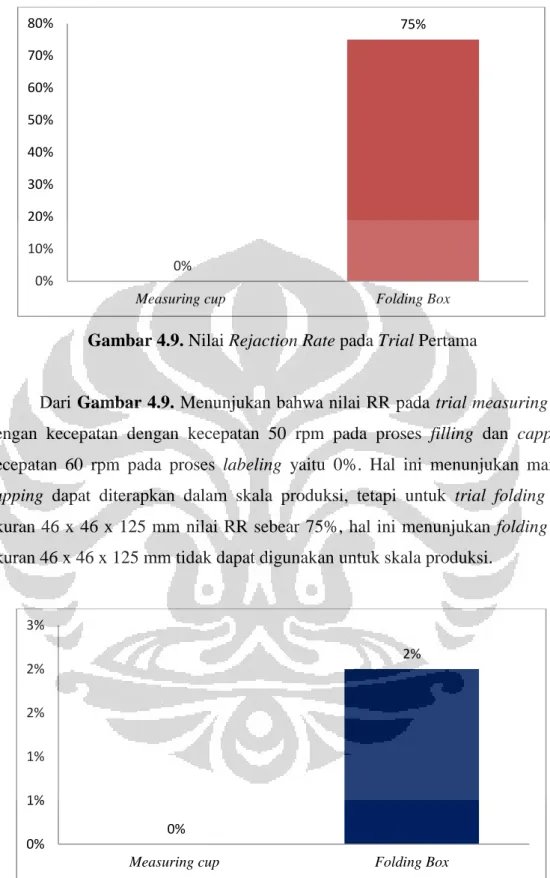
Praktek Kerja Profesi Apoteker di PT. Merck Tbk. bertujuan agar mahasiswa mengetahui aspek-aspek yang berhubungan dengan penerapan CPOB di industri farmasi juga mengetahui dan memahami peran dan tanggung jawab apoteker di dalam industri farmasi. Tugas khusus yang diberikan berjudul Trial Capping
Measuring Cup pada Botol Sirup Multivitamin Ex. Erwina dan Folding Box Ex.
MJSG (New Vendor) yang dilaksanakan di area mesin LFL (Liquid Filling Line) di PT. Merck Tbk. bertujuan untuk memastikan bahwa Measuring Cup Ex. Erwina dan Folding box Ex. MJSG dapat digunakan untuk skala produksi, baik secara manual capping atau cartoning folding box di area produksi.
Kata kunci : PT. Merck Tbk., Trial capping Measuring Cup, Folding box Tugas umum : xi + 69 halaman
Tugas khusus : v + 24 halaman; 12 gambar; 1 tabel Daftar Acuan Tugas Umum : 12 (1967-2012) Daftar Acuan Tugas Khusus : 5 (2012-2013)
Name : Dewi Yuniarsih
NPM : 1306343460
Program Study : Apothecary profession
Title : Apothecary Intership Program Report at PT. Merck Tbk. Jl. TB. Simatupang No.8 Pasar Rebo Jakarta Timur Period February 3th - March 28th 2014
Pharmacists Professional Practice implemented in PT. Merck Tbk. aims to make student aware about aspects related to the implementation of GMP in the pharmaceutical industry and also to know and understand the roles and responsibilities of pharmacists in the pharmaceutical industry. Specific assignment given was Trial Capping Measuring Cup on Multivitamin Syrup Bottle Ex. Erwina and Folding Box Ex. MJSG (New Vendor) in the area of machine LFL (Liquid Filling Line) at PT. Merck Tbk. aims to ensure that the Measuring Cup Ex. Erwina and Folding box Ex. MJSG can be used for production scale, either manually capping or cartoning folding box in the production area.
Keyword : PT. Merck Tbk., Trial capping Measuring Cup, Folding box
General Assignment : xi + 69 pages
Specific Assignment : v + 24 pages; 12 pictures; 1 table Bibliography of General Assignment : 12 (1967-2012) Bibliography of Specific Assignment : 5 (2012-2013)
x
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERNYATAAN ORISINALITAS ... iv
KATA PENGANTAR ... v
HALAMAN PERSETUJUAN PUBLIKASI ... vii
ABSTRAK ... viii ABSTRACT ... ix DAFTAR ISI ... x BAB 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2
BAB 2 TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.1.1 Pengertian Industri Farmasi ... 3
2.1.2 Persyaratan Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik ... 4
2.2.1 Manajemen Mutu ... 5
2.2.2 Personalia ... 5
2.2.3 Bangunan dan Fasilitas ... 8
2.2.4 Peralatan ... 9
2.2.5 Sanitasi dan Higiene ... 9
2.2.6 Produksi ... 10
2.2.7 Pengawasan Mutu ... 14
2.2.8 Inspeksi Diri, Audit Mutu dan Persetujuan Pemasok ... 15
2.2.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk ... 16
2.2.10 Dokumentasi ... 18
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 18
2.2.12 Kualifikasi dan Validasi ... 19
BAB 3 TINJAUAN KHUSUS PT MERCK ... 21
3.1 Latar Belakang Perusahaan ... 21
3.2 Lokasi dan Tata Letak Bangunan ... 21
3.3 Visi dan Misi PT. Merck Tbk. ... 22
3.3.1 Visi PT. Merck Tbk. ... 22
3.3.2 Misi PT. Merck Tbk. ... 22
3.4 Filosofi dan Nilai Utama Perusahaan ... 23
3.5 Organisasi Divisi Manufaktur Perusahaan ... 25
3.5.1 Quality Assurance/Quality Control (QA/QC) ... 25
3.5.2 Product Development Department ... 30
3.5.3 Departemen Supply Chain Management (SCM)... 33
3.6 Produk PT. Merck Tbk. ... 49
BAB 4 PEMBAHASAN ... 50
4.1 Manajemen Mutu ... 51
4.2 Personalia ... 51
4.3 Bangunan dan Fasilitas ... 52
4.4 Peralatan ... 54
4.5 Sanitasi dan Higiene ... 55
4.5.1 Higiene Perorangan ... 55
4.5.2 Sanitasi Bangunan dan Fasilitas ... 57
4.6 Produksi ... 57
4.7 Pengawasan dan Pemastian Mutu Produk ... 59
4.8 Inspeksi Diri dan Audit Mutu ... 63
4.9 Penanganan Keluhan terhadap Produk dan Penarikan Kembali Produk ... 64
4.10 . Dokumentasi………...………. 65
4.11 . Kualifikasi dan Validasi……….. 67
BAB 5 KESIMPULAN DAN SARAN ... 68
5.1 Kesimpulan ... 68
5.2 Saran ... 68
1 Universitas Indonesia
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Kesehatan adalah hak asasi manusia dan sekaligus investasi untuk keberhasilan pembangunan bangsa, oleh karena itu diselenggarakan pembangunan kesehatan (Departemen Kesehatan Republik Indonesia, 2004). Pembangunan kesehatan bertujuan untuk meningkatkan kesadaran, kemauan, dan kemampuan hidup sehat bagi setiap orang agar terwujud derajat kesehatan masyarakat yang setinggi-tingginya, sebagai investasi bagi pembangunan sumber daya manusia yang produktif secara social dan ekonomi (Presiden Republik Indonesia, 2009).
Salah satu langkah pemerintah untuk terselenggaranya pembangunan kesehatan adalah menjamin tersedianya sediaan farmasi, alat kesehatan, dan makanan yang terjamin aman, berkhasiat/bermanfaat dan bermutu, dan khusus untuk obat dijamin ketersediaan dan keterjangkauannya guna meningkatkan derajat kesehatan masyarakat yang setinggi-tingginya (Presiden Republik Indonesia, 2012). Oleh karena itu, untuk menjamin ketersediaan obat, dibutuhkan peran industri farmasi.
Industri farmasi sebagai badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat harus membuat obat sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen registrasi dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Oleh karena itu, industri farmasi wajib menerapkan pedoman CPOB yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai tujuan penggunaanya dalam seluruh aspek dan rangkaian kegiatan pembuatan obat dan atau bahan obat (BPOM, 2012).
Berdasarkan Peraturan Pemerintah Republik Indonesia No.51 tahun 2009 tentang pekerjaan kefarmasian, industri farmasi adalah salah satu tempat pengabdian profesi apoteker. Apoteker memiliki peran yang penting dalam industri farmasi, salah satunya dalam penerapan CPOB. Peran apoteker di industri farmasi adalah sebagai penanggungjawab masing-masing pada bidang pemastian
mutu, produksi dan pengawasan mutu setiap produksi sediaan farmasi (Peraturan Pemerintah RI No. 51, 2009). Peran yang penting ini menuntut seorang apoteker tidak hanya membutuhkan pengetahuan teoritis, tetapi juga pengalaman praktis di lapangan.
Praktek Kerja Profesi Apoteker (PKPA) merupakan salah satu sarana bagi calon apoteker untuk mendapatkan pengalaman praktis dan pemahaman tentang peran dan tugas apoteker di industri farmasi. Oleh karena itu, Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia bekerja sama dengan PT. Merck Tbk. Mengadakan Praktek Kerja Profesi Apoteker (PKPA) yang berlangsung sejak tanggal 1 Februari – 31 Maret.
1.2 Tujuan
Tujuan dari Praktek Kerja Profesi Apoteker (PKPA) di PT Merck Tbk. adalah agar mahasiswa Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia :
1. Memahami penerapan segala aspek CPOB di PT Merck Tbk. 2. Memahami peran serta tugas apoteker di industri farmasi.
3 Universitas Indonesia
BAB 2
TINJAUAN UMUM
2.1 Industri Farmasi (Kementrian Kesehatan Republik Indonesia, 2010)
2.1.1 Pengertian Industri Farmasi
Industri farmasi dapat didefinisikan sebagai badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat, hal ini didasarkan atas Peraturan Menteri Kesehatan Republik Indonesia Nomor 1799/MENKES/PER/XII/2010 tentang industri farmasi (Kementrian Kesehatan Republik Indonesia, 2010).
2.1.2 Persyaratan Industri Farmasi
Industri farmasi wajib memperoleh izin usaha industri farmasi sebelum memulai proses produksinya, oleh karena itu industri tersebut wajib memenuhi persyaratan yang telah ditetapkan oleh Menteri Kesehatan. Persyaratan yang diperlukan industri farmasi dalam mendapatkan izin usaha tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 1799/MENKES/PER/XII/2010 adalah sebagai berikut (Kementrian Kesehatan Republik Indonesia, 2010):
a. Berbadan usaha berupa perseroan terbatas
b. Memiliki rencana investasi dan kegiatan pembuatan obat c. Memiliki Nomor Pokok Wajib Pajak (NPWP)
d. Memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu.
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Permohonan Izin industri Farmasi diajukan kepada Direktur Jenderal dengan tembusan kepada Kepala badan dan Kepala Dinas Kesehatan Provinsi setempat. Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan
Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut berproduksi dan memenuhi ketentuan peraturan perundang-undangan, dengan perpanjangan izin setiap 5 tahun. Sedangkan untuk industri farmasi Penanaman Modal Asing (PMA), masa berlakunya sesuai dengan ketentuan dalam Undang-Undang Republik Indonesia Nomor 1 Tahun 1967 tentang Penanaman Modal Asing. Surat Permohonan izin industri farmasi harus ditandatangani oleh direktur utama dan apoteker penanggung jawab pemastian mutu (Presiden Republik Indonesia, 1967).
Industri farmasi wajib menyampaikan laporan industri secara berkala mengenai kegiatan usahanya :
a. Sekali dalam 6 (enam) bulan, meliputi jumlahnya dan nilai produksi setiap obat atau bahan obat yang dihasilkan.
b. Sekali dalam 1 (satu) tahun.
Laporan industri farmasi disampaikan kepada Direktur Jenderal dengan tembusan kepada Kepala Badan.
2.2 Cara Pembuatan Obat yang Baik (CPOB) (Badan Pengawas Obat dan Makanan, 2012)
CPOB bertujuan untuk menjamin obat dibuat secara konsisten memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. Pada pembuatan obat, pengendalian menyeluruh sangatlah penting untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi (Badan Pengawas Obat dan Makanan, 2012).
Pedoman CPOB yang dikeluarkan oleh Badan Pengawas Obat dan Makanan (BPOM) tahun 2012 terdiri dari 12 aspek, yaitu: Manajemen Mutu; Personalia; Bangunan dan Fasilitas; Peralatan; Sanitasi dan Higiene; Produksi; Pengawasan Mutu; Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok; Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk; Dokumentasi; Pembuatan dan Analisa Berdasarkan Kontrak; Kualifikasi dan Validasi (Badan Pengawas Obat dan Makanan, 2012).
5
Universitas Indonesia 2.2.1 Manajemen Mutu (Badan Pengawas Obat dan Makanan, 2012)
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaanya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah, atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan sistem Pemastian Mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Risiko Mutu. Hal ini hendaklah didokumentasikan dan dimonitor efektivitasnya.
Dalam melaksanakan kebijakan mutu dibutuhkan 2 unsur dasar manajemen mutu yaitu:
a. Suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya; dan
b. Tindakan sistematis yang diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu.
2.2.2 Personalia (Badan Pengawas Obat dan Makanan, 2012)
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu, industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB serta memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaannya.
Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, manajemen mutu (pemastian mutu) dipimpin
oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadai yang diperlukan untuk dapat melaksanakan tugasnya secara efektif. Personil kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu, dan kepala bagian Manajemen Mutu (Pemastian Mutu).
Kepala bagian Produksi hendaklah seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dalam bidang pembuatan obat dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Kepala bagian Produksi hendaklah diberi kewenangan dan tanggung jawab penuh dalam produksi obat, termasuk (Badan Pengawas Obat dan Makanan, 2012):
a. Memastikan bahwa obat diproduksi dan disimpan sesuai prosedur agar memenuhi persyaratan mutu yang ditetapkan;
b. Memberikan persetujuan petunjuk kerja yang terkait dengan produksi dan memastikan bahwa petunjuk kerja diterapkan secara tepat;
c. Memastikan bahwa catatan produksi telah dievaluasi dan ditandatangani oleh kepala bagian Produksi sebelum diserahkan kepada kepala bagian Manajemen Mutu (Pemastian Mutu);
d. Memeriksa pemeliharaan bangunan dan fasilitas serta peralatan di bagian produksi;
e. Memastikan bahwa validasi yang sesuai telah dilaksanakan; dan
f. Memastikan bahwa pelatihan awal dan berkesinambungan bagi personil di departemennya dilaksanakan dan diterapkan sesuai kebutuhan.
Kepala bagian Pengawasan Mutu hendaklah seorang apoteker terkualifikasi dan memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Kepala bagian Pengawasan Mutu hendaklah diberi kewenangan dan tanggung jawab penuh dalam pengawasan mutu, termasuk:
a. Menyetujui atau menolak bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi;
7
Universitas Indonesia c. Memberi persetujuan terhadap spesifikasi, petunjuk kerja pengambilan
sampel, metode pengujian dan prosedur pengawasan mutu lain;
d. Memberi persetujuan dan memantau semua analisis berdasarkan kontrak; e. Memeriksa pemeliharaan bangunan dan fasilitas serta peralatan di bagian
pengawasan mutu;
f. Memastikan bahwa validasi yang sesuai telah dilaksanakan; dan
g. Memastikan bahwa pelatihan awal dan berkesinambungan bagi personil di departemennya dilaksanakan dan diterapkan sesuai kebutuhan.
Kepala bagian Manajemen Mutu (Pemastian Mutu) hendaklah seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Kepala bagian Manajemen Mutu (Pemastian Mutu) hendaklah diberi kewenangan dan tanggung jawab penuh untuk melaksanakan tugas yang berhubungan dengan sistem mutu/ pemastian mutu, termasuk:
a. Memastikan penerapan (dan, bila diperlukan, membentuk) sistem mutu; b. Ikut serta dalam atau memprakarsai pembentukan manual mutu
perusahaan;
c. Memprakarsai dan mengawasi audit internal atau inspeksi diri berkala; d. Melakukan pengawasan terhadap fungsi bagian Pengawasan Mutu;
e. Memprakarsai dan berpartisipasi dalam pelaksanaan audit eksternal (audit terhadap pemasok);
f. Memprakarsai dan berpartisipasi dalam program validasi;
g. Memastikan pemenuhan persyaratan teknik atau peraturan Badan Pengawasan Obat dan Makanan (Badan POM) yang berkaitan dengan mutu produk jadi;
h. Mengevaluasi/mengkaji catatan bets; dan
i. Meluluskan atau menolak produk jadi untuk penjualan dengan mempertimbangkan semua faktor terkait.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan
atau laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya dapat berdampak pada mutu produk.
Di samping pelatihan dasar dalam teori dan praktek CPOB, personil baru hendaklah mendapat pelatihan sesuai dengan tugas yang diberikan. Pelatihan berkesinambungan hendaklah juga diberikan, dan efektifitas penerapannya hendaklah dinilai secara berkala. Hendaklah tersedia program pelatihan yang disetujui kepala bagian masing-masing.Pelatihan hendaklah diberikan oleh orang yang terkualifikasi.
2.2.3 Bangunan dan Fasilitas (Badan Pengawas Obat dan Makanan, 2012) Bangunan dan fasilitas untuk pembuatan obat harus memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadi kekeliruan, pencemaran silang dan kesalahan lain, serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan hendaklah sedemikian rupa untuk menghindarkan pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut.
Bangunan dan fasilitas hendaklah didesain, dikonstruksi, dilengkapi dan dirawat sedemikian agar memperoleh perlindungan maksimal terhadap pengaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarang serangga, burung, binatang pengerat, kutu atau hewan lain. Hendaklah tersedia prosedur untuk pengendalian binatang pengerat dan hama.
Bangunan dan fasilitas hendaklah dirawat dengan cermat, dibersihkan dan, bila perlu, didisinfeksi sesuai prosedur tertulis rinci. Catatan pembersihan dan disinfeksi hendaklah disimpan. Seluruh bangunan dan fasilitas termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling
9
Universitas Indonesia bangunan hendaklah dirawat dalam kondisi bersih dan rapi. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki di mana perlu.Perbaikan serta perawatan bangunan dan fasilitas hendaklah dilakukan hati-hati agar kegiatan tersebut tidak memengaruhi mutu obat.
2.2.4 Peralatan (Badan Pengawas Obat dan Makanan, 2012)
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah kontaminasi silang, penumpukan debu atau kotoran dan, hal-hal yang umumnya berdampak buruk pada mutu produk.
Peralatan manufaktur hendaklah didesain sedemikian rupa agar mudah dibersihkan. Peralatan tersebut hendaklah dibersihkan sesuai prosedur tertulis yang rinci serta disimpan dalam keadaan bersih dan kering.
Peralatan hendaklah dipasang sedemikian rupa untuk mencegah risiko kesalahan atau kontaminasi. Peralatan satu sama lain hendaklah ditempatkan pada jarak yang cukup untuk menghindarkan kesesakan serta memastikan tidak terjadi kekeliruan dan kecampurbauran produk.
Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat memengaruhi identitas, mutu atau kemurnian produk. Kegiatan perbaikan dan perawatan hendaklah tidak menimbulkan risiko terhadap mutu produk.
2.2.5 Sanitasi dan Higiene (Badan Pengawas Obat dan Makanan, 2012)
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, bahan pembersih dan desinfeksi, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
Prosedur higiene perorangan termasuk persyaratan untuk mengenakan pakaian pelindung hendaklah diberlakukan bagi semua personil yang memasuki area produksi, baik karyawan purnawaktu, paruhwaktu atau bukan karyawan yang berada di area pabrik, misal karyawan kontraktor, pengunjung, anggota manajemen senior dan inspektur.
Program higiene yang rinci hendaklah dibuat dan diadaptasikan terhadap berbagai kebutuhan di dalam area pembuatan. Program tersebut hendaklah mencakup prosedur yang berkaitan dengan kesehatan, praktik higiene dan pakaian pelindung personil. Prosedur hendaklah dipahami dan dipatuhi secara ketat oleh setiap personil yang bertugas di area produksi dan pengawasan. Program higiene hendaklah dipromosikan oleh manajemen dan dibahas secara luas selama sesi pelatihan.
Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik. Hendaklah ada prosedur tertulis yang menunjukkan penanggung jawab untuk sanitasi serta menguraikan dengan cukup rinci mengenai jadwal, metode, peralatan, dan bahan pembersih yang harus digunakan untuk pembersihan sarana dan bangunan. Prosedur tertulis terkait hendaklah dipatuhi. Prosedur pembersihan hendaklah rinci supaya operator dapat melakukan pembersihan tiap jenis alat secara konsisten dan efektif. Prosedur sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk memastikan efektivitas prosedur.
2.2.6 Produksi (Badan PengawasObat dan Makanan, 2012)
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar.
Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Penanganan bahan dan produk jadi, seperti penerimaan dan karantina, pengambilan sampel, penyimpanan, penandaan, penimbangan, pengolahan, pengemasan dan distribusi hendaklah dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat.
11
Universitas Indonesia Hal-hal yang perlu diperhatikan dalam produksi antara lain:
a. Pengadaan Bahan Awal
Pembelian bahan awal hendaklah hanya dari pemasok yang telah disetujui dan memenuhi spesifikasi yang relevan, dan bila memungkinkan, langsung dari produsen. Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan hendaklah berisi keterangan mengenai pasokan, nomor bets/lot, tanggal penerimaan atau penyerahan, tanggal pelulusan dan tanggal daluwarsa bila ada. Bahan awal yang diterima hendaklah dikarantina sampai disetujui dan diluluskan untuk pemakaian oleh kepala bagian Pengawasan Mutu.
Bahan awal di area penyimpanan hendaklah diberi label yang tepat. Label hendaklah memuat keterangan paling sedikit sebagai berikut:
1. Nama bahan dan bila perlu nomor kode bahan;
2. Nomor bets/kontrol yang diberikan pada saat penerimaan bahan; 3. Status bahan (misal: karantina, sedang diuji, diluluskan, ditolak); 4. Tanggal daluwarsa atau tanggal uji ulang bila perlu.
Jika digunakan sistem penyimpanan terkomputerisasi yang divalidasi penuh, maka semua keterangan di atas tidak perlu ditampilkan dalam bentuk tulisan terbaca pada label.
b. Pencegahan Pencemaran Silang
Pencemaran bahan awal atau produk oleh bahan atau produk lain harus dihindarkan. Risiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, gas, uap, percikan atau organisme dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Tingkat risiko pencemaran ini tergantung dari jenis pencemar dan produk yang tercemar.
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain
c. Sistem Penomoran Bets/Lot
Hendaklah tersedia sistem yang menjelaskan secara rinci penomoran bets/lot dengan tujuan untuk memastikan bahwa tiap bets/lot produk antara, produk ruahan atau produk jadi dapat diidentifikasi.
Sistem penomoran bets/lot yang digunakan pada tahap pengolahan dan tahap pengemasan hendaklah saling berkaitan. Sistem penomoran bets/lot hendaklah menjamin bahwa nomor bets/lot yang sama tidak dipakai secara berulang. Alokasi nomor bets/lot hendaklah segera dicatat dalam suatu buku log. Catatan tersebut hendaklah mencakup tanggal pemberian nomor, identitas produk dan ukuran bets/lot yang bersangkutan. d. Penimbangan dan Penyerahan
Penimbangan atau penghitungan dan penyerahan bahan awal, bahan pengemas, produk antara dan produk ruahan dianggap sebagai bagian dari siklus produksi dan memerlukan dokumentasi serta rekonsiliasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh Pengawasan Mutu dan masih belum daluwarsa yang boleh diserahkan.
Bahan awal, produk antara dan produk ruahan yang diserahkan hendaklah diperiksa ulang kebenarannya dan ditandatangani oleh supervisor produksi sebelum dikirim ke area produksi.
e. Pengembalian
Semua bahan awal, bahan pengemas, produk antara dan produk ruahan yang dikembalikan ke gudang penyimpanan hendaklah didokumentasikan dengan benar dan direkonsiliasi.
Bahan awal, bahan pengemas, produk antara dan produk ruahan hendaklah tidak dikembalikan ke gudang penyimpanan kecuali memenuhi spesifikasi yang telah ditetapkan.
f. Pengolahan
Semua bahan dan semua peralatan yang dipakai di dalam pengolahan hendaklah diperiksa sebelum dipakai. Peralatan hendaklah dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan hendaklah dilaksanakan mengikuti prosedur yang tertulis. Tiap penyimpangan hendaklah dipertanggungjawabkan dan dilaporkan. Semua produk antara dan ruahan hendaklah diberi label.
13
Universitas Indonesia Pengadaan, penanganan dan pengawasan bahan pengemas primer dan bahan pengemas cetak serta bahan cetak lain hendaklah diberi perhatian yang sama seperti terhadap bahan awal.
Perhatian khusus hendaklah diberikan kepada bahan cetak. Bahan cetak tersebut hendaklah disimpan dengan kondisi keamanan yang memadai dan orang yang tidak berkepentingan dilarang masuk. Label lepas dan bahan cetak lepas lain hendaklah disimpan dan diangkut dalam wadah tertutup untuk menghindarkan kecampurbauran. Bahan pengemas hendaklah diserahkan kepada personil yang berwenang sesuai prosedur tertulis yang disetujui.
h. Pengemasan
Kegiatan pengemasan berfungsi membagi dan mengemas produk ruahan menjadi produk jadi. Pengemasan hendaklah dilaksanakan di bawah pengendalian yang ketat untuk menjaga identitas, keutuhan dan mutu produk akhir yang dikemas.
Semua kegiatan pengemasan hendaklah dilaksanakan sesuai dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam Prosedur Pengemasan Induk. Rincian pelaksanaan pengemasan hendaklah dicatat dalam Catatan Pengemasan Bets.
i. Pengawasan Selama Proses
Untuk memastikan keseragaman bets dan keutuhan obat, prosedur tertulis yang menjelaskan pengambilan sampel, pengujian atau pemeriksaan yang harus dilakukan selama proses dari tiap bets produk hendaklah dilaksanakan sesuai dengan metode yang telah disetujui oleh kepala bagian Manajemen Mutu (Pemastian Mutu) dan hasilnya dicatat. Pengawasan tersebut dimaksudkan untuk memantau hasil dan memvalidasi kinerja dari proses produksi yang mungkin menjadi penyebab variasi karakteristik produk dalam-proses.
Di samping itu, pengawasan selama-proses hendaklah mencakup, tapi tidak terbatas pada prosedur umum sebagai berikut:
1. Semua parameter produk, volume atau jumlah isi produk hendaklah diperiksa pada saat awal dan selama proses pengolahan atau pengemasan; dan
2. Kemasan akhir hendaklah diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam Prosedur Pengemasan Induk.
j. Karantina dan Penyerahan Produk Jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Prosedur tertulis hendaklah mencantumkan cara penyerahan produk jadi ke area karantina, cara penyimpanan sambil menunggu pelulusan, persyaratan yang diperlukan untuk memperoleh pelulusan, dan cara pemindahan selanjutnya ke gudang produk jadi.
Selama menunggu pelulusan dari bagian Manajemen Mutu (Pemastian Mutu), seluruh bets/lot yang sudah dikemas hendaklah ditahan dalam status karantina.
2.2.7 Pengawasan Mutu (Badan Pengawas Obat dan Makanan, 2012)
Pengawasan Mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya.
Pengawasan Mutu mencakup pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan, dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, sampai mutunya telah dibuktikan memenuhi persyaratan.
Pengawasan Mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan Pengawasan Mutu dari Produksi dianggap hal yang fundamental agar Pengawasan Mutu dapat melakukan kegiatan dengan memuaskan.
15
Universitas Indonesia Tiap pemegang izin pembuatan harus mempunyai Bagian Pengawasan Mutu. Bagian ini harus independen dari bagian lain dan di bawah tanggung jawab dan wewenang seorang dengan kualifikasi dan pengalaman yang sesuai, yang membawahi satu atau beberapa laboratorium. Sarana yang memadai harus tersedia untuk memastikan bahwa segala kegiatan Pengawasan Mutu dilaksanakan dengan efektif dan dapat diandalkan.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian Pengawasan Mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan.
Sebelum meluluskan bahan awal atau bahan pengemas untuk digunakan, kepala bagian Pengawasan Mutu hendaklah memastikan bahwa bahan tersebut telah diuji kesesuaiannya terhadap spesifikasi untuk identitas, kekuatan, kemurnian dan parameter mutu lain.
Setelah dipasarkan, stabilitas produk jadi hendaklah dipantau menurut program berkesinambungan yang sesuai, yang memungkinkan pendeteksian semua masalah stabilitas (misal perubahan pada tingkat impuritas, atau profil disolusi) yang berkaitan dengan formula dalam kemasan yang dipasarkan.
2.2.8 Inspeksi Diri, Audit Mutu dan Audit&Persetujuan Pemasok (Badan Pengawas Obat dan Makanan, 2012)
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara obyektif. Manajemen hendaklah membentuk tim inspeksi diri yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB. Audit independen oleh pihak ketiga juga dapat bermanfaat.
Inspeksi diri hendaklah dilakukan secara rutin dan, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi
penolakan yang berulang. Semua saran untuk tindakan perbaikan agar dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan manajemen mutu tersebut. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau suatu tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
Kepala Bagian Manajemen Mutu (Pemastian Mutu) hendaklah bertanggung jawab bersama bagian lain yang terkait untuk memberi persetujuan pemasok yang dapat diandalkan memasok bahan awal dan bahan pengemas yang memenuhi spesifikasi yang telah ditentukan.
2.2.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk (Badan Pengawas Obat dan Makanan, 2012)
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat harus dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif.
Tiap keluhan yang menyangkut kerusakan produk hendaklah dicatat yang mencakup rincian mengenai asal-usul keluhan dan diselidiki secara menyeluruh dan mendalam. Kepala bagian Pengawasan Mutu hendaklah dilibatkan dalam pengkajian masalah tersebut.
Jika produk pada suatu bets ditemukan atau diduga cacat, maka hendaklah dipertimbangkan untuk memeriksa bets lain untuk memastikan apakah bets lain juga terpengaruh. Khusus bets yang mengandung hasil pengolahan ulang dari bets yang cacat hendaklah diselidiki.
Setelah melakukan penyelidikan dan evaluasi terhadap laporan dan keluhan mengenai suatu produk hendaklah dilakukan tindak lanjut. Tindak lanjut ini mencakup:
17
Universitas Indonesia a. Tindakan perbaikan bila diperlukan;
b. Penarikan kembali satu bets atau seluruh produk akhir yang bersangkutan; c. Tindakan lain yang tepat.
Badan POM hendaklah diberitahukan apabila industri farmasi mempertimbangkan tindakan yang terkait dengan kemungkinan kesalahan pembuatan, kerusakan produk, pemalsuan atau segala hal lain yang serius mengenai mutu produk. Operasi penarikan kembali hendaklah mampu untuk dilakukan segera dan tiap saat.
Ada beberapa hal yang perlu diperhatikan dalam Pelaksanaan Penarikan Kembali
a. Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan;
b. Pemakaian produk yang berisiko tinggi terhadap kesehatan, hendaklah dihentikan dengan cara embargo yang dilanjutkan dengan penarikan kembali dengan segera. Penarikan kembali hendaklah menjangkau sampai tingkat konsumen;
c. Sistem dokumentasi penarikan kembali produk di industri farmasi, hendaklah menjamin bahwa embargo dan penarikan kembali dilaksanakan secara cepat, efektif dan tuntas; dan
d. Pedoman dan prosedur penarikan kembali terhadap produk hendaklah dibuat untuk memungkinkan embargo dan penarikan kembali dapat dilakukan dengan cepat dan efektif dari seluruh mata rantai distribusi. Produk yang ditarik kembali hendaklah diberi identifikasi dan disimpan terpisah di area yang aman sementara menunggu keputusan terhadap produk tersebut. Perkembangan proses penarikan kembali hendaklah dicatat dan dibuat laporan akhir, termasuk hasil rekonsiliasi antara jumlah produk yang dikirim dan yang ditemukan kembali. Efektivitas penyelenggaraan penarikan kembali hendaklah dievaluasi dari waktu ke waktu.
2.2.10 Dokumentasi (Badan Pengawas Obat dan Makanan, 2012)
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu.
Dokumen Produksi Induk, Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk (Formula Pembuatan, Instruksi Pengolahan dan Instruksi Pengemasan) menyatakan seluruh bahan awal dan bahan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan.
Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian, dan pengoperasian peralatan. Catatan menyajikan riwayat tiap bets produk, termasuk distribusinya dan semua keadaan yang relevan yang berpengaruh pada mutu produk akhir.
Dokumen hendaklah dikaji ulang secara berkala dan dijaga agar selalu mutakhir. Bila suatu dokumen direvisi, hendaklah dijalankan suatu sistem untuk menghindarkan penggunaan dokumen yang sudah tidak berlaku secara tidak sengaja.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak (Badan Pengawas Obat dan Makanan, 2012)
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindarkan kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
19
Universitas Indonesia Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas yang menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
2.2.12 Kualifikasi dan Validasi (Badan Pengawas Obat dan Makanan, 2012) CPOB menguraikan prinsip kualifikasi dan validasi yang dilakukan di industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian risiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Validasi adalah suatu tindakan pembuktian dengan cara yang sesuai bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi dan pengawasan akan senantiasa mencapai hasil yang diinginkan. Validasi diklasifikasikan menjadi tiga, yakni validasi pembersihan, validasi metode analisis, dan validasi proses.
Validasi pembersihan adalah tindakan pembuktian yang didokumentasikan bahwa prosedur pembersihan yang disetujui akan senantiasa menghasilkan peralatan bersih yang sesuai untuk pengolahan obat. Validasi proses adalah tindakan pembuktian yang didokumentasikan bahwa proses yang dilakukan dalam batas parameter yang ditetapkan dapat bekerja secara efektif dan memberi hasil yang dapat terulang untuk menghasilkan produk jadi yang memenuhi spesifikasi dan atribut mutu yang ditetapkan sebelumnya.
Kualifikasi adalah kegiatan pembuktian bahwa perlengkapan, fasilitas, atau sistem yang digunakan dalam suatu proses/sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten. Kualifikasi diklasifikasikan menjadi empat, yaitu kualifikasi desain, kualifikasi instalasi, kualifikasi operasional, dan kualifikasi kinerja.
Kualifikasi desain adalah dokumen yang memverifikasikan bahwa desain dari fasilitas, sistem dan peralatan sesuai untuk tujuan yang diinginkan. Kualifikasi Instalasi adalah dokumentasi yang memverifikasikan bahwa seluruh aspek kunci dari instalasi peralatan atau sistem telah sesuai dengan tujuan desainnya dan mengikuti rekomendasi yang diberikan oleh industri pembuat. Kualifikasi Kinerja adalah dokumentasi yang memverifikasikan bahwa fasilitas, sistem dan peralatan, yang telah terpasang dan difungsikan, dapat bekerja secara efektif dan memberi hasil yang dapat terulang, berdasarkan metode proses dan spesifikasi yang disetujui. Kualifikasi Operasional adalah dokumentasi yang memverifikasikan bahwa seluruh fasilitas, sistem dan peralatan yang telah diinstalasi atau dimodifikasi berfungsi sesuai rancangan pada rentang operasional yang diantisipasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara. Protokol validasi tertulis hendaklah dibuat untuk merinci kualifikasi dan validasi yang akan dilakukan. Protokol hendaklah dikaji dan disetujui oleh kepala bagian Manajemen Mutu (Pemastian Mutu). Hendaklah dibuat laporan yang mengacu pada protokol kualifikasi dan atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan.
21 Universitas Indonesia
BAB 3
TINJAUAN KHUSUS PT MERCK TBK
3.1 Latar Belakang Perusahaan
PT. Merck Tbk. merupakan industri farmasi dengan berbagai produk yang dikenal dan diproduksi di seluruh dunia. Produk yang dihasilkan oleh PT. Merck Tbk dimulai dari obat-obatan inovatif baik kimia maupun biologis dan produk OTC (Over The Counter) hingga produk kristal cair serta pigmen produksi PT. Merck Tbk. yang digunakan untuk bahan pelapis, plastik dan juga industri percetakan, serta produk dan jasa untuk penelitian farmasi dan bioteknologi. Operasional bisnis PT. Merck Tbk. dikelola di bawah naungan perusahaan induk, Merck KGaA yang memiliki kantor pusat di Darmstadt, Jerman (PT. Merck Tbk., 2013).
Sejak tahun 1917, bekas kantor cabang perseroan di Amerika Serikat yaitu Merck & Co telah berubah menjadi perusahaan yang terpisah dari Grup Merck. Di Indonesia sendiri, PT. Merck Tbk. yang dapat disebut juga perseroan, merupakan pemain utama dalam industri farmasi dan bahan kimia yang telah cukup dikenal di masyarakat. Dalam bidang bisnis farmasi, Perseroan memasarkan produk obat bebas/OTC melalui Divisi Kesehatan Konsumen dan juga obat-obat untuk peresepan melalui Divisi Obat Resep Merck Serono. Merek yang dipasarkan oleh perseroan Merck ini di Indonesia merupakan produk yang telah diterima dan dipercaya oleh konsumen serta praktisi medis, contohnya Sangobion dan Neurobion. Perseroan Merck juga merupakan salah satu pemimpin pasar pada bidang produk terapi yang berhubungan dengan fertilitas, diabetes, neurologis dan juga kardiologis (PT. Merck Tbk., 2013)
3.2 Lokasi dan Tata Letak Bangunan
PT. Merck Tbk. yang merupakan afiliasi dari Merck KGaA, Jerman, di Indonesia, Perseroan berkedudukan dan berlokasi di Jl. TB Simatupang No 8, Pasar Rebo Jakarta Timur sebagai kantor pusat, pabrik dan juga divisi pemasaran bahan kimia. Sedangkan untuk divisi pemasaran farmasi dilaksanakan di
Perkantoran Hijau Arkadia F Tower 15th floor, di Jl TB Simatupang Kav 88, Pasar Minggu, Jakarta Selatan (PT. Merck Tbk., 2013).
PT. Merck Tbk. Yang berlokasi di daerah Pasar Rebo sendiri terbagi menjadi 3 gedung utama, yaitu (PT. Merck Tbk., 2013):
1. Gedung pertama terdiri dari daerah produksi divisi Plant (produksi dan packaging) gudang bahan baku (raw material), bahan pengemas (Packaging material) dan obat jadi (Finished good), ruang laboratorium pengawasan mutu, Ruang Plant director, ruang SCM, Ruang Quality
Assurance Manager, ruang Quality Control Manager, Ruang Product Development Manager, Ruang Enginering Manager, Ruang Workshop,
dan Kantin.
2. Gedung kedua terdiri dari ruang produksi bahan baku baku Tiamin disulfide yang sejak 2006 sudah tidak beroperasi lagi, dan digunakan untuk laboratorium Product Development.
3. Gedung ketiga terdiri dari ruang kantor untuk Divisi Finance, Divisi HR & GA, Divisi EQ (Enviromental Quality), Divisi Chemical, Divisi Merck Serono, Divisi CHC, dan Ruang IT manager.
3.3 Visi dan Misi PT. Merck Tbk. (Merck KGaA, 2013)
3.3.1 Visi PT. Merck Tbk.
PT. Merck Tbk. akan dihargai oleh seluruh pemegang kepentingan karena kesuksesan PT. Merck Tbk. yang berkelanjutan, berkesinambungan, dan di atas pangsa pasar pada bidang usaha yang PT. Merck Tbk. Jalankan (PT. Merck Tbk., 2013)
3.3.2 Misi PT. Merck Tbk.
PT. Merck Tbk. memberikan nilai tambah bagi :
1. Pelanggan PT. Merck Tbk., melalui perluasan kesempatan pada usaha mereka dalam jangka panjang, membentuk kemitraan yang saling menguntungkan.
2. Konsumen PT. Merck Tbk., melalui penyediaan produk-produk yang aman dan bermanfaat
23
Universitas Indonesia 3. Pemegang saham PT. Merck Tbk., melalui pencapaian hasil usaha yang
berkesinambungan dan berarti
4. Karyawan PT. Merck Tbk., melalui penciptaan lingkungan kerja yang aman, dan pemberian kesempatan yang sama bagi semua
5. Lingkungan PT. Merck Tbk., melalui teladan yang PT. Merck Tbk. berikan dalam bentuk tindakan perlindungan dan dukungan bagi masyarakat sekitar.
3.4 Filosofi dan Nilai Utama Perusahaan
Sebagai perusahaan farmasi dan bahan kimia terkemuka, terpercaya dan juga bereputasi internasional, Merck berhasil meraih posisi terdepan dalam upaya peningkatan kesehatan, kesejahteraan dan juga kesempatan untuk hidup dari setiap mahluk hidup, mengingat bahwa industri farmasi dan juga bahan kimia memiliki peranan yang penting dalam kehidupan manusia. Dengan reputasi dan tradisi Merck yang telah terbina dari generasi ke generasi, Merck mengartikan konsep „kesinambungan‟ sebagai suatu komitmen untuk mempertahankan kemampuan dalam persaingan bisnis dengan berfokus pada inovasi (PT. Merck Tbk., 2013).
Dalam waktu yang sama, PT. Merck Tbk. juga bersandar pada filosofi „perubahan‟, yaitu dengan menjalankan strategi visioner dan memulai proses transformasi yang tanpa henti. Proses transformasi yang dimaksud disini mencakup perubahan ide, persepsi dan juga pendekatan serta terus mengembangkan dan melaksanakan filosofi „pertumbuhan‟ secara organik dan berbasis nilai-nilai perseroan untuk mencapai pertumbuhan yang terus berkelanjutan (PT. Merck Tbk., 2013).
PT. Merck Tbk. sendiri memiliki 6 nilai perusahaan yang menjadi dasar dalam mengambil keputusan yaitu (PT. Merck Tbk., 2013):
1. Keberanian - membuka pintu menuju masa depan
a. Keberanian membutuhkan kepercayaan akan kemampuan diri. b. Keberanian memberikan persepsi diri yang sehat.
c. Keberanian mendukung kompetensi yang dibutuhkan untuk melaksanakan keputusan dalam proses perubahan.
d. Keberanian berarti menantang diri sendiri.
e. Keberanian dalam membuka diri terhadap ide-ide baru 2. Pencapaian memungkinkan kesuksesan
a. Pencapaian membentuk kemampuan individu dan kewirausahaan. b. Pencapaian menantang dan mempromosikan karyawan PT. Merck Tbk. c. Pencapaian mendukung pengembangan personal karyawan PT. Merck
Tbk.
d. Pencapaian dapat diukur dari hasil yang diperoleh e. Pencapaian memastikan kemandirian usaha 3. Menghargai landasan bagi segala hubungan
a. Menghargai didasari oleh konsep kemanusiaan dan martabat manusia. b. Menciptakan atmosfer saling menghargai, adil dan pemberian pengakuan. c. Menghargai membutuhkan komunikasi yang terbuka jujur.
d. Menghargai memungkinkan bekerja dengan beragam budaya dan dengan orang-orang yang berbeda.
e. Menghargai berarti menghargai sebuah pencapaian kemarin, hari ini, dan esok.
4. Tanggung jawab menentukan tindakan bisnis PT. Merck Tbk.
a. Tanggung jawab mendasari sikap PT. Merck Tbk. kepada pelanggan, karyawan, investor, dan penyedia layanan.
b. Tanggung jawab berarti memperlakukan sumber daya alam kita dengan perhatian dan melindungi lingkungan kita dengan tingkat kewaspadaan yang tinggi.
c. Tanggung jawab menentukan keputusan usaha yang PT. Merck Tbk. junjung bersama-sama.
d. Tanggung jawab berarti memberikan contoh yang baik.
e. Tanggung jawab mengarah pada sebuah pengakuan dan penerimaan terhadap aktivitas bisnis PT. Merck Tbk.
5. Integritas menjamin kredibilitas PT. Merck Tbk.
a. Integritas merupakan landasan yang menjadikan PT. Merck Tbk. dapat dipercaya oleh semua orang.
25
Universitas Indonesia b. Integritas membuat PT. Merck Tbk. melakukan apa yang PT. Merck Tbk.
katakan.
c. Integritas mewajibkan PT. Merck Tbk. untuk menepati janji. d. Integritas juga berarti mampu mengatakan tidak.
e. Integritas berarti hanya mengizinkan interaksi dan perjanjian yang sesuai dengan nilai-nilai perusahaan PT. Merck Tbk.
6. Transparansi menumbuhkan saling percaya
a. Transparansi adalah keterlibatan seluruh pemegang saham melalui penyampaian informasi.
b. Transparansi membuat tindakan PT. Merck Tbk. dapat dimengerti.
c. Transparansi mendukung sikap yang berorientasi tujuan, di seluruh perusahaan.
d. Transparansi menciptakan keandalan.
e. Transparansi mendukung terciptanya tanggung jawab oleh seluruh karyawan.
3.5 Organisasi Divisi Manufaktur Perusahaan
3.5.1 Quality Assurance/Quality Control (QA/QC) 3.5.1.1Quality Assurance
Mutu dan kualitas built in product merupakan tanggung jawab seluruh karyawan, dimana produk yang dihasilkan harus mempunyai mutu dan kualitas yang sesuai dengan standar mutu yang ditetapkan meliputi khasiat, efikasi dan keamanan obat yang dihasilkan. Peran dari departemen QA di PT. Merck Tbk. dalam produksi obat yaitu menjamin obat yang dibuat dan diedarkan memenuhi persyaratan CPOB dan juga sesuai dengan spesifikasi standar yang ditetapkan. Pengendalian mutu dilakukan terhadap semua faktor yang dapat mempengaruhi mutu obat, yaitu mulai dari bahan awal, bahan pengemas, proses pembuatan, produk jadi, bangunan, peralatan, dan personalia yang terlibat dalam proses produksi (PT. Merck Tbk., 2013).
Departemen QA di PT. Merck Tbk. melakukan tugas – tugasnya yang meliputi (PT. Merck Tbk., 2013):
Inspeksi diri dilakukan untuk menilai apakah semua kegiatan telah melaksanakan CPOB dengan sebaik – baiknya. Inspeksi diri yang dilakukan antara lain inspeksi terhadap karyawan, kalibrasi alat, bangunan, penyimpanan peralatan, proses produksi, pengawasan mutu, serta pemeliharaan gedung.
b. Melaksanakan kegiatan validasi
Validasi merupakan program terdokumentasi yang memberikan jaminan tingkat tinggi bahwa suatu fasilitas atau operasi akan terus-menerus menghasilkan produk yang memenuhi spesifikasi yang telah ditetapkan sebelumnya. Validasi harus selalu dikaji ulang agar selalu up to date sehingga meyakinkan bahwa fasilitas atau operasi yang ada dapat menghasilkan produk yang memenuhi spesifikasi yang diinginkan. Validasi meliputi fasilitas/sistem, peralatan, prosedur analisis, proses produksi dan lain –lain sesuai dengan Rencana Induk Validasi (RIV). Ruang lingkup validasi proses produksi meliputi Prospective, Retrospective, dan Concurrent Validation.
c. In Process Control (IPC)
QA bertugas melaksanakan pengawasan mutu selama proses produksi berlangsung. Pemeriksaan dilakukan pada tiap tahap produksi, sesuai dengan yang tercantum pada dokumen MWS (Manufacturing Work Sheet) dan PWS (Packaging Work Sheet). Pada In Process Control beberapa hal yang diperiksa meliputi :
1. Granul yaitu penampilan fisik, kadar air, susut pengeringan, dan ukuran partikel.
2. Tablet yaitu penampilan fisik, keseragaman bobot, friability, kekerasan,
disolusi, waktu hancur, pemeriksaan kebocoran strip dan blister.
3. Kapsul yaitu penampilan fisik, keseragaman bobot, panjang kapsul, dan waktu hancur.
4. Sirup yaitu penampilan fisik, pH, kekerasan tutup/torque, viskositas, dan volume.
5. Krim yaitu penampilan fisik dan ukuran partikel.
27
Universitas Indonesia Pemeriksaan IPC pada saat pengemasan yaitu meliputi kelengkapan PWS, pemeriksaan kesesuaian nomor bets, QC number serta tanggal daluarsa pada box/label dengan PWS serta kejelasan label atau informasi sehingga dapat dan mudah dibaca.
d. Menyiapkan dan memeriksa dokumen atau formulir teknis untuk registrasi obat, baik obat lokal maupun ekspor.
e. Pusat pengendalian dokumentasi
f. Departemen QA merupakan pelaksana pengendalian dokumen.
Pengendalian dokumen tersebut dilakukan dengan cara memeriksa semua dokumen yang diterbitkan oleh departemen lain yang masih berhubungan dengan proses produksi dan pemasaran produk.
g. Pengendalian perubahan dimana setiap perubahan yang menyangkut proses, material, fasilitas, alat, dokumen dan lain – lain yang berhubungan dengan produk akan ditangani dengan sistem pengendalian perubahan yang dikoordinasikan oleh QA.
h. Pemeriksaan Packaging Material dimana departeman QA akan memastikan kesesuaian dengan melakukan pemeriksaan dan pelulusan
packaging material.
i. Melakukan kualifikasi untuk setiap perubahan bahan baku atau bahan pengemas.
j. Pelatihan atau training CPOB k. Pengkajian produk tahunan
l. Audit eksternal untuk vendor atau Third Party Manufacturing.
m. Pemeriksaan catatan produksi (MWS dan PWS) serta hasil pengujian akhir (Laporan analisa) untuk meluluskan produk jadi ke pasaran
n. Penanganan keluhan produk dan produk kembalian.
Dalam menjalankan tugas utama tersebut, kegiatan departemen QA meliputi (PT. Merck Tbk., 2013):
a. Mengelola dan mengontrol SOP (Standard Operational Procedure) b. GMP auditing, inspeksi diri dan inspeksi eksternal
d. Memonitor program kalibrasi di pabrik e. Menangani keluhan produk.
3.5.1.2 Quality Control (QC) Department
Pengawasan mutu merupakan bagian yang sangat penting dari rangkaian penerapan CPOB, karena pengawasan mutu berkaitan dengan jaminan mutu suatu produk obat jadi yang dihasilkan oleh industri farmasi. Adapun tujuan dari pengawasan ini adalah agar obat yang dihasilkan memenuhi persyaratan mutu yang ditetapkan oleh peraturan yang berlaku. Departemen QC dibagi menjadi 2 bagian, yaitu (PT. Merck Tbk., 2013):
a. Bagian Finished Goods dan Stabilitas b. Bagian Raw Material dan Lab Mikrobiologi
Tugas utama bagian pengawasan mutu adalah melaksanakan kegiatan pengambilan contoh dan pemeriksaan bahan baku dan bahan pengemas, pelulusan bahan baku dan bahan pengemas berdasarkan spesifikasi yang telah ditentukan. Adapun tanggung jawab bagian pengawasan mutu dapat diuraikan menjadi (PT. Merck Tbk., 2013):
a. Bertanggung jawab untuk memantau dan memeriksa bahan baku dan bahan pengemas secara kimia, mikrobiologi atau fisika
b. Bertanggung jawab untuk pemantauan air dan lingkungan.
c. Bertanggung jawab atas kegiatan yang berlangsung laboratorium analisis, dan penyimpanan contoh pertinggal dan dokumen pengawasan mutu. d. Bertanggung jawab untuk melaksanakan kalibrasi internal secara berkala
terhadap alat ukur / instrument laboratorium QC
e. Bertanggung jawab membuat jadwal pelaksanaan validasi metode analisis, membuat protocol, laporan validasi dan melaporkannya kepada QA manager.
Dalam melaksanakan tugas utama tersebut, kegiatan departemen QC meliputi (PT. Merck Tbk., 2013):
a. Mengambil sampel dari bahan baku dan bahan pengemas b. Memeriksa semua sampel sesuai dengan spesifikasinya c. Pemeriksaan air
29
Universitas Indonesia d. Pemeriksaan limbah
e. Uji kebersihan ruangan secara mikrobiologi f. Uji stabilitas
g. Validasi metode analisis
h. Mengkalibrasi semua peralatan QC
i. Memeriksa dan menyimpan laporan analisis baik itu bahan baku maupun produk jadi.
j. Memeriksa dan menyimpan Certificate of Analysis dari supplier.
Departemen QC secara garis besar dibagi menjadi 3 laboratorium yang terpisah yaitu (PT. Merck Tbk., 2013):
a. Laboratorium kimia farmasi
Laboratorium kimia farmasi merupakan tempat pengujian produk berdasarkan analisis kualitatif dan kuantitatif dari produk yang meliputi pemeriksaan bahan baku, bahan kemas dan produk jadi. Pengambilan sampel bahan baku dilakukan di ruangan sampling yang dilengkapi dengan LAF, untuk bahan pengemas dilakukan di ruang sampling packing yang keduanya terdapat di gudang. Pengambilan sampel bahan baku menggunakan rumus (√n + 1) dan
military standard , sedangkan untuk identifikasi diambil dari seluruh wadah, di
mana n adalah jumlah wadah yang datang.
Setelah pengambilan sampel, setiap bahan awal diuji apakah sudah memenuhi persyaratan yang telah ditetapkan. Apabila bahan baku dan pengemas tersebut memenuhi spesifikasi yang telah ditetapkan, bahan baku dan bahan pengemas tersebut direlease di sistem SAP, tetapi jika tidak memenuhi spesifikasi yang telah ditetapkan, bahan baku dan bahan pengemas tersebut diberi label ditolak/rejected berwarna merah kemudian akan diproses di SAP untuk dikembalikan kepada supplier atau dimusnahkan. Pemeriksaan packaging
material meliputi pemeriksaan bahan pengemas primer dan bahan pengemas
sekunder. Pemeriksaan yang dilakukan sesuai dengan spesifikasi dan metode analisis masing – masing bahan.
Pengujian stabilitas untuk produk rutin juga merupakan salah satu program yang dilakukan oleh departemen QC untuk mengetahui sifat stabilitas periodik obat jadi dan untuk menentukan kondisi penyimpanan yang cocok serta tanggal
daluarsa obat tersebut. Uji stabilitas dilakukan dengan cara mengambil beberapa sampel dari batch produksi, sampel tersebut disimpan pada suhu yang sesuai dengan prosedur dan stabilitasnya dipantau melalui pemeriksaan fisik, kimia dan mikrobiologi (jika perlu) dalam waktu yang telah ditetapkan. Uji stabilitas ada 2 yaitu uji stabilitas dipercepat (pada temperature 40 ± 2oC dan kelembaban relative 75 ± 5%) selama 6 bulan; dan uji stabilitas jangka panjang (pada ruang bertemperatur 25oC / 60% RH dan 30oC / 75% RH) hingga akhir shelf life. Obat jadi yang sudah dikemas dalam box disimpan dalam Stability chamber atau ruangan khusus untuk uji stabilitas. Setiap periode uji dilakukan pemeriksaan sesuai protokol uji stabilitas baik pemeriksaan fisik, kimia maupun mikrobiologi (jika perlu). Hasil dicatat dalam laporan stabilitas.
b. Laboratorium Mikrobiologi
Laboratorium Mikrobiologi merupakan suatu tempat untuk melakukan pengujian yang berkaitan dengan mikrobiologi, antara lain dilaksanakan pada uji sterilisasi sediaan steril, uji batas mikroba dan monitoring kebersihan produksi. Laboratorium ini dilengkapi dengan dua LAF yaitu satu untuk uji sterilitas di mana di dalamnya terdapat personal airlock dan material airlock, dan yang lainnya berada di ruang untuk pemeriksaan uji batas bakteri/jamur.
c. Laboratorium Instrumentasi
Laboratorium Instrumentasi QC dilengkapi dengan fasilitas instrumen analisis antara lain KCKT, Spektrofotometri IR, Spektrofotometri UV-Vis,
hardness tester, karl fischer, friability tester, melting point, rotavapor dan
timbangan analitik. Instrumen tersebut digunakan untuk menguji kadar obat serta uji identitas obat.
3.5.2 Product Development Departement
Product Development Departement merupakan bagian dari Divisi Plant
dan memiliki tugas melakukan penelitian, mengevaluasi dan mengembangkan formula baru dan memperbaiki formula yang sudah beredar serta memperbaiki dan melakukan pengembangan packaging untuk produk baru dan produk yang sudah beredar.
31
Universitas Indonesia
Product Development terdiri dari 3 bagian, yaitu (PT. Merck Tbk., 2013):
a. Galenic Development
Galenic Development memiliki fungsi melakukan penelitian dan
pengembangan, mengevaluasi dan mendesain serta memperbaiki formula baru atau formula yang sudah beredar.
Tahap – tahap yang dilaksanakan dalam penyusunan dan pengembangan formula baru meliputi :
1. Tahap Praformulasi
Pada tahap ini Galenic Development meneliti sifat – sifat fisika dan kimia dari bahan baku, bahan tambahan, serta melakukan penelitian terhadap produk sejenis.
2. Tahap Formulasi dalam Skala Laboratorium
Pada tahap ini Galenic Development menyusun formula dengan berbagai komposisi maupun jenis bahan baku yang digunakan dalam skala laboratorium yaitu 1% dari bets komersial.
3. Tahap Formulasi dalam Skala Pilot
Pada tahap ini Galenic Development menyusun formula dengan berbagai komposisi maupun jenis bahan baku yang digunakan dalam skala pilot yaitu 10% bets komersial.
4. Tahap Pengujian Stabilitas
Formula yang telah disusun akan dicoba dan diteliti lebih lanjut melalui tes stabilitas fisik dan kimia misal : perubahan warna, waktu hancur, dan kadar obat selama penyimpanan.
5. Tahap Transfer ke Produksi Komersial/ Skala Produksi
Pada tahap ini Galenic Development melakukan tahap transfer formulasi ke produksi komersial bekerja sama dengan departemen produksi dan QA yang dilakukan minimal 3 bets bersamaan dilakukannya validasi proses pembuatan produk
b. Analytical Development
Analytical Development memiliki fungsi sebagai berikut :
1. Mengembangkan dan memvalidasi metode pengujian yang digunakan untuk memeriksa sampel hasil pengembangan produk