PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT Sargassum hystrix v. buxifolium (Chauvin) J. Agardh SECARA SPEKTROFOTOMETRI METODE FOLIN-CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Maria Stephanie NIM: 048114082
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT Sargassum hystrix v. buxifolium (Chauvin) J. Agardh SECARA SPEKTROFOTOMETRI METODE FOLIN-CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Maria Stephanie NIM: 048114082
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
ii
Penelitian untuk Skripsi
PENETAPAN KADAR FLOROTANIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT Sargassum hystrix v. buxifolium (Chauvin) J. Agardh SECARA SPEKTROFOTOMETRI METODE FOLIN-CIOCALTEAU
Yang diajukan oleh:
Maria Stephanie NIM: 048114082
telah disetujui oleh :
Pembimbing Utama:
Ign. Y. Kristio Budiasmoro, M.Si. Tanggal:
iv
“ Life is opportunity, benefit from it
Life is beauty, admire it
Life is a dream, realize it
Life is a challenge, meet it
Life is a duty, complete it
Life is a game, play it
Life is a promise, fulfill it
Life is sorrow, overcome it
Life is song, sing it
Life is struggle, accept it
Life is tragedy, confront it
Life is an adventure, dare it
Life is luck, make it
Life is too precious, don’t destroy it
Life is life, fight it”
(Mother Theresa)
Kupersembahkan
karya
ini
untuk:
Papa Nyo, Mama Sien, dan adikku,,
Hanny yang setia mendukungku,
menemani di saat senang dan sedih,
Sahabat-sahabatku, yang
memberikan keceriaan dalam
hidupku,
Almamater tercinta,
Semua yang membaca skripsi ini,..
Terima kasih banyak... (^-^)
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Maria Stephanie
Nomor Mahasiswa : 048114082
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“Penetapan Kadar Florotanin dalam Fraksi Etil Asetat Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh secara Spektrofotometri Metode Folin-Ciocalteau”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 18 Juli 2008
Yang menyatakan
(Maria Stephanie)
vi
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia dan kebaikan yang telah diberikan-Nya sehingga penulis dapat menyelesaikan penulisan skripsi berjudul “Penetapan Kadar Florotanin dalam Fraksi Etil Asetat Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. secara Spektrofotometri Metode Folin-Ciocalteau”. Skripsi ini disusun guna memenuhi salah satu syarat untuk memperoleh gelar Sarjana
Farmasi (S. Farm.) pada Fakultas Farmasi Universitas Sanata Dharma. Selama penulisan skripsi ini, penulis telah banyak mendapatkan bantuan
dan dukungan dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan rasa terima kasih yang sebesar-besarnya kepada:
1. Rita Suhadi, M. Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ign.Y. Kristio Budiasmoro, M.Si. selaku dosen pembimbing utama yang telah meluangkan waktu dan tenaga untuk memberikan bimbingan, saran, dan dorongan yang tak pernah habis mulai dari penyusunan proposal hingga terselesaikannya skripsi ini.
3. Christine Patramurti, M. Si., Apt., dan Erna Triwulandari, M.Si., Apt. selaku dosen penguji yang telah meluangkan waktu untuk memberikan masukan dan saran selama penelitian.
4. Dra. A. Nora Iska H., M. Si., Apt. selaku dosen pendamping dan penanggungjawab proyek penelitian payung yang telah menyediakan waktu
dan tenaga untuk ikut menemani selama penelitian, memberikan saran, masukan, dan dorongan selama penyusunan skripsi.
5. Dr. Sabikis, Apt. yang telah memberikan saran, masukan, dan dukungan selama penelitian dan penyusunan skripsi.
6. Lucia Wiwid Wijayanti, M. Si., yang telah memberikan saran, masukan, dan dorongan selama penelitian dan penyusunan skripsi.
7. Abdul Razaq Chasani, M. Si., dan Dr. Rina Sri Kasiamdari dari Laboratorium Taksonomi Tumbuhan Fakultas Biologi Universitas Gadjah Mada Yogyakarta yang telah membantu mengidentifikasi alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
8. Teman-teman seperjuangan selama penelitian “Tim Alga”, Dewi, Hendry, Angel, Andri, Dipta, dan Elsa yang telah bekerja bersama menyelesaikan penelitian, serta memberikan dorongan dan dukungan selama penyusunan skripsi.
9. Teman-teman tim peneliti Teh, Wortel, Jagung, dan Pulveres yang bekerja bersama di laboratorium.
10. Segenap laboran USD, Pak Prapto, Pak Mukmin, Mas Kunto, Mas Parlan, Mas Sarwanto, Mas Wagiran, Mas Kayat, kepala gudang (Mas Otok), dan Pak Kasiran yang telah membantu penulis selama penelitian di laboratorium.
11. Suster Amandin dan Suster Rachel yang selalu memberikan dorongan, semangat, dan dukungan kepada penulis selama kuliah, penelitian hingga terselesaikannya skripsi ini.
viii
12. Hendry yang telah membantu penulis selama kuliah, penelitian, dan penyusunan skripsi.
13. Teman-teman Fakultas Farmasi angkatan 2004, terutama kelas FST, atas kebersamaan dan keceriaan yang telah dijalani selama ini.
14. Teman-teman sekelompok praktikum, Rike, Bor2, Hendry, Yusak, dan Peter, atas kebersamaannya dan pengalaman-pengalaman yang tak terlupakan selama praktikum.
15. Adik-adik angkatan 2005, 2006, dan 2007, yang memberikan warna tersendiri dalam hari-hari penulis.
16. Saudara-saudaraku, Ce Sisil, Ce Lisa, Maria, Ko Benad, Ce Ellen, Christin, Loren, yang memberikan dukungan dan semangat selama penyusunan skripsi. 17. Semua pihak yang tak dapat penulis sebutkan satu per satu yang telah
membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih terdapat banyak kekurangan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang berguna.
Akhir kata, semoga skripsi ini bermanfaat bagi pihak-pihak yang membutuhkan dan dapat memberikan sumbangsih bagi perkembangan ilmu pengetahuan.
Yogyakarta, April 2008 Penulis
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 16 April 2008 Penulis
Maria Stephanie
x
DAFTAR ISI
Halaman
HALAMAN JUDUL………... ii
HALAMAN PERSETUJUAN PEMBIMBING………... iii
HALAMAN PENGESAHAN………...… iv
HALAMAN PERSEMBAHAN………... v
PRAKATA... viii
PERNYATAAN KEASLIAN KARYA ... xi
DAFTAR ISI... xii
DAFTAR GAMBAR ... xiv
DAFTAR TABEL... xvi
BAB II. PENELAAHAN PUSTAKA... 6
A. Alga Coklat Sargassum ... 6
B. Florotanin ... 8
C. Isolasi Florotanin dari Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.. ... 9
1. Penyarian... 9
2. Separasi ... 11
D. Spektrofotometri UV-Vis... 12
E. Metode Folin-Ciocalteau... 17
F. Keterangan Empiris... 18
BAB III. METODOLOGI PENELITIAN ... 20
A. Jenis Rancangan Penelitian... 20
B. Variabel Penelitian dan Definisi Operasional... 20
1. Variabel penelitian... 20
2. Definisi operasional... 20
C. Bahan dan Alat Penelitian... 21
Preparasi Sampel Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh 2. Uji kualitatif senyawa fenolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh ... 23
a. Preparasi ekstrak... 23
b. Uji tanin dan polifenol... 24
3. Isolasi crude florotanin alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh ... 24
4. ... 25
Optimasi metode spektrofotometri secara kolorimetri dengan pereaksi Folin-Ciocalteau a. Pembuatan larutan standar... 25
b. Penetapan Operating Time (OT)... 26
c. Penentuan panjang gelombang maksimum (λmaks)... 26
d. Pembuatan kurva baku floroglusinol... 27
5. ... 27
Estimasi kadar polifenol total dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh 6. Analisis hasil... 28
a. Analisis hasil uji kualitatif untuk tanin dan polifenol... 28
xii
b.
... 28
Analisis hasil penetapan kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh BAB IV. HASIL DAN PEMBAHASAN ... 29
A. Preparasi Sampel Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 29
B. Uji Kualitatif Senyawa Fenolik Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh ... 34
C. Isolasi Crude Florotanin dari Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 35
1. Penyarian... 35
2. Separasi... 36
D. Prinsip Metode Spektrofotometri secara Kolorimetri dengan Pereaksi Folin-Ciocalteau... 38
E. Optimasi Metode Spektrofotometri secara Kolorimetri dengan Pereaksi Folin-Ciocalteau... 41
1. Penetapan Operating Time (OT)... 41
2. Penentuan panjang gelombang maksimum (λmaks)... ...42
F. Penetapan Kurva Baku Floroglusinol ... 44
H. Estimasi Kadar Florotanin dalam Fraksi Etil Asetat Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. ... 46
BAB V. KESIMPULAN, SARAN, DAN KETERBATASAN ... 48
A. Kesimpulan ... 48
B. Saran... 48
C. Keterbatasan ... 48
DAFTAR PUSTAKA ... 50
LAMPIRAN... 55
BIOGRAFI PENULIS ... 67
DAFTAR GAMBAR
Halaman
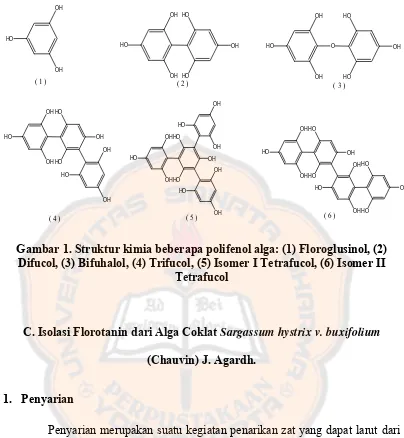
Gambar 1. Struktur kimia beberapa polifenol alga ... 9
Gambar 2. Peralatan sokhlet ... 10
Gambar 3. Oksidasi fenol oleh enzim polifenol oksidase... 31
Gambar 4. Reaksi saat penetapan kadar air dengan Karl Fischer... 33
Gambar 5. Reaksi fenol dengan pereaksi FeCl ...3 ... 35
Gambar 6. Ikatan antara tanin dan gelatin ... 35
Gambar 7. Kesetimbangan reaksi antara bentuk fenol dan ion fenolat ... 39
Gambar 8. Reaksi reduksi asam fosfomolibdat dalam pereaksi Folin-Ciocalteau membentuk kompleks molybdenum blue... ... 40
Gambar 9. Reaksi oksidasi floroglusinol menjadi 2,6-dihidroksi-(1,4)-benzokuinon... ... 40
Gambar 10. Reaksi reduksi-oksidasi floroglusinol dengan pereaksi Folin-Ciocalteau... 40
Gambar 11. Spektra pengukuran Operating Time (OT) dari kompleks molybdenum blue... ... 42
Gambar 12. Spektra panjang gelombang maksimum dari kompleks molybdenum blue yang diukur pada tiga konsentrasi floroglusinol ... 43
Gambar 13. Kurva hubungan konsentrasi floroglusinol dengan absorbansi kompleks molybdenum blue... 46
xiv
DAFTAR TABEL
Halaman Tabel I. Spektrum warna pada daerah visibel... 17 Tabel II. Data hubungan antara konsentrasi floroglusinol dengan absorbansi
kompleks warna molybdenum blue yang terbentuk... ... 45 Tabel III. Kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 47
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat keterangan hasil determinasi spesies alga coklat... 55 Lampiran 2. Hasil perhitungan kadar air serbuk simplisia alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dengan metode Karl Fischer...57 Lampiran 3. Hasil uji kualitatif filtrat ekstrak metanol 80% alga coklat
Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 58 Lampiran 4. Foto uji kualitatif filtrat ekstrak metanol 80% alga coklat
Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 59 Lampiran 5. Vacuum Rotary Evaporator (Buchi) ... 60 Lampiran 6. Foto hasil fraksinasi ekstrak metanol alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh...60 Lampiran 7. Spektra Operating Time (OT) ... 61 Lampiran 8. Spektra hasil scanning λmaks kompleks molybdenum blue pada konsentrasi floroglusinol 1,0 ppm... 61 Lampiran 9. Spektra hasil scanning λmaks kompleks molybdenum blue pada konsentrasi floroglusinol 3,0 ppm... ...62 Lampiran 10. Spektra hasil scanning λmaks kompleks molybdenum blue pada konsentrasi floroglusinol 6,0 ppm... 62 Lampiran 11. Penimbangan baku floroglusinol ... 63 Lampiran 12. Contoh perhitungan kurva baku floroglusinol...63 Lampiran 13. Hasil pembacaan absorbansi kompleks molybdenum blue seri baku
floroglusinol replikasi II pada panjang gelombang maksimum (λmaks) hasil scanning...64 Lampiran 14. Kurva baku floroglusinol ... 64 Lampiran 15. Penimbangan fraksi etil asetat Sargassum hystrix v. buxifolium
(Chauvin) J. Agardh...65 Lampiran 16. Absorbansi kompleks molybdenum blue dari sampel fraksi etil
asetat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh... 65
xvi
Lampiran 17. Contoh perhitungan kadar florotanin dalam fraksi etil asetat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh...65 Lampiran 18. Kadar florotanin dalam fraksi etil asetat Sargassum hystrix v.
buxifolium (Chauvin) J. Agardh... 66
INTISARI
Alga coklat Sargassum banyak tumbuh dan tersebar di perairan Indonesia. Alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. merupakan salah satu kekayaan laut Indonesia yang potensial, namun pemanfaatan alga ini masih belum optimal untuk nutrisi pangan maupun agen biomedis. Alga coklat Sargassum mengandung polifenol sebagai senyawa bioaktif, yaitu florotanin.
Tujuan penelitian ini adalah mendapatkan florotanin dari alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dan menetapkan kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. Ekstraksi dilakukan menggunakan metode sokhletasi dengan menggunakan pelarut metanol p.a. Ekstrak yang diperoleh difraksinasi dengan metanol p.a., kloroform p.a., akuades, dan etil asetat p.a. untuk mendapatkan florotanin.
Konsentrasi florotanin dalam fraksi etil asetat ditetapkan secara spektrofotometri dengan metode Folin-Ciocalteau. Standar yang digunakan adalah floroglusinol dengan seri konsentrasi 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0 ppm dalam pelarut aseton 75 %. Konsentrasi florotanin dihitung ekivalen dengan floroglusinol (mg PE/g fraksi).
Kadar florotanin yang ditetapkan dari tiga kali replikasi sampel yaitu sebesar 5,42 mg PE/g fraksi; 6,32 mg PE/g fraksi; dan 5,36 mg PE/g fraksi, diukur pada panjang gelombang maksimum 750,1 nm dan dihitung menggunakan persamaan kurva baku y = 0,12665 x + 0,0082. Kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. sebesar 5,7 ± 0,54 mg PE/g fraksi.
Kata kunci : alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh., florotanin, metode Folin-Ciocalteau
xviii
ABSTRACT
Sargassum brown algae grow and spread widely in Indonesia marine territorial. Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. is one of Indonesian’s sea treasures that really potential, but not yet optimally used as food nutrition or biomedical agents. Sargassum brown algae contains polyphenols as bioactive substantion, called phlorotannin.
This research’s objective are to get phlorotannin from Sargassum hystrix v. buxifolium (Chauvin) J. Agardh brown algae and to determine phlorotannin concentration in ethyl acetate fraction of Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. brown algae. Extraction have been done by soxhletation method with methanol p.a. solvent. The extract that was gained, then, was fractionated with methanol p.a., chloroform p.a., aquadest and ethyl acetate p.a. to gain phlorotannin.
Phlorotannin concentration in ethyl acetate fraction was determined using spectrophotometric Folin-Ciocalteau method. Standard solution is phloroglucinol that was made in calibration series 0.5; 1.0; 2.0; 3.0; 4.0; 5.0; 6.0 ppm in 75% acetone. Phlorotannin concentration was equivalently calculated with phloroglucinol (mg PE/g fraction).
Phlorotannin concentration in three replications are 5.42 mg PE/g fraction; 6.32 mg PE/g fraction; and 5.36 mg PE/g fraction, measured using 750.1 nm maximum wavelenght and calculated with phloroglucinol’s linear regression equation y = 0.12665x + 0.0082. The phlorotannin concentration in ethyl acetate fraction of Sargassum hystrix v. buxifolium (Chauvin) J. Agardh brown algae is 5.7 ± 0.54 mg PE/g fraction.
Key words : Sargassum hystrix v. buxifolium (Chauvin) J. Agardh brown algae, phlorotannin, Folin-Ciocalteau method
BAB I PENGANTAR
A. Latar Belakang
Di alam telah dikenal ribuan senyawa fenolik yang terbukti mempunyai efek protektif terhadap kerusakan kulit yang diinduksi oleh radiasi UV, seperti asam kafeat, asam ferulat, kuersetin, apigenin, genistein, resveratrol, asam norhidroguaiaretat, asam karnosat, silimarin, polifenol teh, dan tanin (Svobodova et al., 2003).
Eksplorasi senyawa fenolik seperti asam fenolik, flavonoid, dan polifenol untuk mendapatkan agen fotoprotektif baru terus dilakukan. Akan tetapi, eksplorasi tersebut masih mengandalkan tumbuhan-tumbuhan terestrial yang lingkungannya sangat terbatas. Perubahan orientasi dan fokus pengembangan produk alam dari terestrial menjadi pengembangan berbasis kelautan sangat diperlukan, mengingat Indonesia sebagai “the largest marine-mega biodiversity” (Dahuri, 2003). Salah satu contoh kekayaan laut yang berpotensi tinggi adalah alga, yang dikenal dengan rumput laut. Soraya (2005) mengemukakan bahwa di dalam alga coklat terkandung bahan-bahan organik, baik berupa makronutrien maupun mikronutrien seperti polisakarida, hormon, vitamin, dan mineral.
Salah satu mikronutrien dari tumbuhan alga, khususnya alga coklat adalah polifenol yang dikenal sebagai florotanin, merupakan senyawa polifenol yang tidak ditemukan pada tumbuhan terestrial (Burtin, 2003). Beberapa aktivitas biologik florotanin yang telah diteliti adalah antiproliferasi dan antioksidan
(Nakamura et al., 1996; Kang et al., 2005a; Athukorala et al., 2006; Yuan dan Walsh, 2006), antiinflamasi (Shin et al., 2006), inhibitor matriks metalloproteinase (Kim et al., 2006), sitoprotektif terhadap stres oksidatif (Kang et al., 2005b), dan inhibitor HIV-1 reverse transcriptase dan protease (Ahn et al., 2004).
Alga coklat Sargassum hystrix banyak tersebar di perairan Indonesia bagian selatan, seperti di sepanjang pantai selatan Pulau Jawa, Pantai Bali, dan Kupang (Kadi, 2007), namun pemanfaatan alga coklat Sargassum hystrix masih belum optimal. Sejauh ini, pemanfaatan alga coklat Sargassum lebih banyak terfokus pada kandungan alginat dan iodin (Soraya, 2005; Putra, 2006). Burtin (2003) telah mengemukakan bahwa dalam alga coklat terkandung florotanin yang berpotensi untuk dikembangkan menjadi senyawa biomedis. Oleh karena itu, perlu dilakukan penetapan kadar florotanin pada alga coklat agar dapat dimanfaatkan secara optimal sehingga dapat meningkatkan nilai ekonomis alga tersebut.
ekstrak alga berkorelasi positif dengan kandungan total polifenol yang diduga berhubungan dengan kandungan florotanin (Yuan dan Walsh, 2006).
Penelitian mengenai kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. merupakan bagian dari program Hibah A3 Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dan diketuai oleh Dra. Agnes Nora Iska Harnita, M. Si., Apt.
B. Perumusan Masalah
Berdasarkan latar belakang di atas, maka permasalahan penelitian dapat dirumuskan sebagai berikut:
1. Apakah florotanin dapat diisolasi dari alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.?
2. Berapakah kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.?
C. Keaslian Karya
Sepengetahuan peneliti, penelitian mengenai penetapan kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dengan metode Folin-Ciocalteau belum pernah dilakukan.
D. Manfaat Penelitian
1. Manfaat teoritis
Hasil penelitian ini diharapkan mampu memberikan pengetahuan mengenai kadar florotanin pada alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. sehingga dapat dikembangkan menjadi senyawa bioaktif.
2. Manfaat praktis
Hasil penelitian ini diharapkan dapat memberikan sumbangan bagi ilmu pengetahuan mengenai biota laut dan pemanfaatannya, khususnya alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh., dalam industri makanan, farmasi, dan kosmetik.
E. Tujuan Penelitian
1. Tujuan umum:
2. Tujuan khusus:
Memperoleh florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dan mengetahui kadar florotanin dalam alga coklat Sargassum hystix v. buxifolium (Chauvin) J. Agardh. yang diukur secara spektrofotometri menggunakan metode kolorimetri dengan pereaksi Folin-Ciocalteau.
BAB II
PENELAAHAN PUSTAKA
A. Alga Coklat Sargassum
Di perairan Indonesia diperkirakan terdapat lebih dari 15 jenis alga Sargassum dan yang telah dikenal mencapai 12 jenis. Alga Sargassum tumbuh terutama di daerah perairan jernih yang memiliki substrat dasar batu karang, karang mati, batuan vulkanik, dan benda-benda yang bersifat massive yang berada di dasar perairan. Habitat alga Sargassum di perairan dengan kedalaman 0,5 – 10 m. Marga ini tumbuh subur pada daerah tropis dengan suhu perairan 27,25 – 29,30 0C, salinitas 32 – 33,5 o/oo. Alga Sargassum membutuhkan intensitas cahaya matahari yang berkisar antara 6500 – 7500 lux. Alga Sargassum tumbuh berumpun dengan untaian cabang-cabang. Panjang thalli utama mencapai 1 – 3 m dan tiap-tiap percabangan terdapat gelembung udara berbentuk bulat yang disebut bladder yang berguna untuk menopang cabang-cabang thalli terapung ke arah permukaan air untuk mendapatkan intensitas cahaya matahari (Kadi, 2007).
Alga coklat Sargassum berkembang biak melalui reproduksi aseksual (vegetatif) dan seksual (generatif). Reproduksi aseksual dilakukan melalui proses fragmentasi. Cara ini banyak dilakukan untuk usaha budidaya. Reproduksi seksual yaitu perkembangan individu melalui organ jantan (antheredia) dan organ betina (oogenia) (Kadi, 2007).
Di dalam alga coklat Sargassum terkandung alginat yaitu senyawa makronutrien heteropolisakarida yang merupakan konstituen dinding sel dan
dapat digunakan untuk memperbaiki dan meningkatkan kualitas bahan dalam industri tekstil, kalsium alginat digunakan dalam pembuatan obat-obatan. Senyawa alginat juga banyak digunakan dalam produk susu dan makanan yang dibekukan untuk mencegah pembentukan kristal es dan sebagai pengemulsi. Dalam industri farmasi, alginat digunakan sebagai bahan pembuatan pelapis kapsul dan tablet, bahan biomaterial untuk teknik pengobatan seperti micro-encapsulation dan cell transplantation (Soraya, 2005; Putra, 2006; Carolina, 2007; dan Kadi, 2007). Kandungan makronutrien lain yang ditemukan dalam alga coklat Sargassum antara lain mineral yang tinggi (yodium dan kalsium), protein dan asam amino, lipid dan asam lemak (asam linolenat, asam eikosapentoat dan asam arakidonat). Selain adanya kandungan makronutrien, di dalam alga coklat Sargassum juga terdapat mikronutrien yang terdiri dari vitamin C, vitamin E, polifenol, dan karotenoid. Jenis alga Sargassum yang banyak tersebar di pantai selatan Pulau Jawa dari Binuangeun sampai Pantai Krakal di antaranya adalah Sargassum binderi, Sargassum crassifolium, Sargassum duplicatum, Sargasssum
hystrix, dan Sargassum sp. (Kadi, 2007).
Alga coklat Sargasssum hystrix v. buxifolium (Chauvin) J. Agardh. termasuk dalam kelas Phaeophyceae, ordo (bangsa) Fucales, famili Sargassaceae, genus Sargassum, spesies Sargassum hystrix, dan varietas Sargasssum hystrix v. buxifolium (Chauvin) J. Agardh.
B. Florotanin
Polifenol alga atau lebih dikenal sebagai florotanin banyak terdapat pada alga coklat, namun polifenol alga ini mempunyai perbedaan dengan polifenol dari tumbuhan terestrial. Polifenol pada tumbuhan terestrial merupakan turunan asam galat dan asam ellagat, sedangkan polifenol alga berasal dari unit-unit floroglusinol (1,3,5-trihydroxybenzene) (Burtin, 2003).
Florotanin tersusun dari sekumpulan molekul dengan struktur dan tingkat polimerisasi yang heterogen sehingga mempunyai rentang aktivitas biologik yang luas (Athukorala et al., 2006; Yuan dan Walsh, 2006; Kang et al., 2005a). Kandungan tertinggi florotanin ditemukan dalam alga coklat, berkisar 5-15 % dari berat kering (Burtin, 2003).
OH
Gambar 1. Struktur kimia beberapa polifenol alga: (1) Floroglusinol, (2) Difucol, (3) Bifuhalol, (4) Trifucol, (5) Isomer I Tetrafucol, (6) Isomer II
Tetrafucol
C. Isolasi Florotanin dari Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
1. Penyarian
Penyarian merupakan suatu kegiatan penarikan zat yang dapat larut dari bahan yang tidak dapat larut dengan pelarut cair (Anonim, 2000). Untuk melakukan penyarian, harus diketahui zat aktif yang dikandung oleh bahan yang akan disari sehingga mempermudah pemilihan cairan penyari dan cara penyarian yang tepat (Anonim, 2000).
Sokhletasi merupakan salah satu cara penyarian berkesinambungan untuk menghasilkan ekstrak cair yang dilanjutkan dengan proses penguapan. Pada penyarian dengan sokhletasi, serbuk simplisia diisikan pada kantung yang berpori.
Cairan penyari dalam labu dipanaskan hingga mendidih. Uap penyari akan mengembun karena didinginkan oleh pendingin balik. Embun akan turun melalui serbuk simplisia sambil melarutkan zat aktifnya (Anonim, 1986). Metode ini biasa digunakan untuk sampel dengan skala ukuran berat gram. Suatu senyawa yang sama mungkin diperoleh dengan perbandingan berbeda dalam beberapa fraksi senyawa tersebut (Harborne, 1987). Peralatan sokhletasi tertera pada gambar 2 di bawah ini:
Gambar 2. Peralatan Sokhlet, A) tempat meletakkan kertas filter, B) labu alas bulat, C) pipa naiknya uap, D) pendingin
Kecepatan penyarian dipengaruhi oleh kecepatan difusi zat yang larut melalui lapisan batas antara cairan penyari dengan bahan yang mengandung zat tersebut. Pada waktu pembuatan simplisia (serbuk), beberapa sel ada yang dindingnya pecah dan ada yang masih utuh. Proses penyarian pada sel yang dindingnya masih utuh, zat aktif yang terlarut pada cairan penyari untuk keluar dari sel harus melewati dinding sel (Anonim, 1986).
lebih banyak. Penyarian dapat diteruskan sesuai dengan keperluan tanpa menambah volume cairan penyari (Anonim, 1986).
2. Separasi
Ekstrak dari bahan alam mengandung komponen campuran. Maka, tujuan dari tahap ini adalah menghilangkan senyawa yang tidak dikehendaki seoptimal mungkin tanpa mempengaruhi kandungan senyawa yang diinginkan, sehingga diperoleh ekstrak yang murni. Proses dari tahap ini antara lain pengendapan, pemisahan dua cairan yang tidak saling campur (ekstraksi), sentrifugasi, dekantasi, dan filtrasi (Anonim, 2000). Ekstraksi merupakan suatu metode pemisahan komponen dari suatu campuran dengan menggunakan suatu pelarut. Metode ini paling sering digunakan untuk proses pemisahan. Alat yang digunakan tidak khusus dan tidak rumit. Jika tidak dinyatakan lain, alat yang digunakan adalah corong pisah (Khopkar, 1990). Ekstraksi dapat dilakukan dengan berbagai cara, antara lain immiscible liquids (cairan yang tidak campur), cracking emulsion, multiple extraction, dan salting out (Houghton, 2000).
Dasar ekstraksi mengacu pada Hukum Nernst. Hukum distribusi Nernst menyatakan bahwa “pada konsentrasi dan tekanan yang konstan, analit akan terdistribusi dalam proporsi yang selalu sama di antara dua pelarut yang tidak saling campur” (Rohman, 2007). Jika [X1] adalah konsentrasi zat terlarut dalam fase pertama (fase organik) dan [X2] adalah konsentrasi pada fase kedua (fase air), maka saat kesetimbangan terjadi:
[ ]
[ ]
2 1X X KD=
KD adalah koefisien partisi atau distribusi. Semakin besar konsentrasi zat terlarut dalam pelarut organik maka nilai KD akan meningkat. Jika konsentrasi zat terlarut dalam fase organik semakin kecil, maka nilai KD akan menurun (Khopkar, 1990).
D. Spektrofotometri UV-Vis
Teknik spektroskopik adalah salah satu teknik fisikokimia yang mempelajari tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Tiga hal yang mungkin terjadi sebagai akibat interaksi atom atau molekul dengan radiasi elektromagnetik adalah hamburan (scaterring), absorpsi (absorption), dan emisi (emission) (Mulja dan Suharman, 1995). Rohman (2007) menyatakan bahwa banyaknya sinar yang diabsorpsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul yang menyerap radiasi. Dengan demikian, teknik ini dapat digunakan untuk analisis kuantitatif yaitu menetapkan berapa banyak substansi yang ada di sampel dengan mengukur berapa besar cahaya yang diabsorpsi atau diemisikan oleh atom atau molekul di dalamnya (Cairns, 2003).
Spektrofotometri UV-Vis merupakan anggota teknik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultra violet dekat (190 – 380 nm) dan sinar tampak (380 – 780 nm) dengan memakai instrumen spektrofotometer (Mulja dan Suharman, 1995).
tinggi. Panjang gelombang yang menunjukkan terjadinya absorbansi bergantung pada kekuatan ikatan elektron dalam molekul tersebut (Day dan Underwood, 1986).
Intensitas suatu serapan dapat dinyatakan sebagai transmitan (T) yang dapat dirumuskan sebagai berikut:
o
I I T=
Rumusan yang lebih tepat untuk intensitas serapan diturunkan dari Hukum Lambert-Beer. Hukum ini menyatakan adanya hubungan antara serapan dan tebal kuvet dengan konsentrasi bahan penyerap.
c Sedangkan kemungkinan terjadinya eksitasi elektronik dapat dinyatakan dengan rumus:
(Mulja dan Suharman, 1995)
Absorpsi sinar UV dan sinar tampak pada umumnya dihasilkan oleh eksitasi elektron-elektron ikatan sehingga panjang gelombang absorpsi dapat dihubungkan dengan ikatan yang mungkin terdapat dalam suatu molekul.
Terdapat tiga macam proses serapan energi ultraviolet dan sinar tampak, yaitu: 1) serapan oleh transisi elektron ikatan dan elektron antiikatan, 2) serapan oleh transisi elektron d dan f dari molekul kompleks, 3) serapan oleh perpindahan muatan (Rohman, 2007).
Terdapat 4 macam transisi elektron di dalam suatu molekul. 1) Elektron yang tidak berada dalam ikatan. Energi eksitasi elektron ini sangat tinggi dan tidak memiliki kontribusi pada absorpsi di daerah visibel maupun UV. 2) Elektron pada ikatan kovalen tunggal (elektron sigma, σ). Energi eksitasi elektron ini juga terlalu tinggi sehingga tidak memberikan kontribusi pada absorpsi di daerah visibel atau UV (contohnya pada ikatan kovalen hidrokarbon jenuh). 3) Pasangan elektron bebas pada kulit terluar (elektron n), contohnya pada N, O, S, dan halogen. Elektron ini cenderung kurang diikat kuat dibandingkan elektron sigma dan dapat tereksitasi oleh radiasi visibel atau UV. 4) Elekron pada orbital π (phi), contohnya pada ikatan rangkap dua atau tiga. Elektron ini paling mudah tereksitasi dan bertanggung jawab pada sebagian besar spektra pada daerah visibel dan UV (Christian, 2004). Efek absorpsi radiasi pada molekul menghasilkan transisi elektron ke tingkat yang lebih tinggi yang dikenal sebagai orbital antibonding. Transisi yang paling umum adalah transisi dari π menuju π*
Absorpsi radiasi visibel oleh kompleks logam disebabkan oleh satu atau lebih dari transisi berikut, yaitu eksitasi ion logam, eksitasi ligan, atau transisi charge transfer. Eksitasi ion logam dalam kompleks biasanya memiliki daya serap molar yang kecil (ε) 1 – 100 L.cm-1.mol-1 dan ini tidak berguna dalam analisis kuantitatif (Christian, 2004). Sedangkan transisi kompleks logam menunjukkan serapan yang sangat intens (ε = 103 – 105 L.cm-1.mol-1) (Ohannesian dan Streeter, 2002).
Untuk tujuan analisis, senyawa-senyawa yang menunjukkan absorpsi karena perpindahan muatan sangat penting karena absorptivitas molarnya sangat besar (ε > 104 L.cm-1.mol-1). Dengan demikian, senyawa-senyawa kompleks akan memberikan sensitifitas yang tinggi yang berarti bahwa senyawa-senyawa kompleks mudah dideteksi dan ditentukan kadarnya (Rohman, 2007). Beberapa ion anorganik menunjukkan absorpsi yang disebabkan oleh perpindahan muatan, sehingga kompleks-kompleks ini disebut dengan kompleks perpindahan muatan (charge-transfer complexes).
Kompleks charge transfer terdiri dari gugus elektron donor yang berikatan dengan elektron akseptor. Ketika mengabsorpsi radiasi, elektron dari donor akan berpindah ke orbital akseptor (Skoog et al., 1993). Keadaan tereksitasi merupakan hasil dari reaksi reduksi-oksidasi (Rohman, 2007). Pada proses perpindahan muatan hanya dibutuhkan sejumlah kecil energi radiasi karena perpindahan elektron cenderung meningkat. Hal ini akan menyebabkan kompleks yang dihasilkan akan menyerap pada panjang gelombang yang lebih panjang (Rohman, 2007).
Pada absorpsi senyawa anorganik, terjadi transisi antara orbital d yang terisi dengan tak terisi. Energi yang digunakan bergantung dari ikatan ligan ke ion pusat (Skoog et al., 1993). Pada kompleks ion logam dan ligan terjadi transisi orbital elektron d dari ion logam ke orbital π* pada ligan atau dari orbital elektron π ligan ke orbital d dari ion logam (Ohannesian dan Streeter, 2002).
Panjang gelombang saat terjadi eksitasi elektronik yang memberikan serapan maksimum disebut panjang gelombang maksimum. Penentuan panjang gelombang maksimum dapat digunakan untuk mengidentifikasi suatu molekul (Mulja dan Suharman, 1995). Terdapat tiga alasan pengukuran serapan dilakukan pada panjang gelombang maksimum saat analisis kuantitatif, yaitu:
1. Pada panjang gelombang maksimum, kepekaannya juga maksimal karena perubahan serapan untuk setiap satuan konsentrasi adalah yang paling besar. 2. Bentuk kurva serapan akan datar di sekitar panjang gelombang maksimum dan
Hukum Lambert-Beer akan terpenuhi pada kondisi tersebut.
3. Akan diperoleh kesalahan yang sangat kecil apabila dilakukan pengukuran ulang pada panjang gelombang maksimum.
diketahui konsentrasi yang meningkat dan membandingkan warnanya dengan senyawa yang hendak dianalisis. Pada warna yang sama, maka konsentrasinya adalah sama (Roth dan Baschke, 1994).
Reaksi warna pada spektroskopi tersebut akan meningkatkan selektivitas dan sensitivitas. Reaksi warna yang diinginkan dapat digunakan untuk zat dalam jumlah kecil. Reaksi warna ini sangat peka dan produk reaksi warna dapat menyerap cahaya dengan kuat di daerah tampak, bukan di daerah ultraviolet. Reaksi tersebut umumnya digunakan sebagai modifikasi spektrum absorpsi sehingga dapat dideteksi di daerah sinar tampak.
Tabel I. Spektrum warna pada daerah visibel (Christian, 2004)
Rentang Panjang Gelombang
(nm)
Warna Warna Komplementer
380 – 450 Violet Kuning – Hijau
Beberapa kriteria yang harus dipenuhi dalam analisis secara kolorimetri adalah selektif, sensitif, ada kesebandingan antara warna dan konsentrasi, warna yang dihasilkan stabil, reprodusibel, dan larutan jernih (Basset et al, 1994).
E. Metode Folin-Ciocalteau
Pereaksi Folin-Ciocalteau merupakan larutan kompleks ion polimerik yang dibentuk dari asam fosfomolibdat dan asam heteropolifosfotungstat. Pereaksi ini terbuat dari air, natrium-tungstat, natrium-molibdat, asam fosfat, asam klorida, lithium sulfat, dan bromin (Folin, 1944).
Menurut Waterman dan Mole (cit. Khadambi, 2007), metode Folin-Ciocalteau telah digunakan untuk mendeterminasikan fenol total dengan dasar oksidasi gugus hidroksi fenolik. Pereaksi Folin-Ciocalteau akan mengoksidasi fenolat (garam alkali), sehingga mereduksi asam heteropoli menjadi suatu kompleks Mo-W. Fenolat hanya ada pada larutan basa tetapi reagen dan produknya tidak stabil pada kondisi basa. Selama reaksi berlangsung, gugus hidroksi fenolik bereaksi dengan pereaksi Folin-Ciocalteau membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru ungu yang dapat diukur absorbansinya dengan spektrofotometer visibel (Jansoon, 2005).
F. Keterangan Empiris
Alga coklat yang digunakan dalam penelitian ini adalah Sargassum hystrix v. buxifolium (Chauvin) J. Agardh yang diperoleh dari Pantai Drini, Yogyakarta. Menurut Kadi (2007), alga jenis ini banyak tersebar di pantai selatan Pulau Jawa dan belum dilakukan penelitian mengenai kandungan florotanin yang terdapat dalam Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Untuk memastikan adanya kandungan polifenol dalam alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh maka dilakukan uji kualitatif menggunakan pereaksi FeCl3 dan gelatin. Filtrat ekstrak serbuk alga Sargassum
hystrix v. buxifolium (Chauvin) J. Agardh akan bereaksi positif membentuk warna coklat kehijauan saat ditetesi pereaksi FeCl3 apabila terdapat polifenol (Fong et
Florotanin dapat disari dengan cara maserasi maupun sokhletasi. Namun, kerugian cara maserasi adalah waktu pengerjaan lama dan penyarian kurang sempurna. Seperti telah diketahui, bahwa kandungan florotanin dalam alga coklat hanya berkisar 5% hingga 15% dari berat kering (Nagayama et al., 2002), maka perlu dilakukan penyarian berkesinambungan dengan alat sokhlet (sokhletasi) yang dapat menyari zat aktif lebih banyak menggunakan pelarut murni dengan volume relatif konstan (Anonim, 2000). Pertimbangan lain adalah karena florotanin tahan terhadap pemanasan, hal ini dapat ditinjau dari floroglusinol sebagai monomernya yang akan rusak pada suhu 2180C (Anonim, 1989).
Penetapan kadar florotanin dilakukan secara spektrofotometri metode Folin-Ciocalteau karena pereaksi Folin-Ciocalteau dapat bereaksi dengan polifenol alga, mengoksidasi gugus hidroksi fenolik untuk membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru sehingga absorbansi senyawa kompleks tersebut dapat dibaca pada spektrofotometer visibel (Khadambi, 2007).
Kang et al. (2005a) telah mengidentifikasi struktur dari beberapa macam polifenol alga, salah satunya adalah floroglusinol. Floroglusinol mempunyai struktur sederhana dan menyerupai struktur polifenol alga lain bila dibandingkan dengan monomer lain seperti kuersetin dan asam tannat. Sehingga, floroglusinol digunakan sebagai standar ekivalen dalam penetapan kadar polifenol alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. Penetapan kadar florotanin dinyatakan sebagai kesetaraan dengan floroglusinol (mg PE/g fraksi).
BAB III
METODOLOGI PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian ini termasuk dalam penelitian noneksperimental karena tidak ada intervensi atau perlakuan terhadap fenomena yang diamati.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel penelitian
Variabel dalam penelitian ini adalah kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
2. Definisi operasional
a. Alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. yang digunakan adalah spesies alga coklat yang diperoleh dari Pantai Drini, Gunung Kidul, Yogyakarta dengan ciri-ciri fisik yaitu daun panjang, lurus (tidak bergelombang), dan mempunyai banyak percabangan.
b. Ekstrak metanol alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. adalah hasil ekstraksi serbuk simplisia alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dengan metode sokhletasi menggunakan pelarut metanol sampai jernih.
c. Fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. adalah fraksi yang diperoleh dari fraksinasi menggunakan etil
asetat terhadap ekstrak metanol simplisia alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
d. Florotanin adalah polifenol alga yang spesifik dan mempunyai molekul dengan gugus yang sangat heterogen pada tingkat polimerisasi dan memberikan aktivitas biologik yang luas.
e. Parameter validasi metode analisis yang ditentukan dalam penelitian ini adalah akurasi, presisi, dan linearitas.
f. Kadar florotanin adalah jumlah polifenol yang terhitung ekivalen dengan floroglusinol dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. yang ditetapkan secara spektrofotometri dengan metodeFolin-Ciocalteau (mg PE/g fraksi).
C. Bahan dan Alat Penelitian
1. Bahan
Bahan-bahan yang digunakan dalam penelitian adalah sebagai berikut: alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh yang diambil dari Pantai Drini, Gunung Kidul, Yogyakarta, metanol p.a. (Merck, Germany), kloroform p.a. (Merck, Germany), etil asetat p.a. (Merck, Germany), aseton p.a. (Merck, Germany), natrium karbonat p.a. (Merck, Germany), floroglusinol (Merck, Germany), pereaksi Folin-Ciocalteau (Sigma Chem, Co., USA), dan akuades (Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta).
.
2. Alat
Alat-alat yang digunakan dalam penelitian adalah sebagai berikut: autoklaf Sanshenyiliaogixie YX-400Z, oven Memmert ULM 500, UM 400, dan U 50, oven Termaks seri 88725, blender Retsch bv, seperangkat alat titrasi Karl Fischer Mettler DL-18, seperangkat spektrofotometer UV-Vis Perkin Elmer Lambda 20, timbangan elektrik BP 160 dan Scaltec SBC 22 readability 0,01 mg, vacum rotary evaporator (Buchi), waterbath (Abo-Tech), mikropipet 100 – 1000 μL (Acura 825, Socorex), tabung reaksi bertutup (Scott-Germany), alat-alat untuk
sokhletasi yaitu kertas filter Schleicher & Schuell, labu alas bulat (Schoot Duran-Germany), heating mantle, corong pisah 500 mL (Pyrex-Germany), alat sentrifus, homogenizer (Vortex Genie), dan alat-alat gelas yang lazim digunakan untuk penelitian di laboratorium analisis (Pyrex-Germany).
D. Tata Cara Penelitian
1. Preparasi sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh
Alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dikumpulkan, dicuci dengan air mengalir untuk menghilangkan epifit dan sedimen yang menempel, dan dimasukkan dalam autoklaf selama 30 menit pada suhu 100 0
J. Agardh dilakukan dengan menggunakan metode Karl Fischer. Serbuk alga ditimbang dengan seksama 0,2 gram, ditambah 10 mL metanol, dan didiamkan selama 1 hari pada suhu kamar. Selanjutnya dilakukan pre-titrasi pada alat dan uji kebocoran alat hingga didapat angka drift 10-50. Standarisasi dilakukan dengan cara menimbang spuit berisi air, kemudian dimasukkan 1 tetes air ke dalam alat. Spuit ditimbang kembali untuk selanjutnya ditentukan berat air yang dimasukkan. Kemudian dihitung kesetaraan air. Satu mL metanol dimasukkan dan dititrasi dengan alat (blangko) untuk dilakukan perhitungan kadar air. Kemudian 1 mL sampel dimasukkan, dititrasi dengan alat, dan dihitung kadar air dalam sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. Kadar air dalam sampel dihitung dengan rumus:
Kadar air = 100%
2. Uji kualitatif senyawa fenolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
a. Preparasi ekstrak
Tiga puluh mL metanol 80% ditambahkan pada 10 g serbuk alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dengan derajat halus 20/30. Lalu dimasukkan ke dalam wadah dan dipanaskan pada waterbath selama ± 1 jam. Campuran didinginkan pada suhu ruangan, disaring menggunakan corong dan kertas saring (Fong et al., 1992).
b. Uji tanin dan polifenol
Sejumlah volume yang setara dengan 10 g ekstrak metanol 80% yang telah disiapkan sebelumnya pada langkah preparasi ekstrak, diuapkan menggunakan waterbath, ditambahkan 25 mL akuades panas dan dicampur secara merata. Campuran dibiarkan hingga dingin pada suhu kamar, lalu ditambahkan 3-4 tetes larutan NaCl 10%. Ekstrak disaring dengan menggunakan vacuum. Filtrat dibagi ke dalam 4 tabung, masing-masing 3 mL. Pada tabung I ditambahkan 4-5 tetes larutan gelatin 1%. Pada tabung II ditambahkan 4-5 tetes pereaksi garam gelatin (gelatin 1%, ditambahkan NaCl 10%). Pada tabung III ditambahkan 3-4 tetes ferri klorida (FeCl3) LP. Tabung IV sebagai kontrol dan tidak ditambahkan pereaksi apapun. Diamati warna yang terbentuk pada setiap tabung (Fong et al., 1992).
3. Isolasi florotanin dari alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Serbuk alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. ditimbang sebanyak 40 g, kemudian dimasukkan ke dalam kertas filter Scheiller & Schuell dan dimasukkan dalam labu sokhlet. Selanjutnya, diberi pelarut metanol sebanyak 2 kali sirkulasi (1 sirkulasi = 100 mL) ke dalam tabung sokhlet. Proses sokhletasi dilakukan sampai tetesan pelarut jernih selama 30 jam dengan suhu 1200C ± 200C.
metanol hingga 120 mL. Kemudian ditambahkan 120 mL kloroform dan 45 mL akuades dalam corong pisah 500 mL, digojog perlahan dan didiamkan hingga terbentuk 2 lapisan. Lapisan atas dan lapisan bawah dipisahkan, selanjutnya lapisan atas diekstraksi dengan etil asetat sebanyak 2 kali, masing-masing 75 mL. Fraksi etil asetat (bagian atas) dikumpulkan, selanjutnya diuapkan dan diperoleh ekstrak yang merupakan florotanin.
4. Optimasi metode spektrofotometri secara kolorimetri dengan pereaksi Folin-Ciocalteau
a. Pembuatan larutan standar
Ditimbang dengan cara seksama lebih kurang 0,05 g standar floroglusinol, kemudian dilarutkan ke dalam aseton 75 % sampai volume 50,0 mL. Seri konsentrasi larutan intermediet dibuat dengan cara dipipet dari larutan induk sebanyak 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 mL dan dimasukkan ke dalam labu ukur 10,0 mL sehingga diperoleh seri konsentrasi 50,0; 100,0; 200,0; 300,0; 400,0; 500,0; dan 600,0 ppm. Larutan intermediet dipipet sebanyak 0,5 mL dan dimasukkan ke dalam labu ukur 50,0 mL yang mengandung 2,5 mL pereaksi Folin-Ciocalteau yang telah diencerkan dengan akuades 1:1. Didiamkan selama 2 menit, kemudian ditambahkan 7,5 mL Na2CO3 1,9 M dan dicampur dengan akuades sampai volume 50,0 mL. Campuran tersebut divortex setiap 15 menit, selama 30 detik, sebanyak 2 kali vortex. Kemudian campuran disentrifus dengan kecepatan 4000 rpm selama 5 menit dan diambil supernatannya. Diperoleh seri konsentrasi standar
floroglusinol 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 ppm.
b. Penetapan Operating Time (OT)
Sebanyak 0,5 mL larutan intermediet 400,0 ppm dipipet dan dimasukkan ke dalam labu takar 50,0 mL yang mengandung 2,5 mL pereaksi Folin-Ciocalteau yang telah diencerkan dengan akuades 1:1. Didiamkan selama 2 menit, kemudian ditambahkan 7,5 mL Na2CO3 1,9 M, dan dicampur dengan akuades sampai volume 50,0 mL. Operating time diukur dengan spektrofotometer visibel. Pengukuran dilakukan pada panjang gelombang teoritis hasil reaksi floroglusinol dengan Folin-Ciocalteau (750,0 nm).
c. Penentuan panjang gelombang maksimum (λmaks)
d. Pembuatan kurva baku floroglusinol
Dibuat larutan standar seperti pada prosedur 4a. Absorbansi diukur pada panjang gelombang maksimum hasil scanning. Persamaan kurva baku dihitung menggunakan regresi-linier konsentrasi terhadap absorbansi.
5. Estimasi kadar polifenol total dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. ditimbang lebih kurang 0,05 g dengan cara seksama, kemudian dilarutkan dalam aseton 75% hingga volumenya 50,0 mL. Larutan sampel dipipet sebanyak 5,0 mL dan dimasukkan ke dalam labu ukur 50,0 mL yang mengandung 2,5 mL pereaksi Folin-Ciocalteau yang telah diencerkan dengan akuades 1:1. Didiamkan selama 2 menit, kemudian ditambahkan 7,5 mL Na2CO3 1,9 M, dan dicampur dengan akuades sampai volume 50,0 mL. Campuran tersebut diinkubasi pada suhu kamar selama OT (pada 15 menit pertama dan 15 menit kedua, campuran divortex selama 30 detik). Kemudian campuran disentrifus dengan kecepatan 4000 rpm selama 5 menit dan diukur absorbansinya pada panjang gelombang yang digunakan untuk membaca absorbansi larutan baku dengan spektrofotometer visibel. Nilai absorbansi yang diperoleh, dimasukkan ke dalam persamaan kurva baku. Konsentrasi polifenol total dihitung ekivalen dengan floroglusinol (mg PE/g fraksi). Prosedur ini dilakukan sebanyak 3 kali replikasi dengan masing-masing replikasi ditetapkan sebanyak 2 kali dengan cara 2 kali pemipetan (duplo).
6. Analisis hasil
a. Analisis hasil uji kualitatif untuk tanin dan polifenol
Warna hasil reaksi pada uji tabung dibandingkan dengan warna zat yang tidak diberi tambahan pereaksi. Perubahan warna yang terjadi menunjukkan adanya konstituen fenolik dan sebaliknya, bila tidak ada reaksi dengan larutan FeCl3, maka tidak terdapat senyawa tanin maupun fenolik. Apabila terbentuk warna hijau kebiruan atau hitam kehijauan setelah penambahan larutan FeCl3 (diasumsikan terbentuk endapan setelah penambahan garam gelatin) maka terdapat senyawa tanin tipe katekol, sedangkan jika terbentuk warna hitam kebiruan setelah penambahan larutan FeCl3 (diasumsikan terbentuk endapan setelah penambahan garam gelatin) maka terdapat senyawa tanin tipe pirogalol. Apabila tidak ada endapan tetapi terjadi perubahan warna menjadi kehijauan atau hitam kebiruan, maka tidak terdapat senyawa tanin (Fong et al., 1992).
b. Analisis hasil penetapan kadar florotanin dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
BAB IV
HASIL DAN PEMBAHASAN
A. Preparasi Sampel Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Simplisia alga coklat Sargassum diambil dari Pantai Drini, Gunungkidul, Yogyakarta pada musim penghujan, tepatnya pada tanggal 23 Maret 2007. Pengambilan sampel ini dilakukan saat air laut surut sekitar 300 m dari tepi pantai pada pukul 16.00-17.00 BBWI dan suhu air laut mencapai 270C. Terdapat banyak karang pada daerah pantai tempat diambilnya simplisia alga coklat Sargassum. Hal ini dikarenakan secara ekologis, alga coklat berperan dalam pembentukan ekosistem terumbu karang.
Umur alga coklat Sargassum yang dipanen tidak dapat diketahui secara pasti karena alga ini langsung diambil dari alam dan bukan merupakan jenis alga coklat Sargassum yang dibudidayakan. Adanya kandungan polifenol yang bervariasi pada alga coklat Sargassum dapat disebabkan oleh beberapa faktor, antara lain habitat alga, spesies alga, umur alga, serta masa panen.
Identifikasi spesies alga dilakukan di Laboratorium Taksonomi Tumbuhan Fakultas Biologi Universitas Gadjah Mada Yogyakarta. Berdasarkan hasil identifikasi, sampel alga coklat Sargassum termasuk dalam ordo Fucales, famili Sargassaceae, genus Sargassum, dan spesies Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. (Lampiran 1).
Alga coklat Sargassum tumbuh dalam suatu ekosistem biota laut yang
29
terdiri dari berbagai jenis spesies alga. Maka perlu dilakukan pemisahan spesies alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dari spesies alga coklat Sargassum lainnya. Pemisahan dilakukan dengan melihat ciri-ciri fisiknya yaitu daun panjang, lurus (tidak bergelombang), dan mempunyai banyak percabangan. Pencucian alga utuh dilakukan dengan air mengalir untuk menghilangkan kotoran-kotoran yang menempel pada permukaan alga yang berupa epifit, sedimen, pasir yang mengandung silikat, zat kapur, dan bahan organik asing yang bukan berasal dari alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Auterhoff dan Knabe (1978) mengemukakan bahwa silikat dapat membentuk kompleks molibdat H6[SiMo12O40].n H2O dengan adanya pereaksi Folin-Ciocalteau sehingga bila tidak dihilangkan akan mengganggu dalam analisis sampel. Selain itu, bagian akar alga dibuang untuk menghilangkan material-material organik asing dari batu karang yang dimungkinkan dapat turut mereduksi kompleks asam dalam pereaksi Folin-Ciocalteau membentuk senyawa kompleks molydenum blue sehingga juga dapat mengganggu dalam analisis sampel.
Untuk menginaktifasi enzim polifenol oksidase, sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. yang telah dicuci, dipanaskan menggunakan panas uap bertekanan tinggi dengan suhu 1000C. Polifenol oksidase relatif termostabil (Yagar dan Sagiroglu, 2000). Pada suhu 700C dalam waktu 30 menit, polifenol oksidase hanya akan kehilangan kemampuannya sebesar 65%. Sehingga diperlukan suhu lebih dari 700C untuk menginaktifkan polifenol oksidase. Polifenol oksidase perlu diinaktifkan agar rantai polifenol pada alga tidak bertambah panjang yang akan menghasilkan polifenol dengan bobot molekul sedang hingga polifenol dengan bobot molekul tinggi.
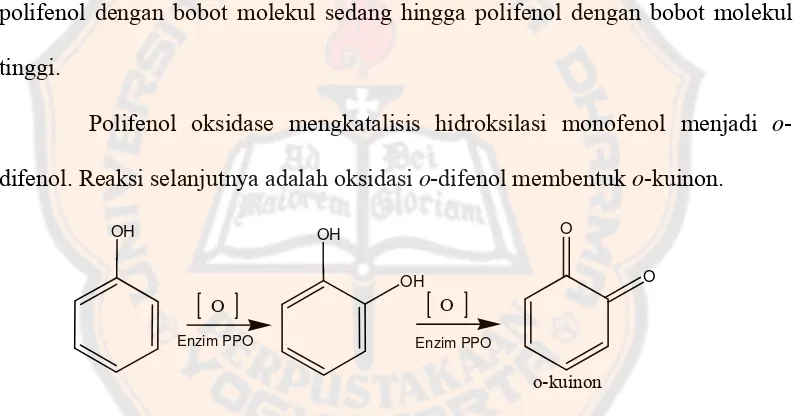
Polifenol oksidase mengkatalisis hidroksilasi monofenol menjadi o -difenol. Reaksi selanjutnya adalah oksidasi o-difenol membentuk o-kuinon.
O O
o-kuinon
OH OH
O O
Enzim PPO Enzim PPO OH
Gambar 3. Oksidasi fenol oleh enzim polifenol oksidase (Sullivan et al., 2003) Proses polimerisasi o-kuinon akan menghasilkan polifenol yang memiliki bobot molekul sedang hingga bobot molekul tinggi. Polifenol tersebut tidak dapat dikembangkan menjadi produk sediaan sunscreen karena tidak memberikan serapan pada daerah panjang gelombang UV.
Pada penelitian yang dilakukan, polifenol alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. yang akan ditetapkan kadarnya adalah polifenol yang terdapat dalam fraksi etil asetat, yaitu floroglusinol dan
oligomernya seperti eckol, phlorofucofuroeckol A, dieckol, 8,8’–bieckol dan florotanin tetramer (Nagayama et al., 2002).
Polifenol alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. yang terdapat dalam fraksi etil asetat merupakan polifenol dengan bobot molekul rendah dan akan memberikan serapan pada panjang gelombang UV B (320 – 280 nm). Polifenol ini akan menjadi zat aktif pada pengembangan sediaan produk sunscreen.
Selanjutnya, sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dikeringkan dalam oven bersuhu 900C hingga benar-benar kering. Penataan sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dalam oven merupakan hal yang penting. Udara panas harus terdistribusi secara merata pada seluruh bagian alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. untuk mencegah tumbuhnya jamur dan mikroba lain yang dapat merusak senyawa-senyawa yang terkandung dalam alga coklat. Proses pengeringan akan mempermudah dalam proses pembuatan serbuk simplisia.
Sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. disimpan dalam bentuk serbuk kering. Menurut Standar Nasional Indonesia (SNI) 01-2690-1992, salah satu kriteria bahwa alga kering bermutu baik adalah memiliki kadar air dengan nilai maksimum berkisar antara 15 – 35%, tergantung pada jenis alga. Kandungan air yang melebihi batasan tersebut akan memudahkan tumbuhnya jamur atau mikroba lain yang dapat merusak kandungan kimia alga.
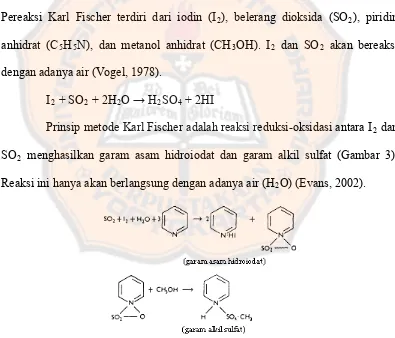
Kadar air dalam serbuk simplisia diukur dengan metode Karl Fischer. Pereaksi Karl Fischer terdiri dari iodin (I2), belerang dioksida (SO2), piridin anhidrat (C5H5N), dan metanol anhidrat (CH3OH). I2 dan SO2 akan bereaksi dengan adanya air (Vogel, 1978).
I2 + SO2 + 2H2O → H2SO4 + 2HI
Prinsip metode Karl Fischer adalah reaksi reduksi-oksidasi antara I2 dan SO2 menghasilkan garam asam hidroiodat dan garam alkil sulfat (Gambar 3). Reaksi ini hanya akan berlangsung dengan adanya air (H2O) (Evans, 2002).
Gambar 4. Reaksi saat penetapan kadar air dengan Karl Fischer Pada pengukuran kadar air terhadap sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. diperoleh hasil bahwa kadar air sampel
alga coklat tersebut sebesar 6,19 ± 3,0 % b/b. Dengan demikian, kadar air tersebut telah memenuhi standar yang disyaratkan oleh SNI.
B. Uji Kualitatif Senyawa Fenolik Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
Senyawa fenolik merupakan metabolit sekunder yang pada umumnya dihasilkan oleh tumbuhan, salah satunya adalah polifenol. Burtin (2003) menyatakan bahwa salah satu mikronutrien dari tumbuhan alga, khususnya alga coklat adalah polifenol yang dikenal sebagai florotanin, merupakan senyawa polifenol yang tidak ditemukan pada tumbuhan terestrial. Uji kualitatif ini perlu dilakukan untuk memastikan ada tidaknya kandungan polifenol dalam sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
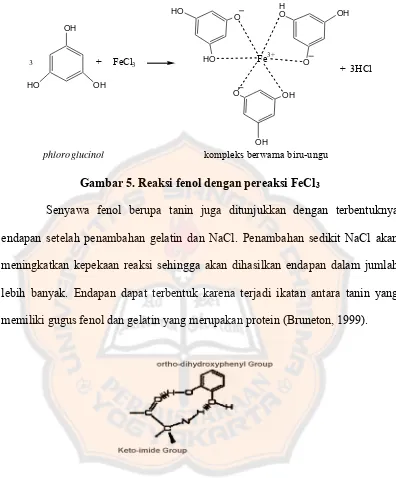
HO OH
Gambar 5. Reaksi fenol dengan pereaksi FeCl3
Senyawa fenol berupa tanin juga ditunjukkan dengan terbentuknya endapan setelah penambahan gelatin dan NaCl. Penambahan sedikit NaCl akan meningkatkan kepekaan reaksi sehingga akan dihasilkan endapan dalam jumlah lebih banyak. Endapan dapat terbentuk karena terjadi ikatan antara tanin yang memiliki gugus fenol dan gelatin yang merupakan protein (Bruneton, 1999).
Gambar 6. Ikatan antara tanin dan gelatin
C. Isolasi Florotanin dari Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
1. Penyarian
Penyarian dilakukan untuk memperoleh senyawa aktif yang dikehendaki.
Zat aktif yang semula berada di dalam sel akan ditarik oleh cairan penyari sehingga larutan zat aktif akan berada dalam cairan penyari tersebut (Anonim 1986). Dalam proses penyarian terhadap serbuk kering alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. digunakan metode sokhletasi. Proses ekstraksi berulang dengan alat sokhlet akan menghasilkan ekstrak yang lebih banyak dengan jumlah pelarut tertentu. Di samping itu, dalam proses sokhletasi tidak memerlukan penambahan cairan pelarut. Sokhletasi dilakukan pada suhu 1200C dengan pertimbangan bahwa polifenol dalam alga tahan terhadap pemanasan. Sokhletasi dihentikan sampai pelarut metanol jernih untuk memastikan bahwa semua senyawa yang relatif polar dapat tersari semuanya ke dalam pelarut metanol. Florotanin merupakan senyawa yang relatif polar sehingga dapat larut dalam pelarut yang relatif polar seperti metanol.
2. Separasi
Pada pemisahan, terbentuk dua lapisan. Fraksi metanol-air akan berada di lapisan atas dan fraksi kloroform berada di lapisan bawah karena berat jenis kloroform lebih besar daripada air. Selanjutnya fraksi kloroform dibuang dan yang digunakan adalah fraksi metanol-air.
Tahap ekstraksi yang kedua adalah mengekstraksi fraksi metanol-air dengan menggunakan pelarut etil asetat untuk memisahkan florotanin yang akan ditetapkan kadarnya dari senyawa-senyawa polar lainnya. Jika dilihat dari kepolarannya, metanol-air dan etil asetat merupakan pelarut yang bersifat relatif polar, akan tetapi pelarut metanol-air lebih bersifat polar daripada etil asetat. Pada pemisahan juga terbentuk dua lapisan Fraksi etil asetat berada di lapisan atas dan fraksi metanol-air berada di lapisan bawah karena berat jenis air lebih besar daripada berat jenis etil asetat. Fraksi metanol-air diekstraksi sebanyak dua kali dengan pelarut etil asetat. Ini dimaksudkan agar dapat diperoleh senyawa yang diinginkan dalam jumlah lebih banyak.
Fraksi etil asetat dikumpulkan dan diuapkan di atas waterbath dengan suhu 800C untuk memperoleh florotanin. Penyimpanan dilakukan dalam oven bersuhu 500C agar florotanin tidak lembab karena florotanin bersifat higroskopis yang mudah rusak dengan adanya paparan dari udara bebas. Kelembaban akan memungkinkan tumbuhnya jamur dan mikroba lain yang dapat merusak kandungan senyawa aktif.
D. Prinsip Metode Spektrofotometri secara Kolorimetri dengan Pereaksi Folin-Ciocalteau
Pereaksi yang digunakan untuk mengestimasi konsentrasi polifenol total dalam florotanin hasil isolasi adalah Folin-Ciocalteau. Pereaksi ini merupakan larutan berwarna kuning jernih yang mengandung kompleks ion polimerik yang terbentuk dari asam heteropoli yaitu asam tungstat dan asam molibdat (Singleton dan Rossi, 1965). Pereaksi Folin-Ciocaltaeu dapat digunakan dalam metode spektrofotometri pada suasana asam, karena dengan penambahan asam, Folin-Ciocalteau akan berwujud cair nonkoloid. Autherhoff dan Knabe (1978) mengemukakan bahwa dalam bentuk tunggal, asam molibdat sukar larut dan membentuk koloidal. Oleh karena itu, molibdat dicampur dalam bentuk garam dan diberikan tambahan asam fosfat (H3PO4) membentuk kompleks asam fosfomolibdat sehingga terbentuk cairan jernih nonkoloidal. Pereaksi Folin-Ciocalteau dengan tambahan asam fosfat memiliki rumus molekul (NH4)3[P(Mo3O10)4].6H2O. Kejernihan merupakan syarat utama analisis dengan menggunakan spektrofotometer karena larutan yang keruh akan mengganggu dalam pembacaan absorbansi sehingga mempengaruhi hasil akhir analisis.
OH
OH HO
Na2CO3
O
OH HO
phloroglucinol 3,5-Dihydroxy-phenol anion
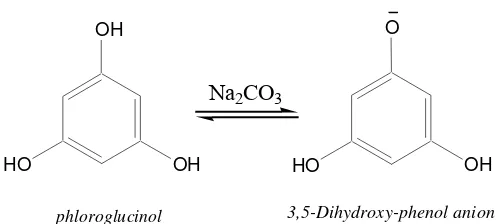
Gambar 7. Kesetimbangan reaksi antara bentuk fenol dan ion fenolat Dalam suasana basa dengan penambahan Na2CO3, kesetimbangan akan lebih bergeser ke arah terbentuknya ion fenolat. Ion fenolat yang terbentuk akan bereaksi dengan pereaksi Folin-Ciocalteau, maka jumlah ion fenolat akan berkurang sehingga kesetimbangan akan bergeser ke arah terbentuknya ion fenolat dan akan dihasilkan ion fenolat dalam jumlah yang lebih banyak. Reaksi ini akan berlangsung hingga semua fenol habis. Kondisi kebasaan yang sedang diperlukan pada reaksi antara ion fenolat dengan pereaksi Folin-Ciocalteau sehingga reaksi dapat berjalan dengan sempurna (Singleton dan Rossi, 1965).
Prinsip reaksi kolorimetri adalah reduksi kompleks asam heteropoli dalam pereaksi Folin-Ciocalteau oleh ion fenolat membentuk kompleks molybdenum-blue dan oksidasi ion fenolat menjadi senyawa kuinon oleh asam heteropoli dalam pereaksi Folin-Ciocalteau.
Saat reaksi berlangsung, pereaksi Folin-Ciocalteau akan memperoleh proton (H+) dari gugus fenol sampel dan air, serta memperoleh elektron dari ion fenolat. Saat itulah terjadi peristiwa reduksi. Sedangkan gugus fenol akan teroksidasi menjadi radikal fenoksi dengan melepaskan elektron yang selanjutnya akan menjadi kuinon. Dengan demikian akan terbentuk kompleks oktahedral molybdenum blue dan kuinon. Kompleks oktahedral yang terbentuk merupakan
kompleks MoO3-fosfat dengan fosfor sebagai pusatnya. Reaksi reduksi yang terjadi:
H3PO4(MoO3)12 + 4e- + 4H+ H7(PMo12O40)
Gambar 8. Reaksi reduksi asam fosfomolibdat dalam pereaksi Folin-Ciocalteau menjadi kompleks molybdenum blue
Reaksi oksidasi yang terjadi:
phloroglucinol
Gambar 9. Reaksi oksidasi floroglusinol menjadi 2,6-dihidroksi-(1,4) benzokuinon
Pereaksi Folin-Ciocalteau 2,6-Dihydroxy-(1,4)benzokuinon Kompleks oktahedral molybdenum-blue
H7(PMo12O40)
Gambar 10. Reaksi reduksi-oksidasi floroglusinol dengan pereaksi Folin-Ciocalteau
panjang gelombang yang lebih panjang (Rohman, 2007). Kompleks yang terjadi akan memberikan sensitifitas yang tinggi ketika diukur dengan spektrofotometer visibel.
E. Optimasi Metode Spektrofotometri secara Kolorimetri dengan Pereaksi Folin-Ciocalteau
1. Penetapan Operating Time (OT)
Penetapan operating time dilakukan untuk menentukan waktu pengukuran suatu senyawa yang mempunyai nilai absorbansi yang stabil. Penentuan OT ini perlu dilakukan karena reaksi reduksi-oksidasi antara senyawa polifenol dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dengan pereaksi Folin-Ciocalteau akan membentuk kompleks molybdenum blue berwarna biru pada suatu waktu tertentu agar dapat bereaksi sempurna.
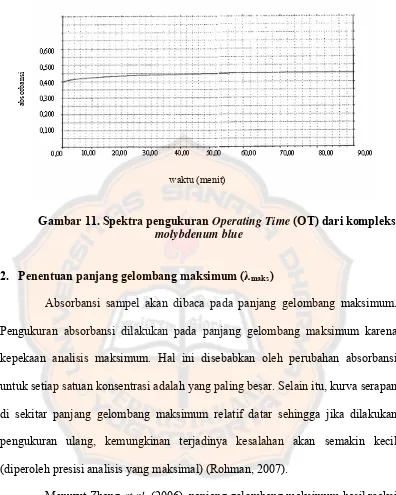
Operating time kompleks molybdenum blue dihasilkan dari larutan baku floroglusinol konsentrasi 3,0 ppm pada panjang gelombang teoritis yaitu 750,0 nm. Penetapan OT ini dilakukan dengan mengukur serapan kompleks yang terbentuk selama 90 menit.
Hasil pengukuran OT pada gambar 10 menunjukkan bahwa kompleks molybdenum blue memberikan serapan yang stabil pada menit ke-50 hingga menit ke-90 dengan nilai absorbansi sebesar 0,454 terhitung sejak saat sampel direaksikan. Pengukuran serapan dilakukan pada rentang waktu tersebut untuk meminimalkan terjadinya kesalahan pengukuran.
absorbansi
Waktu (menit) waktu (menit)
Gambar 11. Spektra pengukuran Operating Time (OT) dari kompleks molybdenum blue
2. Penentuan panjang gelombang maksimum (λmaks)
Absorbansi sampel akan dibaca pada panjang gelombang maksimum. Pengukuran absorbansi dilakukan pada panjang gelombang maksimum karena kepekaan analisis maksimum. Hal ini disebabkan oleh perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar. Selain itu, kurva serapan di sekitar panjang gelombang maksimum relatif datar sehingga jika dilakukan pengukuran ulang, kemungkinan terjadinya kesalahan akan semakin kecil (diperoleh presisi analisis yang maksimal) (Rohman, 2007).
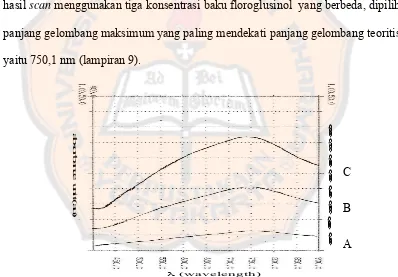
Pengukuran panjang gelombang maksimum dilakukan terhadap tiga konsentrasi baku floroglusinol yaitu 1,0; 3,0; dan 6,0 ppm yang telah direaksikan dengan pereaksi Folin-Ciocalteau. Pada ketiga konsentrasi baku floroglusinol tersebut diperoleh hasil panjang gelombang maksimum yang berbeda-beda. Panjang gelombang maksimum yang diperoleh adalah 758,7 nm pada konsentrasi 1,0 ppm; 750,1 nm pada konsentrasi 3,0 ppm; dan 743,4 nm pada konsentrasi 6,0 ppm.
Dari ketiga panjang gelombang maksimum yang diperoleh berdasarkan hasil scan menggunakan tiga konsentrasi baku floroglusinol yang berbeda, dipilih panjang gelombang maksimum yang paling mendekati panjang gelombang teoritis yaitu 750,1 nm (lampiran 9).
λ (wavelength)
Gambar 12. Spektra panjang gelombang maksimum dari kompleks molybdenum blue yang diukur pada tiga konsentrasi floroglusinol
(A = 1,0 ppm; B = 3,0 ppm; C = 6,0 ppm)
Dari hasil scanning panjang gelombang maksimum, ada kecenderungan bahwa semakin besar konsentrasi baku floroglusinol, maka panjang gelombang maksimum akan bergeser ke panjang gelombang yang lebih kecil (pergeseran
hipsokromik). Pada saat terjadi reaksi reduksi pereaksi Folin-Ciocalteau oleh ion fenolat, terdapat dua kemungkinan senyawa kompleks molybdenum blue yang terbentuk yaitu H7(PMo12O40) dan H5(PMo12O40) (Autheroff dan Knabe, 1977). Di samping itu, jumlah H7(PMo12O40) dan H5(PMo12O40) yang terbentuk juga tidak dapat diketahui secara pasti. Hal ini dikarenakan dalam penelitian tidak dilakukan optimasi pH yang dapat mempengaruhi bentuk dan jumlah senyawa kompleks molybdenum blue.
F. Penetapan Kurva Baku Floroglusinol
Senyawa baku yang digunakan dalam penelitian ini adalah floroglusinol karena merupakan unit monomer dari florotanin alga (Zhang et al., 2006). Di samping itu, floroglusinol juga merupakan salah satu jenis florotanin yang terdapat dalam fraksi etil asetat alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. Penetapan kurva baku floroglusinol dilakukan sebanyak tiga kali replikasi untuk menggambarkan hasil yang sebenarnya. Pengukuran absorbansi kompleks molybdenum blue dari larutan baku dilakukan pada panjang gelombang 750,1 nm. Diperoleh tiga persamaan kurva baku yang berbeda (tabel II).