KROMATOGRAFI
Modul Pembelajaran
Oleh:
Sugeng Riyanto
Ibnu Gholib Gandjar
Sudibyo Martono
Endang Lukitaningsih
Program Studi Ilmu Farmasi S1
Fakultas Farmasi
Universitas Gadjah Mada
Yogyakarta
2013
[Pengampu: Sugeng Riyanto, 4 kali Pertemuan] A. Sejarah perkembangan kromatografi
Pada topik pengantar kromatografi mahasiswa dikenalkan sejarah perkembangan kromatografi, sejak teknik pemisahan campuran zat warna dari ekstrak tumbuhan, menggunakan pita kain atau kertas dilakukan oleh Runge, F.F.(1824-1834). Kemudian diikuti peneliti-peneliti lain. Baru pada tahun 1906-1907, Mikhail Tswett seorang botanis Rusia berhasil memisahkan pigmen kuning dan hijau kloroplas menggunakan fase diam CaCO3 dan fase gerak petroleum eter. Mulai saat itu konsep kromatografi lebih jelas, yaitu adanya fase gerak dan fase diam yang harus ada pada kromatografi. Selanjutnya Wilson, J.N. (1940) mempelajari tentang teori pada kromatografi kertas dan Tiselius, A. (1941) pemenang hadiah nobel atas penemuannya mengenai analisis dengan mekanisme adsorpsi dan elektroforesis. Sedangkan Martin, A.J.P. dan Synge, R.L.M.(1941) mengajukan pertama kali model yang menjelaskan efesiensi kolom, yang dikenal kemudian dengan teori plat (Plate theory) dan selain itu beliau mengembangkan kromatografi cair dan berhasil mendapatkan hadiah Nobel tahun 1952. Teori kromatografi yang kemudian adalah teori kecepatan (Rate theory), teori ini dikembangkan oleh Van Deemter, J.J.(1956).
B. Penggolongan kromatografi
Kromatografi dapat digolong atas dasar wujud fase gerak, maka dikenal kromatografi gas dan kromatografi cair. Bila digolongkan bentuk fase diam, maka dikenal kromatografi planar dan kromatografi kolom. Dapat juga digolongkan atas dasar cara fase gerak mengalir menelusuri fase diam. Penggolongan atas dasar bentuk fase gerak dan fase diam, yang selanjutnya sebagai cara menamai kromatografi secara formal, misalnya: kromatografi gas cairan, kromatografi cairan cairan. Namun menggolongkan kromatografi secara ilmiah adalah atas dasar mekanisme pemisahan. Sehingga dikenal: kromatografi serapan (adsorption chromatography), kromatografi partisi (partition chromatography), kromatografi eksklusi
(exclusion chromatography), kromatografi penukar ion (ion exchange chromatography) dan
kromatografi afinitas (affinity chromatography) C. Definisi istilah
Diberikan beberapa definisi untuk memahami kromatografi misalnya : fase diam, fase gerak, fase pendukung, elusi, visualisasi, Rf, tR, derivatisasi, resolusi, faktor kapasitas, dll. Mekanisme pemisahan
Sebelum menjelaskan mekanisme pemisahan, direview sejenak pengertian mengenai polaritas senyawa (polar dan non polar), diawali dengan unsur elektronegatif, ikatan kovalen, momen dipol dan interaksi terjadinya ikatan hidrogen. Konsep like dissolves like, senyawa polar mudah larut di dalam pelarut polar dan sebaliknya senyawa non polar larut dalam senyawa non polar. Pembahasan mekanisme pemisahan secara partisi diawali dengan menjelaskan ekstraksi pelarut menggunakan dua pelarut yang tidak saling campur, tetapan partisi, KD (hukum Nernst). Dilanjutkan aplikasi KD pada ekstraksi (counter current distribution) dari Craig. Bila campuran senyawa yang masing-masing senyawa berbeda nilai KDnya, maka senyawa akan dapat dipisahkan dengan cara ekstraksi Craig. Mekanisme pemisahan ini adalah secara partisi. Kejadian kesetimbangan konsentrasi senyawa diantara dua pelarut yang tidak saling campur dalam satu tabung dianalogikan kejadian kesetimbangan dalam plat teori. Dibahas sepintas teori distilasi supaya mahiswa lebih dapat memahami pengertian plat teori (N) pada distilasi, counter current extraction dan kromatografi partisi. Mekanisme pemisahan secara adsorpsi dijelaskan dengan pendekatan animasi bila fase diam bersifat polar dan fase gerak bersifat non-polar, terjadi persaingan untuk membuat ikatan hidrogen dengan molekul sampel. Pada sistem ini senyawa sampel polar akan ditahan fase diam polar lebih lama dibanding dengan senyawa sampel non-polar. Mekanisme pemisahan secara eksklusi terjadi bilamana fase diam molekulnya mempunyai pori yang seragam, sehingga molekul senyawa sampel yang ukurannya kecil akan dapat masuk ke pori molekul fase diam, molekul sampel ini akan ditahan lebih lama oleh fase diam, sedangkan molekul sampel yang ukurannya lebih besar tidak ditahan oleh fase diam. Mekanisme pemisahan secara pertukaran ion, terjadi bilamana molekul fase diam adalah senyawa polimer resin yang diberi muatan positif atau negatif yang akan berinteraksi secara ionik dengan molekul sampel yang bermuatan. Ada dua jenis fase diam, yaitu fase diam kationik dan fase diam anionik. Terjadi persaingan antara ion fase gerak dengan ion sampel untuk berikatan dengan bagian ion resin. Perbedaan kekuatan interaksi diantara ion sampel dengan fase diam resina inilah komponen dapat dipisahkan. Mekanisme pemisahan secara afinitas terjadi bilamana interaksi yang sangat spesifik antara molekul sampel dengan molekul yang terikat secara kovalen (immobilized) pada fase diam. Interaksi spesifik dicontohkan seperti reaksi antigen dan antibodi, mana kala antigen diikatkan secara kovalen pada fase diam. Contoh lain terjadinya ikatan hidrogen antara molekul sampel dengan geometri tertentu dengan fase diam yang dimanipulasi bentuk molekulnya sehingga hanya dapat membuat ikatan hidrogen ditempat tertentu tadi.
Selain konsep like dissolves like dan interaksi ikatan hydrogen antara molekul fase gerak, fase diam dan molekul sample, untuk memecahkan masalah pemisahan komponen sample dalam kromatografi dikenal dua teori yaitu: Teori Plat (plate theory) dan Teori Kecepatan (rate theory =kinetic theory).
Teori plat (Plate theory)
Teori ini diketengahkan oleh Martin dan Synge (1941), Konsep teori ini berasal dari teori distilasi, kemudian dikembangkan pada kromatografi. Dibayangkan bahwa didalam kolom kromatografi terdapat plat tipis, plat teori dimana terjadi kesetimbangan komponen sampel diantara fase gerak dan fase diam. Kejadian di satu plat teori ini identik dengan kejadian di satu tabung pada counter current extraction Craig. Kromatografi yang mempunyai jumlah plat teori tinggi (N besar) maka sistem tersebut efisien, mampu memisahkan komponen yang mempunyai perbedaan KD kecil, atau perbedaan kecil kekuatan ikatan hidrogen. Jumlah plat teori (N) dapat dihitung 16 kali kuadrat (jarak puncak,tR dibagi lebar alas puncak,W).
Teori kecepatan (Rate theory)
Teori kecepatan atau disebut juga teori kinetik ditemukan oleh van Deemter (1956) yaitu mempelajari faktor-faktor yang mempengaruhi melebarnya puncak yang secara langsung mempengaruhi HETP (Height Equivalent of a Theoretical Plate) atau disingkat H. HETP ini merupakan ukuran efisiensi kolom, H=L/N. Kolom yang efisien mempunyai N besar, HETP kecil dan lebar alas puncak yang sempit. Teori Kecepatan ( Rate theory ) mempelajari faktor-faktor yang mempengaruhi besarnya HETP. Kurva hubungan HETP dengan kecepatan gas pembawa dinyatakan dalam persamaan van Deemter dan dilukiskan sebagai kurva, disebut kuva van Deemter. Bila dilukiskan persamaannya (persamaan van Deemter) adalah sbb.
HETP = A + B/µ + C.µ
Suku A = difusi eddy, pada persamaan van Deemter disebut sebagai efek jalur ganda. Pelebaran puncak disebabkan oleh panjang jalur-jalur gerakan molekul-molekul komponen dari ujung masuk kolom ke ujung keluar kolom tidak sama. Variasi panjang jalur semakin
besar bila solid support material diameter dan bentuknya tidak seragam. Harga tidak tergantung pada kecepatan aliran gas pembawa.
Suku B/µ = difusi longitudinal. Pembesaran harga H disebabkan oleh difusi molekul di dalam kolom searah dengan panjang kolom. Besarnya sumbangan efek difusi longitudinal terhadap pembesaran harga H berbanding terbalik dengan kecepatan aliran gas pembawa. Difusi longitudinal dalam fase gas lebih besar pengaruhnya terhadap H dari pada difusi longitudinal didalam fase cair.
Suku C.µ = efek perpindahan massa. Pelebaran puncak disebabkan karena tidak dicapainya kesetimbangan partisi pada perpindahan massa komponen sample antara gas (fase gerak) dan cairan (fase diam). Besarnya efek perpindahan massa ini akan semakin besar dengan semakin besarnya kecepatan aliran gas pembawa. Semakin besar µ, semakin sedikit waktu untuk mencapai kesetimbangan dan semakin besar pelebaran puncak. Bila lapisan fase diam tipis akan lebih cepat dicapai kesetimbangan distribusi antara komponen di dalam fase diam dan fase gerak. Maka makin banyak fase diam yang melapisi penyangga akan menyebabkan makin besarnya pelebaran puncak. Kecepatan aliran gas berpengaruh pada efisiensi kolom (N, H dan W). Pada kurva van Deemter dapat dilihat bahwa pada µ optimum memberikan HETP minimum. Maka untuk mencari kondisi optimal yaitu HETP minimum perlu dicari dengan mengubah-ubah kecepatan alir gas pembawa.
3.KROMATOGRAFI LAPIS TIPIS (KLT)
KLT dilakukan pada plat terbuat dari gelas atau aluminium atau plastik yang diatasnya diratakan selapis tipis fase diam. Pada fase diam ini ditotolkan sampel yang kemudian dikembangkan (elusi) menggunakan fase gerak tertentu. Elusi dilakukan di dalam bejana gelas dan selanjutnya bercak diamati (visualisasi).
Fase diam
Sesuai dengan namanya, fase diam selama proses pemisahan harus tetap ditempat, oleh karena disebut stationary phase. Fase diam yang umum digunakan pada KLT adalah Silika gel, dalam perdagangan silika gel dijual dengan bermacam spesifikasi. Pilihan fase diam berikutnya setelah silika gel, adalah alumina. Seperti halnya silika gel, alumina dikenal dengan atau tanpa pengikat dan bahan indikator. Fase diam lain adalah selulosa. Selulosa untuk KLT terdapat dalam bentuk selulosa serat asli (contohnya MN 300) dan selulosa mikrokristal (contohnya Avicel). Fase diam selulosa biasanya digunakan untuk memisahkan senyawa yang bersifat polar.
Fase gerak
Yang digunakan sebagai fase gerak biasanya adalah pelarut organik, dapat digunakan satu macam pelarut organik saja ataupun campuran dari beberapa pelarut, oleh karena itu fase gerak kadang-kadang disebut pelarut atau solven. Namun sebutan yang paling tepat pelarut yang digunakan sebagai fase gerak pada kromatografi adalah eluen (eluent)
Cara-cara elusi
Setelah sampel ditotolkan pada fase diam, plat dimasukkan ke dalam bejana yang berisi fase gerak. Fase gerak akan merambat naik menelusuri fase diam. Ada beberapa cara pengembangan: secara ascendent, descendent, mendatar, pengembangan berulang, dua dimensi, dan sirkular.
Pengamatan (mendeteksi) bercak / visualisasi
Untuk keperluan analisis maka bercak pada plat perlu ditentukan letak, bentuk dan warnanya. Cara mengamati bercak pada KLT dapat dilakukan dengan melihat secara langsung bercak dan cara tidak langsung. Cara tidak langsung dapat digolongkan menjadi dua : pertama dengan mereaksikan komponen sampel /senyawa yang ada di bercak itu dengan pereaksi semprot. Diberikan beberapa contoh pereaksi semprot dan warna yang terjadi dari
beberapa golongan senyawa. Kedua memberikan perlakuan tetapi tanpa merusakkan senyawa komponen sampel, yaitu menyinari dengan lampu ultraviolet.
Analisis Kualitatif
Pada analisis kualitatif diperlukan senyawa murni pembanding. Sampel dielusi pada sistem yang sama dengan senyawa pembanding, bila sampel dan senyawa pembanding selalu memberikan bercak dengan nilai Rf yang sama pada walaupun sistem yang berbeda, maka senyawa sampel identik dengan senyawa pembanding. Dipelajari hubungan struktur molekul senyawa dengan polaritas, sehingga dapat diprediksi Rf suatau senyawa.
Analisis Kuantitatif
Berdasarkan adanya hubungan antara luas bercak dengan berat senyawa yang terkandung pada bercak, maka senyawa di dalam sampel dapat diukur kadarnya dengan membuat persamaan regresi senyawa baku pembanding.
KLT preparatif
Untuk mendapatkan bobot sampel yang cukup untuk pemeriksaan selanjutnya, digunakan KLT preparatif. Pada dasarnya sama antara KLT analitik dan KLT preparafif. Hanya fase diam pada KLT preparatif lebih tebal dari fase diam pada KLT analitik, dan sampel ditotolkan sebagai garis.
Kromatografi Lapisan Tipis Kinerja Tinggi (KLTKT)
KLTKT adalah KLT menggunakan fase diam berukuran lebih halus dengan ukuran diameter fase diam berdistribusi sempit (5-10µm). KLT ini memberikan harga (N) yang tinggi, lebih efisien.
Bioautografi
Diberikan contoh kepada mahasiswa suatu teknik KLT yang diaplikasikan untuk memisahkan senyawa dari campurannya yang kemudian diikuti secara langsung uji bioaktif pada plat hasil elusi. Menggunakan teknik ini dapat diketahui bercak yang biologis aktif, oleh karena itu teknik ini disebut bioautografi.
4.KROMATOGRAFI KERTAS
gerak yang mengandung air, maka air akan terserap kertas menjadi lapisan tipis dipermukaan selulose. Air berfungsi sebagai fase diam dan selulose berfungsi sebagai pendukung, sedangkan cairan lain berfungsi sebagai fase gerak, oleh karena itu dapat digolongkan kromatografi cairan-cairan dan mekanisme pemisahannya adalah partisi. Kertas yang digunakan biasanya kertas saring Whatman No.1. Metoda ini sesuai untuk memisahkan senyawa yang polar misalnya senyawa-senyawa biologi, namun senyawa ksantin dapat dipisahkan dengan baik menggunakan kromatografi kertas. Mahasiswa dapat mempelajari hubungan struktur dan nilai Rf dari senyawa turunan ksantin, menjelaskan terjadinya transisi keto-enol. Visualisasi pada kromatografi kertas sama dengan visualisasi pada KLT, hanya penggunaan pereaksi semprot yang mengandung asam kuat tidak dapat digunakan pada kromatografi kertas.
5. KROMATOGRAFI KOLOM
Bila kromatografi kertas dikelompokkan sebagai kromatografi planar, karena fase diam nampak planar, maka pada kromatografi kolom, fase diam diletakkan didalam tabung silindris, kolom. Umumnya digunakan fase diam silika gel, dengan ukuran partikel lebih besar dari ukuran partikel silika gel untuk KLT, ukuran yang digunakan antara 63-250m. Bila ukuran partikel lebih kecil 63 m maka fase gerak akan mengalir lebih lambat, sehingga perlu ditekan atau hisap untuk mempercepat laju alir. Fase diam lain adalah alumina, selulose, dan sephadex.
Membuat kolom (packing column)
Teknik preparasi kolom dibedakan menjadi dua yaitu cara basah dan cara kering. Teknik cara basah lebih disukai karena dapat dihindari adanya gelembung udara yang terjebak di dalam kolom. Membuat kolom secara basah adalah sbb, fase diam yang digunakan dibuat suspensi dengan fase geraknya, kemudian dimasukkan ke dalam kolom sedikit demi sedikit ke dalam kolom yang sudah berisi fase gerak. Fase diam akan turun perlahan (gravitasi) mengisi kolom, sersusun teratur homogen. Sedangkan teknik cara kering adalah meletakkan fase diam kering ke dalam kolom, bila perlu secara mekanik fase diam yang berada di kolom ditekan dengan alat supaya lebih mampat.
Elusi (pengembangan)
Fase gerak yang digunakan sama seperti kromatografi lainnya (KLT, Kromatografi kertas), dimasukkan kedalam kolom dengan cara dituangkan sedikit demi sedikit atau dialirkan dari bejana yang diletakkan diatas kolom. Fase gerak mengalir menelusuri kolom dengan sendirinya (gravitasi) atau dengan bantuan tekanan. Dibedakan dua jenis cara elusi yaitu pertama : Elusi secara isokratik, adalah selama proses elusi menggunakan fase gerak dengan polaritas tetap. Kedua elusi secara gradien disebut juga solvent programming yaitu selama proses elusi polaritas fase gerak berubah-ubah. Fase gerak yang masuk ke dalam kolom seperti kromatografi yang lain disebut eluen, sedang yang keluar dari kolom disebut eluat atau efluen, Eluat dengan volume tertentu ditampung ke dalam wadah, disebut fraksi.
Mendeteksi komponen yang dipisahkan
Kromatografi kolom yang konvensional tidak dilengkapi detektor, namun sekarang dapat digunakan dengan mengalirkan eluate(efluen) pada detektor untuk mendeteksi komponen. Umumnya digunakan dan mudah dikerjakan adalah dengan memonitor fraksi menggunakan
KLT. Fraksi yang mempunyai profil bercak KLT yang mirip digabungkan. Selanjutnya gabungan fraksi ini dapat dilakukan kromatografi kolom lagi, demikian seterusnya hingga diperoleh senya wa tunggal (murni).
Bioactive guided isolation
Bilamana pada kegiatan fraksinasi bertingkat diatas, dilakukan pemeriksaan aktivitas biologi terhadap setiap hasil fraksinasi, kemudian kepada hasil fraksinasi yang mempunyai aktivitas terkuat dilakukan fraksinasi dan seterusnya dilakukan pemeriksaan aktivitas biologi maka kegiatan itu disebut Bioactive guided isolation.
6.KROMATOGRAFI GAS (KG) [Pengampu : Ibnu Gholib Gandjar, 3 kali Pertemuan] Pendahuluan
Kromatografi gas (KG) merupakan metode yang dinamis untuk pemisahan dan deteksi senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa gas anorganik dalam suatu campuran. KG merupakan teknik instrumental yang dikenalkan pertama kali pada tahun 1950-an, dan saat ini merupakan alat utama yang digunakan oleh laboratorium untuk melakukan analisis. Perkembangan teknologi yang signifikan dalam bidang elektronik, komputer, dan kolom telah menghasilkan batas deteksi yang lebih rendah serta identifikasi senyawa menjadi lebih akurat melalui teknik analisis dengan resolusi yang meningkat.
KG merupakan teknik analisis yang telah digunakan dalam bidang-bidang: industri, lingkungan, farmasi, minyak, kimia, klinik, forensik, makanan, dll.
Kegunaan umum KG adalah untuk: melakukan pemisahan dinamis dan identifikasi semua jenis senyawa-senyawa organik yang mudah menguap dan juga untuk melakukan analisis kualitatif dan kuantitatif senyawa dalam suatu campuran. KG dapat bersifat destruktif dan dapat bersifat non-destruktif tergantung pada detektor yang digunakan.
KG dapat diotomatisasi untuk analisis sampel-sampel padat, cair, dan gas. Sampel padat dapat diekstraksi atau dilarutkan dalam suatu pelarut sehingga dapat diinjeksikan ke dalam sistem KG; demikian juga sampel gas dapat langsung diambil dengan penyuntik (syringe) yang ketat terhadap gas.
Prinsip Kromatografi Gas
KG merupakan teknik pemisahan yang mana solut-solut yang mudah menguap (dan stabil terhadap panas) bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya. Pada umumnya solut akan terelusi berdasarkan pada peningkatan titik didihnya, kecuali jika ada interaksi khusus antara solut dengan fase diam. Pemisahan pada kromatografi gas didasarkan pada titik didih suatu senyawa dikurangi dengan semua interaksi yang mungkin terjadi antara solut dengan fase diam. Fase gerak yang berupa gas akan mengelusi solut dari ujung kolom lalu menghantarkannya ke detektor. Penggunaan suhu yang meningkat (biasanya pada kisaran 50-3500C) bertujuan untuk menjamin bahwa solut akan menguap dan karenanya akan cepat terelusi.
Ada 2 jenis kromatografi gas: 1. Kromatografi gas–cair (KGC)
Pada KGC ini, fase diam yang digunakan adalah cairan yang diikatkan pada suatu pendukung sehingga solut akan terlarut dalam fase diam sehingga mekanisme sorpsi-nya adalah partisi.
2. Kromatografi gas-padat (KGP)
Pada KGP ini, digunakan fase diam padatan (kadang-kadang polimerik). Mekanisme
sorpsi-nya adalah adsorpsi permukaan.
Sistem Peralatan KG
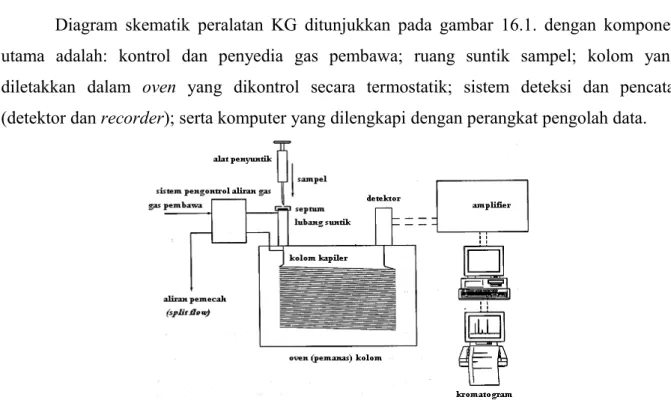
Diagram skematik peralatan KG ditunjukkan pada gambar 16.1. dengan komponen utama adalah: kontrol dan penyedia gas pembawa; ruang suntik sampel; kolom yang diletakkan dalam oven yang dikontrol secara termostatik; sistem deteksi dan pencatat (detektor dan recorder); serta komputer yang dilengkapi dengan perangkat pengolah data.
Gambar. Diagram skematik pada KG.
Fase Gerak pada KG
Fase gerak pada KG juga disebut dengan gas pembawa karena tujuan awalnya adalah untuk membawa solut ke kolom, karenanya gas pembawa tidak berpengaruh pada selektifitas. Syarat gas pembawa adalah: tidak reaktif; murni/kering karena kalau tidak murni akan berpengaruh pada detektor; dan dapat disimpan dalam tangki tekanan tinggi (biasanya merah untuk hidrogen, dan abu-abu untuk nitrogen).
Gas pembawa biasanya mengandung helium, nitrogen, hidrogen, atau campuran argon dan metana. Pemilihan gas pembawa tergantung pada penggunaan spesifik dan jenis detektor yang digunakan. Helium merupakan tipe gas pembawa yang sering digunakan karena memberikan efisiensi kromatografi yang lebih baik (mengurangi pelebaran pita). Penggunaan gas dengan berbagai jenis detektor diringkas dalam tabel 16.1.
Tabel 16.1. Gas pembawa dan pemakaian detektor
Gas pembawa Detektor Hidrogen Hantar panas Helium Hantar panas Ionisasi nyala Fotometri nyala
Termoionik Nitrogen Ionisasi nyala
Tangkap elektron Fotometri nyala Termoionik Argon Ionisasi nyala Argon + metana 5% Tangkap elektron Karbon dioksida Hantar panas
Untuk setiap pemisahan dengan KG terdapat kecepatan optimum gas pembawa yang utamanya tergantung pada diameter kolom. Kecepatan alir gas kira-kira 50-70 ml/menit untuk kolom dengan diameter dalam 6 mm, 25-30 ml/menit untuk kolom dengan diameter dalam 3 mm, dan 0,2-2 ml/menit untuk kolom kapiler. Pada dasarnya, kecepatan alir gas pembawa berbanding lurus dengan penampang kolom, dan penampang kolom tergantung pada jari-jari pangkat dua (luas lingkaran = лr2). Oleh karena itu, jika diameter kolom menjadi 2 kali lebih besar, maka kecepatan alir gas pembawa yang diperlukan 4 kali lebih besar daripada kecepatan alir gas pembawa pada kolom yang lebih kecil. Sebagai contoh, jika diperoleh hasil pemisahan yang baik dengan kolom 2 mm pada kecepatan aliran gas pembawa 20 ml/menit, maka untuk memperoleh hasil yang sama dengan kolom 4 mm diperlukan kecepatan alir gas pembawa 80 ml/menit. Dengan demikian penggunaan kolom dengan diameter yang kecil akan menghemat gas pembawa secara signifikan.
Kolom kapiler memakai kecepatan alir gas yang rendah, yakni antara 0,2-2 ml/menit. Pada tekanan tetap, kecepatan alir gas meningkat dengan meningkatnya suhu (sebagaimana dalam suhu terprogram). Sistem yang baru dan dikendalikan dengan mikroprosesor dapat mengoreksi perubahan kecepatan alir gas pembawa yang disebabkan oleh suhu. Karena kecepatan alir gas pembawa pada kolom kapiler sangat rendah, maka pada kebanyakan detektor ditambah gas tambahan yang ditambahkan ke dalam efluen setelah keluar dari kolom tetapi belum mencapai detektor. Gas tambahan biasanya sama dengan gas pembawa, meskipun kadangkala digunakan helium.
Gas pembawa bekerja paling efisien pada kecepatan alir tertentu. Gas nitrogen akan efisien jika digunakan dengan kecepatan alir ± 10 ml/menit, sementara helium akan efisien pada kecepatan alir 40 ml/menit.
Ruang suntik sampel pada KG
Komponen KG yang utama selanjutnya adalah ruang suntik atau inlet. Fungsi dari ruang suntik ini adalah untuk mengantarkan sampel ke dalam aliran gas pembawa. Berbagai macam jenis inlet dan teknik pengantar sampel telah tersedia. Penyuntikan sampel dapat dilakukan secara manual atau secara otomatis (yang dapat menyesuaikan sejumlah sampel).
Sampel yang akan dikromatografi dimasukkan ke dalam ruang suntik melalui gerbang suntik yang biasanya berupa lubang yang ditutupi dengan septum atau pemisah karet. Ruang suntik harus dipanaskan tersendiri (terpisah dari kolom) dan biasanya 10-150C lebih tinggi daripada suhu kolom maksimum. Jadi seluruh sampel akan menguap segera setelah sampel disuntikkan.
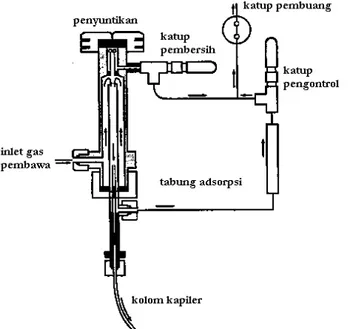
Pada kolom kapiler, sampel yang diperlukan sangat sedikit bahkan sampai 0,01 μl karenanya berbeda dengan kolom kemas yang memerlukan 1-100 μl sampel. Karena pengukuran secara akurat sulit dilakukan jika sampel yang disuntikkan terlalu kecil (pada kolom kapiler), maka ditempuh suatu cara untuk mengecilkan ukuran sampel setelah penyuntikan. Salah satu cara yang dilakukan adalah dengan menggunakan teknik pemecah suntikan (split injection) (gambar 16.2). Dengan menggunakan pemecah suntikan ini, sampel yang banyaknya diketahui, seperti biasanya, disuntikkan ke dalam aliran gas pembawa dan sebelum masuk ke kolom, gas pembawa ini dibagi menjadi 2 aliran. Satu aliran akan masuk ke kolom dan satunya lagi akan dibuang. Aliran relatif dalam kedua aliran ini dikendalikan dengan sejenis penghambat seperti katup jarum pada aliran yang dibuang. Laju alir di dalam kedua aliran diukur dan ditentukan nisbah (rasio) pemecahannya. Jika 1 μl sampel dimasukkan ke dalam pemecah aliran yang mempunyai nisbah pemecahan 1:100, maka sebanyak 0,01 μl sampel masuk ke kolom sedangkan sisanya akan dibuang.
Gambar 16.2. Diagram skematik lubang injeksi yang dipecah (split injection)/tanpa dipecah (splitless injection).
Penyiapan sampel dan penyuntikan
Sampel yang ideal dalam kromatografi gas adalah sampel yang hanya mengandung senyawa yang akan dipisahkan dalam kolom, dan dalam banyak hal juga pelarut yang mudah menguap yang melarutkan sampel tersebut. Walaupun cairan yang mudah menguap (tidak dalam larutan) serta zat padat yang mudah menguap dapat langsung disuntikkan, tetapi
kebanyakan dilarutkan dulu dalam pelarut organik baru kemudian disuntikkan. Konsentrasi sampel biasanya berkisar antara 1-10%. Komponen yang tidak mudah menguap atau tingkat menguapnya rendah tidak boleh ada dalam sampel, karena komponen ini akan tertinggal di ruang suntik yang pada akhirnya akan mengurangi kinerja kolom.
Pelarut sampel yang paling umum digunakan adalah: hidrokarbon bertitik didih rendah, etil eter, alkohol, dan keton. Pelarut yang dipilih harus mempunyai sifat yang berbeda secara nyata dengan sampel yang dianalisis.
Penyuntikan dalam KG dapat dilakukan dengan memakai alat suntik (semprit) kedap gas atau sistem penyuntikan yang telah dirancang secara khusus. Kebanyakan penyuntikan dilakukan dengan menggunakan alat penyuntik mikro.
Dalam kasus tertentu dapat dilakukan penyuntikan langsung ke dalam kolom (on
column injection) tanpa melalui lubang penyuntikan. Teknik ini digunakan untuk
senyawa-senyawa yang mudah menguap sehingga kalau penyuntikannya melalui lubang suntik secara langsung dikhawatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi (pirolisis).
Kolom pada KG
Kolom merupakan tempat terjadinya proses pemisahan karena di dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada KG. Ada 2 jenis kolom pada KG yaitu kolom kemas (packing column) dan kolom kapiler (capillary column). Gambar penampang kolom kemas dan kolom kapiler dapat dilihat ada gambar 16.3.
Kolom kemas terdiri atas fase cair (sekurang-kurangnya pada suhu kromatografi) yang tersebar pada permukaan penyangga yang lembam (inert) yang terdapat dalam tabung yang relatif besar (diameter dalam 1-3 mm). Fase diam hanya dapat dilapiskan saja pada penyangga atau terikat secara kovalen pada penyangga yang menghasilkan fase terikat. Kolom kapiler jauh lebih kecil (0,02-0,2 mm) dan dinding kapiler bertindak sebagai penyangga lembam untuk fase diam cair. Fase diam ini dilapiskan pada dinding kolom atau bahkan dapat bercampur dengan sedikit penyangga lembam yang sangat halus untuk memperbesar luas permukaan efektif. Perbedaan kedua kolom ini (kolom kemas dan kolom kapiler) diringkas dalam tabel 16.2.
Gambar 16.3. Penampang kolom kemas (a) dan kolom kapiler (b).
Tabel 16.2. Perbandingan kolom kemas dan kolom kapiler
Parameter Kolom kemas Kolom kapiler Tabung Baja tahan karat
(stainless steel). Silika (SiOkemurnian yang sangat 3) dengan tinggi (kandungan logam < 1 ppm).
Panjang 1-5 m 5-60 m diameter dalam 2-4 mm 0,10-0,53 mm Jumlah lempeng/meter 1000 5000
Total lempeng 5000 300.000 Tebal lapisan film 10 mikron 0,05-1 mikron Resolusi Rendah Tinggi Kec. alir (mL/menit) 10-60 0,5-1,5
Kapasitas 10 μg/puncak < 100 ng/puncak
Ketika menggambarkan suatu kolom, seseorang biasanya menyatakan panjang kolom (dalam meter), diameter kolom (dalam milimeter), ketebalan lapisan fase diam (dalam mikrometer), dan jenis fase diam, misalkan suatu kolom dapat dinyatakan sebagai berikut:
30 m x 0,53 mm x 0,88 mm OV-101 5% pada Chromosorb 80/ 100
panjang kolom diameter
ketebalan lapisan
Jenis fase
dan konsentrasi Jenis pendukung
Semakin sempit diameter kolom, maka efisiensi pemisahan kolom semakin besar atau puncak kromatogram yang dihasilkan semakin tajam. Pada umumnya, seorang analis akan memilih kolom dengan diameter 0,2 atau yang lebih kecil ketika menganalisis sampel dengan konsentrasi sekelumit atau ketika seorang analis akan memisahkan komponen yang sangat kompleks.
a. Kolom kemas
Jenis kolom ini terbuat dari gelas atau logam yang tahan karat atau dari tembaga dan aluminium. Panjang kolom jenis ini adalah 1–5 meter dengan diameter dalam 1-4 mm.
Efisiensi kolom akan meningkat dengan semakin bertambah halusnya partikel fase diam ini. Semakin kecil diameter partikel fase diam, maka efisiensinya akan meningkat. Ukuran partikel fase diam biasanya berkisar antara 60–80 mesh (250- 170 μm). Untuk KGC dipakai lapisan tipis pada padatan pendukung dengan ketebalan 1-10 μm, dan maksimum fase diam cair yang terdapat pada padatan pendukung adalah 10%.
b. Kolom kapiler
Jenis kolom ini berbeda dengan kolom kemas, dalam hal adanya rongga pada bagian dalam kolom yang menyerupai pipa (tube). Oleh karena itu kolom kapiler juga disebut ”Open
tubular columns”. Fase diam melekat mengelilingi dinding dalam kolom. Ada empat macam
jenis lapisan pada kolom kapiler ini, yaitu: WCOT (Walll Coated Open Tube); SCOT
(Support Coated Open Tube); PLOT (Porous Layer Open Tube); dan FSOT (Fused Silica
Open Tube).
Kolom kapiler sangat banyak dipakai atau lebih disukai oleh para ilmuan. Salah satu sebabnya antara lalin kemampuan kolom kapiler memberikan harga jumlah pelat teori yang sangat besar (> 300.000 pelat).
Banyak macam bahan kimia yang dipakai sebagai fase diam antara lain: squalen, DEGS (Dietilglikol suksinat), OV-17 (phenil methyl silicone oil). Semakin tipis lapisan penyalut sebagai fase diam, maka semakin tinggi suhu operasionalnya. Untuk lapisan salut < 1 μm, suhu operasional dapat mencapai 460ºC, sementara itu suhu minimalnya dapat mencapai - 60ºC.
Fase diam yang dipakai pada kolom kapiler dapat bersifat non polar, polar, atau semi polar. Fase diam non polar yang paling banyak digunakan adalah metil polisiloksan (HP-1; DB-1; SE-30; CPSIL-5) dan fenil 5%-metilpolisiloksan 95% (HP-5; DB-5; SE-52; CPSIL-8). Fase diam semi polar adalah seperti fenil 50%-metilpolisiloksan 50% (HP-17; DB-17; CPSIL-19), sementara itu fase diam yang polar adalah seperti polietilen glikol (HP-20M; DB-WAX; CP-DB-WAX; Carbowax-20M). Jenis fase diam akan menentukan urutan elusi komponen-komponen dalam campuran. Seorang analis harus memilih fase diam yang mampu memisahkan komponen-komponen dalam sampel. Contoh fase diam, kegunaan untuk analisis golongan senyawa, polaritas, dan suhu maksimum operasi yang diizinkan diringkas pada tabel 16.3.
Tabel 16.3. Jenis Fase Diam dan Penggunaannya
Squalen non polar hidrokarbon 125oC
Apiezon L non polar Hidrokarbon,
ester, eter 300
oC
Metil silikon non polar Steroid, pestisida, alkaloida, ester 300
oC
Dionil ptalat semi polar Semua jenis 17oC
Dietilenglikolsuksinat polar Ester 200oC
Carbowax 20M polar Alkohol, amina aromatik, keton
250oC
Suhu Kolom
KG didasarkan pada 2 sifat senyawa yang dipisahkan yakni (i) kelarutan senyawa dalam cairan tertentu, dan (ii) tekanan uapnya atau keatsiriannya (titik didih senyawa). Karena tekanan uap berbanding langsung dengan suhu, maka suhu merupakan faktor yang utama pada KG. Walaupun suhu kolom dapat berkisar antara -100– 4000C, dalam prakteknya beberapa pembatas harus diperhatikan. Beberapa fase diam menjadi padat pada suhu rendah (misalnya Carbowax menjadi padat pada suhu dibawah 500C dan beberapa silikon seperti gom metil silikon akan menjadi padat pada suhu di bawah 1000C). Selain itu, suhu pemakaian kolom yang mengandung fase diam ini dibatasi juga oleh kestabilannya. Beberapa fase diam jika digunakan suhu yang terlalu tinggi akan terurai secara perlahan-lahan. Suhu minimum dan maksimum berbagai jenis fase diam yang dianjurkan terdapat dalam tabel 16.4.
Tabel 16.4. Suhu minimum dan maksimum beberapa fase diam pada KG
Fase diam Suhu minimum (0C) Suhu maksimum
(0C)
Apiezon L 50 255
Metil silikon 0 (untuk gom 100) 300-3500
Fenil/metil silikon 0 300
Carbowax (polietilen glikol) 10-30 225
Sianosilikon 0 275
Alkil ftalat 20 225
Dexsil 50 450
Pemisahan pada KG dapat dilakukan pada suhu tetap yang biasanya disebut dengan
pemisahan isotermal dan dapat dilakukan dengan menggunakan suhu yang berubah secara
terkendali yang disebut dengan pemisahan suhu terprogram.
Pemisahan isotermal paling baik dipakai pada analisis rutin atau jika kita mengetahui agak banyak sifat sampel yang akan dipisahkan. Pilihan awal pada pemisahan isotermal ini adalah suhu yang digunakan beberapa derajat di bawah titik didih komponen campuran utama. Ada 2 hal yang perlu diperhatikan terkait dengan penggunaan pemisahan isotermal ini, yaitu: (1) terkait dengan pemilihan suhu. Jika suhu yang digunakan terlalu tinggi maka komponen akan terelusi tanpa terpisah, sementara jika suhu terlalu rendah maka komponen yang bertitik didih tinggi akan keluar sangat lambat atau bahkan tetap dalam kolom sehingga
akan mengacaukan proses kromatografi selanjutnya, dan (2) terkait dengan proses kromatografi, karena makin lama suatu sampel dalam kolom maka semakin lebar alas puncaknya. Kedua hal ini dapat diatasi jika digunakan pemisahan dengan suhu terprogram.
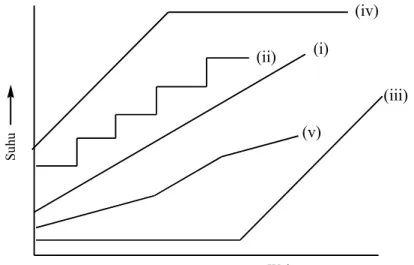
Pemisahan dengan suhu terprogram mempunyai keuntungan, yakni mampu meningkatkan resolusi komponen-komponen dalam suatu campuran yang mempunyai titik didih pada kisaran yang luas. Disamping itu, pada suhu terprogram juga mampu mempercepat keseluruhan waktu analisis, karena senyawa-senyawa dengan titik didih tinggi akan terelusi lebih cepat. (i) (iv) (ii) (iii) (v) Waktu S uh u
Gambar 16.4. Lima jenis pemrograman suhu (i) linier dengan laju yang kita inginkan. (ii) bertahap. (iii) isotermal yang diikuti penaingkatan suhu secara linier. (iv) linier diikuti dengan isotermal. (v) multilinier.
Pemrograman suhu dilakukan dengan menaikkan suhu dari suhu tertentu ke suhu tertentu yang lain dengan laju yang diketahui dan terkendali dalam waktu tertentu. Prosesnya dapat dilakukan dengan berbagai macam cara (gambar 16.4), antara lain: (i) linier dengan laju yang kita inginkan, (ii) bertahap, (iii) isotermal yang diikuti peningkatan suhu secara linier, (iv) linier diikuti dengan isotermal, (v) multilinier (laju berbeda pada saat yang berlainan). Perubahan suhu ini dapat dilakukan secara manual. Untuk KG yang dilengkapi dengan komputer, hal ini dapat dilakukan secara otomatis.
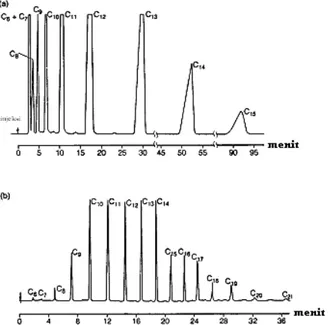
Gambar 16.5. merupakan kromatogram yang diperoleh dari hasil pemisahan seri n-alkana yang dilakukan secara isotermal (pada suhu 1500C; pada gambar a) dan pada suhu terprogram (pada gambar b). Pada pemisahan n-alkana diatas secara isotermal (gambar a), heksana (C6)
sampai dekana (C10) tidak terpisah secara sempurna, sementara itu dengan menggunakan suhu
Gambar 16.5. Pemisahan seri n-alkana yang dilakukan pada suhu isotermal (gambar a) dan pada suhu terprogram (pada gambar b); kolom: Apiezon 3%; kecepatan alir fase gerak (Helium): 10 ml/menit.
Regenerasi Kolom
Setelah kolom dipakai dalam jangka waktu sekian lama, kemungkinan yang paling sering terjadi adalah penyumbatan kolom. Hal ini sering terjadi pada kolom kapiler. Akibat dari hal tersebut maka kinerja kolom akan menurun, khususnya untuk kolom yang fase diamnya adalah fase terikat. Apabila terjadi penyumbatan pada kolom kapiler atau menurunnya kinerja kolom, maka perlu dilakukan regenerasi untuk meremajakan atau mengembalikan kinerja kolom pada kondisi semula.
Ada tiga cara regenerasi kolom yaitu : a. Pemotongan kolom
Pemotongan kolom biasanya dilakukan jika terjadi penyumbatan pada ujung depan kolom (terutama kolom kapiler). Komponen-komponen sampel yang tidak dapat diatsirikan (diuapkan) sering menyumbat kolom pada ujung depannya. Salah satu tanda adanya penyumbatan pada kolom adalah adanya puncak kromatogram yang melebar atau berekor. Pengatasan masalah ini yang umum dilakukan adalah dengan cara memotong kolom kapiler tersebut sepanjang 50 cm dari ujung depannya. Biasanya pemotongan dikerjakan dengan memakai pemotong intan yang ujungnya sangat tajam (pensil intan).
b. Pengkondisian (Conditioning)
Pengkondisian ini bersifat untuk memelihara kolom agar waktu hidup (life time)-nya cukup lama. Pengkondisian dilakukan lebih kurang 30 menit sebelum dan sesudah analisis, tergantung pada kontaminasinya. Oleh karena itu, dapat saja dilakukan pengkondisian lebih dari 30 menit. Suhu yang dipakai pada saat pengkondisian sebaiknya terprogram dengan kenaikan 5ºC/menit sampai suhu operasional.
c. Pencucian kolom
Untuk kolom fase terikat sebaiknya dilakukan pencucian dengan memakai tangki (tabung) pencuci yang dilakukan di luar oven. Yang terbaik untuk dipakai sebagai larutan pencuci adalah pentana yang dapat dipakai sebagai larutan pencuci semua jenis kolom. Untuk mencuci material pengotor yang lebih polar dapat juga dipakai metilen klorida atau metanol.
Setelah proses pencucian maka diusahakan semua cairan pencuci keluar dari kolom. Pada saat instalasi kembali, kolom yang telah dicuci jangan dihubungkan langsung dengan detektor.
Detektor pada KG
Komponen utama selanjutnya dalam kromatografi gas adalah detektor. Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluar fase gerak (gas pembawa) yang membawa komponen hasil pemisahan. Detektor pada kromatografi adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas pembawa dan komponen-komponen di dalamnya menjadi sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak.
Pada garis besarnya detektor pada KG termasuk detektor diferensial, dalam arti respons yang keluar dari detektor memberikan relasi yang linier dengan kadar atau laju aliran massa komponen yang teresolusi. Kromatogram yang merupakan hasil pemisahan fisik komponen-komponen oleh KG disajikan oleh detektor sebagai deretan luas puncak terhadap waktu. Waktu tambat tertentu dalam kromatogram dapat digunakan sebagai data kualitatif, sedangkan luas puncak dalam kromatogram dapat dipakai sebagai data kuantitatif yang keduanya telah dikonfirmasikan dengan senyawa baku. Akan tetapi apabila kromatografi gas digabung dengan instrumen yang multipleks misalnya GC/FT-IR/MS, kromatogram akan disajikan dalam bentuk lain.
Beberapa sifat detektor yang digunakan dalam kromatografi gas ditunjukkan oleh tabel 16.5.
Tabel 16.5. Jenis-jenis detektor, batas deteksi, jenis sampel-sampelnya dan kecepatan alir gas pembawa
Jenis detektor Jenis sampel Batas
deteksi Kecepatan alir (mL/menit)Gas
pem-bawa
H2 Udara
Hantar panas Senyawa umun 5-100 ng 15-30 - -Ionisasi nyala Hidrokarbon 10-100 pg 20-60 30-40 200-500 Penangkap Halogen organik, 0,05-1 pg 30-60 -
-Nitrogen-fosfor Senyawa nitrogen organik dan Fosfat organik 0,1-10 g 20-40 1-5 70-100 Fotometri nyala (393 nm) Senyawa-senyawa sullfur 10-100 pg 20-40 50-70 60-80 Fotometri nyala
(526 nm) Senyawa-senyawa fosfor 1-10 pg 20-40 120-170 100-150 Fotoionisasi Senyawa-senyawa yang terionisasi dengan UV 2 pg C/detik 30-40 - - Konduk-tivitas elektrolitik Halogen, N, S 0,5 pg Cl 2 pg S 4 pg N 20-40 80 -Fourier Transform-infra merah (FT-IR) Senyawa-senyawa organik 1000 pg 3-10 -
-Selektif massa Sesuai untuk senyawa apapun
10 pg-10 ng
0,5-30 -
-Emisi atom Sesuai untuk
elemen apapun 20 pg0,1- 60-70 -
-Berikut akan dijelaskan detektor yang sering digunakan dalam kromatografi gas: a. Detektor hantar panas (Thermal Conductivity Detektor =TCD)
Detektor ini didasarkan bahwa panas dihantarkan dari benda yang suhunya tinggi ke benda lain di sekelilingnya yang suhunya lebih rendah. Kecepatan penghantaran panas ini tergantung susunan gas yang mengelilinginya. Jadi setiap gas mempunyai daya hantar panas yang kecepatannya merupakan fungsi dari laju pergerakan molekul gas yang pada suhu tertentu merupakan fungsi dari berat molekul gas. Gas yang mempunyai berat molekul rendah mempunyai daya hantar lebih tinggi. Jika ada komponen/senyawa yang dibawa fase gerak masuk kedalam detektor, karena BM senyawa biasanya tinggi maka daya hantar menjadi turun.
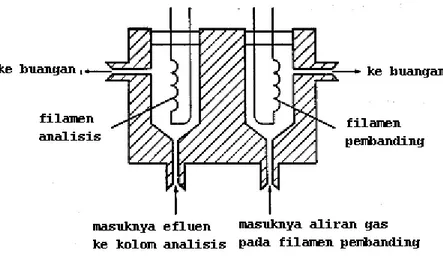
Di dalam detektor ini (gambar 16.6) dipasang filamen ganda yang dibuat dari platina atau campuran logam tungsten-rhenium yang tahan panas hingga 400oC (mirip dengan lampu pijar wolfram). Satu filamen ditempatkan di dalam efluen kolom, dan satu filamen lagi diletakkan pada aliran fase gerak sebelum memasuki tempat penyuntikan sampel dan digunakan sebagai pembanding (filamen pembanding) pada suhu yang sama dengan suhu pada efluen kolom. Filamen ini dialiri listrik untuk memanaskannya. Kedua filamen ini dihubungkan dengan rangkaian listrik yang disebut jembatan Wheatstone, untuk menyeimbangkan arus listrik. Bila molekul sampel masuk ke dalam detektor, maka sampel akan menurunkan daya hantar panas, akibatnya filamen menjadi lebih panas (suhu mejadi lebih tinggi) yang menyebabkan naiknya tahanan sehingga menurunkan arus listrik. Perbedaan arus listrik antara 2 filamen ini dikirimkan ke rekorder atau sistem pengolah data yang kemudian ditampilkan sebagai kromatogram.
Masalah utama dalam detektor ini adalah bahwa filamen harus dilindungi dari udara ketika filamen itu panas. Jadi, filamen tidak boleh dipanaskan tanpa dialiri gas pembawa. Banyak instrumen mutakhir yang telah dirancang untuk mengatasi hal ini artinya filamen hanya dapat dipanasi jika gas pembawa mengalir. Detektor biasanya dibersihkan dengan melepaskannya dari sistem dan merendamkannya dalam sederet pelarut seperti dekalin, metanol, air, dan aseton. Setelah pengeringan (sebelum dipakai), detektor dipanaskan di dalam aliran gas pembawa kromatografi selama 24 jam.
Gambar 16.6. Diagram skematik detektor hantar panas.
Secara teoritis detektor ini memberi keuntungan bahwa komponen yang dideteksi tidak rusak, sehingga memungkinkan komponen dikumpulkan untuk analisis lebih lanjut. Detektor hantar panas termasuk detektor konsentrasi, yakni semua molekul yang melewatinya diukur jumlahnya dan tidak tergantung pada laju aliran fase gerak.
b. Detektor Ionisasi Nyala (Flame Ionization Detektor = FID)
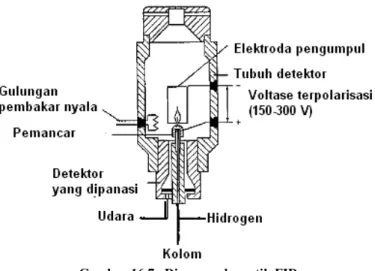
Pada dasarnya senyawa organik bila dibakar akan terurai menjadi pecahan sederhana bermuatan positif, biasanya terdiri atas satu karbon (C+). Pecahan ini meningkatkan daya hantar di sekitar nyala, tempat yang telah dipasang elektroda, dan peningkatan daya hantar ini dapat diukur dengan mudah dan direkam. Dengan demikian, gas efluen dari kolom dialirkan ke dalam nyala hidrogen yang terbakar di udara. Sampel yang dibawa oleh gas pembawa mengalir ke dalam nyala dan diuraikan menjadi ion. Ion ini akan meningkatkan daya hantar dan karenanya akan meningkatkan arus listrik yang mengalir diantara 2 elektroda. Arus itu selanjutnya diperkuat di amplifier dan direkam oleh rekorder.
Detektor ionisasi nyala (FID) ini mengukur jumlah atom karbon, dan bukan jumlah molekul seperti pada TCD. FID pada dasarnya bersifat umum untuk hampir semua senyawa organik (senyawa fluoro tinggi dan karbon disulfida tidak terdeteksi). Disamping itu, respon FID sangat peka, dan linier ditinjau dari segi ukuran cuplikan, serta teliti.
Gambar 16.7. Diagram skematik FID.
Pada pamakaian FID, ada beberapa hal yang perlu diperhatikan: pertama, kecepatan alir O2 (udara) dan H2. Untuk memperoleh tanggapan FID yang optimal sebaiknya kecepatan aliran H2 ± 30 ml/menit dan O2 sepuluh kalinya. Kedua adalah bahwa suhu FID harus diatas 100oC. Hal ini bertujuan untuk mencegah kondensasi uap air yang mengakibatkan FID berkarat atau kehilangan (menurun) sensitivitasnya. Kalau memungkinkan pada selang waktu tertentu dengan pertolongan mekanik, maka dapat dilakukan pembersihkan bagian atas FID (kolektor) yang mungkin telah dilapisi berbagai macam kotoran.
c. Detektor tangkap elektron (Elektron Capture Detektor = ECD)
Detektor ini dilengkapi dengan sumber radio aktif yaitu tritium (3H ) atau 63Ni yang ditempatkan diantara dua elektroda. (Gambar 16.8). Tegangan listrik yang dipasang antara katoda dan anoda tidak terlalu tinggi, antara 2-100 volt. Dasar kerja detektor ini adalah: penangkapan elektron oleh senyawa yang mempunyai afinitas terhadap elektron bebas, yaitu senyawa yang mempunyai unsur-unsur elektronegatif.
Bila fase gerak (gas pembawa N2) masuk ke dalam detektor maka sinar β akan mengionisasi molekul N2 menjadi ion-ion N2+ dan menghasilkan elektron (bebas) yang akan bergerak ke anoda dengan lambat. Dengan demikian, di dalam ruangan detektor terdapat semacam awan elektron bebas yang dengan lambat menuju anoda. Elektron-elektron yang terkumpul pada anoda akan menghasilkan arus garis dasar (baseline current) yang steady dan memberikan garis dasar pada kromatogram. Bila komponen sampel (senyawa dengan unsur elektronegatif) dibawa fase gerak masuk ke dalam ruang detektor yang dipenuhi awan elektron, maka senyawa ini akan menangkap elektron sehingga membentuk ion molekul negatif. Ion molekul ini akan dibawa oleh fase gerak (carrier gas). Akibatnya setiap partikel negatif dibawa keluar detektor, berarti menyingkirkan satu elektron dari sistem sehingga arus
listrik yang steady tadi akan berkurang. Pengurangan arus ini akan dicatat oleh rekorder sebagai puncak pada kromatogram.
Gambar 16.8. Diagram skematik detektor tangkap elektron.
d. Detektor nitrogen-fosfor (Nitrogen Phosphorous Detektor =NPD)
Pada prinsipnya NPD mirip dengan FID, hanya saja fenomena mekanisme nyala plasma belum jelas. Ada kemungkinan terjadi peristiwa pemadaman (quenching) dari nyala plasma dan logam alkali oleh nitrogen /fosfor yang berasal dari sampel.
NPD sangat selektif terhadap nitrogen dan fosfor karena adanya elemen aktif diatas aliran kapiler yang terbakar oleh plasma (1600oC). Elemen aktif merupakan logam kalium atau rubidium atau cesium yang dilapiskan pada silinder kecil alumunium. Kegunaan elemen aktif garam metal alkali adalah sebagai sumber ion di dalam plasma yang bertugas menekan ionisasi hidrokarbon di dalam plasma, akan tetapi sebaliknya menaikkan ionisasi sampel yang mengandung N atau P.
Efisiensi ionisasi N dan P oleh sumber termoionik tersebut juga dibantu dengan menekan aliran H2 dan O2 (udara sebagai bahan bakar plasma). Pada proses ini, untuk mendapatkan efisiensi ionisasi N dan P dipakai laju aliran udara (O2) ± 70-90 ml/ menit dan dipakai laju aliran H2 ± 6 ml/menit. Laju aliran ini sangat dipengaruhi oleh jenis sampel yang dianalisis.
Beberapa hal yang sangat penting untuk diperhatikan apabila memilih NPD pada KG adalah : pertama, dijaga kontinuitas aliran H2, O2 dan efluen pada laju konstan, sebab perubahan sedikit laju aliran akan memberikan hasil yang sangat berbeda. Kedua, dijaga kemurnian segala sesuatu yang menyangkut analisis terhadap kontaminasi unsur-unsur N dan P. Alat-alat gelas harus betul-betul bersih (sangat bersih) dan terbebas dari sesepora bekas deterjen fosfat, dan pembersih gelas dari asam juga harus dibilas betul-betul dengan air suling.
pelarut yang mengandung klor atau silan karena akan menurunkan umur hidup (life time)
pemakaian detektor ini. Demikian juga hindarilah pemakaian bahan anti bocor (perekat) yang terbuat dari fosfat pada detektor, gelas wool pada kolom, lapisan poliamida pada kolom, atau fase cair yang mengandung nitrogen sebagai fase diam (OV-225 atau XE-60) karena kesemua hal tersebut akan mengundang derau (noise) yang lebih besar. Gas pengelusi yang baik adalah helium dengan laju aliran yang umum dipakai 30 ml/menit. NPD sangat baik dalam analisis dibidang farmasi dan klinik dismping itu sangat baik pula untuk mendukung analisis mengenai dampak lingkungan.
Gambar 16.9. Diagram skematik NPD.
e. Detektor fotometri nyala
Detektor fotometri nyala menggunakan prinsip bahwa ketika senyawa yang mengandung sulfur atau fosfor dibakar dalam nyala hidrogen-oksigen, maka akan terbentuk spesies-spesies yang tereksitasi yang akan runtuh (decay) dan menghasilkan suatu emisi kemiluminesen yang spesifik yang dapat diukur pada panjang gelombang tertentu. Untuk yang mengandung atom S, diukur pada panjang gelombang 393 nm, sementara yang mengandung fosfor diukur pada panjang gelombang 526 nm.
f. Detektor konduktivitas elektrolitik
Detektor konduktivitas elektrolitik merupakan detektor yang spesifik untuk mendeteksi senyawa yang mengandung atom sulfur, nitrogen, dan halogen. Detektor ini tersusun atas tungku (furnace) yang mampu memberikan suhu paling kecil 1000C. Efluen dari kolom KG akan memasuki tungku lalu dipirolisiskan dalam suatu udara yang kaya hidrogen atau oksigen. Hasil-hasil dari pirolisis ini selanjutnya dicampur dengan pelarut yang sesuai dan menghasilkan suatu larutan yang bersifat konduktif. Adanya perubahan dalam konduktivitas dimonitor.
Ketika suatu senyawa menyerap energi foton dari suatu lampu UV, maka senyawa tersebut akan terionisasi. Hal inilah yang menjadi dasar detektor ini. Senyawa yang terionisasi ini selanjutnya dikumpulkan dan banyaknya arus yang dihasilkan dimonitor.
Detektor ini dapat digunakan untuk deteksi senyawa-senyawa aromatis, keton, aldehid, ester, amin, senyawa-senyawa sulfur organik, senyawa-senyawa anorganik seperti hidrogen sulfida, HI, HCl, klorin, iodium, dan fosfin. Detektor ini akan tanggap terhadap semua senyawa yang mempunyai potensial ionisasi pada kisaran potensial sumber lampu UV atau terhadap senyawa-senyawa yang mempunyai potensial ionisasi kurang dari 12 eV.
Keuntungan lain detektor ini adalah bahwa pelarut-pelarut umum yang sering digunakan seperti metanol, kloroform, metilen klorida, karbon tetraklorida, dan asetonitril tidak memberikan atau sedikit memberikan tanggapan (respon), jika digunakan lampu UV yang mempunyai potensial ionisasi 12 eV. Lampu-lampu yang paling umum digunakan dan tersedia di pasaran adalah lampu dengan potensial ionisasi 9,5; 10,0; 10,2; 10,9; dan 11,7 eV. Untuk meningkatkan selektifitas detektor, lampu harus dipilih yang hanya dapat mengionisasi analit yang dituju saja.
h. Detektor spektrometer massa
Spektrometer massa jika digunakan sebagai detektor maka akan mampu memberikan informasi data struktur kimia senyawa yang tidak diketahui. Dengan menggunakan spektrometer massa untuk memonitor ion tunggal atau beberapa ion yang karakteristik dalam analit, maka batas deteksi ion-ion ini akan ditingkatkan.
Derivatisasi pada Kromatografi Gas
Derivatisasi merupakan proses kimiawi untuk mengubah suatu senyawa menjadi senyawa lain yang mempunyai sifat-sifat yang sesuai untuk dilakukan analisis menggunakan kromatografi gas. Alasan dilakukannya derivatisasi:
Senyawa-senyawa tersebut tidak memungkinkan dilakukan analisis dengan KG terkait dengan volatilitas dan stabilitasnya.
Untuk meningkatkan batas deteksi dan bentuk kromatogram. Beberapa senyawa tidak menghasilkan bentuk kromatogram yang bagus (misal puncak kromatogram saling tumpang tindih) atau sampel yang dituju tidak terdeteksi, karenanya diperlukan derivatisasi sebelum dilakukan analisis dengan KG.
Meningkatkan volatilitas, misal senyawa gula. Tujuan utama derivatisasi adalah untuk meningkatkan volatilitas senyawa-senyawa yang tidak mudah menguap (non-volatil). Senyawa-senyawa dengan berat molekul rendah biasanya tidak mudah menguap karena adanya gaya tarik-menarik inter molekuler antara gugus-gusug polar karenanya
jika gugus-gugus polar ini ditutup dengan cara derivatisasi akan mampu meningkatkan volatilitas senyawa tersebut secara dramatis.
Meningkatkan deteksi, misal untuk kolesterol dan senyawa-senyawa steroid.
Meningkatkan stabilitas. Beberapa senyawa volatil mengalami dekomposisi parsial karena panas sehingga diperlukan derivatisasi untuk meningkatkan stabilitasnya.
Meningkatkan batas deteksi pada penggunaan detektor tangkap elektron (ECD). Berikut akan diuraikan beberapa cara derivatisasi yang dilakukan pada kromatografi gas, serta gugus-gugus fungsional yang bereaksi.
a. Esterifikasi
Esterifikasi digunakan untuk membuat derivat gugus karboksil. Contoh obat yang mengandung gugus ini adalah obat golongan analgesik, prostaglandin, asam amino, dan obat anti-inflamasi. Pengubahan gugus karboksil menjadi esternya akan meningkatkan volatilitas karena akan menurunkan ikatan hidrogen. Derivatisasi dengan esterifikasi dapat dilakukan dengan cara esterifikasi Fisher biasa dalam asam kuat, menurut reaksi:
R-OH + R'-COOH R'-COORH
+ atau
BF3
Ester metil paling banyak digunakan, meskipun demikian ester etil, propil, dan butil juga sering dimanfaatkan untuk derivatisasi ini. Ester alifatik yang lebih panjang dibuat dengan tujuan untuk menurunkan volatilitas, meningkatkan respon detektor, meningkatkan resolusi atau daya pisah dari bahan penganggu, dan juga meningkatkan resolusi dari senyawa-senyawa yang mempunyai rumus molekul yang hampir sama. Bahan yang sering digunakan adalah boron trifluorida atau boron triklorida dengan alkohol alifatik.
Diazometana biasanya digunakan untuk membuat metil ester, sementara diazoetan digunakan untuk membuat etil ester. Reaksi yang melibatkan keduanya untuk esterifikasi berlangsung secara sempurna dan memberikan hasil derivat yang tinggi. Kerugiannya adalah bahwa diazometan dan diazoetan bersifat toksik, mudah meledak, dan harus dibuat baru, serta sampel harus berada dalam media bebas air. Karena kerumitan ini, maka keduanya jarang digunakan untuk analisis rutin dan hanya digunakan untuk tujuan penelitian.
Ester alkil dibuat dengan tetrametil amonium hidroksida atau trimetilanilinium hidroksida (TMAH) dan alkali iodida (pelarut dimetil asetamid-metanol) sebelum penyuntikan ke kolom kromatografi gas, sementara itu ester aril dibuat dari benzil bromida atau dari pentafluorobenzil bromida.
b. Asilasi
Jika sampel yang diuji mengandung fenol, alkohol, atau amin primer atau sekunder maka sering digunakan derivatisasi dengan asilasi yang merupakan reaksi yang paling umum.
Derivatisasi dengan cara ini dilakukan dengan menggunakan asam asetat anhidrat dan katalis (misalkan asam asetat, asam p-toluen sulfonat, piridin, N-metil amidazol) sebelum penyuntikan ke kromatografi gas (pre column derivatization) atau dilakukan penyuntikan di dalam kolom (on column derivatization). Asilasi pada umumnya memberikan bentuk kromatogram yang baik. Trifluoro asetat (FFA), pentafluoropropianat (PFP), atau heptafluorobutirat (HFB) digunakan untuk meningkatkan sensitifitas analisis. Umumnya kepekaan relatif ester terfluoro adalah: pentafluorobenzoil > HFB > PFP > TFA, dengan beberapa perkecualian. Jika menganalisis ester katekolamin dan metabolitnya dengan TFA, PFP, dan HFB maka urutan elusinya pada fase diam yang kurang polar (SE-30) adalah sebagai berikut: TFA lebih cepat daripada PFP dan yang paling akhir terelusi adalah HFB, sedangkan jika menggunakan fase diam yang lebih polar (OV-1 atau XE-60) maka derivat PFP dan HFB akan terelusi sebelum TFA.
Asilasi dlakukan dengan menggunakan perfluoroanhidrida yang murni atau dalam pelarut, misalkan dalam asetonitril dan etil asetat. Penambahan amin tersier seperti trimetil amin atau trietil amin akan meningkatkan reaktifitasnya dan berfungsi sebagai penerima asam.
c. Alkilasi
Alkilasi digunakan untuk menderivatisasi alkohol, fenol, amina (primer dan sekunder), imida, dan sulfhidril. Derivat dapat dibuat dengan sintesis Wiliamson, yakni alkohol atau fenol ditambah alkil atau benzil halida dengan adanya basa. Jenis agen penderivat yang saat ini digunakan hanya α-bromo-2,3,4,5,6-pentafluorotoluen.
d. Sililasi
Derivat silil saat ini digunakan untuk menggantikan eter alkil untuk analisis sampel yang bersifat polar yang tidak mudah menguap. Derivat yang paling sering dibuat adalah trimetilsilil. Urutan reaktifitas pereaksi sililasi berdasarkan pada pemampuan penyumbang silil adalah sebagai berikut: Trimetilsililimidazol (TMSIM) > N,O-bis -(trimetilsilil)-trifluoroasetamid (BSTFA) > N,O-bis-(trimetilsilil)-asetamid (BSA) > trimetilsililtrifluoroasetamid (MSTFA) > N- trimetilsilildietilamin (TMSDEA) > N-metil-N-trimetilsililasetamid (MSTA) > Trimetilklorosilan (TMCS) > Heksametildisilazan (HMDS).
Urutan reakstivitas gugus-gugus penerima silil adalah sebagai berikut: alkohol > fenol > asam karboksilat > amina > amida. Faktor sterik sangat penting dalam hal penentuan kecepatan reaksi derivatisasi. Untuk setiap gugus fungsi, urutan reaktifitasnya adalah: primer > sekunder > tersier.
yang dilapisi dengan teflon, pereaksi sililasi sering kali mampu melarutkan sampel (meskipun demikian pelarut-pelarut seperti piridin, dimetilformamid, asetonitril, tetrahidrofuran, dan kloroform dapat digunakan untuk melarutkan sampel yang akan diderivatisasi dengan cara sililasi), derivatisasi sering terjadi dalam suhu kamar (akan tetapi gugus fungsional yang sukar diderivatisasi seperti amina sekunder, alkohol tersier, dan amida perlu dilakukan pemanasan pada suhu antara 60-1500C). Laju reaksi derivatisasi juga dapat ditingkatkan dengan penambahan katalis asam seperti dengan trimetilklorosilan atau dengan katalis basa seperti piridin. Dilaporkan bahwa 95 % derivat trimetilsilil (TMS) dapat dibuat dengan menggunakan trimetilsililimidazol (TMSIM) atau dengan N,O-bis-(trimetilsilil)-trifluoroasetamid (BSTFA), yang kadang-kadang ditambah dengan trimetilklorosilan sebagai katalis. Kedua pereaksi ini (TMSIM dan BSTFA) menunjukkan selektifitas. Sebagai contoh, TMSIM tidak bereaksi dengan gugus amino, sedangkan BSTFA merupakan pereaksi terpilih untuk gugus amino. Pembuatan TMS dalam media bebas air lebih reaktif disbanding dalam media yang mengandung air.
Berikut adalah contoh derivatisasi yang digunakan untuk memperbaiki bentuk puncak pseudoefedrin: OH NH H3C CH3 Pseudoefedrin H3C N N Triprolidin N CH3 Dekstrometorfan Pseudoefedrin (CF3CO)2O OCOCF3 N H3C CH3 OH NH H3C CH3 COCF3
Pseudoefedrin yang diderivatisasi dengan trifluoro asetat anhidrida
Sirup dekongestan dibasakan dengan amonia dan diekstraksi ke dalam etil asetat sehingga akan menjamin bahwa semua komponen yang terekstraksi berada dalam bentuk basa bebasnya daripada bentuk garamnya. Bentuk basa inilah yang bertanggungjawab pada bagusnya bentuk puncak kromatografi. Garam-garam atau basa-basa akan terurai karena adanya panas pada lubang suntik KG, sehingga dengan adanya proses ini akan dapat menyebabkan terjadinya peruraian.
Jika ekstrak pada sirup dekongestan di lakukan kromatografi gas secara langsung maka kromatogram yang dihasilkan seperti gambar 16.10 (a). Basa bebas triprolidin dan
dekstrometorfan menunjukkan bentuk puncak yang bagus, akan tetapi pesudoefedrin yang merupakan basa yang lebih kuat karena adanya gugus hidroksil dan gugus amin memberikan bentuk puncak yang kurang bagus. Hal ini dapat diatasi dengan menutup gugus polar (gugus hidroksi dan amin) pada pseudoefedrin dengan cara mereaksikannya menggunakan trifluoroasetat anhidrida (TFA). Perlakuan dengan TFA ini tidak menghasilkan senyawa derivatif terhadap senyawa-senyawa basa tersier dalam ekstrak (sirup dekongestan) ini. Reagen TFA ini sangat bermanfaat karena reagen ini sangat reaktif dan bertitik didih rendah (400C) sehingga kelebihan reagen TFA ini mudah dihilangkan dengan cara evaporasi sebelum dilakukan kromatografi gas.
Gambar 16.10. Kromatogram sirup dekongestan; (A) tidak dilakukan derivatisasi. (B) setelah dilakukan derivatisasi dengan TFA.
e. Kondensasi
Jika sampel yang akan dianalisis mengandung gugus aldehid atau keton maka sering kali dilakukan derivatisasi yang tujuannya adalah untuk mencegah terjadinya enolisasi karena terjadinya ikatan hidrogen, meningkatkan resolusi karena adanya zat penganggu, dan meningkatkan sensitifitas deteksi.
Reaksi kondensasi dapat digunakan untuk derivatisasi amina yang mana pereaksinya mengandung gugus karbonil. Amina primer bereaski dengan keton membentuk enamin atau bereaksi dengan karbon disulida membentuk isotiosianat. Aseton dan siklobutanon bereaksi dengan amin primer membentuk enamin yang menghasilkan puncak tunggal dalam KG.
f. Siklisasi
Penutupan gugus polar melalui siklisasi dilakukan pada senyawa yang mengandung 2 gugus fungsi yang kira-kira sangat mudah dibuat heterosiklis beratom 5 atau 6. Beberapa jenis heterosiklis yang terbentuk adalah: ketal, boronat, triazin, dan fosfit.
Ujung amfoter asam amino dapat dibuat lebih volatil dengan siklisasi menggunakan diklorotetrafluoroaseton membentuk 2,3,-bis-(klorodifluorometil)-4-tersubstitusi 1,3-oksazolidin-5-on menurut reaksi:
CH R N H2 COOH + (CF2Cl)2CO (CF2Cl)CH N H O CO CH R -H2O
Asam amino juga bereaksi dengan anhidrida asam atau klorida membentuk azlakton yang bersifat lebih volatil menurut reaksi:
CH R' NH2 COOH + (R-CO)2O CH N C O C -H2O O R R'
7. KROMATOGRAFI CAIR KINERJA TINGGI (High Performance Liquid Chromatography, HPLC) [ Pengampu: Sudibyo Martono, 4 kali pertemuan ]
HPLC merupakan pengembangan dari kromatografi kolom terbuka. HPLC digunakan untuk analisis senyawa yang non volatile dan thermolabile. Fase diam dalam HPLC merupakan material yang dipacking dalam kolom berbentuk silinder dan memiliki ukuran
partikel berdiameter 3-10 µm. Oleh karena itu, fase gerak tidak dapat melewati fase diam hanya dengan mengandalkan gaya gravitasi seperti pada kromatografi kolom terbuka. Pada proses tersebut, diperlukan suatu pompa yang mendorong fase gerak agar dapat melewati fase diam dengan kecepatan tertentu yang dapat menghasilkan jumlah lempeng teoritik maksimum, sehingga mampu mendapatkan pemisahan yang maksimal.
Pilihan detektor untuk HPLC lebih terbatas apabila dibandingkan dengan pilihan detektor untuk kromatografi gas. Detektor yang paling banyak dipergunakan adalah spektrofotometer dengan keterbatasan hanya molekul yang dapat mengabsorpsi sinar saja yang dapat dianalisis.
Gambar 7.1 berikut ini adalah bagan alat HPLC.
Gambar 7.1. Bagan alat HPLC
Solven atau fase gerak untuk HPLC hendaknya memenuhi kriteria: Mempunyai kemurnian tinggi (derajat HPLC)
Sebelum digunakan disaring terlebih dahulu dengan kertas saring dengan ukuran pori 0,4 µm (untuk fase gerak yang mengandung bufer).
Bebas dari gas yang dapat mengganggu detektor atau menyumbat kolom. Dapat dilakukan dengan memanaskan solven sebelum digunakan atau mengaplikasikan motor vaccum.
Keterangan Bagan Alat HPLC
Gradient controller atau pengatur gradien, adalah alat untuk mengatur komposisi fase gerak
apabila elusi dikerjakan secara gradient.
Pump/dampning system, adalah pompa untuk menyedot fase gerak yang dilengkapi dengan
peredam getaran, sehingga aliran fase gerak stabil tidak, dipengaruhi oleh getaran pompa selama bekerja.
Sample introduction, adalah alat untuk memasukkan sampel biasanya berupa rotary loop
seperti gambar 7.2 berikut ini:
Gambar 7.2. Sistem injektor rotary looppada HPLC
Ketika injektor berada dalam posisi load (A), sampel dimasukkan ke rotary loop dengan bantuan syringe, sehingga sampel akan memenuhi tempat penampungan sampel (daerah berwarna hijau). Bila volume sampel terlalu besar, maka kelebihan sampel akan terbuang secara otomatis ke saluran pembuangan (vent). Ketika injektor ini diposisikan ke inject, maka aliran fase gerak akan berubah dari posisi A menjadi seperti pada gambar B. Fase gerak akan mengalir dengan membawa sampel ke arah kolom.
Column/Pre column, adalah bagian jantung pemisahan pada HPLC. Kolom biasanya terbuat
dari bahan stainless steel dan ukuran diameter dalam memiliki presisi tinggi. Guard column adalah kolom berukuran pendek yang diletakkan diantara injektor dan kolom analitik, fungsinya adalah untuk menahan senyawa yang kemungkinan dapat menyumbat kolom analitik. Fase diam pada guard column dibuat dari jenis bahan yang sesuai dengan fase diam pada kolom analitik. Kolom analitik biasanya berukuran panjang 15 cm, diameter dalam 4,6 mm dengan ukuran partikel fase diam 10 µm (memiliki jumlah lempeng teoritik sekitar 5000), 5 µm (memiliki jumlah lempeng teoritik sekitar 9000), 3 µm (memiliki jumlah lempeng teoritik sekitar 15000). .... Tentunya tergantung/mempertimbangkan panjang kolom lho, karena H = L/N, sementara H = 2,5 x ukuran partikel...Agar diperoleh hasil pemisahan yang baik, maka perlu dilakukan evaluasi kolom secara berkala. Kelayakan kolom dapat dipantau/dievaluasi dengan melihat beberapa parameter di bawah ini secara berkala:
Faktor kapasitas berkisar 2 – 10.
Jumlah lempeng teoritik tidak mengalami perubahan yang signifikan (masih > 50 % nilai lempeng teoritik saat dilakukanperformanceawal kolom).
Faktor resolusi (RS) harus > 1,5 Peak asimetri < 1,2
Tekanan kolom dalam kisaran normal (dapat dikerjakan oleh pompa dengan ringan) Ada banyak faktor yang mempengaruhi efisiensi kolom, sehingga harus dioptimasi agar diperoleh pemisahan yang baik, yaitu:
Kecepatan alir fase gerak, kecepatan alir yang sangat lambat akan menyebabkan terjadinya difusi longitudinal, sedangkan bila terlalu cepat akan menyebabkan terjadinya transfer massa non ekuilibrium, sehingga terjadi pelebaran pita kromatogram
Ukuran partikel fase diam, semakin kecil ukuran partikel maka efisiensi semakin baik, akan tetapi menyebabkan tekanan dalam kolom semakin besar sehingga dibutuhkan kekuatan pompa yang lebih besar.
Panjang kolom, semakin panjang akan semakin besar nilai efisiensi kolom, akan tetapi dapat menyebabkan terjadinya pelebaran pita.
Viskositas fase gerak, semakin kecil nilai viskositas fase gerak maka efisiensi kolom semakin besar, peakakan menjadi semakin ramping.
Temperatur, semakin tinggi temperatur maka viskositas semakin rendah dan efisiensi kolom menjadi lebih besar.
Volume ekstra kolom, semakin besar volume ekstra kolom maka kemungkinan terjadinya pelebaran pita semakin besar, sehingga efisiensi semakin berkurang.
Jumlah sampel dan volume sampel, bila jumlah ataupun volume sampel sangat besar (overload) maka kemungkinan terjadinya pelebaran pita semakin besar, sehingga efisiensi semakin berkurang.
Detector, merupakan alat untuk melihat adanya sinyal dari analit atau solut yang sedang
dianalisis. Hendaknya detektor memiliki kriteria: sensitivitasnya tinggi, batas deteksi rendah, linearitas respon tinggi dan reprodusibilitasnya tinggi. Ada banyak detektor yang dapat diaplikasikan, yaitu:
Detektor spektrofotometer UV/Vis, merupakan detektor universal dan dapat diaplikasikan pada semua analit yang dapat menyerap sinar UV/Vis. Fase gerak yang dipakai tidak boleh menyerap sinar UV/Vis pada panjang gelombang yang dipilih. Detektor spektrofluorometer, merupakan detektor yang lebih selektif dan lebih sensitif