INTISARI
Sirih merah (Piper crocatum Ruiz & Pav) merupakan salah satu tanaman yang secara empiris digunakan oleh masyarakat sebagai obat antikanker. Sirih merah telah diteliti dapat menghambat pertumbuhan sel kanker kolon, payudara, dan leukimia. Penelitian ini bertujuan untuk mengetahui aktivitas sitotoksik ekstrak etanol daun sirih merah terhadap sel kanker kolon WiDr dan melihat potensinya dalam menginduksi apoptosis serta menekan ekspresi protein siklooksigenase.
Penelitian ini termasuk dalam penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Uji aktivitas sitotoksik ekstrak etanolik daun sirih merah dilakukan dengan menggunakan metode 3-(4,5-dimetil thiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) dan dihitung nilai Inhibitory Concentration 50 (IC50) menggunakan regresi linier Microsoft Excel 2007. Pengamatan kematian sel
kanker kolon WiDr dilakukan dengan metode double staining menggunakan etidium bromida-akridin oranye. Pengujian ekstrak etanolik daun sirih merah dalam menekan ekspresi siklooksigenase dilakukan dengan metode imunositokimia.
Hasil uji aktivitas sitotoksik ekstrak etanolik daun sirih merah dengan menggunakan metode MTT menunjukkan nilai IC50 sebesar 727 g/mL. Hasil uji
apoptosis dengan metode double staining menunjukkan ekstrak etanolik daun sirih merah dapat menginduksi apoptosis dan hasil uji imunositokimia menunjukkan bahwa ekstrak etanolik daun sirih merah dapat menekan ekspresi protein siklooksigenase.
ABSTRACT
Red betel (Piper crocatum Ruiz & Pav) is one of the medicinal plants that are empirically used by people as an anticancer drug. Red betel has been observed to inhibit the growth of colon cancer, breast cancer, and leukemia. The aim of this research is to determine the cytotoxic activity of ethanol extract of red betel leaf against cells WiDr and investigate apoptosis induction and suppress the protein expression of cyclooxygenase.
This research was experimental research using completely one direction randomized design. The investigation of cytotoxic activity of ethanolic extract of red betel leaf is done by using 3-(4,5-dimethyl thiazol-2-yl)-2,5-difeniltetrazolium bromide (MTT) method and IC50 values calculated using linear regretion of Microsoft
Excel 2007. Observations of the death of WiDr colon cancer cells was performed by double staining method using acridine orange-ethidium bromide. The activity of extract of red betel leaf in suppressing the expression of cyclooxygenase was conducted using immunocytochemistry method.
The results of the cytotoxic activity test ethanolic extract of red betel leaf using MTT method showed IC50 value of 727g/mL, apoptosis double staining method
shows ethanolic extract of red betel leaf have a potential of inducing apoptosis and the result of immunocytochemistry assay showed that ethanolic extract of red betel leaves can suppress protein expression of cyclooxygenase.
PENGARUH EKSTRAK ETANOLIK DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav) PADA SEL KANKER KOLON WiDr
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Mery Tri Utami NIM : 118114098
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENGARUH EKSTRAK ETANOLIK DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav) PADA SEL KANKER KOLON WiDr
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Mery Tri Utami NIM : 118114098
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Bila memang semua ini adalah cobaan untuk mencapai kesenangan,
saya iklash menjalankannya.
Bila memang semua ini adalah kesakitan untuk mencapai kebahagiaan,
saya rela merasakannya.
Dan...
Bila memang semua ini adalah syarat untuk mencapai keberhasilan,
saya akan memperjuangkannya.
“ Allah is Sufficient for Us, and the Best of Guardians “
(Q.S. Al-Imran 3:173)
Kupersembahkan karyaku untuk :
Papa, Mama, Adikku yang selalu mendukung dan mendoakanku
Para Sahabat
vii
PRAKATA
Syukur bagi Allah SWT karena atas anugrah dan rahmat-Nya Penulis
dapat menyelesakan skripsi ini dengan baik. Skripsi ini disusun untuk memenuhi
salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm.) program studi
Farmasi.
Penulis telah banyak menerima dukungan selama proses perkuliahan,
penelitian dan penyusunan skripsi. Oleh karena itu, Penulis ingin mengucapkan
terima kasih kepada :
1. Aris Widayati selaku Dekan Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta
2. Agustina Setiawati, M.Sc, Apt. selaku Dosen Pembimbing yang telah
memberikan waktu, bimbingan, pengarahan, serta masukan kepada Penulis
dalam penyusunan skripsi.
3. Dr. Erna Tri Wulandari, M.Si., Apt. selaku Dosen Penguji yang telah
memberikan waktu, masukan, kritik dan saran kepada Penulis.
4. Damiana Sapta Candrasari, M.Sc. selaku Dosen Penguji yang telah
memberikan waktu, masukan, kritik dan saran kepada Penulis.
5. Segenap Dosen dan Karyawan Fakultas Farmasi Universitas Sanata Dharma
viii
6. Gigih Prayoga, Tjok Gede Perdana Wiguna, dan Handika Immanuel sebagai
rekan satu tim atas kerjasama, persahabatan, bantuan dan kebersamaan selama
proses penyusunan skripsi.
7. Papa, Mama, Icong, Bunny, Kak Eva, Kak Yeni, Gabriella Septiana, Arvita,
Andung Panjalu, Clara Dewi, atas dukungan dan doa dalam skripsi ini.
8. Teman-teman angkatan 2011 terkhusus Kelas FSM C 2011 dan FST A 2011
atas keceriaan dan kebersamaan yang tidak akan terlupakan.
9. Teknisi Laboratotium Parasitologi dan Team CCRC UGM yang telah
membantu dalam penelitian ini.
10.Bagian Instalasi Patologi Anatomi RSUP Dr. Sardjito Yogyakarta yang telah
membantu dalam penelitian ini.
11.Pihak lain yang tidak dapat disebutkan satu persatu oleh Penulis.
Penulis menyadari bahwa didalam skripsi ini masih ada kekurangan. Oleh
karena itu, Penulis mengharapkan saran dan kritik yang membangun dari seluruh
pihak. Semoga skripsi ini memberikan manfaat bagi kita semua.
Yogyakarta, 15 Juni 2015
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 4
C. Keaslian Penelitian ... 4
D. Manfaat Penelitian ... 5
1. Manfaat teoretis ... 5
x
E. Tujuan Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
A. Kanker dan Karsinogenesis ... 7
B. Kanker Kolon ... 10
C. Ekspresi Siklooksigenase 2 (COX-2) pada Kanker Kolon ... 12
D. Sel WiDr ... 15
E. Apoptosis dan Nekrosis ... 16
F. Tanaman Sirih Merah ... 20
1. Deskripsi tanaman ... 20
2. Klasifikasi tanaman ... 21
3. Kandungan fitokimia ... 22
G. Ekstraksi ... 23
H. Uji Sitotoksik dengan MTT Assay ... 24
I. Uji Apoptosis dengan Metode Double Staining ... 26
J. Uji Imunositokimia ... 28
K. Landasan Teori ... 30
L. Hipotesis ... 31
BAB III METODE PENELITIAN ... 32
A. Jenis dan Rancangan Penelitian ... 32
B. Variabel Penelitian dan Definisi Operasional ... 32
1. Variabel utama ... 32
2. Variabel pengacau ... 32
xi
C. Bahan Penelitian ... 34
D. Alat Penelitian ... 34
E. Tata Cara Penelitian ... 35
1. Determinasi tanaman sirih merah ... 35
2. Pembuatan simplisia ... 35
3. Ekstraksi daun sirih merah dengan metode maserasi ... 35
4. Uji sitotoksisitas ekstrak etanol daun sirih merah dengan metode MTT ... 36
5. Uji apoptosis ekstrak etanol daun sirih merah dengan metode double staining ... 39
6. Pengamatan ekspresi COX-2 dengan metode imunositokimia ... 40
F. Tata Cara Analisis Hasil ... 42
1. Uji MTT ... 42
2. Uji double staining ... 42
3. Uji imunositokimia ... 43
BAB IV HASIL DAN PEMBAHASAN ... 45
A. Determinasi Tanaman dan Ekstraksi Daun Sirih Merah ... 45
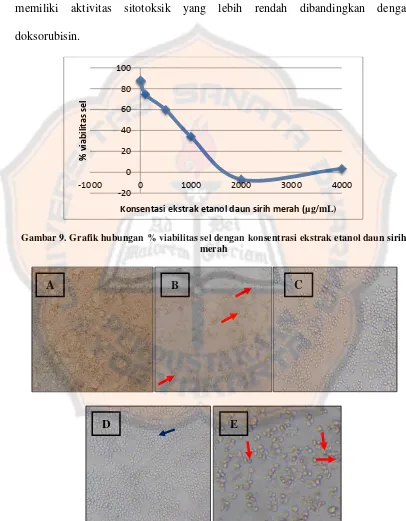
B. Uji Sitotoksik Ekstrak Etanol Daun Sirih Merah dengan MTT assay ... 47
C. Uji Apoptosis Ekstrak Etanol Daun Sirih Merah dengan Metode Double Staining ... 51
xii
BAB V KESIMPULAN DAN SARAN ... 60
A. Kesimpulan ... 60
B. Saran ... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN ... 69
xiii
DAFTAR TABEL
Halaman
Tabel 1. Distribusi sel WiDr pada uji apoptosis dengan metode double
staining ... 53
Tabel 2. Jumlah rata-rata sel yang mengekpresikan COX-2 pada
kelompok perlakuan, kontrol sel, dan doksorubisin ... 57
Tabel 3. Hasil uji statistik kebermaknaan antara kelompok perlakuan
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Skema mekanisme terjadinya kanker ... 9
Gambar 2. Skema perubahan morfologi dan molekuler dalam rangkaian adenoma-karsinoma kolon ... 11
Gambar 3. Skema mekanisme ekspresi COX-2 pada kanker kolon ... 14
Gambar 4. Rangkaian perubahan ultrastruktur yang tampak pada nekrosis (kiri) dan apoptosis (kanan) ... 18
Gambar 5. Tanaman sirih merah ... 21
Gambar 6. Macam-macam reagen untuk deteksi viabilitas sel ... 25
Gambar 7. Mekanisme pembentukan formazan pada reaksi MTT ... 26
Gambar 8. Tahap-tahap dalam metode imunositokimia ... 29
Gambar 9. Kurva hubungan % viabilitas sel dengan konsentrasi ekstrak etanol daun sirih merah ... 49
Gambar 10. Morfologi sel WiDr yang diamati dibawah mikroskop inverted dengan perbesaran 400x ... 49
Gambar 11. Efek perlakuan ekstrak etanol daun sirih merah pada sel WiDr dengan menggunakan metode double-staining ... 54
xv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat keterangan hasil determinasi tanaman sirih merah ... 70
Lampiran 2. Pengolahan data uji sitotoksik MTT assay ... 71
Lampiran 3. Dokumentasi uji sitotoksik MTT assay ... 73
Lampiran 4. Distribusi sel WiDr pada uji apoptosis dengan metode double
staining ... 74
Lampiran 5. Hasil analisis statistik pada uji apoptosis dengan metode
double staining ... 76
Lampiran 6. Dokumentasi uji double staining ... 81
Lampiran 7. Hasil perhitungan uji ekspresi COX-2 dengan metode
imunositokimia ... 82
Lampiran 8. Hasil analisis statistik pada uji imunositokimia ... 83
Lampiran 9. Dokumentasi uji imunositokimia kontrol sel dan perlakuan
xvi
INTISARI
Sirih merah (Piper crocatum Ruiz & Pav) merupakan salah satu tanaman yang secara empiris digunakan oleh masyarakat sebagai obat antikanker. Sirih merah telah diteliti dapat menghambat pertumbuhan sel kanker kolon, payudara, dan leukimia. Penelitian ini bertujuan untuk mengetahui aktivitas sitotoksik ekstrak etanol daun sirih merah terhadap sel kanker kolon WiDr dan melihat potensinya dalam menginduksi apoptosis serta menekan ekspresi protein siklooksigenase.
Penelitian ini termasuk dalam penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Uji aktivitas sitotoksik ekstrak etanolik daun sirih merah dilakukan dengan menggunakan metode 3-(4,5-dimetil thiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) dan dihitung nilai Inhibitory Concentration 50 (IC50)menggunakan regresi linier Microsoft Excel 2007. Pengamatan kematian
sel kanker kolon WiDr dilakukan dengan metode double staining menggunakan etidium bromida-akridin oranye. Pengujian ekstrak etanolik daun sirih merah dalam menekan ekspresi siklooksigenase dilakukan dengan metode imunositokimia.
Hasil uji aktivitas sitotoksik ekstrak etanolik daun sirih merah dengan menggunakan metode MTT menunjukkan nilai IC50 sebesar 727 g/mL. Hasil uji
apoptosis dengan metode double staining menunjukkan ekstrak etanolik daun sirih merah dapat menginduksi apoptosis dan hasil uji imunositokimia menunjukkan bahwa ekstrak etanolik daun sirih merah dapat menekan ekspresi protein siklooksigenase.
xvii
ABSTRACT
Red betel (Piper crocatum Ruiz & Pav) is one of the medicinal plants that are empirically used by people as an anticancer drug. Red betel has been observed to inhibit the growth of colon cancer, breast cancer, and leukemia. The aim of this research is to determine the cytotoxic activity of ethanol extract of red betel leaf against cells WiDr and investigate apoptosis induction and suppress the protein expression of cyclooxygenase.
This research was experimental research using completely one direction randomized design. The investigation of cytotoxic activity of ethanolic extract of red betel leaf is done by using 3-(4,5-dimethyl thiazol-2-yl)-2,5-difeniltetrazolium bromide (MTT) method and IC50 values calculated using linear regretion of
Microsoft Excel 2007. Observations of the death of WiDr colon cancer cells was performed by double staining method using acridine orange-ethidium bromide. The activity of extract of red betel leaf in suppressing the expression of cyclooxygenase was conducted using immunocytochemistry method.
The results of the cytotoxic activity test ethanolic extract of red betel leaf using MTT method showed IC50 value of 727g/mL, apoptosis double staining
method shows ethanolic extract of red betel leaf have a potential of inducing apoptosis and the result of immunocytochemistry assay showed that ethanolic extract of red betel leaves can suppress protein expression of cyclooxygenase.
1
BAB I PENDAHULUAN
A. Latar Belakang
Kanker merupakan sekelompok penyakit yang ditandai dengan
pertumbuhan sel abnormal yang tidak terkendali. Kanker juga merupakan
penyebab utama kematian nomor dua di dunia setelah penyakit jantung di
beberapa negara berkembang (American Cancer Society, 2014). Menurut The
International Agency for Research on Cancer (2013), terdapat sekitar 28 jenis
kanker di 184 negara pada tahun 2012, dengan perkiraan kasus sebanyak 14,1 juta
kasus baru dan 8,2 juta kasus kematian. Tingginya jumlah kematian yang terjadi
disebabkan oleh kurangnya deteksi dini dan fasilitas pengobatan kanker.
Kanker kolon merupakan kanker ganas epitel pada usus besar dan jenis
kanker ketiga terbanyak di Indonesia yang terjadi pada pria (19,1%) maupun
wanita (15,6%) per 100.000 penduduk. Insidensi tersebut lebih besar
dibandingkan dengan insidensi kanker kolon di Australia, Selandia Baru, dan
Eropa Barat (Ferlay et al., 2010). Faktor-faktor seperti tingginya asupan lemak
dan protein, rendahnya asupan serat, riwayat keluarga dengan penyakit kanker
kolon, serta adanya radang usus kronis, dapat meningkatkan resiko terjadinya
kanker kolon (Hartwich et al., 2001).
Upaya-upaya seperti pembedahan (laparoskopi), kemoterapi, radiasi,
maupun dengan obat-obatan dapat dilakukan untuk menyembuhkan dan
menunjukkan ada penurunan 40-50% kematian akibat kanker kolon pada
penderita yang mengkonsumsi obat aspirin atau obat golongan Non Steroid Anti
Inflammatory Drug (NSAID) lain secara terus-menerus. Aspirin dan obat NSAID
lain dapat menghambat kedua COX (COX-1 dan COX-2). Pengobatan ini
menimbulkan efek samping yang tidak diinginkan seperti ulkus gastrointestinal
dan perdarahan lambung, terutama jika mengkonsumsi aspirin dalam dosis tinggi.
Efek samping yang tidak menyenangkan seperti hepatotoksisitas (El-Sayyad et al.,
2009) dan kardiotoksisitas (Wattanapitayakul et al., 2005) juga dilaporkan pada
penggunaan agen kemoterapi doksorubisin sehingga efektivitas penggunaanya
untuk terapi kanker kolon dibatasi. Oleh karena itu, diperlukan terapi alternatif
lain untuk mengobati penyakit kanker kolon dengan mengembangkan obat yang
aman dan efektif dari bahan alam.
Pembentukan dan progresi kanker kolon dipengaruhi oleh aktivitas
siklooksigenase-2 (COX-2), suatu protein yang mengatur sintesis prostaglandin
dan diekspresikan berlebih pada beberapa kanker epitelial. Naghshvar et al.,
(2009) melaporkan bahwa lebih dari 80% kasus kanker kolon menunjukkan
adanya peningkatan ekspresi COX-2 dibandingkan dengan sel normal. Ekspresi
COX-2 disebabkan oleh faktor-faktor pertumbuhan seperti Epidermal Growth
Factor (EGF) atau faktor α pertumbuhan tumor dalam sistem sel yang dapat
menginduksi imunosupresi lokal. Peningkatan prostaglandin E2 dan proliferasi
inhibitor poten limfosit T, menyebabkan sel-sel kanker kolon dapat terhindar dari
sistem pertahanan tubuh (tidak menjalani apoptosis), menunjukkan perubahan
Oleh karena itu, COX-2 dapat dijadikan sebagai target molekuler dalam skrining
senyawa dari bahan alam yang berfungsi sebagai agen kemopreventif untuk
kanker kolon.
Salah satu tanaman yang potensial dikembangkan sebagai agen
kemopreventif adalah sirih merah (Piper crocatum Ruiz & Pav). Berdasarkan
pada penelitian yang dilakukan oleh Astuti, Wahyono, and Nababan (2014),
ekstrak etil asetat daun sirih merah memiliki aktivitas sitotoksik terhadap sel
T47D dan sel WiDr. Daun sirih merah diketahui memiliki kandungan senyawa
kimia seperti flavonoid, alkaloid, saponin, dan tanin. Berdasarkan penelitian yang
dilakukan oleh Safithri and Fahma (2008), air rebusan daun sirih merah
mengandung senyawa flavonoid, alkaloid, dan tanin. Penelitian lain yang
dilakukan oleh Suhermanto (2013) menyatakan bahwa ekstrak etanol 30% daun
sirih merah mengandung kadar flavonoid tertinggi dibandingkan dengan ekstrak
air yang lebih banyak mengandung tanin dan alkaloid. Menurut Deore et al.,
(2009), flavonoid dan tanin termasuk dalam senyawa fenolik yang berfungsi
sebagai antioksidan, antitumor, antiviral, dan antibiotik, sedangkan senyawa
alkaloid mempunyai sifat antineoplastik yang mampu menghambat pertumbuhan
sel-sel kanker.
Penelitian ini dilakukan dengan metode maserasi menggunakan pelarut
etanol untuk memperoleh ekstrak etanol daun sirih merah. Uji sitotoksisitas
dilakukan dengan menggunakan metode
3-(4,5-dimetilthiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) sehingga diperoleh data persentase viabilitas
berbagai seri konsentrasi. Penelitian mengenai aktivitas sitotoksik ekstrak etanol
daun sirih merah terhadap sel WiDr perlu dilakukan lebih lanjut dengan
menelusuri jalur kematian sel WiDr melalui mekanisme apoptosis. Metode yang
digunakan dalam uji apoptosis pada penelitian ini adalah metode double staining
menggunakan reagen akridin oranye-etidium bromida. Penelusuran mekanisme
molekuler aktivitas sitotoksik ekstrak etanol daun sirih juga perlu dilakukan
melalui penekanan ekspresi COX-2 menggunakan metode imunositokimia. Sel
WiDr yang digunakan pada penelitian ini merupakan model sel kanker kolon yang
mengekspresikan COX-2 secara berlebihan, sehingga dapat dijadikan sebagai
target molekuler dalam penemuan agen kemopreventif untuk kanker kolon.
B. Rumusan Masalah
1. Apakah ekstrak etanol daun sirih merah mempunyai aktivitas sitotoksik dan
berapa IC50 ekstrak etanol daun sirih merah terhadap sel WiDr?
2. Apakah ekstrak etanol daun sirih merah dapat menginduksi apoptosis pada sel
WiDr?
3. Apakah ekstrak etanol daun sirih merah dapat menekan ekspresi COX-2 pada
sel WiDr ?
C. Keaslian Penelitian
Penelitian mengenai potensi daun sirih merah telah dilakukan oleh
merah memiliki efek antiproliferatif terhadap sel kanker payudara T47D secara in
vitro.
Menurut penelitian yang dilakukan oleh Katrin, Komarudin, Susanto, and
Winarno (2013), ekstrak etanol daun sirih merah merupakan ekstrak yang paling
aktif menghambat pertumbuhan sel leukemia L1210 dengan IC50 sebesar 13,12
µg/mL.
Penelitian lain yang dilakukan oleh Astuti, Wahyono, and Nababan
(2014) melaporkan bahwa ekstrak etil asetat daun sirih merah memiliki aktivitas
sitotoksik terhadap sel T47D dengan IC50 sebesar 37,43 g/mL dan terhadap sel
WiDr sebesar 120,38 g/mL.
Berdasarkan penelusuran pustaka yang dilakukan oleh peneliti, penelitian
mengenai aktivitas sitotoksik ekstrak etanol daun sirih merah terhadap sel WiDr
belum pernah dilakukan.
D. Manfaat Penelitian 1. Manfaat teoretis
Penelitian ini diharapkan dapat memberikan informasi mengenai
aktivitas sitotoksik ekstrak etanol daun sirih merah terhadap sel WiDr yang
dapat digunakan sebagai referensi untuk penelitian penemuan obat kanker
2. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi mengenai
potensi ekstrak etanol daun sirih merah yang dapat digunakan sebagai terapi
alternatif untuk mengobati kanker kolon.
E. Tujuan Penelitian
1. Mengetahui aktivitas sitotoksik dan nilai IC50 ekstrak etanol daun sirih merah
pada sel WiDr.
2. Mengetahui kemampuan ekstrak etanol daun sirih merah dalam menginduksi
apoptosis pada sel WiDr.
3. Mengetahui kemampuan ekstrak etanol daun sirih merah dalam menekan
7
BAB II
TINJAUAN PUSTAKA
A. Kanker dan Karsinogenesis
Kanker merupakan penyakit keganasan pada sel yang disebabkan adanya
perubahan perilaku sel yang abnormal dalam mengontrol proliferasi dan
diferensiasi sel. Perubahan perilaku tersebut karena adanya transformasi genetik
pada sel terutama pada gen-gen yang mengkode protein yang berperan pada
pengaturan siklus pembelahan sel (Sudiana, 2008). Transformasi genetik sebagian
kecil dapat diwariskan secara herediter seperti pada kanker kolorektal, payudara,
dan prostat, namun sebagian besar kanker dihasilkan dari adanya kerusakan gen
yang terjadi selama hidup seseorang (American Cancer Society, 2014). Sel normal
harus mengalami tujuh perubahan mendasar dalam fisiologi sel yang
menentukannya menjadi fenotip sel ganas. Tujuh perubahan tersebut antara lain
mampu mencukupi sinyal pertumbuhan sendiri, tidak sensitif terhadap
sinyal-sinyal yang menghambat pertumbuhan, kehilangan kemampuan apoptosis,
gangguan perbaikan DNA, kemampuan replikasi tanpa batas (immortal),
kemampuan membentuk pembuluh darah baru (angiogenesis), kemampuan
menginvasi dan bermetastatis (Kumar, Abbas, and Fausto, 2005).
Pembentukan kanker dimulai dari proses displasia yaitu kelainan
diferensiasi sel normal menjadi sel abnormal yang disertai gangguan pengaturan
dalam sel. Pertumbuhan sel abnormal menjadi tidak terkontrol sehingga mengarah
tidak menyebar ke jaringan lain sedangkan sel kanker bersifat menginvasi
jaringan secara progresif dan menyebar ke tempat lain (metastatis).
Ketidakstabilan genetis terus terjadi pada sel ganas dan menyebabkan perubahan
yang lebih lanjut sehingga mempengaruhi sensitivitas terhadap terapi (Chrestella,
2009).
Proses terjadinya karsinogenesis merupakan proses bertahap yang
memerlukan beberapa waktu sampai terjadinya kanker. Proses karsinogenesis
diawali dengan tahap inisiasi pada sel yang terpapar karsinogen sehingga terjadi
ketidakstabilan dan mutasi gen yang menyebabkan terbentuknya neoplastik.
Perubahan yang ditimbulkan oleh karsinogen pada DNA tidak selalu merupakan
inisiasi karena sebagian besar kerusakan atau kesalahan rantai DNA dapat
diidentifikasi dan diperbaiki oleh enzim pengoreksi (proofreading). Enzim
pengoreksi memberikan sinyal pada siklus sel untuk menghentikan perbaikan sel,
namun jika kesalahan tidak dapat diperbaiki, maka sel secara normal
diperintahkan untuk menghancurkan diri sendiri (self-destruct) (Corwin, 2008).
Tahap kedua karsinogenesis adalah tahap promosi. Tahap promosi
merupakan tahap sel yang DNA-nya telah termutasi berubah menjadi neoplasma
dengan bantuan suatu zat promotor. Zat promotor dapat menginduksi tumor di
sel-sel yang sudah mengalami inisiasi, mempercepat proliferasi sel-seldengan
menstimulasi onkogen, atau meningkatkan reseptor permukaan untuk faktor
pertumbuhan, walaupun promotor sendiri tidak bersifat tumorigenik.Transformasi
sel yang terjadi pada tahap ini didorong oleh paparan karsinogen dalam jangka
Tahap terakhir karsinogenesis adalah tahap progresif. Tahap progresif
meliputi manifestasi pertumbuhan dan perkembangan tumor menjadi ganas.
Adanya kegagalan mekanisme apoptosis pada sel yang termutasi, menyebabkan
sel mengalami pertumbuhan membentuk klon sel baru (sel klonal yang memiliki
gene defect). Sistem imun menganggap sel baru tersebut sebagai benda asing dan
dihancurkan melalu jalur Antibody Dependent Cell Cytoxicity (ADCC), aktivitas
komplemen, maupun melalui jalur apoptotik yang diperankan oleh ikatan Fas
pada permukaan sel abnormal dengan ligan yang diekspresikan oleh Natural
Killer cell (NKc) dan Cytotoxic T-Lymphocyte (CTL). Sel abnormal memiliki
kemampuan untuk menipu sistem imun tubuh sehingga sistem imun tidak mampu
menghancurkan atau mengeliminasi kelompok sel abnormal.Sel abnormal tersebut
dapat mengalami proliferasi dan diferensiasi yang berlebihan dan akhirnya sel
berubah menjadi tumor yang bersifat ganas (maligna). Sel maligna ini mempunyai
kemampuan untuk menyebar ke jaringan lainnya, baik dari jaringan sekitar
maupun jaringan yang jauh (metastatis) (Sudiana, 2008).
Gambar 1. Skema mekanisme terjadinya kanker (Departemen Kesehatan RI, 2007). Aspek lain dari tahap progresif adalah terjadinya vaskularisasi yang
dikontrol oleh faktor angiogenesis yang kemudian terjadi invasi sel tumor pada
jaringan limfa maupun pembuluh darah. Apabila sel kanker dalam bentuk emboli
Sel Normal Sel Terinisiasi Sel Kanker
Faktor resiko kanker
(karsinogen) Promotor
kecil memasuki aliran darah maka sel kanker akan mengalami penghancuran
setelah berinteraksi dengan komponen darah. Apabila ada emboli yang tertinggal
pada suatu jaringan atau organ, maka akan memicu pembentukan suatu trombos.
Hal inilah yang menyebabkan sel kanker dapat membelah dan terjadi
perkembangan mikrometastatis yang secara berkelanjutan menjadi jaringan baru
serta memicu proliferasi pembuluh darah (Kumar et al., 2005).
B. Kanker Kolon
Kanker kolorektum adalah kanker yang terjadi didaerah kolon (usus besar)
dan daerah rektum. Secara anatomis, daerah kolon yang berdekatan dengan
rektum merupakan daerah rawan kanker, sehingga hampir setengah dari seluruh
kasus kanker kolorektal terjadi didaerah rektum dan daerah rektosigmoid
(Khomsan, 2009). Insiden puncak karsinoma kolorektum adalah antara usia 60-79
tahun dan kurang dari 20% kasus terjadi sebelum usia 50 tahun. Faktor makanan
seperti asupan kalori makanan yang berlebihan dibandingkan dengan kebutuhan,
rendahnya kandungan serat sayuran yang tidak terserap dalam makanan, tingginya
kandungan karbohidrat olahan, dan kurangnya asupan mikronutrien protektif,
merupakan faktor predisposisi tingginya insiden kanker kolon. Faktor lingkungan,
obesitas, dan inaktivitas fisik merupakan faktor lain yang juga berperan pada
pembentukan kanker kolon (Kumar et al., 2005).
Kanker kolon menjalani tahapan karsinogenesis pada proses
pembentukannya. Inisiasi kanker kolon ditandai dengan terjadinya kerusakan
mutasi gen. Inisiasi pada kolon juga dapat terjadi sejak lahir di mana terdapat
mutasi bawaan di antaranya mutasi gen Adenomatous Polyposis Coli (APC) pada
Familial Adenomatous Polyposis (FAP), serta mutasi human Mut S Homolog 2
(hMSH2) dan human Mut L Homolog 1 (hMLH1) pada kasus Hereditary
Nonpolyposis Colorectal Cancer (HNPCC) (Kim, Cheung, and Hellerstein,
2004).
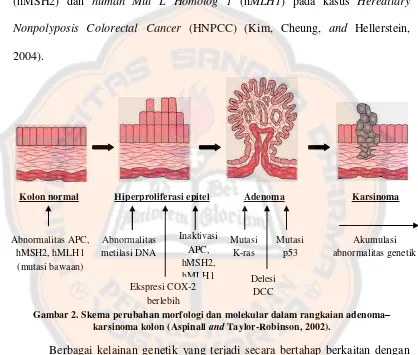
[image:31.595.100.518.202.557.2]
Gambar 2. Skema perubahan morfologi dan molekular dalam rangkaian adenoma–
karsinoma kolon (Aspinall and Taylor-Robinson, 2002).
Berbagai kelainan genetik yang terjadi secara bertahap berkaitan dengan
perubahan perilaku atau fenotipe mukosa kolon. Perubahan yang paling awal pada
pembentukan kanker kolon adalah meningkatnya jumlah sel (hiperplasia) pada
permukaan epitel (lumen). Hiperproliferasi sel epitel usus memulai tahapan
promosi kanker kolon, yang di tandai dengan penebalan dinding kolon.
Hiperproliferasi sel didukung dengan adanya abnormalitas pada metilasi DNA,
inaktivasi APC, hMSH2, hMLH1, dan ekspresi enzim siklooksigenase-2 (COX-2)
yang berlebih. Tingkat mutasi sel semakin bertambah seiring dengan laju Hiperproliferasi epitel
Kolon normal Adenoma Karsinoma
proliferasi sel sehingga sel epitel kolon tidak mampu mengatasi kerusakan DNA
yang terjadi. Sel epitel yang telah terpromosi menghasilkan suatu adenoma yang
ditandai dengan meningkatnya ukuran dan jumlah sel-sel pembentuk kelenjar
namun belum bersifat menginvasi struktur sekitarnya (McPhee and Ganong,
2006).
Akumulasi kerusakan DNA yang semakin meningkat terjadi pada tahap
progresi. Sel epitel yang terpromosi telah mengalami mutasi pada gen Kirsten Rat
Sarcoma (K-Ras), p53, dan Deleted in Colon Cancer (DCC). Secara anatomis,
telah dapat diamati adanya adenoma pada kolon. Adenoma yang terbentuk
membesar secara progresif yang kemudian membentuk suatu displastik.
Perubahan displastik seperti hilangnya produksi musin dan perubahan polaritas sel
dapat dijumpai dengan derajat yang bervariasi. Tahap yang lebih lanjut
menyebabkan invasi sel kanker menembus basal lamina sehingga sel-sel maligna
dapat memasuki pembuluh limfe regional dan terjadi penyebaran ke pembuluh
limfe regional di sekitar kolon. Sel kanker yang masuk ke pembuluh darah dapat
menyebabkan penyebaran ke tempat yang jauh dan membentuk pembuluh darah
baru (angiogenesis) sehingga terbentuk kanker sekunder pada jaringan lain
(metastatis) (Hanahan and Weinberg, 2000).
C. Ekspresi Siklooksigenase 2 (COX-2) pada Kanker Kolon
Siklooksigenase merupakan protein yang dioksigenase dari asam
arakidonat menjadi prostaglandin (Foesslien, 2001). Siklooksigenase memiliki
COX-1 adalah housekeeping gene yang terekspresikan pada suatu level konstan
sepanjang siklus sel dan diekspresikan oleh hampir semua jaringan, sedangkan
COX-2 merupakan gen yang berperan sebagai katalisator dalam proses perubahan
asam arakidonat menjadi prostaglandin (Ranger, Salhah, and Mokbel, 2008).
Protein COX-2 dapat terinduksi dengan cepat karena adanya respon
terhadap promotor tumor, faktor pertumbuhan, hormon, endotoksin bakterial, dan
sitokin (Ranger et al., 2008). COX-2 juga mengalami up-regulasi pada
tempat-tempat inflamasi dan mengalami over-ekspresi pada neoplasma (Sinicrope and
Gills, 2004). Peran COX-2 dalam karsinogenesis telah banyak dilaporkan antara
lain sebagai peningkatan proliferasi sel, resistensi terhadap apoptosis, peningkatan
angiogenesis, stimulasi pertumbuhan sel, supresi imun, dan peningkatan invasi
tumor (Shin et al., 2003). Muller-Decker et al., (2002) menyebutkan bahwa
COX-2 lebih berperan dalam proses promosi tumor dibandingkan pada inisiasi tumor.
Produk akhir dari COX-2 berkonstribusi terhadap berbagai faktor biologis dalam
memicu pertumbuhan tumor. Asam arakidonat dikonversikan oleh COX menjadi
PGG2 setelah dilepaskan dari membran fosfolipid dan kemudian menjadi PGH2.
PGH2 dikonversi menjadi beberapa prostaglandin, termasuk PGE2, PGD2, PGF2,
PGI2, dan tromboksan A2, melalui aktivitas spesifik prostaglandin sintase
(Sinicrope and Gills, 2004). COX-2 mempengaruhi aktivitas angiongenesis
melalui modulasi faktor angiogenik seperti Vascular Endothelial Growth Factor
(VEGF) dan basic Fibroblast Growth Factor (bFGF). Adanya protein
antiapoptosis B-cell lymphoma (Bcl-2) akibat peningkatan ekspresi COX-2
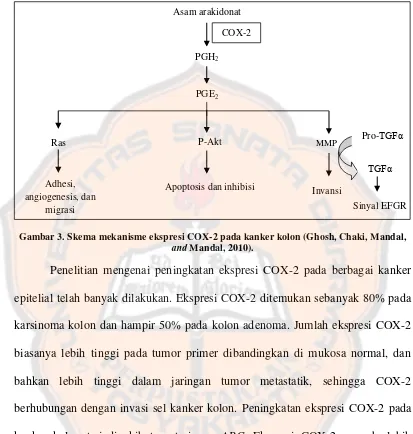
Gambar 3. Skema mekanisme ekspresi COX-2 pada kanker kolon (Ghosh, Chaki, Mandal, and Mandal, 2010).
Penelitian mengenai peningkatan ekspresi COX-2 pada berbagai kanker
epitelial telah banyak dilakukan. Ekspresi COX-2 ditemukan sebanyak 80% pada
karsinoma kolon dan hampir 50% pada kolon adenoma. Jumlah ekspresi COX-2
biasanya lebih tinggi pada tumor primer dibandingkan di mukosa normal, dan
bahkan lebih tinggi dalam jaringan tumor metastatik, sehingga COX-2
berhubungan dengan invasi sel kanker kolon. Peningkatan ekspresi COX-2 pada
kanker kolon terjadi akibat mutasi gen APC. Ekspresi COX-2 yang berlebih
menyebabkan akumulasi prostaglandin E2 (PGE2), dengan melibatkan beberapa
jalur seperti pro-onkogenik cyclic/ Adenosine MonoPhospat (cAMP)/protein
kinase A (PKA), transduksi sinyal onkogenik Epidermal Growth Factor Receptor
(EFGR), dan aktivasi Nuclear Factor Kappa B (NFĸB). Jalur PGE2/cAMP/PKA
akan mengaktivasi tirosin kinase EFGR untuk mentranduksi sinyal mitogenik
sehingga menstimulasi proliferasi sel (Shao, Lee, Gou, Evers, and Sheng, 2003).
COX-2
PGE2 PGH2
Ras P-Akt MMP
Adhesi, angiogenesis, dan
migrasi
Apoptosis dan inhibisi Invansi
Pro-TGFα
TGFα
Aktivasi EFGR melalui PGE2 juga menstimulasi jalur matriks metalloproteinase
(MMP) yang berperan dalam pemacuan metastatis, dan aktivasi NFĸB yang
berperan untuk menghambat apoptosis dengan memicu ekspresi sitokin inflamasi
atau stres oksidatif pada sel inflamatori (Hanahan and Weinberg, 2000).
D. Sel WiDr
Sel WiDr merupakan salah satu model kanker kolon yang diisolasi dari
kolon seorang wanita berusia 78 tahun. Sel WiDr mengalami mutasi p53 pada posisi 273 yaitu terjadi perubahan residu arginin menjadi histidin (GA), namun
adanya p21 yang masih normal memungkinkan terjadinya penghentian daur sel
(Liu et al., 2006). Perubahan tersebut dapat membuat afinitas p53 dalam mengikat
protein apotosis rendah sehingga efeknya tidak maksimal atau bahkan tidak
berfungsi sebagai tumor suppresor gene. Apoptosis pada sel WiDr dapat terjadi
melalui jalur independen p53, di antaranya melalui aktivasi p73 (Levrero et al,
2000).
Karakteristik dari sel WiDr adalah adanya produksi antigen
karsinoembrionik dan ekspresi COX-2 yang tinggi sehingga memacu proliferasi
sel WiDr (Palozza et al., 2005), namun Bcl-2 sebagai protein antiapoptosis tidak
diekspresikan tinggi (Meyerhardt and Mayer, 2005). Sel WiDr memiliki
sensitivitas yang rendah terhadap perlakuan dengan agen kemoterapi golongan
antimetabolit seperti 5-fluorouracil (5-FU) karena adanya peningkatan ekspresi
enzim timidilat sintetase yang merupakan target penghambatan utama dari 5-FU.
P-glikoprotein (Pgp) pada sel WiDr tidak diekspresikan tinggi (Liu et al., 2006).
Pgp merupakan suatu protein yang berperan dalam pengeluaran obat dari sel.
Resistensi doksorubisin dapat terjadi karena adanya overekspresi PgP pada sel
seperti sel MCF-7 sehingga aktivitasnya sebagai agen kemoterapi menjadi
berkurang (Sarmoko, 2012).
Sel WiDr yang dikembangbiakan dalam medium kultur terlihat
berbentuk lebih bulat dibandingkan dengan sel normal serta menunjukkan
peningkatan rasio nukleus terhadap sitoplasma yang ditandai dengan peningkatan
ukuran inti, membesarnya nukleoli, dan distribusi kromatin yang tidak teratur
Beberapa kelebihan dari sel WiDr yaitu dapat membentuk tumor secara
histologikal dengan efisiensi mendekati 100% pada empat host yang berbeda
selama 1-4 tahun setelah inokulasi, mudah untuk dikulturkan, memiliki
doubling-time yang cukup singkat yakni 15 jam, memiliki efisiensi platting yang tinggi
yaitu 51%, dan memiliki mekanisme resistensi terhadap agen kemoterapi yang
cukup tinggi (Palozza et al., 2005).
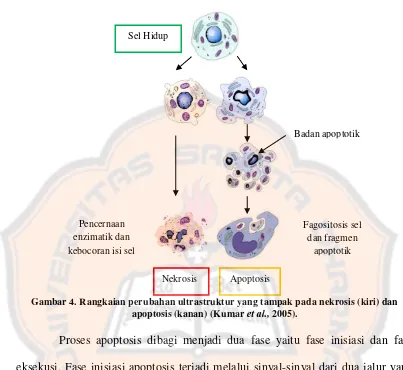
E. Apoptosis dan Nekrosis
Kematian sel merupakan salah satu ciri utama kehidupan dan hasil akhir
dari cedera sel yang terjadi ketika semua fungsi penting berhenti karena kerusakan
yang tidak dapat diperbaiki (Wolpert, 2009). Terdapat dua pola utama kematian
sel yaitu nekrosis dan apoptosis. Nekrosis adalah kematian sel karena adanya
kerusakan sistem membran akibat cedera yang menetap atau berlebihan
membran pembungkus enzim lisozim sehingga enzim lisozim tumpah ke dalam
sitosol dan menyebabkan enzim menjadi aktif. Enzim lisozim yang aktif
kemudian mencerna protein–protein, baik yang berada pada sitosol maupun
protein-protein penyusun membran dari sel tersebut (Sudiana, 2008). Kerusakan
membran plasma ini menyebabkan hilangnya keseimbangan osmotik dan influks
cairan dan ion, pengeluaran protein, enzim, koenzim, dan asam ribonukleat, serta
sel-sel mengalami kebocoran metabolit yang penting bagi rekonstruksi ATP
(Kumar et al., 2005).
Apoptosis yaitu proses kematian sel terprogram yang menghasilkan
perubahan karakteristik morfologi dan biokimia sel (Corwin, 2008). Apoptosis
berperan dalam berbagai proses fisiologis, adaptif, dan patologis. Apoptosis dalam
situasi fisiologis berfungsi untuk menghilangkan sel-sel yang tidak dibutuhkan,
seperti pada masa embriogenesis, dan untuk mempertahankan jumlah berbagai
populasi sel dalam jaringan. Apoptosis juga terjadi dalam situasi patologis, seperti
pada sel-sel yang mengalami kerusakan DNA akibat radiasi atau obat anti kanker
sitotoksik (Kumar et al., 2005). Apoptosis ditandai dengan penyusutan sel (cell
shrinkage), pembengkakan dan pecahnya membran (membran blebbing) tanpa
hilangnya integritas membran, kondensasi kromatin, dan fragmentasi nukleus,
pemadatan organela sitoplasma, dilatasi dari retikulum endoplasma, penurunan
volume sel dan pembentukan badan apoptosis (Azhar, 2008). Berbeda dengan
nekrosis, pada apoptosis, sel tidak akan mengalami kebocoran sitoplasma
sehingga tidak menyebabkan reaksi inflamasi seperti yang terjadi pada nekrosis
Gambar 4. Rangkaian perubahan ultrastruktur yang tampak pada nekrosis (kiri) dan apoptosis (kanan) (Kumar et al., 2005).
Proses apoptosis dibagi menjadi dua fase yaitu fase inisiasi dan fase
eksekusi. Fase inisiasi apoptosis terjadi melalui sinyal-sinyal dari dua jalur yang
terpisah yaitu jalur ektrinsik (apoptosis jalur sitoplasma) maupun intrinsik
(apoptosis jalur mitokondria) (Kumar et al., 2005). Mekanisme apoptosis secara
ekstrinsik dimulai dengan pengikatan ligan dengan reseptor dari famili Tumour
Necrosis Factor (TNF), seperti Fas dan TNFR-1, yang diikuti dengan pengikatan
Fas-associated Death Domain (FADD) (Goldie et al., 2005). FADD yang telah
melekat pada reseptor maut kemudian berikatan dengan pro-kaspase-8 (kaspase-8
dalam bentuk inaktif). Molekul-molekul pro-kaspase-8 akhirnya saling mendekat
dan memecah untuk menghasilkan kaspase-8 yang aktif. Kaspase-8 merupakan
kaspase inisiator yang akan mengaktivasi kaspase eksekutor melalui
pro-kaspase-3 (Kumar et al., 2005).
Pencernaan enzimatik dan kebocoran isi sel
Nekrosis Apoptosis Sel Hidup
Fagositosis sel dan fragmen
Stimulasi reseptor maut sebenarnya sudah cukup untuk menimbulkan
apoptosis, namun pada sel dengan induksi kaspase yang tak memadai untuk
terjadinya apoptosis sesudah adanya stimulasi Fas, memerlukan inisiasi kaspase
melalui mitochondrial pathway. Jalur mitokondria terjadi akibat adanya
peningkatan permeabilitas membran mitokondria karena faktor stres seluler yang
berlebihan sehingga mitokondria melepaskan molekul-molekul pro-apotosis
seperti sitokrom c dan Apoptosis Induncing Factor (AIF) ke dalam sitoplasma
tanpa adanya peran serta reseptor maut. Sitokrom c akan berikatan dengan
Apoptosis Activating Factor-1 (Apaf-1) dan kemudian merangsang pro-kaspase-9
berikatan dengan kompleks ini untuk membentuk apoptosom. Apoptosom akan
mengaktivasi pro-kaspase-9 menjadi kaspase-9 sebagai inisiator apoptosis.
Kaspase-9 akhirnya akan mengaktivasi pro-kaspase-3 menjadi kaspase-3 yang
merupakan kaspase efektor sehingga apoptosis dapat terjadi (Talapatra and
Thomson, 2001).
Pelepasan protein sitokrom c dan AIF diatur oleh famili protein Bcl-2
anti apoptosis dan pro apoptosis. Dua protein anti-apotosis utama yang mengatur
apoptosis adalah Bcl-2 dan Bcl-x. Protein-protein ini normalnya berada di
membran mitokondria dan sitoplasma. Bcl-2 atau Bcl-x hilang pada membran
mitokondria apabila sel kekurangan sinyal atau terkena stres untuk bertahan
hidup. Protein ini kemudian digantikan oleh protein pro apoptosis yaitu Bak, Bax,
dan Bim. Penurunan kadar Bcl-2 atau Bcl-x menyebabkan meningkatnya
permeabilitas membran mitokondria sehingga protein yang dapat mengaktifkan
Fase eksekusi merupakan tahap akhir pertemuan berbagai mekanisme
pemicu apoptosis. Kaspase inisiator yang telah dipecah menjadi bentuk aktif pada
jalur ektrinsik dan intrinsik akan memulai program kematian enzimatik melalui
aktivasi kaspase eksekutor. Enzim-enzim ini memecah protein matriks dan
sitoskeleton sehingga merusak sitoskeleton yang menyebabkan pecahnya nukleus.
Sasaran kaspase pada nukleus adalah protein-protein yang terlibat dalam
transkripsi, replikasi DNA, dan perbaikan DNA (Kumar et al., 2005). Sel-sel yang
mati biasanya mengeluarkan faktor-faktor terlarut untuk merekrut fagosit. Sel-sel
apoptotik dan fragmen-fragmennya memiliki molekul penanda dipermukaannya.
Adanya molekul penanda ini bertujuan untuk mempermudah pengenalan sel
apoptotik dan fragmennya oleh sel sekitar, serta mempermudah sel fagosit
menelan dan menghancurkan badan apoptosis sebelum sel-sel tersebut mengalami
nekrosis sekunder sehingga isinya keluar (menyebabkan timbulnya peradangan).
Berbeda dengan penanda-penanda di sel apoptotik, sel-sel hidup tampaknya
mencegah diri agar tidak tertelan oleh makrofag melalui ekspresi molekul
permukaan tertentu (Ricci and Zong, 2006).
F. Tanaman Sirih Merah 1. Deskripsi tanaman
Tanaman sirih merah tumbuh merambat atau bersandar pada batang pohon
lain. Batang sirih merah berwarna hijau keunguan, berbentuk bulat, bersulur, dan
beruas. Permukaan daun sirih merah berwarna hijau dengan garis-garis berwarna
menyerupai hati dengan ujung daun meruncing, bertangkai, dan tumbuh
berselang-seling dari batangnya. Daun sirih merah mempunyai aroma yang khas,
berlendir, dan rasanya pahit dengan penampakan daun yang berwarna merah
keperakan (Jatmika, 2013). Tanaman sirih merah menyukai tempat teduh,
berhawa sejuk dengan sinar matahari 60-75%, dan dapat tumbuh subur di daerah
pegunungan. Batang tanaman sirih merah akan cepat mengering dan warna merah
daunnya akan pudar jika sirih merah tumbuh di daerah panas dan terkena sinar
[image:41.595.102.506.272.712.2]matahari langsung (Oktaviani et al., 2012).
Gambar 5. Tanaman sirih merah 2. Klasifikasi tanaman
Kingdom : Plantae
Filum : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Piperales
Famili : Piperaceae
Genus : Piper
Jenis : Piper crocatum Ruiz & Pav
3. Kandungan fitokimia
Daun sirih merah memiliki kandungan senyawa kimia yang beragam
seperti flavonoid, alkaloid, saponin, dan tanin. Senyawa flavonoid bersifat
antioksidan, antidiabetik, antikanker, antiseptik, dan anti-inflamasi. Menurut
penelitian Ren, Qiao, Wang, Zhu, and Zhang (2003), senyawa flavonoid dapat
menghambat proliferasi melalui inhibisi proses oksidatif yang dapat menyebabkan
inisiasi kanker. Senyawa alkaloid bersifat antineoplastik sehingga ampuh
menghambat pertumbuhan sel-sel kanker (Agoes, 2010). Senyawa tanin
mempunyai aktifitas sebagai antiproliferatif pada sel kanker yang bekerja pada
tingkat sel yang dengan menghambat fase “S” dari siklus sel (Khanbabaee and
Ree, 2001), sedangkan senyawa saponin memiliki efek sitostatik dan sitotoksik
pada sel tumor maligna (Bachran, Bachran, Sutherland, Bachran, and Fuchs,
2008) dengan cara menginduksi apoptosis dan menghambat proses angiogenesis
(Tong et al., 2011).
Secara empiris sirih merah memiliki banyak fungsi, diantaranya untuk
mengobati diabetes melitus, asam urat, hipertensi, kanker payudara, peradangan
(liver dan prostat), hepatitis, kadar kolesterol, mencegah stroke, dan lain-lain
(Werdhany, Marton, and Setyorini, 2008). Fungsi tanaman sirih merah ternyata
tidak hanya sebatas dari data empiris, namun terdapat data ilmiah yang telah
membuktikan bahwa daun sirih merah memiliki fungsi empiris tersebut, seperti
penelitian yang dilakukan oleh Fitriyani, Winarti, Muslichah, and Nuri (2011)
menunjukkan bahwa ekstrak etanol daun sirih merah dengan dosis 50 mg/kg
Alfarabi, Bintang, Suryani, and Safithri (2010) menunjukkan bahwa ekstrak
etanol 70% daun sirih merah memiliki aktivitas anti diabetogenik melalui aktivitas
antioksidasi.
G. Ekstraksi
Ekstraksi adalah penyarian zat-zat berkhasiat atau zat-zat aktif dari bahan
alam. Prinsip ekstraksi yaitu adanya perpindahan massa komponen zat ke dalam
pelarut. Ektraksi biasanya dimulai dengan menggunakan pelarut organik secara
berurutan dengan kepolaran yang semakin meningkat. Pemilihan pelarut
dilakukan berdasarkan kaidah “like dissolve like”, yaitu suatu senyawa polar akan
larut dalam pelarut polar dan sebaliknya senyawa non polar akan larut dalam
pelarut non polar. Pelarut heksan, eter, petroleum eter, atau kloroform digunakan
untuk mengambil senyawa yang kepolarannya rendah sedangkan alkohol dan etil
asetat digunakan untuk mengambil senyawa-senyawa yang lebih polar (Ma’mun
et al., 2006).
Maserasi merupakan salah satu teknik penyarian yang dilakukan dengan
merendam serbuk simplisia dalam cairan penyari selama beberapa hari pada
temperatur kamar dan terlindung dari cahaya. Jumlah pelarut yang diperlukan
cukup besar yaitu berkisar antara 10-20 kali dari jumlah sampel. Prinsip metode
maserasi adalah cairan penyari menembus dinding sel dan masuk ke dalam rongga
sel yang mengandung zat aktif. Zat aktif tersebut dapat larut karena adanya
perbedaan konsentrasi antara larutan zat aktif didalam sel dengan yang ada diluar
dengan konsentrasi rendah (proses difusi). Peristiwa ini terjadi berulang-ulang
hingga terjadi keseimbangan konsentrasi antara larutan di dalam sel dengan
larutan di luar sel (Ma’mun et al., 2006).
H. Uji Sitotoksik dengan MTT Assay
Sitotoksik adalah sifat toksik yang dimiliki oleh suatu senyawa tertentu
terhadap sel hidup. Uji sitotoksisitas merupakan suatu uji in vitro menggunakan
kultur sel untuk menentukan potensi senyawa atau ekstrak yang dapat
dikembangkan sebagai obat sitotoksik (Hartati et al.,2003). Penetapan jumlah sel
yang bertahan hidup atau viabilitas sel pada uji sitotoksisitas dapat dilakukan
berdasarkan pada parameter seperti kerusakan membran, gangguan sintesis,
degradasi makromolekul, serta perubahan morfologi sel. Uji sitotoksik digunakan
untuk menentukan nilai Inhibition Concentration (IC50). Nilai IC50 merupakan
besarnya konsentrasi suatu senyawa yang menghasilkan hambatan proliferasi sel
sebanyak 50% sehingga dapat menunjukkan potensi ketoksikan senyawa tersebut.
Sifat sitotoksik memiliki tiga tingkatan, yaitu (1) sangat toksik dengan nilai IC50 <
10 µM, (2) toksik dengan nilai IC50 10-20 µM, (3) tidak toksik dengan nilai IC50 >
20 µM. Ekstrak uji dengan nilai IC50 dibawah 100 µg/mL tetap dapat dikatakan
memiliki potensi antiproliferasi dan potensi sebagai agen kemoprevensi
(Ernawati, 2010). Semakin besar harga IC50 maka suatu senyawa semakin tidak
toksik. Akhir dari uji sitotoksisitas adalah memberikan informasi persentase (%)
Gambar 6. Macam-macam reagen untuk deteksi viabilitas sel (Doyle and Griffiths, 2000). Uji sitotoksisitas dapat dilakukan dengan beberapa metode seperti Typan
Blue Staining, Tritium-labeled Thymidine, dan Microculture Tetrazolium Salt
(MTT) (Nertika, 2008). Typan Blue Staining adalah metode sederhana untuk
mengevaluasi integritas membran sel dengan asumsi terjadi proliferasi sel atau
kematian), namun metode ini tidak sensitif dan tidak dapat disesuaikan untuk high
throughput screening. Tritium-labeled Thymidine adalah metode yang dilakukan
dengan mengukur penyerapan zat radioaktif pada sel. Metode ini akurat namun
memerlukan waktu yang banyak dan melibatkan penanganan zat radioaktif. MTT
merupakan suatu metode kolorimetrik. Prinsip dari metode MTT adalah terjadinya
reduksi garam kuning tetrazolium MTT
(3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida) yang telah diabsorbsi ke dalam sel menjadi kristal
formazan berwarna ungu yang tidak larut air oleh enzim suksinat dehidrogenase
yang terdapat dalam jalur respirasi sel pada mitokondria yang aktif pada sel yang
masih hidup. Keuntungan dari uji MTT yaitu lebih sensitif, cepat dan akurat
dibandingkan dengan metode perhitungan langsung serta tidak menggunakan
keadaan fisiologis sel dan variasi aktivitas dehidrogenase mitokondria dalam tipe
[image:46.595.101.519.167.624.2]sel yang berbeda (Doyle and Griffits, 2000).
Gambar 7. Mekanisme pembentukan formazan pada reaksi MTT (Doyle and Griffiths,
2000).
Kristal formazan yang terbentuk pada uji MTT akan diakumulasikan ke
dalam sel apabila kristal formazan yang dihasilkan tidak mampu menembus
membran, sehingga metode ini dapat menunjukkan aktivitas dan integritas
mitokondria. Penambahan larutan stopper (bersifat detergenik) melarutkan kristal
berwarna ini yang kemudian diukur absorbansinya menggunakan ELISA reader.
Intensitas warna ungu yang dihasilkan oleh pembentukan kristal formazan
proporsional dengan jumlah sel hidup. Semakin banyak sel yang hidup, semakin
banyak kristal formazan yang terbentuk, maka semakin tinggi nilai absorbansi
yang diperoleh dan mengindikasikan mortalitas yang rendah (Doyle and Griffiths,
2000).
I. Uji Apoptosis dengan Metode Double Staining
Apoptosis merupakan suatu program kematian pada sel. Pengamatan
terjadinya apoptosis dapat dilakukan dengan metode morphological staining,
seperti uji etidium bromida–akridin oranye (EB/AO), DAPI (4,6-diamidino-2
fenildol), Hoechst staining, Annexin V staining, DNA lader, Terminal
deoxynucleotidyl transferase mediated dUTP Nick End Labeling (TUNEL),
3(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida (MTT)
Caspase-3/7 activity, dan ssDNA staining. Beberapa metode tersebut memiliki
keterbatasan dalam penggunaannya. Metode Annexin V staining dan DNA lader
melibatkan beberapa tahap pengerjaan, sehingga memerlukan waktu yang lama
dalam melakukan uji tersebut dan beberapa prosedur dapat merusak membran sel
serta mengubah distribusi populasi sel hidup, apotosis, dan nekrotik. DAPI
staining, Caspase-3/7 activity, dan ssDNA staining hanya mendeteksi peningkatan
sinyal apoptosis namun tidak dapat mengukur persentase sel hidup, apoptosis, dan
nekrosis. TUNEL assay juga banyak digunakan untuk mendeteksi sel apoptosis,
namun uji ini dapat memberikan sinyal positif palsu pada beberapa sel nekrotik
(Ribble, Goldstein, and Shellman, 2005).
Double staining merupakan metode yang menggunakan akridin
oranye-etidium bromida (AO-EB) untuk memvisualisasikan perubahan nukleus dan
bentuk apoptosis sebagai karekteristik dari apoptosis. Metode ini berdasarkan
pada perbedaan fluorosensi DNA pada sel yang hidup dan mati karena pengikatan
akridin oranye-etidium bromida. Akridin oranye (AO) dapat menembus seluruh
bagian sel sehingga menyebabkan nukleus (inti sel) tampak berwarna hijau. Sel
hidup dengan membran yang masih utuh memiliki nukleus dengan warna hijau
yang seragam. Etidium bromida (EB) hanya dapat berinteraksi dengan sel yang
membrannya sudah rusak sehingga menyebabkan nukleus berwarna merah.
Selama sel mengalami proses apoptosis dan membran blebbing mulai terjadi, EB
dapat masuk ke dalam sel dan memberikan warna oranye. Sel yang mengalami
early apoptosis akan mengalami kondensasi atau fragmentasi kromatin dan
memiliki tampilan kromatin berwarna oranye yang terkondensasi dan
terfragmentasi (terpecah-pecah menjadi bagian yang lebih kecil) sehingga
terbentuk badan-badan apoptosis. Sel yang mati karena mengalami nekrosis
memiliki nukleus berwarna oranye dengan struktur normal. Warna yang
ditimbulkan oleh EB pada sel mati lebih dominan jika dibandingkan dengan AO
sehingga nukleus pada sel mati berwarna oranye (Maryati and Sutrisna, 2011).
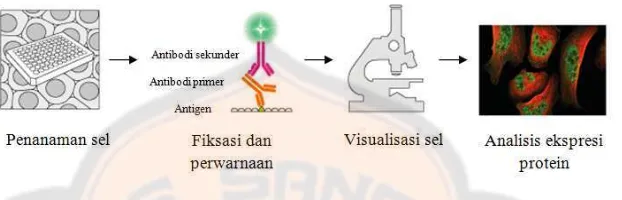
J. Uji Imunositokimia
Imunositokomia adalah metode yang digunakan untuk mendeteksi
adanya protein atau antigen tertentu dalam sel dengan menggunakan antibodi
spesifik. Antibodi digunakan untuk menunjukkan adanya antigen dalam sel.
Sampel yang dapat dianalisis dengan metode ini yaitu noda darah, kultur sel,
suspensi sel, dan sitospin (IHC World, 2015). Metode imunositokimia terdiri dari
empat tahap yaitu (1) penanaman sel, (2) fiksasi dan perwarnaan dengan antibodi,
(3) visualisasi sel dengan mikroskop, dan (4) analisis ekspresi protein yang telah
divisualisasikan. Fiksasi dilakukan dengan menggunakan pelarut organik seperti
alkohol dan aseton untuk melepaskan lipid, mendehidrasi sel, dan mengendapkan
protein, serta menggunakan reagen cross-linking seperti formaldehid yang
melibatkan jembatan intermolekuler melalui gugus amino bebas (The Human
Protein Atlas, 2015). Ekspresi protein yang telah divisualisasikan dihitung
berdasarkan jumlah sel yang mengekspresi protein tertentu dari keseluruhan sel
dan dinyatakan dalam satuan persen (%). Sel yang mengekspresikan protein
mengekspresikan protein tertentu memberikan warna ungu/biru (Dai, Meiyanto,
[image:49.595.161.472.170.270.2]Supardjan, and Agustina, 2004).
Gambar 8. Tahap-tahap dalam metode imunositokimia (The Human Protein Atlas, 2015)
Metode deteksi imunositokimia terdiri dari dua jenis yaitu metode
langsung dan metode tidak langsung. Pada metode langsung, antibodi yang
mengikat fluoresen atau zat warna langsung berikatan dengan antigen pada sel,
namun metode ini kurang sensitif bagi protein yang sedikit menghasilkan sinyal
kuat. Pada metode tidak langsung, antigen diikatkan pada antibodi primer secara
langsung namun ditambahkan juga antibodi sekunder yang akan mengikat enzim
seperti peroksidase, alkali fosfatase, atau glukosa oksidase. Substrat kromogen
yang ditambahkan diubah oleh enzim sehingga terjadi pembentukan warna
(pigmen) yang akan mewarnai sel. Adanya pengikatan beberapa antibodi sekunder
pada antibodi primer yang sama akan meningkatkan sensitivitas dan fleksibilitas
dalam variasi pemilihan kombinasi antibodi primer dan sekunder. Metode tidak
langsung juga memiliki kelemahan seperti membutuhkan waktu yang lebih tinggi
dan adanya resiko pengikatan non-spesifik pada antibodi sekunder (The Human
K. Landasan Teori
Kanker kolorektal adalah kanker yang terjadi didaerah kolon (usus besar)
dan daerah rektum. Estimasi meningkatnya jumlah kasus baru sebanyak 96.830
dan kasus kematian sebanyak 50.310 pada tahun 2014 diperkirakan terjadi akibat
kanker kolon. Penggunaan agen kemoterapi, radiasi, maupun obat-obatan
golongan NSAID menjadi pilihan umum untuk mengobati kanker kolon, namun
terapi tersebut menimbulkan efek samping yang besar. Pengembangan terapi
efektif dalam pengobatan kanker kolon masih sangat diperlukan untuk menekan
jumlah kematian penderita. Salah satu alternatif pengobatan kanker kolon yang
dapat dilakukan adalah melalui penggunaan tanaman obat.
Tanaman sirih merah merupakan salah satu tanaman yang telah diteliti
mempunyai efek sitotoksik dan mampu menghambat pertumbuhan sel kanker.
Daun sirih merah diketahui memiliki kandungan senyawa kimia yang beragam
seperti flavonoid, alkaloid, saponin, dan tanin yang berfungsi sebagai antioksidan,
antikanker, antiinflamasi, dan antineoplastik. Metode ekstraksi yang digunakan
untuk mendapatkan senyawa kimia dalam daun sirih merah adalah maserasi
dengan pelarut etanol. Menurut Agnes, Lois, Aning, and Nani (2013), pelarut
etanol digunakan sebagai penyari karena etanol dapat menarik senyawa kimia
yang bersifat semipolar sampai polar seperti flavonoid, alkaloid, saponin, dan
tanin.
Uji sitotoksisitas merupakan suatu uji in vitro menggunakan kultur sel
untuk menentukan apakah senyawa atau ekstrak berpotensi untuk dikembangkan
diketahui dengan menggunakan metode MTT. Perubahan morfologi sel kanker
kolon perlu dianalisis lebih lanjut untuk mengetahui terjadinya apoptosis.
Apoptosis dapat dideteksi dengan menggunakan metode pengecatan akridin
oranye–etidium bromida. Peningkatan ekspresi COX-2 diketahui berperan dalam
karsinogenesis kanker kolon. Pengukuran ekspresi COX-2 pada kanker kolon
dapat dilakukan dengan metode imunositokimia.
L. Hipotesis
Ekstrak etanol daun sirih merah mempunyai aktivitas sitotoksik dengan
menginduksi apoptosis dan diperantarai oleh penekanan ekspresi COX-2 pada sel
32
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian mengenai pengaruh ekstrak etanol daun sirih merah pada sel
WiDr merupakan jenis penelitian eksperimental murni dengan menggunakan
rancangan acak lengkap pola searah.
B.Variabel Penelitian dan Definisi Operasional 1. Variabel utama
a. Variabel bebas. Variabel bebas dari penelitian ini adalah besarnya konsentrasi
ekstrak etanol daun sirih merah pada sel kanker kolon WiDr.
b. Variabel tergantung. Variabel tergantung dari penelitian ini adalah viabilitas sel
WiDr yang diukur dengan nilai IC50 ekstrak etanol daun sirih merah, distribusi
kematian sel, dan penekanan ekspresi COX-2.
2. Variabel pengacau
a. Variabel pengacau terkendali
1) Waktu dan tempat pengambilan daun sirih merah yaitu di Dusun Bedingin,
Desa Sumber Adi, Kecamatan Mlati, Kabupaten Sleman, Yogyakarta, pada
bulan Juli 2014.
2) Kondisi dan tempat dilakukan penelitian yaitu di Laboratorium Parasitologi,
3) Kondisi sel kanker kolon WiDr yang digunakan yaitu dalam keadaan 80%
konfluen, tercukupi nutrisinya, dan bebas dari kontaminasi.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali dalam
penelitian ini adalah umur, tempat tumbuh, jenis dan jumlah kandungan kimia
daun sirih merah.
3. Definisi operasional
a. Ekstrak etanol daun sirih merah adalah ekstrak kental daun sirih merah yang
diperoleh dengan cara maserasi sebanyak dua kali meggunakan pelarut etanol
70%
b. Sel WiDr adalah sel model kanker kolon yang diisolasi dari kolon manusia
yang mengekspresikan protein COX-2 secara berlebih.
c. Uji sitotoksik MTT adalah metode yang digunakan untuk mengetahui
persentase viabilitas sel WiDr setelah pemberian ekstrak etanol daun sirih
merah dan dinyatakan dalam parameter IC50 (Inhibition Concentration 50)
d. Uji apoptosis double staining adalah metode uji dengan menggunakan reagen
etidium bromide-akridin oranye untuk memvisualisasikan kematian sel WiDr.
e. Ekspresi siklooksigenase-2 (COX-2) adalah protein yang diekspresikan oleh
sel WiDr yang ditunjukkan dengan warna cokelat pada sitoplasma sel.
f. Imunositokimia adalah metode uji untuk mengetahui skor ekspresi COX-2
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini yaitu daun sirih merah
(diperoleh dari Sleman, Yogyakarta); sel WiDr (diperoleh dari Laboratorium
Parasitologi, Fakultas Kedokteran, Universitas Gadjah Mada); pelarut DMSO
(Merck); etanol 70% (Merck); medium kultur lengkapyang mengandung
penisilin-streptomisin 1% (v/v) (Gibco), Fetal Bovine Serum (FBS) 10% (v/v)
(Gibco), Fungizone 0,5% (Gibco), dan media Rosswell Park Memorial Institute
(RPMI) 1640 (Gibco); Tripsin-EDTA 0,25%; reagen MTT
[3-(4,5-dimetiltiazol-2-il)-2,5difeniltetrazoliumbromida] (Bio Basic Canada Inc); larutan Phoshat
Buffer Saline (PBS) pH 7,4; larutan stopper berupa sodium deodesil sulfat (SDS)
10% dalam 0,1 N HCl; reagen etidium bromida-akridin oranye (EtBr-AO)
(Sigma), antibodi primer COX-2 rabbit monoclonal (Lab Vision Corp.), antibodi
sekunder Trekkie Universal Link (Anti Mouse and Rabbit ter-biotinylated), larutan
DBA, reagen streptavidin (Trek Avidin-HRP label), metanol, larutan hidrogen
peroksidase (blocking solution), aquades, larutan Maye Haemotoxylin, alkohol,
xylol, dan Tripsin 0,5 % (Gibco),
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini antara lain : alat-alat gelas
(PYREX), timbangan analitik, aluminium foil (Klin Pak), vortek, waterbath
(Memmert), rotary vacuum evaporator (Buchi Labortechnik AG CH-9230),
tabung conical (Iwaki), inkubator CO2 (Thermo Heraeus HeraCell 150),
glass, cell counter, 96-well plate (Iwaki), 24-well plate (Iwaki), pipet Pasteur,
ELISA reader (Bio-Rad), laminar air flow cabinet (Labconco), mikroskop
inverted (Olympus), mikroskop flourosens (Zeiss MC 80), kamera digital (Canon
DSLR 1000D), haemocytometer (Neubauer), yellow tips, blue tips, eppendorf
(Plasti brand), tissue, glove,pinset, dan masker.
E. Tata Cara Penelitian 1. Determinasi tanaman sirih merah
Tanaman sirih merah yang di peroleh dari daerah Sleman,
Yogyakarta, dilakukan determinasi di bagian Biologi Farmasi, Fakultas
Farmasi, Universitas Gajah Mada, dengan membandingkan ciri morfologi
tanaman sirih merah dengan buku acuan (Backer and Bakhuizen, 1965).
2. Pembuatan simplisia
Daun sirih merah yang telah dikumpulkan kemudian dicuci bersih
dibawah air mengalir. Daun sirih merah kemudian ditiriskan dan dikeringkan.
Proses pengeringan dilakukan menggunakan oven pada suhu 600-700C hingga daun mudah diserbukkan. Daun sirih merah kemudian diserbuk dengan mesin
penyerbuk sampai halus. Pengeringan dan penyerbukan daun sirih merah
dilakukan di Merapi Farma, Kaliurang, Yogyakarta.
3. Ekstraksi daun sirih merah dengan metode maserasi
Sebanyak 100 mg serbuk simplisia daun sirih merah direndam dalam
1000 mL etanol 70% dalam erlenmeyer bertutup. Perendaman dibiarkan
pertama menggunakan shaker. Maserat diambil dan disaring menggunakan
kertas saring setelah direndam selama 24 jam. Maserat ditampung dalam
tabung erlenmeyer bertutup dan kemudian disimpan terlindung dari cahaya
matahari. Ampas serbuk daun sirih merah yang tertinggal kemudian diperas
dan direndam kembali dalam 1000 mL etanol 70% dalam erlenmeyer bertutup.
Perendaman dibiarkan selama 24 jam terlindung dari cahaya matahari sambil
diaduk selama 6 jam pertama menggunakan shaker. Maserat diambil dan
disaring kembali menggunakan kertas saring setelah 24 jam direndamlalu
digabungkan dengan maserat sebelumnya. Maserat yang terkumpul kemudian
dipekatkan dengan rotary evaporator. Hasil evaporasi dituang ke dalam cawan
porselen kemudian dipanaskan di atas waterbath dengan suhu 800C untuk mendapatkan ekstrak etanol daun sirih merah yang kental.
4. Uji sitotoksisitas ekstrak etanol daun sirih merah dengan metode MTT
a. Preparasi sel kanker kolon WiDr. Sel WiDr diambil dari tangki nitrogen dan
segera dicairkan dalam penangas air dengan suhu 370C. Ampul disemprot dengan etanol 70% dan dimasukkan dalam LAF. Sel WiDr dipindahkan dari
dalam ampul ke dalam conical tube steril yang telah berisi medium kultur
lengkap (mengandung penisilin-streptomisin 1% (v/v), FBS 10% (v/v),
Fungizone 0,5%, dan media RPMI 1640). Suspensi sel WiDr disentrifugasi
dengan kecepatan 650 rpm selama 3 menit dan supernatan yang terbentuk
dibuang. Medium kultur lengkap yang baru ditambahkan kembali kedalam