KOMPLEKSOMETRI KOMPLEKSOMETRI
Kompleks adalah dibentuk melalui reaksi ion logam, sebuah kation, Kompleks adalah dibentuk melalui reaksi ion logam, sebuah kation, dengan sebuah anion atau molekul netral yang larut namun sedikit terdisosiasi. dengan sebuah anion atau molekul netral yang larut namun sedikit terdisosiasi. Titrasi kompleksometri adalah titrasi berdasarkan pembentukan senyawa Titrasi kompleksometri adalah titrasi berdasarkan pembentukan senyawa kompleks antara kation dengan zat pembentuk kompleks. Salah satu zat kompleks antara kation dengan zat pembentuk kompleks. Salah satu zat pembentuk
pembentuk kompleks kompleks yang yang banyak banyak digunakan digunakan dalam dalam titrasi titrasi kompleksometrikompleksometri adalah garam dinatrium etiln diamina tetra
adalah garam dinatrium etiln diamina tetra asetat (dinatrium EDTA).asetat (dinatrium EDTA).
EDTA merupakan salah satu jenis asam amina polikarboksilat. EDTA EDTA merupakan salah satu jenis asam amina polikarboksilat. EDTA sebenarnya adalah ligan seksidentat yang dapat berkoordinasi dengan suatu ion sebenarnya adalah ligan seksidentat yang dapat berkoordinasi dengan suatu ion logam lewat kedua nitrogen dan keempat gugus karboksil-nya atau disebut ligan logam lewat kedua nitrogen dan keempat gugus karboksil-nya atau disebut ligan multidentat yang mengandung lebih dari dua atom koordinasi per molekul. Suatu multidentat yang mengandung lebih dari dua atom koordinasi per molekul. Suatu EDTA
EDTA dapat membentuk senydapat membentuk senyawa kompleks yang awa kompleks yang mantap dengan mantap dengan sejumlah besarsejumlah besar ion logam sehingga EDTA merupakan ligan yang tidak selektif. Dalam larutan ion logam sehingga EDTA merupakan ligan yang tidak selektif. Dalam larutan yang agak asam, dapat terjadi protonasi parsial EDTA tanpa pematahan sempurna yang agak asam, dapat terjadi protonasi parsial EDTA tanpa pematahan sempurna kompleks logam, yang menghasilkan produk baru seperti CuHY
kompleks logam, yang menghasilkan produk baru seperti CuHY--.. Faktor-faktor yang membuat EDTA sebagai titrimetri:
Faktor-faktor yang membuat EDTA sebagai titrimetri: 1.
1. selalu membentuk kompleks ketika direaksikan dengan ion logamselalu membentuk kompleks ketika direaksikan dengan ion logam 2.
2. kestabilannya dalam membentuk kelat sangatkestabilannya dalam membentuk kelat sangat konstan konstan sehingga reaksi berjalansehingga reaksi berjalan sempurna (kecuali dengan logam alkali)
sempurna (kecuali dengan logam alkali) 3.
3. dapat bereaksi cepat dengan banyak jenis ion logamdapat bereaksi cepat dengan banyak jenis ion logam 4.
4. telah dikembangkantelah dikembangkan indikatornya indikatornya secara khusussecara khusus 5.
5. mudah diperoleh bahan baku primernyamudah diperoleh bahan baku primernya 6.
6. dapat digunakan baik sebagai bahan yang dianalisis maupun sebagai bahandapat digunakan baik sebagai bahan yang dianalisis maupun sebagai bahan untuk
untuk standardisasI standardisasI[4][4]
EDTA akan membentuk kompleks yang stabil dengan semua logam EDTA akan membentuk kompleks yang stabil dengan semua logam kecuali logam alkali seperti natrium dan kalium. Logam alkali tanah seperti kecuali logam alkali seperti natrium dan kalium. Logam alkali tanah seperti kalsium dan magnesium membentuk kompleks yang tidak stabil dengan EDTA kalsium dan magnesium membentuk kompleks yang tidak stabil dengan EDTA pada
pada pH pH rendah, rendah, karena karena titrasi titrasi logam-logam logam-logam ini ini dengan dengan EDTA EDTA dilakukan dilakukan padapada larutan buffer ammonia pH 10. Persamaan reaksi umum pada titrasi larutan buffer ammonia pH 10. Persamaan reaksi umum pada titrasi kompleksometri adalah:
Mn+ + Na2EDTA (MEDTA)n-4 + 2H+ [1]
Untuk mendeteksi titik akhir titrasi digunakan zat warna. Indikator zat warna ditambahkan pada larutan logam pada saat awal sebelum dilakukan titrasi dan akan membentuk kompleks berwarna dengan sejumlah logam kecil. [1]
Indikator yang dapat digunakan untuk titrasi kompleksometri ini antara lain: 1. Mureksida
garam monium dari asam purpurat dan anionnya mempunyai struktur (1), marupakan indikator ion logam pertama yang digunakan dalam titrasi EDTA, berwarna ungu kemerahan pH 9 sampai pH 11 dan biru di atas pH 11.
2. Biru Tua Solokrom atau Kalkon
Nama lain hitam eriokrom RC mempunyai 2 atom hidrogen fenolat yang dapat terionisasi secara bertahap dengna pK masing-masing 7,4 dan 13,5, pada titrasi kalsium secara kompleksometri dengna adanya magnesium ini harus dilakukan pada pH kira-kira 12,3.Perubahan warnanya dari merah jambu menjadi biru
murni. 3. Kalmagit
Indikator ini mempunyai perubahan warna ayng sama seperti hitam solokrom, tetapi warnanya agak lebih jelas dan tajam. Larutan indikator ini stabil hampir tanpa batas waktu.
4. Kalsikrom
Mempunyai struktur lingkaran dan sangat selektif untuk kalsium. Zat ini sebenarnya tidak begitu sesuai sebagai indikator EDTA.[3]
5. Hitam Solokrom (Hitam Eriokrom T)
Indikator ini peka terhadap perubahan kadar logam dan pH larutan. Pada pH 8 -10 senyawa ini berwarna biru dan kompleksnya berwarna merah anggur. Pada pH 5 senyawa itu sendiri berwarna merah, sehingga titik akhir sukar diamati, demikian juga pada pH 12. Umumnya titrasi dengan indikator ini dilakukan pada pH 10.
Indikator ini berwarna kuning sitrun dalam suasana asam dan merah dalam suasana alkali. Kompleks logam-jingga xilenol berwarna merah, karena itu digunakan pada titrasi dalam suasana asam.[4]
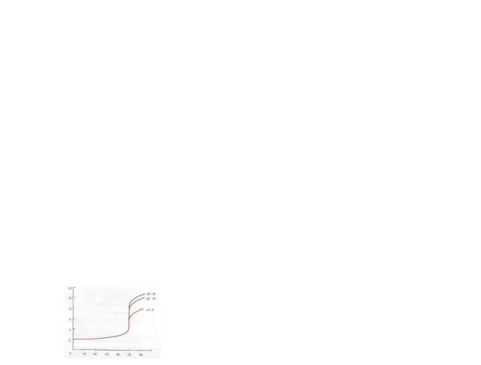
Berikut adalah kurva titrasi kompleksometri
Gambar 4.2.1. Kurva titrasi 50 mL 0,01 M Ca2+ dititrasi dengan 0,01 M EDTA pada pH 8, 10, dan 12
Macam-macam titrasi komplesometri A. Titrasi langsung
Merupakan metode yang paling sederhana dan sering dipakai. Larutan ion yang akan ditetapkan ditambah dengan buffer, misalnya buffer pH 10 lalu ditambah indicator logam yang sesuai dan dititrasi langsung dangan larutan baku dinatrium edetat. Untuk mecegah pengendapan logam hidroksida atau garam basa dengan buffer, dilakukan dengan penambahan pembentuka kopleks pembantu misalnya tartrat, sitrat, atau trietanol amin.
B. Titrasi kembali
Cara ini penting untuk logam yang mengendap dengan hidrokasida pada pH yang dikehendaki untuk titrasi, untuk senyaw yang tidak larut misalnya: sulfat, kalsium oksalat, untuk senyawa yang membentuk kompleks yang sangat lambat dan ion logam yang membentuk kompleks lebih stabildengan natrium edeta daripada dengan indicator. Pada keadaan demikian, dapat ditambahkan larutan baku dinatrium edetat berlebihan kemudian larutan ditambah buffer pada pH yang diinginkan, dan kelebihan dinatrium edetat dititrasi kembali
dengan larutan baku ion logam. Titik akhir ditunjukkan dengan pertolongan indikator logam.
C. Titrasi subtitusi
Cara ini dilakukan bila ion logam tersebut memberikan itik akhir yang jelas apabila dititrasi secara langsung atau dengan titrasi kembali, atau juga ion logam tersebut membentuk komples dengna dinatrium edetat lebih stabil daripada logam lain seperti magnesium dan kalsium. Kalsium, timbal dan raksa dapat ditetapkan dengan cara ini dengan indikator hitam eriokrom dengan hasil yang memuaskan.
D. Titrasi tidak langsung
Cara titrasi tidak langsung dapat digunakan untuk menetukan kadar ion-ion seperti anion yang tidak bereaksi dengna pengkelat. Sebagi contoh barbiturate tidat bereaksi dengan EDTA, akan tetapi secara kuantitatif dapt diendapkan dengan ion merkuri dalam keadaan bas sebagai ion kompleks. Setelah pengendapan dengan kelebihan Hg(II), kompleks dipindahkan dengan cara penyaringan dan dilarutkan kembali dalam larutan baku EDTA berlebihan. E. Titrasi alkalimetri
Pada titrasi ini, proton dari dinatrium edetat, Na2H2Y dibebaskan oleh logam
berat dan dititrasi dengan larutan baku alkali sesuai dengan persamaan reaksi berikut:
Mn+ + H2Y2- (MY)+n-4 + 2H- [1]
Logam larutan yang ditetapkan dengan metode ini sebelum dititrasi harus dalam suasana netral terhadap indikator yang digunakan. Penetapan titik akhir menggunakan indikator asam-basa atau secara potensiometri. [1]
Titrasi kompleksometri digunakan untuk menentukan kandungan garam-garam logam seperti:
-
bismut subkarbonat-
bismut subnitrat-
kalsium karbonat-
kalsium klorida-
kalsium glukonat-
kalsium hidrogen fosfat-
kalsium hidroksida-
larutan topikal kalsium pantotenat-
kalsium sulfat-
magnesium karbonat-
magnesium stearat-
magnesium sulfat-
mangan sulfat-
zink sulfat [4]Kesadahan adalah salah satu sifat kimia yang dimiliki oleh air. Penyebab air menjadi sadah adalah karena adanya ion-ion Ca2+, Mg2+, atau juga dapat disebabkan karena adanya ion-ion lain dari polyvalent metal (logam bervalensi banyak) seperti Al, Fe, Mn, Sr, dan Zn dalam bentuk garam sulfat, klorida dan bikarbonat dalam jumlah kecil.
Pengertian kesadahan air adalah kemampuan air mengendapkan sabun, dimana sabun ini diendapkan oleh ion-ion Ca2+ dan Mg2+. Karena penyebab dominan/utama kesadahan adalah Ca2+ dan Mg2+, khususnya Ca2+ maka arti dari kesadahan dibatasi sebagai sifat/karateristik air yang menggambarkan konsentrasi jumlah dari ion Ca2+ yang dinyatakan sebagai CaCO3.
Kesadahan ada dua jenis, yaitu:
-
Kesadahan sementara adalah kesadahan yang disebabkan oleh adanya garam-garam bikarbonat, seperti Ca(HCO3)2, kesadahan sementara ini dapat denganmudah dieliminir dengan pemanasan (pendidihan), sehingga terbentuk endapan CaCO3 atau MgCO3.
Ca(HCO3)2 (dipanaskan) CO2(gas) + H2O(cair) + CaCO3(endapan)
Mg(HCO3)2(dipanaskan) CO2(gas) + H2O(cair) + MgCO3(endapan)[4]
-
Kesadahan tetap adalah kesadahan yang disebabkan oleh adanya garam-garam klorida, sulfat dan karbonat, misal CaSO4, MgSO4, Cal2, MgCl2. Kesadahantetap dapat dikurangi dengan penambahan larutan soda kapur (terdiri dari larutan natrium karbonat dan manesium hidroksida) sehingga terbentuk endapan kalium karbonat (padatan/endapat) dan magnesium hidroksida (padatan/ endapan) dalam air.[4]
Kation penyebab kesadahan dapat dikurangi atau dihilangkan dengan proses- proses sebagai berikut:
-
PemanasanPenghilang kesadahan dengan cara pemanasan hanya dapat menghilangkan kesadahan sementara yakni garam Ca(HCO3)2 dan Mg(HCO3)2. Jika air yang
mengandung garam-garam tersebut dipanaskan maka akan terjadi senyawa CaCO3 dan MgCO3 yang mempunyai sifat kelarutan kecil di dalam air
sehingga dapat diendapkan.
-
Proses pengendapan kimiaDi dalam proses penghilang kesadahan dengan pengendapan kimia tujuanya adalah untuk membentuk garam-garam kalsium dan magnesium menjadi bentuk garam-garam yang tidak larut, sehingga dapat diendapkan dan dapat
dipisahkan dari air.
-
Proses pertukaran ionPada proses pertukaran ion, kalsium dan magnesium ditukar dengan sodium. Pertukaran ini berlangsung dengan cara melewatkan air sadah ke dalam tempat butiran yang terbuat dari bahan yang mempunyai kemampuan menukarkan ion. Bahan penukar ion pada awalnya menggunakan bahan yang berasal dari alam yaitu greensand yang biasa disebut zeloit. [5]
Tabel 4.2.2 derajat kesadahan
Lunak < 50 < 2,9 1-75
Agak sadah 50-100 2,9-5,9 75-150
Sadah 100-200 5,9-11,9 150-300
Sangat sadah >200 > 11,9 > 300
Amonia (NH3) atau azane adalah senyawa dari nitrogen dan hydrogen,
tidak berwarna dengan karateristik berbau tajam. Gas ammonia dapat menyebabkan kerusakan paru-paru dan kematian. Amonia memberikan si gnifikasi terhadap gizi kebutuhan organism, baik langsung atau tidak langsung juga merupakan bahan untuk sintesis banyak obat-obatan dan digunakan di banyak produk pembersih.
Masa molar : 17,031 g / mol
Penampilan : gas yang tidak berwarna dan berbau sangat menyengat Titik lebur : -77,73 °C
Titik didih : -33,34 °C Keasaman (pKa) : 32,5 Kebasahan (pKb) : 4,75
Amonium klorida (NH4Cl) sebuah senyawa anorganik. Kristal putih
garam, sangat larut dalam air. Mineral ini umumnya terjadi pada pembakaran (dibentuk oleh kondensasi dari gas batubara yang diturunkan). Amonia klorida terjadi secara alami di gunung berapi daerah pembentukan pada batuab volkanik dekat asap-releasing ventilasi (fumarol). Kristal langsung membentuk gas, dan cenderung berumur pendek, karena mereka larut dalam air.
Masa molar : 53,491 g / mol Penampilan : putih, hidroskopis Titik lebur : 338 °C
Keasaman (pKa) : 9,245
EDTA (C10H16 N2O5) adalah asam karboksilat poliamino dan berwarna,
tidak larut dalam air padat. Merupakan anggota dari asam karboksilat poliamino keluarga ligan. EDTA 4 - biasanya mengikat kation logam melalui dua amina dan empat karboksilat.
Masa molar : 292,24 g / mol Penampilan : putih, hidroskopis Titik lebur : 237-245 °C
Keasaman (pKa) : 1,5
Murexide (NH4C8H4 N5O6) juga disebut ammonium purpurate atau MX,
adalah amonium garam dari asam purpura . Ini dapat dibuat dengan memanaskan alloxantin dalam amonia gas sampai 100 ° C, atau dengan uramil mendidih (5-aminobarbituric asam) dengan oksida merkuri. Murexide sedikit larut dalam air. Dalam larutan asam kuat berwarna kuning, larutan asam lemah berwarna ungu-kemerahan, larutan basa berwarna biru-ungu.
Rumus molekul : NH4C8H4 N5O6
Massa molar : 284,19 g / mol
Penampila : bubuk ungu kemerahan
Natrium hidroksida (NaOH) juga dikenal sebagai soda kaustik atau sodium hidroksida adalah sejenis basa logam kaustik. Natrium hidroksida membentuk larutan alkalin yang kuat ketika dilarutkan ke dalam air, natrium hidroksida digunakan di berbagai macam bidang industri sebagai basa dalam proses produksi bubur kayu dan kertas, tekstil, air minum, sabun dan deterjen. Natrium hidroksida adalah basa yang paling umum digunakan dalam laboratorium kimia. Natrium hidroksida lembab cair dan secara spontan, menyerap karbon dioksida dari udara bebas, sangat larut dalam air dan akan melepaskan panas ketika dilarutkan, juga larut dalam etanol dan methanol, tidak larut dalam dietil eter, meninggalkan noda kuning pada kain dan kertas.
Masa molar : 39,9971 g /mol Penampilan : zat padat putih Titik lebur : 318 °C
Titik didih : 1390 °C Densitas : 2,1g /mol Kebasahan (pKb) : -2,43
Seng sulfat (ZnSO4) adalah senyawa anorganik dengan rumus ZnSO4
berupa padatan tak berwarna yang merupakan sumber umum dari ion seng larut. Berat molekul : 161,47 g/mol
Titik lebur : 680 oC Titik didih : 740 oC
Densitas : 5,7 g/100 ml A. Alat-alat yang digunakan
- batang pengaduk - beakerglass - botol aquadest - buret - corong - Erlemeyer - gelas arloji - kertas saring - labu ukur - neraca analitik - pipet tetes - pipet volume - statif dan klem
- termometer
B. Bahan-bahan yang digunakan - air sumur - ammonia (NH3) - ammonium klorida (NH4Cl) - aquadest (H2O) - etiendiamintetraasetat (HO2CCH2)2 NHCH2CH2 N(CH 2CO2CO2H)2) - indikator EBT-NaCl - indikator Murexide (NH4C8H4 N5O6)-NaCl
- natrium hidroksida (NaOH) - seng sulfat (ZnSO4)
A. Preparasi larutan
-
membuat larutan seng sulfat 0,01 M sebanyak 100 mL-
membuat larutan buffer pH 10 sebanyak 100 mL (6,75 gram amonium klorida ditambahkan dengan 57 mL larutan amonium pekat)-
membuat larutan natrium hidroksida 2 M sebanyak 100 mL-
membuat larutan EDTA 0,01 M sebanyak 500 mLB. Standarisasi larutan EDTA 0,01 M
-
memipet 25 mL larutan seng sulfat 0,01 M, memasukkan ke dalam Erlenmeyer 250 mL-
menambahkan kurang lebih 75 mL aquadest dan 2 mL larutan buffer pH 10-
mengocok lalu menambahkan sedikit indikator EBT-NaCl sampai warna larutan merah anggur-
mentitrasi dengan larutan EDTA 0,01 M sampai warna lasrutan menjadi biru-
mengulangi percobaan sampai 3 kali. C. Menentukan kesadahan total-
memipet 25 mL larutan contoh, memasukkan ke dalam Erlenmeyer 250 mL-
menambahkan 20 tetes larutan NaOH 2 M dan sedikit indikator Murexide-NaCl-
mentitrasi dengan larutan EDTA sampai terjadi warna merah anggur-
melakukan percobaan samapi 3 kali.Data pengamatan standarisasi larutan EDTA
Keterangan I II II
Volume larutan seng sulfat dititrasi (mL) 102 102 102 Volume larutan EDTA - peniter (mL) 43,1 42,9 43,4 Volume rata-rata larutan seng sulfat dititrasi (mL) 43,1
4.5.2 Data pengamatan penentuan kesadahan total
Keterangan I II III
Volume larutan dititrasi - sampel (mL) 25 25 25 Volume larutan EDTA - peniter (mL) 5,1 4,4 5 Volume rata-rata larutan yang dititrasi-sampel (mL) 4,8
Data pengamatan penentuan kesadahan tetap
Keterangan I II III
Volume larutan dititrasi - sampel (mL) 25 25 25 Volume larutan EDTA - peniter (mL) 10,3 9,1 10,2 Volume rata-rata larutan yang dititrasi-sampel (mL) 9,9
Tabel 4.6.4. Data pengamatan perubahan standarisasi EDTA
Standarisasi larutan EDTA Perubahan Warna Larutan titran dengan indicator EBT-NaCl
ZnSO4 + Larutan bufer
Merah anggur Standarisasi larutan EDTA
ZnSO4 + Larutan buffer + EDTA
Biru Tabel 4.6.5. Data pengamatan perubahan penentuan kadar Ca2+
Menentukan kesadahan total Perubahan Warna Larutan titran dengan indicator Murexide-NaCl
Larutan sampel + NaOH + Murexide NaCl Ungu Penentuan kadar Ca + dengan EDTA
Larutan sampel + NaOH + Murexide NaCl + EDTA
Merah anggur
Tabel 4.6.6. Data pengamaan perubahan penentu kadar Mg2+
Menentukan kesadahan tetap Perubahan Warna Larutan titran dengan indicator EBT-NaCl
Larutan sampel + NaOH + EBT NaCl Ungu
Penentuan kadar Mg + dengan Murexide-NaCl
Larutan sampel + NaOH + EBT NaCl + EDTA Merah angur Persamaan Reaksi
A. Standarisasi larutan EDTA
Zn2+ + HIn2-(biru) ZnIn-(merah) + H+
(seng) (EDTA) (seng EDTA) (hidrogen)(Khopkar)
B. Menetukan kandungan Ca2+
Ca2+ + HIn2-(biru) CaIn-(merah) + H+
(Kalsium) (EDTA) (kalsium EDTA) (hidrogen)(Khopkar)
Ca2+ + Mgy2-(biru)- Cay2- + Mg2+
(kalsium) (magnesium) (kalsium EDTA) (magnesium)
Mg2+ + Hin2-(biru) MgIn- (merah) + H+
(magnesium) (EDTA) (magnesium EDTA) (hidrogen)(Khopkar)
Pembahasan
1. Memahami Kompleksometri
-
Kompleksometri ialah jenis titrasi dimana titrant dan titrat sailing mengkompleks, jadi membentuk hasil berupa kompleks. Reaksi-reaksi pembentukan kompleks atau yang menyangkut kompleksbanyak sekali,dan penerpan juga banyak, tidak hanya dalam titrasi
-
Penambahan indikator bertujuan untuk mengetahui kadar kesadahan total dan kesadahan tetap. Kesadahan tetap menggunakan indikator EBT- NaCl, kesadahan tetap menggunakan indikator Murexide. Karena pada pH diatas 11, murexide berubah menjadi biru-
EDTA sbagai lartan baku skunder karena EDTA lalu membentuk kompleks ketika direksiakan dengan ion logam dan kestabilan EDTA sangat konstan sehingga reaksi sempurna-
ZnSO4 sebagai larutan baku primer karena mudah bereaksi denganlarutan EDTA
-
Perubahan warna terjadi karena larutan tersebut sudah mencapi titik ekuivalen-
Konsentrasi EDTA yang didapat pada saat praktikum adalah 0,00575M, sedangkan secara teori 0,01M. Ini disebabkan karena EDTA membentuk senyawa kompleks yang lebih stabil.2. Memahami Kesadahan
-
Menentukan kesadahan air menggunakan titrasi karena untuk menentukan kesadahan diperlukan volume titrasi dari air sampel-
Kesadahan air adalah kandungan mineral-mineral tertentu di dalam air, umumnya ion kalsium (Ca) dan magnesium (Mg) dalam bentuk garam karbonat. Air sadah adalah air yang memiliki kadar mineral yang tinggi, sedangkan air lunak adalah air dengan kadar mineral yang rendah. Selainion kalsium dan magnesium, penyebab kesadahan juga bisa merupakan ion logam lain maupun garam-garam bikarbonat dan sulfat. Metode paling sederhana untuk menentukan kesadahan air adalah dengan sabun.
Dalam air lunak, sabun akan menghasilkan busa yang banyak
-
Penyebab kesalahan dari pratikum yang kami lakukan, kami menyimpulkan kesalahan yang terjadi karena faktor penimbangan EDTA, peimbangan tidak bisa dipastikan secara sempurna karena menggunakan timbangan neraca-
Berdasarkan praktikum yang telah kami lakukan, kami menyimpulkan bahwa kesadahan air, berbeda-beda tergantung air yang kita uji dantingkat kesadahan air tersebut. Kesimpulan
-
Kompleksometri merupakan titrasi dimana reaksi antara titran dan titrat membentuk senyawa kompleks-
Kadar kesadahan dalam air sampel Kadar Ca dalam air sampelKandungan Ca pada air sampel sumur 1 yang pertama mencapai 81,6 ppm, air tersebut masih bisa digunakan karena masih dalam ambang batas kesadahan air.
Kadar Ca pada air sampel sumur 2 tingkat kesadahan mencapai 70,4 ppm, air tersebut masih bisa digunakan karena masi di baha batas
kesadahan air
Kadar Ca pada air sampel yang ketiga, mengunakan air kran tingkat kesadahan mencapai 80 ppm air tersebut masih bisa digunakan karena masih di bawah batas kesadahan air
Kadar Mg dalam air sampel
Kadar Mg pada air sammpel sumur 1, tingkat kesadahan mencapai 80,2872 ppm air tersebut sudah tidak bisa digunakan karena melampaui batas kesadahan air
Kadar Mg pada air sampel sumur 2 tingkat kesadahan mencapai 71,3448 ppm, air tersebut sudah tidak bisa digunakan karena melampaui batas
kesadahan air
Kadar Mg pada air sampel 3, mengunakan air kran tingkat kesadahan mencapai 79,704ppm, air terseb ut sudah tidak bisa digunakan karena melampaui batas kesadahan air
Kadar Ca dan Mg dalam air sampel
Kadar Ca dan Mg dalam air sampel yang pertama mencapai 165 ppm, air masih bisa digunakan
Kadar Ca dan Mg dalam air sampel yang kedua mencapai 364 ppm air tidak bisa digunakan karena melebihi ambang batas kesadahan air.
Kadar Ca dan Mg dalam air sampel yang ketiga mencapai 163 ppm air masih bisa digunakan karena pada batas normal kesadahan air
Kompleksometri
1. Pembuatan larutan standard seng sulfat 0,01 M M ZnSO4 =
0,01 M =
W = 0,161 gramJadi untuk membuat larutan standard ZnSO4 0,01 M yaitu dengan
menimbang 0,161 gram ZnSO4 dan melarutkannya didalam labu ukur 100
mL sampai tanda batas.
2. Pembuatan larutan NaOH 2 M
M NaOH =
2 M =
W = 8 gramJadi untuk membuat larutan standard NaOH 2 M yaitu dengan menimbang 8 gram NaOH dan melarutkannya didalam labu ukur 100 mL sampai tanda batas.
3. Pembuatan larutan standard EDTA 0,01 M MEDTA =
0,01 M =
W = 1,46 gramJadi untuk membuat larutan EDTA 0,01 M yaitu dengan menimbang 1,46 gram dan melarutkannya didalam labu ukur 500 mL sampai tanda batas. 4. Perhitungan Standarisasi Diketahui : MZnSO4 = 0,01 M V ZnSO4 = 25 mL MEDTA = 0,01 M VEDTA1 = 43,1 mL VEDTA2 = 43,9 mL VEDTA3 = 43,4 mL Vrata-rata = = = 43,47 mL
VZnSO4 × MZnSO4 = VEDTA× MEDTA
25 × 0,01 = 43,47× MEDTA
MEDTA = 0,00575 M
Jadi Molaritas EDTA adalah 0,00575 M. 5. Menentukan kadar Ca2+ Diketahui : V sampel1 = 25 mL V sampel2 = 25 mL V sampel3 = 25 mL MEDTA = 0,01 M VEDTA1 = 5,1 mL
VEDTA2 = 4,4 mL
VEDTA3 = 6 mL
BM Ca2+ = 40
Ditanya : Kadar Ca+ pada tiap-tiap sampel? Ca2+ =
=
= 81,6 ppm
Jadi kadar Ca2+ dari air sampel 1(air sumur 1 ) adalah 81,6 ppm. Ca2+ =
=
=
70,4 ppmJadi kadar Ca2+ dari air sampel 2 (air sumur 2) adalah 70,4 ppm. Ca2+ =
=
= 80 ppm
Jadi kadar Ca2+ dari air sampel 3(air kran) adalah 80 ppm. 6. Menentukan kadar Ca2+ dan Mg2+
Diketahui : V sampel1 = 25 mL V sampel2 = 25 mL V sampel3 = 25 mL MEDTA = 0,01 M VEDTA1 = 10,3 mL VEDTA2 = 9,1 mL VEDTA3 = 10,2 mL
BMCaCO3 = 100
Ditanya : Kadar Ca2+dan Mg2+ ?
Ca2+ dan Mg2+=
=
= 412 ppm
Jadi kadar Ca2+ dan Mg2+ dalam air sampel 1 (air sumur 1) adalah 165 ppm. Ca2+ dan Mg2+ =
=
= 364 ppmJadi kadar Ca2+ dan Mg2+ dalam air sampel 2 (air sumur 2) adalah 364 ppm. Ca2+dan Mg2+ =
=
= 408 ppmJadi kadar Ca2+dan Mg2+ dalam air sampel 3 (air kran) adalah 163 ppm. 7. Menentukan kadar Mg2+
Diketahui :
Kadar Ca2+sampel1 = 81,6 ppm
Kadar Ca2+sampel2 = 70,4 ppm
Kadar Ca2+sampel3 = 80 ppm
Kadar Ca2+ dan Mg2+sampel1 = 412 ppm
Kadar Ca2+ dan Mg2+sampel2 = 364 ppm
Kadar Ca2+ dan Mg2+sampel3 = 408 ppm
BM Mg2+ = 24,3
Ditanya : Kadar Mg2+ pada tiap-tiap sampel?
Mg2+ = [(Kadar Ca2+ dan Mg2+sampel1) – Kadar Ca2+sampel1)] ×
=
[
(
412) – 81,6) × ]
= 330,4 × 0,243 = 80,2872 ppmJadi kadar Mg2+ dalam air sampel 1 (air sumur 1) adalah 80,2872 ppm. Mg2+ = [(Kadar Ca2+ dan Mg2+sampel2) – Kadar Ca2+sampel2)] ×
=
[
(
364) – 70,4) × ]
= 293,6 × 0,243 = 71,3448 ppmJadi kadar Mg2+ dalam air sampel2 (air sumur 2) adalah 71,3448 ppm. Mg2+ = [(Kadar Ca2+ dan Mg2+sampel3) – Kadar Ca2+sampel3)] ×
=
[
(
408) – 80) × ]
= 328 × 0,243 = 79,704 ppmDAFTAR PUSTAKA
1. Gholib, Ibnu, Kimia Farmasi Analisi, Pustaka Belajar, Yogyakarta, 2007. 2. Khopkar, konsep Dasar Kimia Analitik, Universitas Indonesia, Jakarta,
1990.
3. Basset, J,Vogel Kimia Analisis Kuatitatif Anorganik, Buku Kedokteran EGC, 1994.
4. (____,http//www.wikipedia.com/27/04/2012.