TESIS
OLEH
YASMINE F. SIREGAR NIM: 147115002
PROGRAM PENDIDIKAN DOKTER SPESIALIS
DEPARTEMEN KARDIOLOGI DAN KEDOKTERAN VASKULAR FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
MEDAN 2019
HALAMAN PERNYATAAN ORISINALITAS
PERAN NILAI RASIO NEUTROFIL-LIMFOSIT
DALAM MENILAI KEADAAN KOLATERAL ARTERI KORONER PADA PENDERITA PENYAKIT JANTUNG KORONER STABIL
TESIS PROFESI
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang pernah dituliskan atau diterbitkan oleh orang lain, kecuali yang digunakan sebagai acuan referensi dan telah disebutkan dalam daftar pustaka.
Nama : Yasmine F. Siregar NIM : 147115002
Tanda tangan :
Medan, Februari 2019
Yasmine F. Siregar
UCAPAN TERIMA KASIH
Puji dan syukur saya ucapkan kehadirat Allah SWT yang telah memberikan berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan tesis ini. Tesis ini dibuat untuk memenuhi syarat kelulusan dalam Program Pendidikan Dokter Spesialis Jantung dan Pembuluh Darah di Fakultas Kedokteran Universitas Sumatera Utara.
Pada kesempatan ini perkenankanlah penulis menyatakan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada :
1. Rektor Universitas Sumatera Utara dan Dekan Fakultas Kedokteran Universitas Sumatera Utara yang telah memberikan kesempatan kepada penulis untuk mengikuti Program Pendidikan Dokter Spesialis Jantung dan Pembuluh Darah di Fakultas Kedokteran Universitas Sumatera Utara.
2. Prof. dr. Harris Hasan, SpPD, SpJP(K) selaku Ketua Departemen Ilmu Jantung dan Pembuluh Darah Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan yang telah memberikan kesempatan kepada penulis untuk mengikuti Program Pendidikan Dokter Spesialis Jantung dan Pembuluh Darah di Fakultas Kedokteran Universitas Sumatera Utara.
3. dr. Cut Aryfa Andra, M.Ked(Cardio), SpJP(K) selaku Sekertaris Departemen Ilmu Jantung dan Pembuluh Darah Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan yang telah membimbing dan memberikan saran-saran berharga dalam penulisan penelitian ini.
4. dr. Ali Nafiah Nasution, M.Ked(Cardio), SpJP(K) selaku Ketua Program Studi PPDS Ilmu Jantung dan Pembuluh Darah Fakultas Kedokteran Universitas Sumatera Utara yang telah memberikan ide, arahan serta masukan sehingga dapat menerapkan pola berpikir yang komprehensif mengenai tulisan ini.
5. dr. Yuke Sarastri, M.Ked(Cardio), SpJP selaku Sekretaris Program Studi PPDS Ilmu Penyakit Jantung dan Pembuluh Darah Fakultas Kedokteran Universitas Sumatera Utara yang telah memberikan kritikan dan saran yang begitu berharga sehingga penulis dapat menyelesaikan tesis ini.
6. Dr. dr. Zulfikri Mukhtar SpJP (K) sebagai pembimbing satu penulis dalam penyusunan tesis ini yang dengan penuh kesabaran telah membimbing, mengoreksi serta memberikan saran-saran yang begitu berharga sehingga akhirnya tesis ini dapat terselesaikan dengan baik.
7. dr. Ali Nafiah Nasution, M.Ked(Cardio), SpJP(K) sebagai pembimbing dua penulis dalam penyusunan tesis ini yang telah membimbing dan memberikan saran sehingga akhirnya tesis ini dapat terselesaikan dengan baik.
8. Para guru penulis: Prof. dr. T. Bahri Anwar, SpJP(K); Prof. dr. Sutomo Kasiman, SpPD, SpJP(K); Prof. dr. Abdullah Afif Siregar, SpA(K), SpJP(K); Prof. dr. Harris Hasan, SpPD, SpJP(K); dr.Nora C. Hutajulu, SpJP(K); Dr. dr. Zulfikri Mukhtar, SpJP(K); Alm. dr. Isfanuddin N. Kaoy, SpJP(K); dr. Parlindungan Manik, SpJP(K); dr. Refli Hasan, SpPD, SpJP(K); Alm. dr. Amran Lubis, SpJP(K); dr. Nizam Akbar, SpJP(K); dr.
Zainal Safri, SpPD, SpJP(K); dr. Andre P. Ketaren, SpJP(K); dr. Andika Sitepu, SpJP(K); dr. Anggia C. Lubis, SpJP; dr. Ali Nafiah Nasution, M.Ked(Cardio), SpJP(K); dr. Cut Aryfa Andra, M.Ked(Cardio), SpJP(K);
dr. Hilfan Ade Putra Lubis, M.Ked(Cardio), SpJP; dr. Andi Khairul, M.Ked(Cardio), SpJP; dr. Abdul Halim Raynaldo, M.Ked(Cardio), SpJP(K); dr. M. Yolandi, SpJP; dr. Yuke Sarastri, M.Ked(Cardio), SpJP; dr.
Teuku Bob Haykal, M.Ked(Cardio), SpJP; dr. T. Winda Ardini, M.Ked(Cardio), SpJP; dr. Faisal Habib, SpJP serta guru lainnya yang tidak dapat penulis sebutkan satu persatu, yang telah banyak memberikan masukan dan dorongan selama mengikuti program pendidikan magister ini.
9. Direktur Rumah Sakit Umum Pusat Haji Adam Malik Medan yang telah memberikan kesempatan, fasilitas, dan suasana kerja yang baik sehingga
penulis dapat mengikuti Program Pendidikan Dokter Spesialis Jantung dan Pembuluh Darah.
10. Teristimewa untuk kedua orang tua yang sangat penulis hormati dan sayangi yakni Prof. dr. Abdullah Afif Siregar, SpA(K), SpJP(K) dan ibunda tercinta dr. Chairiyah Tanjung, SpKK(K) yang selama ini telah memberikan dukungan dan perhatian baik moril dan materi serta doa dan nasihat agar penulis tetap semangat, sabar dan tegar dalam mengikuti pendidikan sampai selesai. Semuanya itu tidak akan dapat penulis balas dengan apapun, penelitian ini hanya permulaan bukti kecil tanda terima kasih yang penulis persembahkan untuk orang tua tercinta.
11. Kepada Bapak dan Ibu Mertua Penulis, dr. Masdulhag Siregar, SpOG(K) dan dr. Tapisari Tambunan, SpPK(K), yang selama ini memberikan dukungan moril dan materi serta doa, nasihat yang tulus agar penulis tetap semangat, sabar dan tegar dalam mengikuti pendidikan sampai selesai.
12. Kepada suami tercinta dr. Alamsyah Faritz Siregar yang telah memberikan dukungan, semangat dan doa serta pengertian kepada penulis sehingga tetap semangat dan kuat dalam menyelesaikan penelitian ini.
13. Keempat sahabat seperjuangan penulis yaitu dr. Marisa K. Hazrina, dr.
Rizki Astria F, dr. Suhenda B.H. Ginting, dan dr. Omar Mokhtar Siregar yang sejak awal masa pendidikan telah bersama-sama dengan penulis saling membantu dan bekerjasama melalui berbagai proses pendidikan.
14. Rekan-rekan sahabat Kelakar Medan yang telah memberikan waktu dan tenaga dalam membantu pengambilan sampel penelitian, proses seminar dan memberikan masukan serta saran dan doa dalam penyelesaian tesis ini dan saling membantu dalam mengikuti program pendidikan profesi ini.
15. Para perawat Pusat Jantung Terpadu RSUP H. Adam Malik Medan khususnya yang bertugas di bagian Cardiac Emergency, CVCU, dan ruangan rawat inap yang telah memberikan kesempatan kepada penulis pada waktu luang untuk mengambil data sampel penelitian.
16. Para staf administari Ahmad Syafi’i, Nanda dan Husna yang telah membantu terselenggaranya penelitian ini.
Semoga Allah Yang Maha Pengasih membalas semua jasa dan budi baik mereka yang telah membantu penulis dalam menyelesaikan penelitian ini.
Akhirnya penulis mengharapkan agar penelitian dan tulisan ini kiranya dapat bermanfaat bagi kita semua.
Medan, Februari 2019
Penulis
ABSTRAK
Latar Belakang: Kolateral arteri koroner (KAK) merupakan respon adaptif terhadap iskemia miokard kronis. Pasien dengan stenosis koroner memiliki derajat kolateral yang bervariasi. Kadar sel inflamasi adalah determinan dari perkembangan pembuluh kolateral. Rasio neutrofil-limfosit (RNL) berperan sebagai penanda prognostik respon inflamasi sistemik dan perkembangan KAK.
Penelitan ini bertujuan untuk melihat hubungan antara nilai RNL dengan perkembangan KAK pada pasien penyakit jantung koroner (PJK) dengan multivessel disease.
Metode: Sebanyak 151 penderita multivessel disease terlibat dalam penelitian ini.
Derajat KAK diklasifikasikan menurut klasifikasi Rentrop, yaitu kurang baik (nilai Rentrop 0-1) dan baik (nilai Rentrop 2-3). Faktor-faktor yang signifikan dengan nilai p≤0,25 pada model bivariat akan dimasukkan ke dalam regresi logistik multipel. Analisis receiver–operating characteristic (ROC) dilakukan untuk menentukan titik potong nilai RNL yang memprediksi kondisi KAK yang kurang baik
Hasil: Dari 151 pasien PJK dalam studi ini, dijumpai 76 penderita dengan KAK kurang baik dan 75 penderita dengan KAK baik. Penderita PJK dengan KAK yang kurang baik memiliki nilai RNL yang lebih tinggi dibandingkan penderita PJK dengan KAK baik (2,25±1,189 vs. 3,03±1,527, p <0,001) Hasil analisis regresi logistik multipel mendapatkan nilai RNL yang tinggi adalah prediktor independen KAK yang kurang baik (OR 0,756; IK 95% 0,587 – 0,974). Hasil analisis ROC menemukan nilai potong RNL 1,99 (AUC 0,72, sensitivitas 78,9%, spesifisitas 52%) untuk memprediksi KAK yang kurang baik.
Kesimpulan: Rasio neutrofil-limfosit yang tinggi mampu memprediksi keadaan kolateral arteri koroner yang kurang baik pada penderita penyakit jantung koroner stabil dengan multivessel disease. Nilai RNL >1,99 secara independen berhubungan dengan KAK yang kurang baik. Nilai ini memiliki sensitivitas 78,9% dan spesifisitas 52%.
Kata Kunci: kolateral arteri koroner; rasio neutrofil limfosit; penyakit jantung koroner; parameter hematologis
ABSTRACT
Background: Coronary collateral circulation (CCC) is an adaptive response to chronic myocardial ischemia. Patients with coronary stenosis develop varying degrees of collateral. Levels of inflammatory cells were suggested as potential determinants of collateral development. Neutrophil to lymphocyte (N/L) ratio has been proposed as a prognostic marker to determine systemic inflammatory response and the development of CCC. Our aim was to determine the relationship between N/L ratio and development of CCC in patients with coronary artery disease (CAD) with multivessel disease.
Methode: A total of 151 patients with multivessel disease were included in this study. Coronary collateral grades were classified according to Rentrop collateral grades as either poorly developed CCC (Rentrop grade 0-1) or well developed CCC (Rentrop grades 2-3). Factors significant at the p≤0.25 in the bivariate models were put into multiple logistic regressions. The receiver–operating characteristic (ROC) analysis were performed to determine the cutoff value of NLR in prediction poor CCC.
Result: Of the 151 CAD patients in this study, 76 patients had poorly developed CCC and 75 patients had well developed CCC. Poorly developed CCC had significantly higher N/L ratio than well developed CCC (2.25±1.189 vs.
3.03±1.527, p <0.001). Logistic regression analysis showed that N/L ratio (OR 0.756; CI 95% 0.587 – 0.974, p 0.031) was independent predictor of poorly developed CCC. The ROC analysis provided a cut-off value of 1.99 (AUC 0.72, sensitivity 78.9%, specificity 52%) for N/L ratio to predict poorly developed CCC.
Conclusion: Higher neutrophil to lymphocyte ratio was useful in predicting poor coronary collateral circulation in stable coronary heart disease with multivessel disease. Neutrophil to lymphocyte ratio >1.99 was independently associated with impairment in coronary collateralization. This value had a sensitivity of 78.9%
and specificity of 52%.
Keyword: coronary collateral circulation; neutrophil to lymphocyte ratio;
coronary artery disease; hematologic parameter.
Halaman
Lembar pengesahan ... i
Halaman Penyataan Orisinalitas ... ii
Ucapan Terima Kasih ... iii
Abstrak ... vii
Abstract ... viii
Daftar Isi ... ix
Daftar Gambar ... xi
Daftar Tabel ... xii
Daftar Singkatan Dan Lambang ... xiii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Pertanyaan Penelitian ... 5
1.3. Hipotesis Penelitian ... 5
1.4. Tujuan Penelitian ... 6
1.4.1. Tujuan Umum ... 6
14.2. Tujuan Khusus ... 6
1.5. Manfaat Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1. Penyakit Jantung Koroner ... 7
2.1.1. Patofisiologi Penyakit Jantung Koroner ... 9
2.1.1.1.Formasi Plak Aterosklerosis ... 9
2.1.1.2.Remodelling Arteri ... 10
2.1.1.3.Stenosis Arteri Koroner ... 10
2.1.2. Diagnosis Penyakit Jantung Koroner ... 12
2.1.2.1.Pemeriksaan Non Invasif ... 13
2.1.2.2.Pemeriksaan Invasif ... 14
2.2. Anatomi Sirkulasi Koroner ... 14
2.3. Kolateral Arteri Koroner ... 16
2.3.1. Mekanisme Pembentukan Kolateral (Angiogenesis & Arteriogenesis) ... 19
2.3.2. Determinan Sirkulasi Kolateral Arteri Koroner ... 21
2.3.3. Klasifikasi Kolateral Arteri Koroner ... 22
2.4. Peran Inflamasi pada Penyakit Jantung Koroner Stabil ... 24
2.4.1. Peran Neutrofil dan Limfosit dalam Penyakit Jantung Koroner Stabil ... 25 2.4.2. Peran Rasio Neutrofil-Limfosit (RNL) dalam Memprediksi
BAB III METODE PENELITIAN ... 31
3.1. Desain Penelitian ... 31
3.2. Tempat dan Waktu ... 31
3.3. Populasi dan Sampel ... 31
3.4. Besar Sampel ... 31
3.5. Kriteria Inklusi dan Eksklusi ... 32
3.6. Cara Kerja dan Alur Penelitian ... 32
3.7. Identifikasi Variabel ... 34
3.8. Definisi Operasional ... 34
3.9. Pengolahan dan Analisis Data ... 36
3.10. Etika Penelitian ... 37
3.11. Rincian Biaya Penelitian ... 37
BAB IV HASIL PENELITIAN ... 38
4.1. Karakteristik Subjek Penelitian ... 38
4.2. Korelasi Karakteristik Subjek Penelitian ... 39
4.3. Analisis Multivariat Terhadap Faktor-faktor yang Berperan dalam Menentukan Keadaan kolateral Arteri Koroner ... 42
4.4. Performa Rasio Neutrofil-Limfosit Terhadap Keadaan Kolateral Arteri Koroner ... 43
BAB V PEMBAHASAN ... 45
BAB VI PENUTUP ... 50
6.1. Kesimpulan ... 50
6.2. Keterbatasan Penelitian dan Saran ... 50
DAFTAR PUSTAKA ... 52 LAMPIRAN
No Judul Halaman 2.1 Kurva aliran darah koroner maksimal dan saat istirahat dipengaruhi
oleh stenosis di proksimal arteri………. 11
2.2 Faktor-faktor yang mempengaruhi keseimbangan antara kebutuhan (kiri) dan suplai (kanan) oksigen ……….. 11
2.3 Anatomi arteri koroner………... 16
2.4 Angiografi koroner pada PJK dengan oklusi multipel ……….. 17
2.5 Suplai kolateral ke tiga arteri koroner utama ……… 19
2.6 Skema hipotesa beberapa faktor yang berperan dalam proses angiogenesis ……….. 21
2.7 Klasifikasi Rentrop ………... 23
2.8 Klasifikasi Werner ……… 24
2.9 Skema kerangka teori penelitian……… 29
2.10 Kerangka konsep penelitian ……….. 30
3.1 Skema alur penelitian………... 34
4.1 Analisis kurva Receiver-operating characteristics untuk rasio neutrofil-limfosit (RNL) sebagai prediktor keadaan kolateral arteri koroner ……….……… 44
No Judul Halaman 2.1 Klasifikasi keparahan angina berdasarkan Canadian Cardiovascular
Society……….……… 8
2.2 Definisi angiogenesis, arteriogenesis dan pembuluh
kolateral……….………. 20
4.1 Karakteristik dasar subjek penelitian ……… 40 4.2 Karakteristik hasil laboratorium subjek penelitian ……… 41 4.3 Karakteristik hasil angiografi koroner berdasarkan arteri koroner yang
terlibat dan lokasi lesi ……… 41
4.4 Hubungan karakteristik hasil angiografi koroner dengan keadaan
kolateral arteri koroner……… 42
4.5 Analisis multivariat variabel yang berperan dalam menentukan
keadaan kolateral arteri koroner ………. 43
SINGKATAN NAMA
ACEi : Angiotensin converting enzyme inhibitor ARB : Angiotensin II receptor blocker
AUC : Area under the curve
BPK : Bedah pintas koroner
b-FGF : Basic fibroblast growth factor CAMP : Cathelicidin antimicrobial peptide
ELA : Elastase
HDL : High-density lipoprotein
hs-CRP : High sensitivity C-reactive protein I-CAM : Intracellular adhesion molecule-1
IK : Interval kepercayaan
IKP : Intervensi koroner perkutan KAK : Kolateral arteri koroner
KGD : Kadar gula darah
LAD : Left anterior descending LCx : Left circumflex artery LDL : Low-density lipoprotein
LM : Left main
MMP : Matriks metalloproteinase
NET : Neutrophil extracellular trap
NO : Nitric oxide
OR : Odds ratio
PJK : Penyakit jantung koroner
PDA : Posterior descending artery RDW : Red cell distribution width
ROC : Receiver-operating characteristics ROS : Reactive oxygen species
RNL : Rasio neutrofil-limfosit
TNF : Tumor necroting factor
WHO : World Heart Association
VD : Vessel disease
LAMBANG
n1 : Besar sampel kelompok 1
n2 : Besar sampel kelompok 2
α : alpha
β : beta
S : simpangan baku gabungan
≥ : lebih besar sama dengan
≤ : lebih kecil sama dengan
> : lebih besar
< : lebih kecil
µ : mikro
% : persentase
Zα : nilai baku alpha
Zβ : nilai baku beta
X1 – X2 : selisih minimal rerata yang dianggap bermakna
BAB I PENDAHULUAN
1.1. Latar Belakang
Penyakit kardiovaskular, terutama penyakit jantung koroner (PJK) merupakan penyebab morbiditas dan mortalitas yang paling utama di dunia.
Laporan dari World Heart Organization (WHO) pada tahun 2013, sebanyak 17,5 juta orang meninggal setiap tahunnya karena penyakit kardiovaskular, hal ini sekitar 31% dari total kematian di dunia. Sekitar 80% dari semua kematian di dunia disebabkan oleh serangan jantung dan stroke. Selain itu, diketahui bahwa 75% kematian akibat penyakit kardiovaskular terjadi pada negara berpenghasilan rendah hingga menengah. Di Amerika, tercatat 15,4 juta orang menderita PJK, 7,8 juta orang diantaranya memiliki angina pektoris and 7,6 juta orang pernah mengalami infark miokard (Go, 2014). Sebanyak 375.295 orang meninggal karena PJK, serta diperkirakan terdapat 635.000 kasus baru PJK dan 300.000 kasus serangan berulang setiap tahunnya (Mozaffarian, 2015).
Di Indonesia, menurut data Riset Kesehatan Dasar (Riskesdas) tahun 2013, penyakit kardiovaskular yang paling banyak djumpai adalah PJK dan gagal jantung. Prevalensi PJK berdasarkan diagnosis dokter atau gejala sebesar 1,5%, dan semakin meningkat seiring dengan bertambahnya umur hingga mencapai 3,6%. Tidak jauh berbeda dengan PJK, prevalensi gagal jantung juga meningkat seiring bertambahnya umur, mulai 0,5% (65 – 74 tahun) hingga 1,1% ( ≥ 75 tahun) (Kemenkes RI, 2013).
PJK stabil merupakan suatu keadaan yang disebabkan oleh adanya plak ateromatosa di arteri koroner yang menyebabkan obstruksi dan secara perlahan akan mempersempit satu atau lebih arteri koroner epikardial (Marzili, 2012;
Pepine 2012). Kondisi ini akan menyebabkan ketidakseimbangan antara suplai dan kebutuhan oksigen miokard yang dapat menyebabkan iskemia/hipoksia
miokard serta akumulasi sisa metabolit. Gejalanya terinduksi oleh aktivitas, tetapi dapat juga terjadi secara spontan dan ditandai dengan gejala tidak nyaman di dada secara transien (angina pektoris) (Wilder, 2016; Montalescot, 2013).
Luaran pada pasien PJK stabil sangat bergantung pada luas area infark yang terjadi, dengan menurunkan luas area infark maka dapat menurunkan angka mortalitas kardiovaskular. Luas infark dapat dipengaruhi beberapa faktor, seperti durasi oklusi, luas area yang berisiko iskemia, suplai kolateral arteri koroner ke area iskemia, dan konsumsi oksigen miokard (Gloekler, 2007).
Kolateral arteri koroner (KAK) sudah diketahui sejak lama sebagai sumber suplai darah alternatif ke area miokard yang berisiko infark (Seiler, 2010). KAK adalah cabang-cabang anastomosis kecil yang berhubungan secara langsung ke arteri koroner besar dan sebagai prekursor sirkulasi kolateral untuk mempertahankan perfusi miokard pada kondisi stenosis berat akibat aterosklerotik di proksimal arteri koroner (Popma, 2015).
Kolateral arteri koroner yang berkembang dengan baik dapat mengurangi iskemia, menurunkan luas infark, mengurangi disfungsi ventrikel kiri, dan memberikan luaran yang lebih baik (Habib, 1991; Berry, 2007). Angka ketahanan hidup 10 tahun pada pasien PJK yang memiliki kolateral didapati lebih tinggi bermakna dibanding dengan pasien tanpa kolateral. (Meier, 2007).
Pada jantung dewasa normal, kolateral dibentuk dari pembuluh darah kecil berdinding tipis, berdiameter < 50 µm dan hanya berperan kecil dalam sirkulasi darah koroner. Pembuluh kolateral tidak tampak pada keadaan normal atau stenosis arteri koroner ringan karena kaliber yang kecil. Sebagai respon dari stenosis arteri koroner, iskemik miokard, dan perbedaan tekanan transstenosis, diameter pembuluh kolateral semakin besar (200-600 µm) dan otot polosnya semakin tebal sehingga mampu mempertahankan aliran darah. Secara konsekuan kolateral akan terlihat pada angiografi koroner (Gregg, 1980; Erwin, 2018). KAK baru berperan aktif pada keadaan iskemia berat dan rekuren (Levin, 1974).
Angiogenesis (pembentukan pembuluh darah baru) dan arteriogenesis (pertumbuhan arteriol yang sudah ada) merupakan dasar dari perkembangan KAK. Beberapa studi menunjukkan ada beberapa faktor lain yang mempengaruhi
pembentukan KAK, seperti keparahan/kecepatan progresi stenosis arteri koroner, diabetes mellitus, hipertensi, status merokok, disfungsi endotel, kebiasaan olahraga, mediator endogen, stres oksidatif dan obat-obat tertentu (Seiler, 2010).
Selama perkembangan KAK, banyak faktor endogen yang terlibat, seperti growth factor, nitric oxide, pertanda inflamasi dan neurohormonal yang menyebabkan disfungsi endotel (Verma, 2002).
Patogenesis terbentuknya KAK sangat kompleks, terdapat adanya hubungan kompleks antara pembentukan pembuluh darah yang baru dan proses inflamasi. Beberapa studi melaporkan respon inflamasi sistemik berhubungan dengan adanya aterosklerosis sistemik dan perkembangan KAK. Sitokin inflamasi seperti TNF-alfa dan interleukin-6 terbukti mampu memprediksi perkembangan pembuluh kolateral (Rahkit, 2005; Seiler, 2010). Begitu pula Guray dkk. (2014) yang melaporkan bahwa peningkatan konsentrasi molekul adhesi dalam darah merupakan penanda KAK yang buruk. Level hs-CRP yang tinggi juga terbukti berhubungan dengan KAK yang insufisien.
Dalam dua dekade terakhir, hitung total leukosit sebagai penanda inflamasi akut dan kronik menjadi fokus penelitian dan didapatkan hasil bahwa hitung leukosit total tidak hanya menjadi faktor risiko penyakit kardiovaskular tetapi juga faktor prognostiknya (Bhat, 2013; Sawant, 2014; Darmawan, 2016).
Level leukosit dan subtipenya (neutrofil, monosit dan limfosit) berhubungan dengan mortalitas jangka pendek dan jangka panjang, proses aterosklerosis berat dan respon terapi fibrinolitik rendah pada pasien infark miokard akut (Horne, 2005).
Neutrofil merupakan elemen inflamasi pertama yang meningkat pada kerusakan miokardium dan berperan dalam proses trombosis dan inflamasi.
Sementara itu, limfosit berperan dalam respons imun spesifik (Kirtane, 2004).
Pada saat terjadinya iskemia, neutrofil berkumpul di daerah yang mengalami iskemia dan daerah yang mengalami reperfusi akan melepaskan enzim proteolitik atau Reactive Oxygen Species (ROS) dan merusak miosit disekitarnya. Hal ini diperparah dengan mekanisme neutrofil yang memperberat iskemia miokard dan memperluas area infark melalui oklusi mikrovaskular yang ditimbulkan (Oncel,
2015; Huang, 2009; Darmawan, 2016). Telah diperkirakan bahwa penurunan angka limfosit pada proses inflamasi berhubungan dengan kenaikan level steroid (kortisol) akibat stress dan peningkatan kejadian apoptosis (Hotchkiss, 2003). Mor dkk (2006) melaporkan limfopenia berhubungan dengan instabilitas plak aterosklerosis pada fase akut sindroma koroner akut. Penurunan angka limfosit ini merupakan penanda outcome buruk pada proses akut.
Rasio neutrofil-limfosit menunjukkan adanya ketidakseimbangan antara kombinasi penanda inflamasi, yaitu neutrofil sebagai komponen aktif inflamasi dengan limfosit sebagai komponen regulasi dan protektif. Leukosit merupakan prediktor independen kematian/infark miokard, namun rasio neutrofil-limfosit memiliki nilai prediktor yang lebih baik dan diperkirakan lebih efektif dalam memprediksi peningkatan resiko kardiovaskular, luaran klinis dan prognosis (Horne, 2005).
Kalkan dkk. (2014) melaporkan bahwa dijumpai hubungan antara nilai rasio neutrofil-limfosit dengan perkembangan KAK. Nilai rasio neutrofil-limfosit yang tinggi memprediksi perkembangan KAK yang buruk pada keadaan obstruksi total kronis. Kemampuan nilai rasio neutrofil-limfosit untuk memprediksi keadaan KAK mungkin berdampak pada kemampuannya nilai ini untuk digunakan sebagai prediktor luaran klinis. Secara tidak langsung, nilai rasio neutrofil-limfosit mampu mendeteksi pasien-pasien dengan risiko tinggi (Nacar, 2014).
Tindakan revaskularisasi, baik secara intervensi koroner perkutan (IKP) ataupun bedah pintas koroner (BPK), tidak selalu dapat dijalani oleh pasien.
Beberapa kondisi yang mencegah pasien menjalani IKP atau BPK diantaranya keadaan anatomis koroner yang tidak memungkinkan atau keengganan pasien untuk menjalani prosedur. Pada kondisi seperti ini induksi pembentukan pembuluh darah kolateral dapat menjadi alternatif terapi yang dapat dilakukan (Mobius-Winkler, 2016; Meier, 2009).
Penelitian di Turki oleh Akin dkk. (2015) dan Uysal dkk. (2015) masing- masing menemukan rasio nilai neutrofil-limfosit > 2.55 dan > 2.75 untuk menggambarkan keadaan kolateral arteri koroner yang buruk pada pasien PJK
dengan penyakit pembuluh koroner multipel. Sementara Nacar dkk. (2014) menemukan nilai rasio neutrofil-limfosit > 3.55 adalah prediktor KAK yang buruk pada oklusi total kronis koroner. Di Indonesia, penelitian oleh Malik (2016) menemukan nilai rasio neutrofil-limfosit > 3.05 berhubungan dengan kolateral yang buruk pada pasien dengan oklusi total kronis koroner.
Nilai rasio neutrofil-limfosit adalah indikator inflamasi yang mampu membantu klinisi untuk menilai keadaan KAK pada PJK stabil yang belum bersedia menjalani tindakan revaskularisasi. Dengan mengetahui nilai potong rasio neutrofil-limfosit, dapat ditentukan keadaan inflamasi yang secara tidak langsung mempengaruhi perkembangan kolateral arteri koronernya. Angka neutrofil dan limfosit diperoleh dari pemeriksaan darah lengkap, tersedia luas dan memiliki biaya pemeriksaan yang paling murah dibandingkan penanda inflamasi lainnya. Selain itu, titik potong nilai rasio neutrofil-limfosit pada PJK stabil yang digunakan di luar negeri belum tentu dapat digunakan di Indonesia. Oleh sebab itu, perlu dilakukan penelitian mengenai hubungan nilai rasio neutrofil-limfosit dengan keadaan KAK pada penderita PJK stabil di RSUP H. Adam Malik Medan.
1.2. Pertanyaan Penelitian
Bagaimana peran nilai rasio neutrofil-limfosit dalam menilai keadaan kolateral arteri koroner pada penderita penyakit jantung koroner stabil dengan multivessel disease.
1.3. Hipotesis Penelitian
Hipotesis penelitian ini adalah semakin tinggi nilai rasio neutrofil-limfosit maka semakin buruk keadaan kolateral arteri koroner pada penderita penyakit jantung koroner stabil dengan multivessel disease.
1.4. Tujuan Penelitian 1.4.1. Tujuan Umum
Untuk mengetahui peran nilai rasio neutrofil-limfosit dalam menilai keadaan kolateral arteri koroner pada penderita penyakit jantung koroner stabil dengan multivessel disease.
1.4.2. Tujuan Khusus
Untuk mendapatkan titik potong nilai rasio neutrofil-limfosit yang sesuai dengan keadaan kolateral arteri koroner pada penyakit jantung koroner stabil dengan multivessel disease.
1.5. Manfaat Penelitian 1.5.1 Kepentingan Akademik
Hasil penelitian ini diharapkan dapat memberikan manfaat ilmiah mengenai peran nilai rasio neutrofil-limfosit dalam menilai keadaan kolateral arteri koroner pada penderita penyakit jantung koroner stabil dengan multivessel disease.
1.5.2 Kepentingan Masyarakat
Hasil penelitian ini diharapkan dapat memberikan manfaat terhadap penderita penyakit jantung koroner, sehingga dapat menjadi pertimbangan dalam pemilihan tatalaksana dan dapat memperbaiki luaran.
BAB II
TINJAUAN PUSTAKA
2.1. Penyakit Jantung Koroner Stabil
Penyakit jantung koroner (PJK) stabil merupakan suatu keadaan yang disebabkan oleh adanya plak ateromatosa di arteri koroner yang menyebabkan obstruksi dan secara perlahan akan mempersempit satu atau lebih arteri koroner epikardial (Marzili, 2012; Pepine, 2012). Kondisi ini akan menyebabkan ketidakseimbangan antara suplai dan kebutuhan oksigen miokard yang dapat menyebabkan iskemia/hipoksia miokard serta akumulasi sisa metabolit. Gejalanya terinduksi oleh aktivitas, tetapi dapat juga terjadi secara spontan dan ditandai dengan gejala tidak nyaman di dada secara transien (angina pektoris) (Wilder, 2016; Montalescot, 2013).
PJK stabil memiliki gejala klinis yang beragam. Nyeri dada adalah gejala yang paling banyak ditemukan, baik pada angina pektoris stabil, angina pektoris tidak stabil, Prinzmetal angina, angina mikrovaskular dan infark miokard akut.
Meskipun demikian, PJK stabil bisa memiliki keluhan selain angina, manifestasi klinis yang lain adalah iskemia miokard tersamar, gagal jantung, aritmia dan henti jantung mendadak. Pada pasien PJK stabil dengan diabetes mellitus, biasanya keluhan bersifat atipikal atau ekuivalen angina, seperti nyeri midepigastrium, intoleransi aktivitas, sesak nafas dan mudah lelah (Morrow, 2015).
Nyeri akibat iskemia miokard (angina pektoris) memiliki 4 kriteria klinis, yaitu:
a. Lokasi
Nyeri terasa bagian tengah dada di dekat sternum, dapat pula terasa dari epigastrium hingga ke rahang bawah, di antara tulang belikat atau antara lengan dan pergelangan tangan.
b. Karakteristik
Nyeri dada terasa seperti tekanan, ikatan, perasaan ditimpa, dicekik atau terbakar.
c. Durasi
Durasi nyeri dada tidak lebih dari 10 menit.
d. Hubungan dengan aktivitas
Nyeri dada dicetuskan oleh aktivitas atau tekanan emosional dan hilang/membaik dengan istirahat dan/atau pemberian nitrat dalam beberapa menit (Montalescot, 2013).
Klasifikasi The Canadian Cardiovascular Society secara luas telah digunakan sebagai sistem untuk menentukan derajat angina pektoris. Sistem ini membagi derajat angina menjadi 4 kelas dan pembagian dilakukan berdasarkan kapan simptom nyeri dada mulai muncul akibat aktivitas fisik tertentu (Campeau, 2002).
Tabel 2.1. Klasifikasi Keparahan Angina berdasarkan Canadian Cardiovascular Society (Montalescot, 2013)
Kelas I Aktivitas sehari-hari tidak menyebabkan angina, seperti berjalan dan naik tangga. Angina pektoris muncul saat melakukan aktivitas berat atau cepat atau dalam waktu lama.
Kelas II Ditemukan ada keterbatasan ringan saat melakukan aktivitas sehari-hari.
Angina muncul saat berjalan, menaiki tangga dengan cepat, berjalan atau menaiki tangga setelah makan, saat udara dingin, atau ada tekanan stress atau beberapa jam setelah bangun tidur.
Kelas III Keterbatasan fisik bermakna saat beraktivitas. Angina muncul saat berjalan pada permukaan datar lebih dari 2 blok atau menaiki lebih dari 1 tangga dengan kecepatan normal pada keadaan normal.
Kelas IV Tidak dapat melakukan aktivitas sehari-hari tanpa disertai angina muncul saat istirahat.
2.1.1. Patofisiologi Penyakit Jantung Koroner Stabil 2.1.1.1. Formasi Plak Aterosklerosis
Aterogenesis merupakan hasil dari interaksi kompleks dari dinding pembuluh darah, darah dan molekul-molekul di dalam darah. Salah satu hal yang penting adalah keterlibatan inflamasi yang memegang peran penting dalam semua tahap aterogenesis. Inflamasi terjadi pada level lokal, miokard dan komplikasi sistemik dari aterosklerosis.
Ketika dinding endotelium terpapar dengan bakteri, hormon vasokonstriksi, produk glikosidasi dan sitokin proinflamasi, hal ini meningkatkan ekspresi dari molekul adhesi yang menyebabkan leukosit menempel pada permukaan dinding arteri. Migrasi dari leukosit bergantung pada ekspresi dari sitokin penarik yang sinyalnya berhubungan dengan faktor risiko aterosklerosis.
Setelah berada di tunika intima arteri, leukosit (terutama monosit dan limfosit) berinteraksi dengan sel endotel dan sel otot polos dari dinding arteri. Disini terjadi interaksi antara sel yang bersifat pro aterogenesis (melalui proses inflamasi dan imunitas) dan mediatornya, serta dilepaskan juga autakoid (contohnya histamin) yang meningkatkan tonus vaskular (Libby, 2005).
Akibat utama dari proses inflamasi ini adalah pembentukan ateroma dini, dimana otot polos bermigrasi dari tunika media ke tunika intima. Sel-sel berproliferasi, berikatan dengan matriks ekstraselular dan melepaskan matriks metalloproteinase (MMP). MMP adalah bentuk respon dari berbagai stress oksidatif, gangguan hemodimanik, inflamasi dan autoimun. MMP memodulasi aktivasi, proliferasi, migrasi dan kematian sel, pembentukan pembuluh darah baru, remodeling, proses destruksi dan penyembuhan dari matriks ekstraseluler arteri dan miokard (Libby, 2000).
Selanjutnya MMP berikatan dengan lipoprotein dan menetap di tunika intima. Ikatan ini menyebabkan lipoprotein lebih mudah mengalami oksidasi dan glikasi (William KJ, 1998). Hasil akhir proses oksidasi dan glikasi lipoprotein merupakan produk yang mencetuskan proses inflamasi (Tabas, 1999; Berliner, 2001). Proses pembentukan lesi terus berlanjut dan dilanjutkan dengan proses kalsifikasi sehingga lesi menjadi keras (Demer, 2002). Disamping proses
proliferasi sel, terjadi juga kematian sel (apoptosis) pada inti lesi aterosklerosis (Geng, 2002). Kematian sel makrofrag yang berisi lipid akan mengaktivasi deposisi faktor jaringan ekstraseluler (Bogdanov, 2003). Lipid ekstraseluler bersatu dengan tunika intima dan membentuk plak aterosklerosis dengan inti kaya lipid yang nekrotik.
2.1.1.2. Remodelling arteri
Proses pembentukan plak aterosklerosis terus berlangsung. Namun bertambahnya ukuran plak belum menyebabkan penyempitan lumen yang bermakna. Dinding arteri mengalami remodelling, lumen belum menyempit sampai volume plak > 40% dari lumen arteri (Ambrose, 1988). Fenomena ini disebut remodelling positif atau fenomena Glagovian (Glagov, 1987).
2.1.1.3. Stenosis arteri koroner
Penyempitan arteri koroner mempengaruhi hemodinamik bergantung pada derajat stenosis segmen epikardial dan seberapa besar kemampuan vasodilatasi segmen distal (Gambar 2.1). Jika stenosis masih dibawah 60% dari lumen pembuluh darah, aliran darah maksimal yang dapat melewati arteri koroner tidak mengalami gangguan yang berarti, selain itu sebagai respon aktivitas fisik, pembuluh darah dapat berdilatasi untuk mencukupi aliran darah yang adekuat. Di saat stenosis, mencapai 70% dari lumen, aliran darah saat istirahat masih normal, akan tetapi aliran darah maksimal akan berkurang walaupun sudah dengan dilatasi maksimal pembuluh darah. Pada kondisi ini, saat kebutuhan oksigen meningkat, aliran cadangan koroner tidak adekuat, kebutuhan oksigen melebihi suplai yang ada, dan menyebabkan iskemia miokard. Apabila stenosis mencapai 90% lumen, bahkan dengan dilatasi yang maksimal pun aliran darah tidak adekuat untuk mencukupi kebutuhan basal sehingga iskemia miokard dapat terjadi saat istirahat (Wilder, 2016; Hasan, 2016).
Gambar 2.1. Kurva aliran darah koroner maksimal dan saat istirahat dipengaruhi oleh stenosis di proksimal arteri (persentase lesi terhadap lumen) (Wilder, 2016).
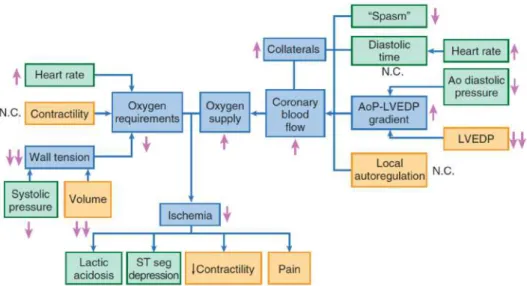
Karakteristik gejala pada PJK stabil yaitu angina pektoris yang dapat disebabkan meningkatnya kebutuhan oksigen miokard ataupun menurunnya suplai oksigen ke miokard. Hal ini bisa terjadi karena beberapa hal, seperti peningkatan denyut jantung, tekanan dinding ventrikel kiri, dan kontraktilitas, yang kemudian akan dipengaruhi oleh aliran darah koroner dan kadar oksigen arteri koroner (Gambar 2.2) (Morrow, 2015).
Gambar 2.2. Faktor-faktor yang mempengaruhi keseimbangan antara kebutuhan (kiri) dan suplai (kanan) oksigen. Tanda panah menunjukkan efek nitrat. AoP =
tekanan aorta, LVEDP = tekanan akhir diastolik ventrikel kiri; N.C. = tidak ada perubahan (Morrow, 2015).
Pada kondisi meningkatnya kebutuhan oksigen miokard (demand angina), terjadi peningkatan denyut jantung, peningkatan tekanan akhir diastolik ventrikel kiri dan peningkatan kontraktilitas. Hal ini biasanya disebabkan oleh respon fisiologis terhadap aktivitas fisik, respon emosional dan status mental yang meningkatkan respon hemodinamik dan katekolamin, meningkatkan tonus adrenergik, dan menurunkan aktivitas vagal. Selain itu, latihan fisik serta kebutuhan metabolik yang meningkat, seperti demam, tirotoksikosis, takikardia, hipertensi tidak terkontrol, serta hipoglikemia, juga dapat meningkatkan kebutuhan oksigen (Morrow, 2015; Hasan, 2016).
Angina juga dapat terjadi karena menurunnya suplai oksigen (supply angina) secara transien, akibat dari vasokonstriksi koroner yang menyebabkan stenosis dinamik. Dengan adanya stenosis yang disebabkan aterosklerosis, trombus oleh platelet dan leukosit dapat mengaktifkan substansi-substansi vasokonstriktor seperti serotonin dan tromboksan A2. Kerusakan endotel akibat aterosklerosis arteri koroner menyebabkan penurunan produksi substansi vasodilator, menyebabkan respons vasokonstriksi yang abnormal terhadap aktivitas dan stimulus lain (Hasan, 2016; Morrow, 2015).
2.1.2 Diagnosis Penyakit Jantung Koroner Stabil
Penilaian faktor risiko penting untuk memperkirakan seberapa besar seseorang berisiko menderita PJK stabil. Beberapa faktor risiko yaitu, merokok, hipertensi, diabetes mellitus, hiperlipidemia, dan riwayat keluarga.
Manifestasi klinis PJK stabil paling awal adalah angina yang dijumpai pada 50% pasien, biasanya disebabkan oleh obstruksi arteri koroner utama oleh plak aterosklerosis. Angina pektoris dikarakteristikan dengan rasa tidak nyaman di substernal, terasa berat, atau seperti ditimpa, yang dapat menjalar ke rahang, bahu, punggung, atau lengan, dan berlangsung selama beberapa menit. Gejala ini biasanya dicetuskan oleh aktivitas dan hilang dengan istirahat setelah beberapa
menit atau dengan penggunaan nitrogliserin. Pasien dengan PJK stabil dapat asimptomatik atau datang dengan gejala sindroma koroner akut, gagal jantung, aritmia atau mati mendadak (Cassar, 2009).
Dari pemeriksaan fisik biasanya tidak dijumpai kelainan yang berarti pada pasien dengan kondisi stabil. Akan tetapi, pemeriksaan adanya penyakit-penyakit penyerta lain seperti hipertensi, penyakit paru obstruktif kronis (akibat merokok), xanthelasma (hiperlipidemia), adannya bukti penyakit aterosklerosis selain koroner (pulsasi perifer yang lemah, karotis, atau aneurisma aorta abdominal) sangat penting. (Cassar, 2009; Hasan, 2016).
2.1.2.1. Pemeriksaan non Invasif
Pada pasien dengan sangkaan PJK stabil, pemeriksaan non invasif utama perlu dilakukan adalah pemeriksaan laboratorium, EKG istirahat, ekokardiografi dan foto toraks. Pemeriksaan laboratorium meliputi total kolesterol, kolesterol low-density lipoprotein (LDL), kolesterol high-density lipoprotein (HDL), trigliserida, kreatinin serum (laju filtrasi glomerulus) dan kadar gula darah puasa (Morrow, 2015). Kemajuan dalam bidang patobiologi aterotrombosis mengajukan pentingnya pemeriksaan penanda inflamasi untuk mendeteksi aterosklerosis dan risiko kardiovaskular. Pemeriksaan high-sensitivity C-reactive protein (hsCRP) fase akut secara konsisten menunjukkan adanya risiko kejadian kardiovaskular yang dibuktikan dengan temuan plak aterosklerosis dari hasil pencitraan (Ridker, 2011).
Pemeriksaan EKG normal pada setengah dari pasien PJK stabil. EKG normal menunjukkan fungsi ventrikel kiri yang baik. Gambaran EKG abnormal yang bisa ditemukan adalah perubahan gelombang ST-T non spesifik dengan atau tanpa gelombang Q patologis. Pada pasien yang terbukti memiliki lesi koroner, abnormalitas segnem ST-T berhubungan dengan keparahan penyakit.
Pemeriksaan noninvasif lainnya yang dapat dilakukan adalah uji latih jantung, myocardial perfusion imaging, stress echocardiography, CT-scan jantung, dan cardiac magnetic resonance imaging. Pemeriksaan non-invasif sebelumnya memang dapat digunakan dalam menegakkan diagnosa PJK stabil,
namun sebagian iskemia miokard dapat terjadi tanpa adanya lesi di arteri koroner epikardial. Sehingga, prosedur invasif, yaitu dengan angiografi koroner merupakan pemeriksaan yang paling objektif dan merupakan baku emas dalam menentukan suatu penyakit arteri koroner (Wilder, 2016; Hasan H, 2016).
2.1.2.2. Pemeriksaan Invasif
Angiografi koroner adalah baku emas untuk mendiagnosis PJK stabil dan mampu menilai keparahan anatomi koroner (Marzili, 2012; Pepine, 2012).
Angiografi koroner memiliki 2 tujuan utama, yaitu menilai risiko kejadian kardiovaskular dan kematian pasien serta membantu menentukan pilihan terapi revaskularisasi. Angiografi koroner dapat menjelaskan mengenai anatomi arteri koroner, termasuk lokasi, panjang pembuluh darah, diameter, dan bentuk epikardial dari pembuluh darah (Hasan, 2016; Krishnaswamy, 2013). Selain itu, angiografi koroner juga dapat menentukan lokasi lesi koroner, derajat obstruksi, aliran kolateral, dan aliran darah di lumen arteri tersebut. Pada oklusi kronis, lesi umumnya multipel dan difus (Claessen, 2012).
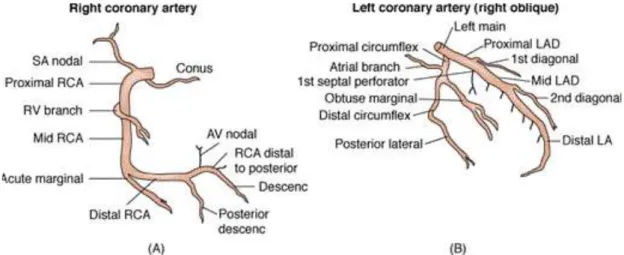
2.2. Anatomi Sirkulasi Koroner
Pada manusia dan mamalia, pembuluh darah epikardial utama adalah left main (LM) dan right main coronary artery (RCA). Arteri koroner kiri dan kanan berasal dari ostium koroner yang berada di basis aorta, di sebelah kanan dan kiri sinus Valsava. Ostium koroner kiri berjumlah tunggal. Dari ostium koroner, keluar LM yang pendek yang bercabang menjadi left anterior descending artery (LAD) dan left circumflex (LCx) (Green, 1967; Virmani, 1984).
LAD berjalan di sepanjang interventricular groove. LAD berjalan mengelilingi arteri pulmonalis, sepanjang septum interventrikel hingga hampir mencapai apeks. Pada beberapa kasus, LAD gagal mencapai apeks dan memiliki sedikit cabang di dinding anterolateral ventrikel kiri (Angelini, 1989). Namun sebagian LAD berjalan hingga mengelilingi apeks (wraparound LAD) dan menyuplai darah ke sebagian septum posterior bahkan menggantikan posterior
descending artery (PDA). LAD memiliki beberapa cabang, yaitu diagonal arteries dan septal perforating branches (Musselman, 1992). Pada umumnya manusia memiliki 1-3 diagonal arteries, dengan ukuran cabang paling besar berasal dari LAD proksimal dan cabang semakin kecil jika berasal dari dekat apeks. Diagonal arteries terletak paralel terhadap satu sama lain (Ilia, 1991).
Septal perforating branches berasal dari sudut kanan LAD dan masuk ke dalam septum interventrikular. Septal perforator arteries dapat menjadi bifurkasio atau trifurkasio dengan pola susunan yang tidak beraturan (Rath, 1986).
LCx berjalan di posterior sepanjang apendiks atrium kiri, atrioventricular groove, hingga annulus mitral. LCx bercabang menjadi 1-4 obtuse marginal branch, dengan pola paling sering adalah 2-3 cabang (Nerantzis, 1980). Distribusi LCx dan cabangnya berlawanan dengan RCA. Jika LCx memiliki distribusi yang luas, RCA akan memiliki cabang yang lebih sedikit dan begitu pula sebaliknya.
Ramus LCx memperdarahi bagian lateral ventrikel kiri. Obtuse marginal branch memperdarahi bagian posterolateral ventrikel kiri.
RCA berjalan di sepanjang atrioventricular groove kanan dan mengelilingi annulus katup trikuspid. Cabang pertama adalah cabang infundibular, yang bertugas memperdarahi otot di sepanjang right ventricular outflow tract atau infundibulum. Cabang selanjutnya adalah sinus node artery.
Sinus node artery berasal dari proksimal RCA. Pada 50-70% pasien, sinus node artery mendapat perdarahan dari RCA dan sekitar 3% pasien, sumber perdarahan didapat dari LCx (Kyriakidis, 1983). Dari bagian mid RCA, keluar right ventricular marginal branch yang memperdarahi bagian lateral dinding ventrikel kanan. Beberapa cabang halus dari RCA memperdarahi atrium. Bagian distal RCA memiliki anatomi beragam. Pada pasien dengan pola koroner dominan kanan, sebanyak 50-60% PDA muncul dari lengkungan RCA, 13% berasal dari acute marginal branch dan 19% berasal dari antara acute marginal branch dan lengkungan RCA (Adams, 1985).
Muskulus papilaris anterolateral mendapat sumber perdarahan dari diagonal branch dari LAD dan marginal branch dari LCx. Hal ini bertujuan untuk melindungi muskulus papilaris dari disfungsi akibat iskemia. Sebaliknya,
muskulus papilaris posteromedial hanya mendapat perdarahan dari PDA sehingga lebih rentan terhadap kerusakan akibat infark miokard (Voci, 1995).
Gambar 2.3. Anatomi arteri koroner. (A) Arteri koroner kanan, (B) Arteri koroner kiri (Kern, 2011).
2.3. Kolateral Arteri Koroner
Kolateral arteri koroner (KAK) adalah cabang-cabang anastomosis kecil yang berhubungan secara langsung ke arteri koroner besar dan sebagai prekursor sirkulasi kolateral untuk mempertahankan perfusi miokard pada kondisi stenosis berat akibat aterosklerotik di proksimal arteri koroner (Popma, 2015). Jaringan yang terbentuk dari anastomosis cabang kecil arteri koroner merupakan prekursor dari sirkulasi kolateral. Perkembangan sirkulasi kolateral diawali dengan pembentukan pembuluh kolateral yang menghubungkan beberapa komponen dari sirkulasi arteri koroner. Pada jantung dewasa normal, kolateral dibentuk dari pembuluh darah kecil berdinding tipis, berdiameter < 50 µm dan hanya berperan kecil dalam sirkulasi darah koroner. Pembuluh kolateral tidak tampak pada keadaan normal atau stenosis arteri koroner ringan karena kaliber yang kecil.
Sebagai respon dari stenosis arteri koroner dan iskemia miokard, perbedaan tekanan transstenosis memungkinkan aliran darah melewati sirkulasi anatomis tersebut. Akibatnya, diameter pembuluh kolateral semakin besar (200-600 µm) dan otot polosnya semakin tebal sehingga mampu mempertahankan aliran darah
(Gregg, 1980; Erwin, 2018). Sirkulasi kolateral berperan sebagai sumber alternatif suplai darah terhadap miokard yang mengalami iskemia atau berisiko mengalami iskemia. Kolateral tidak hanya bisa mempertahankan perfusi normal saat istirahat tetapi juga dapat mencegah iskemia terinduksi stress dalam latihan jantung submaksimal (Canty JM, 2015).
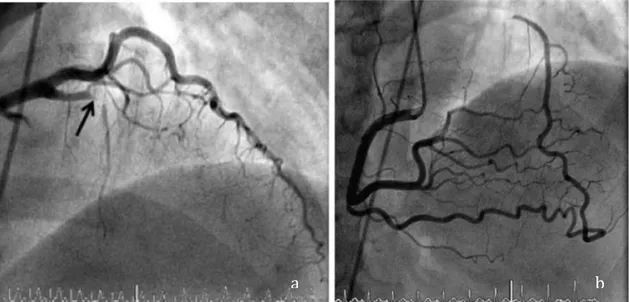
Gambar 2.4. Angiografi koroner pada PJK dengan oklusi multipel. a) oklusi total kronis pada proksimal arteri LAD, b) injeksi kontras ke RCA, kontras tanpak mengisi secara retrograde ke LAD melalui cabang kolateral (Seiler, 2013).
a b
a
Gambar 2.5. Suplai kolateral ke tiga arteri koroner utama. a) kolateral yang berkembang pada oklusi left anterior descending (LAD), b) kolateral yang berkembang pada oklusi right coronary artery (RCA) dan c) kolateral yang berkembang pada oklusi left circumflex artery (LCx) (Levin, 1974; Erwin 2018).
2.3.1 Mekanisme pembentukan kolateral (angiogenesis & arteriogenesis) Terbentuknya pembuluh darah kolateral meliputi proses angiogenesis dan arteriogenesis. Pembuluh darah baru dapat terbentuk dari pleksus yang sudah ada sebelumnya melalui proses penonjolan atau intususepsi. Pembentukan pembuluh darah baru ini disebut angiogenesis. Sel-sel endotelial dan sel otot polos sangat penting untuk kematangan pembuluh yang baru terbentuk. Selama proses angiogenesis, kapiler-kapiler baru terbentuk disekitar daerah yang mengalami iskemia, sebagaimana terjadi juga pada infark miokard dan stroke. Proses remodelling yang mencakup ambilan kolateral-kolateral yang sudah ada menjadi suatu pembuluh darah yang lebih matang, disebut arteriogenesis (Seiler, 2013).
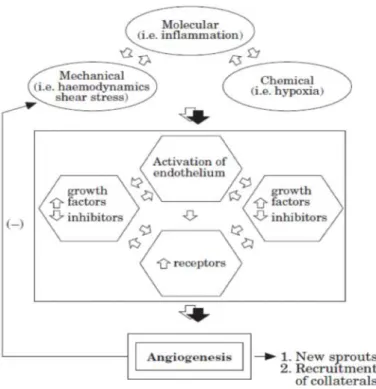
Dengan terjadinya iskemia, growth factors seperti faktor 1α yang diinduksi oleh hipoksia dan mediator-mediator inflamasi akan dilepaskan dan menyebabkan vasodilatasi, meningkatkan permeabilitas vaskular, dan akumulasi monosit dan makrofag yang akan mensekresikan lebih banyak growth factors dan mediator-mediator inflamasi (Arras, 1998). Sel-sel inflamasi ini akan
mengeluarkan metalloproteinase yang akan meleburkan matriks dan lapisan basal sekitar pembuluh darah. Hipoksia akan mensensitisasi sel-sel endotelial untuk efek kemotaktik dan proliferasi dari berbagai growth factor dengan cara memperbanyak reseptor. Sel-sel endotel akan berlekatan, bermigrasi, berproliferasi, dan membentuk lumen pembuluh darah yang baru. Sel-sel sekitar dan sel otot polos juga terlibat dalam proses ini.
Tabel 2.2. Definisi angiogenesis, arteriogenesis dan pembuluh kolateral (Berry, 2007)
Istilah Definisi
Angiogenesis Pembentukan kapiler baru melalui yang keluar dari venula post kapiler
Arteriogenesis Transformasi dari arteriol yang sudah ada menjadi arteriol kolateral fungsional yang memiliki komponen vasomotorik
Pembuluh darah kolateral
Pembuluh darah kolateral adalah pembuluh yang menghubungkan arteri-arteri yang paralel tanpa adanya capillary bed
Pencetus proses arteriogenesis yang paling utama adalah tekanan tangensial pada dinding pembuluh darah (shear stress) dan sel-sel mononuklear sum-sum tulang. Stenosis, obstruksi ataupun oklusi arteri besar, menyebabkan penurunan tekanan post-stenosis, terjadi gradien tekanan yang besar dan membentuk jalur anastomosis kolateral dari vaskular yang tidak mengalami kelainan. Gradien tekanan ini yang meningkatkan aliran darah melalui arteriol- arteriol kolateral, sehingga semakin meningkatkan tekanan dinding pembuluh darah, dan kemudian mengaktifkan endotelium arteriol kolateral, perlekatan molekul, dan growth factor. Dalam beberapa hari, monosit yang ada di sirkulasi melekat ke endotel kolateral menghasilkan reaksi inflamasi. Disolusi matriks terjadi dan pembuluh darah mulai berkembang dengan proliferasi aktif dari sel-sel endotel dan otot polos (Seiler, 2013; Meier, 2013).
Selain karena stimulasi monosit dan makrofag, arteriogenesis berhubungan dengan tekanan dinding pembuluh darah yang meningkatkan aliran
darah, sehingga induksi arteriogenesis melalui latihan fisik yang rutin juga dapat menjadi pilihan terapi.
Gambar 2.6. Skema hipotesa beberapa faktor yang berperan dalam proses angiogenesis.
Pencetus utama angiogenesis dapat dibagi menjadi tiga kategori, yaitu mekanik, kimiawi, dan faktor molekular. Terbentuknya pembuluh darah baru melibatkan beberapa tahap, migrasi, adesi, dan proliferasi dari sel-sel endotel. Hingga pada akhirnya mengalami pembentukan dan maturasi dari struktur tubular yang baru yang dapat memberikan aliran darah (Tabibiazar, 2001).
2.3.2 Determinan Sirkulasi Kolateral Arteri Koroner
Iskemia miokard berat dan rekuren, gradient tekanan, shear stress, dan faktor pertumbuhan adalah beberapa faktor yang menstimulasi sirkulasi arteri koroner. Takeshita dkk. (1982) melaporkan bahwa KAK berkembang sebagai respon dari intermiten iskemia. Kolateral ini membantu menyediakan sirkulasi pada saat kebutuhan berat, seperti pada oklusi akibat sindroma koroner akut.
Herlitz dkk. (1993) menyatakan bahwa angina pektoris kronik sebelum infark miokard menginduksi lebih banyak kolateral sehingga luas infark menjadi lebih kecil. Paparan terhadap kadar oksigen yang rendah menyebabkan akumulasi vascular endothelial growth factor (VEGF), mRNA dan TGF- ß.
Tidak seperti angiogenesis yang dirangsang oleh proses hipoksia jaringan, arteriogenesis tidak diinduksi oleh hipoksia, namun dirangsang oleh shear stress.
Growth factor yang terlibat dalam arteriogenesis antara lain TGF-α, granulocyte- macrophage colony-stimulating factor (GM-CSF), dan b-FGF (van Royen, 2001).
Perbedaan tekanan pada arteri utama menyebabkan aliran melalui kolateral digunakan. Tekanan di distal stenosis menurun, aliran darah beredistribusi melalui arteriol yang menghubungkan area tekanan tinggi dengan area tekanan rendah (Sasayama, 1992; van Royen, 2001). Peningkatan aliran darah meningkatkan shear stress pada arteri kolateral, upregulasi molekul adhesi endotel dan meningkatkan adherensi monosit yang berubah menjadi makrofag. Akibatnya, terjadi perubahan morfologi dan remodelling vaskular. (Conway, 2001; van Royen, 2001).
Terdapat perbedaan kemokin dan growth factor yang terlibat pada angiogenesis dan arteriogenesis. Beberapa growth factor yang sama antara lain b- FGF dan PDGF (platelet-derived growth factor) (Conway, 2001; van Royen, 2001). Pada keaadaan iskemia, ekspresi faktor angiogenesis bertambah. Namun pada keadaan diabetes mellitus, hiperlipidemia dan usia tua, sirkulasi kolateral buruk disebabkan oleh faktor angiogenesis yang terganggu (Waltenberger, 2001).
2.3.3. Klasifikasi Kolateral Arteri Koroner
Kolateral fungsional dapat tumbuh di antara dua terminal arteri koroner, antara dua cabang arteri koroner, antara cabang-cabang arteri yang sama atau via vasa vasorum pembuluh darah yang sama (Levin, 1974). Levin menjelaskan aliran kolateral ke tiga pembuluh darah utama. Kugel arteri adalah kolateral yang berasal dari RCA proksimal atau arteri sinus nodal atau LCx melewati septum intraatrial, beranastomosis ke arteri nodal AV dan mensuplai ke RCA atau LCx distal. Cincin Vieussens adalah kolateral yang menghubungkan arteri konus RCA dengan proksimal cabang ventrikel kanan dari LAD (Kugel, 1927).
Ada beberapa klasifikasi dalam menilai kolateral, yaitu klasifikasi Rentrop dan Werner, keduanya dinilai dari angiografi koroner. Klasifikasi Werner membagi kolateral menjadi 3 kelompok, yaitu CC 0 (tidak ada hubungan antara
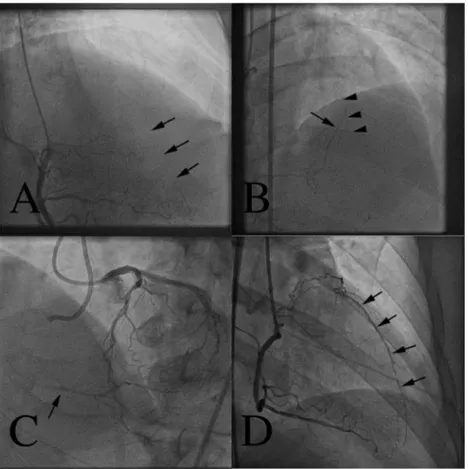
arteri resipien dan arteri donor), CC 1 (dijumpai hubungan antara kedua arteri berupa koneksi halus seperti benang) dan CC2 (dijumpai hubungan antara kedua arteri berupa koneksi besar seperti cabang pembuluh darah). Penilaian aliran kolateral berdasarkan angiografi yang paling banyak digunakan yaitu berdasarkan klasifikasi Rentrop, yang membagi kolateral menjadi 4 kelompok berdasarkan derajat aliran pembuluh darah yang menerima (Popma, 2015; Traupe, 2010).
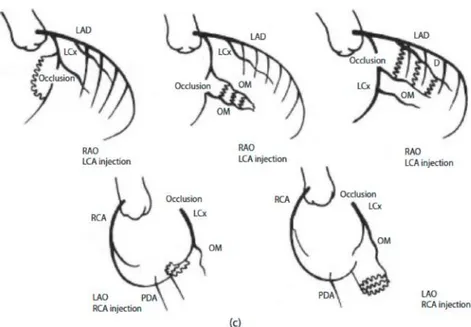
Rentrop 0 (tidak ada aliran), Rentrop 1 (tampak cabang-cabang kecil terisi), Rentrop 2 (tampak aliran parsial di arteri epikardial dari arteri yang mengalami penyempitan), dan Rentrop 3 (tampak aliran penuh mengisi arteri epikardial yang mengalami penyempitan) (Rentrop, 1985).
Gambar 2.7. Klasifikasi Rentrop. (A) Rentrop 0 (total oklusi kronik di LAD tanpa adanya kolateral dari RCA, tanda panah menunjukkan LAD tidak tampak), (B) Rentrop 1 (kolateral dari RCA ke LAD), (C) Rentrop 2 (tampak kolateral dari LAD ke RCA yang menghasilkan pengisian parsial RCA, (D) Rentrop 3 (kolateral dari RCA memberi pengisian penuh ke LAD (Vo, 2015).
Gambar 2.8. Klasifikasi Werner. (A) CC0, tidak ada koneksi dari LAD ke RCA, (B) CC1 (gambaran koneksi seperti benang) dari LAD ke RCA, (C) CC2, gambaran kolateral berupa cabang-cabang dari LCX ke RCA (Vo, 2015).
2.4. Peran Inflamasi pada Penyakit Jantung Koroner Stabil
Perkembangan arteri kolateral merupakan respon adaptif terhadap kronis iskemia miokard dan bertujuan untuk mencegah kerusakan jaringan. (Cohen, 1986; Akin, 2015). Keberadaan pembuluh kolateral mampu meningkatkan aliran sehingga menurunkan angka frekuensi angina dan kejadian kardiovaskular serta menjaga fungsi kontraktilitas miokard (William DO, 1976; Akin, 2015).
Perkembangan kolateral bergantung pada derajat keparahan obstruksi koroner, kadar sel-sel penanda inflamasi, growth factor dan angiogenesis.
Patogenesis terbentuknya KAK sangat kompleks, terdapat adanya hubungan kompleks antara pembentukan pembuluh darah yang baru dan proses inflamasi. Beberapa studi melaporkan respon inflamasi sistemik berhubungan dengan adanya aterosklerosis sistemik dan perkembangan KAK. Sitokin inflamasi seperti TNF-alfa dan interleukin-6 terbukti mampu memprediksi perkembangan pembuluh kolateral (Rahkit, 2005; Seiler, 2010). Begitu pula Guray dkk. (2004) yang melaporkan bahwa peningkatan konsentrasi molekul adhesi dalam darah merupakan penanda KAK yang buruk. Level hs-CRP yang tinggi juga terbukti berhubungan dengan KAK yang insufisien. Penanda inflamasi yang paling sederhana adalah leukosit. Level leukosit dan subtipenya (neutrofil, monosit dan limfosit) telah lama terbukti berperan sebagai prediktor PJK stabil (Horne, 2005).
2.4.1. Peran Neutrofil dan Limfosit dalam Penyakit Jantung Koroner Stabil Neutrofil adalah bagian sel darah putih dari kelompok granulosit. Sel ini berdiameter 12–15 µm dan memilliki inti yang khas padat terdiri atas sitoplasma pucat di antara 2 hingga 5 lobus dan mengandung banyak granula merah jambu (azuropilik). Granula terbagi menjadi granula primer yang muncul pada stadium promielosit, dan sekunder yang muncul pada stadium mielosit dan terbanyak pada neutrofil matang. Granula primer mengandung mieloperoksidase, fosfatase asam dan asam hidrolase lain, sementara yang sekunder mengandung fosfatase dan lisosom. Neutrofil adalah komponen utama dari sistem imun nonspesifik. Nilai normal neutrofil ialah 2–7x109/l atau 40-80% per millimeter kubik darah. Bila neutrofil dilepaskan ke dalam sirkulasi darah, waktu paruhnya dalam sirkulasi kira-kira 6 jam. (Hoffbrand, 1984).
Neutrofil berperan sebagai pertahanan awal terhadap patogen, inflamasi dan respons imun innate melalui proses degranulasi, fagositosis, apoptosis, pelepasan reactive oxygen species (ROS) dan pembentukan neutrophil extracellular trap (NET). Mekanisme ini dipicu oleh patogen, aktivasi leukosit, sitokin atau stimulus inflamasi. Neutrofil memproduksi granul sitoplasma yang mengandung myeloperoxidase (MPO), matrix metalloproteinase 8 (MMP8), cathelicidin antimicrobial peptide (CAMP), azurocidin 1 (AZU1), cathepsin G (CTSG), dan elastase 2 (ELA2). Secara langsung enzim-enzim ini melawan pathogen namun bisa pula memperberat respon inflamasi. Di samping fungsinya dalam imunitas innate, aktivasi neutrofil tidak selalu menguntungkan. Banyak studi yang membuktikan keterlibatan neutrofil dalam perkembangan penyakit kardiovaskular seperti aterosklerosis, trombosis dan sindroma koroner akut (Gaul, 2017).
Neutrofil merupakan sel yang besar dan kaku yang melakukan adhesi dengan endotel kapiler sehingga mencegah reperfusi dari kapiler yang mengalami iskemia. Sel tersebut melepaskan beberapa autokoid yang akan menginduksi vasokonstriksi serta agregrasi trombosit seperti tromboksan-B2, leukotriene-B4 metabolit asam arakhidonat, mieloperoksidase, elastase serta beberapa enzim
hidrolitik yang berpengaruh terhadap stabilitas plak aterosklerosis seperti asam fosfatase (Oncel, 2015; Huang, 2009).
Pada studi eksperimen in vitro, tampak migrasi neutrofil dimediasi oleh LDL teroksidasi via peningkatan kontraktilitas endotel dan upregulasi intracellular adhesion molecule-1 (ICAM-1). Penelitian lain menunjukkan bahwa rendahnya kadar neutrofil menurunkan proses aterogenesis dengan cara mengurangi inflamasi dan apoptosis sel dalam plak. Di dalam plak, neutrofil melepaskan ROS. Hal ini akan memicu aktivasi endotelium, penarikan lebih banyak neutrofil, oksidasi LDL dan semuanya berkontribusi pada ketidakstabilan plak aterosklerosis. Pada plak ateroma, neutrofil mengalami apoptosis, kemudian melepaskan berbagai peptida yang mengundang migrasi monosit/makrofag ke dalam lesi untuk proses fagositosis sel yang apoptosis (Zernecke, 2007).
Meningat perannya dalam aterotrombosis dan kejadian kardiovaskular, neutrofil telah menjadi pengganti dari salah satu dari risiko kardiovaskular.
Beberapa penelitian kecil menunjukkan kadar plasma neutrofil elastase berhubungan dengan keparahan PJK (Amaro, 1995; Kosar, 1998; Smith, 2000).
Beberapa studi yang lebih besar membuktikan bahwa angka neutrofil dalam darah dan rasio neutrofil-limfosit berhubungan dengan keparahan dan kompleksitas PJK, kejadian iskemia berulang, mortalitas, infark akut, infark miokard luas dan kekakuan arteri. Penelitian yang lebih baru menunjukkan NET berhubungan dengan keparahan aterosklerosis koroner dan status protrombosis (Borissoff, 2013; Stakos, 2015).
Neutrofil dan monosit telah diketahui memainkan peranan penting dan berefek langsung dalam respon inflamasi, namun limfosit terbukti berperan lebih luas dalam memodulasi respon inflamasi pada setiap proses aterosklerosis.
Leukositosis, neutrofilia dan limfopenia adalah respon klasik stress sistemik dan berhubungan dengan prognosis yang buruk (Le Tulzo, 2002).
Dalam penelitian dikatakan bahwa limfosit T mempunyai peran proktetif terhadap proses aterosklerosis. Peran limfosit T ialah dengan memodulasi proliferasi otot polos yang terjadi selama proses perbaikan vaskular dan didapatkan bahwa pada kadar limfosit yang rendah dijumpai lesi aterosklerosis
yang lebih berat (Ducloux, 2003).
Limfopenia disangkakan terjadi akibat kenaikan kadar serum kortisol dan katekolamin sebagai respons stress sistemik (Thomson, 1980). Penurunan persentase limfosit disebabkan oleh peningkatan apoptosis, penurunan proliferasi dan diferensiasi limfosit dan redistribusi limfosit dalam sistem limfopoetik (Cioca, 2000).
Rasio neutrofil-limfosit (RNL) memiliki nilai diskriminatif lebih baik dibandingkan total sel darah putih pada infark miokard akut (Núñez, 2008).
Angka limfosit yang lebih rendah berhubungan dengan progresi aterosklerosis, fraksi ejeksi rendah, nekrosis miokard lebih luas, derajat obstruksi mikrovaskular dan kejadian kardiovaskular. Limfopenia memberi prognosis lebih buruk pada PJK stabil, infark miokard akut dan gagal jantung (Núñez, 2008; Major, 2002;
Blum, 1994; Ommen, 1997; Núñez, 2010; Levy, 2006).
2.4.2. Peran Rasio Neutrofil-Limfosit (RNL) dalam Memprediksi Keadaan Kolateral Arteri Koroner pada Penyakit Jantung Koroner Stabil Kolateral arteri koroner adalah hasil dari angiogenesis dan/atau arteriogenesis. Perkembangannya adalah proses yang kompleks, melibatkan sel inflamasi beragam dan matriks ekstraseluler. CRP adalah indikator inflamasi yang menghambat produksi nitric oxide (NO), menghilangkan aktivitas NO dan secara tidak langsung mennghambat angiogenesis. Pajanan jangka panjang terhadap inflamasi akan mencegah migrasi sel endotel yang dimediasi growth factor.
Fichtlscherer dkk. (2000) menunjukkan bahwa peningkatan kadar CRP serum adalah penanda gangguan reaktivitas endotel vaskular pada pasien PJK stabil.
Inflamasi kronis menghambat diferensiasi, survival dan fungsi sel progenitor endotel. Selain itu, inflamasi kronis juga menginduksi apoptosis sel dan produksi mediator proinflamasi pada sel mononuklear. Hal ini tidak menguntungkan karena dapat mengganggu proses angiogenesis sebagai respons terhadap iskemia kronik.
Peningkatan aktivitas inflamasi terbukti berhubungan dengan perkembangan KAK yang buruk. Leukosit dan tipenya berperan dalam modulasi respon inflamasi, namun hubungannya dengan perkembangan KAK masih belum
jelas (Heil, 2004). Kocaman dkk. (2011) melaporkan level leukosit yang tinggi pada oklusi non total berhubungan dengan perkembangan kolateral yang baik.
Sebaliknya, van der Hoeven dkk. (2013) melaporkan level leukosit yang tinggi ditemukan pada pasien dengan KAK yang buruk.
Neutrofil merupakan elemen inflamasi pertama yang meningkat pada kerusakan miokardium dan berperan dalam proses trombosis dan inflamasi.
Sementara itu, limfosit berperan dalam respons imun spesifik (Kirtane, 2004).
Penurunan angka limfosit ini merupakan penanda outcome buruk pada proses akut, seperti infark miokard akut. RNL menunjukkan adanya ketidakseimbangan antara neutrofil (komponen aktif inflamasi) dengan limfosit (komponen regulasi dan protektif). Leukosit merupakan prediktor independen kematian/infark miokard, namun RNL memiliki nilai prediktor yang lebih baik dan diperkirakan lebih efektif dalam memprediksi peningkatan resiko kardiovaskular, luaran klinis dan prognosis (Horne, 2005).
Penelitian di Turki oleh Akin dkk. (2015) dan Uysal dkk. (2015) masing- masing menemukan nilai RNL > 2.55 dan > 2.75 untuk menggambarkan keadaan KAK yang buruk pada pasien PJK stabil dengan penyakit pembuluh koroner multipel. Sementara Nacar dkk. (2014) menemukan nilai RNL > 3.55 adalah prediktor KAK yang buruk pada oklusi total kronis koroner. Di Indonesia, penelitian oleh Malik (2016) menemukan nilai RNL > 3.05 berhubungan dengan kolateral yang buruk pada pasien dengan oklusi total kronis koroner.
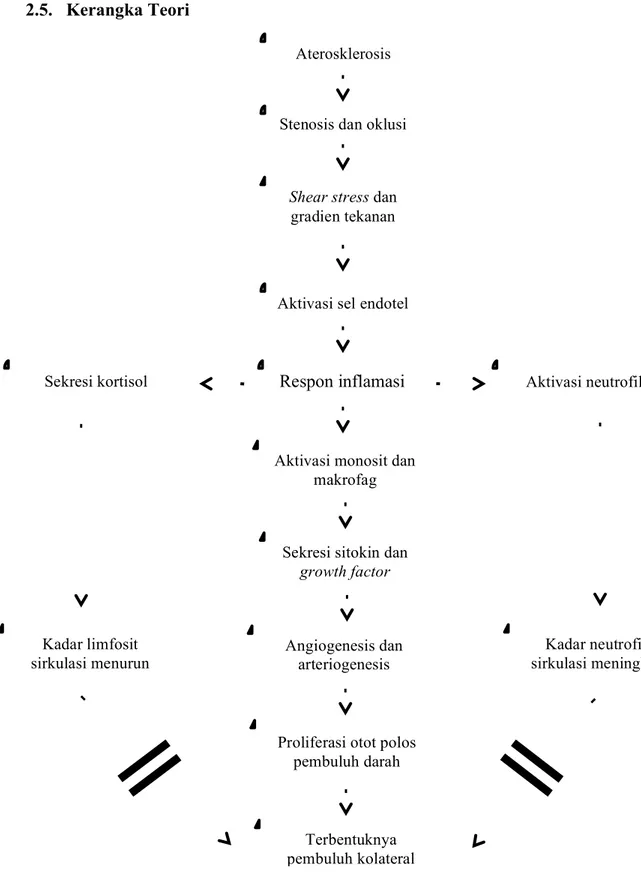
2.5. Kerangka Teori
Gambar 2.9. Skema kerangka teori penelitian.
Aterosklerosis
Stenosis dan oklusi
Respon inflamasi Shear stress dan
gradien tekanan
Aktivasi sel endotel
Sekresi kortisol Aktivasi neutrofil
Kadar limfosit sirkulasi menurun
Kadar neutrofil sirkulasi meningkat Aktivasi monosit dan
makrofag
Angiogenesis dan arteriogenesis
Sekresi sitokin dan growth factor
Terbentuknya pembuluh kolateral Proliferasi otot polos
pembuluh darah
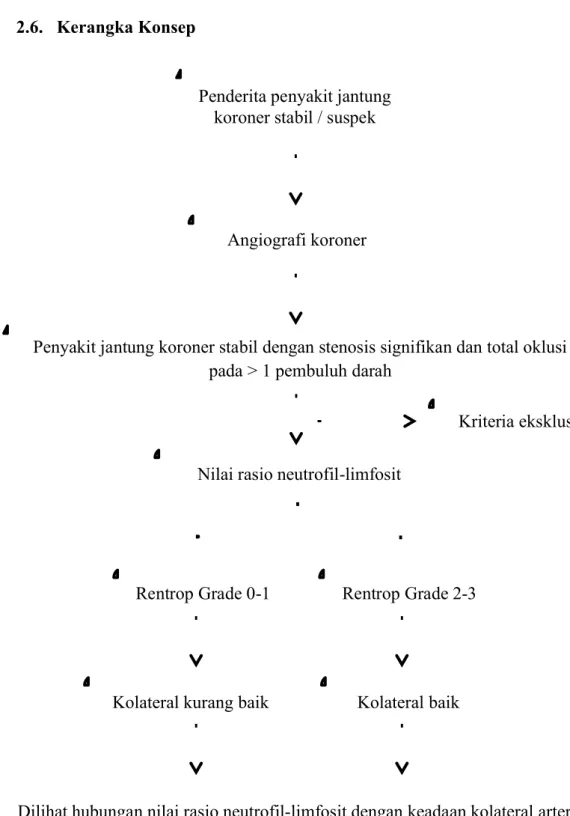
2.6. Kerangka Konsep
Gambar 2.10. Kerangka konsep penelitian Penderita penyakit jantung
koroner stabil / suspek
Angiografi koroner
Kriteria eksklusi
Rentrop Grade 0-1 Rentrop Grade 2-3
Penyakit jantung koroner stabil dengan stenosis signifikan dan total oklusi pada > 1 pembuluh darah
Dilihat hubungan nilai rasio neutrofil-limfosit dengan keadaan kolateral arteri koroner Nilai rasio neutrofil-limfosit
Kolateral kurang baik Kolateral baik