ALKALINITAS
(Laporan Praktikum Manajemen Kualitas Air)
Oleh
Boy Apriliawan 1614201010
Kelompok 3
PROGRAM STUDI SUMBERDAYA AKUATIK JURUSAN PERIKANAN DAN KELAUTAN
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
LEMBAR PENGESAHAN
Judul Praktikum : Alkalinitas
Tempat Praktikum : Laboratorium Perikanan dan Kelautan
Tanggal Praktikum : 08 November 2017
Nama : Boy Apriliawan
NPM : 1614201010
Program Studi : Sumberdaya Akuatik
Jurusan : Perikanan dan Kelautan
Fakultas : Pertanian
Universitas : Lampung
Kelompok : 3 (Tiga)
Bandar Lampung, 08 November 2017 Mengetahui,
Asisten
I. PENDAHULUAN
I.1 Latar Belakang
Sebagian besar dari permukaan bumi kita tertutup oleh air, air yang ada di permukaan bumi kita ini memiliki kegunaan masing-masing. Baik itu untuk konsumsi maupun untuk budidaya. Baik itu untuk konsumsi maupun untuk budidaya, komponen air mesti memenuhi syarat-syarat tertentu yang dinamakan tingkat kualitas air. Kualitas air merupakan aspek yang sangat penting untuk diperhatikan dan dijaga agar dapat dimanfaatkan dengan baik, oleh kita maupun oleh generasi selanjutnya. Khusunya untuk usaha budidaya, kualitas air suatu perairan sangatlah menentukan keberhasilan budidaya itu sendiri. Karena hal ini secara langsung berhubungan dengan organisme yang dibudidaya. Salah satu parameter kualitas air yang sangat berperan dalam usaha budidaya itu sendiri yakni alkalinitas. Alkalinitas merupakan kuantitas anion dalam perairan yang dapat menetralkan kation hidrogen sehingga tingkat keasaman suatu perairan dapat dinetralisir Alkalinitas selain berhubungan dengan pH air tentunya sangat berpengaruh pada tingkat produktivitas perairan.
Alkalinitas merupakan kapasitas air untuk menetralkan tambahan asam tanpa penurunan nilai pH larutan. Sama halnya dengan larutan buffer, alkalinitas merupakan pertahanan air terhadap pengasaman. Alkalinitas adalah hasil reaksi-reaksi terpisah dalam larutan hingga merupakan sebuah analisa “makro” yang menggabungkan beberapa reaksi. Alkalinitas dalam air disebabkan oleh ion-ion karbonat (CO32- ), bikarbonat (HCO3- ), hidroksida (OH-) dan borat (BO33-), fosfat (PO43-), dan sebagainya.
setiap orang yang ingin membudidayakan ikan harus mengetahui masalah alkalinitas. Sebab itulah praktikum alkalinitas ini dilakukan.
1.2 Tujuan Praktikum
Adapun tujuan pada praktikum alkalinitas ini, sebagai berikut: 1. Mengetahui cara menghitung nilai alkalinitas.
II. TINJAUAN PUSTAKA
II.1 Pengertian Alkalinitas
Alkalinitas merupakan parameter kimia di perairan yang menunjukan jumlah ion karbonat dan bikarbonat yang mengikat logam golongan alkali tanah pada perairan tawar. Nilai ini menggambarkan kapasitas air untuk menetralkan asam, atau biasa juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH. Perairan.mengandung alkalinitas ≥20 ppm menunjukkan bahwa perairan tersebut relatif stabil terhadap perubahan asam/basa sehingga kapasitas buffer atau basa lebih stabil. Selain bergantung pada pH, alkalinitas juga dipengaruhi oleh komposisi mineral, suhu, dan kekuatan ion. Nilai alkalinitas alami tidak pernah melebihi 500 mg/liter CaCO3. Perairan dengan nilai alkalinitas yang terlalu tinggi tidak terlalu disukai oleh organisme akuatik karena biasanya diikuti dengan nilai kesadahan yang tinggi atau kadar garam natrium yang tinggi (Effendi, 2003).
Alkalinitas adalah suatu parameter kimia perairan yang menunjukan jumlah ion karbonat dan bikarbonat yang mengikat logam golongan alkali tanah pada perairan tawar. Nilai ini menggambarkan kapasitas air untuk menetralkan asam, atau biasa juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH (Afrianto,1991). Alkalinitas relatif sama jumlahnya dengan kesadahan dalam suatu perairan. Alkalinitas juga berpengaruh terhadap pH dalam suatu perairan. Dalam kondisi basa ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hidrogen yang bersifat asam sehingga keadaan pH menjadi netral (Russady,2010).
Alkalinitas sering disebut sebagai besaran yang menunjukkan kapasitas penyangga dari ion bikarbonat, dan sampai tahap tertentu ion karbonat dan hidroksida dalam air. Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga menurunkan kemasaman dan menaikan pH. Alkalinitas biasanya dinyatakan dalam satuan ppm (mg/l) kalsium karbonat (CaCO3). Air dengan kandungan kalsium karbonat lebih dari 100 ppm disebut sebagai alkalin, sedangkan air dengan kandungan kurang dari 100 ppm disebut sebagai lunak atau tingkat alkalinitas sedang. Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan nilai alkalinitas di atas 20 ppm (Achmad, 2004).
2.2 Fungsi Alkalinitas di perairan
Perairan yang mengandung mineral karbonat, bikarbonat dan silikat akan mempunyai pH diatas netral dan dapat mencegah terjadinya penurunan pH secara drastis. Pada perairan tertutup, penambahan karbonat dari sel-sel kerang atau dolomit dapat memperbaiki alkalinitas dan sistem buffer perairan itu. Penambahan sodium bikarbonat secara periodik juga akan menghasilkan hal yang sama. Alkalinitas diperlukan untuk mencegah terjadinya fluktuasi pH yang besar, selain itu juga merupakan sumber CO2 untuk proses fotosintesis fitoplankton. Nilai alkalinitas akan menurun jika aktifitas fotosintesis naik, sedangkan ketersediaan CO2 yang dibutuhkan untuk fotosintesis tidak memadai (Amri, 2002).
Alkalinitas sebagai sumber karbon bagi fitoplankton, dibutuhkan dalam melakukan proses fotosintesis. Oleh karena itu peningkatan alkalinitas sudah tentu dapat menambah ketersediaan CO2 untuk proses ini. Jika fitoplankton menggunakan CO2 dalam proses fotosintesis, maka pH air menjadi naik, hal ini terjadi disebabkan oleh sifat CO2 yang asam. Dari uraian tersebut diketahui bahwa jika kondisi air pekat dapat dipastikan nilai alkalinitasnya cepat sekali menurun, dikarenakan banyaknya CO2 yang digunakan (Rezqi, 2009).
Sistem buffer (penyangga) perubahan pH pada intinya merupakan proses penggantian CO2 yang digunakan untuk proses fotosintsis. Perubahan pH sebetulnya tidak berpengaruh langsung terhadap udang, akan tetapi berpengaruh langsung terhadap reaksi kimia dalam air. Perubahan (fluktuasi) pH yang tinggi antara pagi dan siang dapat menyebabkan kesetimbangan dalam air terganggu, sehingga pada akhirnya mempengaruhi kualitas air secara keseluruhan. Nilai pH yang ideal untuk kehidupan udang adalah 7.5 – 8.5. Pada siang hari, fitoplankton memanfaatkan CO2 untuk proses fotosintesis. Proses berkurangnya CO2 oleh fitoplankton ini biasanya lebih cepat dibandingkan dengan proses penggantiannya. Terjadinya pengurangan CO2 juga mengakibatkan adanya peningkatan pH air. Hal ini disebabkan oleh adanya perubahan dalam reaksi kesetimbangan. Jika CO2 berkurang, maka HCO3- akan bereaksi menghasilkan CO2 untuk proses fotosintesis. Proses ini dapat menghindarkan terjadinya peningkatan pH secara drastis. Jika HCO3- berkurang, maka CO32- akan bereaksi untuk menghasilkan CO2 dan H2O. Pada malam hari, saat proses fotosintesis berhenti, proses respirasi hewan, mikroba dan fitoplankton berlangsung dan akan menghasilkan CO2. Selanjutnya proses tersebut bereaksi dengan H+ menjadi HCO3- (Sammut, 2011).
2.3 Konsentrasi Alkalinitas di Perairan Yang Sesuai
nilai alkalinitas tinggi lebih produktif dari pada perairan dengan nilai alkalinitas rendah (Effendi, 2003).
Konsentrasi total alkalinitas tidak hanya berpengaruh langsung terhadap pertumbuhan plankton tetapi juga mempengaruhi parameter kualitas air yang lain, yakni pH air yang akhirnya mempengaruhi produksi dan pertumbuhan budidaya (Kordi, 2007).
Alkalinitas perairan berkaitan dengan gambaran kandungan karbonat dari batuan dan tanah yang dilewati oleh air serta sedimen dasar perairan. Nilai alkalintias tinggi biasanya juga demikian di wilayah kering di mana terjadi evaporasi secara intensif. Perairtan dengan nilai alkalinitas tinggi lebih produktif daripada dengan nilai alkalintias, tetapi berkaitan dengan keberadaan fosfor dan elemen esensial lain yang kadarnya meningkat dengan meningkatnya nilai alkalinitas (Effendi, 2003).
Tinggi atau rendahnya alkalinitas dalam suatu perairan tidak lepas dari pengaruh parameter lain seperti pH, atau kesadahan. Di mana semakin tinggi alkalinitas, maka kedua parameter tersebut akan mengikuti. konsentrasi total alkalinitas sangat erat hubungannya dengan konsentrasi total kesadahan air. Umumnya total alkalinitas mempunyai konsentrasi yang sama dengan konsentrasi total kesadahan. Selain bergantung pada pH, alkalinitas juga dipengaruhi oleh komposisi mineral, suhu, dan kekuatan ion. Unsur-unsur alkalinitas juga dapat bertindak sebagai
Alkalinitas ditetapkan melalui titrasi asam basa. Asam kuat seperti asam sulfat dan asam klorida (H2SO4 dan HCl) menetralkan zat-zat alkalinitas yang merupakan zat basa sampai titik akhir titrasi (titik ekuivalensi) kira-kira pada pH 8,3 dan pH 4,5. Titik akhir ini dapat ditentukan oleh:
1. Jenis indikator yang dipilih dimana warnanya berubah-ubah pada pH titik akhir titrasi (pH ekuivalen).
2. Perubahan nilai pH pada pH meter waktu titrasi asam basa dimana lengkungan pada grafik pH dan volume asam memperlihatkan titik akhir titrasi/titik ekuivalensi (Achmad, 2004).
Titik ekuivalen pada penentuan alkalinitas jumlah dapat diketahui dengan adanya kadar karbondioksida pada akhir titrasi. Jika contoh air asli mengandung hidroksida sedikit, dan apabila pengadukan selain titrasi tidak kuat alkalinitas akan menentukan titik ekivalent. Harga pH berikut ini merupakan titik ekivalen yang berkaitan dengan kadar alkalinitas sebagai kalsium karbonat. pH 5,1 untuk alkalinitas yang jumlahnya 30 mg 1 L, indikator campuran antara brom-kresol hijau atau methyl-methyl jingga untuk pH kurang dari 4,6 (Alaerts, 2002).
2.5 Larutan Indikator Yang Digunakan
Indikator fenolftalein yang sudah dikenal merupakan asam diprotik dan tidak berwarna. indikator ini terurai dahulu menjadi bentuk tidak berwarna dan kemudian, dengan hilangnya proton kedua menjadi ion dengan sistem terkonjugat, menghasilkan warna merah. Metil orange, indikator lainnya yang banyak digunakan merupakan basa dan berwarna kuning dalam bentuk molekulnya. Penambahan proton menghasilkan kation yang berwarna merah muda (Barus, 2002).
Indikator buatan adalah indikator yang sudah dibuat di laboratorium atau di pabrik alat – alat kimia, kita tinggal menggunakannya.Untuk mengidentifikasi sifat asam, basa, dan garam biasanya menggunakan kertas lakmus.Kertas lakmus terdiri dari lakmus merah dan lakmus biru.Indicator buatan lainnya adalah indicator universal, indicator asam basa seperti fenolptalin dan metal jingga.Indikator ini selain untuk menentukan sifat asam basa juga dapat digunakan untukmenentikan derajat keasaman atau pH larutan. Indikator adalah suatu zat penunjuk, yang dapat membedakan larutan, apakah asam, basa, atau netral.Indikator asam basa adalah senyawa khusus yang ditambahkan pada larutan, dengan tujuan mengetahui kisaran pH dalam larutan tersebut. Senyawa indikator yang tak terdisosiasi akan mempunyai warna berbeda dibanding indikator terionisasi (Brandy, 1994).
BCG-MR yaitu indikator yang bersifat amfoter, yang artinya bisa bereaksi dengan asam maupun basa. Indikator ini digunakan untuk mengetahui asam dalam keadaan berlebih. Selain itu alasan pemilihan indikator ini adalah karena memiliki trayek pH 6-8 melalui suasana asam dan basa atau dapat bekerja pada suasana asam dan basa, yang berarti memiliki rentang trayek kerjanya yang luas yakni meliputi asam-netral-basa. Pada suasana asam, indikator akan berwarna merah muda, sedang pada suasana basa akan berwarna hijau-biru. Setelah ditambah BCG-MR, larutan akan berwarna merah muda karena berada dalam kondisi asam. Asam borat berfungsi sebagai penangkap NH3 sebagai destilat berupa gas yang bersifat basa. Supaya ammonia dapat ditangkap secara maksimal, maka sebaiknya ujung alat destilasi ini tercelup semua ke dalam larutan asam standar sehingga dapat ditentukan jumlah protein sesuai dengan kadar protein bahan (Mubarak, 2009).
III. METODELOGI PRAKTIKUM
III.1 Waktu dan Tempat
Adapun waktu dan tempat dilaksanakannya praktikum ini yaitu pada hari/tanggal, Rabu/ 08 November 2017 bertempat di Laboratorium Perikanan dan Kelautan Universitas Lampung.
III.2 Alat dan Bahan
Adapun Alat dan bahan yang digunakan pada praktikum ini seperti air sample, pipet tetes, Erlenmeyer, indikator pp, larutan H2SO4 dan larutan BCGMR.
III.3 Cara Kerja
IV. HASIL DAN PEMBAHASAN
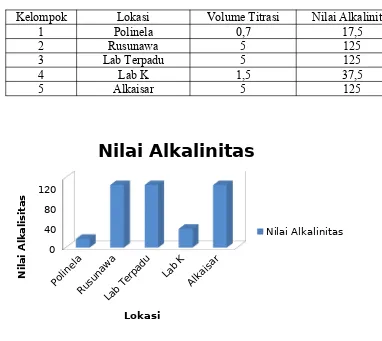
Cara kerja kelompok 3 pada praktikum alkalinitas ini yaitu air sampel dari kolam laboratorium perikanan diambil sebanyak 50 ml kemudian diberi indikator pp sebanyak 2 tetes, lalu dititrasi menggunakan H2SO4 sebanyak 5 ml dan hasil nya yaitu air warna hijau masih tetap hijau.
Dalam perairan, kadar alkalinitas terdapat secara alami sebagai faktor kimia. Artinya pada setiap perairan pasti terdapat alkalinitasnya baik tinggi ataupun rendah. Menurut Effendi (2003), alkalinitas adalah suatu parameter kimia perairan yang menunjukan jumlah ion karbonat dan bikarbonat yang mengikat logam golongan alkali tanah pada perairan tawar. Kemudian menurut Kordi dan Tancung (2007), bahwa ketersediaan ion basa bikarbonat (HCO3) dan karbonat (CO32-) merupakan parameter total alkalinitas.Alkalinitas juga berpengaruh terhadap pH dalam suatu perairan. Dalam kondisi basa ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hydrogen yang bersifat asam sehingga keadaan pH menjadi netral.sebaliknya bila keadaan terlalu asam, ion karbonat akan mengalami hidrolis menjadi ion bikarbonat dan melepaskan hidrogen oksida yang bersifat basa, sehingga keadaan kembali netral. Perairan dengan nilai alkalinitas yang terlalu tinggi tidak terlalu disukai oleh organisme akuatik karena biasanya diikuti dengan nilai kesadahan yang tinggi atau kadar garam natrium yang tinggi (Achmad, 2004). Kadar alkalinitas yang sangat rendah, air kehilangan kemampuan menyangga perubahan keasaman dan pH yang berfluktuasi sangat cepat sehingga dapat menggangu kehidupan ikan budidaya. Ikan sangat sensitif pada kondisi kadar alkalinitas yang rendah (Tubawalony, 2007).
Alkalinitas juga berpengaruh terhadap pH dalam suatu perairan. Dalam kondisi basa ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hidrogen yang bersifat asam sehingga keadaan pH menjadi netral.sebaliknya bila keadaan terlalu asam, ion karbonat akan mengalami hidrolis menjadi ion bikarbonat dan melepaskan hidrogen oksida yang bersifat basa, sehingga keadaan kembali netral. Perairan dengan nilai alkalinitas yang terlalu tinggi tidak terlalu disukai oleh organisme akuatik karena biasanya diikuti dengan nilai kesadahan yang tinggi atau kadar garam natrium yang tinggi (Achmad, 2004).
Pemberian kapur yang berlebihan atau aliran air yang kurang baik dapat berakibat alkalinitas air tinggi dan dapat berakibat fatal bagi ikan (Irianto, 2005). Alkanitas yang rendah diperairan dapat diatas dengan pengapuran dengan doses 5 ppm. Jenis kapur yang digunakan disesuaikan kondisi PH air sehingga pengaruh pengapuran tidak membuat pH tinggi. Jenis kapur yang baik digunakan adalah Ca (OH)2diaplikasikan untuk menaikkan alkanitas sekaligus menaikkan PH air. Kapur memberikan pengaruh yang bervariasi pada tanah pertanian karena fungsinya bermacam-macam bagi tanah dan tanaman. Pengapuran tanah masam dengan bahan mengandung Ca dan Mg dapat mengurangi kemasaman tanah. Tanah dikapur bukan semata-mata ingin menaikkan pH tetapi juga kerena tingginya Al. Al itu yang sebenarnya yang menjadi problem pada tanah masam, karena menghambat ketersediaan unsur hara (Kuswandi, 2005).
Faktor kegagalan pada praktikum alkalinitas yaitu pada kelompok 4 mendapatkan hasil nilai alkalinitas 37,5 dimana tidak mencapai nilai alkalinitas yg normal diperaira.
Kandungan alkalinitas yang rendah, akan berdampak negatif pada produktifitas suatu organisme seperti akan mempengaruhi kesehatan dan pertumbuhan untuk kelangsungan hidupnya serta akan memepengaruhi kuantitas kadar parameter lain diantaranya CO2, pH dan parameter lainya. Penyebab yang mempengaruhi terjadinya penurunan pH salah satunya yaitu terhadap bahan organik dimana akibat pH yang kurang stabil maka konsentrasi total alkalinitas juga akan terpengaruh. Hal ini disebabkan karena pada keadaan asam banyak tersedia ion hidrogen bebas yang kemudian hidrogen bebas tersebut akan membentuk senyawa asam dengan mengikat basa-basa bebas seperti karbonat maupun bikarbonat yang merupakan unsur pembentuk total alkalinitas air, akibatnya menurunkan konsentrasi total alkalinitas (Krismono, 2010).
V. PENUTUP
5.1 Kesimpulan
Kesimpulan yang didapatkan dari praktikum kali ini, yaitu:
1. Perhitungan alkalinitas akan diperoleh jika sudah mendapatkan nilai volume titrasi air sampel yang digunakan
2. Nilai total alkalinitas yang tinggi terdapat pada kelompok 4
3. Alkalinitas diperlukan untuk mencegah terjadinya fluktuasi pH yang besar, selain itu juga merupakan sumber CO2 untuk proses fotosintesis fitoplankton. Nilai alkalinitas akan menurun jika aktifitas fotosintesis naik, sedangkan ketersediaan CO2 yang dibutuhkan untuk fotosintesis tidak memadai
5.2 Saran
DAFTAR PUSTAKA
Afrianto. E dan Liviawaty. E., 1991. Teknik Pembuatan Tambak Udang. Kanisus, Yogyakarta.
Achmad, R. 2004. Kimia Lingkungan. Yogykarta: Penerbit Andi.
Amri K, Ir. M.Si. 2002. Budi Daya Udang Windu secara Intensif. Jakarta: Agromedia pustaka.
Brandy, TE, Putjamaka & Sumiha.1994. Kimia Universitas Asas dan Struktur.Jakarta : Erlangga.
Effendi, I. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya Lingkungan Perairan. Kanisius. Yogyakarta.
Gusrina, 2008. Budidaya Ikan Jilid I. Direktorat Pembinaan Sekolah Menengah Kejuruan. Jakarta.
Hakim, N., Y. Nyakpa, dan . Lubis. 2006. Dasar-dasar Ilmu Tanah. Universitas Lampung. Lampung
Ince, 2008. Setelah belajar Tentang Alkalinitas. Kagaya. Borneo
Irianto, A., 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta.
Kholis M, S.Pi, MM. 2010. Agribisnis Patin. Penebar Swadaya. Jakarta.
Kordi.K.M.G.H, 2007. Meramu Pakan Untuk Ikan Karnivor. CV. Anelka Ilmu, Krismono. 2010. Hubungan Antara Kualitas Air Dan Pengaruhnya Terhadap
Populasi Ikan Di Perairan Danau Limboto. LIMNOTEK (2010) 17 (2) : 171-180.
Kuswandi. 2005. Pengapuran Tanah Pertanian: Edisi Revisi. Yogyakarta: Kanisius
Mujiman., A, 1989. Makanan Ikan. Penebar Swadaya, Jakarta.
Noerati. 2006. Diktat Praktikum Kualitas Air Proses Dan Air Limbah Industri Tekstil. Sekolah Tinngi Teknologi Tekstil. Bandung.
Novita, Sherly. 2008. Pengaruh Penambahan Kalsium Karbonat Sebagai Fortifikan Kalsium Terhadap Sifat Fisikokimia Dan Organoleptik Permen Jeli Susu. Jurnal Teknologi Pangan dan Gizi, Vol. 7 No. 1 : 27-39
Radini. D, 2006. Optimasi Suhu, pH Serta Jenis Pakan Pada Kultur Daphnia sp. Sekolah Ilmu dan Teknologi Hayat. Bandung.
Ratnawati E. 2008. Budidaya Udang Windu (Penaeus Monodon) Sistem Semi Intenslf pada Tambak Tanah Sulfat Masam. Peneliti pada Balai Riset Perikanan Budidaya Air Payau. Maros.
Reni, 2008. Air-Kehidupan/ak-k-Kesudahan.UI. Jakarta.
Rezqi V. S. K. 2009. Pengaruh Tiga Cara Pengolahan Tanah Tambak Terhadap Pertumbuhan Udang Vanamd Litopenaeus vannamei. IPB. Bogor.
Salmin, 2000. Kadar Oksigen Terlarut di Perairan Sungai Dadap, Goba, Muara
Rompas. 2008. Fungsi Alkalinitas. Gramedia. Jakarta.
Sammut J Dr.,dan Mustafa A Ir., MS. 2011. Teknik Pengapuran pada Pematang Tambak Tanah Sulfat Masam. Balai Riset Perikanan Budidaya Air Payau. Maros.
Soeyasa, 2001. Ekologi Perairan. Departemen Kelautan dan Perikanan Dirjen.Pendidikan Menengah Atas, Jakarta.
Susmanto, 1991. Membuat Kolam Ikan. Penebar Swadaya, Jakarta.
Suyanto R Dra. Ny. S ,dan Takarina E. P., Ir. Msi. 2009. Panduan Budidaya Udang Windu. Penebar Swadaya. Yogyakata