ANGKA LEMPENG TOTAL (ALT)
RIMPANG TEMULAWAK (Curcuma xanthorrhiza Roxb.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Raissa Wanadri Putri Ruga NIM : 078114014
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
vii
Segala ucapan syukur penulis panjatkan ke hadirat Allah Bapa, yang memberikan kekuatan, sukacita, dan kemenangan dalam penyusunan skripsi yang berjudul : “Pengaruh Waktu Pengeringan terhadap Angka Lempeng Total (ALT) Rimpang Temulawak (Curcuma xanthorrhiza Roxb.)” merupakan karya ilmiah penulis untuk memenuhi syarat memperoleh gelar Sarjana Farmasi (S. Farm.) di Fakultas Farmasi Universitas Sanata Dharma.
Dalam proses penyelesaian skripsi ini, penulis menerima banyak bantuan dari berbagai pihak, baik berupa bimbingan, saran, dan berbagai macam masukan. Oleh karena itu, penulis menyampaikan ucapan terima kasih kepada :
1. Bapak Ipang Djunarko, M.Sc, Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Ibu Maria Dwi Budi Jumpowati, S.Si., selaku Dosen Pembimbing yang telah memberikan bimbingan dan saran dalam penyusunan skripsi ini. Terima kasih untuk kesempatan yang diberikan kepada saya untuk belajar dari pengalaman menjadi asisten dosen Praktikum Mikrobiologi.
3. Bapak Prof. Dr. C. J. Soegihardjo, Apt. dan Bapak Yohanes Dwiatmaka, M. Si., selaku Dosen Penguji.
4. Ibu C. M. Ratna Rini Nastiti, M. Pharm., Apt., selaku Ketua Program Studi Fakultas Farmasi Universitas Sanata Dharma.
viii
Ruga, dan Adikku Alodia V. P Ruga, untuk kasih sayang yang kalian berikan, itu yang selalu menginspirasiku untuk terus bertahan dan berjuang untuk menyelesaikan tugas akhir ini.
7. Teman-teman se-perjuanganku : Mega Gunawan, I Putu Chandra Dinata, dan I Wayan Arditayasa. Aku mengucap syukur karena Tuhan mengizinkanku untuk melalui semua ini bersama kalian. Itu semua hanya karena Dia ingin aku selalu percaya pada campur tangan-Nya.
8. Sahabatku, Afni Panggar Besi dan Widya Sari Nugrahani. Terima kasih karena kalian selalu ada ketika aku membutuhkan kalian. Suka duka bersama kalian sangat hebat dan luar biasa.
9. Adik-adikku : Heni Ariyanti, Bernadeta Feni M., dan Novia Sarwoningtyas (Filipi 4 : 13). Doa dan sukacita yang kalian berikan selalu menguatkanku untuk terus berjuang.
10. Oki Christina, Ranindya Siska, Lilik Suryaningsih, Stella Octaviani, Christine Charisma, dan Monica Sugiharto. Aku percaya masa depan yang terbaik juga tersedia untuk kalian.
11. Adik-adik angkatan 2008-2010 : Caroline Ester D, Fatrisia Vivi, Tri Harjono, Carolie Ivoni, Natalia Windari, Kaleb Franky, Hermanto, Dina Christin, dan Eva Ekayanti.
ix
karena itu, penulis masih memerlukan kritik dan saran yang membangun guna perbaikan skripsi ini. Semoga skripsi ini dapat bermanfaat dan memberikan informasi yang berguna bagi pembaca.
x
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN PERSETUJUAN PUBLIKASI ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Rumusan permasalahan ... 6
2. Manfaat penelitian ... 7
3. Keaslian penelitian ... 7
B. Tujuan Penelitian ... 8
1. Tujuan umum ... 8
2. Tujuan khusus ... 8
xi
1. Keterangan botani ... 9
2. Deskripsi rimpang temulawak ... 9
3. Kandungan kimia rimpang temulawak ... 10
4. Manfaat rimpang temulawak ... 10
B. Proses Pengolahan Simplisia ... 11
C. Aktivitas Air (aw) ... 15
D. Angka Lempeng Total (ALT) ... 16
E. Landasan Teori ... 19
F. Hipotesis ... 21
BAB III METODOLOGI PENELITIAN ... 22
A. Jenis dan Rancangan Penelitian ... 22
B. Variabel Penelitian dan Definisi Operasional ... 23
1. Variabel penelitian ... 23
2. Definisi operasional ... 23
C. Bahan Penelitian ... 24
D. Alat Penelitian ... 24
E. Tata Cara Penelitian ... 25
1. Pengumpulan rimpang temulawak ... 25
2. Identifikasi rimpang temulawak ... 25
3. Pencucian dan perajangan rimpang temulawak ... 26
4. Pengeringan rimpang temulawak ... 26
xii
7. Cara perhitungan ALT ... 29
8. Menghitung dan membulatkan angka ... 30
F. Analisis Hasil ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
A. Pengumpulan Bahan ... 35
B. Identifikasi Rimpang Temulawak (Curcuma xanthorrhiza Roxb.) ... 35
C. Pengolahan Rimpang Temulawak ... 37
1. Sortasi basah ... 38
2. Pencucian ... 39
3. Perajangan ... 39
4. Pengeringan ... 40
5. Sortasi kering ... 44
D. Uji Angka Lempeng Total (ALT) ... 44
1. Homogenisasi sampel ... 45
2. Pengenceran sampel ... 45
3. Uji angka lempeng total (ALT) rimpang kering temulawak ... 46
BAB V KESIMPULAN DAN SARAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
LAMPIRAN ... 68
xiii
Tabel I. Nilai aw pada berbagai mikroba... 15
Tabel II. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu pengeringan hari ke-0 dengan waktu inkubasi 24 dan 48 jam... 50 Tabel III. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu
pengeringan hari ke-2 dengan waktu inkubasi 24 dan 48 jam... 53 Tabel IV. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu
pengeringan hari ke-4 dengan waktu inkubasi 24 dan 48 jam... 54 Tabel V. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu
pengeringan hari ke-6 dengan waktu inkubasi 24 dan 48 jam... 55 Tabel VI. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu
pengeringan hari ke-8 dengan waktu inkubasi 24 dan 48 jam... 56 Tabel VII. Nilai Angka Lempeng Total (ALT) rimpang temulawak pada waktu
pengeringan hari ke-10 dengan waktu inkubasi 24 dan 48 jam... 58 Tabel VIII. Nilai ALT rimpang temulawak pada berbagai waktu pengeringan pada
waktu inkubasi 24 dan 48 jam... 59 Tabel IX. Nilai dan makna signifikansi pada data nilai ALT rimpang temulawak
sebelum dilakukan transformasi dan sesudah dilakukan transformasi.... 61 Tabel X. Hasil uji Post Hoc pada nilai ALT rimpang temulawak pada
xiv
Gambar 1. Rimpang segar temulawak dari Pasar Borobudur Magelang... 36
Gambar 2. Irisan rimpang temulawak... 37
Gambar 3. Hasil uji ALT rimpang temulawak... 47
xv
Lampiran 1. Hasil identifikasi rimpang temulawak ... 69 Lampiran 2. Cara perhitungan nilai ALT rimpang temulawak... 70 Lampiran 3. Nilai ALT rimpang temulawak pada pengeringan hari ke-0 s/d 10
selama waktu inkubasi 24 dan 48 jam... 82 Lampiran 4. Perbandingan nilai ALT rimpang temulawak pada pengeringan hari
ke-0 s/d 10 waktu inkubasi 24 dan 48 jam... 84 Lampiran 5. Hasil uji normalitas pada nilai ALT rimpang temulawak pada
pengeringan hari ke-0 s/d 10 waktu inkubasi 24 jam... 84 Lampiran 6. Hasil uji normalitas data hasil transformasi pada nilai ALT rimpang
temulawak pengeringan hari ke-0 s/d 10 waktu inkubasi 24 jam... 86 Lampiran 7. Hasil uji Friedman dan uji Post Hoc pada nilai ALT rimpang
xvi
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan salah satu tanaman yang banyak digunakan sebagai bahan baku dalam pembuatan obat tradisional. Salah satu cara untuk menentukan kualitas, keamanan, dan khasiat simplisia adalah dengan menghitung banyaknya cemaran mikrobia, misalnya bakteri. Parameter mikrobiologi yang ditetapkan oleh Keputusan Menteri Kesehatan Republik Indonesia untuk menetapkan besarnya angka cemaran bakteri adalah uji Angka Lempeng Total (ALT).
Penelitian ini merupakan penelitian eksperimental dengan rancangan penelitian acak lengkap pola searah. Penelitian ini dilakukan dengan tujuan untuk menghitung nilai ALT rimpang temulawak yang dikeringkan selama 10 hari yang dianalisis secara deskriptif-komparatif dan mengetahui pengaruh dari beberapa waktu pengeringan terhadap nilai ALT rimpang temulawak. Berdasarkan KepMenKes RI No : 661/MenKes/SK/VII/1994, besarnya nilai ALT tidak lebih dari 107 CFU/g sampel, sedangkan untuk mengetahui pengaruh nilai ALT terhadap berbagai waktu pengeringan rimpang temulawak digunakan analisis statistik dengan menggunakan uji Post Hoc yaitu uji Wilcoxon.
xvii
Javanese turmeric (Curcuma xanthorrhiza Roxb.) is one of the plant, which is widely used as raw material in the manufacture of traditional medicine. One way to determine the quality, safety, and the effectivity of simplicia as raw material is calculate the number of microbial contamination, such as bacteria. Microbiological parameters set by Keputusan Menteri Kesehatan Republik Indonesia which is used to determine the number of bacteria contained is a Total Plate Count (TPC) test.
This was an experimental study with a completely randomized study design. This research were conducted to calculate the value of TPC produced from the dried Curcumae Rhizoma for 10 days and then performed a descriptive-comparative. Based on KepMenKes RI No. 661/Menkes/SK/VII/1994, TPC values was not more than 107 CFU/g of sample, where as to determine the effect on the value of TPC to a variety of Curcumae Rhizoma drying time, use statistical analysis with Post-Hoc test, which is Wilcoxon test.
1
PENGANTAR
A. Latar Belakang
Masyarakat Indonesia banyak menggunakan obat tradisional sebagai salah satu pengobatan alternatif dengan memanfaatkan kekayaan alam. Obat tradisional adalah bahan atau ramuan bahan berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sari atau galenik, atau campuran dari bahan-bahan tersebut, yang secara turun-temurun telah digunakan untuk pengobatan berdasarkan pengalaman (Depkes RI, 2005). Besarnya pemanfaatan obat tradisional di Indonesia membuktikan bahwa obat tradisional mampu memberikan dampak positif bagi kesehatan masyarakat. Oleh karena itu, kualitas obat tradisional perlu ditingkatkan agar dapat digunakan secara maksimal dalam fasilitas pelayanan kesehatan.
Peningkatan kualitas obat tradisional dapat dilakukan dengan cara mengendalikan proses pengolahan simplisia. Pentingnya pengendalian proses pengolahan simplisia adalah untuk mendapatkan simplisia yang berkualitas, aman, dan berkhasiat sehingga penggunaannya tidak diragukan di kalangan masyarakat. Tahap-tahap pengolahan simplisia, antara lain adalah pengumpulan bahan baku, sortasi basah, pencucian, perajangan, pengeringan, dan penyimpanan (Depkes RI, 1985).
dengan menggunakan sinar matahari secara langsung. Cara pengeringan seperti ini mempunyai beberapa kelemahan, seperti ketergantungan pada cuaca dan pencemaran mikrobia pada simplisia.Metode pengeringan dengan sinar matahari digunakan dalam penelitian ini karena peneliti menyamakan kondisi pengeringan dengan pedagang pengumpul, di mana pedagang pengumpul banyak mendistribusikan rimpang temulawak kepada industri-industri, baik industri rumah tangga maupun industri dengan skala besar. Oleh karena itu, dapat diketahui apakah rimpang temulawak yang dikeringkan dengan menggunakan sinar matahari mempunyai kualitas yang baik untuk dijadikan bahan baku obat tradisional.
Cemaran mikrobia dapat tumbuh dan berkembang pada kandungan air yang relatif tinggi, sehingga munculnya mikrobia dapat menyebabkan kerusakan dan pengurangan kualitas pada simplisia. Mikrobia dapat mencemari simplisia melalui air, debu, udara, dan juga alat-alat pengolahan selama proses produksi (Hariyati, 2008). Berkurangnya kualitas simplisia dapat memberikan dampak yang buruk bagi keamanan dan khasiat simplisia terkait dengan masalah kesehatan, apabila simplisia tersebut akan dikonsumsi (Nurdjanah, 1987).
merupakan akibat dari pertumbuhan. Pertumbuhan mengarah pada suatu peningkatan dalam jumlah individu-individu yang menghasilkan suatu populasi atau kultur (Brooks, 2005). Proses pengeringan dilakukan untuk mengurangi kadar air yang terkandung dalam simplisia sehingga didapatkan kadar air yang rendah. Oleh karena itu, pengeringan merupakan salah satu cara untuk menghambat pertumbuhan mikrobia, khususnya bakteri.
Temulawak (Curcuma xanthorrhiza Roxb.) adalah salah satu dari tanaman di Indonesia yang digunakan sebagai obat tradisional, di mana penggunaannya sangat meluas di kalangan masyarakat dan dipercaya mempunyai banyak khasiat untuk menyembuhkan penyakit. Menurut Badan Pusat Statistik (BPS) (cit. Sembiring dan Ginting, 2006), pengembangan tanaman temulawak di Indonesia sangat potensial karena produksi rimpang temulawak mengalami peningkatan sejak tahun 2001-2002. Badan Pengawasan Obat dan Makanan Republik Indonesia (BPOM RI) juga telah menetapkan bahwa temulawak merupakan salah satu dari sembilan tanaman obat unggulan di Indonesia. Kandungan kimia rimpang temulawak yang sering dimanfaatkan dalam bidang kesehatan adalah pati, kurkuminoid, dan minyak atsiri (Sembiring, 2007). Beberapa khasiat yang dimiliki oleh temulawak untuk pengobatan adalah sebagai agen antiinflamasi (anti radang) dan anti hepatotoksik (anti keracunan empedu) (Arisandi, 2006).
kesehatan apabila dikonsumsi. Oleh karena itu, suatu produk obat bahan alam tidak boleh mengandung cemaran mikrobia atau apabila tidak dapat dihindari harus sesuai dengan batas maksimum yang dipersyaratkan.
Beberapa jenis cemaran bakteri yang berhubungan dengan kesehatan, khususnya yang terkait dengan keracunan makanan antara lain adalah Salmonella sp., Shigella sp., Campylobacter, Listeria monocytogenes, Yersinia enterocolityca, Staphylococcus aureus, Clostridium botulinum, dan Escherichia coli (Hariyati, 2008). Masalah-masalah kesehatan yang dapat terjadi karena adanya mikrobia patogen antara lain adalah gejala gastrointestinal dan demam tifoid (Salmonella), disentri (Shigella), gejala gastrointestinal (Yersinia) gastroenteritis (Campylobacter), (Fardiaz, 1992), dan diare dengan tingkat keparahan tinggi yang dapat disebabkan oleh bakteri Escherichia coli (Bartram, 2003).
No. 661/MenKes/RI/SK/VII/1994 yaitu tidak lebih dari 107 koloni/g (Depkes RI, 1994).
Dari penelitian yang dilakukan oleh Monica (2009), tentang jumlah Angka Lempeng Total (ALT) pada rimpang basah, rimpang kering, dan ekstrak etanolik temulawak dinyatakan bahwa terjadi penurunan nilai ALT pada rimpang temulawak yang sudah mengalami proses pengeringan. Data penelitian yang didapatkan menunjukkan besarnya nilai rata-rata ALT pada rimpang basah temulawak setelah waktu inkubasi 48 jam adalah 2,9 ± 0,058 x 108 koloni/g sampel, sedangkan nilai rata-rata ALT pada rimpang temulawak yang sudah dikeringkan setelah waktu inkubasi 48 jam adalah 1,4 ± 0,058 x 107 koloni/g sampel.
Hal inilah yang mendorong peneliti untuk melakukan penelitian mengenai pengaruh waktu pengeringan terhadap nilai ALT yang dihasilkan oleh rimpang temulawak, dengan variabel penelitian yaitu lama pengeringan selama 10 hari. Menurut Pursglove (cit. Nurdjanah, 1987), pengeringan rimpang dilakukan selama 10-15 hari untuk mencapai kadar air 8-10%. Selama waktu pengeringan 10 hari tersebut, sampel rimpang kering temulawak dicuplik setiap dua hari yaitu pada pengeringan hari ke-0, 2, 4, 6 , 8, dan 10 untuk dilakukan pengujian dan dihitung jumlah bakteri serta nilai ALT-nya. Menurut KepMenKes RI No: 661/MenKes/SK/VII/1994, nilai ALT yang baik pada rimpang dalam bentuk sediaan rajangan adalah tidak lebih dari 107 koloni/g (Depkes RI, 1994).
keamanan simplisia. Nilai ALT tersebut dianalisis dengan menggunakan statistika, yang bertujuan untuk mengetahui ada tidaknya perbedaan bermakna dari waktu pengeringan terhadap nilai ALT pada rimpang temulawak. Langkah awal yang dilakukan dalam uji statistik adalah uji normalitas. Uji normalitas yang digunakan adalah Shapiro-Wilk karena jumlah sampel yang digunakan kurang dari 50. Apabila distribusi data yang didapatkan normal, maka analisis dilanjutkan dengan uji repeated ANOVA. Apabila distribusi data yang didapatkan tidak normal, digunakan uji Friedman sebagai alternatif uji repeated ANOVA. Analisis data dilanjutkan dengan uji Post Hoc dengan menggunakan uji Wilcoxon untuk melihat perbedaan bermakna pada nilai ALT apabila didapatkan nilai signifikansi di bawah 0,05 pada uji Friedman.
1. Rumusan permasalahan
a. Apakah nilai ALT rimpang temulawak pada berbagai waktu pengeringan memenuhi persyaratan yang ditetapkan dalam KepMenKes RI No : 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 koloni/g sampel?
2. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi bagi ilmu pengetahuan mengenai pengaruh waktu pengeringan terhadap nilai ALT rimpang temulawak sebagai bahan baku dalam pengembangan obat tradisional guna mengetahui kualitas, khasiat, dan batas keamanannya. b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan keterangan bagi masyarakat tentang keamanan dan kualitas rimpang temulawak yang dikeringkan dengan sinar matahari sebagai bahan baku obat tradisional, berdasarkan nilai ALT yang ditentukan sesuai dengan KepMenKes RI (1994).
3. Keaslian penelitian
B. Tujuan Penelitian
1. Tujuan umum
Untuk memberikan informasi kepada masyarakat mengenai kualitas, keamanan, dan khasiat rimpang temulawak sebagai bahan baku obat tradisional yang dapat meningkatkan kesehatan masyarakat.
2. Tujuan khusus
a. Untuk mengetahui nilai ALT rimpang temulawak yang dikeringkan selama 10 hari memenuhi persyaratan ataukah tidak berdasarkan KepMenKes RI No: 661/MenKes/SK/VII/1994, yaitu tidak lebih dari 107 koloni/g sampel. b. Untuk mengetahui waktu pengeringan memberikan perbedaan yang
9
PENELAAHAN PUSTAKA
A. Temulawak (Curcuma xanthorrhiza Roxb.)
1. Keterangan botani
Temulawak termasuk dalam famili Zingiberaceae, genus Curcuma, dan spesies Curcuma xanthorrhiza Roxb. (Rukmana, 1995). Temulawak mempunyai nama daerah yang bermacam-macam, antara lain adalah temu lawak (Sumatra, Jawa), koneng gede (Sunda), temo labak (Madura) (Depkes RI, 1979).
2. Deskripsi rimpang temulawak
Temulawak banyak ditemukan di hutan-hutan daerah tropis dan berkembang biak di tanah tegalan sekitar pemukiman, terutama pada tanah gembur, sehingga rimpangnya mudah berkembang menjadi besar. Temulawak termasuk jenis tumbuh-tumbuhan herba, di mana rimpangnya sejak lama dikenal sebagai bahan ramuan obat (Arisandi, 2006).
Pada pemeriksaan makroskopik, rimpang temulawak (Curcumae rhizome) merupakan keping tipis dengan bentuk bulat atau jorong, ringan,
3. Kandungan kimia rimpang temulawak
Temulawak adalah kepingan rimpang Curcuma xanthorrhiza Roxb. (familia Zingiberaceae) dengan kadar minyak atsiri tidak kurang dari 8,0% v/b. Pemerian bau aromatik, rasa tajam, dan pahit (Direktorat Jenderal Pengawasan Obat dan Makanan, 1995). Kandungan zat yang terdapat dalam rimpang temulawak adalah zat kuning yang disebut kurkumin, dan juga protein, pati, serta zat-zat minyak atsiri. Minyak atsiri temulawak mengandung phelandren, kamfer, borneol, xanthorrhizol, tumerol, dan sineal. Kandungan kurkumin dalam rimpang temulawak berkisar antara 1,6 - 2,22% dihitung berdasarkan berat kering (Rukmana, 1995).
4. Manfaat rimpang temulawak
Temulawak adalah salah satu dari tanaman di Indonesia yang digunakan sebagai obat tradisional, di mana penggunaannya sangat meluas di kalangan masyarakat dan dipercaya mempunyai banyak khasiat untuk menyembuhkan penyakit. Badan Pengawasan Obat dan Makanan Republik Indonesia (BPOM RI) telah menentukan bahwa temulawak adalah salah satu dari sembilan tanaman obat unggulan di Indonesia (Sembiring, 2007).
B. Proses Pengolahan Simplisia
Simplisia adalah bahan alamiah yang digunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, simplisia merupakan bahan yang dikeringkan. Beberapa tahapan dalam pengolahan simplisia yang dapat mempengaruhi kualitas simplisia, antara lain adalah pengumpulan bahan baku, sortasi basah, pencucian, perajangan, pengeringan, pengepakan, dan penyimpanan (Depkes RI, 1985).
Salah satu faktor yang memungkinkan terjadinya pencemaran oleh mikrobia adalah pengolahan pasca panen. Pengolahan pasca panen yang baik dilakukan untuk menghasilkan simplisia tanaman obat yang bermutu dan memiliki efek terapi yang tinggi (Sembiring, 2007). Tahap-tahap pengolahan pasca panen penting untuk diperhatikan dan dikendalikan apabila ingin mendapatkan simplisia yang mempunyai keamanan dan kualitas yang baik.
menjadi uap, dan uap tersebut akan berdifusi dari dalam rimpang yang dikeringkan menuju ke permukaan, dan akhirnya menguap (Voigt, 1995).
Pengeringan merupakan salah satu tahap dalam proses pengolahan pasca panen yang dapat mempengaruhi kualitas dan keamanan simplisia. Untuk proses penyebaran panas berlaku prinsip dasar bahwa secara alamiah arah gerak energi panas berlangsung dari suhu tinggi ke suhu yang rendah (Voigt, 1995). Tujuan dilakukan pengeringan adalah untuk mengurangi kandungan air, sehingga didapatkan simplisia yang tidak mudah rusak dan dapat disimpan lebih lama. Pada saat kandungan air menurun, reaksi enzimatik dihentikan sehingga dapat mencegah penurunan mutu atau perusakan simplisia (Depkes RI, 1985).
Lama waktu pengeringan akan mempengaruhi besarnya kandungan air yang terdapat dalam simplisia. Kondisi lembab karena kandungan air merupakan salah satu kondisi di mana mikrobia dapat melakukan aktivitas-aktivitas enzimatik dalam simplisia, salah satunya adalah melakukan pertumbuhan. Ketika pengeringan berlangsung akan terjadi penurunan kandungan air dalam simplisia. Penurunan kandungan air inilah yang menyebabkan pertumbuhan mikrobia terhambat karena aktivitas enzimatik dalam simplisia juga secara langsung akan dihentikan.
keadaan iklim, sehingga cara ini hanya baik dilakukan di daerah yang udaranya panas atau dengan kelembaban yang rendah. Kelembaban yang tinggi dapat memperpanjang waktu pengeringan, sehingga memberi kesempatan pada mikrobia untuk tumbuh pada simplisia sebelum simplisia tersebut kering (Depkes RI, 1985), dan memungkinkan nilai ALT yang dihasilkan juga akan semakin tinggi dan melampaui batas persyaratan dikarenakan banyaknya mikrobia yang tumbuh.
Hal-hal yang perlu diperhatikan selama pengeringan simplisia adalah kebersihan, kelembaban udara, aliran udara, dan tebal bahan (Sembiring, 2007), dengan persyaratan kadar air untuk mencegah terjadinya reaksi enzimatis dan pertumbuhan fungi dan bakteri, terutama untuk bahan simplisia nabati adalah kurang dari 10% (Katno, 2008). Pada nilai kadar air tersebut kerusakan bahan dapat ditekan, baik dalam proses pengolahan maupun waktu penyimpanan, serta dinilai cukup aman. Kandungan air dalam bahan pangan dan obat tradisional, selain mempengaruhi terjadinya perubahan kimia juga ikut menentukan kandungan mikrobia yang terdapat di dalamnya.
yang diterbitkan oleh Depkes RI (1994) tentang Persyaratan Obat Tradisional No. 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 koloni/g sampel untuk sediaan dalam bentuk rajangan.
Selain harus bergizi dan menarik, produk obat tradisional juga harus bebas dari bahan-bahan berbahaya yang berupa cemaran kimia dan mikrobia. Kandungan mikrobia selain mempengaruhi mutu produk obat tradisional, juga menentukan keamanan produk tersebut untuk dikonsumsi, sehingga dibutuhkan pengolahan pasca panen yang tepat untuk dapat mengurangi kerusakan dan meningkatkan kualitas bahan baku obat tradisional, baik secara fisik maupun kimiawi (Katno, 2008).
Produk obat tradisional dapat menjadi beracun apabila terkontaminasi oleh bakteri patogen yang tumbuh dan berkembang biak selama penyimpanan, sehingga mampu memproduksi toksin yang membahayakan manusia. Suatu produk obat bahan alam tidak diperbolehkan mengandung cemaran mikrobia patogen seperti Salmonella sp., Shigella sp., Campylobacter, Listeria monocytogenes, Yersinia enterocolityca, Staphylococcus aureus, Clostridium botulinum, dan Escherichia coli. Apabila terdapat mikrobia patogen, besar kemungkinan akan berbahaya pada saat dikonsumsi.
film, pembentukan lendir, pengendapan atau kekeruhan, dan berbagai bau seperti bau gas, asam, alkohol, maupun bau busuk (Fardiaz, 1992).
C. Aktivitas Air(aw)
Pertumbuhan mikrobia dalam bahan baku obat tradisional berhubungan dengan jumlah air yang tersedia untuk pertumbuhan mikrobia di dalamnya. Salah satu faktor yang berpengaruh terhadap penurunan mutu produk obat tradisional adalah perubahan kadar air (Herawati, 2008). Aktivitas air atau water acivity (aw)
adalah jumlah air bebas yang dapat digunakan oleh mikrobia untuk pertumbuhannya (Supriyono, 2003).
Tabel I. Nilai aw pada berbagai mikrobia Grup Mikrobia Nilai aw minimal
Salah satu proses pengolahan simplisia yang dapat menurunkan tingkat aktivitas air adalah pengeringan. Pengeringan dapat mengurangi kandungan air yang terdapat dalam bahan baku obat tradisional. Dengan mengurangi kandungan air pada simplisia, diharapkan dapat menghentikan reaksi enzimatis dan menghambat mikrobia untuk dapat tumbuh dan berkembang karena mikrobia tidak dapat bertumbuh dan berkembang biak, terutama bakteri.
Waktu pengeringan yang optimal diharapkan dapat menghasilkan nilai aw
perpanjangan hidup mikrobia, karena aktivitas air (aw) merupakan faktor yang
dapat mempengaruhi pertumbuhan mikrobia (Oktavia, 2000). Tingkat kelembaban yang tinggi akan menyebabkan rimpang temulawak mengalami penyerapan air, sehingga nilai aw akan meningkat (Fardiaz, 1992). Menigkatnya
nilai aw memberikan kesempatan pada bakteri untuk dapat tumbuh dan
berkembang dengan baik, karena bakteri lebih mudah untuk melakukan pertumbuhan pada nilai aw yang mendekati 1,00 (Tarigan, 1988). Sebagai contoh,
ketika nilai lembab nisbi atau relative humadity (RH) 90%, ini berarti bahwa nilai aw adalah 0,9.
D. Angka Lempeng Total (ALT)
Bakteri adalah sekelompok mikrobia yang termasuk dalam prokariot bersel satu, berkembang biak dengan membelah diri dan bahan-bahan genetiknya tidak terbungkus dalam membran inti. Pada umumnya bakteri tidak mempunyai klorofil, kecuali pada beberapa spesies tertentu yang mempunyai pigmen fotosintesis. Oleh karena itu, ada bakteri yang sifatnya heterotrof dan autotrof (Tarigan, 1988).
Bakteri umumnya berukuran kecil dengan karakteristik dimensi sekitar
1µm. Sel-selnya dapat berupa tunggal ataupun untaian, beberapa kelompok
kimia bakteri terdiri dari 85% air, zat hidrat arang, protein, lemak, garam-garaman, enzim, dan vitamin (Adam, 1992).
Kebanyakan bakteri merupakan jasad transparan (tembus cahaya) dengan indeks bias yang sama dengan indeks bias cairan suspensi di mana bakteri tersebut hidup (Tarigan, 1988). Bentuk dan ukuran suatu bakteri dapat dipengaruhi oleh faktor lingkungan, seperti temperatur inkubasi dan media pertumbuhan. Biasanya sel-sel bakteri yang berumur muda akan berukuran lebih besar apabila dibandingkan dengan sel-sel yang berumur tua (Sylvia, 2008).
Terdapat beberapa perbedaan karakteristik yang membedakan bentuk koloni yang dimiliki oleh bakteri dan kapang/khamir. Menurut Fardiaz (1992), baik kapang atau khamir tergolong dalam sel eukariotik yang mempunyai inti sel sejati, di mana kapang adalah fungi multiseluler yang mempunyai filamen dan pertumbuhannya pada makanan mudah dilihat karena penampakannya yang berserabut seperti kapas, sedangkan khamir adalah fungi uniseluler yang tidak mempunyai filamen yang pertumbuhannya lebih cepat dibandingkan dengan kapang.
Beberapa bakteri dapat mengoksidasi karbohidrat secara lengkap menjadi CO2 dan H2O, atau memecahnya menjadi asam, alkohol, aldehida, atau keton.
Mikrobia terutama bakteri yang bersifat patogen dapat ditemukan di tanah, air, udara, tanaman, binatang, bahan pangan, peralatan untuk pengolahan, bahkan pada tubuh manusia. Tanaman membawa berbagai jenis mikrobia yang dapat berasal dari mikroflora alami tanaman, baik yang berasal dari lingkungan maupun yang masuk selama pemanenan, distribusi, penanganan pasca panen, pengolahan, serta penyimpanan produk. Pertumbuhan mikrobia terjadi dalam waktu singkat dan pada kondisi yang sesuai, antara lain tersedianya nutrisi, pH, suhu, dan kadar air dalam bahan (Djaafar dan Rahayu, 2007).
Parameter uji mikrobiologi yang dapat menentukan besarnya jumlah mikrobia, khususnya bakteri yang terdapat dalam simplisia adalah Angka Lempeng Total (ALT). Prinsip dari perhitungan ALT dengan metode plate count adalah pertumbuhan bakteri mesofil aerob setelah diinkubasikan dalam perbenihan yang cocok selama 24-48 jam pada suhu 35 ± 1o C (Badan Standarisasi Nasional, 1992). Tujuan utama dilakukannya uji ALT adalah untuk memberikan jaminan bahwa simplisia yang menjadi bahan baku obat tradisional tidak mengandung bakteri patogen dan non-patogen melebihi batas yang ditetapkan.
yang mengandung koloni dalam jumlah yang memenuhi syarat tersebut, maka harus dilakukan sederetan pengenceran dan pencawanan (Hadioetomo, 1985).
Berdasarkan KepMenKes RI No. 661/MenKes/SK/VII/1994, nilai ALT pada simplisia dalam bentuk rajangan adalah tidak lebih dari 107 koloni/gram bahan. Nilai ini juga dapat dijadikan sebagai batas standar keamanan dari produk obat tradisional, sehingga apabila nilai ALT yang didapatkan lebih besar dari batas persyaratan dapat dijelaskan secara deskriptif bahwa bahan baku obat tradisional tersebut mempunyai keamanan dan khasiat yang tidak terjamin untuk dikonsumsi.
E. Landasan Teori
Masyarakat Indonesia banyak menggunakan kekayaan alam dalam pengobatan alternatif, salah satunya adalah dengan menggunakan obat-obat tradisional. Temulawak merupakan salah satu bahan baku dalam pembuatan obat tradisional. Penggunaannya banyak diaplikasikan dalam pengobatan berbagai macam penyakit seperti jaundice, pengerasan empedu, demam, konstipasi, dan penggunaan dalam sediaan infusa yang diberikan pada wanita untuk melancarkan proses laktasi.
dalam rimpang temulawak, terutama bakteri. Bakteri memerlukan lingkungan yang cocok untuk melakukan pertumbuhan dan perkembangan, di mana kondisi lembab karena kandungan air merupakan kondisi yang mendukung pertumbuhan bakteri.
Lama waktu pengeringan dapat menyebabkan simplisia mengalami perubahan-perubahan, baik secara fisik maupun kimia. Lama waktu pengeringan juga dapat menyebabkan aktivitas-aktivitas enzim yang terdapat dalam rimpang terhenti. Ketika terjadi penurunan kandungan air dalam rimpang, maka terjadi penghambatan pertumbuhan bakteri, baik dari jumlah maupun ukurannya.
Bakteri yang tumbuh dapat menyebabkan kualitas simplisia menjadi tidak terjamin karena keberadaan bakteri akan mempengaruhi kesehatan masyarakat apabila rimpang temulawak akan dikonsumsi, sehingga diperlukan waktu pengeringan yang optimal agar didapatkan jumlah cemaran yang berada di bawah batas nilai standar yang telah ditetapkan. Jumlah bakteri yang tumbuh dapat dilihat melalui nilai Angka Lempeng Total (ALT).
dan disentri. Oleh karena itu, keberadaannya sebisa mungkin diminimalkan dengan cara mengontrol proses pengolahan simplisia dengan baik.
Pada penelitian ini dilakukan analisis secara deskriptif komparatif dengan membandingkan nilai ALT hasil penelitian dengan nilai ALT yang ditetapkan oleh KepMenKes RI No : 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 koloni/g. Nilai ALT juga dianalisis dengan menggunakan statistik. Uji normalitas menggunakan uji Shapiro-Wilk karena jumlah sampel yang digunakan kurang dari 50. Uji normalitas dilanjutkan dengan uji Repeated ANOVA apabila nilai signifikansi (p) yang didapatkan > 0,05 yang menyatakan bahwa data berdistribusi normal dan transformasi dilakukan data apabila data yang didapatkan tidak berdistribusi normal (p < 0,05). Uji Friedman dilakukan apabila saat transformasi data didapatkan data yang tidak berdistribusi normal, kemudian dilanjutkan dengan uji Post Hoc dengan menggunakan uji Wilcoxon ketika nilai siginifikansi (p) yang didapatkan < 0,05 pada uji Friedman. Penggunaan uji Post Hoc dilakukan dengan tujuan untuk mengetahui adanya perbedaan bermakna atau tidak bermakna dari waktu pengeringan rimpang temulawak terhadap nilai ALT, sehingga dapat diketahui ada tidaknya pengaruh waktu pengeringan terhadap nilai ALT rimpang temulawak.
F. Hipotesis
Terdapat perbedaan bermakna nilai Angka Lempeng Total (ALT) rimpang temulawak pada berbagai hari pengeringan ke-0, 2, 4, 6, 8, dan 10.
22
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena dilakukan perlakuan terhadap subyek uji, dengan rancangan penelitian acak lengkap pola searah. Nilai Angka Lempeng Total (ALT) yang didapatkan dibandingkan dengan nilai ALT yang ditetapkan dalam KepMenKes RI No : 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 koloni/g sampel, sedangkan untuk melihat pengaruh dari berbagai waktu pengeringan terhadap nilai ALT rimpang temulawak digunakan analisis statistik.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel penelitian
a. Variabel bebas : waktu pengeringan rimpang temulawak hari ke-0, 2, 4, 6, 8, dan 10.
b. Variabel tergantung : nilai ALT rimpang temulawak pada waktu pengeringan hari ke- 0, 2, 4, 6, 8, dan 10.
c. Variabel terkendali : lama inkubasi (24-48 jam), suhu inkubasi (370C), media yang digunakan (Plate Count Agar), asal bahan baku rimpang segar temulawak (Pasar Borobudur, Magelang, Jawa Tengah), umur rimpang (10 bulan), cara pengeringan (menggunakan sinar matahari).
d. Variabel tak terkendali : suhu pengeringan, kelembaban udara pengeringan, dan cuaca pengeringan.
2. Definisi operasional
a. Rimpang segar temulawak adalah rimpang temulawak yang dibeli di Pasar Borobudur, Magelang, Jawa Tengah, pada umur 10 bulan selama bulan September 2010 dan dicuci bersih dengan air mengalir, sehingga didapatkan rimpang segar yang bebas dari kotoran.
c. Waktu pengeringan rimpang temulawak adalah waktu yang digunakan untuk mengurangi kandungan air pada rimpang temulawak, dilakukan selama 10 hari di bawah sinar matahari dan ditutupi dengan kain hitam. Rimpang kering di uji nilai ALT-nya pada hari ke-0, 2, 4, 6, 8, dan 10. d. Angka Lempeng Total (ALT) adalah jumlah koloni bakteri mesofilik aerob
dalam tiap 1 g sampel rimpang temulawak yang ditumbuhkan pada suhu 370C selama 24 - 48 jam, dan dilakukan dengan perlakuan duplo dengan tingkat pengenceran mulai dari 10-1 sampai dengan 10-6, kemudian hasilnya dihitung berdasarkan cara perhitungan dalam Standar Nasional Indonesia No. 01-2897-1992.
C. Bahan Penelitian
Rimpang temulawak didapatkan dari pedagang pengumpul di Pasar Borobudur, Magelang, Jawa Tengah, dipanen pada umur 10 bulan selama bulan September 2010; media Plate Count Agar (PCA); larutan pengencer Peptone Dilution Fluid (PDF); Triphenyl Tetrazolium Chloride (TTC) 1%; alkohol 70% dan aquadest steril.
D. Alat Penelitian
counter (Electric Bactery Colony Counter Health), bunsen, Microbiological Safety Cabinet, dan blender.
E. Tata Cara Penelitian
1. Pengumpulan rimpang temulawak
Rimpang temulawak diambil dari pedagang pengumpul di Pasar Borobudur, Magelang. Rimpang diambil selama bulan September 2010 sebanyak 5 kg untuk diolah ke tahap pengolahan simplisia (identifikasi, pencucian, perajangan, dan pengeringan rimpang temulawak). Rimpang temulawak yang dipilih adalah rimpang yang dipanen pada umur 10 bulan selama bulan September 2010, tidak bertunas, permukaan dalam keadaan kering, hanya sedikit kotoran yang menempel, dan dalam keadaan yang segar. 2. Identifikasi rimpang temulawak
cm, tebal 2-5 mm, permukaan luar berkerut, warna coklat kuning sampai coklat, bidang irisan berwarna coklat kuning buram, melengkung tidak beraturan, tidak rata, tebal 3 mm sampai 4 mm. Bekas patahan terdapat amilum, kuning jingga sampai coklat jingga terang.
3. Pencucian dan perajangan rimpang temulawak
Rimpang temulawak dicuci dengan air mengalir dan dibersihkan dari tanah dan kotoran lain yang melekat dengan penyikatan dan kemudian diangin-anginkan untuk menghilangkan tetes air sisa pencucian. Setelah ditiriskan, rimpang kemudian dirajang dengan tebal ± 7-8 mm (Sembiring, 2007).
4. Pengeringan rimpang temulawak
Pengeringan rimpang dilakukan dengan menggunakan sinar matahari. Rimpang yang sudah dirajang diletakkan di atas tikar dan ditutup dengan menggunakan kain hitam. Tujuan penggunaan kain hitam saat proses pengeringan adalah untuk mempercepat proses penguapan air yang terdapat dalam rimpang sehingga rimpang dapat kering dengan waktu yang lebih singkat. Pengeringan dilakukan selama 10 hari, namun apabila rimpang belum dapat dipatahkan selama pengeringan 10 hari, maka waktu pengeringan dilanjutkan hingga didapatkan rimpang yang mudah dipatahkan.
5. Pembuatan serbuk rimpang kering temulawak
alkohol 70%, kemudian dilakukan pengujian nilai ALT pada serbuk rimpang temulawak tersebut.
6. Pengujian ALT rimpang kering temulawak (Badan Standarisasi Nasional,
1992; Badan Pengawas Obat dan Makanan RI, 2006)
Rimpang temulawak yang sudah mengalami proses pencucian dan perajangan, dikeringkan selama 10 hari dan diuji ALT pada waktu pengeringan hari ke-0, 2, 4, 6, 8, dan 10. Adapun tahap-tahap dalam pengujian ALT adalah sebagai berikut:
a. Pembuatan larutan pengencer Pepton Dilution Fluid (PDF)
Sebanyak 15 g pepton dimasukkan ke dalam labu takar 1 L dan ditambahkan aquadest sampai volume 1 L, kemudian disterilkan dengan autoklaf pada suhu 1210C selama 15 menit.
b. Penyiapan dan homogenisasi sampel
Sampel yang digunakan untuk homogenisasi adalah rimpang temulawak yang sudah dikeringkan pada hari ke-0, 2, 4, 6, 8, dan 10. Rimpang kering temulawak ditimbang sebanyak 1 g dalam kondisi yang steril. Selanjutnya serbuk yang sudah ditimbang dimasukkan ke dalam labu takar 10 ml dan ditambahkan larutan pengencer PDF sampai volume 10 ml, dihomogenkan dan didapatkan sampel dengan konsentrasi 10-1.
c. Pembuatan media Plate Count Agar (PCA)
tersebut kemudian disterilkan dengan autoklaf pada suhu 1210C selama 15 menit.
d. Pengenceran serbuk rimpang temulawak
Dari masing-masing sampel (serbuk rimpang temulawak) pada tahap penyiapan dan homogenisasi sampel (konsentrasi 10-1), dalam kondisi steril dipipet sebanyak 1 ml dan kemudian dimasukkan ke dalam tabung reaksi yang sudah berisi 9 ml PDF steril, dihomogenkan menggunakan vortex sehingga didapatkan pengenceran dengan konsentrasi 10-2. Dilakukan demikian hingga konsentrasi 10-6.
e. Uji Angka Lempeng Total (ALT)
7. Cara perhitungan ALT (Badan Standarisasi Nasional, 1992)
Perhitungan hasil uji ALT dilakukan dengan cara sebagai berikut:
a. Dipilih cawan petri dari satu pengenceran yang menunjukkan jumlah koloni antara 25-250 setiap cawan, dihitung semua koloni dalam cawan petri dan dihitung rata-rata jumlah koloni, dikalikan dengan faktor pengenceran dan hasilnya dinyatakan sebagai jumlah bakteri per mililiter atau gram.
b. Jika salah satu dari dua cawan petri terdapat jumlah koloni lebih kecil dari 25 atau lebih besar dari 250, dihitung rata-rata jumlah koloni, dikalikan dengan faktor pengenceran dan hasilnya dinyatakan sebagai jumlah bakteri per mililiter atau gram.
c. Jika hasil dari dua pengenceran jumlahnya berturut-turut terletak antara 25-250 koloni, dihitung jumlah koloni dari masing-masing pengenceran seperti yang disebut pada butir a dan b di atas, dan dihitung rata-rata jumlah koloni dari ke dua pengenceran tersebut. Jika jumlah yang tertinggi lebih besar dari dua kali jumlah yang terkecil, jumlah yang lebih kecil dinyatakan sebagai jumlah bakteri per mililiter atau gram.
d. Jika rata-rata jumlah koloni masing-masing cawan petri tidak terletak antara 25 dan 250 koloni, dihitung jumlah koloni seperti pada butir a dan b di atas, dan dinyatakan sebagai jumlah bakteri perkiraan per mililiter atau g.
atau 8 sektor. Dihitung rata-rata jumlah koloni dalam satu cawan petri dan dikalikan dengan faktor pengenceran. Hasilnya dinyatakan sebagai jumlah bakteri perkiraan per mililiter atau g.
f. Jika dalam 1/8 bagian cawan petri terdapat lebih dari 200 koloni, maka jumlah koloni yang didapat = 8 x 200 (1000), dikalikan dengan faktor pengenceran dan hasilnya dinyatakan sebagai jumlah bakteri perkiraan per mililiter atau gram lebih besar dari jumlah yang didapat (lebih besar dari 1600 x faktor pengenceran).
g. Jika tidak ada koloni yang tumbuh dalam cawan petri maka jumlah bakteri perkiraan dinyatakan lebih kecil dari satu dikalikan dengan pengenceran yang terendah (< 10).
h. Jika hanya terjadi satu perambatan (seperti rantai) maka koloni dianggap satu. Tetapi bila satu atau lebih rantai terbentuk dan yang berasal dari sumber yang berpisah-pisah, maka tiap sumber dihitung sebagai satu koloni.
8. Menghitung dan membulatkan angka
Dalam melaporkan jumlah koloni atau jumlah koloni perkiraan hanya dua angka penting yang digunakan, yaitu angka yang pertama dan kedua (dimulai dari kiri), sedangkan angka yang ketiga diganti dengan 0 apabila kurang dari 5 dan apabila 5 atau lebih dijadikan 1 yang ditambahkan pada angka kedua.
F. Analisis Hasil
Data pada penelitian ini merupakan data yang berupa nilai ALT yang diperoleh dari hasil pengamatan dan perhitungan ALT pada waktu pengeringan hari ke-0, 2, 4, 6, 8, dan 10. Perhitungan ALT didasarkan pada Standar Nasional Indonesia (SNI) No. 01-2897-1992 tentang Cara Uji Cemaran Mikroorganisme.
Pada analisis deskriptif komparatif, nilai ALT yang didapatkan dalam penelitian dibandingkan dengan persyaratan nilai ALT yang terdapat dalam KepMenKes RI No : 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 koloni/gram bahan untuk sediaan dalam bentuk rajangan, sedangkan untuk melihat ada tidaknya perbedaan secara bermakna atau tidak bermakna dari waktu pengeringan terhadap nilai ALT rimpang temulawak, maka dilakukan analisis statistik. Langkah pertama yang dilakukan untuk melakukan analisis statistik adalah dengan melakukan uji normalitas.
Uji normalitas dapat dilakukan dengan menggunakan uji Kolmogorov-Smirnov untuk sampel yang lebih besar dari 50, sedangkan uji Shapiro-Wilk untuk sampel yang kurang dari 50. Dalam penelitian ini digunakan uji Shapiro-Wilk karena sampel yang digunakan kurang dari 50. Besarnya sampel dalam penelitian ini yaitu enam sampel yang dihitung berdasarkan pengambilan sampel rimpang temulawak pada pengeringan hari ke-0, 2, 4, 6, 8, dan 10.
> 0,05, apabila nilai signifikansi kurang dari nilai tersebut maka data yang didapatkan tidak berdistribusi normal.
33
HASIL DAN PEMBAHASAN
Besarnya penggunaan obat tradisional di Indonesia membuktikan bahwa obat tradisional memberikan dampak yang baik bagi kesehatan. Salah satu bahan baku obat tradisional yang banyak digunakan di Indonesia sebagai pengobatan alternatif adalah rimpang temulawak. Temulawak sering digunakan untuk mengobati penyakit hati seperti jaundice dan pengerasan empedu, demam, konstipasi, dan penggunaan dalam sediaan infusa yang diberikan pada wanita untuk melancarkan proses laktasi (Perry, 1980).
Peningkatan kualitas obat tradisional penting untuk diperhatikan karena dampak positif dari penggunaannya di kalangan masyarakat. Peningkatan kualitas ini dilakukan guna menjamin kualitas, keamanan dan khasiat bahan baku yang akan digunakan dalam pengobatan di masyarakat. Kualitas bahan baku obat tradisional dapat dilihat dari penampakan fisik simplisia, di mana tidak terdapat perubahan-perubahan yang tidak diinginkan seperti penampilan, tekstur, rasa, dan bau yang terdapat pada makanan (Hariyati, 2008).
simplisia tersebut mempunyai khasiat yang baik untuk dikonsumsi oleh masyarakat.
Pengolahan simplisia merupakan salah satu cara yang dapat dilakukan dalam rangka meningkatkan kualitas obat tradisional. Proses pengolahan simplisia dapat dijadikan suatu standar yang memperlihatkan bahwa bahan baku obat tradisional yang digunakan mempunyai kualitas, keamanan dan khasiat yang terjamin. Tahap-tahap dalam pengolahan simplisia yang dapat dilakukan antara lain adalah pengumpulan bahan baku, sortasi basah, pencucian, perajangan, pengeringan dan penyimpanan.
Pengolahan simplisia di Indonesia masih banyak yang dilakukan secara tradisional, terutama proses pengeringan. Pengeringan dilakukan dengan cara menjemur simplisia di bawah sinar matahari guna mengurangi kandungan air yang terdapat dalam simplisia. Pengeringan dilakukan di bawah sinar matahari dengan tujuan untuk mengkondisikan dengan cara pengeringan tradisional yang masih banyak dilakukan oleh pedagang pengumpul, di mana rimpang-rimpang tersebut kemudian didistribusikan kepada pengelola rimpang temulawak untuk dijadikan bahan baku dalam pembuatan obat tradisional, baik industri rumah tangga maupun industri dengan skala besar.
akan mempengaruhi kualitas dan keamanan simplisia. Apabila terdapat bakteri pada simplisia, maka keberadaannya harus berada pada batas standar keamanan yang sudah ditetapkan.
Besarnya jumlah bakteri dalam simplisia dapat dilihat dengan melakukan uji Angka Lempeng Total (ALT). Batas standar keamanan nilai ALT yang ditetapkan oleh KepMenKes RI No. 661/MenKes/SK/VII/1994 untuk sediaan dalam bentuk rajangan adalah tidak lebih dari 107 CFU/g bahan.
A.Pengumpulan Bahan
Rimpang temulawak yang digunakan dalam penelitian ini didapatkan dari salah satu pedagang pengumpul di Pasar Borobudur, Magelang, Jawa Tengah. Rimpang tersebut dipanen pada umur ± 10 bulan selama bulan September 2010. Rimpang temulawak yang didapatkan dari pedagang pengumpul dipilih bagian rimpang yang segar dan tidak bertunas, permukaan rimpang dalam keadaan yang kering, dan hanya sedikit kotoran-kotoran yang menempel. Rimpang-rimpang yang sudah dipilih tersebut kemudian disiapkan untuk masuk dalam tahap pengolahan.
B.Identifikasi Rimpang Temulawak (Curcumae Rhizoma)
dan kemudian dibandingkan dengan ciri-ciri rimpang temulawak yang terdapat dalam Materia Medika Indonesia (MMI) Jilid III (Depkes RI, 1979).
Secara organoleptis, rimpang temulawak yang digunakan dalam penelitian ini memiliki bau khas aromatis temulawak, rasa agak pahit dan berwarna oranye. Ciri-ciri organoleptis ini sesuai dengan yang tertulis pada Depkes RI (1979).
Berdasarkan pengamatan secara makroskopis, diketahui bahwa rimpang temulawak yang digunakan dalam penelitian ini berbentuk bundar lonjong, keras, dan ringan. Rimpang berdiameter ± 4-6 cm dengan tebal ± 2-5 mm. Kulit rimpang berwarna kuning kecoklatan sampai dengan coklat dengan permukaan yang melengkung dan tidak beraturan atau berkerut-kerut. Hasil pengamatan secara makroskopis ini menunjukkan hasil yang sesuai dengan Depkes RI (1979). Keseluruhan hasil identifikasi ini menyatakan bahwa rimpang yang digunakan dalam penelitian ini merupakan rimpang temulawak (Curcuma xanthorrhiza Roxb.)
Hasil identifikasi rimpang temulawak adalah sebagai berikut :
Gambar 1. Rimpang segar temulawak dari Pasar Borobudur Magelang Keterangan gambar : rimpang temulawak dengan permukaan luar yang berkerut,
A B
C
Gambar 2. Irisan rimpang temulawak
A = Irisan rimpang temulawak dengan bentuk kepingan dan warna rimpang temulawak, B = Irisan rimpang temulawak dengan tebal rimpang temulawak, C =
Irisan rimpang temulawak dengan diameter rimpang temulawak
C.Pengolahan Rimpang Temulawak
Proses pengolahan simplisia tidak hanya dapat menekan pertumbuhan bakteri, namun juga dapat menyebabkan terjadinya reaksi enzimatis pada bahan pangan. Enzim yang terdapat dalam bahan pangan dapat memungkinkan terjadinya reaksi kimia dengan lebih cepat, dan juga dapat mengakibatkan bermacam-macam perubahan pada komposisi bahan pangan. Salah satu reaksi enzimatis yang dapat terjadi pada bahan pangan adalah reaksi browning (pencoklatan). Menurut Winarno (cit. Aziya, 2001), browning dapat terjadi jika bahan pangan mengalami perlakuan mekanis, yang biasanya dapat mengakibatkan perubahan penampilan yang terkadang menyebabkan penurunan mutu.
Kebanyakan bakteri hidup dalam tanah, sehingga apabila tanah tersebut masih menempel pada simplisia yang telah dipanen dan tidak dilakukan pengolahan dengan baik maka keberadaannya akan mempengaruhi kualitas dan keamanan simplisia. Oleh karena itu, teknik pengolahan simplisia yang baik diperlukan untuk mendapatkan rimpang temulawak yang bermutu, baik pada kualitas, keamanan, maupun khasiatnya. Simplisia dengan mutu yang baik akan mempengaruhi kondisi kesehatan masyarakat. Apabila rimpang temulawak berada pada batas keamanan yang ditetapkan, maka rimpang dapat dikatakan terjamin dan layak untuk dikonsumsi oleh masyarakat karena keberadaan bakteri dalam rimpang temulawak sudah berada pada batas yang diharapkan.
1. Sortasi basah
tinggi, oleh karena itu pembersihan simplisia dari tanah yang terikut dapat mengurangi jumlah mikrobia awal (Depkes RI, 1985). Dalam tahap ini, rimpang temulawak yang masih mengandung kotoran ataupun bahan-bahan asing seperti akar, pasir, debu, dan binatang dipisahkan dari bagian rimpang agar tidak terikut pada tahap pencucian. Kotoran-kotoran yang masih ada dalam rimpang dapat memiliki cemaran mikrobia, salah satunya bakteri. Oleh karena itu, keberadaan kotoran-kotoran tersebut harus diminimalkan agar tidak mempengaruhi nilai Angka Lempeng Total (ALT) pada saat pengujian.
2. Pencucian
Proses pencucian dilakukan setelah proses sortasi basah, di mana pencucian rimpang temulawak dilakukan dengan dialirkan di bawah air yang mengalir sambil disikat. Menurut Depkes RI (1985), pencucian dapat dilakukan dengan menggunakan air bersih, misalnya dari mata air, air sumur, atau air PAM. Proses ini bertujuan untuk menghilangkan kotoran-kotoran dan mengurangi cemaran mikrobia yang melekat pada bahan (Sembiring, 2007). Proses pencucian dapat meninggalkan 42% jumlah mikrobia dari jumlah awal (Depkes RI, 1985).
3. Perajangan
permukaan yang luas, sehingga bahan-bahan tersebut harus disebarkan dalam lapisan-lapisan yang lebih tipis. Apabila lapisan rimpang temulawak yang akan dikeringkan tidak sesuai dengan tebal rimpang yang ditentukan maka kelembaban yang terdapat dalam rimpang dapat mempengaruhi lamanya waktu pengeringan. Tingkat kelembaban yang tinggi akan menyebabkan rimpang temulawak mengalami penyerapan air, sehingga nilai aw akan meningkat
(Fardiaz, 1992). Menigkatnya nilai aw memberikan kesempatan pada bakteri
untuk dapat tumbuh dan berkembang dengan baik, karena bakteri lebih mudah untuk melakukan pertumbuhan pada nilai aw yang mendekati 1,00 (Tarigan,
1988).
Perajangan yang terlalu tipis dapat mengurangi kandungan zat aktif yang terkandung dalam rimpang, sedangkan apabila terlalu tebal pengurangan kadar air dalam rimpang akan cukup sulit sehingga membutuhkan waktu pengeringan yang lama dan kemungkinan besar bahan akan mudah untuk ditumbuhi oleh cemaran. Ketebalan perajangan untuk rimpang temulawak adalah sebesar 7-8 mm (Sembiring, 2007). Proses perajangan yang dilakukan pada umumnya tidak menambah jumlah cemaran mikrobia yang terdapat dalam rimpang, karena proses perajangan dilakukan untuk mempermudah proses pengeringan dan mempercepat waktu pengeringan (Depkes RI, 1985). 4. Pengeringan
sinar matahari. Pengeringan rimpang ditujukan untuk mengurangi kandungan air yang terdapat dalam rimpang sehingga dapat mencegah pertumbuhan cemaran mikrobia seperti bakteri dan kapang/khamir. Kandungan air yang tinggi dalam rimpang akan memberikan kesempatan pada mikrobia untuk tumbuh dan berkembang.
Pengeringan dilakukan dengan meletakkan rimpang temulawak di atas tikar, disebarkan secara merata dan tidak ada yang saling menumpuk satu sama lain. Tujuannya adalah agar proses penguapan rimpang dapat berjalan dengan baik. Selama masa pengeringan berlangsung, digunakan kain hitam untuk menutupi seluruh bagian rimpang. Tujuan penggunaan kain hitam ini adalah untuk memudahkan penyerapan aliran panas dan membiarkan aliran panas tersebar merata di seluruh permukaan rimpang. Penutupan dengan kain hitam juga ditujukan untuk menghindari benda-benda asing yang berasal dari udara bebas yang dapat menempel pada rimpang oleh karena kondisi tempat pengeringan rimpang temulawak. Apabila kotoran-kotoran tersebut menempel pada rimpang akan mempengaruhi nilai ALT yang didapatkan pada saat pengujian.
dalam penelitian ini adalah 10 hari (waktu pengeringan minimal), di mana selama masa pengeringan tersebut diharapkan kadar air yang terdapat dalam rimpang sudah mencapai ± 8-10%. Salah satu tanda yang dapat menyatakan bahwa kadar air dalam rimpang sudah mencapai ± 8-10% dan pengeringan dapat dihentikan adalah apabila rimpang dapat dipatahkan dengan mudah (Sembiring, 2007).
Lama waktu pengeringan akan mempengaruhi aktivitas enzim yang terdapat dalam rimpang temulawak, di mana aktivitas enzim ini akan mempengaruhi besarnya jumlah pertumbuhan bakteri yang terdapat dalam media pertumbuhan. Menurut Tarigan (1988), air berperan sebagai bahan pelarut pada reaksi-reaksi metabolisme dan juga untuk kebutuhan kelangsungan hidupnya, sehingga dengan melakukan pengeringan, aktivitas enzim pada sel bakteri dapat dihentikan. Hal ini menyebabkan pertumbuhan bakteri juga dapat ditekan.
Penekanan pertumbuhan bakteri ini memberikan dampak terhadap kualitas dan keamanan rimpang temulawak sebagai bahan baku obat tradisional. Keamanan rimpang temulawak dapat dilihat dari tidak adanya pertumbuhan bakteri yang terdapat dalam media pertumbuhan, atau jika terdapat pertumbuhan bakteri maka jumlahnya harus berada pada batas keamanan yang sudah ditetapkan.
dimaksudkan untuk melihat pada hari pengeringan yang ke berapa nilai ALT akan memberikan perbedaan bermakna terhadap hari pengeringan yang lain, karena diharapkan selama 10 hari pengeringan tersebut nilai ALT yang didapatkan bisa memenuhi persyaratan yang ditetapkan oleh KepMenKes RI No. 661/MenKes/SK/VII/1994 yaitu tidak lebih dari 107 CFU/g bahan.
Proses pengeringan di bawah sinar matahari akan sangat bergantung pada faktor suhu, cuaca pengeringan, dan kelembaban udara lingkungan tempat dilakukannya proses pengeringan. Pada dasarnya faktor-faktor ini tidak dapat dikendalikan secara langsung dan menjadi salah satu kelemahan dari pengeringan di bawah sinar matahari. Pengeringan dengan menggunakan sinar matahari juga dipengaruhi oleh faktor kelembaban udara, karena harus dilakukan penyimpanan, sehingga proses pengeringan dilanjutkan pada keesokan harinya. Selama masa penyimpanan, rimpang temulawak dapat mengikat air yang terdapat pada lingkungan tempat penyimpanan.
5. Sortasi kering
Dalam tahap ini, rimpang yang sudah dikeringkan dipisahkan kembali dari kotoran-kotoran asing yang mungkin terdapat selama pengeringan berlangsung, misalnya pasir, kerikil, atau kotoran lainnya sehingga didapatkan rimpang temulawak murni. Apabila pengotor ini masih terdapat dalam rimpang, maka keberadaannya dapat mempengaruhi hasil dari nilai ALT rimpang temulawak. Rimpang temulawak pada pengeringan hari ke-0, 2, 4, 6, 8, dan 10 diambil untuk dilakukan sortasi kering dan kemudian digunakan sebagai sampel untuk pengujian ALT.
D.Uji Angka Lempeng Total (ALT)
Simplisia adalah bahan alamiah yang digunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, simplisia merupakan bahan yang dikeringkan (Depkes RI, 1985). Salah satu macam simplisia yang banyak digunakan di Indonesia adalah rimpang temulawak. Untuk memastikan bahwa rimpang temulawak yang digunakan mempunyai kualitas, keamanan, dan khasiat yang terjamin untuk diolah menjadi obat tradisional, dapat dilakukan pengujian Angka Lempeng Total (ALT).
diinkubasikan dalam kondisi yang sesuai selama 24-48 jam pada suhu 35 ± 1oC (Badan Standarisasi Nasional, 1992).
1. Homogenisasi sampel
Homogenisasi sampel merupakan tahap awal dari langkah pengujian ALT. Homogenisasi dilakukan untuk memperoleh distribusi bakteri yang merata dalam sampel uji. Dasar dilakukannya homogenisasi adalah untuk membebaskan sel-sel bakteri yang terlindung oleh partikel dalam sampel dan untuk menggiatkan kembali sel-sel bakteri yang mungkin terganggu kelangsungan hidupnya karena kondisi yang kurang menguntungkan dalam sampel (Hadioetomo, 1985).
Media homogenisasi yang digunakan adalah Pepton Dilution Fluid (PDF). Pepton merupakan salah satu sumber nitrogen (N) kompleks yang dapat digunakan sebagai sumber nutrisi dalam media pertumbuhan yang sesuai untuk bakteri (Fakultas Kedokteran UGM, 2000). Proses homogenisasi menghasilkan suspensi dengan konsentrasi 10-1 yang akan digunakan dalam tahap pengenceran.
2. Pengenceran sampel
masing-masing pengenceran digunakan untuk uji ALT. Dengan melakukan pengenceran, perhitungan nilai ALT akan lebih mudah karena semakin tinggi tingkat pengenceran akan didapatkan koloni-koloni bakteri yang terpisah dan berada dalam range 25-250 koloni (BPOM, 2006).
3. Uji Angka Lempeng Total (ALT) rimpang kering temulawak
Uji Angka Lempeng Total (ALT) merupakan salah satu parameter dalam menentukan besarnya jumlah mikrobia, khususnya bakteri. Uji ini dilakukan untuk memberikan informasi dan kepastian kepada masyarakat bahwa bahan baku obat tradisional yang digunakan mempunyai keamanan yang baik untuk dikonsumsi. Metode perhitungan jumlah bakteri dilakukan dengan cara viable count, di mana dalam metode ini diasumsikan bahwa mikrobia yang hidup dalam suspensi akan tumbuh menjadi satu koloni setelah diinkubasikan dalam media biakan agar dan lingkungan yang sesuai (Lay, 1994).
Salah satu cara perhitungan yang digunakan dalam metode viable count adalah dengan metode taburan (pour plate). Metode taburan digunakan karena pada dasarnya bakteri yang terdapat dalam sampel rimpang temulawak tidak diketahui sifatnya akan kebutuhannya pada O2, sehingga metode ini baik
untuk digunakan dalam menghitung jumlah sel yang hidup baik aerob ataupun anaerob karena dalam metode ini akan terlihat apakah bakteri tumbuh di atas permukaan media agar atau di seluruh media agar (Tarigan, 1988).
seperti media dan alat-alat bebas dari segala macam kontaminan, sehingga akan berpengaruh pada besarnya nilai ALT yang akan dihasilkan. Selain untuk menjaga media dari kontaminasi, juga untuk memastikan bahwa yang tumbuh pada media benar-benar berasal dari sampel rimpang kering temulawak.
Media padat yang digunakan untuk pertumbuhan bakteri adalah Plate Count Agar (PCA) yang ditambah dengan pereaksi Triphenyl Tetrazolium Chloride (TTC) 1%. Penggunaan media PCA dalam uji ALT sebagai media
pertumbuhan bakteri karena dalam media PCA mengandung pepton yang merupakan salah satu jenis protein yang dibutuhkan oleh sel bakteri untuk tetap hidup. Komponen pepton juga berfungsi sebagai buffer yang dapat mempertahankan pH dalam keadaan netral (Setiawan, 2009).
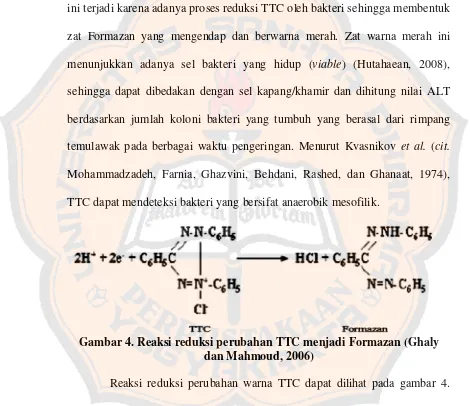
A B
C
Gambar 3. Hasil uji ALT rimpang temulawak
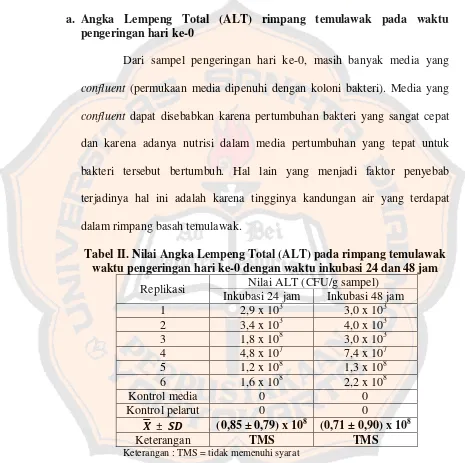
Gambar 1 memperlihatkan media pertumbuhan PCA yang ditambahkan TTC 1% dan dibandingkan dengan kontrol media dan kontrol pelarut. Penambahan TTC 1% dalam penelitian ini adalah sebagai indikator untuk melihat perubahan warna pada koloni bakteri, di mana perubahan warna ini terjadi karena adanya proses reduksi TTC oleh bakteri sehingga membentuk zat Formazan yang mengendap dan berwarna merah. Zat warna merah ini menunjukkan adanya sel bakteri yang hidup (viable) (Hutahaean, 2008), sehingga dapat dibedakan dengan sel kapang/khamir dan dihitung nilai ALT berdasarkan jumlah koloni bakteri yang tumbuh yang berasal dari rimpang temulawak pada berbagai waktu pengeringan. Menurut Kvasnikov et al. (cit. Mohammadzadeh, Farnia, Ghazvini, Behdani, Rashed, dan Ghanaat, 1974), TTC dapat mendeteksi bakteri yang bersifat anaerobik mesofilik.
Gambar 4. Reaksi reduksi perubahan TTC menjadi Formazan (Ghaly dan Mahmoud, 2006)
2006). Ikatan NH dan HCl yang terbentuk pada zat Formazan menandakan terjadinya reaksi reduksi karena reaksi reduksi berlangsung ketika terjadi pengambilan elektron oleh suatu zat (Brady, 1999).
Kontrol dalam penelitian ini bertujuan untuk memastikan bahwa media dan pelarut yang digunakan benar-benar steril. Kontrol yang dibuat adalah kontrol media dan kontrol negatif. Tujuan dari pembuatan kontrol media adalah untuk melihat bahwa media yang digunakan tidak terkontaminasi mikrobia sehingga pada kelompok perlakuan dapat dipastikan bahwa mikrobia yang tumbuh adalah berasal dari sampel rimpang temulawak, sedangkan tujuan dari pembuatan kontrol negatif atau kontrol pelarut adalah untuk melihat bahwa di dalam pelarut yang digunakan dalam proses homogenisasi sampel juga tidak terdapat mikrobia. Kontrol media maupun kontrol negatif dalam penelitian ini tidak menunjukkan adanya pertumbuhan bakteri, sehingga dapat disimpulkan bahwa koloni-koloni bakteri yang tumbuh berasal dari rimpang kering temulawak. Gambar 3B dan 3C menunjukkan bahwa baik pada kontrol media ataupun kontrol negatif tidak terdapat pertumbuhan bakteri atau cemaran mikrobia lainnya, begitu juga pada kontrol media dan kontrol negatif pada sampel pengeringan hari ke-0, 2, 4, 6, dan 8.
dilakukan agar sisa uap air yang terdapat dalam cawan petri tidak menetes pada media dan justru dapat menambah kontaminasi yang tumbuh dalam media. Sampel diinkubasikan selama 24-48 jam.
a. Angka Lempeng Total (ALT) rimpang temulawak pada waktu pengeringan hari ke-0
Dari sampel pengeringan hari ke-0, masih banyak media yang confluent (permukaan media dipenuhi dengan koloni bakteri). Media yang confluent dapat disebabkan karena pertumbuhan bakteri yang sangat cepat
dan karena adanya nutrisi dalam media pertumbuhan yang tepat untuk bakteri tersebut bertumbuh. Hal lain yang menjadi faktor penyebab terjadinya hal ini adalah karena tingginya kandungan air yang terdapat dalam rimpang basah temulawak.
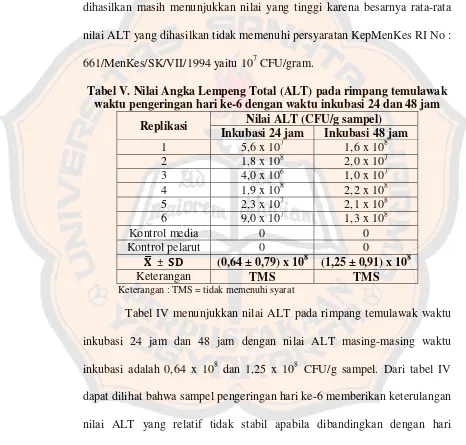
Tabel II. Nilai Angka Lempeng Total (ALT) pada rimpang temulawak waktu pengeringan hari ke-0 dengan waktu inkubasi 24 dan 48 jam
Replikasi Nilai ALT (CFU/g sampel) Inkubasi 24 jam Inkubasi 48 jam
1 2,9 x 103 3,0 x 103
Keterangan : TMS = tidak memenuhi syarat
nilai ALT yang diperoleh adalah 0,85 x 108 CFU/g sampel pada waktu inkubasi 24 jam dan 0,71 x 108 CFU/g sampel pada waktu inkubasi 48 jam dengan nilai simapngan deviasi (SD) yang cukup besar. Istilah CFU (Colony Forming Units) digunakan ketika koloni yang tumbuh tidak hanya berasal dari satu sel mikrobia, karena beberapa sel mikrobia yang membentuk satu kelompok (populasi) (Lay, 1994).
Simpangan deviasi menunjukkan besarnya keragaman sampel pada tiap pengulangan (replikasi). Nilai SD yang besar juga dapat menandakan bahwa data yang diperoleh pada tiap replikasi tidak memiliki distribusi data yang normal. Hal ini didukung oleh hasil analisis statistik yang memberikan nilai signifikansi (p) dibawah 0,05, baik pada waktu inkubasi 24 jam maupun 48 jam.
b. Angka Lempeng Total (ALT) rimpang temulawak pada waktu pengeringan hari ke-2
Pada sampel rimpang kering temulawak pengeringan hari ke-2, rimpang temulawak sudah mengalami pengurangan kadar air karena adanya proses penguapan dari pengeringan di bawah sinar matahari. Berkurangnya kandungan air yang terdapat dalam rimpang temulawak tidak menjamin bahwa nilai ALT yang dihasilkan juga akan mengalami penurunan. Hal ini ditunjukkan dengan hasil nilai ALT pada sampel pengeringan hari ke-2 yang menunjukkan peningkatan dari pengeringan hari ke-0, baik pada waktu inkubasi 24 jam dan 48 jam.
Tabel III. Nilai Angka Lempeng Total (ALT) pada rimpang temulawak waktu pengeringan hari ke-2 dengan waktu inkubasi 24 dan 48 jam
Replikasi Nilai ALT (CFU/g sampel) Inkubasi 24 jam Inkubasi 48 jam
1 1,7 x 108 2,6 x 108
Keterangan : TMS = tidak memenuhi syarat
Nilai rata-rata ALT menunjukkan adanya peningkatan apabila dibandingkan dengan nilai rata-rata ALT pada pengeringan hari ke-0 yaitu 1,5 x 108 CFU/g sampel untuk waktu inkubasi 24 jam dan 2,1 x 108 CFU/g sampel untuk waktu inkubasi 48 jam. Nilai SD yang didapatkan pada sampel pengeringan hari ke-2 yang dihasilkan lebih kecil jika dibandingkan dengan pengeringan hari ke-0. Hal ini dikarenakan pada pengeringan hari ke-2 memberikan range keterulangan yang lebih stabil pada tiap replikasi. Dari tabel II dapat dilihat baik pada inkubasi 24 jam maupun 48 jam, nilai ALT yang diperoleh tidak memenuhi persayaratan KepMenKes RI No. 661/MenKes/SK/VII/ 1994 yaitu 107 koloni/g.
c. Angka Lempeng Total (ALT) rimpang temulawak pada waktu pengeringan hari ke-4