UJI ANGKA LEMPENG TOTAL RIMPANG BASAH, RIMPANG KERING, DAN EKSTRAK ETANOLIK TEMULAWAK
(Curcuma xanthorrhiza Roxb.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Maria Diyan Monica NIM : 068114119
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
Yang diajukan oleh : Maria Diyan Monica NIM : 068114119
Telah disetujui oleh :
Dosen Pembimbing
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: Nama : Maria Diyan Monica
Nomor Mahasiswa : 068114119
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Universitas Sanata Dharma karya ilmiah saya yang berjudul:
Uji Angka Lempeng Total Rimpang Basah, Rimpang Kering, dan Ekttrak Etanolik Temulawak (Curcuma xanthorrhiza Roxb.)
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 17 Februari 2010
Yang menyatakan
“Uji Angka Lempeng Total Rimpang Basah, Rimpang Kering, dan Ekstrak
Etanolik Temulawak (Curcuma xanthorrhiza Roxb.)”.
Skripsi ini disusun untuk memenuhi salah satu syarat bagi penulis dalam memperoleh gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penyusunan hingga terselesaikannya skripsi ini tentu saja tidak terlepas dari arahan, bimbingan, dan bantuan dari berbagai pihak, yang tanpa mereka skripsi ini tidak mungkin terwujud. Oleh karena itu, penulis ingin mengucapkan terimakasih kepada:
1. Ibu Erna Tri Wulandari, M.Si., Apt., selaku dosen pembimbing yang telah memberikan arahan dan dukungan dalam penyusunan skripsi ini.
2. Ibu Maria Dwi Budi Jumpowati, S.Si., selaku dosen penguji atas bimbingan dan perhatiannya.
3. Ibu Yustina Sri Hartini, M.Si., Apt., selaku dosen penguji atas bimbingan dan perhatiannya.
4. Segenap dosen yang telah memberikan bimbingan dan bantuan dalam bentuk apapun kepada penulis.
6. Mas Sarwanto, Mas Wagiran, dan Mas Sigit serta segenap karyawan Fakultas Farmasi Sanata Dharma yang telah memberikan begitu banyak bantuan dan kemudahan dalam proses pengerjaan skripsi ini.
7. Orang tuaku tercinta, mama dan papa atas segala doa, dukungan, dan pengorbanannya, serta seluruh keluarga terutama kakak dan adikku, dan Garbo atas segala perhatian dan bantuannya.
8. Teman-teman angkatan 2006, terutama 2006 FST atas segenap kebersamaan selama ini.
9. Teman-teman seperjuangan : Krismawulan, Dwi, Thomas, Joice, Melia, Wulan, dan Eka, terimakasih untuk kebersamaan dalam suka dan duka.
10.Teman Kost “Putri Ayu”, terutama Nona, Wiwik, Rinda, Susi, yang banyak memberi semangat dan senyuman.
11.Teman, rekan, dan semua pihak yang tidak dapat disebutkan satu per satu oleh penulis, yang telah memberikan bantuan baik langsung maupun tidak.
Penulis menyadari adanya keterbatasan dan kekurangan dari penulis, sehingga skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang membangun sangat diharapkan. Semoga skripsi ini berguna bagi seluruh pembaca, dan dapat digunakan sebagaimana mestinya.
Yogyakarta
tradisional sebagai bahan baku obat tradisional. Rimpang temulawak dimanfaatkan dalam berbagai bentuk hasil olahan seperti rimpang basah, rimpang kering, dan ekstrak etanolik temulawak. Hasil olahan rimpang temulawak tersebut melewati beberapa proses pengolahan seperti pencucian, pengeringan, dan ekstraksi. Bahan baku obat tradisional harus memenuhi persyaratan keamanan yang telah ditetapkan pemerintah, salah satunya adalah nilai Angka Lempeng Total (ALT).
Penelitian ini merupakan jenis penelitian non-eksperimental dengan rancangan penelitian deskriptif komparatif. Penelitian ini bertujuan untuk memeriksa jumlah cemaran bakteri dari rimpang basah, rimpang kering, dan ekstrak etanolik temulawak sehingga dapat ditentukan apakah nilai ALT tersebut melebihi batas keamanan yang telah ditetapkan atau tidak. Persyaratan ALT menurut SK Menteri Kesehatan Republik Indonesia nomor 661/MENKES/SK/VII/1994 adalah 10 koloni/gram bahan untuk rajangan rimpang basah, 10 koloni/gram bahan untuk serbuk dari rimpang kering (Anonim, 1994a), dan menurut Monografi Ekstrak Tumbuhan Obat Indonesia adalah 10 koloni/ml ekstrak untuk ekstrak etanolik temulawak (Anonim, 2004).
Data yang diperoleh merupakan data kuantitatif yang dianalisis dengan perhitungan Angka Lempeng Total. Dari data kuantitatif 3 macam sampel dengan 3 kali replikasi yang dilakukan, diperoleh jumlah koloni untuk rimpang temulawak sebesar 2,9x108±0,058x108 koloni/gram sampel; untuk rimpang kering temulawak sebesar 1,4x107±0,058x107 koloni/gram sampel; dan untuk ekstrak etanolik temulawak sebesar 1,0x103±0,16x103 koloni/ml sampel.
Dari data yang didapatkan di atas dapat disimpulkan bahwa bentuk olahan rimpang basah, rimpang kering, dan ekstrak etanolik temulawak pada penelitian ini tidak memenuhi parameter keamanan nilai ALT yang telah ditetapkan pada SK Menteri Kesehatan Republik Indonesia 661/MENKES/SK/VII/1994 dan Monografi Ekstrak Tumbuhan Obat Indonesia.
ABSTRACT
Curcuma (Curcuma xanthorrhiza Roxb.) is one of the plants have been widely used by Indonesian people and traditional medicine industries as raw material in process of making traditional medicine. Curcuma rhizome used in various type such as rhizome, dried rhizome, or ethanolic extract. As raw material for traditional medicine, those products of curcuma rhizome have to fullfill the safety strandard, and one of those safety standard is Total Plate Count.
The research was considered a non-experimental research with descriptive and comparative research design. The aim of this research was to count the Total Plate Count of curcuma rhizome, dried curcuma rhizome, and ethanolic extract of curcuma. The prerequirement of Total Plate Count according to the Indonesian Departemen of Health number 661/MENKES/SK/VII/1994 was 10 colonies/gram for rhizome, 10 colonies/gram for powder of dried rhizome (Anonym, 1994a), and according to Monography of Indonesian Herbal Medicine Extract was 10 colonies/ml for ethanolic extract of curcuma (Anonym, 2004).
Data achieved was quantitative ones which were analyzed by applying the computation of Total Plate Count. From quantitative data of 3 samples and 3 times replication which were implementated, it was found that amount colony of curcuma rhizome = 2,9 108±0,058x108 colonies/gram of sample; amount colony of dried curcuma rhizome = 1,4x107±0,058x107 colonies/gram of sample, amount colony of ethanolic extracted curcuma = and 1,0x102±0,16x102 colonies/ml of sample.
Based on the finding above,it can be concluded that curcuma rhizome, dried curcuma rhizome, and ethanolic extract of curcuma in this research not fullfill the Total Plate Count prerequirement of Indonesian Departemen of Health number 661/MENKES/SK/VII/1994 and Monography of Indonesian Herbal Medicine Extract.
ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 31 Desember 2009 Penulis
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN PUBLIKASI ... v
PRAKATA ... vi
INTISARI ... viii
ABSTRACT ... ix
PERNYATAAN KEASLIAN KARYA ... x
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xv
DAFTAR TABEL ... xvi
DAFTAR LAMPIRAN ... xvii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Permasalahan... 4
2. Keaslian Karya ... 4
3. Manfaat Penelitian ... 5
B. Tujuan Penelitian ... 5
BAB II. PENELAAHAN PUSTAKA ... 6
A. Rimpang Temulawak ... 6
1. Pencucian ... 8
2. Pengeringan ... 10
3. Ekstraksi ... 11
C. Obat Tradisional ... 13
D. Cemaran Bakteri... 14
E. Uji Angka Lempeng Total (ALT) ... 17
F. Landasan Teori ... 19
G. Hipotesis ... 20
BAB III. METODOLOGI PENELITIAN ... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian dan Definisi Operasional ... 21
C. Bahan Penelitian... 22
D. Alat Penelitian ... 23
E. Tata Cara Penelitian ... 23
1. Pengumpulan Rimpang Temulawak ... 23
2. Identifikasi Rimpang Temulawak ... 23
3. Pencucian dan Perajangan Rimpang Temulawak ... 23
4. Pengeringan Rimpang Temulawak ... 23
5. Penyerbukan Simplisia Temulawak ... 24
7. Pengujian ALT Rimpang Basah, Rimpang Kering, dan Ekstrak
Etanolik Temulawak ... 25
8. Perhitungan Koloni Bakteri... 27
F. Analisis Data ... 29
BAB IV. HASIL DAN PEMBAHASAN ... 30
A. Pengumpulan Bahan... 30
B. Identifikasi Rimpang Temulawak ... 30
C. Pengolahan Rimpang Temulawak ... 32
1. Pencucian ... 32
2. Perajangan ... 33
3. Pengeringan ... 33
4. Sortasi Kering ... 34
5. Pembuatan Serbuk ... 34
6. Ekstraksi ... 35
D. Uji Angka Lempeng Total (ALT) ... 36
1. Penanganan Rimpang ... 36
2. Homogenisasi Sampel ... 36
3. Pengenceran Sampel ... 37
4. Uji ALT Rimpang basah, Rimpang Kering, dan Ekstrak Etanolik Temulawak ... 37
BAB V. KESIMPULAN DAN SARAN ... 46
A. Kesimpulan ... 46
DAFTAR GAMBAR
Tabel II. Hasil Uji ALT Untuk Sampel Rimpang Kering Temulawak Setelah Inkubasi Selama 48 Jam ... 42 Tabel III. Hasil Uji ALT Untuk Sampel Ekstrak Etanolik Temulawak Setelah
DAFTAR LAMPIRAN
Lampiran 1. Hasil Uji ALT Rimpang Basah Temulawak ... 51
Lampiran 2. Hasil Uji ALT Serbuk Rimpang Kering Temulawak ... 53
Lampiran 3. Hasil Uji ALT Ekstrak Etanolik Temulawak ... 55
Lampiran 4. Gambar Hasil Uji ALT Rimpang Basah Temulawak ... 57
Lampiran 5. Gambar Hasil Uji ALT Rimpang Kering Temulawak ... 58
Lampiran 6. Gambar Hasil Uji ALT Ekstrak Etanolik Temulawak ... 59
1
A.Latar Belakang
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan salah satu tanaman yang penggunaannya sangat meluas di kalangan masyarakat Indonesia. Pemanfaatan temulawak ini sangat bervariasi, mulai dari bumbu masak hingga sebagai tanaman bahan obat. Pemanfaatan temulawak sebagai tanaman obat didukung oleh Badan Pengawas Obat dan Makanan (Badan POM) yang telah menetapkan sembilan tanaman obat unggulan yang telah diteliti atau diuji secara klinis. Sembilan tanaman obat unggulan Indonesia tersebut di antaranya adalah sambiloto, jambu biji, jati belanda, cabe jawa, temulawak, jahe merah, kunyit, mengkudu dan salam (Plantus, 2008).
Pemanfaatan temulawak telah ada sejak dahulu sebagai bahan baku jamu tradisional. Namun saat ini, pemanfaatan temulawak tidak hanya sebatas jamu yang dibuat secara tradisional tetapi juga telah dimanfaatkan oleh Industri Obat Tradisional (IOT). Telah dilakukan Pencanangan Gerakan Nasional Minum Temulawak (GNMT) oleh Pemerintah RI di Keraton Yogyakarta pada tanggal 14 Juli 2005 (Anonim, 2005a). Semenjak adanya GNMT yang dicanangkan pemerintah, tidak terasa pemanfaatan temulawak telah mendunia baik di dalam maupun di luar negeri antara lain di Eropa, Amerika, dan Asia (Sidik, 2006).
2
darah, mencegah stroke, mencegah penyakit jantung koroner, dan meningkatkan daya tahan tubuh (Sidik, 2006). Manfaat temulawak yang berkhasiat obat terutama dihasilkan dari kandungan kimia yang ada di dalam rimpang temulawak di antaranya adalah kurkumin dan minyak atsiri. Kurkuminoid memiliki aktivitas hepatotoksik, antiinflamasi, antiperoksidasi, dan splasmolitik, sedangkan minyak atsiri memiliki aktivitas koleretik atau meningkatkan sekresi empedu (Soediro, 1997).
Temulawak mudah tumbuh dan tersebar di berbagai daerah di Indonesia. Rimpang temulawak banyak digunakan sebagai rempah. Di samping itu, rimpang temulawak secara turun menurun juga telah digunakan oleh masyarakat kita untuk pemeliharaan kesehatan. Saat ini temulawak merupakan bahan obat alam yang paling banyak digunakan oleh industri obat tradisional dalam negeri untuk memproduksi obat tradisional (Anonim, 2005a).
Temulawak dimanfaatkan oleh masyarakat dan industri obat tradisional dalam berbagai bentuk hasil olahan di antaranya adalah rimpang basah temulawak, rimpang kering temulawak, dan ekstrak etanolik temulawak. Berbagai bentuk yang digunakan sebagai bahan baku obat tersebut merupakan hasil olahan dari temulawak tersebut telah mengalami proses pengolahan tertentu. Teknik pengolahan tanaman obat terdiri dari sortasi, pencucian, penjemuran/penirisan, pengirisan/perajangan, dan pengolahan lebih lanjut menjadi berbagai produk/diversifikasi produk (Sembiring, 2008).
kaidah bahwa sediaan farmasi harus memiliki sifat-sifat aman, berkhasiat, dan berkualitas tinggi maka diupayakan pula produk yang bahan bakunya memenuhi tiga kriteria tersebut. Itu sebabnya upaya penanganan pengolahan yang efektif diperlakukan sedemikian mungkin sehingga tingkat kontaminannya minim (Soediro, 1997). Proses pengolahan rimpang merupakan salah satu faktor yang menentukan kualitas bahan baku obat.
Berbagai hasil olahan rimpang temulawak yang digunakan dalam pembuatan obat tradisional harus memiliki kualitas yang baik agar mutu obat tradisional yang dihasilkan juga baik. Kualitas yang baik dari bahan obat menjadi faktor penentu akan kualitas, keamanan, dan khasiat dari obat tradisional yang dihasilkan. Kualitas bahan baku obat tradisional salah satunya dilihat dari segi keamanan. Terpenuhinya standar keamanan dapat menjamin bahwa sediaan obat tidak toksis ketika dikonsumsi.
Keamanan bahan baku obat tradisional salah satunya dilihat dari nilai Angka Lempeng Total (ALT). Nilai ALT bahan baku obat tradisional harus memenuhi nilai tertentu sesuai standar pemerintah (Anonim, 2004). Menurut SK Menteri Kesehatan Indonesia nomor 661/IMENKES/SK/VII/1994 Tentang Persyaratan Obat Tradisional batas nilai ALT untuk obat bentuk rajangan adalah 10 koloni/gram bahan, untuk serbuk adalah 10 koloni/gram bahan (Anonim, 1994a), dan menurut Monografi Ekstrak Tumbuhan Obat Indonesia batas ALT untuk ekstrak etanolik temulawak adalah 10 koloni/ml ekstrak (Anonim, 2004).
4
karena bakteri tersebut dapat menyebabkan terjadinya kerusakan atau dapat memproduksi toksin (racun) yang dapat menimbulkan penyakit pada manusia (Taufik, 2004). Jumlah cemaran bakteri pada bahan baku obat tradisional perlu diuji sebagai salah satu parameter keamanan obat tradisional yang menggambarkan banyaknya cemaran karena bakteri, sehingga dapat ditentukan apakah nilai ALT dari bahan baku obat tradisional tersebut memenuhi persyaratan yang telah ditetapkan atau tidak.
1. Permasalahan
Dari latar belakang diatas muncul permasalahan sebagai berikut :
a. Berapakah nilai ALT pada rimpang basah temulawak, rimpang kering temulawak, dan ekstrak etanolik temulawak?
b. Apakah nilai ALT yang didapat pada rimpang basah temulawak, rimpang kering temulawak, dan ekstrak etanolik temulawak melebihi batas keamanan yang telah ditetapkan pada SK Menteri Kesehatan Indonesia nomor 661/IMENKES/SK/VII/1994 Tentang Persyaratan Obat Tradisional dan Monografi Ekstrak Tumbuhan Obat Indonesia?
2. Keaslian Penelitian
Menurut sumber-sumber informasi yang diperoleh, penelitian ilmiah tentang uji cemaran bakteri yang pernah dilakukan adalah sebagai berikut :
a. Pengujian cemaran bakteri dan cemaran kapang/khamir pada produk jamu gendong di Daerah Istimewa Yogyakarta oleh Pratiwi (2005).
Penelitian mengenai uji angka lempeng total rimpang basah, rimpang kering, dan ekstrak etanolik temulawak belum pernah dilakukan.
3. Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah :
a. Manfaat teoritis : memberikan sumbangan informasi mengenai cemaran bakteri pada temulawak sebagai bahan obat tradisional.
b. Manfaat praktis : memberikan keterangan keamanan tentang berbagai hasil olahan rimpang temulawak yang digunakan sebagai bahan baku obat tradisional yaitu rimpang basah temulawak, rimpang kering temulawak, dan ekstrak etanolik temulawak.
B.Tujuan Penelitian
6 BAB II
PENELAAHAN PUSTAKA
A. Rimpang Temulawak (Curcuma xanthorrhiza Roxb.)
Rimpang temulawak adalah rimpang Curcuma xanhtorrhiza Roxb. Kadar minyak atsiri tidak kurang dari 6% (Anonim, 1979).
1. Deskripsi Rimpang Temulawak
Pemeriksaan secara organoleptis menunjukkan bahwa rimpang temulawak memiliki bau aromatik yang khas, rasa yang tajam dan pahit. Untuk pemeriksaan secara makroskopis menunjukkan bahwa rimpang temulawak merupakan keping tipis, bentuk bundar atau jorong, ringan, keras, rapuh, garis tengah sampai 6 cm, tebal 2 mm sampai 5 mm, permukaan luar berkerut, warna coklat kuning sampai coklat, bidang irisan berwarna coklat kuning buram, melengkung tidak beraturan, tidak rata, sering dengan tonjolan melingkar pada batas antara silinder pusat dengan korteks, korteks sempit, tebal 3 mm sampai 4 mm. Bekas patahan berdebu, warna kuning jingga sampai coklat jingga terang (Anonim, 1979).
berbentuk jarum kecil. Butir pati berbentuk pipih, bulat panjang sampai bulat telur memanjang, panjang butir 20 µm – 70 µm, lebar 5 µm sampai 30 µm, tebal 3 µm sampai 10 µm, lamela jelas, hilus di tepi. Berkas pembuluh tipe kolateral, tersebar tidak beraturan pada parenkim korteks dan pada silinder pusat; berkas pembuluh di sebelah dalam endodermis tersusun dalam lingkaran dan letaknya lebih berdekatan satu dengan yang lainnya; pembuluh didampingi oleh sel sekresi, panjang sampai 200 µm, berisi zat berbutir berwarna coklat yang dengan besi (III) klorida lp menjadi lebih tua (Anonim, 1979).
Serbuk dari rimpang kering temulawak memiliki warna kuning kecoklatan. Fragmen pengenal yang khas adalah butir pati, fragmen parenkim dengan sel minyak, fragmen berkas pembuluh, warna kuning intensif (Anonim, 1979).
2. Kandungan Kimia Rimpang Temulawak
Daging buah (rimpang) temulawak mempunyai beberapa kandungan senyawa kimia antara lain berupa fellandrean dan turmerol atau yang sering disebut minyak menguap. Kandungan lain adalah minyak atsiri, kamfer, glukosida, folumetik karbinol. Kandungan kimia yang ada dalam ekstrak temulawak di antaranya adalah kurkumin, desmetoksi kurkumin, minyak atsiri dengan komponen utama xantorizol dan oleoresin (Anonim, 2004).
3. Manfaat Temulawak
8
berkhasiat obat terutama dihasilkan dari kandungan kimia yang ada di dalam rimpang temulawak di antaranya adalah kurkumin dan minyak atsiri (Soediro, 1997). Rimpang ini dipercaya dapat meningkatkan kerja ginjal dan bekerja sebagai anti inflamasi. Manfaat lain dari rimpang tanaman ini adalah meningkatkan nafsu makan, anti kolesterol, anti anemia, anti oksidan, dan pencegah kanker (Anonim, 2005b). Kurkumin yang terdapat pada rimpang tumbuhan ini bermanfaat sebagai anti jerawat, di samping sebagai anti hepototoksik (anti keracunan empedu) (Anonim, 2005b).
B. Proses Pengolahan Rimpang
Teknik pengolahan sangat berpengaruh terhadap khasiat dari produk tanaman yang diperoleh. Jika penanganan ataupun pengolahannya tidak benar maka mutu produk yang dihasilkan kurang berkhasiat atau kemungkinan dapat menimbulkan toksik apabila dikonsumsi. Teknik pengolahan tanaman obat terdiri dari sortasi, pencucian, penjemuran/penirisan, pengirisan/perajangan, dan pengolahan lebih lanjut menjadi berbagai produk/diversifikasi produk (Anonim, 2009b).
1. Pencucian
cucian dan air bilasannya, jika masih terlihat kotor maka pencucian atau pembilasan perlu diulangi satu atau dua kali. Perlu diperhatikan bahwa pencucian harus dilakukan dalam waktu yang sesingkat mungkin untuk menghindari larut dan terbuangnya zat yang terkandung dalam bahan (Anonim, 2009b). Pencucian bahan dapat dilakukan dengan beberapa cara antara lain :
a. Perendaman bertingkat
Perendaman biasanya dilakukan pada bahan yang tidak banyak mengandung kotoran seperti daun, bunga, dan buah. Proses perendaman dilakukan beberapa kali pada wadah dan air yang berbeda, pada rendaman pertama air cuciannya mengandung kotoran paling banyak. Saat perendaman kotoran-kotoran yang melekat kuat pada bahan dapat dihilangkan langsung dengan tangan. Metode ini akan menghemat penggunaan air, namun sangat mudah melarutkan zat-zat yang terkandung dalam bahan.
b. Penyemprotan
10
c. Penyikatan (manual maupun otomatis)
Pencucian dengan menyikat dapat dilakukan terhadap jenis bahan yang keras/tidak lunak dan kotorannya melekat sangat kuat. Pencucian ini memakai alat bantu sikat yang digunakan bentuknya bisa bermacam-macam, dalam hal ini perlu diperhatikan kebersihan dari sikat yang digunakan. Penyikatan dilakukan terhadap bahan secara perlahan dan teratur agar tidak merusak bahan. Pembilasan dilakukan pada bahan yang sudah disikat. Metode pencucian ini dapat menghasilkan bahan yang lebih bersih dibandingkan dengan metode pencucian lainnya, namun meningkatkan resiko kerusakan bahan, sehingga merangsang tumbuhnya bakteri.
Setelah pencucian, bahan langsung ditiriskan di rak-rak pengering. Selesai pengeringan dilakukan kembali penyortiran apabila bahan langsung digunakan dalam bentuk segar (Anonim, 2009b).
2. Pengeringan
Pengeringan yang tepat meliputi dua masalah utama yaitu pengaturan suhu dan pengaliran udara yang teratur. Cara pengeringan yang paling sederhana dilakukan adalah pengeringan di bawah sinar matahari. Kelebihan dari metode pengeringan di bawah sinar matahari adalah biaya yang murah, tetapi memiliki kekurangan yaitu suhu dan kelembaban yang tidak dapat dikontrol, serta waktu yang relatif lebih lama. Waktu pengeringan tergantung cuaca dan intensitas penyinaran, serta mudah terkontaminasi oleh bakteri dari luar, serta pengaruh sinar ultraviolet yang dapat merusak kandungan kimia dari simplisia. Cara pengeringan yang lain adalah dengan pengering mekanis (oven) yang menggunakan tambahan panas. Pengeringan dengan panas buatan ini memberikan beberapa keuntungan yaitu : tidak tergantung cuaca, tidak memerlukan tempat yang luas, kondisi pengeringan dapat dikontrol sehingga pengeringan dapat rata pada tiap bagian dari simplisia. Pengeringan dengan alat pengering mekanis akan mendapatkan hasil yang lebih baik bila kondisi pengeringan ditentukan dengan tepat dan selama pengeringan dikontrol dengan baik (Anonim, 1994b). Suhu pengeringan yang ideal adalah 50 – 600C dan hasil yang baik dari proses pengeringan adalah bahan simplisia yang mengandung kadar air 5-10% (Anonim, 2006).
3. Ekstraksi
12
Maserasi merupakan cara ekstraksi yang paling sederhana (Voigt, 1994). Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari. Maserasi dilakukan dengan cara merendam serbuk simplisia atau bahan dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan di luar sel, maka larutan yang terpekat didesak keluar (Anonim, 1986). Ekstraksi pelarut adalah metode yang efektif untuk mengekstrak kurkuminoid (Jayaprakasha dkk, 2005).
Larutan penyari berfungsi untuk menarik senyawa aktif dari bahan alam. Beberapa jenis larutan penyari yang biasa digunakan dalam ekstraksi adalah etanol, air, eter, dan kloroform. Alkohol bagaimanapun juga adalah pelarut serba guna yang baik untuk ekstraksi pendahuluan. Alkohol dapat digunakan dalam ekstraksi senyawa-senyawa yang sedikit polar (Harbourne, 1987).
Dalam Monografi Ekstrak Tumbuhan Obat Indonesia (Anonim, 2004) tertera bahwa ekstraksi temulawak dapat dilakukan dengan menggunakan larutan penyari etanol 70%. Etanol dapat memiliki aksi sebagai desinfektan dengan mekanisme denaturasi protein pada konsentrasi 70-90% (Fardiaz, 1992).
Ekstrak kental temulawak adalah ekstrak yang dibuat dari rimpang tumbuhan Curcuma xanthorrhiza Roxb., suku Zingiberaceae, mengandung minyak atsiri tidak kurang dari 4,6% dan kurkuminoid tidak kurang dari 14,2%. Ektrak temulawak berwarna kuning kecoklatan, dengan bau khas dan rasa yang pahit (Anonim, 2004).
C. Obat Tradisional
Menurut Undang-Undang Republik Indonesia No. 23 tahun 1992 tentang kesehatan, obat tradisional adalah bahan atau ramuan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian (galenik) atau campuran dari bahan tersebut yang secara turun temurun telah digunakan untuk pengobatan berdasarkan pengalaman (Anonim, 1994a).
14
pengolahan dianggap sangat penting karena sifat banyak produk obat herbal yang sering kompleks dan variabel serta jumlah dan kuantitas kecil dari penetapan bahan aktif yang terdapat di dalamnya (Anonim, 2007).
Dalam sistem pengobatan formal Indonesia, terdapat perbedaan peran yang sangat jelas antara penggunaan obat modern (kimia) dengan obat tradisional. Utamanya adalah pada obat obat modern sudah memenuhi tiga paradigma, yaitu Mutu, Aman, dan Manfaat (Quality, Safety, Efficacy (QSE)) (Anonim, 2008).
Sebagai upaya meningkatkan status obat tradisional menjadi sediaan fitofarmaka maka sediaan tersebut harus dibuat dalam bentuk ekstrak atau fraksi yang terstandar, serta memenuhi beberapa persyaratan antara lain : (1) jaminan
quality (kualitas), di mana bahan simplisia dan produk akhir harus memenuhi persyaratan tentang keajegan dari kandungan aktif (senyawa marker), (2) jaminan
safety (keamanan), di mana produk akhir harus aman atau tidak toksik pada hewan coba yang dipersyaratkan dan (3) jaminan efficacy (manfaat), di mana produk akhir harus menunjukkan aktivitas biologis pada uji praklinik dengan hewan coba, dan menunjukkan aktivitas biologis pada uji klinik dengan manusia (Anonim, 2008).
D. Cemaran Bakteri
pigmen fotosintesis. Oleh karena itu ada bakteria yang bersifat heterotrof dan ada juga bakteri yang bersifat autotrof. Bakteria heterotrof dapat dibedakan menjadi bakteria yang hidup sebagai parasit dan saprofit, sedang bakteri heterotrof dapat dibedakan berdasarkan atas sumber energi yang digunakan untuk mensintesis makanannya menjadi fotoautotrof dan kemoautotrof. Bakteri dapat hidup di mana saja, ada yang dapat merugikan kehidupan manusia, hewan, maupun tumbuhan (Pelczar, 1986).
Di setiap tempat seperti dalam tanah, udara maupun air selalu dijumpai mikroba. Umumnya jumlah mikroba dalam tanah lebih banyak daripada dalam air ataupun udara. Umumnya bahan organik dan senyawa anorganik lebih tinggi dalam tanah sehingga cocok untuk pertumbuhan mikroba heterotrof maupun autotrof (Sumarsih, 2008).
Keberadaan mikroba di dalam tanah terutama dipengaruhi oleh sifat kimia dan fisika tanah. Komponen penyusun tanah yang terdiri atas pasir, debu, lempung dan bahan organik maupun bahan penyemen lain akan membentuk struktur tanah. Struktur tanah akan menentukan keberadaan oksigen dan lengas dalam tanah. Dalam hal ini akan terbentuk lingkungan mikro dalam suatu struktur tanah. Mikroba akan membentuk mikrokoloni dalam struktur tanah tersebut, dengan tempat pertumbuhan yang sesuai dengan sifat mikroba dan lingkungan yang diperlukan (Sumarsih, 2008).
16
dekat dengan tanah. Beberapa bakteri patogen yang dapat mencemari tanaman melalui tanah adalah Bacillus sp., Clostridium sp., dan Listeria monocytogenes
(Djaafar dkk, 2007).
Akar tanaman merupakan habitat yang baik bagi pertumbuhan mikroba. Interaksi antara bakteri dan akar tanaman akan meningkatkan ketersediaan nutrien bagi keduanya. Permukaan akar tanaman disebut rhizoplane. Sedangkan rhizosfer adalah selapis tanah yang menyelimuti permukaan akar tanaman yang masih dipengaruhi oleh aktivitas akar. Tebal tipisnya lapisan rhizosfer antar setiap tanaman berbeda. Rhizosfer merupakan habitat yang sangat baik bagi pertumbuhan mikroba oleh karena akar tanaman menyediakan berbagai bahan organik yang umumnya menstimulir pertumbuhan mikroba (Sumarsih, 2008).
Mikroba terutama bakteri yang bersifat patogen dapat ditemukan di mana saja, di tanah, air, udara, tanaman, binatang, bahan pangan, peralatan untuk pengolahan bahkan pada tubuh manusia. Tanaman membawa berbagai jenis mikroba, yang dapat berasal dari mikroflora alami tanaman, baik yang berasal dari lingkungan maupun yang masuk selama pemanenan, distribusi, penanganan pasca panen, pengolahan, serta penyimpanan produk. Pertumbuhan mikroba terjadi dalam waktu singkat dan pada kondisi yang sesuai, antara lain tersedianya nutrisi, pH, suhu, dan kadar air dalam bahan (Djaafar dkk, 2007).
aw (water activity) atau kelembaban relatif. Bakteri umumnya memerlukan aw 0,90-0,999. Sebagian besar bakteri umumnya menyukai pH netral untuk tumbuh, berkisar antara pH 7-8, meskipun ada beberapa bakteri yang tumbuh pada suasana asam dan basa (Anonim, 2009a).
E. Uji Angka Lempeng Total (ALT)
Tujuan utama dari dilakukannya uji ALT adalah untuk memberikan jaminan bahwa ekstrak tidak boleh mengandung bakteri patogen dan tidak mengandung mikroba non patogen melebihi batas yang ditetapkan. Uji ALT berprinsip pada adanya pertumbuhan koloni bakteri aerob mesofil setelah cuplikan diinokulasikan pada media lempeng agar dengan cara tuang dan diinkubasi pada suhu yang sesuai (Anonim, 2000).
Analisa kuantitatif mikroba-mikroba tidak dapat dihitung secara tepat dengan pemeriksaan mikroskopik, kecuali bila sekurang-kurangnya ada 100 juta (108) sel untuk tiap ml. Sejumlah tertentu bahan yang akan diperiksa diencerkan secara berturut-turut, kemudian 1 ml dari tiap larutan tersebut ditanamkan pada lempeng agar-agar nutrien dan koloni-koloni yang kemudian tumbuh dihitung. Karena hanya sel-sel yang hanya sanggup membentuk koloni saja yang dihitung, maka metode ini dikenal pula sebagai penghitungan sel hidup.
18
Uji ALT merupakan penghitungan jumlah bakteri yang hidup (viable cell count). Cara ini hanya menggambarkan jumlah sel yang hidup, sehingga dikatakan lebih tepat bila dibandingkan dengan cara total cell count. Pada metode ini diasumsikan bahwa setiap sel mikroba hidup dalam suspensi akan tumbuh menjadi 1 koloni setelah diinkubasikan dalam media biakan dan lingkungan yang sesuai. Setelah masa inkubasi, jumlah koloni yang tumbuh dihitung, dan merupakan perkiraan atau dugaan dari jumlah mikroba dalam suspensi tertentu (Hadioetomo, 1985).
Pada perhitungan ALT sebaiknya hanya lempeng agar yang mengandung 30-300 koloni saja yang digunakan dalam perhitungan. Lempeng agar dengan koloni >300 sulit untuk dihitung sehingga kemungkinan kesalahan penghitungan sangat besar. Pengenceran sampel akan membantu untuk memperoleh penghitungan jumlah yang benar, namun pengenceran yang terlalu tinggi akan menghasilkan lempeng agar dengan jumlah koloni yang rendah (<30 koloni). Lempeng demikian tidak absah secara statistik untuk digunakan dalam perhitungan (Lay, 1994). Nilai ALT didapatkan dari rata-rata jumlah koloni pada tiap cawan dikalikan dengan faktor pengencerannya (Anonim, 2000).
nilai ALT untuk ekstrak etanolik temulawak adalah sebesar 10 koloni/ml (Anonim, 2004).
F. Landasan Teori
Temulawak merupakan salah satu tanaman obat unggulan Indonesia dan merupakan tanaman obat yang paling banyak digunakan sebagai bahan baku pembuatan obat tradisional dalam Industri Obat Tradisional. Pada proses pencucian, pengeringan, dan ekstraksi menggunakan etanol 70% dari rimpang temulawak, didapatkan hasil yang berupa : rimpang basah, rimpang kering, dan ekstrak etanolik temulawak. Ketiga hasil tersebut memiliki tingkatan tahapan pengolahan yang berbeda. Proses pengolahan merupakan salah satu faktor penting yang menentukan kualitas olahan rimpang basah, rimpeng kering, maupun ekstrak etanolik yang dihasilkan, termasuk dari segi keamanannya.
20
konsentrasi 70% sampai 90% dapat berfungsi sebagai desinfektan yang dapat mengurangi jumlah bakteri yang terdapat pada suatu bahan.
ALT merupakan metode penghitungan jumlah cemaran oleh mikroba, dan merupakan metode penghitungan cemaran yang paling sensitif, di mana dapat digunakan untuk menghitung jumlah mikroba yang masih hidup dan dapat menghitung beberapa jenis mikroba sekaligus.
Pemerintah telah menetapkan parameter nilai ALT untuk obat tradisional melalui SK Menteri Kesehatan nomor 661/MENKES/SK/VII/1994 dan Monografi Ekstrak Tumbuhan Obat Indonesia. Untuk bahan bentuk rajangan batas nilai ALT maksimum adalah 10 koloni/gram bahan, untuk serbuk adalah sebesar 10 koloni/gram bahan, dan untuk ekstrak etanolik temulawak adalah sebesar 10 koloni/ml bahan.
G. Hipotesis
21 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non-eksperimental karena tidak ada perlakuan terhadap subjek uji. Rancangan penelitian ini adalah penelitian deskriptif-komparatif di mana hasil penelitian menggambarkan jumlah cemaran bakteri pada rimpang basah, rimpang kering, dan ekstrak etanolik temulawak dan kemudian dibandingkan dengan batas ketentuan nilai ALT yang telah ditetapkan pada SK Menteri Kesehatan Republik Indonesia 661/MENKES/SK/VII/1994 (Anonim, 1994a) dan Monografi Ekstrak Tumbuhan Obat Indonesia (Anonim, 2004).
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas : tahapan pengolahan rimpang temulawak yaitu pencucian rimpang, pengeringan rimpang, dan ekstraksi menggunakan etanol 70%. b. Variabel tergantung : nilai ALT pada hasil olahan rimpang temulawak
yang berupa rimpang basah, rimpang kering, dan ekstrak etanolik temulawak.
c. Variabel pengacau terkendali : waktu inkubasi, suhu inkubasi, media yang digunakan, asal rimpang, umur rimpang, larutan penyari.
22
2. Definisi Operasional
a. Rimpang basah temulawak adalah rimpang temulawak yang dihasilkan dari rimpang temulawak yang diambil di Pasar Beringharjo yang dipanen pada umur 7-12 bulan, selama bulan Desember 2009, telah dicuci bersih, ditiriskan, dan dihancurkan menggunakan blender.
b. Rimpang kering temulawak adalah rimpang basah temulawak yang telah dicuci bersih, ditiriskan, dirajang setebal 4-5 mm, dikeringkan dengan menggunakan oven selama tiga hari berturut-turut pada suhu 50 – 60 oC. c. Ekstrak etanolik temulawak adalak ekstrak yang dihasilkan dari penyarian
serbuk temulawak menggunakan pelarut etanol 70% dengan metode maserasi selama 24 jam, dan kemudian dipekatkan menggunakan penangas air.
d. ALT adalah jumlah koloni bakteri dalam tiap 1 gram atau 1 ml sampel rimpang basah temulawak, rimpang kering temulawak, atau ekstrak etanolik temulawak. Nilai ALT dalam penelitian ini didapatkan dari hasil perhitungan rata-rata jumlah koloni tiap cawan dikalikan dengan faktor pengencerannya.
C. Bahan Penelitian
Bahan-bahan lain yang digunakan dalam penelitian ini adalah Plate Count Agar (PCA), pereaksi Peptone Dilution Fluid (PDF), aquadest, dan etanol 70%.
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas (Pyrex), penangas air, oven (Memmert), hot plate (Heidolph MR 2002), timbangan analitik (Precition Balance Model AB-204, Mettler Toledo), autoclav, inkubator, cawan petri, hot plate, alat hitung koloni, bunsen, dan Laminar Air Flow (LAF).
E. Tata Cara Penelitian 1. Pengumpulan Rimpang Temulawak
Rimpang temulawak diambil dari pedagang pengumpul di Pasar Beringharjo Yogyakarta. Rimpang diambil selama bulan Desember 2009, sebanyak 3 kilogram untuk diolah ke tahap selanjutnya. Rimpang temulawak yang dipilih adalah rimpang yang tua, berumur 7-12 bulan, yang masih dalam keadaan segar, tidak busuk, tidak cacat, dan tidak rusak (Anonim, 2006). 2. Identifikasi Rimpang Temulawak
Identifikasi rimpang dilakukan dengan memeriksa irisan rimpang secara organolepstis, makroskopis dan mikroskopis, kemudian mencocokan hasilnya dengan acuan standar yaitu Materia Medika Indonesia Jilid III (Anonim, 1979).
3. Pencucian dan Perajangan Rimpang Temulawak
24
air pencucian. Setelah penirisan cukup, kemudian rimpang dirajang kira-kira setebal 4 mm sampai 5 mm (Anonim, 2006). Perajangan dilakukan dengan menggunakan alat pemotong empon-empon manual berbahan stainless steel. 4. Pengeringan Rimpang Temulawak
Pengeringan dilakukan dengan menggunakan pemanas mekanis (oven). Rimpang yang dihasilkan pada tahap perajangan kemudian dimasukkan ke dalam oven blower. Suhu pengeringan diatur pada 50– 60 oC. Rimpang dibiarkan berada dalam oven selama tiga hari berturut-turut. Setelah genap tiga hari, rimpang kering ditempatkan pada kantung tertutup rapat untuk selanjutnya diolah menjadi serbuk. Rimpang dapat dikatakan sudah kering apabila mudah dipatahkan dengan tangan (Anonim, 2006). Rimpang temulawak yang telah dikeringkan segera diserbuk dengan menggunakan blender. Kemudian serbuk diayak dengan menggunakan ayakan no.8/14. 5. Pembuatan Ekstrak Etanolik Rimpang Temulawak
6. Pengujian ALT Rimpang Basah, Rimpang Kering, dan Ekstrak Etanolik
Temulawak
a. Penyiapan dan homogenisasi sampel
1)Rimpang basah temulawak : segera setelah didapatkan rimpang basah temulawak yang telah dicuci bersih dan ditiriskan, maka rimpang basah temulawak ditumbuk kasar secukupnya dalam kondisi steril dan ditimbang sebanyak 1 gram. Dalam kondisi steril, 1 gram rimpang basah yang telah ditimbang kemudian dimasukkan ke dalam wadah yang telah berisi 9 ml Peptone Dilution Fluid (PDF) dan selanjutnya dihomogenkan menggunakan vortex.
2)Rimpang kering temulawak : segera setelah didapatkan serbuk dari rimpang kering temulawak, kemudian ditimbang serbuk kering temulawak sebanyak 1 gram dalam kondisi steril. Selanjutnya serbuk yang telah ditimbang dimasukkan ke dalam wadah yang telah berisi 9 ml PDF dan selanjutnya dihomogenkan menggunakan vortex.
3)Ekstrak etanolik temulawak : segera setelah didapatkan ekstrak etanolik temulawak kemudian dipipet ekstrak sebanyak 1 ml dalam kondisi steril. Selanjutnya ekstrak tersebut dimasukkan ke dalam wadah yang telah berisi 9 ml PDF dan selanjutnya dihomogenkan menggunakan vortex.
b. Pembuatan media
26
sampai 60oC, kemudian dituangkan dalam wadah yang lebih kecil. Media tersebut selanjutnya disterilkan dengan autoklaf pada suhu 121oC selama 15 menit.
c. Pembuatan Peptone Dilution Fluid (PDF) sebagai pengencer
Sebanyak 1 gram peptone dilarutkan dalam 1 liter air suling dan diukur pH 7,0±2, diisikan ke dalam tabung reaksi sebanyak 9 ml, dan disterilkan dengan autoklaf pada suhu 121oC selama 15 menit.
d. Pengenceran sampel
Dari masing-masing jenis sampel yang didapatkan pada tahap penyiapan dan homogenisasi sampel (konsentrasi 10-1), dalam kondisi steril dipipet sebanyak 1 ml dan dimasukkan dalam tabung reaksi bertutup yang telah berisi 9 ml PDF steril dan dikocok homogen menggunakan vortex sehingga didapatkan pengenceran dengan konsentrasi 10-2. Demikian seterusnya hingga didapatkan sampel dengan konsentrasi 10-6 atau sesuai dengan yang diperlukan.
e. Uji Angka Lempeng Total (Anonim, 2000)
selama 24-48 jam dengan posisi terbalik. Dilakukan tiga kali replikasi dengan perlakuan duplo untuk masing-masing replikasi. Jumlah koloni yang tumbuh diamati dan dihitung.
7. Cara Penghitungan ALT (Anonim, 2000)
Dipilih cawan petri dari satu pengenceran yang menunjukkan jumlah koloni antara 30-300. Jumlah koloni rata-rata dari kedua cawan dihitung lalu dikalikan faktor pengencerannya. Hasil dinyatakan sebagai Angka Lempeng Total dalam tiap gram contoh. Bila ditemui jumlah koloni kurang dari 30 atau lebih dari 300, maka diikuti petunjuk sebagai berikut :
1. Bila salah satu dari cawan petri menunjukkan jumlah koloni 30 atau lebih dari 300 koloni, dihitung jumlah rata-rata koloni, kemudian dikalikan dengan faktor pengencerannya. Hasil kali dinyatakan sebagai Angka Lempeng Total dalam tiap ml/gram contoh
2. Bila terdapat cawan dari dua tingkat pengenceran yang berurutan menunjukkan jumlah koloni antara 30-300, maka dihitung jumlah koloni dari masing-masing pengenceran dan dikalikan faktor pengencerannya kemudian diambil rata-ratanya. Jika hasil perhitungan pada tingkat yang lebih tinggi didapati jumlah koloni rata-rata lebih besar 2 kali jumlah koloni yang seharusnya, maka dipilih dari tingkat pengenceran yang terendah.
28
pengenceran terendah dan dihitung sebagai Angka Lempeng Total perkiraan.
4. Bila tidak ada pertumbuhan pada semua cawan dan bukan disebabkan karena faktor inhibitor, maka Angka Lempeng Total dilaporkan sebagai kurang dari satu dikalikan faktor pengenceran terendah.
5. Bila jumlah koloni per cawan kurang dari 3000, maka cawan dengan tingkat pengenceran tertinggi dibagi dalam beberapa sektor (2, 4, atau 8). Jumlah koloni dikalikan dengan faktor pembagi dan faktor pengencerannya, hasil dilaporkan sebagai Angka Lempeng Total Perkiraan.
6. Bila jumlah koloni lebih dari 200 pada 1/8 bagian cawan, maka jumlah koloni adalah 200 x 8 x faktor pengenceran. Angka Lempeng Total Perkiraan dihitung sebagai lebih besar dari jumlah koloni yang diperoleh. 7. Jika dijumpai koloni spreader meliputi seperempat sampai setengah bagian
cawan, maka dihitung koloni yang tumbuh diluar daerah sprader. Jika 75% dari seluruh cawan mempunyai koloni spreader dengan keadaan seperti diatas, maka dicatat sebagai “Spr”. Untuk keadaan ini harus dicari
penyebabnya dan diperbaiki cara kerjanya, pengujian diulang.
F. Analisis Data
30 BAB IV
HASIL DAN PEMBAHASAN
A. Pengumpulan Bahan
Rimpang temulawak didapatkan dari salah satu pedagang pengumpul yang ada di Pasar Beringharjo Yogyakarta, yang berasal dari petani di daerah Cilacap. Rimpang tersebut dipanen selama bulan Desember 2009 pada saat berumur 7-12 bulan. Dari tahap pengumpulan bahan didapatkan rimpang yang masih dalam kondisi segar, namun masih terdapat beberapa rimpang yang busuk dan cacat, serta masih terdapat pengotor berupa tanah dan pasir yang cukup banyak.
Dari rimpang yang terkumpul kemudian dilakukan sortasi basah sebagai tahapan awal untuk memisahkan rimpang temulawak dari rimpang yang busuk dan cacat, serta bahan-bahan lain yang mungkin masih terikut seperti kerikil, akar, serangga, atau pengotor lainnya. Sortasi basah perlu dilakukan untuk mengurangi benda asing yang ikut dalam proses pengolahan selanjutnya (Anonim, 2006). Bahan lain tidak boleh terikut karena yang akan diteliti adalah jumlah cemaran bakteri dari rimpang temulawak. Dari tahap sortasi basah didapatkan rimpang temulawak yang sudah terpisah dari bahan selain rimpang, tetapi masih terdapat tanah dan pengotor yang menempel pada rimpang temulawak.
organoleptis, makroskopis, dan mikroskopis dari rimpang yang terkumpul dengan ciri-ciri rimpang Curcuma xanthorrhiza Roxb. yang ada pada Materia Medika Jilid III (Anonim, 1979).
Dari hasil pengamatan organoleptis didapatkan bahwa rimpang temulawak yang terkumpul memiliki bau khas aromatis temulawak, dengan rasa agak pahit, pedas, dan kelat di lidah. Rimpang temulawak berwarna kuning orange tua dan berbentuk pipih bulat. Ciri-ciri organoleptis ini sesuai dengan yang tertera pada Materia Medika Indonesia Jilid III (Anonim, 1979).
Dari pengamatan secara makroskopik diketahui bahwa rimpang temulawak yang terkumpul berbentuk kepingan bulat agak lonjong, ringan, keras tapi rapuh, dengan pinggir berkerut, dan berdiameter antara 4-6 cm dengan tebal antara 1-3 cm. Hasil pengamatan secara makroskopis ini menunjukkan ciri-ciri makroskopis yang sesuai dengan ciri-ciri makroskopis Curcuma xanthorrhiza
Roxb. yang tertera pada Materia Medika Indonesia Jilid III (Anonim, 1979). Dari pengamatan secara mikroskopis pada rimpang temulawak yang terkumpul, didapatkan adanya beberapa bagian sel pada rimpang seperti parenkim silinder pusat, endodermis, butir minyak, berkas pembuluh kolateral, butir pati, hipodermis, epidermis, parenkim korteks. Bagian yang merupakan ciri khas dari rimpang Curcuma xanthorrhiza Roxb. adalah adanya butir pati dan butir minyak. Hasil pengamatan ciri-ciri mikroskopis ini sesuai dengan ciri-ciri mikroskopis
32
bahwa bahan rimpang yang digunakan dapat penelitian adalah benar rimpang dari spesies Curcuma xanthorrhiza Roxb. Perbandingan hasil pengamatan secara organoleptis, makroskopis, dan mikroskopis rimpang temulawak yang digunakan sebagai bahan penelitian dengan ciri-ciri temulawak pada standar acuan MMI Jilid III disajikan pada lampiran 7.
C. Pengolahan Rimpang Temulawak
1. Pencucian
Tahap pencucian dilakukan dengan mencuci rimpang di bawah air mengalir sambil disikat perlahan. Tahap ini perlu dilakukan untuk menghilangkan tanah dan pengotor lain yang masih melekat pada rimpang temulawak (Sembiring, 2008). Setelah semua rimpang selesai dicuci bersih, kemudian rimpang ditiriskan selama beberapa saat untuk menghilangkan tetesan-tetesan air sisa hasil pencucian (Anonim, 2006). Penirisan ini perlu dilakukan mengingat selama proses pencucian terjadi kontak rimpang dengan air yang kemungkinan dapat menambah kandungan air pada permukaan rimpang. Air dari pencucian ini harus dihilangkan dengan ditiriskan karena adanya air akan menjadi tempat yang baik bagi pertumbuhan mikroba (Jawetz dkk, 1995). Hal ini dapat mengacaukan hasil penelitian karena jumlah bakteri yang ada nantinya bukan hanya berasal dari rimpang seperti yang diharapkan, tetapi juga berasal dari air sisa pencucian.
lingkungan ke dalam sampel. Sampel disimpan dalam freezer karena di dalam
freezer suhu dapat diturunkan sangat rendah. Suhu yang rendah ini dapat menghentikan reaksi enzimatis dari bakteri sehingga tidak terjadi pertumbuhan bakteri (Rukmi, 2009).
2. Perajangan
Perajangan berfungsi untuk membantu proses pengeringan, karena pada tahap perajangan ini rimpang utuh dipotong menjadi lebih tipis sehingga akan menambah luas permukaan untuk proses pengeringan (Anonim, 2009b). Meningkatnya luas permukaan yang kontak dengan udara pada rimpang akan mempercepat proses keluarnya air dari rimpang sehingga proses pengeringan dapat berjalan dengan lebih cepat. Perajangan rimpang dilakukan dengan menggunakan alat pemotong empon-empon manual dengan mata pisau stainless steel yang tajam sehingga didapatkan potongan rimpang dengan tebal yang seragam. Rajangan tidak boleh terlalu tebal karena akan memperlama proses pengeringan serta akan memperbesar kemungkinan tumbuhnya jamur dan bakteri (Anonim, 2009b). Pada tahap ini dihasilkan rajangan rimpang basah dengan ukuran yang seragam dan siap untuk dikeringkan.
3. Pengeringan
34
selama proses pengeringan. Proses pengeringan simplisia dilakukan sampai terjadi keseimbangan kadar air antara simplisia dengan lingkungannya, artinya proses penguapan air dari simplisia sudah berhenti karena jumlah molekul-molekul air yang diuapkan dari simplisia sama dengan jumlah molekul-molekul air yang diserap oleh permukaan simplisia. Simplisia yang sudah kering ditandai dengan potongan rimpang yang mudah dipatahkan.
Pada penelitian ini digunakan metode pengeringan menggunakan pemanas mekanis (oven). Metode ini dipilih karena dengan metode ini suhu pengeringan dapat diatur dan stabil, tidak tergantung pada cuaca. Selain itu, pada alat pengering terdapat kipas yang memungkinkan aliran udara pada seluruh bagian ruangan sehingga pengeringan dapat merata ke seluruh bagian simplisia. Pada tahap pengeringan ini dihasilkan simplisia rimpang temulawak kering yang siap diolah ke tahap selanjutnya.
4. Sortasi Kering
Proses sortasi kering dilakukan untuk menyeleksi simplisia kering dari pengotor yang mungkin masih terikut (Anonim, 2009b). Proses ini perlu dilakukan supaya pengotor-pengotor yang ada tidak ikut terserbuk sehingga dapat diperoleh simplisia rimpang temulawak yang murni. Pengotor-pengotor tersebut perlu dihilangkan agar nantinya yang terserbuk adalah hasil dari pengeringan rimpang saja. Pada tahapan ini dihasilkan sampel berupa rimpang kering temulawak.
Pembuatan serbuk dilakukan dengan menghancurkan simplisia kering menggunakan blender. Pada proses penyerbukan terjadi penghancuran simplisia menjadi lebih kecil. Setelah seluruh simplisia diserbuk kemudian dimasukkan dalam wadah tertutup rapat dan disimpan dalam freezer. Proses penyerbukan dari rimpang kering ini perlu dilakukan agar nantinya didapatkan suspensi sampel yang merata dari rimpang kering temulawak. Hal ini berfungsi agar koloni bakteri dapat tumbuh menyebar secara merata pada media yang digunakan sehingga akan memudahkan penghitungan nilai ALT. Selain itu dengan dilakukannya penyerbukan maka akan terjadi penghancuran sel dari rimpang temulawak yang telah dikeringkan sehingga sel bakteri yang ada di dalam rimpang dapat keluar dan dapat tersuspensi secara merata pada cairan pengencer yang digunakan.
6. Ekstraksi
Dari serbuk yang didapatkan selanjutnya dilakukan ekstraksi untuk mendapatkan ekstrak etanolik temulawak. Metode penyarian yang digunakan adalah maserasi. Metode maserasi dipilih karena metode ini merupakan metode yang mudah dan sederhana. Proses ekstraksi serbuk temulawak dilakukan menurut Monografi Ekstrak Tumbuhan Obat Indonesia (Anonim, 2004).
36
terjadi pembunuhan sel bakteri yang ada pada serbuk dari rimpang kering yang disari sehingga kemungkinan akan menurunkan jumlah cemaran bakteri yang digambarkan dengan menurunnya nilai ALT. Pada tahap ini didapatkan sampel yang ketiga berupa ekstrak etanolik temulawak yang siap diuji ke tahap selanjutnya.
D. Uji Angka Lempeng Total (ALT)
1. Penanganan Rimpang
Sebelum digunakan sebagai cuplikan sampel, rimpang basah, rimpang kering, dan ekstrak etalonik perlu disiapkan melalui tahapan penanganan sampel. Sampel berupa rimpang basah dan rimpang kering dihancurkan terlebih dahulu supaya dapat disuspensikan pada pengencer PDF. Proses penghancuran rimpang basah dan kering ini dilakukan dalam kondisi aseptis baik ruangan maupun alatnya untuk menghindari adanya kontaminasi dari lingkungan.
2. Homogenisasi Sampel
Homogenisasi sampel perlu dilakukan untuk mendapatkan cairan uji dengan distribusi bakteri yang merata dalam tiap bagian contoh uji. Homogenisasi sampel dilakukan dengan menggunakan Peptone Dilution Fluid (PDF). Proses homogenisasi sampel dilakukan menggunakan vortex supaya sampel dapat bercampur merata pada tiap bagian diluent.
bakteri karena adanya perbedaan kondisi pertumbuhan. Untuk mengembalikan viabilitas sel bakteri agar tetap dapat hidup dan tumbuh, maka diperlukan suatu media yang dapat menyediakan nutrisi yang cukup bagi sel bakteri. Pada penelitian ini digunakan diluent PDF sebagai pengencer sekaligus penyedia nutrisi bagi sel bakteri yang disuspensikan. PDF mengandung pepton yang merupakan salah satu jenis protein yang dibutuhkan oleh sel bakteri untuk tetap hidup. Komponen pepton ini juga berfungsi sebagai buffer yang dapat mempertahankan pH dalam keadaan netral (Setiawan, 2009). Pada proses homogenisasi sampel dihasilkan suspensi sampel yang homogen pada tiap bagiannya dengan konsentrasi 10-1 yang siap diencerkan.
3. Pengenceran Sampel
Dari suspensi sampel dengan pengenceran 10-1 di atas, kemudian dilakukan pengenceran. Pengenceran ini berfungsi untuk mempermudah perhitungan jumlah koloni. Dalam satu cawan petri, jumlah koloni yang dihitung adalah yang memiliki jumlah koloni antara 30-300 koloni. Pengenceran perlu dilakukan karena jumlah bakteri dalam contoh sampel tidak diketahui sebelumnya, sehingga dengan dilakukannya pengenceran dapat menghindari pertumbuhan bakteri yang terlalu pekat dan tidak dapat dihitung (Lay, 1994). Dari proses pengenceran sampel didapatkan 3 jenis sampel dengan tingkat pengenceran 10-1 sampai 10-6 yang siap digunakan untuk uji ALT.
4. Uji ALT Rimpang basah, Rimpang Kering, dan Ekstrak Etanolik
38
Uji ALT merupakan cara penghitungan jumlah mikroba yang terdapat dalam suatu produk yang tumbuh pada media agar pada suhu dan waktu inkubasi yang ditetapkan. Uji ini disebut juga dengan viable count atau penghitungan jumlah mikroba yang hidup, di mana perhitungannya diasumsikan dengan keadaan bahwa setiap sel mikroorganisme hidup dalam suspensi akan tumbuh menjadi satu koloni setelah ditumbuhkan dalam media pertumbuhan dan lingkungan yang sesuai.
Untuk metode ALT jumlah koloni yang layak untuk dihitung pada tiap cawan petri adalah antara 30-300 koloni. Apabila jumlah koloni pada tiap cawan petri yang dihitung lebih dari 300 koloni, kondisi ini disebut sebagai Too Numerous To Count (TNTC) atau terlalu banyak untuk dihitung yang dapat memperbesar ketidaktepatan perhitungan jumlah koloni secara keseluruhan. Sedangkan apabila koloni dalam satu cawan petri berjumlah kurang dari 30 koloni, maka jumlah perhitungan yang dihasilkan kurang absah secara statistik sehingga dapat dikatakan hasil perhitungan kurang valid (Lay, 1994).
Pada pengujian ALT cara kerja aseptis perlu diperhatikan. Hal ini disebabkan pada pengujian ALT yang akan ditumbuhkan adalah bakteri, sementara bakteri terdapat di mana-mana, bahkan di udara. Cara kerja yang tidak aseptis dapat mengacaukan hasil pengujian karena bakteri yang tumbuh tidak hanya berasal dari cuplikan sampel saja tetapi juga dari kontaminan selama pengerjaan. Jika benar pengerjaan yang dilakukan sudah mengikuti teknik aseptis, maka pada kontrol media dan pelarut tidak akan tumbuh koloni bakteri.
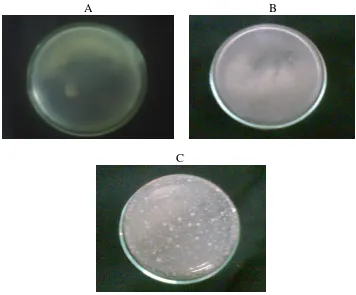
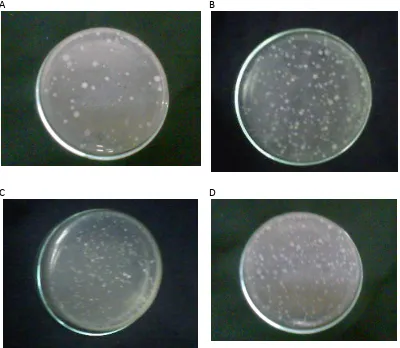
A B
C
Gambar 1. Perbandingan Kontrol Media PCA, Kontrol Pelarut PDF, dan Perlakuan Sampel Setelah Inkubasi Selama 48 jam
Keterangan Gambar : A = Kontrol Media PCA, B = Kontrol Pelarut PDF, C=Perlakuan Sampel
40
dalam pengerjaan sudah mengikuti cara kerja yang aseptis dan juga media dan pelarut yang digunakan sudah benar steril sehingga koloni yang tumbuh pada cawan sampel benar berasal dari bakteri yang ada pada sampel, bukan dari kontaminan selama pengerjaan.
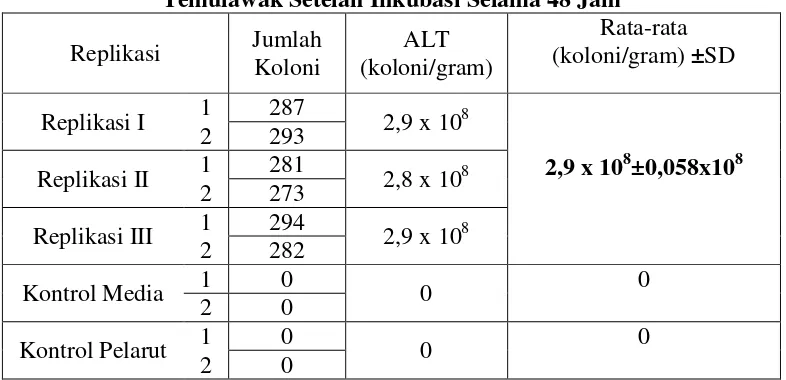
Selanjutnya dilakukan perhitungan koloni bakteri pada cawan yang mengandung cuplikan suspensi sampel. Dipilih cawan petri yang memiliki jumlah koloni antara 30-300, dan perhitungan koloni dilakukan menurut ketentuan dari Parameter Umum Ekstrak Terstandar Indonesia (Anonim, 2000). Hasil dari perhitungan untuk sampel rimpang basah disajikan dalam tabel I :
Tabel I. Hasil Uji Angka Lempeng Total Untuk Sampel Rimpang Basah Temulawak Setelah Inkubasi Selama 48 Jam
Replikasi Jumlah Koloni
ALT (koloni/gram)
Rata-rata (koloni/gram) ±SD Replikasi I 1 287 2,9 x 108
2,9 x 108±0,058x108 2 293
Replikasi II 1 281 2,8 x 108 2 273
Replikasi III 1 294 2,9 x 108 2 282
Kontrol Media 1 0 0 0
2 0
Kontrol Pelarut 1 0 0 0
2 0
didapat cukup stabil. Dari nilai SD ini dapat dimaknai bahwa proses pencucian yang dilakukan dapat menghasilkan nilai ALT yang seragam pada sampel.
Nilai ALT yang didapat pada sampel rimpang temulawak ini sangat besar, yang menunjukkan jumlah cemaran bakteri juga sangat banyak. Hal ini disebabkan karena pada sampel rimpang basah temulawak, kandungan air yang ada pada rimpang masih sangat tinggi. Tingginya kandungan air ini dapat menyebabkan bakteri yang ada dalam sampel akan tetap hidup dan memungkinkan bakteri tersebut untuk tumbuh sehingga menyebabkan jumlah cemaran bakteri sangat banyak.
42
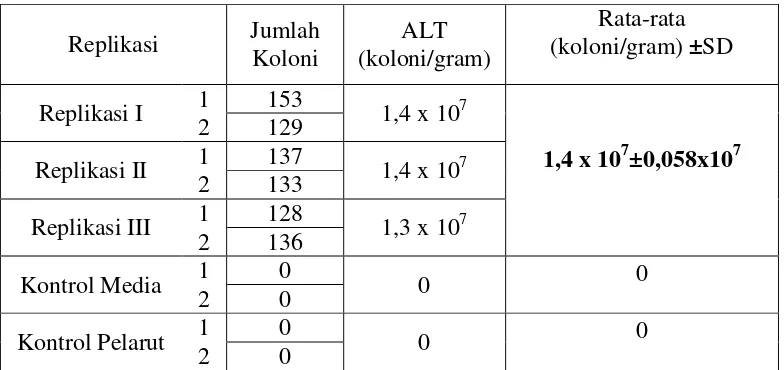
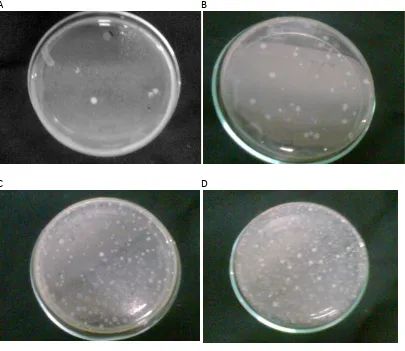
Tabel II. Hasil Uji Angka Lempeng Total Untuk Sampel Rimpang Kering Temulawak Setelah Inkubasi Selama 48 Jam
Replikasi Jumlah Koloni
ALT (koloni/gram)
Rata-rata (koloni/gram) ±SD Replikasi I 1 153 1,4 x 107
1,4 x 107±0,058x107 2 129
Replikasi II 1 137 1,4 x 107 2 133
Replikasi III 1 128 1,3 x 107 2 136
Kontrol Media 1 0 0 0
2 0
Kontrol Pelarut 1 0 0 0
2 0
Dari tabel II diketahui rata-rata nilai ALT untuk sampel serbuk rimpang kering temulawak sebesar 1,4x107±0,058x107 koloni/gram sampel. Pada sampel rimpang basah, nilai SD yang didapatkan berkisar 4% dari besar nilai rata-rata ALT. Hal ini menunjukkan bahwa variasi data yang didapat pada sampel rimpang temulawak tidak terlalu besar yang berarti juga bahwa variasi data nilai ALT yang didapat kecil. Dari nilai SD ini dapat dimaknai bahwa proses pengeringan yang dilakukan dapat menghasilkan nilai ALT yang seragam pada sampel.
bakteri yang hidup. Dengan demikian, ketika dilakukan uji ALT pada sampel rimpang kering temulawak, jumlah bakteri yang hidup telah berkurang sehingga menghasilkan nilai ALT yang juga mengalami penurunan dibandingkan nilai ALT pada sampel rimpang basah temulawak. Meskipun demikian, nilai ALT yang didapatkan pada sampel rimpang kering temulawak masih cukup tinggi. Menurut SK Menteri Kesehatan Republik Indonesia nomor 661/IMENKES/SK/VII/1994 Tentang Persyaratan Obat Tradisional menyatakan bahwa syarat nilai ALT untuk jenis serbuk dari rimpang kering adalah tidak lebih dari 10 koloni. Hasil uji ALT menunjukkan bahwa nilai ALT rimpang kering temulawak jauh melebihi batas. Hal ini menunjukkan bahwa proses pengeringan yang dilakukan dapat mengurangi jumlah cemaran bakteri dibandingkan pada sampel rimpang basah, namun rimpang kering yang dihasilkan belum memenuhi persyaratan nilai ALT yang telah ditetapkan.
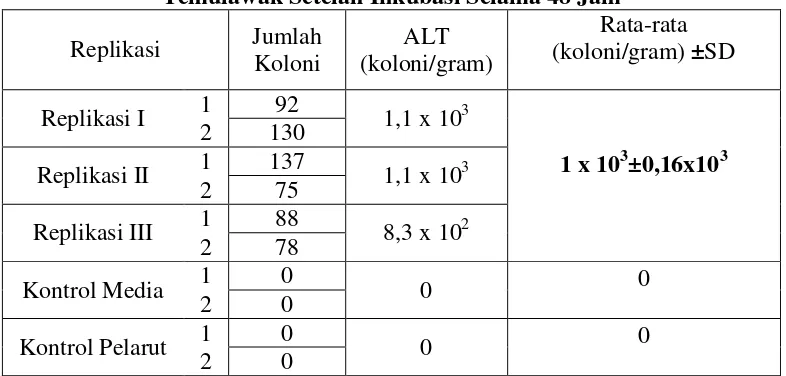
Tabel III. Hasil Uji Angka Lempeng Total Untuk Sampel Ekstrak Etanolik Temulawak Setelah Inkubasi Selama 48 Jam
Replikasi Jumlah Koloni
ALT (koloni/gram)
Rata-rata (koloni/gram) ±SD Replikasi I 1 92 1,1 x 103
1 x 103±0,16x103 2 130
Replikasi II 1 137 1,1 x 103
2 75
Replikasi III 1 88 8,3 x 102
2 78
Kontrol Media 1 0 0 0
2 0
Kontrol Pelarut 1 0 0 0
2 0
44
paling besar dibandingkan pada dua sampel yang lain, yaitu berkisar 16% dari nilai rata-rata ALT. Hal ini menggambarkan bahwa variasi nilai data pada sampel ekstrak etanolik adalah yang paling besar. Hal ini menunjukkan bahwa proses pemekatan ekstrak yang dilakukan dengan penangas air pada penelitian ini dapat menyebabkan cemaran bakteri yang sangat bervariasi dan tidak terkontrol.
Nilai ALT untuk sampel ekstrak etanolik temulawak ini merupakan nilai ALT yang paling kecil dibandingkan sampel rimpang basah maupun serbuk rimpang kering temulawak, yang berarti bahwa sampel ekstrak etanolik mengandung jumlah cemaran bakteri yang paling sedikit dibandingkan sampel yang lain. Hal ini disebabkan karena proses ekstraksi menggunakan cairan penyari etanol 70%. Cairan etanol 70% ini merupakan desinfektan yang efektif untuk membunuh berbagai jenis mikroba melalui mekanisme denaturasi protein (Jawetz, 1995). Penggunaan etanol 70% sebagai cairan penyari pada proses maserasi akan membunuh sel-sel bakteri yang ada sehingga terjadi pengurangan nilai ALT.
Dari tiga jenis sampel hasil olahan rimpang temulawak yang diuji, semuanya menunjukkan nilai ALT yang masih jauh melebihi batas, meskipun proses pengolahan rimpang temulawak sudah dilakukan sesuai standar teknis pengolahan rimpang temulawak (Anonim, 2006). Hal ini selain disebabkan karena adanya cemaran bakteri yang memang berasal dari sampel, tetapi juga dapat disebabkan karena ada beberapa faktor yang dapat mempengaruhi nilai ALT yang pada penelitian ini kurang dapat dikontrol oleh peneliti. Beberapa faktor tersebut diantaranya adalah lama dan kondisi penyimpanan sampel. Lama dan kondisi penyimpanan sampel tentunya dapat mempengaruhi jumlah cemaran bakteri.
Selain itu, pada penelitian ini masih mungkin yang terhitung sebagai nilai ALT bukan hanya koloni bakteri saja. Hal ini disebabkan karena pada media yang digunakan masih memungkinkan adanya khamir yang tumbuh, di mana khamir memiliki morfologi yang hampir sama dengan bakteri. Adanya khamir yang masih mungkin tumbuh ini disebabkan karena pada media agar yang digunakan terdapat kandungan air yang cukup tinggi yang merupakan media yang baik bagi pertumbuhan khamir.
46 BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Nilai ALT yang diperoleh untuk rimpang basah temulawak adalah sebesar 2,9x108±0,058x108 koloni/gram sampel; untuk rimpang kering temulawak sebesar 1,4x107±0,058x107 koloni/gram sampel; dan untuk ekstrak temulawak sebesar 1,0x102±0,16x102 koloni/ml sampel.
2. Nilai ALT yang didapatkan dari sampel rimpang basah, rimpang kering, dan ekstrak etanolik melebihi batas persyaratan ALT yang telah ditetapkan pada
SK Menteri Kesehatan Republik Indonesia nomor
661/MENKES/SK/VII/1994 dan Monografi Ekstrak Tumbuhan Obat Indonesia.
B. Saran
1. Perlu dilakukan penelitian mengenai cara pengolahan rimpang temulawak yang dapat mengurangi cemaran bakteri pada rimpang temulawak, seperti adanya pengontrolan pada kondisi simpan rimpang secara khusus sehingga jumlah cemaran bakteri yang ada dapat minimal dan dapat memenuhi persyaratan yang ditetapkan.
2. Pada pengujian ALT perlu digunakan reagen yang dapat membedakan pertumbuhan koloni bakteri dengan koloni mikroba lain, salah satunya adalah
DAFTAR PUSTAKA
Anonim, 1979, Materia Medika, jilid III, 63-70, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1986, Sediaan Galenik, 2-40, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1994a, Peraturan Prundang-undangan Obat Tradisional,Jilid I, 21-5, 9-46, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1994b, Teknologi Pengeringan Simplisia Untuk Pedesaan, Prosiding Symposium Penelitian Bahan Obat Alami,VII, 78-79, Balai Penelitian Tanaman Rempah dan Obat, Bogor.
Anonim, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, Cetakan Pertama, 4-5, Badan Pengawas Obat dan Makanan Republik Indonesia, Jakarta.
Anonim, 2004, Monografi Ekstrak Tumbuhan Obat Indonesia, Vol. I, 114-117, Badan POM RI, Jakarta
Anonim, 2005a, Gerakan Nasional Minum Temulawak, http://www.pom.go.id/oai/info/GNMT.htm, diakses tanggal 28 Januari 2010
Anonim, 2005b, Tanaman Obat Indonesia : Temulawak,
http://www.iptek.net.id/ind/pd_tanobat/view.php?mnu=2&id=129, diakses tanggal 28 Januari 2010
Anonim, 2006, Standar Teknis Prosedur Operasional Pengolahan Temulawak, 2-4, Direktorat Pengolahan Hasil Pertanian, Direktorat Jendral Pengolahan dan Pemasaran Hasil Pertanian, Departemen Pertanian Indonesia, Jakarta. Anonim, 2008, Budidaya dan Pasca Panen Tanaman Obat Untuk Meningkatkan
Kadar Bahan Aktif,
http://balittro.litbang.deptan.go.id/eng/index.php?option=com_content&ta sk=view&id=88&Itemid=44, diakses tanggal 29 Januari 2010
Anonim, 2009a, Faktor Lingkungan Bagi Pertumbuhan Mikroba,
48
Anonim, 2009b, Teknologi Penyiapan Simplisia Terstandar Tanaman Obat, http://balittro.litbang.deptan.go.id/index/view+penyiapan+simplisia&cd =9&hl=id&ct=clnk&gl=id&client=firefox-a, diakses tanggal 29 Januari 2010
Atlas, R. M., 1997, Handbook of Micribiological Media, 2nd Edition, 207, 497, 506, 796, CRC Press Inc, New York.
Djaafar, T.F, dan Rahayu S., 2007, “Cemaran Mikroba Pada Produk Pertanian,
Penyakit yang Ditimbulkan, dan Pencegahannya”, Balai Pengkajian Teknologi Pertanian Yogyakarta, Jurnal Litbang Pertanian.
Fardiaz, S., Mikrobiologi Pangan, Edisi I, 130, Gramedia Pustaka Utama, Jakarta. Hadioetomo, R. S., 1985, Mikrobiologi Dasar dan Praktek-Teknik dan Prosedur
Dasar Dalam Laboratorium, 42-46, Gramedia, Jakarta.
Harborne, J. B., 1987, Metode Fitokimia, 50-51, Penerbit ITB, Bandung.
Huda, M. D. K., Cahyono, B., dan Limantara, L., 2006, “Pengaruh Proses
Pengeringan Terhadap Kandungan Kurkuminoid Dalam Rimpang Temulawak”, Universitas Diponegoro Semarang, Jurnal Teknologi Pangan.
Jawetz, E. J. I., Melnick and Adelberg, E. A., 1995, Mikrobiologi Untuk Profesi Kesehatan, 234-240, 286-290, Diterjemahkan oleh Tonang, A., Edisi XVI, EGC, Jakarta.
Jawetz, E. J. I., Melnick and Adelberg, E. A., 1996, Mikrobiologi Kedokteran,
234-240, 286-290, Diterjemahkan oleh Nugroho, E., dan Maulany, Edisi XX, EGC, Jakarta.
Jayaprakasha, G.K., Rao, L.J.M., Sakariah, K.K., 2005, “Chemistry and Biological Activities of Curcuma Longa”, Trends in Food Science & Technology 16, 533-548.
Lay, B.W., 1994, Analisis ,Mikroba di Laboratorium, Edisi I, 47-54, PT. Raja Grafindo Persada, Jakarta.
Pelczar, J.R., dan Michael, J., 1986, Microbiology, 20-25, Mc Grawhill Book Company, New York.
Plantus, 2008, Sembilan Tanaman Obat Unggulan Hasil Uji Klinis Badan POM,
Pothitirat, W., Supabphol, R., Dritsanapan, W. 2004. “Comparison of Free Radical Scavenging Activity and Curcuminoids Content of Turmeric Extracts Using Different Methods of Extraction”. Mahidol University
Journal of Pharmaceutical Sciences.
Rahardjo, M., dan Otih Rostiana, 2005, Budidaya Tanaman Temulawak, Edisi I, 24-28, Balai Penelitian Tanaman Obat dan Aromatika, Jakarta
Rukmi, I., 2009, “Keanekaragaman Aspergilus Pada Berbagai Simplisia Jamu Tradisional”, Universitas Diponegoro Semarang, Jurnal Sains dan Matematika.
Sembiring, B.S., 2008, Teknologi Pengolahan Tanaman Obat, http://balittro.litbang.deptan.go.id/eng/index.php?option=com_content&
view=article&id=106:teknologi-pengolahan-tanaman-obat&catid=19:artikel&Itemid=38, diakses tanggal 28 Januari 2010 Setiawan, W.A., 2009, Kultivasi, reproduksi, dan Pertumbuhan Mikroba,
http://unila.ac.id/wasetiawan/files/2009/07/kultivasi-repr