i
UJI ANGKA KAPANG/KHAMIR (AKK), ANGKA LEMPENG TOTAL (ALT), DAN IDENTIFIKASIEscherichia coli DALAM JAMU CEKOK
DARI PENJUAL JAMU RACIK “X” DI YOGYAKARTA
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Diajukan oleh : Ribka Alvianita Susetyo
NIM : 108114105
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Karena masa depan sunguh ada, dan harapanmu tidak akan hilang”
Amsal 23:18
“Segala Tulisan yang diilhamkan Allah memang bermanfaat untuk mengajar,
untuk menyatakan kesalahan, untuk memperbaiki kelakuan dan untuk mendidik
orang dalamkebenaran”
2 Timotius 3:16
Dengan penuh ucapan syukur, Tabita Ribka Alvianita Susetyo
vii PRAKATA
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Pengasih atas berkat dan penyertaan-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT), dan Identifikasi Escherichia coli dalam Jamu Cekok dari Penjual Jamu Racik “X” di
Yogyakarta” ini dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penyelesaian skripsi ini tentunya tidak lepas dari bantuan berbagai pihak, baik secara langsung maupun secara tidak langsung. Oleh karena itu penulis hendak mengucapkan terima kasih kepada :
1. Bapak Ipang Djunarko, M.Sc.,Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Pembimbing skripsi ini atas segala kesabaran untuk selalu membimbing, memberi motivasi, dan memberi masukan kepada penulis dalam menyusun skripsi ini.
3. Bapak Prof. Dr. C.J. Soegihardjo, Apt. dan Ibu Damiana Sapta Candrasari, M.Sc. selaku Dosen Penguji skripsi. Terimakasih atas bantuan dan masukkan kepada penulis demi kemajuan skripsi ini.
viii
5. Bapak Jumakir, Pak Sutiyono, dan Bu Septi selaku pembimbing selama melakukan penelitian di Balai Laboratorium Kesehatan Yogyakarta, terimakasih atas bimbingan, ilmu, kesabaran, dan semangat yang selalu dibagikan dalam proses pembuatan skripsi ini.
6. Rekan – rekan penelitian seperjuangan Arellia Oktaviori, Anastasia Ika, Maria Dyah Kartika dan Theresia Nurida, untuk semangat kerjasama yang selalu dibagikan dalam proses penyusunan skripsi.
7. Teman – teman FKK B 2010 Maria Malida Vernandes Sasadara, Brigitta Lynda, Yudhytha Anggarhani, Angelia Rosari, Agriva Devaly, Evan Gunawan, Stefanus Indra, Anggun Indah, Lukas Surya, Cornelia Melinda, Juana Merianti, Desi Irwanta, Sherly Damima, Antonio Leonardo, terima kasih untuk kebersamaan kita.
8. Teman-teman “Wisma Sri Widodo” Mbak Febrin, Mbak Tania, Ejho,
Dephik dan tak lupa Mas Teti atas bantuan, dukungan, semangat, perhatian, tawa dan bersedia menjadi tempat curahan hati.
9. Bryan Wisnu Hernadi, terimakasih untuk dukungan semangat, doa, moodbooster, yang selalu ada selama proses pembuatan skripsi ini.
10. Pihak-Pihak lain yang turut membantu penulis namun tidak dapat disebutkan satu persatu.
ix
kefarmasian, serta semua pihak, baik mahasiswa, lingkungan akademis, maupun masyarakat.
Yogyakarta,
x DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT... xviii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 5
C. Keaslian Penelitian... 6
D. Manfaat Penelitian ... 6
E. Tujuan Penelitian ... 7
xi
A. Obat Tradisional, Jamu dan Cairan Obat Dalam... 8
B. Cara Pembuatan Obat Tradisional yang Baik (CPOTB)... 10
C. Jamu Cekok ... 11
D. Angka Kapang Khamir (AKK) ... 14
E. Angka Lempeng Total (ALT)... 16
F. Escherichia coli... 18
G. IdentifikasiEscherichia coli ... 23
1. Uji fermentasi gula-gula... 23
2. UjiSulfur Indol Motility... 24
3. Uji IMVIC ... 25
H. Keterangan Empiris... 27
BAB III. METODE PENELITIAN... 28
A. Jenis dan Rancangan Penelitian ... 28
B. Variabel Penelitian dan Definisi Operasional ... 28
1. Variabel utama... 28
2. Variabel pengacau ... 28
3. Definisi operasional... 29
C. Bahan Penelitian... 30
1. Bahan utama... 30
2. Bahan kimia ... 30
D. Alat Penelitian... 30
E. Tata Cara Penelitian ... 31
xii
2. Penanganan wadah/kemasan penyiapan sampel ... 31
3. Tahap pra-pengkayaan ... 31
4. Pengujian Angka Kapang Khamir ... 32
5. Uji Angka Lempeng Total ... 34
6. Uji identifikasiEscherichia coli ... 40
7. Pengecatan Gram ... 42
8. Interpretasi hasil ... 43
F. Analisis Hasil ... 43
BAB IV. HASIL DAN PEMBAHASAN ... 44
A. Pengambilan sampel... 44
B. Uji Angka Kapang Khamir (AKK) ... 45
C. Uji Angka Lempeng Total (ALT) ... 50
D. Uji IdentifikasiEscherichia coli ... 53
1. Uji pengkayaan dalam mediaEscherichia coli Broth... 53
2. IsolasiE.colipada sampel jamu cekok dalam mediaTrypon Bile X-Glucoronide... 55
3. Identifikasi dan konfirmasi keberadaanE.colipada sampel jamu cekok ... 56
a. Uji biokimia ... 57
b. Uji SIM ... 60
c. Uji IMVIC ... 62
1. Uji indol ... 63
xiii
3. Uji Voges Proskaeur ... 65
4. Uji sitrat... 67
d. Pengecatan Gram ... 68
E. Uji MPN... 72
1. Uji pendugaan bakteriColiform... 72
2. Uji penegasan bakteriColiform ... 74
3. Uji konfirmasiColiformfekal... 75
BAB V. KESIMPULAN DAN SARAN ... 77
A. Kesimpulan ... 77
B. Saran ... 77
Daftar Pustaka ... 78
Lampiran ... 81
xiv
DAFTAR TABEL
Tabel I. Petunjuk penghitungan TPC (Total Plate Count)... 38
Tabel II. Hasil uji IMVIC ... 43
Tabel III. Angka Kapang Khamir (AKK) Jamu cekok waktu 5 hari inkubasi ... 48
Tabel IV. Angka Kapang Khamir (AKK) dari ke-3 sampel jamu cekok ... 49
Tabel V. Angka Lempeng Total (ALT) jamu cekok waktu inkubai 48 jam... 52
Tabel VI. Angka Lempeng Total (ALT) dari ke-3 sampel jamu cekok ... 52
xv
DAFTAR GAMBAR
Gambar 1. Uji dalam mediaEscherichia coli Broth... 54
Gambar 2. Hasil IsolasiE.coli pada sampel jamu cekok dalam media Trypton Bile X-Glucoronide(TBX) ... 56
Gambar 3. Hasil uji fermentasi gula-gula sampel jamu cekok ... 59
Gambar 4. Hasil uji sulfur sampel jamu cekok ... 61
Gambar 5. Hasil uji motilitas sampel jamu cekok pada media SIM ... 62
Gambar 6. Hasil uji indol sampel jamu cekok pada media SIM ... 64
Gambar 7. Hasil uji metil merah sampel jamu cekok ... 65
Gambar 8. Hasil uji Voges Proskaeur sampel jamu cekok ... 66
Gambar 9. Hasil uji sitrat sampel jamu cekok ... 68
Gambar 10. Hasil Pengecatan Gram biakan bakteri sampel jamu cekok ... 70
Gambar 11. Hasil uji air pada media LTB yang digunakan untuk pembuatan jamu cekok ... 73
xvi
DAFTAR LAMPIRAN
Lampiran 1. Surat Ijin Laboratorium ... 82
Lampiran 2. Hasil uji MPNcoliformdancoliformfekal ... 83
Lampiran 3. Tabel MPN menurut formula Thomas ... 84
Lampiran 4. Foto Penanganan Sampel... 87
Lampiran 5. Nilai ALT sampel jamu cekok inkubasi 24 jam ... 87
Lampiran 6. Perhitungan dan nilai ALT jamu cekok inkubasi 48 jam ... 88
Lampiran 7. Perhitungan dan nilai AKK inkubasi 5 hari ... 90
Lampiran 9. Foto ALT inkubasi 48 jam ... 92
xvii INTISARI
Jamu Cekok merupakan obat tradisional Indonesia yang banyak dikonsumsi oleh masyarakat. Jamu cekok memiliki khasiat menambah nafsu makan, dan kebanyakan dikonsumsi oleh anak-anak. Pembuatan jamu yang kurang memperhatikan sanitasi dan higienitas perlu diwaspadai adanya cemaran mikroba. Adanya cemaran mikroba ini memungkinkan timbulnya penyakit sehingga mengurangi keamanannya bila dikonsumsi oleh anak-anak..
Penelitian ini bertujuan untuk mengetahui Angka Kapang Khamir (AKK), Angka Lempeng Total (ALT), dan keberadaan bakteri patogen Escherichia coli pada sediaan jamu cekok yang dijual oleh salah satu penjual
jamu racik jamu racik “X” di Kota Yogyakarta.
Penelitian ini merupakan penelitian non eksperimental dengan rancangan deskriptif komparatif. Dilakukan replikasi sebanyak tiga kali dan dilakukan uji AKK, ALT, dan identifikasiEscherichia coli.
Hasil penelitian menunjukkan jumlah AKK dalam sampel jamu cekok adalah 2,5 x 104 – 10,0 x 104, Angka Lempeng Total 1,6 x 107 – 2,7 x 107serta positif mengandung bakteriE.coli.
xviii ABSTRACT
Jamu cekok is an Indonesian traditional medicine and has been consuming by Indonesian public especially to increase appetite and it is mostly consumed by children. The manufacture processing that is less attention of hygiene and sanitation may increases possibility of microorganism contaminating. Microorganism contaminating may increases diseases and reduce the safety when it is consumed by children.
The research’s purpose was to provide information about total plate
count, the number of mold/yeast, and the presence of Escherichia coli in jamu
cekok from “X”seller in Yogyakarta.
This research is non-experimental research with descriptive explorative design. Sample replication was counted three times and determination of total plate count, the number of mold/yeast, and identification ofE.coliwere done.
The research’s result of jamu cekokwere show that ranged of total plate count was between 1,6 x 107–2,7 x 107, the number of mold/yeast was beetwen 2,5 x 104–10,0 x 104andE.colicontamination was positive.
1 BAB I PENGANTAR
A. Latar Belakang Penelitian
Perkembangan obat tradisional di jaman modern kini meningkat karena banyaknya masyarakat yang lebih memilih menggunakan obat tradisional daripada obat sintetik. Kecenderungan masyarakat dalam mencari alternatif pengobatan yang berdasar pada “back to nature” (kembali ke alam) dikarenakan efek samping pengobatan yang memanfaatkan bahan-bahan alam relatif lebih kecil, lebih aman, praktis, serta murah (Suharmiati dan Handayani, 2005).
Dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 007 tahun 2012 tentang Registrasi Obat Tradisional pasal 1 ayat 1 disebutkan obat tradisional adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian (galenik) atau campuran dari bahan tersebut yang secara turun menurun telah digunakan untuk dan dapat diterapkan sesuai norma yang berlaku(DepKes RI, 2012).
merupakan alternatif pengobatan untuk mengobati penyakit ringan seperti pegal linu, nyeri saat menstruasi, untuk melancarkan asi, flu, batuk, masuk angin, dan untuk menambah nafsu makan pada anak (Soedarsono dan Harini, 2002).
Dalam Keputusan Kepala Badan Pengawas Obat dan makanan Nomor : Hk.00.05.4.2411 tahun 2004 tentang pengelompokan dan Penandaan Obat Bahan Alam Indonesia antara lain dalam pasal 2 disebutkan bahwa jamu harus memenuhi kriteria : aman sesuai persyaratan yang ditetapkan; klaim khasiat dibuktikan berdasarkan data empiris, dan memenuhi persyaratan mutu yang berlaku. Obat tradisional berdasarkan sumber pembuatnya dapat dikelompokkan sebagai obat tradisional buatan sendiri dan obat tradisional buatan pabrik. Obat tradisional buatan penjual jamu atau lebih dikenal dengan sebutan jamu gendong termasuk dalam kategori jamu buatan sendiri ini banyak digemari oleh masyarakat Indonesia khususnya di Pulau Jawa (Supardi, Herman, Yuniar, 2011).
Dalam budaya masyarakat Jawa dikenal adanya jamu cekok. Jamu cekok adalah jamu khusus yang ditujukan bagi anak-anak yang mengalami penurunan nafsu makan. Penamaan jamu cekok mengacu pada cara pemberian yang diminumkan secara paksa dengan cara memeras jamu ke dalam mulut anak. Jamu cekok ini dipercaya memiliki khasiat sebagai perangsang munculnya nafsu makan pada anak. Jamu cekok adalah ramuan bahan tradisional yang terdiri dari Curcuma xanthorriza Roxb. (temulawak), Zingiber zerumbet L. (lempuyang gajah), Tinospora crispa L. (brotowali), Curcuma aeruginosaRoxb. (temu ireng) sertaCarica papaya L. (pepaya).
Di Yogyakarta terdapat salah satu tempat usaha jamu cekok terkenal yang dijual oleh penjual jamu racik “X” (Limananti& Triratnawati, 2003). Dari hasil observasi yang peneliti lakukan pada proses pembuatan jamu cekok oleh penjual
jamu racik “X” pada bulan September 2013 ini sangat memungkinkan terjadinya kontaminasi bakteri. Kontaminasi ini mungkin terjadi karena dalam proses pembuatan jamu cekok alat-alat yang digunakan kurang higienis dan kurang terjaga kebersihannya serta tempat pembuatannya pun diruangan yang sanitasinya tidak cukup baik sehingga memungkinkan adanya kontaminasi bakteri. Penjual
jamu racik “X” berjualan dari pukul 06.00 sampai 19.30. Produksi jamu dilakukan pada jam 09.00 setiap harinya, jamu yang dibuat pada hari ini akan dijual untuk keesokan harinya. Jeda waktu yang lama ini memungkinkan adanya pertumbuhan bakteri dan jamur. Peneliti memilih melakukan observasi pada penjual jamu “X”
kota Yogyakarta, namun ada juga yang berasal dari luar kota Yogyakarta. Penjual
jamu racik “X” menjual sekitar 20 macam jenis jamu, namun yang paling banyak peminatnya adalah jamu cekok.Sampel jamu cekok yang diambil dari penjual
jamu racik “X” dianggap dapat mempresentasikan cara pembuatan jamu pada
penjual jamu yang lain. Jamu cekok sebagai obat tradisional ini harus memenuhi persyaratan yang berlaku yang ditetapkan oleh Badan Pengawas Obat dan Makanan Republik Indonesia (Limananti& Triratnawati, 2003; Soedarsono dan Harini, 2002).
Dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 007 tahun 2012 tentang Registrasi Obat Tradisional pasal 4 ayat 1 disebutkan bahwa obat tradisional yang dibuat oleh usaha jamu racikan dan usaha jamu gendong tidak memerlukan izin edar. Jamu cekok sebagai produk usaha jamu racikan memang tidak memerlukan izin edar namun, kualitasnya harus dapat dijamin terutama dalam hal kebersihan dan proses pembuatannya sehingga tetap aman dikonsumsi (Depkes RI, 2012).
Escherichia coli adalah bakteri patogen yang bila ada di saluran pencernaan dalam jumlah banyak dapat menimbulkan infeksi dan menyebabkan berbagai penyakit, seperti diare, meningitis, gangguan pada ginjal, kejang perut, demam dan infeksi lainnya (Suriawiria, 1986). Bakteri E.coli digunakan sebagai indikator adanya kontaminasi fecesdan kondisi sanitasi yang tidak baik terhadap air, makanan dan minuman (Fardiaz, 1993). Jamu cekok yang umumnya dikonsumsi oleh anak-anak bila tercemar bakteri E.coli dapat mengakibatkan penyakit infeksi dan diare. Anak-anak memiliki sistem pertahanan tubuh yang lebih rentan dibandingkan dengan orang dewasa. Apabila E.coli masuk ke dalam tubuh maka akan memproduksi toksin berbahaya. Toksin inilah yang dapat menyebabkan diare, ganguan pencernaan, dan komplikasi kesehatan lainnya (Tempo, 2013).
Penelitian ini bertujuan untuk meneliti cemaran mikrobia yang meliputi Angka Kapang Khamir (AKK), Angka Lempeng Total (ALT) dan identifikasi keberadaan bakteri patogen khususnya Escherichia coli pada jamu cekok yang dijual oleh penjual jamu racik “X”sehingga dapat diketahui apakah jamu cekok yang dijual oleh penjual jamu racik “X” sudah memenuhi persyaratan secara
mikrobiologis.
B. Rumusan Masalah
1. Berapakah angka lempeng total dan angka kapang khamir yang terdapat pada sediaan jamu cekok yang dijual oleh penjual jamu racik“X” Yogyakarta?
C. Keaslian Penelitian
Penelitian jamu cekok pernah dilakukan oleh Angelia melaporkan bahwa jamu cekok dapat meningkatkan berat badan pada mencit yang dengan dosis 0,052 mg/20gBB/hari (Angelia, 2007). Penelitian lain yang dilakukan Jauhari (2007) melaporkan bahwa jamu cekok dapat dibuat diformulasikan dalam bentuk sediaan tablet hisap dengan komposisi : jamu cekok 58,7%, manitol 11,3%, dan dekstrosa 30%.Limananti dan Trianawati (2003) melakukan penelitian tentang manfaat jamu cekok dengan melakukan wawancara kepada konsumen terkait khasiat jamu cekok dan budaya masyarakat yang masih melestarikan budaya minum jamu. Sedangkan publikasi penelitian mengenai Uji Angka Kapang Khamir (AKK), Angka Lempeng Total (ALT), dan identifikasi Escherichia coli pada sediaan jamu cekok penjual jamu racik “X” di kota Yogakarta belum pernah dilakukan.
D. Manfaat Penelitian 1. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi mengenai Angka Lempeng Total, Angka Kapang Khamir dan ada tidaknya bakteri Escherichia coli dalam jamu cekok yang dijual olehpenjual jamu racik “X”
di kota Yogyakarta. 2. Manfaat praktis
E. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui kualitas mikrobiologis jamu cekok yang dijual oleh penjual jamu racik “X” di Yogyakarta dalam aspek Angka Kapang Khamir, Angka Lempeng Total dan keberadaanE.coli 2. Tujuan khusus
(1) Mampu memberikan data dan informasi mengenai angka lempeng total dan angka kapang khamir pada jamu cekok penjual jamu racik “X”
Yogyakarta.
8 BAB II
TINJAUAN PUSTAKA
A. Obat Tradisional, Jamu dan Cairan Obat Dalam
Dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 007 tahun 2012 pada pasal 1 ayat 1 dinyatakan : Obat Tradisional adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian (galenik), atau campuran dari bahan tersebut yang secara turun temurun telah digunakan untuk pengobatan, dan dapat diterapkan sesuai dengan norma yang berlaku di masyarakat (DepKes RI, 2012).
Berdasarkan data WHO pada tahun 2005 sekitar 80% penduduk dunia pernah menggunakan obat herbal. Di Indonesia obat tradisional masih sangat sering digunakan. Data ini didukung dengan hasil riset dari Susenas (Survey Sosial Ekonomi Nasional) pada tahun 2007 bahwa tercatat 65,01% penduduk Indonesia yang mengeluh sakit dalam waktu kurang dari sebulan akan memilih melakukan pengobatan sendiri dengan menggunakan obat tradisional. Menurut data Riskesdas tahun 2010, 50% penduduk Indonesia mengkonsumsi jamu untuk terapi alternatif dan sebagai upaya untuk memelihara kesehatan (Supardi, Herman, Yuniar, 2010)
baku dari lingkungan sekitar. Obat tradisional buatan penjual jamu salah satunya adalah jamu gendong, yaitu suatu bentuk minuman yang sangat digemari masyarakat di Jawa, dan di berbagai pulau lain di Indonesia.Konsumsi jamu sebagai upaya pengobatan telah dikenal luas dan dimanfaakan masyarakat untuk tujuan mengobati penyakit ringan, mencegah datangnya penyakit, menjaga ketahanan dan kesehatan tubuh, serta untuk tujuan kecantikan (Supardi, Herman, Yuniar, 2010).
Jamu merupakan cairan obat dalam. Jamu adalah obat tradisional yang tidak memerlukan pembuktian ilmiah sampai uji klinis, tetapi cukup dengan bukti empiris (Handayani dan Suharmiati, 2002). Sebagaimana diatur dalam Keputusan Menteri Kesehatan RI No : 661/Menkes/SK/VII/1994, persyaratan obat tradisional yang meliputi keseragaman volume, angka kapang khamir, angka lempeng total, mikroba patogen, aflatoksin, bahan tambahan cairan obat dalam seperti pengawet dan pewarna, wadah dan peyimpanan. Angka kapang khamir tidak boleh lebih dari 103dan lempeng total yang diperbolehkan adalah tidak lebih dari 104. Mikroba patogen harus mempunyai nilai negatif. Mikroba patogen yang dimaksud adalah semua mikroba yang dapat menyebabkan orang menjadi sakit bila kemasukan mikroba tersebut. Obat tradisional untuk penggunaan obat dalam termasuk di dalamnya cairan obat dalam perlu diwapadai adanya mikroba seperti :Salmonella, Escherichiacoli, Staphylococcus aureus, dan Pseudomonas aeruginosa. Cairan obat dalam tidak boleh mengandung bakteri patogen karena
penyakit. Persyaratan obat tradisional yang baik bertujuan untuk melindungi konsumen dan menjaga mutu dari obat tradisional itu sendiri (BPOM, 1994).
B. Cara Pembuatan Obat Tradisional Yang Baik (CPOTB) Pembuatan obat tradisional termasuk jamu harus memenuhi kriteria dan persyaratan yang ditentukan. Badan Pengawas Obat dan Makanan (BPOM) pada tahun 2005 menyatakan bahwa obat tradisional merupakan produk yang dibuat dari bahan alam yang jenis dan sifat kandungannya sangat beragam sehingga untuk menjamin mutu obat tradisional diperlukan cara pembuatan yang baik dengan lebih memperhatikan proses produksi dan penanganan bahan baku (BPOM, 2005).
Cara Pembuatan Obat Tradisional yang Baik (CPOTB) meliputi seluruh aspek yang menyangkut pembuatan obat tradisional, yang bertujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya. Tujuan dari CPOTB ini adalah untuk melindungi masyarakat terhadap hal-hal merugikan dari penggunaan obat tradisional yang tidak memenuhi persyaratan mutu (BPOM, 2005).
dalam proses pembuatan produk jamu, sehingga kualitas mutu tetap terjamin dan aman untuk dikonsumsi. Usaha jamu gendong dan jamu racik tidak memerlukan ijin edar karena lingkup distribusinya yang kecil sehingga pengawasannya dianggap mudah (DepKes RI, 2012).
C. Jamu Cekok
Jamu cekok merupakan ramuan bahan tradisional yang secara empiris berdasarkan pengalaman turun-temurun dipercaya memiliki khasiat sebagai perangsang munculnya nafsu makan pada anak. Istilah cekok mengacu pada cara atau metode pemberian jamu yaitu dengan cara meminumkan jamu secara paksa langsung ke dalam mulut anak. Pertama-tama ramuan jamu yang masih berupa campuran tumbuh-tumbuhan, rempah-rempah yang telah dihaluskan dan diberi sedikit air, ditempatkan padaselembar kain kecil serupa sapu tangan, kemudian ujung-ujungnya disatukan (seperti membungkus). Anak yang akan dicekok biasanya menunjukkan sikap menolak dan berontak, dipangku orang tuanya dengan posisi agak berbaring. Selanjutnya hidung anak dipencet sehingga mulutnya akan terbuka dengan sendirinya. Pada saat inilah jamu yang telah disiapkan diperas di mulut anak sehingga cairannya masuk ke dalam mulut. (Limananti dan Triratnawati, 2003)
cekok ini cukup mudah dan sederhana hanya dengan menghaluskan semua bahan, dikukus, lalu didiamkan dan ketika ada pembeli datang baru diperas dan dicekokkan, atau dibawa pulang. Pembuatan jamu ini biasanya dilakukan pukul 09.00 dan jamu yang dibuat akan dijual keesokan harinya.
Komponen jamu cekok yang digunakan meliputi : a. Temulawak (Curcuma xanthorrizaRoxb.)
Temulawak merupakan tanaman asli Indonesia dan termasuk salah satu jenis temu-temuan yang paling banyak digunakan senagai bahan baku obat tradisional. Selain itu, temulawak merupakan sumber bahan pangan, pewarna, bahan baku industri seperti kosmetika, maupun dibuat makanan atau minuman segar. Sebagai ramuan obat tradisional, temulawak dapat digunakan sebagai bahan obat utama (remedium cardinale), bahan obat penunjang (remedium adjuvans), pemberi warna (corrigenta odoris). Secara empiris, temulawak digunakan sebagai obat dalam bentuk tunggal maupun campuran. Rimpang temulawak berbau tajam, rasanya pahit agak pedas. Temulawak mempunyai khasiat laktagoga, kolagoga dan digunakan dalam pengobatan perut kembung, sembelit, diare, haid tidak lancar, serta menambah nafsu makan (Dalimartha, 2006).
b. Lempuyang gajah (Zingiber zerumbet)
(Hariana, 2006). Tanaman Lempuyang gajah berwarna hijau agak kehitaman, bagian rimpang muda maupun rimpang tua berwarna kuning muda dengan daging berwarna kuning. Rimpang berasa pahit getir dan berbau wangi (Rukmana, 2004).
c. Brotowali (Tinospora crispaL.)
Secara turun temurun, brotowali sudah banyak dimanfaatkan oleh masyarakat Indonesia sebagai obat demam, sakit perut, mengobati gatal-gatal, luka yang sulit disembuhkan seta digunakan sebagai penambah nafsu makan. Brotowali dapat memberikan efek farmakologis seperti analgesik, anti-inflamasi, antikoagulan, tonikum, antiperiodikum, dan diuretik (Kresnady, 2003).
d. Temu ireng (Cucurma aeruginosaRoxb.)
Temu ireng berasal dari famili Zingiberaceae. Rimpangnya mempunyai rasa pahit, tajam dan sifatnya dingin. Berkhasiat sebagai peluruh flatus (karminatif), peluruh dahak, meningkatkan nafsu makan (stomakik), anthelmintik, pembersih darah setelah melahirkan atau setelah haaid (Hariana, 2006).
e. Daun Pepaya (Carica papayaL.)
glikosid, karposid dan saponin, sakarosa, dekstrosa, dan levulosa (Santoso, 2006).
D. Angka Kapang Khamir (AKK)
Angka kapang/khamir adalah jumlah koloni kapang dan khamir yang ditumbuhkan dalam media yang sesuai selama 5 hari pada suhu 20-25OC dan dinyatakan dalam satuan koloni /mL (Soekarto, 2008).
Kapang merupakan mikroorganisme bersel banyak yang membentuk miselia yang tampak sebagai benang-benang halus. Mikroba ini membentuk spora sebagai salah satu alat perkembangbiakannya. Kapang juga dapat membentuk mikotoksin yang telah dikenal sebagai penyebab keracunan akut maupun kronis (Depkes RI, 1998).
Khamir adalah mikroorganisme bersel satu dengan bentuk oval dan berukuran lebih besar daripada bakteri. Khamir dapat tumbuh pada makanan, peralatan pengolahan pangan, atau permukaan bangunan yang mengandung sedikit air dan zat gizi yang mungkin berasal dari sisa makanan yang tidak dibersihkan secara sempurna (DepKes RI, 1998).
antibiotik, anak-anak, dan orang yang terinfeksi HIV. Mikotoksin merupakan toksin yang diproduksi oleh jamur. Mikotoksin yang sering ditemukan adalah aflatoksin yang diproduksi oleh Aspergilus flavus dan Aspergillus parasiticus. Fungi ini secara alami terdapat dalam tanah, kacang tanah, jagung, beras, singkong, kacang-kacangan, cabai dan rempah-rempah (Pratiwi, 2008). Bahan makanan dan minuman yang disimpan pada suhu hangat dan basah dapat diinfeksi oleh jamur sehingga mengkotaminasi makanan dengan aflatoksin. Pada manusia aflatoksin dapat menyebabkan toksigenik (menimbulkan keracunan), mutagenik (menimbulkan mutasi), dan dapat meningkatkan risiko karsinoma hepatoseluler (Underwood, 1999). Salah satu contoh khamir yang paling sering ditemukan menimbulkan infeksi pada manusia adalah golongan Candida. Candida adalah anggota flora normal yang terdapat pada saluran pencernaan, selaput mukosa saluran pernapasan, vagina, uretra, kulit dan dibawah jari-jari kuku tangan dan kaki. Penyakit yang disebabkan oleh ragi spesies Candida disebut kandidiasis, kandidiasis dapat bersifat akut atau subakut dan dapat menyebabkan infeksi pada mulut, vagina, kulit, kuku, bronki, atau paru-paru. Terkadang infeksi Candida dapat menyebabkan septikemia, endokarditis, atau meningitis. Infeksi Candida umumnya terjadi apabila kondisi tubuh inang sedang mengalami penurunan daya tahan tubuh (Kuswadji, 1999).
menjadi alkohol dan CO2. Contoh khamir yang yang dapat menyebabkan pembusukan bahan pangan adalahSaccaromyces cerevisiae(SNI, 2009).
Jumlah kapang (jamur) dan khamir yang besar, menunjukkan kemunduran dari mutu obat tradisional. Kapang dan khamir akan berkembang biak bila tempat tumbuhnya cocok (DepKes RI, 1994).
Untuk mengetahui jumlah AKK dapat dilakukan dengan metode MA PPOM nomor 96/mik/00. Uji AKK memiliki prinsip pertumbuhan kapang khamir setelah cuplikan diinokulasikan pada media yang sesuai dan diinkubasikan pada suhu 20-25°C. (Fardiaz, 1993). Perhitungan AKK berdasarkan prosedur Metode analisis Pusat Pengujian Obat dan Makanan (MA PPOMN, 2006).
E. Angka Lempeng Total (ALT)
Keputusan Menteri Kesehatan RI No: 661/Menkes/SK/VII/1994 menyatakan bahwa perlu dicegah peredaran obat tradisional yang tidak memenuhi persyaratan keamanan, kemanfaatan dan juga mutu. Salah satu parameter yang dipersyaratkan adalah Angka Lempeng Total (ALT) (DepKes RI, 1994).
Angka Lempeng Total (ALT) adalah pertumbuhan bakteri mesofil aerob setelah sampel diinkubasi dalam perbenihan yang cocok selama 24-48 jam pada suhu 37°C. Dalam pengujian ALT digunakan metode pour plate dengan cara menginokulasikan bakteri pada media agar tuang pada suhu 45°C dalam cawan petri. Ketika agar memadat, sel-sel bakteri tidak dapat bergerak dalam agar dan akan tumbuh menjadi koloni (SNI, 1992).
Uji Angka Lempeng Total dan lebih tepatnya ALT aerob mesofil atau anaerob mesofil menggunakan media padat dengan hasil akhir berupa koloni yang dapat diamati secara visual berupa angka dalam koloni (cfu) per ml/g atau koloni/100ml. Prinsip pengujian Angka Lempeng Total menurut metode Analisis Mikrobiologi (MA PPOMN nomor 96/mik/00) yaitu pertumbuhan koloni bakteri aerob mesofil setelah cuplikan diinokulasikan pada media lempeng agar dengan metode pour plate dan diinkubasi pada suhu yang sesuai. Pada pengujian Angka Lempeng Total menggunakan media PCA (Plate Count Agar) sebagai media padatnya. Digunakan juga pereaksi khusus Triphenyl Tetrazolium Chloride 0,5 % (TTC) (BPOM, 2008).
Angka Lempeng Total harus ditekan sekecil mungkin. Meskipun mikroba tersebut tidak membahayakan bagi kesehatan, tetapi kadang-kadang karena pengaruh sesuatu yang dapat menjdi mikroba membahayakan. Yang jelas angka lempeng total tersebut dapat digunakan sebagai petunjuk tingkat berapa industri tersebut melaksanakan Cara Pembuatan Obat Tradisional yang Baik (CPOTB). Makin kecil angka lempeng total bagi setiap produk makin tinggi nilai pengetrapan CPOTB di industri tersebut (DepKes RI, 1994).
Perhitungan jumlah bakteri yang hidup (viable count) menggambarkan jumlah sel yang hidup, sehingga lebih tepat apabila dibandingkan dengan cara total cell count. Pada metode ini setiap sel mikroba yang hidup dalam suspensi
akan diamati dan dan dihitung jumlah koloni yang tumbuh dan merupakan perkiraan atau dugaan dari jumlah mikroba dalam suspensi tertentu (Hadioetomo, 1993).
Koloni yang tumbuh tidak selalu berasal dari 1 sel mikroba, karena ada beberapa mikroba tertentu yang cenderung berkelompok atau berantai. Bila ditumbuhkan pada media dan lingkungan yang sesuai, kelompok bakteri ini akan menghasilkan 1 koloni. Oleh karena itu, seringkali digunakan istilah Colony Forming Unit (CFU) untuk menghitung jumlah mikroba hidup. Sebaiknya hanya lempeng agar yang mengandung 25-250 koloni saja yang digunakan dalam perhitungan (SNI, 1992).
Lempeng agar dengan koloni>250 koloni akan sulit dihitung sehingga kemungkinan adanya kesalahan dalam penghitungan sangat besar. Digunakan pengenceran sampel untuk membantu memperoleh perhitungan dalam jumlah yang benar (Lay, 1994).
F. Escherichia coli
Mikroba yang paling umum digunakan sebagai indikator adanya pencemaran feses dalam air, bahan makanan maupun minuman termasuk jamu adalah Escherichia coli. E.coli merupakan spesies dengan habitat dalam saluran pencernaan dan saluran non pencernaan seperti tanah dan air. Mikroba dari jenis tersebut selalau terdapat dalam kotoran manusia. E.coli merupakan mikroba dari kelompok Coliform. Mikroba dari kelompok Coliform secara keseluruhan tidak umum hidup atau terdapat di air, makanan ataupun minuman, sehingga keberadaannya dapat dianggap sebagai petunjuk terjadinya pencemaran kotoran dalam arti luas, baik dari kotoran hewan ataupun manusia(Purnawijayanti, 2001).
Infeksi Escherichia coli seringkali berupa diare yang disertai darah, kejang perut, demam, dan terkadang dapat menyebabkan gangguan pada ginjal. InfeksiEscherichia colipada beberapa penderita, anak-anak dibawah 5 tahun, dan orang tua dapat menimbulkan komplikasi yang disebut sindrom uremik hemolitik. Sekitar 2 – 7% infeksi E.coli dapat menimbulkan komplikasi. Berdasarkan sifat virulensinya, E.coli yang dapat dikelompokan menjadi E.coli yang dapat menyebabkan infeksi intestin, antara lain :
1.Escherichia colienteropatogenik (EPEC)
2.Escherichia colienterotoksigenik (ETEC)
ETEC merupakan diare penyebab diare pada anak dan wisatawan yang bepergian ke daerah yang bersanitasi buruk. Oleh karena itu, diare yang disebabkan bakteri ini sering disebut juga sebagai diare wisatawan. Faktor kolonisasi ETEC yang spesifik untuk manusia adalah fimbria adhesin. Faktor ini dapat menyebabkan ETEC melekat pada epitel usus halus sehingga biasanya menyebabkan diare tanpa demam. Beberapa galur bakteri ini menghasilkan eksotoksin yang tidak tahan panas (LT), ETEC juga memproduksi toksin yang tahan panas (ST). Toksin yang tahan panas (ST) tahan dalam air mendidih selama 30 menit. Enterotoksin yang stabil dalam pemanasan ini merupakan peptida yang memiliki bobot molekul sekitar 4000 dalton. Karena ukurannya yang kecil inilah, toksin ST diperkirakan sulit diinaktifkan oleh pemanasan. Toksin ini dapat menyebabkan konsentrasi guanosin monosulfat siklik dalam sitoplasma meningkat sehingga meningkatkan konsentrasi adenosin monofosfat setempat (cAMP). Hal ini menimbulkan hipersekresi air dan klorida secara terus-menerus dan lama yang disertai penghambatan resorpsi natrium. Lumen usus teregang oleh cairan dan mengakibatkan hipermotilitas dan diare.
3. Escherichia colienteroinvasif (EIEC)
4. Escherichia coli enterohemoragik (EHEC)
Jenis bakteri ini menghasilkan suatu toksin yang bernama verotoksin. Nama verotoksin sesuai dengan efek sitotoksik toksin ini pada sel vero, yaitu sel ginjal yang diperoleh dari sel ginjal monyet Afrika (African green monkey). EHEC dapat menyebabkan kolitis berdarah (diare berat yang disertai pendarahan dan sindrom uremik hemolitik (gagal ginjal akut yang disertai anemia hemolitik mikroagiopatik dan trombositopenia).
5. Escherichia colienteroagregatif (EAEC)
EAEC merupakan penyebab utama diare pada masyarakat berkembang. Bakteri ini dapat menimbulkan diare akut dan kronis. EAEC melekat pada sel manusia dengan pola yang khas dan menyebabkan diare yang tidak berdarah, tidak menginvasi, dan tidak menyebabkan inflasi pada mukosa intenstin. EAEC diperkirakan memproduksi entero aggregative ST toxin (EAST), yang merupakan suatu enterotoksin yang tidak tahan panas. EAEC juga memproduksi hemolisin yang diproduksi galur E.coli yang dapat menyebabkan infeksi saluran kemih. Peranan toksin dan hemolisin dalam virulensi EAEC belum diketahui dengan pasti (Radji, 2009).
Escherichia coli adalah bagian normal dari flora saluran usus. Escherichia coliseringkali diduga sebagai penyebab timbulnya diare. Mekanisme E.colimenimbulkan diare yaitu :
aktifitas enzim adenil siklase dalam sel mukosa usus halus dan merangsang sekresi cairan yang mempunyai kekuatan 100 kali lebih rendah dibandingkan toksin kolera dalam menimbulkan diare. Sedangkan toksin ST bekerja dengan cara mengaktivasi enzim guaiakolat siklase menghasilkan siklik guanosin monofosfat yang dapat menyebabkan gangguan absorpsi klorida dan natrium serta menurunkan motilitas usus halus
b.Escherichia colimenimbulkan diare dengan cara menginvasi langsung lapisan epitelium dinding usus. Ketika invasi lapisan usus terjadi, diare timbul karena pengaruh racun lipopolisakarida dinding sel (endotoksin) (Jawetz, 1996).
manitol, maltosa, dan sukrosa) menjadi asam laktat, asam cuka, CO2 dan asam tertentu lainnya tergantung dari spesies bakterinya, (3) sumber karbon yang digunakan sebagai sumber energi adalah asetat (Holt, 2002).
G. IdentifikasiEscherichia coli
Uji Identifikasi bakteri E.coli adalah serangkaian uji berdasarkan karakteristikE.coli.Uji dilakukan dengan menggunakan media dan reagen khusus seperti, uji fermentasi gula-gula (glukosa, laktosa, manitol, maltosa, sukrosa), uji Sulfur Indol Motility(SIM), dan uji IMVIC (Indol, Metil merah, Voges Proskauer, dan Sitrat). Hasil uji idetifikasi dibandingkan dengan karakterisktik E.coli (Holt, dkk, 2000).
1. Uji fermentasi gula-gula (glukosa, laktosa, manitol, maltosa dan sukrosa) Uji fermentasi gula-gula bertujuan untuk mengetahui kemampuan bakteri dalam menguraikan gula-gula spesifik yang mencerminkan sifat bakteri tersebut dan dapat digunakan sebagai salah satu cara identifikasi bakteri. Masing-masing mikroba mempunyai kemampuan yang berbeda-beda dalam memfermentasikan berbagai karbohidrat. Fermentasi merupakan proses oksidasi biologi dalam keadaan anaerob dimana yang bertindak sebagai substrat adalah karbohidrat. Hasil dari fermentasi berbeda-beda tergantung dari jenis bakterinya. Uji fermentasi karbohidrat dilihat dari pembentukan asam yang akan ditunjukkan dengan adanya perubahan warna medium menjadi kuning dan terbentuknya gas yang terjebak dalam tabung durham (Nugraheni, 2010).
kemampuan E.coli dalam memfermentasikan gula-gula spesifik dapat digunakan sebagai dasar untuk uji identifikasiE.coli(Holt dkk, 2000).
2. UjiSulfur Indol Motility(SIM)
Uji ini terdiri dari tiga parameter pengamatan, yaitu uji pembentukan sulfur (H2S), uji pembentukan Indol dari hasil peruraian asam amino, dan pengamatan pergerakan pertumbuhan bakteri dalam media tabung. Media yang digunakan adalah media SIM yang memiliki komposisi sebagai berikut : (1) Pancreatic Digest of Casein, (2) Peptic Digest of Animal Tissue, (3) Ferrous Ammonium Sulfate, (4) Sodium Thiosulfate, (5) Nutrient Agar. Komposisi media SIM tersebut memungkinkan untuk dilakukan tiga pengujian sekaligus dalam satu media. KandunganFerrous Ammonium SulfatedanSodium Thiosulfatedigunakan untuk uji sulfur, kandungan Nutrien Agar (NA) dapat digunakan untuk uji motilitas sedangkan uji Indol perlu penambahan reagen kovacs (Finegold dan Baron, 1996).
(Nugraheni, 2010). Menurut Holt dkk (2000), bakteri E.coli tidak mampu menghasilkan residu sulfur dalam proses peruian asam amino.
Uji motilitas adalah metode yang digunakan untuk mengidentifikasi E.coli terhadap bakteri lainnya berdasarkan penyebaran koloni karena E.coli memiliki kemampuan bergerak (motil) dalam media SIM. Adanya kandungan NA semisolid dalam media SIM memungkinkan bakteri yang memiliki flagel melakukan pergerakan dalam media tersebut. E.coli memiliki karakteristik mempunyai flagel di seluruh badan (peritrich) sebagai alat gerak dalam habitatnya. Apabila dalam media terdapat pertumbuhan bakteri yang menyebar, maka dinyatakan bakteri yang diidentifikasi tersebut adalah golongan EnterobactertermasukE.coli(Holt dkk, 2000).
3. Uji IMVIC a) Uji indol
Uji indol digunakan untuk mendekteksi ada tidaknya indol dari peruraian triptofan oleh bakteri Coliform. E.coli merupakan jenis bakteri Coliform. Uji ini menggunakan media Sulfur Indol Motility (SIM) dengan penambahan reagen kovacks. Hasil positif ditandai dengan warna merah atau merah muda di permukaan media. Uji ini dilakukan setelah pengamatan motilitas agar tidak menganggu pengamatan motilitas pada media uji (Anonim, 1993).
b) Uji metil merah
meyebabkan terjadinya penurunan pH media pertumbuhan menjadi lebih rendah. Hasil positif ditunjukkan dengan adanya perubahan warna menjadi merah (Lay, 1994).
c) Uji Voges Proskauer
Uji ini berguna untuk mengidentifikasi mikroba yang mampu memfermentasi 2,3-butanadiol. Apabila mikroba mampu memfermentasikan karbohidrat menjadi 2,3-butanadiol sebagai produk utama maka akan terjadi penumpukan bahan tersebut dalam media pertumbuhan. Penambahan reagen kalium hidroksida dan alfanaftol dapat menentukan adanya setoin yang merupakan suatu senyawa perkusor dalam sintesis 2,3-butanadiol. Setelah penambahan reagen kalium hidroksida, adanya asetoin akan ditunjukkan oleh perubahan warna menjadi merah pada medium yang akan diperjelas dengan penambahan alfanaftol (Lay, 1994).
d) Uji sitrat
H. Keterangan Empiris
Penelitian ini ingin melihat besarnya Angka Kapang Khamir (AKK), Angka Lempeng Total (ALT), dan ada tidaknya bakteri Escherichia coli dalam
28 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental dengan rancangan penelitian deskriptif eksploratif.
B. Variabel dan Definisi Operasional
Variabel–variabel yang digunakan pada penelitian ini adalah : 1. Variabel utama
a. Variabel bebas
Waktu pengambilan sampel jamu cekok penjual jamu racik jamu racik
“X” di Yogyakarta
b. Variabel tergantung
Angka Lempeng Total, Angka Kapang/Khamir dan keberadaanE.coli 2. Variabel pengacau
a. Variabel pengacau terkendali
larutan metil merah, larutan alfa naftol, lauratan kalium hidroksida, kristal violet, larutan iodium, alkohol 70%, safranin. Suhu inkubasi (37-44oC), dan waktu inkubasi (24-48 jam) untuk uji Identifikasi E.coli.
b. Variabel pengacau tak terkendali
Cara pembuatan jamu cekok, cara penyimpanan setelah pembuatan jamu cekok, waktu penyimpanan jamu cekok setelah pembuatan, kualitas bahan yang digunakan.
3. Definisi operasional
a. Jamu cekok yang digunakan adalah jamu cair dengan komposisi Curcuma xanthorriza, Roxb. (temulawak), Zingiber zerumbet L. (lempuyang gajah), Tinospora crispa L. (brotowali), Curcuma aeruginaosaRoxb. (temu ireng) sertaCarica papayaL. (pepaya).
b. Angka kapang/khamir (AKK) adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung jumlah kapang dan atau khamir yang terdapat dalam jamu cekok.
c. Angka lempeng total (ALT) adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung jumlah bakteri aerob mesofil yang terdapat dalam jamu cekok
C. Bahan Penelitian 1. Bahan utama
Bahan utama yang digunakan yaitu jamu cekok yang dijual oleh penjual jamu racik“X” di kota Yogyakarta
2. Bahan kimia
a. Media yang digunakan untuk pengujian AKK adalah Potato Dextrose Agar(PDA).
b. Media yang digunakan dalam pengujian ALT adalah Plate Count Agar (PCA).
c. Media untuk uji konfirmasi (IMVIC) E.coli menggunakan media TryptonBroth (TB), Methyl-Red Voges Proskauer (MR-VP), Simon’s Citarte agar(SCA).
d. Kloramfenikol 1%, PDF (Pepton Dilution Fluid), aquadest steril, etanol 70%, pereaksi indol, larutan metil merah, larutan α-naftol, larutan KOH 40%
e. Larutan gula-gula (glukosa, laktosa, manitol, maltosa, sukrosa), Kontrol positif E.coli ATCC 25922, Media Tryptone Bile X-Glucoronide(TBX), MediaE.coli Broth(ECB)
D. Alat Penelitian
Microbiologycal Safety Cabinet, Autoclaf (KT-40 ALP), Inkubator, Oven
E. Tata Cara Penelitian 1. Pemilihan sampel
Sampel jamu yang dipilih diambil dari jamu cekok yang dijual olehpenjual jamu racik X di kota Yogyakarta.
2. Penanganan wadah/kemasan penyiapan sampel
Kemasan jamu yang akan dibuka dibersihkan dengan kapas beralkohol 70% kemudian dibuka secara aseptis di dekat nyala api spiritus.
3. Tahap pra-pengkayaan
a. Homogenisasi sampel untuk uji AKK
10 ml jamu cekok diambil dan dimasukan kedalam labu ukur 100 ml kemudian ditambahkan larutan pengencer Pepton Dilution Fluid (PDF) hingga tanda batas sehingga diperoleh pengenceran 10-1.
b. Homogenisasi sampel untuk uji ALT
Secara aseptis diambil sebanyak 10 ml sampel ke dalam labu ukur 100 ml, lalu ditambahkan 90 ml BPW dan dihomogenkan hingga diperoleh pengenceran 10-1
c. Pengenceran sampel untuk uji AKK
d. Pengenceran sampel untuk uji ALT
5 buah labu ukur 10 ml disiapkan, masing-masing telah diisi dengan 9 ml pengencer BPW. Dipipet 1 ml pengenceran 10-1 dari hasil homogenisasi pada penyiapan sampel dan dimasukkan ke dalam tabung pertama yang telah diisi 9 ml BPW hingga diperoleh pengenceran 10-2 dan dihomogenkan dengan menggunakan vortex. Kemudian dibuat pengenceran selanjutnya hingga 10-5.
4. Pengujian Angka Kapang Khamir a. Pembuatan larutan kloramfenikol
Sebanyak 1 gram kloramfenikol dilarutkan ke dalam 100 ml aquadest steril.
b. Pembuatan media Potato Dextrose Agar (PDA)
Sebanyak 39 gram serbuk PDA disuspensikan dalam 1000 ml aquadest, kemudian dilarutkan dengan pemanasan dan diaduk hingga merata, dimasukkan dalam wadah yang sesuai. Kemudian ditambahkan kloramfenikol 100 gram/L media dicampur hingga merata. Sterilisasi dengan autoklaf selama 15 menit pada suhu 121°C. Kemudian dituang ke dalam cawan petri atau tabung reaksi steril dan dibiarkan memadat.
c. Uji Angka Kapang Khamir
campuran tersebut merata. Setelah agar membeku, cawan petri dibalik dan diinkubasikan pada suhu 25oC atau pada suhu kamar selama 5 hari. Pengamatan dilakukan setiap hari sampai hari ke-5. Koloni kapang dan khamir dihitung setelah 5 hari.
Uji sterilitas media dilakukan dengan menuangkan media PDA dalam cawan petri dan dibiarkan memadat. Uji sterilitas pengencer dilakukan dengan cara menuangkan media PDA dan 1 ml pengencer (PDF) lalu dibiarkan memadat.
d. Cara menghitung dan menyatakan Hasil
Cara menghitung dan menyatakan hasil AKK sesuai dengan MA PPOMN nomor 96/mik/00. Cawan petri dipilih dari suatu pengenceran yang menunjukkan jumlah koloni antara 10-150 koloni. Jumlah koloni dari kedua cawan dihitung lalu dikalikan dengan faktor pengencerannya. Bila pada cawan petri dari 2 tingkat pengenceran yang berurutan menunjukkan jumlah antara 10-150, maka dihitung jumlah koloni dan dikalikan faktor pengenceran, kemudian diambil angka rata-rata. Hasil dinyatakan sebagai angka kapang/khamir dalam tiap ml atau gram contoh. Untuk beberapa kemungkinan lain yang berbeda dari pernyataan diatas, maka diikuti petunjuk sebagai berikut.
b. Bila pada tingkat pengenceran yang lebih tinggi didapat jumlah koloni lebih besar dari dua kali jumlah koloni pada pengenceran dibawahnya, maka dipilih tingkat pengenceran terendah (misal pada pengenceran 10-2 diperoleh 60 koloni dan pada pengenceran 10-3 diperoleh 20 koloni, maka dipilih jumlah koloni pada tingkat pengenceran 10-2yaitu 20 koloni). c. Bila dari seluruh cawan petri tidak ada satupun yang menunjukkan jumlah antara 10-150 koloni, maka dicatat angka sebenarnya dari tingkat pengenceran terendah dan dihitung sebagai angka kapang/khamir perkiraan
d. Bila tidak ada pertumbuhan pada semua cawan dan bukan disebabkan karena faktor inhibitor, maka angka kapang/khamir dilaporkan sebagai kurang dari satu dikalikan faktor pengenceran terendah.
(MA PPOMN, 2006) 5. Uji Angka Lempeng Total
a. Pembuatan MediaPlate CountAgar (PCA)
Sebanyak 7,05 g PCA ditimbang dan di campurkan dengan 300 ml aquadest, dipanaskan hingga larutan jernih. Kemudian disterilkan dengan autoklaf selama 15 menit pada suhu 121oC
b. Larutan PengencerBuffered Pepton Water(BPW)
c. Uji Angka Lempeng Total (ALT)
Dari masing-maisng pengenceran dipipet 1 ml ke dalam cawan petri steril secara duplo. Dalam setiap cawan petri dituangkan sebanyak 15 ml media PCA yang telah dicairkan yang bersuhu 45±1oC dalam waktu 15 menit dari pengenceran pertama. Cawan petri digoyangkan dengan hati-hati agar sampel tersebar merata kemudian dibuat duplo. Dilakukan pula uji kontrol untuk mengetahui sterilitas media dan pengencer. Uji sterilitas media dilakukan dengan cara menuangkan media PCA dalam suatu cawan petri dan biarkan memadat. Uji sterilitas pengencer dilakukan dengan cara menuangkan media PCA dan 1 ml pengencer BPW lalu dibiarkan memadat.
Seluruh cawan petri diinkubasi terbalik pada suhu 35oC selama 24 jam hingga 48 jam. Jumlah koloni yang tumbuh diamati dan dihitung. Dihitung Angka Lempeng total dalam 1 ml contoh dengan mengkalikan jumlah rata-rata koloni pada cawan dengan faktor pengenceran yang digunakan.
(SNI, 1992) d. Cara menghitung dan menyatakan hasil
Cara menganalisis hasil pengujian sesuai Prosedur baku pengujian mikrobiologi, Direktorat Jenderal Pengawasan Obat dan Makanan DepKes RI (1992)
koloni dan kalikan dengan faktor pengencer. Nyatakan hasilnya sebagai jumlah bakteri per ml atau gram.
2) Jika cawan duplo dari pengeceran terendah terdapat jumlah koloninya lebih kecil dari 25, hitung jumlah koloni yang ada pada cawan dari setiap pengenceran, rerata jumlah koloni per cawan dan kalikan dengan faktor pengencerannya untuk menetukan nilai Total Plate Count(TPC). Nyatakan hasilnya sebagai jumlah bakteri per ml atau gram (Tabel 1 nomor 3)
3) Jika hasil dari cawan duplo, cawan yang satu dengan 25 koloni sampai dengan 250 koloni dan cawan yang lain lebih dari 250 koloni, hitung kedua cawan dalam penghitungan TPC (Tabel 1 nomor 7)
4) Jika hasil dari cawan duplo, cawan yang satu dengan koloni 25-250 dan cawan yang lain kurang dari 25 atau menghasilkan lebih dari 250 koloni, hitung keempat cawan dalam penghitungan TPC (tabel 1 nomor 8)
5) Jika kedua cawan dari satu pengeceran menghasilkan 25-250 koloni hitung keempat cawan termasuk cawan yang kurang dari 25 atau yang lebih dari 250 koloni dalam penghitungan TPC (tabel 1 nomor 9)
6) Jika jumlah koloni dari semua lebih dari 250 koloni :
satu bagian atau lebih, untuk mendapatkan jumlah koloni dalam satu cawan petri, hitung rata-rata jumlah koloni dan kalikan dengan faktor pembagi dan pengenceran.
ii. Jika 1/8 bagian cawan petri terdapat lebih dari 200 koloni maka jumlah koloni yang didapat 8x200 = 1600, kemudian dikalikan dengan faktor pengencer dan nyatakan hasilnya sebagai jumlah bakteri perkiraan per ml atau gram lebih besar dari jumlah yang didapat (lebih besar dari 1600xfaktor pengencer) (table 1 nomor 4)
7) Jika tidak koloni yang tumbuh dalam cawan petri, nyatakan jumlah bakteri perkiraan lebih kecil dari satu dikalikan dengan faktor pengencer terendah (<10) (Tabel 1 nomor 6)
8) Menghitung koloni merambat (spreader). Ada tiga macam perambat pada koloni, yaitu :
i) Merupakan rantai yang tidak terpisah-pisah,
ii) perambat yang terjadi di antara dasar cawan petri dan perbenihan, dan
iii) perambat yang terjadi pada pinggir atau permukaan perbenihan Maka cara menghitungnya adalah sebagai berikut.
ii. Apabila terjadi hanya satu perambatan seperti rantai, maka koloni dianggap satu. Tetapi apabila satu atau lebih rantai yang terbentuk dan berasal dari sumber yang terpisah-pisah, maka tiap sumber dihitung sebagai satu koloni.
iii. Rerata jumlah koloni dari setiap pengenceran, dilaporkan jumlahnya sebagai TPC (Tabel 1 nomor 5)
iv. Gabungkan perhitungan koloni dan perhitungan spreader untuk menghitung TPC
v. Apabila butir kedua dan ketiga yang terjadi, sebaiknya pemeriksaan diulang, karena koloni dalan keadaan sulit dihitung.
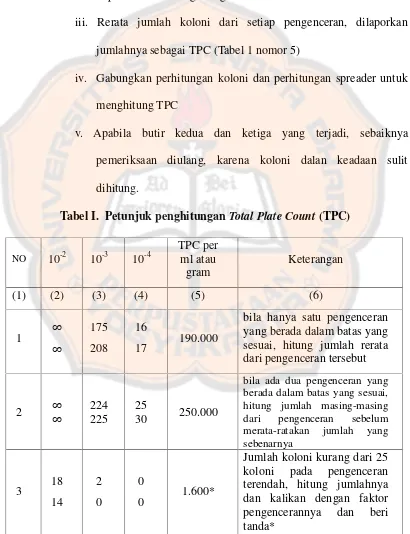
Tabel I. Petunjuk penghitunganTotal Plate Count(TPC)
NO 10-2 10-3 10-4
NO 10-2 10-3 10-4
Jumlah koloni lebih dari 250 koloni, hitung koloni yang dapat dihitung atau yang mewakili, beri tanda*
NO 10-2 10-3 10-4 kurang dari 25 koloni atau lebih dari 250 koloni, kemudian rerata jumlah sebenarnya.
e. Cara menghitung dan membulatkan angka
Dalam melaporkan jumlah koloni atau jumlah koloni perkiraan hanya 2 angka penting yang digunakan, yaitu angka yang pertama dan kedua (di mulai dari kiri), sedangkan angka ketiga diganti dengan 0, apabila kurang dari 5 dan apabila 5 atau lebih dijadikan 1 yang ditambah pada angka yang ke dua.
Contoh: 523.000 dilaporkan sebagai 520.000 (5.2 x 105), 85.700 dilaporkan sebagai 86.000 (8.6 x 104)
6. Uji identifikasiEscherichia coli
1. Uji pra-pengkayaan
2. Pengkayaan
Secara aseptik dipipet 10 ml suspensi hasil homogenisasi contoh dan diinokulasikan pada 90 ml ECB. Kemudian diinkubasi pada suhu 35-37oC selama 18-24 jam.
3. Isolasi
Dari biakan pengkayaan diinokulasikan sengkelit pada permukaan TBX dan diinkubasi dengan posisi lempeng terbalik pada suhu 35-37oC selama 24-28 jam. Diamati koloni spesifik yang tubuh dengan ciri-ciri bentuk bulat, diameter 2-3 mm, berwarna hijau dengan kilap logam dan bintik biru kehijauan ditengahnya.
4. Identifikasi dan konfirmasi
Dua atau lebih koloni spesifik pada TBX diinokulasikan pada NA miring, kemudian diinkubasi pada suhu 35-37oC selama 18-24 jam. Dari biakan NA miring akan dilanjutkan dengan uji biokimia melalui Uji IMVIC (Indol, Metil merah, Voges Proskauer, dan Sitrat) dan pewarnaan Gram sebagai berikut :
a. Uji indol
Dari biakan NA miring diinokulasikan 1 sengkelit biakan ke dalam Trypton Brothdan diinkubasikan pada suhu 35-37oC selama 18-24 jam. Setelah diinkubasi ditambahkan 1 ml pereaksi indol (Reagen Kovacs) ke dalam masing-masing tabung dan dikocok beberapa
b. Uji metil merah
Dari biakan NA miring diinokulasikan 1 sengkelit biakan ke dalam MR-VP dan diinkubasikan pada suhu 35-37oC selama 48 jam. Setelah diinkubasi tambahkan 5 tetes larutan metil merah dan dikocok homogen selama beberapa menit. Warna kuning menunjukkan reaksi negatif dan warna merah menunjukkan reaksi positif
c. Uji Voges Proskauer
Dari biakan NA miring diinokulasikan pada media MR-VP dan diinkubasi pada suhu 35-37°C selam 48 jam. Setelah diinkubasi tambahkan 12 tetes larutan alfa naftol dan 4 tetes larutan KOH 40%, dikocok kemudian didiamkan selama 2-4 jam. Jika warna biakan menjadi merah muda hingga merah menyala menunjukkan reaksi positif, warna tidak berubah menunjukkan reaksi negatif d. Uji sitrat
Dari biakan NA miring diinokulasikan pada media Simmon’s citrate agar lalu diinkubasikan pada suhu 35-37oC selama 24-48 jam. Warna biru menunjukkan reaksi positif, warna hijau menunjukkan reaksi negatif.
7. Pengecatan Gram
(gram iodine) selama 1 menit. Cuci dengan air dan tiriskan. Cuci (hilangkan warna) dengan alkohol 95% selama 30 detik. Cuci dengan air, tiriskan dan bubuhkan larutan safranin selama 10-30 detik. Cuci dengan air dan tiriskan. Serap dengan kertas saring, keringkan dan dilakukan pengamatan dengan menggunakan mikroskop pada perbesaran 1000 kali.
8. Interpretasi hasil
Escherichia coli merupakan bakteri gram negatif dan berbentuk batang. Idenifikasi bakteri dilakukan dengan pengamatan menggunakan mikroskop dengan uji sifat biokimia. Sampel dikatakan positif mengandung Escherichia coli menurut MA PPOMN nomor 97/mik/00 bila menunjukkan hasil pada reaksi biokimia IMVIC sebagai berikut :
Tabel II. Hasil uji IMVIC
(SNI, 1992) F. Analisis Hasil
Analisis data dilakukan secara deskriptif eksploratif yaitu dengan menganalisis hasil uji AKK dengan metode MA PPOMN nomor 96/mik/00, analisis ALT dengan metode SNI 01-2897-1992, dan identifikasi E.coli dengan metode MA PPOMN nomor 97/mik/00
Uji Indol Uji Metil Merah Uji Poges Proskauer
Uji Sitrat
-44 BAB IV
HASIL DAN PEMBAHASAN
Kecenderungan masyarakat untuk back to nature menjadikan obat tradisional sebagai pilihan pendamping atau alternatif dari obat sintetik. Hal ini menjadikan jamu sebagai salah satu obat tradisional asli Indonesia menjadi semakin diminati.
Sebagaimana diatur dalam Keputusan Menteri Kesehatan RI No : 661/Menkes/SK/VII/1994, bahwa persyaratan obat tradisional meliputi keseragaman volume, angka kapang khamir, angka lempeng total, mikroba patogen, aflatoksin, bahan tambahan cairan obat dalam seperti pengawet dan pewarna, wadah dan peyimpanan. Angka kapang khamir tidak boleh lebih dari 103 dan lempeng total yang diperbolehkan adalah tidak lebih dari 104. Mikroba patogen harus mempunyai nilai negatif. Di Yogyakarta ada salah satu produk jamu cekok yang sangat diminati baik oleh warga kota Yogyakarta maupun konsumen yang berasal dari luar kota Yogyakarta. Jamu cekok ini kebanyakan dikonsumsi oleh anak-anak sehingga harus memenuhi persyaratan yang berlaku untuk melindungi konsumen.
Uji yang dilakukan meliputi uji Angka Kapang Khamir (AKK), Uji Angka Lempeng Total (ALT) dan uji identifikasi bakteriE.coli.
a. Pengambilan sampel
sampel ini berdasarkan produk jamu cekok penjual jamu racik “X” mempunyai banyak peminat/konsumen dan merupakan produsen pembuat jamu cekok yang terkenal di kota Yogyakarta. Penjual jamu racik “X” ini menjual 20 macam jenis
jamu racik, namun yang paling banyak diminati adalah jamu cekok. Konsumen penjual jamu racik “X” tidak hanya berasal dari wilayah kota Yogyakarta tetapi
ada pula yang berasal dari luar kota bahkan luar pulau Jawa. Sampel yang diambil
hanya dari satu penjual jamu yaitu penjual jamu racik “X” dikarenakan jamu racik
“X” sudah lama dan sangat terkenal serta diminati banyak konsumen, sehingga dianggap dapat mempresentasikan cara pembuatan jamu pada penjual jamu yang lain.
Menurut Gay dan Diehl (1992) analisis penelitian deskriptif dapat menggunakan jumlah sampel sebanyak 10% dari total populasi. Menurut survey yang sudah peneliti lakukan di kota Yogyakarta terdapat lima penjual jamu racik jamu cekok, sehingga dipilih satu sampel yang dianggap dapat mempresentasikan pembuatan jamu cekok oleh penjual yang lain.
Pengambilan sampel dilakukan tiga kali selama tiga minggu berturut-turut setiap pagi hari sekitar pukul 08.00 dimana pada jam tersebut ramai pembeli. Pengambilan sampel menuju tempat dilakukannya uji menggunakancool boxagar meminimalisir terjadinya kontaminasi selama dalam perjalanan (Lampiran 2) b. Uji Angka Kapang Khamir (AKK)
tradisional. Kapang khamir akan berkembang biak bila tempat tumbuhnya cocok untuk pertumbuhan. Kapang khamir dapat tumbuh pada kondisi kelembaban tinggi dan lingkungan yang hangat. Jamu cekok setelah pembuatan langsung disimpan pada wadah tertutup sehingga dapat menyebabkan timbulnya uap air. Uap air yang timbul ini dapat meningkatkan kelembaban jamu cekok. Kondisi penyimpanan yang lembab serta waktu penyimpanan selama hampir 24 jam dapat menyebabkan pertumbuhan kapang khamir.
memiliki struktur sel yang lebih sederhana, sehingga dapat tumbuh lebih cepat dibanding kapang khamir yang struktur selnya lebih rumit (Radji, 2009)
Media yang digunakan adalah PDA (Potato Dextrose Agar) yang ditambah dengan kloramfenikol Penggunaan PDA ini berdasarkan kandungan nutrisi pada PDA yang meliputi ekstrak kentang, Glukosa, dan Agar yang merupakan nutrien yang baik untuk pertumbuhan kapang khamir. PDA adalah media yang direkomendasikan untuk mendeteksi, menumbuhkan dan menghitung kapang khamir pada produk makanan atau minuman (Oxoid 9thedition, 2006).
Fungsi penambahan kloramfenikol adalah sebagai antibakteri sehingga diharapkan koloni yang tumbuh pada media PDA adalah kapang khamir. Kloramfenikol digunakan karena kloramfenikol merupakan antibiotik spektrum luas sehingga banyak bakteri dapat dihambat pertumbuhannya. Kloramfenikol bekerja dengan cara mengikat sub unit ribosom 50s dan menghambat pembentukan ikatan peptida bakteri dan sel prokariotik lainnya (Fardiaz,1992). Ikatan peptida berperan untuk pembentukan dinding sel bakteri. Apabila ikatan peptida tidak terbentuk, maka pembentukan dinding sel akan terganggu dan sel akan lisis. Kloramfenikol tidak akan menghambat pertumbuhan kapang khamir karena kapang khamir adalah sel eukariotik.
bertumpuk sehingga susah diamati dan dilakukan perhitungan. Pengenceran dilakukan hingga 10-5, karena pada tingkat pengenceran kelima sudah didapatkan koloni terpisah. Uji AKK ini menggunakan metode pour plate agar sampel yang ditanam dapat tersebar merata pada cawan petri dan lebih memudahkan dalam melakukan pengamatan serta perhitungan. Untuk mengetahui sterilitas dari media dilakukan uji sterilitas media dengan cara menuangkan media ke dalam cawan petri dan dibiarkan memadat. Selain dilakukan uji sterilitas media dilakukan pula uji pengencer atau kontrol pelarut dengan menuang BPW dan media dalam cawan petri dan dibiarkan memadat.Uji sterilitas media dan pengencer ini bertujuan untuk melihat apakah cara kerja yang dilakukan aseptis atau tidak sehingga dapat dipastikan kapang khamir yang tumbuh benar-benar berasal dari sampel bukan kontaminan dari cara kerja.
Seri pengenceran dilakukan hingga 10-5. Setelah sampel diencerkan dan ditanam pada media PDA, sampel diinkubasi terbalik selam 5 hari pada suhu 20-25°C dan diamati pertumbuhan koloni setiap harinya hingga hari kelima. Inkubasi terbalik ini bertujuan agar uap air yang terbentuk selama masa inkubasi tidak menetes ke media dan mempengaruhi pertumbuhan mikroba.
Nilai AKK dihitung dari cawan petri yang memiliki 10-150 koloni. Berdasarkan tabel III, maka AKK dari tiap sampel dapat ditentukan (Tabel IV) :
Tabel IV. Angka Kapang Khamir (AKK) dari ke-3 sampel jamu cekok
disimpan pada wadah tertutup yang dapat menimbulkan uap air. Uap air yang timbul menyebabkan kelembaban pada wadah meningkat. Kelembaban yang tinggi dapat menjadi tempat pertumbuhan yang baik bagi kapang khamir.
c. Uji Angka Lempeng Total (ALT)
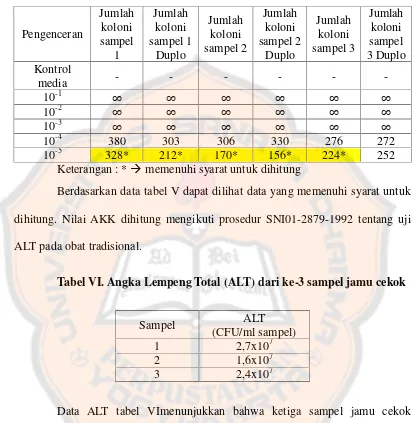
Tabel V. Angka Lempeng Total (ALT) Jamu Cekok Waktu Inkubasi 48 jam
Keterangan : *memenuhi syarat untuk dihitung
Berdasarkan data tabel V dapat dilihat data yang memenuhi syarat untuk dihitung. Nilai AKK dihitung mengikuti prosedur SNI01-2879-1992 tentang uji ALT pada obat tradisional.
Tabel VI. Angka Lempeng Total (ALT) dari ke-3 sampel jamu cekok
Sampel ALT
(CFU/ml sampel)
1 2,7x107
2 1,6x107
3 2,4x107
ada banyaknya debu, dan wadah penyimpanan yang lembab. Penyimpanan selama kurang lebih 24 jam dapat menjadi masa inkubasi untuk petumbuhan mikrobia kontaminan. Dalam pembuatannya jamu cekok ini juga tidak dipanaskan hingga mendidih, sehingga memungkinkan segala kontaminan mikroba dapat tumbuh dengan baik. Pemanasan tidak dilakukan sampai mendidih karena menurut penjual apabila sampai mendidih dikhawatirkan khasiat dari masih-masing bahan akan hilang. Menurut Menkokesra (2013) pada umumnya mikrobia akan mati dengan pemanasan pada suhu 70°C.
d. Uji identifikasiEscherichia coli
Uji identifikasi E.coli bertujuan untuk mengetahui apakah dalam sampel jamu cekok yang digunakan mengandung cemaran bakteri E.coli atau tidak, karena menurut observasi yang sudah peneliti lakukan pada bulan September 2013 pengolahan produksi jamu cekok yang dijual oleh penjual jamu racik “X”
kurang terjamin kebersihannya selama proses pembuatannya serta penyimpanannya yang terlalu lama.
1. Uji Pengkayaan dalam MediaEscherichia coli Broth
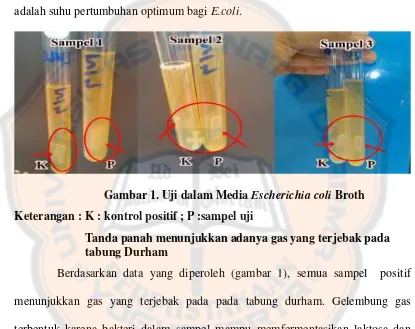
yang digunakan sebagai pembanding apakah reaksi dan karakteristiknya sama dengan sampel, apabila sama maka hasilnya adalah positif. Selain sebagai pembanding, kontrol positif juga berfungsi untuk mencegah terjadinya bias. Sampel kemudian diinkubasikan pada suhu 44°C selama 24 jam. Suhu 44°C adalah suhu pertumbuhan optimum bagiE.coli.
Gambar 1. Uji dalam MediaEscherichia coliBroth Keterangan : K : kontrol positif ; P :sampel uji
Tanda panah menunjukkan adanya gas yang terjebak pada tabung Durham
Berdasarkan data yang diperoleh (gambar 1), semua sampel positif menunjukkan gas yang terjebak pada pada tabung durham. Gelembung gas terbentuk karena bakteri dalam sampel mampu memfermentasikan laktosa dan dapat memproduksi gas. Laktosa yang merupakan polisakarida harus dipecah terlebih dahulu agar dapat masuk ke dalam sel bakteri. Laktosa akan dipecah oleh
akan dimetabolisme dan menghasilkan asam-asam campuran serta O2 (Atlas, 1997).Setelah didapatkan hasil positif pada media ECB, maka selanjutkan dilakukan isolasiE.coliuntuk lebih menegaskan hasil.
2. Isolasi E.coli pada sampel jamu cekok dalam media Trypton Bile X-Glucoronide(TBX)
Tujuan isolasi ini adalah untuk menegaskan bakteri yang tumbuh selama uji pengkayaan adalah E.coli. Pada uji isolasi E.coli digunakan media yang spesifik terhadap pertumbuhanE.coli yaitu media TBX. Media TBX mengandung χ-β-D-glucoronideyang merupakan agen kromofor. Dalam E.coliterdapat banyak enzim glukoronidase yang akan terdekteksi oleh χ-β-D-glucoronide. E.coli akan menyerap χ-β-D-glucoronide sehingga akan terjadi interaksi antara χ-β-D-glucoronide dengan enzim glukoronidase. Ketika E.coli memfermentasikan gula makaχ-β-D-glucoronideakan dilepaskan keluar sel sehingga menyebabkan koloni E.coliyang tumbuh akan berwarna hijau kebiruan (Bridson, 2006).
Gambar 2. Hasil IsolasiE.colipada sampel jamu cekok dalam mediaTrypton Bile X-Glucoronide(TBX)
Keterangan : tanda panah merah menunjukan koloni terpisahE.coliyang berwarna hijau kebiruan
Dari data (Gambar 2) didapatkan ketiga sampel positif mengandung E.coli yang ditunjukkan dengan adanya koloni berwarna hijau biru. Maka selanjutnya dilakukan uji identifikasi dan konfirmasi keberadaan E.coli pada sampel jamu cekok.
3. Identifikasi dan konfirmasi keberadaanE.coli pada sampel jamu cekok