PENJUAL JAMU RACIK “X” DI YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Arellia Oktaviori
NIM : 108114108
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENJUAL JAMU RACIK “X” DI YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Arellia Oktaviori
NIM : 108114108
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
PERSEMBAHAN
“Janganlah takut, sebab Aku menyertai engkau;
Janganlah bimbang, sebab Aku ini Allahmu;
Aku akan meneguhkan, bahkan akan menolong engkau;
Aku akan memegang engkau
dengan tangan kanan-
Ku yang membawa kemenangan”
Yesaya, 41 : 10
Kupersembahkan karya kecilku ini untuk:
Tuhan Yesus Kristus sumber kekuatan dan pengharapanku,
Papah, mamah, dan adik-adik ku yang tersayang
Seseorang yang selalu memberi motivasi,
Saudara-saudaraku dan Teman-temanku
vii PRAKATA
Segala puji dan syukur penulis panjatkan kepada Tuhan Yang Maha
Esa atas segala berkat dan kasih karunia-Nya dalam penelitian dan
penyusunan skripsi yang berjudul “Uji Angka Lempeng Total (ALT), Angka
Kapang/Khamir (AKK), dan Identifikasi Staphylococcus aureus dalam Jamu
Cekok dari Penjual Jamu Racik “X” di Yogyakarta” sehingga dapat
diselesaikan dengan baik dan tepat waktu. Skripsi ini disusun sebagai salah
satu syarat untuk meraih gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
Dalam proses penyelesaian skripsi ini, banyak kendala yang dihadapi
penulis. Akan tetapi, di tengah kesulitan tersebut penulis mendapat dukungan,
bimbingan, kritik dan saran dari berbagai pihak. Oleh karena itu, pada
kesempatan ini penulis mengucapkan terima kasih kepada :
1. Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Yohanes Dwiatmaka, M.Si. selaku Dosen Pembimbing atas
kebijaksanaan, perhatian, kesabaran serta waktu, tenaga, dan pikiran
dalam membimbing penyusunan skripsi ini.
3. Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Penguji yang telah
memberikan saran dan kritik yang membangun dalam penyusunan
viii
4. Ibu Damiana Sapta Candrasari, M.Sc. selaku Dosen Penguji yang telah
memberikan saran dan kritik yang membangun dalam penyusunan
skripsi ini.
5. Ibu CM. Ratna Rini Nastiti, M.Pharm, Apt. selaku Ketua Program
Studi Farmasi sekaligus Ketua Tim Panitia Skripsi Fakultas Farmasi
Universitas Sanata Dharma.
6. Ibu Maria Dwi Budi Jumpowati, S.Si. atas perhatian, pengarahan,
masukan, kritik, saran, dan kesabarannya dalam membimbing
penyusunan skripsi ini.
7. Seluruh dosen dan staf karyawan fakultas farmasi yang telah
mendukung dan memberikan ilmu kefarmasian serta membentu dalam
proses penyelesaian skripsi ini.
8. Seluruh pegawai Laboratorium Kesehatan Yogyakarta, khususnya
bagian mikrobiologi yang telah banyak membantu penulis dalam
pelaksaan penelitian laboratorium.
9. Teman-teman seperjuangan dalam penelitian ini yang telah bekerja
sama dan selalu memberikan dukungan : Ribka Alvianita, Maria Dyah
Kartika, Anastasia Ika, dan Theresia Nurida Ambarwulan.
10.Teman-teman angkatan 2010, khususnya FKK B dan FSM C 2010
11.Teman-teman terkasih kost Wisma Ananda
12.Semua pihak yang tidak dapat penulis sebutkan satu persatu, yang
telah membantu dan memberikan dukungan dalam penelitaian ini
ix
Penulis menyadari bahwa skripsi ini jauh dari sempurna. Oleh karena
itu, penulis menerima segala ktitik dan saran yang bersifat membangun demi
sempurnanya skripsi ini. Semoga skripsi ini dapat bermanfaat dan
memberikan informasi kepada pembaca.
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN………... ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN PERSETUJUAN PUBLIKASI………. ... v
PERNYATAAN KEASLIAN KARYA ... vi
xi
BAB III. METODE PENELITIAN ... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian dan Definisi Operasional ... 21
1. Variabel penelitian ... 21
2. Definisi operasional ... 22
C. Bahan Penelitian ... 22
D. Alat Penelitian ... 23
E. Tata Cara Penelitian ... 23
1. Penentuan dan pemilihan sampel ... 23
2. Homogenisasi dan pengenceran sampel ... 24
3. Uji ALT ... 24
4. Uji AKK ... 25
5. Uji Identifikasi S.aureus ... 25
F. Analisis hasil ... 30
BAB IV. PEMBAHASAN ... 35
A. Penentuan dan Pemilihan Sampel ... 35
B. Homogenisasi dan Pengenceran Sampel... 36
xii
DAFTAR GAMBAR
Gambar 1. Sampel jamu cekok dalam wadah steril ... 36
Gambar 2. Kontrol media dan kontrol negative pada uji ALT ... 39
Gambar 3. Hasil pengujian ALT setelah inkubasi 48 jam ... 40
Gambar 4. Hasil pengujian AKK dari kontrol negatif dan sampel setelah
inkubasi 5 hari ... 46
Gambar 5. Media Giolitti – Cantoni Broth ... 52
Gambar 6. Hasil uji isolasi pada kontrol positif S.aureus ATCC 25923 dan sampel jamu cekok ... 55
Gambar 7. Hasil uji fermentasi gula-gula pada kontrol positif S.aureus
ATCC 25923 dan sampel jamu cekok ... 57
Gambar 8. Hasil uji koagulase pada kontrol positif S.aureus ATCC 25923 dan sampel jamu cekok ... 60
Gambar 9. Hasil uji katalase pada kontrol positif S.aureus ATCC 25923 dan sampel jamu cekok ... 61
xiii
DAFTAR TABEL
Tabel I. Hasil identifikasi positif S.aureus ... 29
Tabel II. Angka lempeng total rata-rata pada jamu cekok yang diproduksi
oleh penjual jamu racik “X” di Yogyakarta ... 41
Tabel III. Angka kapang/khamir rata-rata pada jamu cekok yang diproduksi
oleh penjual jamu racik “X” di Yogyakarta ... 47
Tabel IV. Hasil uji identifikasi S.aureus dalam jamu cekok ... 64
Tabel V. Hasil uji identifikasi S.aureus dalam jamu cekok dan karakteristik
xiv
DAFTAR LAMPIRAN
Lampiran 1. Surat ijin penelitian di Balai Laboratorium Kesehatan
Yogyakarta ... 62
Lampiran 2. Hasil perhitungan uji ALT pada jamu cekok setelah inkubasi
48 jam ... 73
Lampiran 3. Hasil perhitungan uji AKK pada jamu cekok setelah inkubasi
xv INTISARI
Jamu cekok merupakan salah satu obat tradisional yang banyak diminati oleh masyarakat. Ramuan jamu cekok digunakan untuk meningkatkan nafsu makan pada anak-anak. Proses pembuatan dan penyajian sediaan jamu cekok dilakukan secara tradisional dan kurang memperhatikan kebersihan, maka tidak menutup kemungkinan dapat tercemar oleh mikroorganisme. Untuk mengetahui kualitas dan keamanannya secara mikrobiologis, maka perlu dilakukan pengujian. Pengujian tersebut meliputi uji Angka Lempeng Total, Angka Kapang/Khamir dan identifikasi bakteri patogen, khususnya Staphylococcus aureus.
Penelitian yang dilakukan merupakan penelitian non eksperimental dengan rancangan deskriptif eksploratif. Tujuan penelitian adalah untuk memberikan informasi mengenai angka lempeng total, angka kapang/khamir dan ada tidaknya cemaran bakteri S.aureus pada sampel jamu cekok dari penjual jamu racik “X” di Yogyakarta.
Hasil pengujian pada ketiga sampel jamu cekok diperoleh ALT berkisar antara 3,4 x 106 - 1,9 x 107 koloni/ml, AKK berkisar antara 1,1 x 105 – 1,3 x 105, dan cemaran S.aureus adalah negatif.
xvi ABSTRACT
Jamu cekok is the one of traditional medicines needed by public. That is useful to increase appetite for children. The manufacture processing and presenting of Jamu cekok those are less attention of hygiene will increase the possibility of microorganism contaminating. This condition requires testing to determine the microbiological quality and safety. The determination test includes the total plate count, the number of mold/yeast, and identification of pathogenic bacteria, especially Staphylococcus aureus.
This is a non-experimental research with descriptive - explorative design. The purpose of this research is to provide information about the total plate count, the number of mold/yeast, and the presence of S.aureus in Jamu cekok’s samples from Jamu Racik “X” seller in Yogyakarta.
The research’s result on three samples of jamu cekok were show that the ranged of the Total Plate Count is between 3.4 x 106– 1.9 x 107 colonies/ml, the Number of Mold/Yeast is between 1.1 x 105 – 1.3x 105 colonies/ml, and S.aureus
contamination was negative.
Key words: Jamu Cekok, Total Plate Count, The Number of Mold/Yeast,
1 BAB I
PENGANTAR
A. Latar Belakang
Perkembangan ilmu pengetahuan dan teknologi yang semakin modern
pada zaman sekarang tidak mengurangi penggunaan obat tradisional oleh
masyarakat di negara-negara berkembang terutama Indonesia. Obat tradisional
telah diterima secara luas oleh masyarakat walaupun sudah banyak beredar
obat-obatan modern di kalangan masyarakat. Masyarakat menggunakan obat
tradisional karena obat tradsional memiliki harga yang relatif murah dan efek
samping yang lebih kecil bahkan tidak ada daripada obat-obat sintetik (Latief,
2012).
Menurut peraturan Badan Pengawasan Obat dan Makanan Republik
Indonesia, obat tradisional dikelompokkan menjadi tiga golongan yaitu jamu, obat
herbal terstandar dan fitofarmaka. Salah satu golongan obat tradisional yang
banyak diminati oleh masyarakat hingga saat ini adalah jamu. Penggunaan jamu
masih sangat populer dan banyak diminati oleh masyarakat terutama yang tinggal
di daerah pedesaan (Pramudya, 2008). Di Indonesia, jamu telah diterima dan
digunakan oleh masyarakat secara turun-temurun sebagai alternatif pengobatan
untuk menyembuhkan suatu penyakit dan meningkatkan kesehatan (Wasito,
2011). Hal ini diperkuat dengan data yang dihimpun dalam Riset Kesehatan Dasar
mengonsumsi jamu dan sekitar 95,6% diantaranya merasakan khasiat jamu dalam
meningkatkan kesehatan (Depkes RI, 2011).
Jamu cekok merupakan salah satu jenis jamu yang paling banyak diminati
oleh masyarakat. Jamu cekok biasa digunakan untuk meningkatkan nafsu makan
dan mengobati beberapa penyakit pada anak-anak (Limananti dan Triratnawati,
2003). Berdasarkan Keputusan Menteri Kesehatan No : 661 tahun 1994 , cairan
obat dalam adalah sediaan obat tradisonal berupa larutan emulsi atau suspensi
dalam air, bahan bakunya berasal dari serbuk simplisia atau sediaan galenik dan
digunakan sebagai obat dalam (Depkes RI, 1994).
Di Yogyakarta terdapat salah satu pedagang jamu cekok yang banyak
diminati oleh masyarakat. Konsumen jamu cekok tidak hanya berasal dari kota
Yogyakarta, tetapi dari luar kota Yogyakarta pun banyak yang membeli dan
mengonsumsi jamu cekok yang diproduksi oleh penjual jamu racik “X”
(Limananti dan Triratnawati, 2003). Berdasarkan observasi yang dilakukan oleh
peneliti pada bulan September 2013, ramuan jamu cekok dibuat sendiri oleh
penjual jamu racik “X” dengan bahan dasar temulawak (Curcuma xanthorrhiza),
lempuyang gajah (Zingiber zerumbet ), brotowali (Tinospora tuberculata), temu
ireng (Curcuma aeruginosa) serta daun pepaya (Carica papaya). Pembuatan jamu
cekok dilakukan secara sederhana dengan jumlah yang sesuai kebutuhan tanpa
takaran yang baku dan proses pembuatannya dilakukan sehari sebelum dijual,
yaitu pada pukul 09.00 WIB. Bahan-bahan sesuai kebutuhan dicuci satu kali
dengan dicelupkan ke dalam ember yang berisi air, ditumbuk kasar dengan
harinya siap untuk dijual. Selama proses penjualan, bahan-bahan jamu yang telah
diolah disimpan dalam wadah besar (panci) yang terbuka. Penjualan jamu racik
“X” dimulai dari pukul 06.00 WIB sampai pukul 19.30 WIB. Selama rentang
waktu tersebut, tidak dilakukan pemanasan ulang pada jamu dan peralatan yang
digunakan hanya dibilas menggunakan air.
Berdasarkan hasil observasi, proses pembuatan dan penyimpanan jamu
tersebut memungkinkan adanya cemaran mikroorganisme pada jamu. Dalam
KepMenKes no. 661/MENKES/SK/VII/1994 tentang persyaratan obat tradisional,
diatur batas aman mikroorganisme yang terdapat dalam obat tradisional, yaitu
dalam Angka Lempeng Total tidak lebih dari 104, Angka Kapang/Khamir tidak
lebih dari 103 dan tidak mengandung mikroba patogen. Salah satu mikroba
patogen yang perlu diwaspadai dalam sediaan jamu cekok adalah Staphylococcus
aureus (Depkes RI, 1994).
Staphylococcus aureus sering ditemukan dalam saluran pernafasan,
permukaan kulit dan rambut hewan berdarah. Lebih dari 30-50% populasi
manusia adalah pembawa S.aureus sehingga dapat menyebabkan kontaminasi
pada makanan termasuk pada pengolahan obat tradisional (Le Loir, Baron, and
Gautier, 2003). Adanya kontaminasi S.aureus dapat menyebabkan terjadinya
keracunan dengan gejala umum yang muncul 2-6 jam setelah mengonsumsi
makanan yang terkontaminasi, seperti mual, muntah, kram perut, diare dan lemas
Bakteri S.aureus dimungkinkan dapat hidup dalam sedian jamu cekok
karena adanya kesesuaian suhu maupun pH antara habitat hidup S. aureus dan
sediaan jamu cekok. Bakteri S.aureus dan jenis staphylococci lainnya dapat
menghasilkan berbagai enzim dan toksin yang menyebabkan infeksi pada manusia
maupun hewan, sehingga dapat menyebabkan terjadinya foodborne intoxication
(Brooks, 2007). Foodborne intoxication adalah penyakit yang terjadi akibat
mengonsumsi makanan yang terkontaminasi toksin (racun) dari bakteri, jamur,
atau bahan kimia (Albert, 2013).
Adanya cemaran mikroorganisme tersebut dapat menyebabkan penurunan
kualitas dan keamanan jamu cekok. Usaha jamu ini merupakan usaha jamu
racikan tanpa izin edar sehingga kualitas dan keamanan jamu cekok tersebut
belum terjamin. Hal inilah yang mendorong peneliti untuk melakukan uji cemaran
mikroorganisme yang meliputi uji angka lempeng total, angka kapang/khamir,
dan identifikasi cemaran mikroba patogen, khususnya S.aureus dalam jamu cekok
yang diproduksi oleh penjual jamu racik “X” sehingga dapat menjamin kualitas
dan keamanan jamu tersebut.
1. Perumusan Masalah
a. Berapa angka lempeng total dan angka kapang/khamir dalam jamu cekok dari
penjual jamu racik “X” di Yogyakarta?
b. Apakah pada jamu cekok dari penjual jamu racik “X” di Yogyakarta
2. Keaslian penelitian
Sejauh penelusuran pustaka, belum pernah ada publikasi penelitian
tentang uji angka lempeng total, angka kapang/khamir, dan identifikasi
Staphylococcus aureus dalam jamu cekok dari penjual jamu racik “X” di
Yogyakarta.
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi bagi
perkembangan ilmu pengetahuan mengenai angka lempeng total, angka
kapang/khamir, dan ada tidaknya Staphylococcus aureus pada jamu cekok dari
penjual jamu racik “X” di Yogyakarta.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat mengenai kualitas dan keamanan jamu cekok yang dijual oleh
pedagang jamu racik “X” dilihat dari angka lempeng total, angka
kapang/khamir, dan ada tidaknya Staphylococcus aureus, sehingga kesehatan
masyarakat menjadi lebih terjamin.
B. Tujuan Penelitian
1. Tujuan umum
Mengetahui kualitas dan keamanan berdasarkan ada tidaknya cemaran
2. Tujuan khusus
Penelitian ini diharapkan mampu memberikan informasi mengenai:
a. Angka Lempeng Total dan Angka Kapang/Khamir pada jamu cekok dari
penjual jamu racik “X” di Yogyakarta.
b. Hasil uji cemaran Staphylococcus aureus pada penjual jamu cekok dari
7 BAB II
PENELAAHAN PUSTAKA
A. Obat Tradisional
Peraturan Menteri Kesehatan RI Nomor 007 tahun 2012 pasal 1
menyebutkan bahwa ; obat tradisional adalah bahan atau ramuan bahan yang
berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sari atau gelenik,
atau campuran dari bahan tersebut yang telah digunakan secara turun menurun
untuk pengobatan dan diterapkan sesuai dengan norma yang berlaku di
masyarakat (Depkes RI, 2012).
Menurut peraturan Badan Pengawas Obat dan Makanan (BPOM) RI, obat
tradisional dikelompokkan menjadi tiga golongan, yaitu jamu, obat herbal
terstandar, dan fitofarmaka. Jamu adalah ramuan yang terbuat dari bahan
tumbuhan, bahan hewan, bahan mineral, sediaan galenik atau campuran bahan
tersebut yang telah digunakan untuk pengobatan berdasarkan pengalaman. Obat
herbal terstandar adalah obat bahan alam yang telah dibuktikan keamanan dan
khasiatnya secara ilmiah dengan uji praklinik dan bahan bakunya telah
terstandarisasi. Fitofarmaka adalah sediaan obat bahan alam yang telah
dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik pada
hewan percobaan dan uji klinis pada manusia serta bahan baku dan produknya
Obat tradisional telah digunakan sejak lama oleh semua lapisan
masyarakat untuk pengobatan maupun perawatan kesehatan. Khasiat obat
tradisional tidak dapat dirasakan secara langsung setelah mengonsumsi obat
tradisional tersebut tetapi secara bertahap dengan mengonsumsi terus menerus.
Oleh karena itu, obat tradisional harus terjamin mutu dan keamanannya sehingga
aman dikonsumsi masyarakat (Wasito, 2011). Berdasarkan Keputusan Menteri
Kesehatan Nomor 661/MENKES/SK/VII/1994 tentang persyaratan obat
tradisional, terutama cairan obat dalam, yaitu keseragaman volum, tidak boleh
mengandung Angka Lempeng Total lebih dari 104, Angka Kapang/Khamir tidak
lebih dari 103, aflatoksin tidak dari 30 bpj, dan tidak boleh mengandung bakteri
patogen Escherichia coli, Salmonella, Staphylococcus aureus, dan Pseudomonas
aeruginosa (Depkes RI, 1994).
B. Jamu Cekok
Jamu cekok merupakan jamu yang paling banyak diminati oleh
masyarakat dan biasanya digunakan untuk meningkatkan nafsu makan pada
anak. Metode pemberian jamu cekok sangat khas, yaitu semua ramuan bahan
ditempatkan pada selembar kain serupa sapu tangan dan bagian ujungnya
disatukan seperti membungkus, kemudian diperas dan dicekokkan atau memaksa
anak untuk membuka mulutnya sehingga cairan jamu dapat masuk ke dalam
mulut (Limananti dan Triratnawati, 2003).
Jamu cekok merupakan sediaan cairan obat dalam yang terbuat dari
1. Temulawak
Temulawak (Curcuma xanthorrhiza Roxb) merupakan tanaman yang
tergolong dalam famili Zingiberaceae, berbatang semu, dan banyak
dimanfaatkan sebagai obat tradisional. Bagian tanaman yang digunakan
adalah rimpang. Rimpang temulawak mengandung xanthorrizol,
kurkuminoid, minyak atsiri, protein, lemak, selulosa, dan mineral. Rimpang
temulawak berkhasiat untuk meningkatkan nafsu makan, menurunkan
kolesterol, memperbaiki fungsi pencernaan, memelihara kesehatan fungsi
hati, dan sebagai antioksidan (Rahardjo, 2010).
2. Lempuyang gajah
Lempuyang gajah (Zingiber zerumbet L.) memiliki bau yang tajam,
rasa pedas dan bersifat hangat. Lempuyang gajah mengandung alkaloid,
camphene, camphor, gingerol, zingiberol, minyak esensial, ferulic acid, dan
chlorogenic acid. Lempuyang gajah berkhasiat untuk meningkatkan nafsu
makan, mengobati perut, cacingan, disentri, gangguan empedu, kejang pada
anak, radang ginjal (nephritis), radang usus (enteritis), radang lambung
(gastritis), sembelit, anemia, dan penyakit kulit (Hariana, 2008).
3. Brotowali
Tanaman brotowali (Tinospora condifilia L.) mengandung alkaloid,
glikosida, zat pahit pikroretin serta berberina. Brotowali dapat digunakan
untuk meningkatkan nafsu makan, mengobati luka, borok, gatal-gatal, kencing
4. Temu hitam
Temu hitam (Curcuma aeruginosa Roxb) mengandung kurkumin,
tanin,kurkumenol, kurkumol, germakon dan kurdion. Temu hitam memiliki
khasiat antara lain untuk menambah nafsu makan, cacingan, nyeri haid,
ambeien, membersihkan darah setelah melahirkan, meningkatkan stamina,
menyuburkan kandungan, dan menetralkan racun dalam tubuh. Bagian yang
sering digunakan adalah bagian rimpang (Anonim, 2013).
5. Daun pepaya
Daun pepaya (Carica papaya L.) mengandung alkaloid karpain,
tanin, flavonoid, papain dan saponin. Daun pepaya berkhasiat untuk
menambah nafsu makan, obat jerawat, mengobati demam berdarah,
melancarkan produksi ASI dan saluran pencernaan, dan bisa juga sebagai anti
kanker (Agoes, 2010).
C. Angka Lempeng Total (ALT)
Angka Lempeng Total (ALT) merupakan metode kuantitatif yang
digunakan untuk menetapkan angka bakteri aerob mesofil yang terdapat dalam
obat tradisional. Prinsip pengujian angka lempeng total, yaitu dengan melihat
pertumbuhan koloni bakteri aerob mesofil pada media agar setelah diinkubasi
selama 24-48 jam dan dihitung jumlah bakteri yang hidup (Radji, 2010).
Penentuan jumlah bakteri dapat dilakukan dengan beberapa cara, antara
1. Jumlah bakteri secara keseluruhan ( total cell count)
Pada metode total cell count, dihitung semua bakteri baik yang hidup
maupun yang mati. Perhitungan dapat dilakukan dengan 2 metode yaitu :
a. Menghitung langsung secara mikroskopis
Jumlah bakteri dihitung dalam satuan isi yang sangat kecil dan
menggunakan kaca obyek khusus yang bergaris (Petroff-Hauser) berbentuk
bujur sangkar. Jumlah cairan yang terdapat antara kaca obyek dan kaca
penutup mempunyai volume tertentu, sehingga satuan isi yang terdapat dalam
bujur sangkar juga tertentu (Lay, 1994).
Cairan yang mengandung jumlah bakteri yang tinggi dapat
menggunakan cara ini. Selain menghitung secara langsung dengan mata, dapat
pula digunakan alat penghitung elektronik coulters counter. Alat ini dapat
menghitung semua benda yang memiliki ukuran diameter 30 µm, sehingga
cairan yang akan dihitung jumlah bakterinya haruslah benar-benar hanya
mengandung bakteri (Lay,1994).
Pada penghitungan dengan metode menghitung langsung secara
mikroskopis, hasil dari pengenceran bahan diteteskan pada kaca obyek khusus
yang terdapat kolom-kolom penghitung (hemasitometer) dan diamati dengan
mikroskop untuk menentukan jumlah sel. Misalnya didapatkan jumlah yang
terhitung 12 sel, maka penghitung jumlah sel adalah : 12 x 25 x 50 x 103 = 1,5
x 107 sel/ml, di mana 12 : jumlah sel yang terhitung, 25 : jumlah kotak pada
ruang penghitung yang digunakan untuk meghitung, 50 : volume tiap-tiap
bakteri yang hidup maupun mati dapat dihitung dengan ditambahkan zat
pewarna metilen biru. Sel yang mati akan tampak berwarna biru, sedangkan
sel yang hidup akan tampak tidak berwarna karena sel hidup mampu
mereduksi zat warna tersebut secara enzimatik. Adapun kerugian dari metode
ini yaitu kesalahan dalam menghitung akibat sistem pengencerannya tidak
homogen lagi (Lay, 1994).
b. Menghitung dengan cara kekeruhan
Perhitungan dengan cara kekeruhan dilakukan dengan menggunakan alat
spektrofotometer. Dasar teknik ini adalah banyaknya cahaya yang diabsorpsi
sebanding dengan banyaknya sel bakteri pada batas-batas tertentu. Jumlah
mikroba dalam suspensi dapat ditentukan dengan menentukan kerapatan optik.
Pengukuran kerapatan optik menggunakan kolorimeter yang membiaskan
cahaya dengan gelombang tertentu. Gelombang cahaya melewati suspensi
biakan dan banyaknya cahaya yang ditransmisikan setelah melewati suspensi
diukur. Jumlah cahaya yang ditransmisiskan setelah melewati suspensi biakan
berbanding terbalik dengan jumlah mikroba dan jumlah cahaya yang
diabsorpsi. Jumlah cahaya yang diabsorpsi tergantung pada bentuk dan besar
sel (Lay, 1994).
Spektrofotometer dapat mengukur kepekatan sel dari suspensi dalam
%T (transmittance) atau OD ( jumlah cahaya yang diabsorpsi dan
disebarkan). OD digunakan sebagai satuan hitungan, karena OD sebanding
2. Jumlah bakteri yang hidup (viable count)
Cara ini hanya menggambarkan jumlah sel yang hidup, sehingga lebih
tepat bila dibandingkan dengan cara total cell count. Pada metode ini
diasumsikan bahwa setiap sel mikroba hidup dalam suspensi akan tumbuh
menjadi 1 koloni setelah diinkubasikan dalam media biakan dan lingkungan
yang sesuai. Setelah masa inkubasi, jumlah koloni yang tumbuh dihitung dan
merupakan perkiraan atau dugaan dari jumlah mikroba dalam suspensi
tertentu (Hadioetomo, 1985). Koloni yang tumbuh tidak selalu berasal dari 1
sel mikroba, karena beberapa mikroba tertentu cenderung untuk berkelompok
atau berantai. Bila ditumbuhkan pada media dan lingkungan yang sesuai
kelompok bakteri ini hanya akan menghasilkan 1 koloni. Lempeng agar yang
digunakan untuk perhitungan, yaitu lempeng agar yang mengandung 30 - 300
koloni. Lempeng agar dengan koloni >300 sulit untuk dihitung sehingga
kemungkinan kesalahan perhitungan sangat besar. Pengenceran sampel akan
membantu untuk memperoleh penghitungan jumlah yang benar, namun
pengenceran yang terlalu tinggi akan menghasilkan lempeng agar dengan
jumlah koloni yang rendah (<30 koloni). Lempeng demikian tidak absah
secara statistik untuk digunakan dalam perhitungan (Lay,1994).
Angka Lempeng Total harus ditekan sekecil mungkin. Angka lempeng
total dapat digunakan sebagai petunjuk tingkat industri tersebut melaksanakan
lempeng total maka semakin tinggi nilai penerapan CPOTB di industri tersebut
(Depkes RI, 1994).
D. Angka Kapang/ Khamir (AKK)
Kapang adalah kelompok mikroba yang tergolong dalam fungi multi
seluler yang memiliki filamen sebagai ciri khas morfologi kapang yang
membedakan dengan khamir. Sifat-sifat umum kapang antara lain; memiliki
inti sel, berspora, mempunyai bagian-bagian tubuh yang berfilamen dengan
dinding sel yang mengandung selulosa dan khitin atau keduanya, dapat
berkembang biak secara seksual maupun aseksual, dan bersifat obligat aerob
(Diffen, 2013).
Khamir adalah fungi uniselular yang tidak memiliki filamen. Khamir
tidak mempunyai flagela sehingga tidak dapat bergerak aktif. Khamir
memiliki bentuk dan ukuran yang bervariasi, lunak dan berwarna krem.
Pada umumnya khamir hidup di daun tanaman dan bunga, tanah dan air
(Brooks, 2007).
Khamir dapat berkembang biak secara bertunas, pembelahan sel,
pembentukan spora aseksual, dan pembentukan spora seksual. Khamir
dapat tumbuh dengan baik pada pH asam (4-4,5), suhu optimum 25-300C
dan suhu maksimum 35-470C. Khamir dapat tumbuh baik pada kondisi
aerobik (memerlukan oksigen) dan ada sebagian khamir yang bersifat
Khamir dapat bersifat patogen dan menyebabkan infeksi pada
manusia. Khamir yang bersifat patogen dan paling sering menyebabkan
infeksi adalah Candida albicans. Candida albicans terdapat di membran
mukosa mulut, saluran pernapasan, saluran pencernaan, vagina , kulit dan di
bawah jari-jari kuku. Selain itu, Candida albicans juga terdapat dalam
lingkungan seperti tanah, tanaman, makanan dan makanan ternak
(Hellmensen, 1999). Candida yang terdapat di dalam tubuh akan dikontrol
oleh bakteri baik agar jumlahnya rendah dan seimbang dengan cara
memfagositosis candida tersebut. Saat pertumbuhannya berlebihan, candida
akan mengkolonisasi saluran pencernaan dan membentuk strukstur seperti
akar yang disebut rizoid. Rizoid dapat menembus mukosa atau dinding usus
dan menyebabkan terbentuknya lubang sehingga dapat masuk ke sistemik
(aliran darah). Kondisi ini disebut sebagai sindrom kebocoran usus (leaky
gut syndrome). Kebocoran pada dinding usus akan menyebakan khamir
(Candida) dapat menyebar ke berbagai bagian tubuh seperti mulut, sinus,
tenggorokan, saluran reproduksi, jantung dan kulit sehingga dapat
menyebabkan infeksi penyakit (Disable world, 2007)
Kapang/khamir dapat mencemari obat tradisional terutama jamu
cekok, melalui bahan baku yang digunakan dalam pengolahan jamu cekok
seperti rimpang temulawak,temu hitam dan lempuyang gajah yang pada
umumnya tumbuh didalam tanah. Pada umumnya kapang/khamir terdapat di
dalam tanah. Bahan baku yang tumbuh di dalam tanah tersebut memiliki
seperti keadaan tanah yang lembab atau basah dan kandungan air yang
terdapat dalam bahan baku obat tradisional. Oleh karena itu, bahan baku
yang digunakan harus dicuci bersih sebelum digunakan sehingga dapat
mengurangi kontaminasi kapang/khamir (Pratiwi 2008).
Beberapa jenis fungi dapat memproduksi senyawa beracun (toksin)
yang disebut dengan mikotoksin. Mikotoksin adalah metabolit sekunder
yang diproduksi oleh fungi yang dapat menyebabkan penyakit dan kematian
pada manusia maupun hewan. Pada umumnya mikotoksin tahan terhadap
panas sehingga dengan pengolahan atau pemasakan pun tidak menjamin
hilangnya atau berkurangnya aktivitas toksin tersebut (Brooks, 2007).
Mikotoksin yang dapat mencemari makanan, terutama obat
tradisional adalah aflatoksin. Aflatoksin adalah racun yang dihasilkan oleh
kapang Aspergillus flavus dan Aspergillus parasiticus. Kedua jenis fungi ini
secara alami terdapat didalam tanah sehingga sangat mudah mencemari
tanaman yang umumnya tumbuh di dalam tanah seperti biji kacang atau
empon-empon. Bahan baku yang kurang baik dan proses pengolahan yang
tidak tepat dapat meningkatkan kontaminasi aflatoksin pada makanan.
Apabila mengonsumsi makanan yang mengandung aflatoksin dosis tinggi
dalam jangka pendek dapat menyebabkan keracunan akut dan
mengakibatkan terjadinya kerusakan hati, serta pada kasus yang serius dapat
menyebabkan kematian. Sedangakan apabila mengonsumsi makanan yang
mengandung aflatoksin dengan dosis menengah hingga rendah dalam jangka
kekebalan tubuh, mengganggu metabolism protein, dan mengganggu
ketersediaan gizi mikro. Aflatoksin juga dapat mengganggu pertumbuhan
anak dan mengganggu janin jika dikonsumsi oleh wanita hamil (Pratiwi,
2008).
Angka kapang/khamir merupakan jumlah kapang dan khamir yang
terdapat dalam suatu sampel. Semakin besar jumlah kapang dan kamir,
maka menunjukkan kemunduran dari mutu obat tradisional (Depkes RI,
1994 ; Radji,2010).
Jumlah kapang/ khamir yang terdapat dalam suatu sampel dapat
ditentukan beradasarkan prosedur dalam Metode Analisis Pusat Pengujian
Obat dan Makanan Nasional. Koloni kapang/khamir yang tumbuh pada
media setelah diinkubasi selama 5 hari pada suhu 250C dihitung dan dipilih
cawan petri yang mengandung 10-150 koloni. Hasil perhitungan dinyatakan
sebagai jumlah koloni kapang/khamir yang terdapat dalam satu milliliter
sampel (Anonim,2006).
E. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri patogen yang memiliki
ciri-ciri tidak berspora, tidak bergerak, berdiameter sekitar 0,5 - 1 µm, menghasilkan
enzim katalase dan bersifat koagulase positif. Bakteri S.aureus biasanya
membentuk koloni berwarna abu-abu hingga kuning tua kecoklatan (Hennekine
370C tetapi suhu terbaik untuk menghasilkan pigmen adalah suhu ruangan
(20-250C) (Brooks, 2007).
S.aureus dapat ditemukan dalam saluran pernafasan, permukaan kulit
dan rambut hewan berdarah panas terutama manusia.Lebih dari 30-50% populasi
manusia adalah pembawa S. aureus (Le Loir dkk., 2003). Makanan yang diolah
menggunakan tangan atau yang kontak langsung dengan tangan (salah satunya
adalah jamu cekok) sangat mudah tercemar oleh bakteri S.aureus. Hal ini dapat
terjadi karena S.aureus merupakan flora normal yang terdapat pada permukaan
kulit (Hennekinne, 2009). Hampir semua orang pernah mengalami infeksi
S.aureus selama hidupnya dengan tingkat keparahan yang beragam, dari
keracunan makanan atau infeksi kulit ringan hingga infeksi berat yang
mengancam jiwa (Brooks, 2007).
S.aureus dapat menghasilkan enterotoksin yang tahan panas dan dapat
menyebabkan keracunan makanan pada manusia bersama dengan makanan yang
terkontaminasi. Apabila makanan yang dikonsumsi terkontaminasi oleh
Staphylococcal enterotoksin (SE), maka SE akan masuk ke saluran pencernaan
dan mencapai usus halus. Selanjutnya toksin tersebut akan merusak dinding usus
halus dan menimbulkan sekresi jaringan usus dengan cepat (Brooks, 2007).
F. Media
Media adalah suatu substrat yang mengandung unsur-unsur makanan
(nutrisi) yang diperlukan oleh mikroorganisme untuk pertumbuhannya. Mikroba
dapat tumbuh dengan baik pada suatu media yang memiliki kondisi lingkungan
memiliki karakteristik dan ciri-ciri yang berbeda dalam persyaratan
pertumbuhannya. Ada mikroba yang dapat hidup pada media yang mengandung
sulfur dan ada pula yang membutuhkan tambahan zat-zat tertentu untuk dapat
hidup. Berdasarkan karakteristik pertumbuhan mikroba inilah yang menyebabkan
beberapa peneliti memodifikasi media sebagai penunjang pertumbuhan mikroba
(Rao, 2013).
Media yang digunakan dalam penelitian, antara lain:
1. Plate Count Agar
Plate Count Agar (PCA) merupakan media yang digunakan untuk
menghitung jumlah bakteri yang terdapat dalam produk susu dan produk
makanan lainnya, termasuk obat tradisional. Plate Count Agar mengandung
nutrisi yang penting bagi pertumbuhan mikroorganisme (Bridson, 2006).
2. Pepton Dextrose Agar
Pepton Dextrose Agar (PDA) merupakan media yang digunakan untuk
menstimulasi pertumbuhan konidia fungi (kapang/khamir). Pepton Dextrose
Agar mengandung dekstrosa dan ekstrak kentang sebagai sumber nutrisi
yang baik untuk pertumbuhan fungi (Bridson, 2006).
3. Giolitti- Cantoni Broth
Media Giolitti- Cantoni Broth merupakan media pengkayaan S.aureus yang
digunakan sebelum prosedur isolasi. Media Giolitti- Cantoni Broth
mengandung tripton, ekstrak daging sapi, ekstrak khamir, D-manitol,
natrium klorida, litium klorida, glisin, vitamin dan mineral (Oxoid, 2013a).
Baird Parker Agar (BPA) merupakan salah satu media selektif yang
digunakan untuk memperoleh biakan murni S.aureus berdasarkan karakter
biokimianya yang akan mempengaruhi sifat pertumbuhan bakteri pada
media (BPOM RI,2008). Baird Parker Agar mengandung natrium piruvat
yang berfungsi untuk melindungi sel yang rusak, emulsi kuning telur sebagai
agen diagnostik, dan litium, glisin serta tellurit sebagai agen selektif (Oxoid,
2013b).
G. Keterangan Empiris
Penelitian ALT, AKK, dan identifikasi S.aureus dilakukan untuk
menjamin keamanan obat tradisional untuk dikonsumsi oleh masyarakat.
Penelitian ini diharapkan dapat memberikan gambaran tentang cemaran
mikroorganisme dalam sediaan obat tradisional, yaitu jamu cekok yang
21 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan merupakan penelitian non eksperimental dengan
rancangan penelitan deskriptif eksploratif. Penelitian dilakukan di Laboratorium
Balai Kesehatan Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel penelitian
a. Variabel bebas : waktu pengambilan sampel jamu cekok yang dijual oleh
penjual jamu racik “X” di Yogyakarta
b. Variabel tergantung : nilai angka lempeng total (ALT), angka
kapang/khamir (AKK), keberadaan S.aureus yang terdapat dalam sediaan
jamu cekok yang diperoleh dari penjual jamu racik “X” di Yogyakarta.
c. Variabel pengacau terkendali : suhu inkubasi, lama inkubasi, media yang
digunakan, sterilisasi alat, sterilisasi media
d. Variabel pengacau tak terkendali : cara pembuatan jamu cekok, kualitas
2. Definisi operasional
a. Jamu cekok adalah suatu ramuan yang berbahan dasar temulawak,
lempuyang gajah dan temu hitam yang telah dihaluskan dan diberi sedikit
air rebusan brotowali dan daun pepaya, ditempatkan pada kain kecil dan
setiap bagian ujung kain diikat seperti membungkus, kemudian diperas
dan diberikan kepada anak dengan cara dicekok atau membuka paksa
mulut anak sehingga cairannya masuk ke dalam mulut.
b. Angka Lempeng Total (ALT) merupakan jumlah koloni bakteri yang
terdapat dalam tiap 1 ml sampel jamu cekok.
c. Angka kapang/khamir (AKK) merupakan jumlah koloni kapang dan
khamir yang terdapat dalam jamu cekok dan dihitung dengan rumus yang
telah ditentukan tanpa membedakan morfologi koloni.
d. Uji Staphylococcus aureus merupakan uji yang dilakukan untuk
menetapkan adanya S.aureus dengan cara melihat ada tidaknya
pertumbuhan S.aureus pada media yang digunakan.
C. Bahan Penelitian
1. Bahan utama yang digunakan, yaitu jamu cekok dari penjual jamu racik
“X” di Yogyakarta
2. Media yang digunakan antara lain Plate Count Agar (PCA) untuk uji ALT,
Potato Dextrose Agar (PDA) untuk uji AKK, media pengkayaan (Giolitti-
Cantoni Broth), media selektif (Baird Parker Agar), media identifikasi
Saccharose Broth, Simmon Citrate Agar, Sulphur Indole Motility Agar,
dan Nutrient Agar).
3. Pereaksi yang digunakan adalah reagen Staphylococcus aureus Kit
(Plamatec), H2O2 3%, Perwarnaan Gram (Gram A, Gram B, Gram C,
Gram D).
4. Bakteri pembanding : Staphylococcus aureus ATCC 25923
D. Alat Penelitian
Microbiological Safety Cabinet (MSC), Inkubator (WTC Bider),
stomacher, Mikroskop (Olympus Corp. Model U-MDOB3), pipet tetes, tabung
reaksi (Pyrex), cawan petri (Pyrex), pipet volume (Pyrex), gelas ukur (Pyrex),
neraca analitik (Sartorius), lampu spiritus dan jarum ose dispossible.
E. Tata Cara Penelitian 1. Penentuan dan pemilihan sampel
Sampel jamu cekok yang digunakan adalah jamu cekok yang dibuat
sendiri oleh penjual “X” di Yogyakarta yang sudah puluhan tahun menjual
jamu cekok dan sangat terkenal bahkan sampai luar Jogja. Sampel jamu
cekok diambil sebanyak tiga kali dalam waktu yang berbeda dengan selang
waktu selama 1 minggu. Sampel diambil dan dipindahkan ke dalam botol
steril. Kemudian sampel jamu dibawa ke laboratorium dan dilakukan
pengujian yang meliputi uji Angka Lempeng Total, Angka Kapang/Khamir
2. Homogenisasi dan pengenceran sampel
Sampel yang akan diuji terlebih dahulu dihomogenkan dengan larutan
pengencer pepton dilution fluid (PDF). Sebanyak 25 ml sampel jamu cekok
ditambahkan dengan 225 ml larutan pepton dilution fluid (1:10) sehingga
diperoleh pengenceran 10-1. Hasil pengenceran, dipipet sebanyak 1 ml sampel
ke dalam tabung yang berisi 9 ml larutan pengencer PDF sehingga diperoleh
pengenceran 10-2. Pengenceran dilakukan demikian seterusnya sehingga
diperoleh pengenceran bertingkat sampai 10-5.
3. Uji ALT
Sampel dari masing-masing pengenceran diambil sebanyak 1 ml,
dimasukkan ke dalam cawan petri dan dibuat duplo. Setiap cawan petri
tersebut dituangkan sebanyak 15 ml media PCA yang telah dicairkan yang
bersuhu 45 ± 10C dalam waktu 15 menit dari pengenceran pertama. Cawan
petri digoyangkan dengan hati-hati hingga tercampur merata. Untuk
mengetahui sterilitas media dan pengencer dibuat uji kontrol (blangko)
dengan diberikan 1 ml pengencer dan media pada satu media cawan petri,
dibiarkan hingga membeku (memadat). Setelah media memadat, cawan petri
diinkubasi pada suhu 35 ± 10C selama 24-48 jam. Koloni yang tumbuh pada
setiap cawan petri yang mengandung 25-250 koloni setelah 48 jam dicatat.
Koloni yang tumbuh pada cawan petri dihitung rata-rata jumlah koloni dan
dikalikan dengan faktor pengencer yang digunakan. Hasil dinyatakan
4. Uji AKK
Sampel jamu cekok dari masing-masing pengenceran diambil
sebanyak 1 ml, dimasukkan ke dalam cawan petri dan dibuat duplo. Setiap
cawan petri ditambahkan sebanyak 15 ml media PDA yang telah dicairkan
pada suhu 45 ± 10C dalam waktu 15 menit dari pengenceran pertama. Cawan
petri digoyang dengan hati-hati hingga sampel dan media tercampur merata,
dibiarkan hingga membeku (memadat). Untuk mengetahui sterilitas media
dan pengencer dibuat uji kontrol (blangko). Setelah media memadat, cawan
petri diinkubasikan pada suhu 250C atau suhu kamar selama 5 hari dan
diamati pada hari ke-3 sampai hari ke-5. Dicatat pertumbuhan koloni pada
setiap cawan petri yang mengandung 10-150 koloni. Jumlah koloni yang
tumbuh dihitung dengan mengalikan jumlah koloni pada cawan dengan
faktor pengencer yang digunakan kemudian diambil angka rata-rata. Hasil
dinyatakan sebagai angka lempeng total dalam tiap gram atau ml sampel
(Anonim, 2006).
5. Uji identifikasi S.aureus
a. Uji pengkayaan dalam media Giolitti-Cantoni Broth
Secara aseptik, dipipet 1mL cuplikan tiap sampel dan dimasukkan ke
dalam tabung yang berisi 9 mL Giolitti-Cantoni Broth, dicampur homogen
dan diinkubasi pada suhu 35- 370C selama 24 jam. Pada kontrol positif,
ditanam 1 jarum ose bakteri S.aureus ATCC 25923 ke dalam tabung reaksi
yang berisi 9 mL Giolitti-Cantoni Broth, dikocok homogen dan
perubahan warna pada media menjadi hitam keruh yang menunjukkan adanya
pertumbuhan S.aureus.
b. Isolasi koloni S.aureus dari jamu cekok dalam media selektif Baird Parker
Agar
Satu sengkelit koloni dari uji pengkayaan diambil dan digoreskan
pada lempeng media selektif Baird Parker Agar dengan teknik streak plate .
Pada kontrol positif S.aureus ATCC 25923 juga dilakukan hal yang sama.
Kemudian semua lempeng diinkubasikan 35- 370C selama 48 jam dengan
posisi lempeng terbalik. Setelah 48 jam, diamati adanya pertumbuhan koloni
yang berwarna hitam mengkilat dan zona putih disekelilingnya. Hasil
perlakuan dibandingkan dengan kontrol positif.
c. Identifikasi S.aureus
Satu koloni spesifik yang tumbuh pada media selektif Baird Parker
Agar dipilih dan ditanamkan pada media Nutrient Agar (NA) miring secara
goresan. Kemudian dilakukan uji fermentasi gula-gula, uji motilitas, uji sitrat,
1) Uji fermentasi gula-gula
Koloni yang dipilih adalah koloni tersangka biakan yang tumbuh
pada media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923.
Kemudian diinokulasikan pada media Glucose Broth, Lactose Broth,
Mannitol Broth, Maltosa Broth, dan Saccharose Broth secara aseptik.
Diinkubasikan 35- 370C selama 24 jam, diamati perubahan warna pada media
menjadi kuning dan tidak adanya gas yang terjadi setelah diinkubasi selama
24 jam.
2) Uji motilitas
Koloni yang digunakan adalah koloni tersangka biakan yang tumbuh pada
media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923,
kemudian diinokulasikan secara aseptik pada media Sulphur Indol Motility
(SIM) dengan cara ditusukan tegak lurus pada media agar tegak dan
diinkubasi pada suhu 35-370C selama 24 jam. Perubahan yang terjadi pada
media diamati dan hasil perlakuan dinyatakan positif terdapat S.aureus
apabila tidak menyebarnya pertumbuhan bakteri pada bekas tusukan pada
media yang menunjukkan bakteri tersebut bersifat non motil.
3) Uji sitrat
Koloni yang digunakan adalah koloni tersangka biakan yang tumbuh
pada media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923,
kemudian diinokulasikan secara aseptik pada media Simmon’s Citrate Agar
(SCA) dengan cara ditusukan tegak lurus pada media agar tegak dan
pada media diamati, apabila media dari hijau menjadi biru bahwa bakteri
mampu menggunakan sitrat sebagai satu-satunya sumber energi.
4) Uji koagulase
Koloni yang digunakan adalah koloni tersangka biakan yang tumbuh
pada media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923,
kemudian diinokulasikan secara aseptik pada media NA miring dan dinkubasi
pada suhu 35-370C selama 24 jam. Satu ose bakteri pada media NA miring
diambil, diletakkan pada kaca objek dan diteteskan reagen S.aureus Kit. Hasil
uji dinyatakan positif terdapat S.aureus apabila terjadi penggumpalan.
5) Uji katalase
Koloni yang digunakan adalah koloni tersangka biakan yang tumbuh
pada media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923,
kemudian diinokulasikan secara aseptik pada media NA miring dan
diinkubasi pada suhu 35-370C selama 24 jam. Satu ose bakteri dari NA
miring diambil, diletakkan pada kaca objek dan diteteskan reagen H2O2 3%.
Hasil uji dinyatakan positif terdapat S.aureus apabila terjadi reduksi H2O2
akan terlihat adanya gelembung O2 di sekitar pertumbuhan bakteri.
6) Uji mikroskopik dengan pengecatan Gram
Koloni yang digunakan adalah koloni tersangka biakan yang tumbuh
pada media Baird Parker Agar dan kontrol positif S.aureus ATCC 25923,
kemudian diinokulasikan secara aseptik pada media NA miring dan
diinkubasi pada suhu 35-370C selama 24 jam. Sebanyak satu ose bakteri pada
dengan kaca penutup yang sudah dibersihkan dan difiksasi di atas nyala api
bunsen. Kemudian diteteskan zat warna dasar (kristal violet) sebanyak 2 tetes
dan didiamkan selama 1 menit. Setelah itu dicuci dengan air mengalir dan
dikeringkan. Kemudian ditetesi dengan larutan lugol iodin dan didiamkan
selama 1 menit. Setelah kering, dicuci dengan alkohol (larutan peluntur)
sebanyak 2 tetes dan didiamkan ± 30 detik, dicuci dengan air mengalir lalu
dikeringkan. Selanjutnya diberi zat warna pembanding atau penutup yaitu
safranin sebanyak 2 tetes dan didiamkan selama 2 menit. Kemudian dicuci
dengan air mengalir lalu dikeringkan. Selanjutnya diamati dengan mikroskop
dan hasil uji dinyatakan positif terdapat S.aureus apabila berbentuk kokus
dan berwarna ungu serta bergerombol
7) Interpretasi hasil
S.aureus dinyatakan positif terdapat dalam jamu cekok apabila hasil
menunjukkan identitas sesuai tabel I
F. Analisis Hasil 1. Uji ALT
Cara menghitung dan menyatakan hasil pengujian, sebagai berikut:
a. Cawan petri yang dipilih untuk perhitungan adalah cawan petri dari satu
pengenceran yang menunjukkan jumlah koloni antara 25 - 250 setiap
cawan. Semua koloni dalam cawan petri dihitung. Rata-rata koloni
dihitung dan dikalikan dengan faktor pengenceran. Hasilnya dinyatakan
sebagai jumlah bakteri per milliliter atau gram.
b. Jika salah satu dari dua cawan petri terdapat jumlah koloni lebih kecil dari
25 atau lebih besar dari 250, dihitung rata-rata jumlah koloni, dikalikan
dengan faktor pengenceran dan hasilnya dinyatakan sebagai jumlah bakteri
permililiter atau gram.
c. Jika hasil dari dua pengenceran jumlahnya berturut-turut terletak antara
25 - 250 koloni, dihitung jumlah koloni dari masing-masing pengenceran
seperti yang disebut pada butir a dan b di atas, dan dihitung rata-rata
jumlah koloni dari kedua pengenceran tersebut. Jika jumlah yang tertinggi
lebih besar dari dua kali jumlah yang terkecil, jumlah yang lebih kecil
dinyatakan sebagai jumlah bakteri per milliliter atau gram.
d. Jika rata-rata jumlah koloni masing-masing cawan petri tidak terletak
antara 25 - 250 koloni, dihitung jumlah koloni seperti pada butir a dan b di
atas, dan dinyatakan sebagai jumlah bakteri perkiraan per milliliter atau
e. Jika jumlah koloni dari semua pengenceran lebih dari 250 koloni, maka
setiap dua cawan petri dengan pengenteran tertinggi di bagi ke dalam 2,4
atau 8 sektor. Dihitung jumlah koloni dalam satu bagian atau lebih. Untuk
mendapatkan jumlah koloni dalam satu cawan petri, dihitung rata-rata
jumlah koloni dan dikalikan dengan faktor pembagi dan pengenceran.
Hasil dinyatakan sebagai jumlah bakteri perkiraan per mililiter atau gram.
f. Jika dalam 1/8 bagian cawan petri terdapat lebih dari 200 koloni, maka
jumlah koloni yang didapat = 8 x 200 (1600), dikalikan dengan faktor
pengenceran dan hasilnya dinyatakan sebagai jumlah bakteri perkiraan per
milliliter atau gram lebih besar dari jumlah yang didapat (lebih besar dari
1600 x faktor pengenceran).
g. Jika tidak ada koloni yang tumbuh dalam cawan petri, dinyatakan jumlah
bakteri perkiraan lebih kecil dari satu dikalikan dengan faktor pengenceran
yang terendah (< 10)
h. Menghitung koloni perambat (Speader)
Ada 3 macam perambatan pada koloni, yaitu :
(1) Merupakan rantai yang tidak terpisah-pisah
(2) Perambatan yang terjadi diantara dasar cawan petri dan pembenihan
(3) Perambatan yang terjadi pada pinggir atau permukaan pembenihan
Kalau terjadi hanya 1 (satu) perambatan (seperti rantai) maka koloni
dianggap 1 (satu). Tetapi bila 1 atau lebih rantai terbentuk dan yang berasal
dari sumber yang berpisah-pisah, maka tiap sumber dihitung sebagai 1 (satu)
Bila (2) dan (3) terjadi maka sebaiknya pemeriksaan diulangi karena
koloni dalam keadaan semacam ini agak sukar dihitung.
i. Cara menghitung dan membulatkan angka
Dalam melaporkan jumlah koloni atau jumlah koloni perkiraan
hanya 2 angka penting yang digunakan, yaitu angka yang pertama dan
kedua (dimulai dari kiri), sedangkan angka yang ketiga diganti dengan 0
apabila kurang dari 5 dan apabila 5 atau lebih dijadikan 1 yang
ditambahkan pada angka yang kedua.
Contoh : 523.000 dilaporkan sebagai 520.000 (5,2 x 105)
83.600 dilaporkan sebagai 84.000 (8,4 x 104)
(SNI,1992).
2. Uji AKK
Cawan petri yang dipilih untuk perhitungan adalah cawan petri dari
pengenceran yang menunjukkan jumlah koloni antara 10 - 150. Jumlah koloni
dari kedua cawan dihitung lalu dikalikan dengan faktor pengencerannya. Bila
pada cawan petri dari dua tingkat pengenceran yang berurutan menunjukkan
jumlah antara 10 - 150, maka dihitung jumlah koloni dan dikalikan faktor
pengenceran, kemudian diambil angka rata-rata. Hasil dinyatakan sebagai
Untuk beberapa kemungkinan lain yang berbeda dari pernyataan di atas,
maka diikuti petunjuk sebagai berikut :
a. Bila hanya salah satu di antara kedua cawan petri dari pengenceran yang
sama menunjukkan jumlah antara 10 - 150 koloni, dihitung jumlah koloni
dari kedua cawan dan dikalikan dengan faktor pengenceran.
b. Bila pada tingkat pengenceran yang lebih tinggi didapat jumlah koloni
lebih besar dari dua kali jumlah koloni pada pengenceran di bawahnya,
maka dipilih tingkat pengenceran terendah (Misal: pada pengenceran 10-2
diperoleh 60 koloni dan pada pengenveran 10-3 diperoleh 30 koloni, maka
dipilih jumlah koloni pada pengenceran 10-2 yaitu 60 koloni).
Bila pada pengenceran yang lebih tinggi didapat jumlah koloni kurang dari
dua kali jumlah koloni penegnceran dibawahnya, maka diambil angka
rata-rata dari jumlah koloni dari kedua pengenceran tersebut. Hasil
dinyatakan sebagai angka kapang dan khamir dalam tiap gram sampel
(Misal pada pengenceran 10-2 diperoleh 6 koloni dan pengenceran 10-3
diperoleh 10 koloni, maka angka kapang/khamir adalah:
6 + 10
2 × 10
3 = 8 × 103
c. Bila dari seluruh cawan petri tidak ada satupun yang menunjukkan jumlah
antara 10 - 150 koloni, maka dicatat angka sebenarnya dari tingkat
pengenceran terendah dan dihitung sebagai angka kapang dan khamir
d. Bila tidak ada pertumbuhan pada semua cawan dan bukan disebabkan
karena faktor inhibitor, maka angka kapang dan khamir dilaporkan sebagai
kurang dari satu dikalikan faktor pengenceran terendah (< 1 x faktor
pengenceran terendah) (Anonim, 2006).
3. Uji identifikasi S.aureus
Jika pada media terdapat pertumbuhan koloni menunjukkan hasil
yang sesuai dengan interpretasi pada tabel I, maka dapat dinyatakan S.aureus
35 BAB IV
HASIL DAN PEMBAHASAN
A. Penentuan dan Pengambilan Sampel
Sampel yang digunakan dalam penelitian adalah jamu cekok yang
diproduksi oleh penjual jamu racik “X” di Yogyakarta. Jamu racik “X” dipilih
karena jamu ini merupakan salah satu jenis jamu yang banyak diminati oleh
masyarakat kota Yogyakarta maupun luar Yogyakarta. Jamu cekok biasanya
digunakan untuk meningkatkan nafsu makan pada anak-anak. Berdasarkan hasil
observasi yang telah dilakukan, jamu cekok diolah sehari sebelum jamu
dijajakan. Proses pembuatannya menggunakan peralatan yang sederhana dan
dibersihkan dengan membilas menggunakan air. Bahan dasar jamu yang telah
diolah disimpan dalam wadah besar tanpa ditutup dan dalam rentang waktu
penjualan tidak dilakukan pemanasan berulang sehingga berpotensi
menyebabkan kontaminasi mikroba.
Sampel jamu diambil sebanyak tiga kali dalam selang waktu satu minggu
dengan tujuan untuk mengetahui keseragaman sediaan jamu cekok yang diuji.
Pengambilan sampel dilakukan secara aseptis yaitu dengan memasukkan sampel
ke dalam botol steril dan disimpan dalam cool box. Sampel jamu yang diambil
dimasukkan ke dalam botol kaca steril dan berwarna gelap agar terhindar dari
sinar matahari yang dapat merusak sampel. Selama dalam perjalanan menuju
laboratorium, sampel dibawa dan disimpan dalam box yang berisi es batu (cool
kontaminasi dari lingkungan selama perjalanan dari tempat penjual jamu racik X
menuju tempat penelitian (laboratorium kesehatan Yogyakarta) dan untuk
memperlambat pertumbuhan mikroba.
Gambar 1. Sampel jamu cekok dalam wadah botol steril
B. Homogenisasi dan Pengenceran Sampel
Homogenisasi sampel merupakan tahap awal penyiapan sampel yang
dilakukan sebelum dilakukan pengujian selanjutnya, yaitu uji ALT, AKK, dan
identifikasi S.aureus. Homogenisasi dilakukan untuk memperoleh distribusi yang
seragam di dalam sampel yang akan ditetapkan.
Proses homogenisasi dilakukan secara aseptis dekat dengan nyala api
bunsen, dengan mengencerkan 25 ml sampel menggunakan 225 ml larutan
pengencer dan dihomogenkan dengan stomacher sehingga diperoleh suspensi
dengan pengenceran 10-1.Kemudian dari pengenceran tersebut diambil 1 ml dan
pengenceran 10-2 sampai pengenceran 10-5. Pengenceran suspensi sampel
dilakukan untuk mendapatkan koloni yang terpisah dan jumlah koloni yang
sekurang-kurangnya dalam satu cawan memenuhi range yang telah ditetapkan
sehingga mempermudah perhitungan koloni. Jika tidak dilakukan pengenceran,
maka koloni yang tumbuh akan sangat pekat sehingga akan mempersulit proses
perhitungan jumlah koloni. Hal ini disebabkan karena jumlah mikrobia yang
terdapat dalam sampel tersebut tidak diketahui sebelumnya.
Larutan pengencer yang digunakan adalah Peptone Dilution Fluids
(PDF), yang juga berperan sebagai sumber nutrisi untuk pertumbuhan mikrobia
karena banyak mengandung pepton. Pepton merupakan salah satu sumber
nitrogen yang dapat digunakan oleh mikrobia untuk dapat hidup dan tumbuh
dalam media yang sesuai (Bridson, 2006).
C. Uji Angka Lempeng Total (ALT)
Uji ALT merupakan salah satu parameter mikrobiologis yang dilakukan
untuk menentukan jumlah cemaran mikroba, khususnya bakteri yang terdapat
dalam sediaan jamu cekok. Prinsip pengujian ALT yaitu pertumbuhan bakteri
mesofilik setelah sampel diinokulasi dan diinkubasi dalam media pembenihan
yang sesuai pada suhu 350C selama 24 - 48 jam (SNI, 1992). Suhu inkubasi 350C
digunakan untuk menghambat pertumbuhan fungi, karena suhu optimum
pertumbuhan fungi berkisar pada suhu 25 - 300C, sedangkan suhu optimum
pertumbuhan bakteri mesofilik adalah 25 - 450C sehingga bakteri dapat tumbuh
dihitung dengan cara viable count, dimana diasumsikan bahwa setiap sel
mikrobia yang hidup akan tumbuh membentuk satu koloni setelah diinkubasikan
dalam media pembiakan pada kondisi yang sesuai (Hadioetomo, 1995).
Dalam uji ALT, setiap sampel dibuat seri pengencer 10-1 sampai 10-5 dan
masing-masing pengenceran dibuat duplo dengan tujuan untuk meningkatan
akurasi perhitungan. Setelah semua sampel diencerkan, maka sampel ditanam
dalam media Plate Count Agar (PCA) yang mengandung sumber nutrisi untuk
pertumbuhan bakteri. Teknik penanaman menggunakan metode taburan (pour
plate), dimana media PCA dituangkan ke dalam cawan petri yang berisi 1 ml
sampel, kemudian didinginkan hingga padat dan diinkubasi dengan posisi
terbalik agar uap air yang terkondensasi pada tutup cawan tidak menetes ke
media sehingga tidak mengganggu perhitungan koloni. Metode pour plate
digunakan karena tidak diketahui sifat akan kebutuhan oksigen dari bakteri yang
terdapat dalam sampel jamu cekok, sehingga bakteri yang bersifat aerob dan
anaerob dapat tumbuh dengan baik pada media dan jumlah koloni yang dihitung
merupakan jumlah keseluruhan sel yang hidup.
Setiap proses pengerjaan dalam penelitian dilakukan secara aseptis yaitu
dekat dengan nyala lampu spiritus (jarak 20 cm dari nyala lampu spiritus) dan di
dalam Microbiological Safety Cabinet (MSC). Proses pengerjaan secara aseptis
dilakukan untuk menghindari adanya kontaminasi baik pada alat maupun bahan
digunakan yang dapat mempengaruhi nilai ALT yang dihasilkan. Untuk
mengetahui bahwa bakteri yang tumbuh pada media biakan merupakan bakteri
media dan kontrol pelarut. Kontrol media hanya berisi PCA, yang dimaksukan
untuk memastikan bahwa media yang digunakan tidak terkontaminasi sehingga
bakteri yang tumbuh bukan berasal dari media yang digunakan. Kontrol pelarut
dibuat dengan menambahkan media PCA dan pelarut tanpa penambahan sampel.
Pembuatan kontrol pelarut dimaksudkan untuk memastikan bahwa bakteri yang
tumbuh bukan berasal dari larutan pengencer yang digunakan.
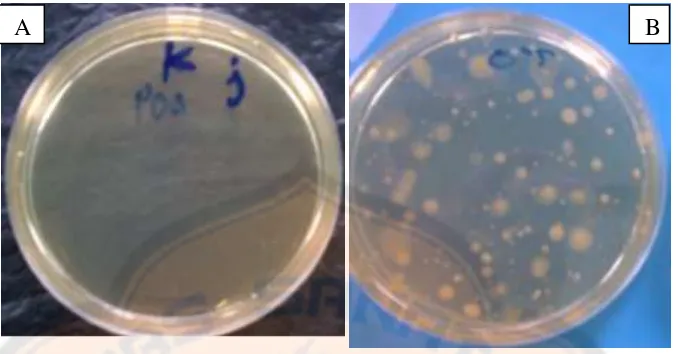
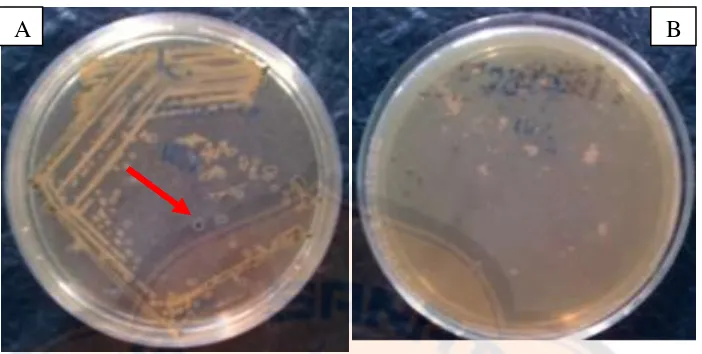
Gambar 2. Kontrol media (A) dan kontrol pelarut (B)
Pada gambar 2, tidak tampak adanya pertumbuhan koloni bakteri pada
media setelah diinkubasi pada suhu 35 0C selama 24-48 jam. Hasil pengujian
menunjukkan bahwa media maupun pelarut yang digunakan tidak mengandung
bakteri dan koloni yang tumbuh pada media biakan benar-benar bakteri yang
berasal dari sampel jamu cekok tersebut.
Koloni yang tumbuh pada media setelah diinkubasi pada suhu 35 ± 10C
selama 24 - 48 jam, dihitung menggunakan cara yang ditetapkan dalam Standar
sebagai jumlah koloni per mL sampel. Pada pengujian ALT, dipilih cawan petri
yang menunjukkan pertumbuhan koloni berada dalam rentang 25 - 250 koloni.
Berdasarkan Keputusan Menteri Kesehatan RI No: 661/MENKES /SK /VI I/1994,
nilai ALT pada cairan obat dalam tidak boleh lebih dari 104 koloni/ml sehingga
ALT harus ditekan sekecil mungkin.
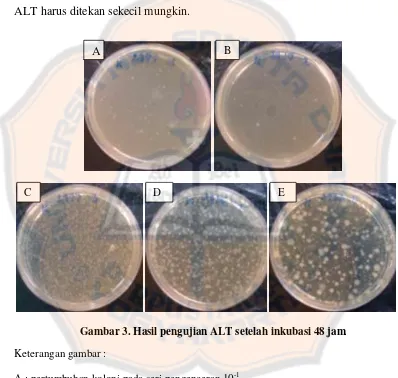
Gambar 3. Hasil pengujian ALT setelah inkubasi 48 jam
Keterangan gambar :
A : pertumbuhan koloni pada seri pengenceran 10-1 B : pertumbuhan koloni pada seri pengenceran 10-2 C : pertumbuhan koloni pada seri pengenceran 10-3 D : pertumbuhan koloni pada seri pengenceran 10-4 E : pertumbuhan koloni pada seri pengenceran 10-5
B
A
B
E D
Pada gambar 3, tampak adanya pertumbuhan koloni bakteri berwarna
putih pada media dengan seri pengenceran 10-1 - 10-5. Koloni yang tumbuh
dihitung dan dinyatakan hasilnya sebagai jumlah koloni per mL. Seri pengenceran
yang digunakan untuk menghitung jumlah koloni tergantung pada kepekatan
suspense dari masing-masing sampel. Pada setiap sampel dengan seri pengeceran
10-1 - 10-3 memiliki jumlah koloni yang sangat banyak dan pekat sehingga sulit
untuk dihitung dan tidak digunakan untuk menghitung jumlah koloni.
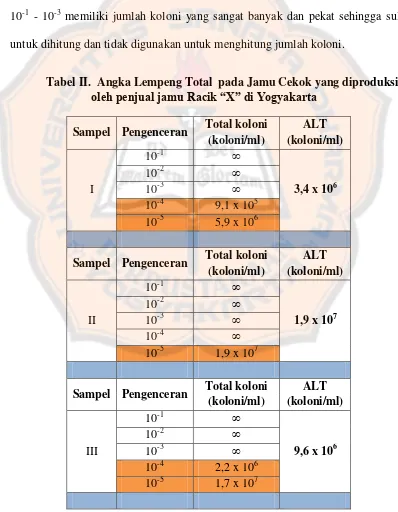
Tabel II. Angka Lempeng Total pada Jamu Cekok yang diproduksi
oleh penjual jamu Racik “X” di Yogyakarta
Berdasarkan tabel II (tabel lengkap pada lampiran 2), terlihat bahwa pada
setiap sampel dengan pengenceran 10-1 sampai pengenceran 10-3 dan 10-4 untuk
sampel 2, memiliki jumlah koloni yang sangat banyak dan sulit untuk dihitung
sehingga jumlah koloni dinyatakan tak terhingga (∞). Pada sampel 1 dan 3, cawan
petri yang digunakan untuk perhitungan jumlah koloni adalah pengenceran 10-4
dan 10-5 karena pada pengenceran tersebut memiliki jumlah koloni yang berada
dalam rentang 25 – 250 koloni, sedangkan pada sampel 2, hanya pengenceran 10-5
yang memiliki jumlah koloni dalam rentang 25 – 250 koloni, sehingga dapat
digunakan untuk perhitungan ALT.
Nilai ALT dari ketiga sampel jamu cekok yang diambil dalam tiga waktu
yang berbeda menunjukkan nilai ALT melebihi standar yang diperbolehkan.
Menurut Keputusan Menteri Kesehatan RI No:661/MENKES/SK/VII/1994,
Angka lempeng total tidak boleh lebih dari 104 (Depkes RI, 1994). Angka
lempeng total yang tinggi pada sampel jamu yang diteliti kemungkinan
disebabkan karena proses pembuatan maupun proses penyimpanan yang kurang
higienis seperti bahan baku jamu cekok berupa rimpang yang tumbuh di dalam
tanah hanya dicuci satu kali menggunakan air dan bagian kulit rimpang tidak
dikupas sehingga ada kemungkinan tercemar bakteri yang hidup di tanah seperti
Escherichia coli, Pseudomonas dan Bacillus species (Reid and Wong, 2005).
Selain itu, peralatan yang digunakan hanya dibilas menggunakan air, racikan jamu
cekok yang disimpan dalam wadah besar terbuka dan peramu atau penjual tidak
mencuci tangan sebelum meramu atau mencekokkan jamu tersebut. Tingginya
baku atau pengolahan jamu cekok tercemar oleh bakteri yang hidup di air seperti
Escherichia coli, Salmonella, Shigella, Pseudomonas dan Vibrio cholerae
(Cabral, 2010). Proses pengemasan dan transportasi juga dapat mempengaruhi
tingginya nilai ALT jamu cekok seperti saat memasukkan sampel ke dalam botol
steril tidak secara aseptis yaitu dekat dengan lampu bunsen dan sampel jamu
cekok yang tumpah tidak dibersihkan dengan kasa yang diberi alkohol, serta saat
proses transportasi ada cemaran mikroba melalui udara.
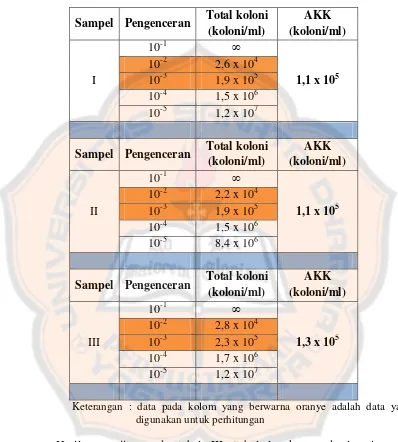
D. Uji angka kapang/khamir (AKK)
Uji angka kapang/khamir merupakan salah satu parameter mikrobiologis
yang digunakan untuk mengetahui seberapa besar jumlah kapang/khamir yang
terdapat dalam sediaan obat tradisional. Jumlah kapang/khamir yang melebihi
batas yang ditetapkan menunjukkan kemunduran mutu obat tradisional dan
dikhawatirkan akan menimbulkan dampak negatif bagi kesehatan Prinsip
pengujian AKK adalah melihat adanya pertumbuhan kapang/khamir pada media
yang sesuai setelah diinkubasi selama 5 hari pada suhu 250C. Kapang/khamir
memiliki struktur yang lebih kompleks dan memerlukan waktu yang relatif lama
untuk membentuk spora (Bryson, 2006).
Untuk mengetahui berapa besar jumlah kapang/khamir yang terdapat
dalam sediaan jamu cekok, maka dapat digunakan metode hitungan cawan petri
yang didasarkan pada anggapan bahwa setiap sel yang hidup akan berkembang
menjadi satu koloni. Perhitungan sel-sel hidup dilakukan dengan metode plate
count yaitu menghitung jumlah sel yang mampu membentuk koloni pada media