BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian adalah metode eksperimental. Penelitian meliputi pengumpulan dan penyiapan bahan tumbuhan, pembuatan simplisia, pemeriksaan karakteristik simplisia, skrining fitokimia, pembuatan ekstrak, pengujian aktivitas antioksidan buah andaliman melalui pemeriksaan kadar SOD pada darah tikus dengan metode spektrofotometri dan histologi organ hati tikus.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan terdiri dari lemari pengering, oven, tanur, penangas air, rotary evaporator, seperangkat alat penetapan kadar air, desikator, neraca hewan, neraca analitis (Baeco), neraca kasar (Homeline), blender (Philips), alat-alat gelas laboratorium, mortar dan stamfer, aluminium foil, kertas saring, oral sonde, spuit, vortex,sentrifuge, microplate, mikropipet, spektrofotometri UV-Vis (Thermo scientific), perlengkapan alat bedah hewan.
3.1.2 Bahan
3.1.3 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian adalah tikus betina, berusia 2-3 bulan dengan berat badan 150-200 g, sehat dan berprilaku normal.
3.2 Pembuatan Pereaksi
3.2.1 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai 100 ml ( Depkes RI, 1979).
3.2.2 Pereaksi Besi (III) klorida 1 %
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml (Depkes RI, 1995).
3.2.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.4 Pereaksi Dragendorff
Sebanyak 8,0 g bismuth (II) nitrat dilarutkan dalam 20 ml asam nitrat pekat kemudian dicampurkan dengan larutan kalium iodide sebanyak 27,2 g dalam 50 ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Depkes RI, 1995).
3.2.5 Larutan Kloralhidrat
3.2.6 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam sulfat pekat tambahkan etanol hingga 50 ml (Merck, 1978).
3.2.7 Pereaksi Mayer
Sebanyak 1,36 g raksa (II) klorida, dilarutkan dalam air suling hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 20 ml air suling. Kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.8 Pereaksi Molish
Sebanyak 3 g alfa naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.9 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,001 g kristal natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1979).
3.2.10 Pereaksi Timbal (II) Asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes RI, 1995). 3.2.11 Pereaksi Asam Sulfat 2 N
3.3 Prosedur Pembuatan Simplisia 3.3.1 Pengambilan Bahan Tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan tumbuhan diambil dari perkebunan desa Onan Rungu, Kab. Samosir.
3.3.2 Identifikasi Tumbuhan
Identifikasi sampel tumbuhan dilakukan di Herbarium Medanense (MEDA) Bidang Botani Universitas Sumatera Utara.
3.3.3 Pembuatan Simplisia
Bahan buah andaliman yang sudah masak atau hampir masak dipetik, kemudian dikumpulkan, sortasi basah, dicuci bersih di bawah air mengalir, ditiriskan, dan ditimbang beratnya. Buah andaliman selanjutnya dikeringkan di lemari pengering hingga kering, sortasi kering, kemudian ditimbang beratnya, dan disimpan dalam wadah plastik yang tertutup rapat.
3.4 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air (WHO, 1992), penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam (Depkes RI, 1995).
3.4.1 Pemeriksaan Makroskopik
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia buah andaliman. Serbuk simplisia buah andaliman diletakkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, selanjutnya diamati di bawah mikroskop.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, dan tabung penerima.
Cara kerja:
3.4.4 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah
dipanaskan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.5 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105 oC sampai bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.4.6 Penetapan Kadar Abu Total
timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.5 Skrining Fitokimia Simplisia
Skrining fitokimia serbuk simplisia buah andaliman meliputi pemeriksaan senyawa golongan flavonoid, alkaloid, saponin, tanin, glikosida, dan steroid/triterpenoid.
3.5.1 Pemeriksaan Flavonoid
Sebanyak 10 g serbuk simplisia ditambah air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 1 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah kekuningan atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.2 Pemeriksaan Alkaloid
menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida: diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
a. Ditambahkan 2 tetes pereaksi Mayer b. Ditambahkan 2 tetes pereaksi Bouchardat c. Ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan pada paling sedikit dua dari tiga percobaan di atas (Depkes RI, 1995).
3.5.3 Pemeriksaan Saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2N menunjukkan adanya saponin (Depkes RI, 1995).
3.5.4 Pemeriksaan Tanin
Sebanyak 0,5 gram serbuk simplisia ditimbang, disari dengan 10 ml air suling selama 15 menit lalu disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes larutan pereaksi besi (III) klorida 10 %. Apabila terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.5.5 Pemeriksaan Glikosida
disaring. Pada 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok dan didiamkam selama 5 menit, lalu disaring. Filtrat diekstraksi dengan 20 ml campuran 3 bagian kloroform dan 2 bagian isopropanol, ini dilakukan sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. sisanya dilarutkan dalam 2 ml metanol. Larutan ini digunakan untuk percobaan berikut: larutan sisa dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisanya ditambahkan 2 ml air dan 5 tetes pereaksi Molisch kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung. Jika terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya gula (Depkes RI, 1995).
3.5.6 Pemeriksaan Steroid/Triterpenoid
Sebanyak 1g serbuk simplisia dimaserasi dengan eter 20 ml selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Lieberman-Bourchard), diteteskan pada saat akan mereaksikan sampel uji. Apabila terbentuk warna biru atau biru hijau menunjukkan adanya steroid sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.6 Proses Pembuatan Ekstrak Etanol Buah Andaliman (EEBA)
Setelah 5 hari, kemudian disaring, ampas diperas. Ampas dicuci dengan pelarut secukupnya, diaduk dan disaring hingga diperoleh 100 bagian. Tampung maserat ke dalam bejana tertutup, dibiarkan di tempat sejuk terlindung dari cahaya selama 2 hari kemudian dienaptuangkan. Pemekatan ekstrak dilakukan dengan alat rotary evaporator, kemudian ekstrak dikeringkan dengan penangas air.
3.7 Pembuatan Sediaan Uji
3.7.1 Pembuatan Suspensi Na-CMC 1% (b/v)
Sebanyak 1 g Na-CMC ditaburkan dalam lumpang yang berisi air suling panas. Didiamkan selama 15 menit hingga diperoleh massa yang transparan, lalu digerus sampai homogen dan berbentuk gel, diencerkan dengan air suling, dihomogenkan dan dimasukkan ke labu tentukur 100 ml, dicukupkan volumenya dengan air suling hingga 100 ml.
3.7.2 Pembuatan Suspensi Rutin
Ditimbang rutin sebanyak 50 mg, ditambahkan suspensi Na-CMC 1% sedikit demi sedikit sambil digerus homogen, lalu diencerkan dengan suspensi Na-CMC 1% hingga 10 ml. Dalam hal ini rutin digunakan sebagai pembanding. 3.7.3 Pembuatan Suspensi EEBA (Ekstrak Etanol Buah Andaliman)
ml, dicukupkan volumenya hingga 10 ml. Perhitungan dosis ekstrak etanol buah andaliman (EEBA) dapat dilihat pada Lampiran 8, halaman 67 .
3.8 Induksi Stres Pada Tikus
Penginduksian stres pada tikus dilakukan pada hari ke-8 dan ke-9 pengujian. Penginduksian dilakukan dengan memberikan doksorubisin HCL dosis 20 mg/kg bb secara intraperitonial (Thandavarayan, dkk., 2015 ; Ihab, dkk., 2009).
3.9 Pengujian Ekstrak Etanol Buah Andaliman dengan Metode Spektrofotometri UV-vis terhadap aktivitas SOD pada tikus
3.9.1 Penyiapan Hewan Percobaan
Sebelum digunakan, tikus diaklimatisasi selama 7 hari dengan kondisi laboratorium. Masing-masing kandang diberikan sekam dan diberi makan yang teratur. Hewan percobaan dikelompokkan menjadi 6 kelompok, masing-masing terdiri dari 5 ekor tikus betina. Pengujian dilakukan selama 9 hari, kelompok tersebut adalah :
Kelompok I : diberikan Na-CMC 1% secara oral selama 9 hari
Kelompok II : diberikan doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial pada hari ke-8 dan ke-9
Kelompok IV : diberikan suspensi EEBA dosis 150 mg/kg bb secara oral selama 7 hari, dilanjutkan hari ke-8 dan 9 bersama dengan pemberian doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial
Kelompok V : diberikan suspensi EEBA dosis 300 mg/kg bb secara oral selama 7 hari, dilanjutkan hari ke-8 dan 9 bersama dengan pemberian doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial
Kelompok VI : diberikan rutin dosis 50 mg/kg bb secara oral selama 7 hari, dilanjutkan hari ke-8 dan 9 bersama dengan pemberian doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial Tikus dipuasakan selama 12 jam dan pada hari ke-10 semua hewan percobaan dianastesi dengan ketamin dosis 70 mg/kg bb secara intraperitonial lalu dikorbankan. Selanjutnya diambil cuplikan darah dari jantung tikus (intracardial) untuk dilakukan pengukuran aktivitas SOD dan hati tikus untuk dilakukan pemeriksaan histologi.
3.9.2 Pengambilan Darah Tikus
3.9.3 Pengambilan Serum Darah Tikus
Darah yang didapat, disentrifugasi selama 10 menit dengan kecepatan 3000-4000 rpm hingga terpisah antar serum/supernatan dan endapannya. Lapisan serum yang berupa cairan diambil dengan menggunakan spuit dan ditampung didalam mikrotube.
3.9.4 Pengukuran Kadar SOD
Pengukuran kadar SOD dilakukan dengan metode spektrofotometri UV-Vis berdasarkan prosedur Bioassay Systems (Enzychrom Superoxide Dismutase Assay Kit) pada panjang gelombang 440 nm yang dapat dilihat pada Lampiran 10, halaman 70. Pengujian aktivitas SOD dilakukan menurut metode yang telah dilakukan Waisundra dan Hoon (2013) dan Suarsana, dkk., (2013)
3.10 Histologi organ hati
Diambil organ hati kemudian dicuci dengan larutan fisiologis 0,9% kemudian dimasukkan dalam larutan dapar formaldehida 10% dan hasilnya dilihat di bawah mikroskop. Pembuatan preparat histologi dilakukan di rumah sakit Murni Teguh.
3.11 Pemeriksaan Histologi Jaringan Hati Tikus dengan Pewarnaan Hematoxylin Eosin (HE)
3.11.1 Pembuatan Preparat Blok Parafin
Langkah-langkah pembuatan blok parafin adalah sebagai berikut:
kemudian berturut-turut alkohol 80%, alkohol 95%, dan alkohol absolut. Pada masing-masing proses dilakukan selama 30 menit sampai 1 jam.
b. tahap selanjutnya adalah pencucian dengan menggunakan larutan xylol yaitu
xylol 1, xylol 2, dan xylol 3 masing-masing selama 1-2 jam.
c. proses penanaman. Caranya: sampel direndam dalam campuran xylol dan parafin cair pada suhu 60–70oC, dengan perbandingan xylol : parafin berturut-turut 3:1, 1:1, dan 1:3 masing-masing selama 2 jam.
d. dilakukan pencetakan dan dibiarkan membeku, kemudian blok parafin dipotong dengan menggunakan alat mikrotom dengan ketebalan irisan 5-7 μm. 3.11.2 Pewarnaan Hematoxylin Eosin
Pemeriksaan histologi hati dilakukan pada seluruh sampel hati tikus. Pewarnaan HE dimulai dengan melakukan deparafinisasi dengan memasukkan preparat ke dalam seri larutan xylol I, II, III. Tahapan selanjutnya adalah fiksasi dengan memasukkan preparat ke dalam larutan alkohol 96%. Kemudian dicuci dengan air mengalir dan direndam dalam akuades. Preparat direndam dalam
3.12 Analisis Data
Data hasil penelitian dianalisis dengan menggunakan program SPSS versi 17. Data dianalisis dengan menggunakan metode Kolmogorov Smirnov untuk menentukan homogenitas dan normalitasnya. Kemudian dilanjutkan menggunakan metode One Way ANOVA untuk menentukan perbedaan rata-rata di antara kelompok. Jika terdapat perbedaan, dilanjutkan dengan menggunakan uji
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense Bidang Botani Universitas Sumatera Utara. Hasil identifikasi menunjukkan bahwa sampel termasuk suku Rutaceae jenis Zanthoxylum acanthopodium DC. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 2, halaman 57.
4.2 Hasil Pemeriksaan Karakteristik Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik dari buah andaliman diperoleh bahwa buah muda berwarna hijau, dan matang berwarna merah tua sampai merah kecoklatan. Bentuk buah bulat dan kecil, lebih kecil dari merica, bila digigit mengeluarkan aroma wangi dan rasa tajam yang khas, dan dapat merangsang produksi air liur. Biji berada dalam buah dan keras. Pemeriksaan makroskopik yang dilakukan terhadap simplisia buah andaliman yaitu simplisia berwarna hitam, berbau khas, dan biji keluar dari buah. Pemeriksaan karakteristik buah andaliman secara makroskopik dilakukan untuk memperoleh identitas simplisia. Hasil pemeriksaan makroskopik buah andaliman dan simplisia buah andaliman dapat dilihat pada Lampiran 3, halaman 58.
4.2.2 Pemeriksaan mikroskopik
4.2.3 Karakteristik simplisia
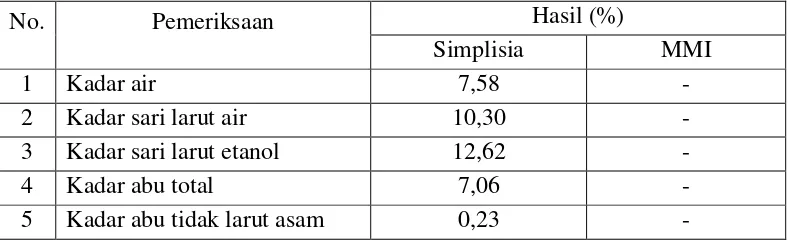
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu yang tidak larut asam dapat dilihat pada Tabel 4.1 Tabel 4.1 Hasil pemeriksaan karakteristik simplisia buah andaliman
No. Pemeriksaan Hasil (%)
Simplisia MMI
1 Kadar air 7,58 -
2 Kadar sari larut air 10,30 -
3 Kadar sari larut etanol 12,62 -
4 Kadar abu total 7,06 -
5 Kadar abu tidak larut asam 0,23 -
Berdasarkan hasil pemeriksaan, simplisia buah andaliman mempunyai kadar air sebesar 7,58%, hasil ini memenuhi persyaratan kadar air simplisia buah pada buku Cara Pembuatan Simplisia yaitu tidak lebih dari 8% (Depkes RI, 1985). Semakin kecil kadar air simplisia, kemungkinan terjadinya pertumbuhan mikroorganisme dan hidrolisis senyawa kimia yang terdapat dalam simplisia tersebut semakin kecil. Kadar sari larut air diperoleh sebesar 10,30% dan kadar sari larut etanol sebesar 12,62%. Penentuan kadar sari sangat berguna untuk memberikan gambaran mengenai banyaknya bahan yang terlarut dari simplisia. Sedangkan kadar abu total simplisia yang didapat sebesar 7,06% dan kadar abu tidak larut asam sebesar 0,23%.
yang terdapat pada simplisia dengan cara melarutkan abu total menggunakan asam klorida (WHO, 1992). Semakin rendah kadar abu maka mutu simplisia semakin tinggi.
Persyaratan karakteristik simplisia buah andaliman tidak tertera pada monografi di dalam buku Materia Medika Indonesia (MMI) sehingga hasil yang diperoleh diatas tidak dapat dibandingkan.
Ekstraksi serbuk simplisia dilakukan secara maserasi. Penyarian 500 gram simplisia buah andaliman menggunakan etanol 96% menghasilkan 59,41 gram ekstrak dengan persentase rendemen sebesar 11,9%.
4.3 Skrining Fitokimia
Skrining fitokimia terhadap simplisia dan ekstrak buah andaliman dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat didalamnya. Hasil skrining fitokimia terhadap simplisia dan ekstrak buah andaliman dapat dilihat pada Tabel 4.2
Tabel 4.2 Hasil skrining fitokimia serbuk simplisa dan ekstrak buah andaliman No. Pemeriksaan Simplisia Buah
Andaliman
(+) : mengandung golongan senyawa (-) : tidak mengandung golongan senyawa
Flavonoid pada tumbuhan bergenus Zanthoxylum memberi khasiat sebagai antitumor, antioksidan, antibakteri, antiinflamasi, dan antifungi (Kristanty dan Junie, 2015).
4.4 Pengaruh Ekstrak Etanol Buah Andaliman terhadap Kadar SOD pada Tikus
Pemeriksaan kadar SOD dilakukan secara kuantitatif dengan metode spektrofotometri UV-Vis berdasarkan prosedur Bioassay Systems (EnzyChrom Superoxide Dismutase Assay Kit) pada panjang gelombang 440 nm yang dapat dilihat pada Lampiran 10, halaman 70. Metode ini berdasarkan pada prinsip kolorimetri untuk penentuan aktivitas enzim SOD dalam sampel biologi secara kuantitatif. Di dalam pengujian, superoksida (O2-) dihasilkan oleh reaksi katalisis xanthine oxidase (XO). O2- bereaksi dengan pewarna WST-1 untuk membentuk
produk berwarna. SOD mengumpulkan O2- sehingga berkurangnya O2- berguna
untuk reaksi kromogenik. Intensitas warna (OD440nm) digunakan untuk
menentukan aktivitas SOD di dalam sampel. Semakin tinggi absorbansi yang diperoleh (ΔΔOD) maka semakin tinggi aktivitas SOD dari sampel (Anonim,
2012).
Tabel 4.3 Absorbansi Standar SOD
Konsentrasi SOD (U/ml) Absorbansi (440 nm)
0 0
Berdasarkan tabel diatas diperoleh kurva standar seperti ditunjukkan pada Gambar 4.1.
Gambar 4.1 Kurva Standar SOD
Kurva standar didapat dari hubungan berbagai konsentrasi standar dengan absorbansi yang terbentuk. Dari kurva kalibrasi ini diperoleh nilai r2. Nilai r2 berkisar antara 0 sampai 1 yang menunjukkan seberapa dekat nilai perkiraan untuk analisis regresi yang mewakili data yang sebenarnya. Dari kurva standar
diperoleh persamaan garis regresi y = 0,0043 ln(x) – 0,0009 dengan nilai r2 = 0,8898.
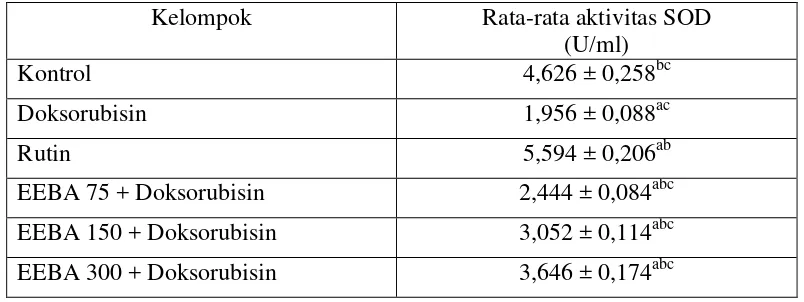
Aktivitas SOD dihitung dengan mensubstitusikan nilai absorban (y) sampel pada panjang gelombang 440 nm ke dalam persamaan garis regresi logaritma y = a ln(x) + b, yang diperoleh dari kurva standar SOD sehingga diperoleh nilai aktivitas SOD (x). Hasil aktivitas SOD kemudian dilakukan analisis statistika menggunakan one way analysis of variant (ANOVA) dan dilanjutkan dengan uji Post Hock Tukey HSD. Dari hasil uji yang dilakukan didapatkan perbedaan hasil pengukuran yang signifikan (p<0,05) antar kelompok perlakuan. Hasil uji aktivitas SOD ekstrak etanol buah andaliman pada darah tikus dapat dilihat pada Tabel 4.4.
Tabel 4.4 Aktivitas SOD ekstrak etanol buah andaliman pada darah tikus Kelompok Rata-rata aktivitas SOD
(U/ml)
Kontrol 4,626 ± 0,258bc
Doksorubisin 1,956 ± 0,088ac
Rutin 5,594 ± 0,206ab
EEBA 75 + Doksorubisin 2,444 ± 0,084abc EEBA 150 + Doksorubisin 3,052 ± 0,114abc EEBA 300 + Doksorubisin 3,646 ± 0,174abc Keterangan :
a : Sig (p)<0,05 ada perbedaan yang signifikan dengan kelompok kontrol
b : Sig (p)<0,05 ada perbedaan yang signifikan dengan kelompok doksorubisin
Gambar 4.2 Pengaruh kelompok perlakuan terhadap aktivitas SOD
Perbedaan rata-rata aktivitas SOD pada setiap perlakuan dapat dilihat pada Gambar 4.2. Rata-rata nilai aktivitas SOD pada kelompok kontrol adalah 4,626 ± 0,258 U/ml. Nilai tersebut menunjukkan standar nilai aktivitas enzim SOD tikus dalam keadaan sehat (normal). Hasil uji statistik menunjukkan bahwa aktivitas SOD kelompok kontrol lebih tinggi dibandingkan dengan kelompok doksorubisin. Kelompok rutin memiliki aktivitas SOD tertinggi (5,594 ± 0,206 U/ml) dan kelompok perlakuan doksorubisin memiliki aktivitas SOD paling rendah (1,956 ± 0,088 U/ml). Hal ini menunjukkan bahwa pemberian doksorubisin dapat menginduksi peningkatan radikal bebas, dan menimbulkan stress oksidatif serta menurunkan aktivitas SOD (Hassanen, dkk., 2015).
Berdasarkan analisis statistika diketahui bahwa perlakuan pemberian ekstrak etanol buah andaliman memberikan pengaruh secara signifikan terhadap peningkatan aktivitas SOD pada kelompok EEBA 75 (2,444 ± 0,084 U/ml), EEBA 150 (3,052 ± 0,114 U/ml), dan EEBA 300 (3,646 ± 0,174 U/ml) dibandingkan dengan kelompok doksorubisin (stres oksidatif). Pemberian EEBA
4.626
mampu meningkatkan aktivitas SOD lebih tinggi dibandingkan dengan kelompok doksorubisin, dari hasil uji dapat dilihat bahwa semakin tinggi dosis EEBA yang diberikan semakin tinggi aktivitas SOD yang dihasilkan, bila dibandingkan dengan kelompok doksorubisin EEBA dengan dosis 300 mg/kg bb memberikan aktivitas paling baik. Hasil penelitian sebelumnya terkait uji aktivitas antioksidan EEBA secara in vitro dengan metode DPPH menunjukkan nilai IC50 sebesar 32,19
ppm (kuat) (Gultom, 2012), dari hasil kedua metode tersebut dapat dilihat bahwa baik melalui pengukuran SOD maupun dengan metode peredaman DPPH, EEBA memiliki aktivitas antioksidan yang kuat (Kristanty, dkk., 2013).
Aktivitas SOD kelompok EEBA bila dibandingkan dengan kelompok rutin (sebagai kontrol positif) menunjukkan perbedaan yang signifikan (p<0,05), dimana aktivitas SOD rutin (5,594±0,206 U/ml) menunjukkan aktivitas yang lebih tinggi. Kelompok EEBA dengan dosis 300 mg/kg bb (3,646 ± 0,174 U/ml) memiliki aktivitas SOD yang paling tinggi dibandingkan dengan dosis lainnya, akan tetapi masih belum bisa menyamai aktivitas SOD pada kelompok rutin. Rutin merupakan golongan flavonoid yang memiliki aktivitas antioksidan yang tinggi dan dapat mengurangi peroksida lipid (Annapurna, dkk., 2009).
Berdasarkan hasil skrining fitokimia, EEBA mengandung senyawa polifenol yang berupa flavonoid sebagai antioksidan ekstrasel berperan dalam menghambat enzim yang bertanggung jawab dalam produksi radikal anion superoksida (O2-) seperti xantin oksidase dan protein kinase C. Disamping itu
flavonoid juga menghambat enzim siklooksigenase, lipoksigenase, monooksigenase mikrosom, glutation S-transferase dan NADH oksidase yang semuanya terlibat dalam pembentukan ROS (Pieta, 2000), sehingga dapat dilihat bahwa aktivitas antioksidan EEBA, yaitu dengan meningkatnya kadar SOD dalam darah, merupakan kerja dari senyawa flavonoid yang terdapat dalam buah andaliman.
4.5 Pemeriksaan Histologi Jaringan Hati Tikus
Pemeriksaan histologi jaringan hati tikus dilakukan dengan pewarnaan
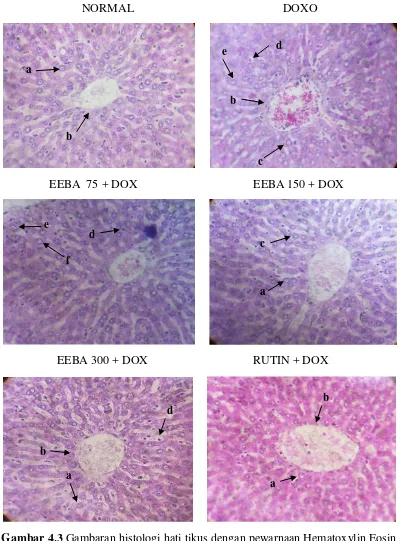
NORMAL DOXO
Gambar 4.3 Gambaran histologi hati tikus dengan pewarnaan Hematoxylin Eosin pada berbagai perlakuan (perbesara 40x)
Keterangan :
Berdasarkan hasil pemeriksaan histologi pada gambar 4.3, terlihat bahwa pada kelompok normal (Gambar 4.3.a), susunan jaringan hati pada semua tikus masih dalam keadaan baik walaupun di beberapa bagian terdapat adanya degenerasi sel. Pada semua kelompok hewan yang diberikan doksorubisin, terlihat adanya sel yang mengalami nekrosis, steatosis, dan perdarahan yang dapat dilihat pada sinusoid. Namun nekrosis dan perdarahan yang paling parah terlihat pada kelompok yang diberi perlakuan stres tunggal (Gambar 4.3.b). Pada Gambar 4.3.b terlihat susunan sel tidak beraturan dan sangat jauh berbeda tampilannya dengan Gambar 4.3.a. Selain itu juga terlihat adanya perdarahan sinusoid pada beberapa bagian hati.
Gambaran histologi hati pada kelompok rutin menunjukkan kondisi hati yang masih baik dan hampir sama dengan kelompok kontrol (normal). Dimana dapat dilihat dari kondisi sel hatinya yang sebagian besar masih dalam kondisi normal. Hanya ada beberapa sel hati yang mengalami degenerasi dan nekrosis.
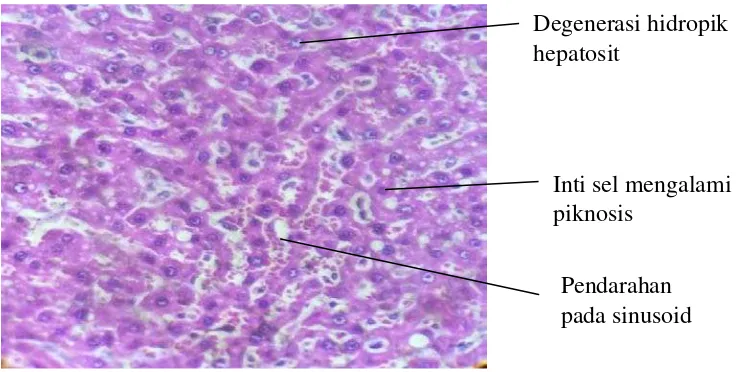
Gambar 4.4 Sel hati yang mengalami kerusakan pada kelompok yang diberikan perlakuan doksorubisin
Pada gambar histologi hati kelompok EEBA terlihat sel sel hati dalam keadaan yang lebih baik bila dibandingkan dengan kelompok perlakuan stres
Degenerasi hidropik hepatosit
Inti sel mengalami piknosis
oksidatif yang diberikan doksorubisin (Gambar 4.4). EEBA dengan dosis 300 mg/kg bb (Gambar 4.3.f) menunjukkan kondisi jaringan hati yang paling baik bila dibandingkan dosis lainnya, hal ini terlihat dari sedikitnya sel hati yang mengalami nekrosis. EEBA dengan dosis 75 mg/kg bb (Gambar 4.3.d) dan 150 mg/kg bb (Gambar 4.3.e) menunjukkan kondisi hati yang lebih baik dibanding kelompok doksorubisin, namun masih ada beberapa sel yang mengalami nekrosis, sehingga dapat dilihat bahwa pemberian EEBA dapat mencegah kerusakan hati yang disebabkan oleh radikal bebas yang dihasilkan doksorubisin dan mencegah peroksidasi lipid. Hal tersebut terkait dengan aktivitas enzim SOD dalam hati, yang berperan dalam dismutasi radikal superoksidan menjadi hidrogen peroksida. Senyawa bioaktif flavonoid dalam EEBA mengeliminasi radikal bebas dan mencegah reaksi berantai lebih lanjut terhadap komponen membran sel sehinnga dapat melindungi sel-sel hati (Suarsana, 2013).
Doksorubisin meningkatkan proses apoptosis pada jaringan hati, diinduksi oleh peroksidasi lipid pada mikrosom dan terutamadi mitokondria oleh adanya ion Fe3+ dan termasuk kerusakan pembuluh darah dan stenosis pada sel-sel hati (Hassanen, dkk., 2015).
Stres oksidatif adalah peristiwa patogenetik utama yang terjadi pada beberapa gangguan hati, seperti gangguan pada metabolisme sel untuk berproliferasi, dan menjadi penyebab utama kerusakan hati pada Iskemia (Ismail, 2012).
dinding sel menurun sehingga menimbulkan kerusakan sel berupa degenerasi seperti terlihat pada kelompok yang diberi perlakuan DOX (Djajakirana, 2009).
Radikal bebas tidak mempunyai pasangan elektron, sehingga radikal bebas tersebut akan bebas di dalam tubuh dan berusaha untuk mencapai kestabilan dengan berikatan dengan molekul di dekatnya. Ikatan antara radikal bebas dengan molekul terdekat mengakibatkan kerusakan struktur molekul tersebut. Kerusakan membran sel oleh radikal bebas terjadi melalui rangkaian proses ikatan kovalen antara radikal bebas dengan komponen-komponen membran, oksidasi gugus tiol pada komponen membran oleh radikal bebas dan reaksi peroksidasi lipid. Hasil peroksidasi lipid membran oleh radikal bebas, berefek langsung terhadap kerusakan makromolekul penting seperti lipid, protein dan DNA (Pradana, dkk., 2003).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan yang diperoleh berdasarkan pada hasil dan pengamatan adalah : a. ekstrak etanol buah andaliman mampu meningkatkan aktivitas enzim
SOD, dimana aktivitas SOD pada kelompok yang diberi EEBA menunjukkan perbedaan yang signifikan dengan kelompok yang diberi doksorubisin (stres oksidatif).
b. ekstrak etanol buah andaliman dapat mencegah kerusakan hati yang disebabkan oleh doksorubisin
c. peningkatan aktivitas SOD terjadi seiring dengan peningkatan dosis EEBA yang diberikan. Dimana dosis yang paling efektif adalah EEBA dosis 300 mg/kg bb, dengan kadar rata rata SOD 3,646 U/ml.
5.2 Saran
Berdasarkan pada pembahasan dan kesimpulan, maka penulis menyarankan : a. untuk melakukan isolasi dan identifikasi terhadap jenis senyawa flavonoid
yang terkandung dalam EEBA.