LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. Kimia Farma (Persero) Tbk, Plant Jakarta
Jl. Rawagelam V No. 1 Kawasan Industri Pulogadung Jakarta Timur
05 Mei – 16 Mei 2008
Disusun oleh:
Ainul Mardiah (073202006)
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2008
Ainul Mardiah : Laporan Praktek Kerja Profesi Farmasi Industri di PT. Kimia Farma (Persero) Tbk, Plant…, 2008 USU e-Repository © 2008
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. Kimia Farma (Persero) Tbk
Plant Jakarta
Jl. Rawagelam V No. 1 Kawasan Industri Pulogadung Jakarta Timur
05 Mei – 16 Mei 2008
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun oleh:
Ainul Mardiah, S. Si (073202006) Lady Balqis Ali, S. Farm (073202050) Rafiqoh Parinduri, S. Farm (073202073) Sri Wati, S. Farm (073202098)
PT. Kimia Farma (persero) Tbk Plant Jakarta
Disetujui oleh:
Drs. Herry Rustanto, Apt Dra. Tia Mutianingsih, Apt
Pembimbing PT. Kimia Farmasi Plant Jakarta Pembimbing PT. Kimia Farmasi Plant Jakarta
Fakultas Farmasi Universitas Sumatera Utara
Dekan
Prof. Dr. Sumadio Hadisahputra, Apt NIP. 131 283 716
KATA PENGANTAR
Puji Syukur Alhamdulillah kami panjatkan kepada Tuhan Yang Maha Esa, atas Berkat Rahmat-Nya sehingga Praktek Kerja Profesi Apoteker ( PKPA) di PT. Kimia Farma (Persero) Tbk, Plant Jakarta pada tanggal 05 Mei 2008 sampai dengan 16 Mei 2008 telah dilaksanakan dengan baik.
Kerja Praktek Profesi Apoteker di PT. Kimia Farma (Persero) Tbk, Plant Jakarta merupakan salah satu syarat yang harus dipenuhi untuk memperoleh gelar apoteker di Fakultas Farmasi Universitas Sumatera Utara dengan harapan agar setiap calon apoteker mendapatkan pengalaman dan pengetahuan tentang peran apoteker di Industri Farmasi.
Pada kesempatan ini kami mengucapkan banyak terima kasih kepada Bapak Drs. Herry Rustanto, Apt, dan Ibu Dra. Tia Mutianingsih, Apt, sebagai pembimbing yang telah meluangkan waktu untuk memberikan bimbingan moril dan pengatahuan kepada kami selama pelaksanaan PKPA di PT. Kimia Farma (Persero) Tbk, Plant Jakarta. Dan kami turut mengucapkan banyak terima yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara.
2. Bapak Drs. Wiryanto, M.Si, Apt., selaku Koordinator Program Pendidikan Profesi Apoteker Universitas Sumatera Utara .
3. Bapak Drs. Abdul Manan, Apt., selaku Plant Manager Jakarta yang telah memberikan tempat bagi kami dalam melaksanakan Praktek Kerja Profesi Apoteker dengan baik.
4. Seluruh Staf dan Karyawan/ Karyawati PT. Kimia Farma (Persero) Tbk, Plant Jakarta, yang telah banyak meluangkan waktunya untuk memberikan bantuan informasi selama pelaksanaan PKPA ini.
5. Teman – teman Profesi Apoteker Stambuk 2007, terima kasih atas segala bantuan dan motivasi yang telah diberikan
6. Semua pihak yang banyak memberikan bantuan baik moril maupun materiil yang tidak dapat disebutkan satu persatu.
Kami berharap semoga pengetahuan dan pengalaman yang kami peroleh selama kami menjalani PKPA ini dapat bermanfaat bagi rekan – rekan dan semua pihak yang membutuhkan khususnya buat kalangan Profesi Apoteker.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna, seperti kata pepatah mengatakan Tak Ada Gading Yang Tak Retak oleh karena itu penulis mengharapkan masukan , kritik dan saran dari pembaca bagi profesi kefarmasian yang akan datang.
Jakarta, juli 2008
Penulis
DAFTAR ISI
Halaman JUDUL ……...………. LEMBAR PENGESAHAN ………... i KATA PENGANTAR ……….. ii DAFTAR ISI ………. iv DAFTAR GAMBAR ………. v DAFTAR LAMPIRAN ……….. vi BAB I. PENDAHULUAN ………. 1 1.1. Latar Belakang ……….. 1 1.2. Tujuan ……….. 3BAB II. TINJAUAN UMUM INDUSTRI FARMASI ……… 4
2.1. Sejarah ……… 4
2.2. Visi dan Misi ……….... 5
2.3. Lokasi Industri Farmasi PT. Kimia Farma (Persero), Tbk ……….. 6
2.3.1. Lima Plant PT. Kimia Farma (Persero) Tbk …. 7 2.3.2. Struktur Organisasi ………... 8
2.4. Cara Pembuatan Obat yang Baik (CPOB) ……… 10
BAB III.KEGIATAN DIINDUSTRI FARMASI ……….. 22
3.1. Keterlibatan Dalam Produksi ……… 22
3.1.1. Bagaian Perencanaan Pengendalian Produksi dan Inventory ……… 22
3.2. Bagian Penyimpanan ……… 25
3.3. Bagian Produksi ……… 28
3.4. Bagian Pengelolahan Mutu dan Validasi ………. 41
3.5. Keselamatan, Kesehatan Kerja dan Lingkungan …….. 46
BAB IV. PEMBAHASAN ……… 52
BAB V. KESIMPULAN DAN SARAN ……….. 57
5.1. Kesimpulan ……….. 57
5.2. Saran ……… 57
DAFTAR GAMBAR
1. Struktur Organisasi PT. Kimia Farma (Persero) Tbk………..8 2. Struktur Organisasi PT. Kimia Farma (Persero) Tbk. Plant Jakarta………9
DAFTAR LAMPIRAN
1. Struktur Organisasi PPPI
(Perencanaan Pengendalian Produksi Dan Lingkungan…...……….59
2. Struktur Organisasi Bagian Produksi………60
3. Sruktur Organisasi Bagian Pengolahan Mutu………61
4. Struktur Organisasi Bagian Penyimpanan……….62
5. Alur Produksi Bagian Formulasi I……….63
6. Alur Proses Produksi Narkotika……….64
7. Alur Proses Produksi Bagian Formulasi II……….65
8. Alur Proses Sediaan Kapsul Bagian Formulasi III………66
9. Alur Proses Sediaan Injeksi Bagian Formulasi III………67
10. Alur Proses Sediaan Sirup Kering Bagian Formulasi III………..68
11. .Alur Proses Sediaan Krim Bagian Formulasi III……….69
12. Alur Proses Produksi Tablet Dan Kapsul Betalaktam………..70
13. Bagan Proses Pengemasan………71
14. Alur Proses Produksi Sirup Kering Betalaktam………72
15. Skema Proses Pengolahan Air………..73
16. Alur Proses Produksi (Penerimaan Dan Penggunaan Bahan Baku Serta Bahan Pengemas)…..74
17. Alur Proses Produksi (Penerimaan Dan Penggunaan Bahan Baku Serta Bahan Pengemas, lanjutan)………..………..75
19. Upaya Pengolahan Limbah………77 20. Denah Bangunan PT. Kimia Farma (Persero) Tbk, Plant Jakarta……….78 21. Denah Bangunan PT. Kimia Farma (Persero) Tbk, Plant
BAB I
PENDAHULUAN
1.1. Latar Belakang
Kesehatan merupakan hak setiap warga Negara. Setiap orang mempunyai hak untuk hidup layak, baik dalam kesehatan pribadi maupun keluarganya termasuk didalamnya mendapatkan makanan, pakaian, perumahan dan pelayanan sosial yang diperlukan.
Berdasarkan Undang – Undang Republik Indonesia No. 23 tahun 1992 tentang kesehatan, yang dimaksud dengan sehat adalah keadaan sejahtera dari badan, jiwa dan sosial yang memungkinkan setiap orang hidup produktif secara sosial dan ekonomi. Pembangunan kesehatan diarahkan guna mencapai kesadaran, kemauan, dan kemampuan untuk hidup sehat bagi masyarakat agar dapat mewujudkan derajat kesehatan yang optimal. Untuk dapat mencapai upaya, yaitu peningkatan kesehatan (promotif), pencegahan penyakit (preventif),
penyembuhan penyakit (kuratif) dan pemulihan kesehatan (rehabilitatif).
Dalam menyelenggarakan upaya – upaya tersebut, maka diperlukan sarana – sarana yang mendukung. Menurut Undang – Undang Republik Indonesia No. 23 tahun 1992 pasal 56, salah satu sarana kesehatan adalah pabrik obat atau industri farmasi. Industri farmasi sebagai salah satu sarana kesehatan adalah tempat untuk melaksanakan pekerjaan kefarmasian, antara lain pembuatan obat, pengendalian mutu, pengamanan pengadaan, penyimpanan dan distribusi obat.
Salah satu langkah utama yang dilakukan industri farmasi dalam upaya menghasilkan obat jadi yang senantiasa memenuhi persyaratan mutu sesuai
dengan yang telah ditentukan serta sesuai dengan tujuan penggunaannya adalah dengan menerapkan Pedoman Cara Pembuatan Obat Yang Baik (CPOB). Jaminan mutu suatu produk obat jadi tidak hanya sekedar lulus dari serangkaian pengujian akan tetapi mutu harus dibentuk atau dibangun pada seluruh tahapan proses produksi dari awal sampai akhir. Oleh sebab itu, pelaksanaan CPOB harus diterapkan pada seluruh aspek produksi dan pengendalian mutu.
Pengembangan produksi yang dilakukan PT. Kimia Farma (Persero) Tbk. Plant Jakarta adalah dengan terus meningkatkan kualitas produk yang dihasilkan dan meningkatkan jumlah produk yang memiliki sertifikat CPOB. PT. Kimia Farma (Persero) Pant Jakarta selain mengupayakan pengembangan dan perbaikan dalam aspek produksi juga dilakukan pada aspek sumber daya manusia. Pengembangan aspek kualitas sumber daya manusia dilakukan dengan memberikan kesempatan bagi personilnya untuk mengikuti pelatihan ataupun seminar yang menunjang kemampuan dan keterampilan.
Industri farmasi merupakan institusi yang memiliki dwi fungsi yaitu unit pelayanan kesehatan (non frofit oriented) dan sebagai institusi bisnis (profit
oriented). Industri farmasi merupakan tempat memproduksi obat jadi atau bahan
baku obat. Obat yang dibuat harus memiliki mutu tinggi dan kualitas yang baik. Industri farmasi selain dapat sebagai unit usaha yang memproduksi obat untukkebutuhan masyarakat, juga mempunyai peran yang sangat strategis dalam menyediakan obat, karena obat merupakan salah satu komoditi dibidang kesehatan yang sangat penting.
Praktek Kerja Profesi Apoteker di industri farmasi secara langsung dapat digunakan untuk mengaplikasi ilmu yang diperoleh, sehingga diharapkan
dapat menilai sampai sejauh mana peran farmasis di industri obat. Kendala yang biasa dihadapi oleh para farmasis selaku penanggung jawab dalam menegakan profesionalismenya dalam lingkungan yang cenderung selalu berfikir tentang
profit oriented dan bukan patient oriented. Praktek kerja lapangan ini diharapkan
dapat memberikan gambaran dan wacana tentang atmosfer lingkungan industri farmasi.
Universitas adalah sarana pencetak apoteker, sejak awal sudah harus mempersiapkan lulusannya sehingga mempunyai wawasan dan pengetahuan yang cukup untuk bisa berperan dan memberikan andil dalam menjalankan profesinya diindustri farmasi. Aspek teoritis yang kuat dan ditunjang dengan aspek prakstis yang diharapkan dapat mencetak lulusan tang berkualitas. Sehubungan dengan itu maka Program Pendidikan Profesi Apoteker Universitas Sumatera Utara menjalin kerja sama dengan PT. Kimia Farma (Persero) Tbk Plant Jakarta, menyelenggarakan Praktek Kerja Profesi Apoteker yang dimulai dari tanggal 05 Mei 2008 sampai dengan tanggal 16 Mei 2008, dengan adanya Praktek Kerja Profesi Apoteker di industri farmasi diharapkan mahasiswa Profesi Apoteker mampu menerapkan ilmu yang diperoleh saat kuliah dan mendapatkan pengetahuan praktis lainnya yang bermanfaat sebagai panduan dan tolak ukur dalam menjalankan Profesi Apoteker dimasa yang akan datang.
1.2. Tujuan
Tujuan Praktek Kerja Profesi Apoteker di Industri PT. Kimia Farma
(Persero) Tbk. Plant Jakarta adalah :
1. Mempersiapkan Apoteker untuk menjalani profesinya secara professional, handal, dan mandiri serta mampu menghadapi tantangan dimasa yang akan datang.
2. Memberikan gambaran tentang struktur organisasi, tugas dan fungsi Apoteker, situasi dan kondisi di Industri PT. Kimia Farma (Persero) Tbk. Plant Jakarta.
3. Mempelajari, memahami, mengetahui, tugas dan tangng jawab Apoteker di Industri farmasi PT. Kimia Farma (Persero) Tbk. Plant Jakarta baik dibidang managereal dan penerapan CPOB.
BAB II
TINJAUAN UMUM INDUSTRI FARMASI
2.1. Sejarah
Industri adalah kegiatan memproses atau mengolahan barang dengan menggunakan sarana dan peralatan, misalkan mesin, dalam pengertian bisnis, Industri adalah himpunan perusahaan yang memproduksi barang-barang yang bersifat substitusi dekat atau (closed substitute) yang memiliki nilai permintaan silang yang relatif tinggi.
Industri farmasi menurut Surat Keputusan Mentri Kesehatan No. 245/MenKes/V/1990 adalah indutri obat jadi adalah industri yang menghasilkan suatu produk yang telah melalui seluruh tahap proses pembuatan. Obat jadi tersebut dapat berupa sediaan atau paduan bahan-bahan yang siap dipergunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi. Sedangkan industri bahan baku adalah bahan yang diproduksi oleh suatu industri, diamana bahan baku tersebut adalah semua bahan baik yang berkhasiat ataupun yang tidak berkhasiat yang digunakan dalam proses penggunaan obat.
Menurut Surat Keputusan Mentri Kesehatan No. 245/MenKes/V/1990 usaha industri farmasi wajib memenuhi persyaratan sebagai berikut:
1. Didirikan oleh perusahaan umum (Perum), badan hukum berbentuk perseroaan terbatas (PT) dan kopersai.
3. Memiliki Nomor Pokok Wajib Pajak (NPWP)
4. Memenuhi persyaratan Cara Pembuatan Obat Yang Baik (CPOB) sesuai dengan SK MenKes No. 43/ MenKes/SK/II/1988 tentang pedoman CPOB. 5. Wajib mempekerjakan sekurang-kurangnya dua orang Apoteker Warga
Negara Indonesia (WNI), yang masing-masing sebagai penanggung jawab pengawasan mutu dan penanggung jawab pengawasan produksi.
6. Obat jadi yang diproduksi oleh perusahaan Industri farmasi hanya boleh diedarkan setelah mendapat persetujuan sesuai dengan ketentuan
perundang-undangan yang berlaku.
2.2 Visi dan Misi
A. Visi Industri Farmasi Indonesia menurut SK MenKes No. 47/SK/II/1983 adalah:
1. Upaya dibidang obat harus memperhatikan aspek sosial dan diarahkan untuk mendukung peningkatan dan pemantapan upaya kesehatan.
2. Mengusahakan kemandirian dibidang obat, khususnya bahan baku obat dengan jalan:
a. Mempercepat dan memperlancar transfer teknologi serta meningkatkan kemampuan pengembangan teknologi.
b. Memberikan perlindungan yang wajar terhadap obat produksi dalam negeri.
c. Penelitian dan pengembangan bahan baku dalam negeri dan
B. Misi Industri Farmasi Indonesia menurut SK MenKes No. 47/SK/II/1983 adalah:
1. Meningkatkan tersedianya dengan jenis dan jumlah yang cukup sesuai dengan kebutuhan nyata masyarakat yang diperlukan dalam kesehatan. 2. Meningkatkan penyebaran obat secara merata dan teratur sehingga
mudah diperoleh pada saat yang diperlukan serta terjangkau oleh masyarakat.
3. Menjamin kebenaran khasiat, keamanan, mutu dan keabsahan obat yang beredar serta meningkatan ketepatan, kerasionalan dan efesiensi penggunaan obat
4. Memanfaatkan potensi nasional deibidang obat menunjang pembangunan ekonomi menuju tercapainya kemandirian dibidang obat.
2.3. Lokasi Industri Farmasi PT. Kimia Farma (Persero) Tbk
PT. Kimia Farma (Persero) Tbk. Plant Jakarta berlokasi di JL.Rawagelam V No. 1 Kawasan Industri Pulogadung Jakarta Timur. PT. Kimia Farma (Persero)
Tbk. Plant Jakarta mempunyai area seluas 35.000 m2, dengan area bangunan
untuk non betalaktam seluas 11,225 m2, sumber air yang digunakan berasal dari
perusahaan Air Minum (PAM)dan air artesis sedangkan sumber listrik yang digunakan berasal dari Perusahaan Listrik Negara (PLN)dan sebagai cadangan digunakan Generator Set. Sumber udara untuk setiap ruangan menggunakan Air
Bangunan pabrik PT. Kimia Farma (Persero) Tbk. Plant Jakarta yang
mencapai luas 35.000 m2 meliputi :
1. Gedung Perkantoran
Bangunan untuk perkantoran terletak di bagian depan yang terdiri dari dua lantai. Pada lantai pertama terdapat lobi, masjid, koperasi, poliklinik, dapur dan kantin. Pada lantai dua terdapat ruang Plant Manager, ruang Manager Produksi, ruang Manager PPPI, ruang administrasi keuangan, ruang personalia, ruang pembelian dan ruang rapat.
2. Gedung Produksi Non Betalaktam
Bangunan yang terletak dibelakang perkantoran dimana pada lantai satu digunakan untuk produksi non betalaktam, produk steril, penyimpanan bahan baku dan bahan pengemas. Lantaidua digunakan sebagai laboratorium pengujian, dokumentasi, penyimpanan contoh pertinggal, teknologi formulasi, pemastian mutu, dan perpustakaan.
3. Gedung Produksi Betalaktam
Bangunan untuk produksi betalaktam merupakan gedung yang terpisah yang terdiri dari dua lantai. Lantai satu dipakai untuk produksi dan lantai dua dipakai untuk ruang pengemasan sediaan.
4. Instalasi Pengolahan Air Limbah
Unit pengolahan limbah, terdiri dari dua bagian yaitu pengolahan limbah betalaktam dan non betalaktam.
5. Bangunan Pelengkap
Bangunan ini terdiri dari generator diesel, penampungan air (PAM) dan artesis, steam dan laundry.
2.3.1. Lima Plant PT. Kimia Farma (Persero) Tbk yaitu:
1. Plant Jakarta
Memproduksi obat dalam bentuk sediaan tablet, tablet salut, kapsul, granul, sirup kering, suspensi/sirup, tetes mata, cream antibiotik dan injeksi. Unit ini satu-satunya pabrik obat yang mendapat tugas oleh pemerintah untuk memproduksi golongan narkotik di Indonesia. Unit produksi ini telah memperoleh sertifikat CPOB dan ISO- 9001.
2. Plant Bandung
Memproduksi bahan baku Kina dan turunanya, dan Alat Kontrasepsi Dalam Rahim (AKDR) serta obat asli Indonesia seperti Batugin Elixir dan Enkasari. Unit ini juga memproduksi tablet, sirup, serbuk, dan produk kontrasepsi Pil Keluarga Berencana. Unit produksi ini telah menerima sertifikat CPOB dan ISO-9001.
3. Plant Semarang
. Unit Produksi ini mengkhususkan diri memproduksi minyak jarak,
pemurnian minyak nabati seperti minyak kelapa, minyak kelapa sawit, minyak kedelai, minyak kacang serta kosmetika dalam bentuk serbuk/bedak. Unit produksi ini menjamin kualitas hasil produksi dengan menerapkan system manajemen mutu ISO-9001, serta telah mendapat sertifikat CPOB
4. Plant Watudakon (Jombang), Jawa Timur
Satu-satunya pabrik yang mengolah tambang yodium di Indonesia. Unit ini memproduksi yodium dan garam-garamnya, bahan baku ferro sulfat sebagai bahan utama pembuatan tablet besi untuk obat tambah darah dan kapsul
lunak “Yodiol” yang merupakan obat pilihan untuk pencegahan gondok. Unit ini telah memproduksi sertifikat CPOB, ISO-9001 dan ISO-14001.
5. Plant Tanjung Morawa ( Medan), Sumatera Utara.
Unit ini khusus untuk memasok kebutuhan obat di wilayah Sumatera. Produk yang dihasilkan pabrik berupa sediaan tablet, cream, dan kapsul dalam skala kecil. Plant ini telah memperoleh sertifikat CPOB.
2.3.2 Struktur Organisasi
A. Struktur Organisasi PT. Kimia Farma (Persero) Tbk.
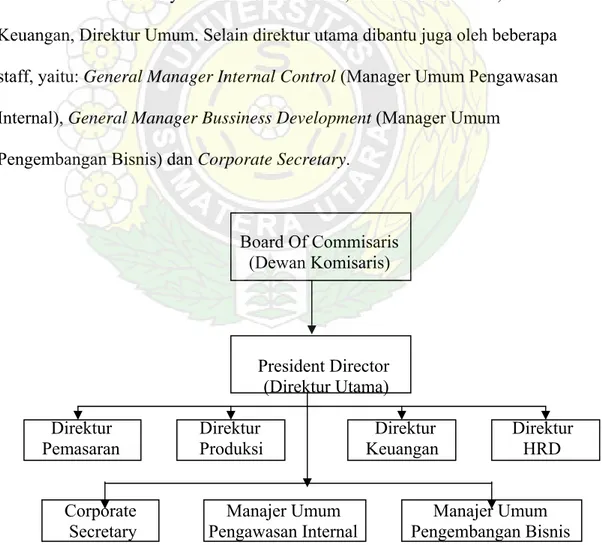
PT. Kimia Farma (Persero) Tbk, dipimpin oleh seorang Direktur Utama, dibantu oleh 4 Direktur yaitu: Direktur Produksi, Direktur Pemasaran, Direktur Keuangan, Direktur Umum. Selain direktur utama dibantu juga oleh beberapa staff, yaitu: General Manager Internal Control (Manager Umum Pengawasan Internal), General Manager Bussiness Development (Manager Umum
Pengembangan Bisnis) dan Corporate Secretary.
Board Of Commisaris
(Dewan Komisaris)
President Director
(Direktur Utama)
Direktur Direktur Direktur Direktur
Pemasaran Produksi Keuangan HRD
Corporate Manajer Umum Manajer Umum
Secretary Pengawasan Internal Pengembangan Bisnis
B. Struktur Organisasi PT. Kimia Farma (Persero)Tbk. Plant Jakarta
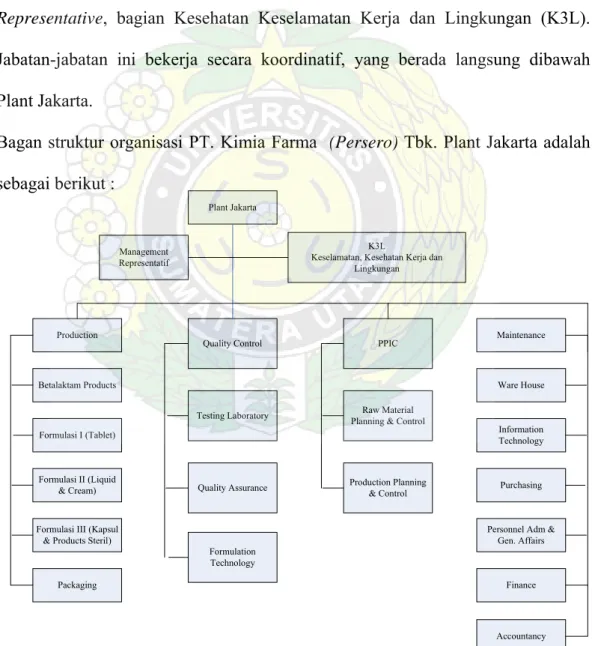
PT. Kimia Farma (Persero) Tbk. Plant Jakarta dipimpin oleh Plant
Manager yang langsung membawahi Bagian Produksi, Pengelolaan Mutu,
Perencanaan Pengendalian Produksi dan Inventori (PPPI), Bagian Administrasi/Keuangan, Bagian Pembelian, Bagian Umum Personalia dan Bagian Teknik Pemeliharaan.
Selain itu terdapat juga beberapa jabatan fungsionl seperti Management
Representative, bagian Kesehatan Keselamatan Kerja dan Lingkungan (K3L).
Jabatan-jabatan ini bekerja secara koordinatif, yang berada langsung dibawah Plant Jakarta.
Plant Jakarta
Management Representatif
K3L
Keselamatan, Kesehatan Kerja dan Lingkungan Production Betalaktam Products Formulasi I (Tablet) Formulasi II (Liquid & Cream)
Formulasi III (Kapsul & Products Steril)
Packaging Quality Control Testing Laboratory Quality Assurance Formulation Technology PPIC Raw Material Planning & Control
Production Planning & Control Maintenance Ware House Information Technology Purchasing
Personnel Adm & Gen. Affairs
Finance
Accountancy
Bagan struktur organisasi PT. Kimia Farma (Persero) Tbk. Plant Jakarta adalah sebagai berikut :
2.3 Cara Pembuatan Obat yang Baik (CPOB) a. Ketentuan Umum
Cara Pembuatan Obat Yang Baik (CPOB) menyangkut seluruh aspek produksi dan pengendalian mutu, bertujuan untuk menjamin mutu yang telah disesuaikan dengan tujuan penggunaannya.
Ketentuan umum memuat beberapa landasan yang penting diperhatikan yaitu:
1. Pengawasan menyeluruh pada proses pembuatan obat untuk menjamin
bahwa konsumen obat yang bermutu tinggi. Pengawasan menyeluruh merupakan salah satu kegiatan yang sangat esensial pada pembuatan obat.
2. Untuk menjamin mutu suatu obat jadi tidak boleh hanya mengandalkan pada
suatu pengujian tertentu saja. Mutu obat harus dibangun dalam produk obat itu sendiri. Mutu obat tergantung mutu bangunan, peralatan dan personalia yang terlibat.
3. CPOB merupakan pedoman yang dibuat untuk memastikan agar sifat dan
mutu obat yang dihasilkan sesuai dengan syarat bahwa standar mutu obat yang telah ditentukan telah tercapai.
b. Personalia
Kualitas sediaan obat yang dihasilkan ditentukan oleh beberapa faktor penunjang, salah satu faktor terpenting adalah faktor manusia. Oleh karena alur produksi hanya bisa terjadi jika personil yang mengerjakannya mempunyai kualitas yang sesuai dengan tingkat pendidikan dan pengalamannya.
Jumlah karyawan disemua tingkatan hendaklah cukup serta memiliki pengetahuan, keterampilan dan kemampuan sesuai dengan tugasnya serta
kesehatan mental dan fisik yang baik sehingga mampu melaksanakan tugasnya secara professional dan sebagaimana mestinya. Mereka hendaklah mempunyai sikap dan kesadaran tinggi untuk mewujudkan CPOB. Hal-hal yang perlu diperhatikan dalam aspek ini adalah:
1. Organisasi dan tanggung jawab
Dalam perusahaan, struktur organisasi disusun sedemikian rupa sehingga bagian pengawasan mutu dipimpin oleh orang yang berbeda yang tidak saling bertanggung jawab satu terhadap lain. Masing-masing hendaklah diberi wewenang penuh dan sarana yang cukup yang diperlukan untuk melaksanakan tugasnya secara efektif. Keduanya tidak dapat menghambat atau membatasi tanggung jawabnya atau yang dapat menimbulkan pertentangan kepentingan pribadi atau financial.
Manajer Produksi dan Pengawasan Mutu hendaklah seorang Apoteker yang cakap, terlatih dan memiliki pengalaman praktis dan memadai di bidang industri farmasi dan keterampilan dalam kepemimpinan sehingga memungkinkan melaksanakan tugas secara professional.
Manajer Produksi hendaklah memiliki wewenang serta tanggung jawab penuh untuk mengelola produksi obat. Manajer Produksi hendaklah memiliki tanggung jawab bersama dalam menjaga mutu obat, baik dengan Manajer Pengawasan Mutu maupun Manajer teknik.
Manajer Pengawasan Mutu hendaklah diberi wewenang dan tanggung jawab penuh dalam seluruh tugas pengawasan mutu yaitu dalam penyusunan, verifikasi dan pelaksanaan seluruh prosedur pengawasan mutu. Manajer pengawasan Mutu adalah satu-satunya yang memiliki wewenang untuk
meluluskan bahan awal produk antara, produk ruahan dan obat jadi bila produk sesuai dengan spesifikasinya, atau menolaknya bila tidak cocok dengan spesifikasinya atau bila tidak dibuat dengan prosedur yang tidak disetujui kondisi yang ditentukan.
2. Pelatihan
Seluruh karyawan yang berhubungan langsung dengan proses pembuatan obat hendaklah dilatih mengenai kegiatan tertentu yang sesuai dengan tugasnya maupun mengenai prinsip CPOB. Pelatihan hendaklah diberikan olah tenaga kompoten. Pelatihan khusus hendaklah bagi mereka yang berkerja didaerah steril dan daerah bersih atau bagi mereka yang bekerja menggunakan bahan yang mempunyai resiko tinggi,toksik atau yang menimbulkan sensitifisasi.
Latihan mengenai CPOB harus dilakukan secara berkesinambungan dan dengan frekuensi yang memadai untuk menjamin agar para karyawan terbiasa dengan persyaratan dengan CPOB yang berkaitan dengan tugasnya. Pelatihan mengenai CPOB dilaksanakan menurut program tertulis yang telah disetujui oleh Manajer Produksi dan Manajer Pengawasan.
Catatan pelatihan karyawan mengenai CPOB hendaklah disimpan dan efektifitas program pelatihan dinilai secara berkala. Setelah mengadakan pelatihan, pelatihan karyawan hendaklah dinilai untuk menentukan apakah mereka memilki kualifikasi yang memadai untuk melaksanakan tugas yang diberikan kepadanya.
3. Bangunan dan Fasilitas
Bangunan untuk produksi obat-obatan hendaklah memiliki ukuran, rancangan konstruksi dan letak yang memadai untuk mencegah bahan yang dapat meiliki kualitas dan hendaknya memberikan kondisi lingkunagan yang sesuai, karena akan mempengaruhi kelancaran kerja. Letak bangunan dibuat cukup tinggi agar terhindar dari banjir dan dilengkapi dengan saluran pembuangan air.
Beberap persyartan yang perlu diperhatikan pada bangunan industri farmasi, antara lain:
1. Pabrik ditata sedemikian rupa untuk mencegah kekacauan dan kemungkinan
pencemaran silang serta tercampurnya obat, komponen , dan bahan pengemas ysang berlainan.
2. Sekat ruangan hendaknya digunakan untuk mencegah pencemaran atau
kasalahan.
3. Diperlukan pemisahan ruangan untuk kegiatan tertentu sesuai dengan fungsi
kegiatan produksi.
4. Ruangan yang diperlukan untuk pembutan steril harus terpisah dari kegiatan
lainnya.
5. Untuk daerah produksi, permukaan bagian dalam ruangan (dinding, lantai,
dan langit-langit) harus licin, bebas dari keretakan dan sambungan terbuka, mudah didesinfeksi dan dibersihkan. Lantai dibuat dari bahan kedap air, permukaan rata, dan mudah dibersihkan.
6. Daerah penyimpanan hendaknya diatur sedemikian rupa, sehingga
memungkinkan penyimpanan bahan dan produk dalam keadaan kering, bersih, dan teratur. Hendaknya disediakan daerah khusus untuk menyimpan
bahan yang mudah terbakar, yang mudah meledak, yang sangat beracun, narkotika dan bahan berbahaya lain serta untuk produk atau bahan yang ditolak..
Berdasarkan kelompok kegiatan dan tingkat kebersihannya, maka tata ruang bangunan industri farmasi terdiri atas:
1. White area (Daerah putih), termasuk kelas I dan II. Untuk kelas I, jumlah
partikel maksimum permeter kubik (m3) sebanyak 3.500 sedangkan untuk
kelas II jumlah partikel maksimum permeter kubik (m3) sebanyak 350.000.
Meliputi ruang penyaringan steril, pengolahan, pengisian salep mata, pengisian injeksi, pengolahan aseptis, dan pengisian bubuk steril.
2. Grey area ( Daerah abu-abu), termasuk kelas III dimana, jumlah partikel
permeter kubik (m3) sebanyak 3.500.000. Meliputi ruang pengolahan dan
pengemasan obat nonsteril dan ruang pembuatan salep selain salep mata. 3. Black area (Daerah hitam) termasuk kelas IV yang meliputi ruang ganti
pakaian, ruang masuk, kantor penerimaan bahan awal, gudang bahan awaldan obat jadi, ruang generator, ruang makan, ruang istirahat, dan toilet.
c. Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki rancangan bangunan dan konstruksi yang tepat, ukuran yang memadai, dan ditempatkan dengan tepat, sehingga mutu setiap produk terjamin secara seragam dari batch ke batch serta memudahkan pembersihan dan perawatannya.
Rancangan bangunan dan konstruksi peralatan hendaklah memenuhi persyaratan sebagai berikut:
1. Permukaan peralatan yang bersentuhan dengan bahan baku, produk antara, produk jadi tidak boleh bereaksi. Mengadisi atau mengabsorbsi, yang dapat mengubah identitas, mutu atau kemurniannya diluar batas yang ditentukan. 2. Peralatan tidak boleh menimbulkan akibat yang merugikan terhadap produk. 3. Bahan-bahan yang diperlukan untuk suatu tujuan khusus, seperti pelumas atau
pendingin tidak boleh bersentuhan langsung dengan bahan yang diolah.
4. Peralatan hendaknya dapat dibersihkan dengan mudah, baik bagian dalam maupun bagian luar.
5. Peralatan yang digunakan untuk menimbang, mengukur, menguji, dan mencatat hendaklah diperiksa ketelitiannya secara teratur serta dikalibrasi menurut suatu program dan prosedur yang tepat.
6. Peralatan hendaknya dirawat sesuai dengan jadwal yang tepat.
7. Alat-alat harus dikalibrasi dan divalidasi untuk menjamin kelancaran kerja. 8. Daerah yang digunakan sebagai tempat penyimpanan bahan yang mudah
terbakar hendaklah dilengkapi dengan perlengkapan elektris yang eksploisasi serta dibumikan dengan sempurna.
d. Sanitasi dan Higiene
Sanitasi dan Higiene mutlak diperlukan dalam setiap aspek pembuatan obat Ruang lingkup sanitasi dan hygiene meliputi semua sumber pencemaran produk seperti personalia, bangunan, peralatan, bahan awlal serta wadahnya. Sumber pencemaran hendaklah dihilangkan dengan program sanitasi dan higiene yang menyeluruh dan terpadu.
1. Personalia
Seluruh karyawan hendaknya menjalani kesehatan baik sebelum maupun setelah diterima sebagai karyawan selama bekerja. Higiene perorangan harus dilatih dan diterapkan semua karyawan yang berhubungan dengan proses produksi, dan semua karyawan hendaknya menghindari untuk bersentuhan langsung dengan produksi, sehingga diperlukan pakaian pengaman yang memadai dan sesuai dengan tugasnya.
2. Bangunan
Bangunan yang digunakan untuk pembuatan obat hendaknya dirancang dan dibangun dengan tepat untuk memudahkan pelaksanaan sanitasi yang baik. Bangunan hendaknya dilengkapi fasilitas sanitasi yang memadai seperti toilet, loker, bak cuci, tempat penyimpanan bahan pembersih, insektisida, bahan fungi dan lain-lain. Hendaknya disusun pula suatu prosedur yang merupakan prosedur tetap untuk melaksanakan sanitasi dengan jadwal yang teratur, serta diuraikan dengan cukup rinci.
3. Peralatan.
Peralatan harus dibersihkan sebelum dan sesudah digunakan sesuai prosedur yang telah ditetapkan. Suatu prosedur yang dirinci untuk pembersihan dan sanitasi peralatan sekurang-kurangnya meliputi penanggung jawab, jadwal, metode, peralatan dan bahan yang dipakai dalam pembersihan, merupakan prosedur tetap untuk melaksanakan sanitasi dengan jadwal yang teratur yang tidak bersamaan dengan jadwal produksi. Selain itu prosedur sanitasi dengan higiene hendaknya diatur dan dievaluasi secara berkala untuk memastikan
bahwa seluruh prosedur telah memenuhi syarat dan telah dilakukan secara efektif.
e Produksi
Produksi obat-obatan hendaklah dilaksanakan sesuai dengan prosedur yang telah ditetapkan agar senantiasa diperoleh obat jadi yang memenuhi spesifikasi yang ditentukan. Aspek-aspek yang harus diperhatikan dalam kegiatan produk meliputi:
1. Bahan awal
Pemeriksaan bahan awal dilakukan oleh bagian pemastian mutu berdasarkan spesifikasi yang ditentukan dan dikarantina, sampai diluluskan untuk dipakai. Bahan awal yang tidak memenuhi syarat disimpan terpisah untuk dikembalikan kepada pemasok atau dimusnahkan.
2. Validasi proses
Semua prosedur produksi hendaklah divalidasi dengan tetap dan dilaksanakan menurut prosedur yang telah ditentukan. Proses dan prosedur tersebut hendaknya secara rutin dievaluasi ulang untuk memastikan bahwa proses dan prosedur tetap mampu memberikan hasil yang diinginkan.
3. Pencemaran.
Pencemaran kimiawi atau mikroba terhadap suatu obat yang dapat merugikan kesehatan atau mempengaruhi daya terapeutik serta mempengaruhi kualitas produk tidak dapat diterima. Perhatian khusus hendaklah diberikan pada masalah pencemaran silang, karena sekalipun sifat dan tingkatanya tidak berpengaruh langsung pada kesehatan, hal ini
4. Sistem penomoran batch atau lot
Suatu system yang menjabarkan cara penomoran batch dan lot secara rinci diperlukan untuk memastikan bahwa produk antara, produk ruahan atau obat jadi suatu batch dan lot dapat dikenali dengan nomor batch dan lot tertentu tidak digunakan secara berulang
5. Penimbangan dan penyerahan
Penimbangan atau perhitungan dan penyerhan bahan baku, bahan pengemas, produk antara dan produk ruahan dianggap suatu bagian dari siklus produksi dan memerlukan dokumentasi yang lengkap
6. Pengembalian
Semua bahan baku, bahan pengemas, produk antara dan produk ruahan yang dikembalikan ketempat penyimpanan hendaklah didokumentasikan dan dicek dengan baik. Bahan-bahan tersebut tidak boleh dikembalikan kecuali memenuhi spesifikasi yang ditetapkan.
7. Pengelolaan
Pemeriksaan awal pada pengolahan baik bahan, kondisi daerah pengolahan, wadah dan peralatan harus mengikuti prosedur tertulis yang telah ditetapkan. Pencegahan pencemaran silang dalam seluruh tahap pengolahan.
8. Produk steril
Produk steril hendaklah dibuat dengan pengawasan khusus untuk menghilangkan pencemaran mikroba dan partikel lain. Produksi steril dapat digolongkan dalam dua kategori utama, yaitu yang harus diperoses dengan cara aseptic pada semua tahap, dan yang disterilkan dalam wadah akhir yang disebut juga sterilisasi akhir. Untuk membuat produk steril diperlukan suatu
ruangan terpisah yang selalu bebas debu dan dialiri udara yang melewati saringan bakteri. Tekanan udara dalam ruangan hendaklah lebih tinggi dari ruangan disebelahnya.
9. Pengemasan
Produk ruahan menjadi obat jadi, yang dilaksanakan dengan pengawasan yang tepat untuk menjaga identitas, keutuhan dan kualitas barang yang sudah dikemas. Semua kegiatan pengemasan hendaklah dilaksanakan dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam prosedur pengemasan induk.
10. Bahan atau produk pulihan
Bahan atau produk dapat diolah ulang atau dipulihkan asalkan bahan tersebut layak untuk diolah ulang melalui prosedur tertentu yang telah disahkan, serta hasilnya masih memenuhi persyaratan spesifikasi yang ditentukan dan tidak terjadi perubahan yang berarti terhadap mutunya Sisa produk yang tidak layak untuk diolah ulang atau bahan pulihan yang tidak memiliki spesifikasi, mutu kemanjuran atau keamanan tidak boleh ditambahkan kedalam batch berikutnya.
11. Obat kembalian
Obat jadi yang dikembalikan dari gudang pabrik jika, ditemukan adanya kerusakan kualitas teknis obat atau adanya reaksi merugikan dari obat misal karena label atau kemasan luar kotor atau rusak, dapat diberi label kembali atau diolah ulang kebatch berikut asalkan tidak ada resiko terhadap mutu produk dan pengerjaan pengolahan ulang hendaklah disahkan dan didokumentasikan secara khusus. Obat kembalian dari peredaran dapat
dijual kembali, diberi label kembali atau diolah kembali jika telah dilakukan evaluasi secara cermat dan hasil pemeriksaan ulang olah Bagian Pemastian Mutu dinyatakan memenuhi syarat.
12. Karantina obat jadi dan penyerahan kegudang obat jadi
Karantina obat jadi merupakan titik akhir pengawasan sebelum obat jadi diserahkan ke gudang dan siap didistribusikan.
13. Pengawasan distribusi obat jadi
Sistem distribusi hendaknya dirancang dengan tepat sehingga menjadi obat jadi yang pertama masuk didistribusikan terlebih dahulu (First In First Out). 14. Penyimpanan bahan awal, Produk antara, produk ruahan dan obat jadi.
Bahan tersebut disimpan rapi dan teratur untuk mencegah resiko tercampur baur atau pencemaran sera memudahkan pemeriksaan dan pemeliharaan.
f. Pengawasan Mutu
Pengendalian mutu obat dilaksanakan melalui sistem pengawasan yang terencana dan terpadu. Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan obat yang baik untuk memastikan tiap obat yang dibuat senantiasa memenuhi persyaratan mutu yang sesuai dengan penggunaannya. Pengawasan mutu penting dalam penetapan spesifikasi, pengambilan contoh dan pengujian beserta dukungan dan prosedur yang menjamin bahwa pengujian benar-benar dilaksanakan, serta kelulusan bahan dan produk tidak akan diberikan sebelum mtunya dinilai memuaskan. Keterlibatan dan rasa tanggung jawab semua unsur yang berkepentingan dalam seluruh rangkaian pembuatan adalah mutlak untuk mencapai sasaran mutu yang ditetapkan mulai dari saat obat dibuat sampai didistribusi obat jadi.
Untuk keperluan tersebut harus ada suatu bagian pengawasan mutu yang berdiri sendiri. Bagian pengawasan mutu bertanggung jawab untuk memastikan bahwa:
1. Tahap produksi obat telah dilaksanakan sesuai prosedur yang telah
ditetapkan dan telah divalidasi sebelumnya, antara lain melalui evaluasi dokumentasi produk terdahulu.
2. Semua pengawasan selama proses dan pemeriksaan laboratorium terhadap
suatu bets obat telah dilkasanakan dan bets tersebut telah memenuhi spesifikasi yang ditetapkan sebelum didistribusi.
3. Suatu bets memenuhi persyaratan mutunya selama waktu peredaran yang ditetapkan.
Bagian pengawasan mutu ini memiliki wewenang khusus untuk memberikan keputusan akhir meluluskan atau menolak atas mutu bahan baku atau produk obat ataupun hal lain yang mempengaruhi mutu obat.
g. Infeksi Diri
Tujuan infeksi diri adalah untuk melakukan penilaian apakah seluruh aspek produksi dan pengendalian mutu dalam pabrik memenuhi ketentuan CPOB. Program infeksi diri harus dirancang untuk mendeteksi kelemahan dan pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan. Infeksi diri ini harus dilakukan secara teratur. Seluruh tindakan perbaikan yang disarankan untuk melaksanakan infeksi diri ditunjuk tim infeksi diri yang mampu menilai secara objektif pelaksanaan CPOB. Tim infeksi diri ditunjuk oleh manager perusahaan, sekurang-kurangnya terdiri dari 3 orang yang ahli dibidang pekerjaan dan paham mengenai CPOB. Infeksi diri hendaknya dilakukan oleh orang yang kompeten
dari perusahaan dengan atau tanpa bantuan tenaga ahli dari luar. Keseluruhan prosedur dan pencatatan mengenai infeksi diri ini harus didokumentasikan.
h. Penanganan Ketentuan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian
Keluhan terhadap obat dan laporan keluhan dapat menyangkut mutu, efek samping yang merugikan atau masalah efek terapeutik. Semua laporan dan laporan keluhan hendaknya diteliti dan dievaluasi dibuatkan laporan.
Penarikan kembali obat dapat berupa penarikan kembali satu atau beberapa bacth atau seluruh obat jadi tertentu dari suatu mata rantai distribusi. Penarikan kembali dilakukan apabila ditemukan adanya produk yang tidak memenuhi persyaratan mutu atau dasar pertimbangan adanya efek samping yang tidak diperhitungkan yang merugikan kesehatan.
Obat kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan kepabrik karena adanya keluhan, kerusakan, kadarluarsa, masalah keabsahan atau sebab lain mengenai kondisi obat, wadah atau kemasan sehingga menimbulkan keraguan akan keamanan, identitas, mutu dan jumlah obat yang bersangkutan.
Prosedur pengamanan obat kembalian hendaklah dengan memperhatikan hal-hal berikut antara lain: Identifikasi dan pencatatan mutu dari obat kembalian, dikarantina, dilakukaan penelitian, pemeriksaan dan pengujian.
Obat kembalian yang tidak dapat diolah ulang hendaklah dimusnahkan dan hendaklah dibuat prosedur pemusnahan bahan atau produk yang ditolak mencakup pencegahan pencemaran lingkungan dan mencegah kemungkinan jatuhnya obat tersebut ketangan orang yang tidak berwenang.
Pelaksanaan penanganan terhadap obat kembalian dan tindak lanjut yang dilakukan hendaklah dicatat dan dilaporkan. Untuk tiap pemusnahan obat kembalian hendaknya dibuat berita acara yang ditandatangani oleh pelaksana pemusnahan dan saksi.
i .Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi managemen yang meliputi spesifikasi prosedur, metode dan instruksi, perencanaan, pelaksanaan, pengendalian, serta evaluasi seluruh rangkaian pembuatan obat. Dokumentasi sangat penting untuk memastikan bahwa setiap petugas dapat instruksi secara rinci dan jelas mengenai bidang tugas yang harus dilakukan sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan.
Sistem dokumentasi harus menggambarkan riwayat lengkap dari setiap
bacth atau lot suatu produk sehingga memungkinkan penyelidikan serta
penelusuran terhadap bacth atau lot produk yang bersangkutan. Sistem dokumentasi juga digunakan dalam pemantauan dan pengendalian.
BAB III
KEGIATAN DI INDUSTRI FARMASI
3.1. Keterlibatan Dalam Produksi
3.1.1. Bagian Perencanaan Pengendalian Produksi Dan Iventory ( PPPI )
PPPI merupakan bagian yang bertanggung jawab dalam perencanaan dan pengendalian bahan produksi dan inventori serta menjadi penghubung antara bagian marketing dan produksi.
Tugas dan fungsi dari PPPI adalah :
a. Mengevaluasi dan mengkonfirmasi pesanan dari pemasaran / unit lain. b. Menghitung dan merencanakan kebutuhan bahan baku / kemasan. c. Mengendalikan stok bahan baku / kemasan agar efektif dan efisien.
d. Merencanakan dan membuat jadwal produksi per triwulan untuk seluruh item. e. Mengendalikan proses produksi agar efektif, efisien, dan sesuai jadwal. f. Menyiapkan laporan Managerial per bulan.
Berdasarkan struktur organisasi, PPPI membawahi 2 bagian yaitu : 1) Bagian Perencanaan dan Pengendalian Bahan
a. Supervisor pengendalian bahan b. Supervisor perencanaan bahan
2) Bagian Perencanaan dan Pengendalian Produksi a. Supervisor pengendalian produksi
3.1.a. Bagian Perencanaan dan Pengendalian Bahan.
Tugas bagian ini merencanakan dan mengendalikan persediaan bahan yang di butuhkan untuk proses produksi, bekerja sama dengan bagian pemasaran yang mengacu pada Rencana Kerja dan Anggaran Perusahaan ( RKAP ). Dalam hal perencanaan bahan PPPI berkoordinasi dengan 4 bagian lain yaitu bagian produksi, bagian pengelolaan mutu, bagian penyimpanan dan bagian pembelian.
Perencanaan harus dilakukan secara efisien, beberapa strategi dalam system perencanaan bahan baku dan bahan kemasan adalah sebagai berikut :
a. Penentuan kuantum stok ditetapkan berdasarkan hasil produksi tahun sebelumnya dibagi 12 bulan dan stok minimum adalah persediaan untuk tiga bulan.
b. Penentuan jumlah ditentukan dengan cara RE Order Level ( ROL ), yaitu kuantum yang menyebutkan waktu dilakukan order kembali.
c. Jadwal penerimaan pesanan untuk bahan kemasan adalah 40 hari dari tanggal SPPB ( Surat Permohonan Pemesanan Bahan ) dan untuk bahan baku adalah 3 bulan dari tanggal SPPB.
d. Jumlah yang di butuhkan termasuk untuk buffer stock, bila kurang akan dibuatkan SPPB ( Surat Permohonan Pemesanan Bahan ).
Jumlah permintaan pemesanan barang dari pemasaran akan menjadi bahan pertimbangan, sehingga akan ada beberapa kemungkinan yaitu :
a. Pesanan di penuhi 100 % karena bahan baku tersedia, SDM mencukupi dan kapasitas mesin besar.
b. Pesanan tidak dipenuhi sama sekali karena bahan baku kosong atau mesin produksi rusak.
c. Pesanan dipenuhi sebagian atau kurang dari 100 % karena keterbatasan bahan dan kapasitas produksi.
d. Jumlah pesanan dapat ditambah atau dikurangi, hal tersebut terjadi karena adanya beberapa factor, yaitu kapasitas produksi terbatas, stok obat di pasaran masih banyak, serta bahan baku tidak lengkap.
Sesuai dengan pemesanan, maka bagian perencanaan dan pengendalian bahan membuat surat permohonan pemesanan barang ( SPPB ) dengan melampirkan spesifikasi bahan dan untuk bahan pengemas disertai contohnya yang kemudian dikirim kebagian pembelian. Untuk pembelian produk local dilakukan oleh bagian pembelian plant Jakarta, sedangkan untuk produk impor dilakukan oleh bagian pembelian kantor pusat yang akan mengkoordinir bagian pembelian ini di seluruh Indonesia. Untuk pengendalian stok bahan dilakukan pengecekan jumlah pemakaian per hari perhitungan dengan cermat pada saat pembuatan SPPB dan mengatur jadwal kedatangan bahan yang akan dipesan sesuai jadwal.
3.1.b. Bagian Perencanaan dan Pengendalian Produksi
Tugas utama bagian perencanaan dan pengendalian produksi ( PP Produksi ) adalah merencanakan dan mengendalikan proses produksi, agar berjalan lancer dan berkesinambungan. Dilakukan berdasarkan konfirmasi dan dibuat jadwal produksi per minggu dalam satu triwulan.
Bila bahan – bahan yang di perlukan untuk produksi telah di terima, maka langkah – langkah selanjutnya adalah :
a. Mengevaluasi pesanan dengan mengkonfirmasi Bagian Perencanaan Bahan, Bagian Laboratorium Pengujian dan Bagian Produksi.
b. Mengkonfirmasi bagian pemasaran maksimal lima hari kerja.
c. Membuat rencana penurunan SPK ( Surat Perintah Kerja ), dimana rencana ini harus di sesuaikan dengan kesiapan bahan dan mesin, SPK diturunkan ke bagian produksi setiap minggu.
d. Mengevaluasi SPK apakah SPK tersebut belum, sedang atau sudah di jalankan.
Supervisor PP Produksi memonitor perkembangan proses produksi, untuk memudahkan monitoring, maka SPK yang di keluarkan harus diperiksa kelengkapannya, antara lain :
1. Bon Penyerahan Bahan Baku ( BPBB ) dari penimbangan sentral ( PS ) ke produksi.
2. Bon I sampai ke Bon IV adalah bon penyerahan produk setengah jadi ( BPPSJ ), yaitu :
• Bon I dari produksi ke KIP. • Bon II dari KIP ke produksi. • Bon III dari produksi ke KIP. • Bon IV dari KIP ke pengemasan.
3. Bon V adalah bon penyerahan produk jadi ( BPPJ ) dari pengemasan ke bagian penyimpanan.
4. Khusus untuk tablet salut terdapat : • Bon IA dari proses massa ke KIP. • Bon IIA dari KIP ke proses. • Bon IB dari cetak ke KIP. • Bon IIB dari KIP ke coating.
Setiap minggu dilakukan evaluasi kegiatan produksi dan setiap bulan dibuat laporan evaluasi ke bagian pemasaran, apakah kegiatan produksi memenuhi target atau tidak.
3.2. Bagian Penyimpanan
Bagian penyimpanan bertugas untuk mengelola penerimaan, penyimpan dan pengeluaran baik bahan baku, bahan kemasan, serta produk jadi, bagian ini di pimpin oleh seorang Asisten Manager Penyimpanan yang membawahi 4 supervisor, yaitu :
1. Supervisor Gudang Bahan Baku. 2. Supervisor Gudang Bahan Kemas.
3. Supervisor Gudang Bahan Jadi dan Ekspedisi. 4. Supervisor Penimbangan Sentral.
Alur proses pada bagian penyimpanan adalah sebagai berikut :
a. Penerimaan.
Barang yang dikirim oleh pemasok ke gudang penyimpanan disesuaikan dengan surat pesanan ( SP ) dari bagian pembelian. Oleh petugas penyimpanan setiap barang yang datang, harus diperiksa kesesuaiannya dengan SP dan dilakukan pemeriksaan secara visual. Jika telah sesuai, bagian pembelian membuat surat bukti titipan barang sementara ( BTBS ) dan di beri label kuning sebagai tanda bahwa barang tersebut berstatus karantina. BTBS juga berfungsi sebagai permohonan periksa yang di serahkan kepada bagian Laboratorium Pengujian.
Apabila hasil pemeriksaan laboratorium ( HPL ) tidak lulus, maka bahan diberi label merah dan diberi tulisan DITOLAK kemudian dikembalikan kepada pemasok disertai surat pengembalian. Untuk bahan baku yang DILULUSKAN diberi label hijau oleh bagian Laboratorium Pengujian dan dibuat bon penerimaan bahan baku ( BPBB ) dan bon penerimaan bahan kemas ( BPBK ). Apabila sudah dinyatakan lulus, surat jalan ditanda tangani untuk penagihan pembayaran. Surat jalan tersebut di serahkan kepada bagian Pembelian sebagai data stok barang. Untuk bahan baku betalaktam penerimaan dilakukan dalam gudang tersendiri yang terdapat di dalam area Beta Laktam.
Pada HPL terdapat jadwal uji ulang barang yang disimpan. Pemeriksaan ulang bahan aktif dilakukan setiap 1 tahun sekali, sedangkan untuk bahan tambahan di lakukan 2 tahun sekali. Jika hasil pemeriksaan ulang menyatakan barang tersebut sudah tidak memenuhi syarat lagi, maka barang tersebut diberi label DITOLAK kemudian dimusnahkan.
b. Penyimpanan.
Ruangan penyimpanan terbagi atas 4 ruang, di sesuaikan dengan sifat dan jenisnya untuk menjaga stabilitas barang digudang penyimpanan, yaitu :
a. Ruang A
Terbagi atas 4 bagian, yaitu ; ruang penerimaan bahan baku, ruang karantina bahan baku, produk jadi dan ekspedisi serta ruang sampling bahan baku. Ruang sampling bahan baku merupakan zona abu – abu dan berada di bawah tanggung jawab Laboratorium Pengujian. Suhu ruang A ini diatur tidak lebih dari 30ºC dan kelembaban ( Rh ) maksimal 75 % pengkondisian ruangan ini di lakukan hanya saat jam kerja.
b. Ruang B
Merupakan gudang penyimpanan bahan baku ( umumnya untuk bahan – bahan pembantu ). Suhu ruang ini di monitor tidak boleh lebih dari 30 ºC dan kelembaban maksimal 75 % ± 5%. Pengkondisian ruangan ini dilakukan hanya pada saat jam kerja.
c. Ruang C.
Merupakan ruang penyimpanan bahan pengemas primer (misal : alumunium foil). Suhu ruang ini di monitor maksimal 25 ºC dan kelembaban maksimal 70 % ± 5 %, dikondisikan selama 24 jam.
d. Ruang D.
Merupakan ruang penyimpanan bahan baku, terutama bahan aktif. Suhu ruangan maksimal 25 ºC dan kelembaban maksimal 70 % ± 5 %, dikondisikan selama 24 jam. Ruangan ini dibagi 4 bagian, yaitu :
• Untuk bahan aktif produk lisensi. • Untuk bahan baku non lisensi.
• Bagian ruang bersuhu kurang dari 8-15 ºC ( cool storage ). Untuk penyimpanan bahan aktif seperti dopamine HCL, ekstra kental saga, ekstra pekat sirih, dll.
• Untuk penyimpanan bahan baku yang masih dalam status KIP jika memang perlu kondisi penyimpanan khusus, bagian ini di batasi dengan garis kuning pada lantai. Untuk produksi yang reject di dalam area di batasi garis merah.
Sistem penyimpanan yang digunakan dalam rak bawah merupakan bahan – bahan yang sering di pakai, dan rak atas merupakan bahan – bahan yang jarang di pakai, bahan dalam wadah ukuran kecil disimpan dalam lemari. Pengontrolan
suhu dan kelembaban gudang dilakukan 2x sehari, yaitu pada pukul 09.00 pagi dan 14.00 siang. Pemeriksaan kebersihan gudang dilakukan 1x seminggu, seperti, ventilasi, atap, lantai dan dinding, serta melindungi bahan dari gangguan binatang, di lakukan pest control setiap 2 minggu sekali oleh pihak ketiga. Untuk barang – barang yang mudah terbakar seperti aseton dan alcohol disimpan dalam gudang terpisah dengan gudang terpisah dengan gudang lain “gudang api“.
c. Pengeluaran
Pengeluaran bahan baku dari penyimpanan melalui penimbangan sentral ( PS ) berdasarkan pada SPK dari PPPI kepada bagian produksi. Selanjutnya bagian PS akan mengeluarkan BPBB ke bagian penyimpanan. Bagian penyimpanan akan mengeluarkan barang sesuai dengan permintaan tersebut. System pengeluaran di bagian penyimpanan menggunakan system FIFO ( First in First out ) dengan melihat nomor hasil pemeriksaan laboratorium dan system FEFO ( First expire First out ) untuk barang yang kadaluarsanya sangat pendek. Pengeluaran bahan pengemas dari gudang kemasan berdasarkan BPBP ( Bon Permintaan Bahan Pengemasan ) yang diserahkan oleh bagian produksi yang membutuhkan.
Bagian penyimpanan berkoordinasi dengan bagian PPPI, setiap akhir bulan dilakukan stock opname barang yang dapat di lihat dari kartu stok bagian penyimpanan. Jika terjadi kekeliruan karena penulisan atau kesalahan apapun, maka harus dibuat berita acara.
d. Penimbangan Sentral.
Penimbangan sentral dipimpin oleh Supervisor Penimbangan Sentral (PS). Setelah SPK di keluarkan oleh PPPI kepada bagian produksi, maka bagian produksi akan meminta bahan baku yang dibutuhkan kepada PS dengan
menyerahkan rencana produksi dan bahan baku, Catatan Pengolahan Batch ( CPB ) dan bon permintaan bahan baku ( BPBB ). Kemudian PS akan mengeluarkan bon permintaan bahan baku intern ( BPBI ) pada gudang bahan baku. Bila persediaan barang yang akan digunakan tidak tersedia atau tidak cukup maka gudang bahan baku akan mengeluarkan barang permintaan.
PS memiliki 4 ruang penimbangan yaitu ruang 1, 2, 3 dan 4. ruang 1 digunakan untuk penimbangan zat aktif golongan narkotika. Ruang 4 digunakan untuk penimbangan cairan dan gula dalam jumlah yang besar. Ruang 2 dan 3 digunakan untuk menimbang bahan baku lainnya.
3.3. Bagian Produksi
Bagian produksi PT. Kimia Farma ( Persero ) Tbk. Plant Jakarta dipimpin oleh seorang Manager yang membawahi 5 ( Lima ) bagian yang masing – masing dipimpin oleh seorang Asisten Manager yaitu Bagian Formulasi I, Formulasi II, Formulasi III, Beta laktam dan Bagian Pengemasan.
1. Bagian Formulasi I dan Narkotika.
Bagian formulasi I dipimpin oleh seorang Asisten Manager yang
membawahi 3 Supervisor yaitu Supervisor Granulagsi,Pencetakan dan Penyalutan. Alur proses produksi diawali dari bagian PPPI mengeluarkan SPK (Surat Perintah Kerja) kepada Bagian Formulasi I untuk melakukan produksi kemudian Bagian Formulasi I akan meminta bahan baku ke Penimbangan Sentral dengan menyertakan rencana produksi dan penimbangan bahan baku,Catatan Pengolahan Batch (CPB) yang dilampirkan dengan Berita Acara Produksi (BAP), Man Hour dan Machine Hour dan Bon Penyerahan Bahan Baku ( BPBB ). Bahan
baku yang telah diterima dari Penimbangan Sentral akan dilanjutkan dengan proses pencampuran.
Proses pembuatan tablet meliputi penimbangan bahan baku, pencampuran dan pencetakan. Metode pembuatan tablet ada 3 macam yaitu granulasi basah, granulasi kering dan kempa langsung. Pemilihan metode tergantung dari sifat zat aktif yang akan dibuat tablet.
a. Granulasi Basah
Proses ini diawali dengan pembuatan larutan pengikat terlebih dahulu. Bahan aktif, bahan pengisi dan bahan penghancur dicampur sampai homogen, kemudian ditambahkan larutan pengikat dalam super mixer Diosna. Masa yang didapat dilakukan pengayakan basah kemudian dikeringkan dalam ruang pengering ( dehumidifier ) kurang lebih satu malam granul yang telah kering tersebut dilakukan pengayakan kering, kemudian dilakukan final mixing dengan menambahkan bahan pelicin didalam V-mixer selama 5 menit. Massa yang dihasilkan kemudian dikirim ke KIP untuk diperiksa LOD nya ( bon I ), apabila memenuhi syarat, bagian KIP akan menyerahkan Bon II, kemudian massa dicetak dan dilakukan pemeriksaan meliputi bobot tablet setiap 30 menit. Setelah proses pencetakan selesai kemudian produk dikirim ke KIP sebagai produk ruahan disertakan Bon III dan akan diperiksa meliputi bobot tablet, diameter tablet, waktu hancur, kekerasan dan uji disolusi. Apabila lulus maka produk diserahkan kebagian pengemasan di sertakan Bon IV dan siap untuk dikemas.
b. Granulasi Kering.
Proses granulasi kering dilakukan dengan mengayak semua bahan kemudian dilakukan pencampuran dengan alat V-mixer, setelah itu dilakukan
slugging dengan mesin roller compactor kemudian slug dihancurkan dan diayak menjadi granul. Ukuran granul sesuai dengan ukuran mesh pada mesin pengayak. Granul yang dihasilkan ditambahkan dengan fase luar dan dicampur dalam V-mixer selama lima menit. Massa yang telah terbentuk dikirim ke KIP untuk dilakukan pemeriksaan LOD granul, apabila diluluskan dilanjutkan ke proses pencetakan. Produk yang telah dicetak dikirim lagi ke KIP untuk diperiksa meliputi bobot tablet, diameter tablet, waktu hancur, kekerasan dan uji disolusi. Apabila lulus maka produk diserahkan kebagian pengemasan untuk dikemas.
c. Cetak Langsung.
Proses pembuatan tablet dengan metode cetak langsung diawali dengan proses pencampuran semua bahan pembantu, kemudian ditambahkan bahan aktif dan dilakukan pencampuaran dengan V-mixer. Massa yang dihasilkan dikirim ke KIP untuk diperiksa besarnya LOD di Laboratorium, setelah dinyatakan lulus kemudian dilakukan pencetakan. Produk ruahan hasil pencetakan dikirim lagi ke KIP untuk diperiksa meliputi bobot tablet, diameter tablet, waktu hancur, kekerasan dan uji disolusi. Apabila lulus maka produk diserahkan kebagian pengemasan untuk dikemas. Pada beberapa sediaan tablet dilakukan proses penyalutan. Tablet salut yang diproduksi oleh PT. Kimia Farma (Pesero) Tbk. Plant Jakarta ada 2 jenis yaitu: Tablet salut gula dan tablet selaput film. Keutungan dari tablet salut antara lain:
a. Memperbaiki mutu estetika produk b. Menutup rasa dan bau yang tidak enak.
c. Memungkinkan produk yang lebih mudah ditelan oleh penderita d. Melindungi obat dan in aktivitas atau kerusakan oleh asam lambung.
e. Memudahkan penanganan terutama pada pengemasan. f. Meningkatkan stabilitas produk.
g. Memodifikasi pelepasan zat aktif.
Macam – macam tablet salut antara lain : a. tablet salut gula.
Proses pembuatan tablet salut gula adalah tablet yang akan disalut dilakukan proteksi ( Protecting ) dengan melakukan larutan shellac atau polimer organik, hal ini bertujuan untuk melindungi tablet inti terhadap pengaruh bahan penyalut yang digunakan dalam penyalutan.
Tablet yang telah diproteksi kemudian diberi bentuk dan penambahan bobot dengan proses sub coating yaitu melapisi tablet yang akan disalut untuk mencegah masuknya air kedalam inti tablet, kemudian dikeringkan selama semalam. Coating merupakan pelapisan yang dilakukan setelah inti tablet tertutup sampai tablet inti tidak tampak lagi, setelah proses ini juga dilakukan pengeringan selama semalam. Setelah tablet selesai di Coating, proses selanjutnya adalah
smoothing untuk membersihkan sisa Coating yang menempel pada tablet. Setelah
smoothing selesai maka dilakukan pemberian warna (Coloring) yang juga merupakan salah satu identitas tablet tersebut, setelah pewarnaan selesai dan sempurna langkah selanjutnya adalah polishing.
b. Salut Selaput Film
Proses yang dilakukan dalam proses penyalutan film adalah tahap pertama pelarutan bahan salut film kemudian dimasukkan kedalam alat penyemprot Accelacota. Penyalutan dilakukan terhadap tablet yang bergerak
berputar, sampai semua bahan penyalut habis. Seleksi juga dilakukan pada tablet selaput namun tidak ada proses printing.
Selanjutnya ruahan tersebut dikirim keKIP, kemudian disampling oleh IPC untuk dilakukan pemeriksaan oleh Laboratorium Pengujian. Bila hasilnya diluluskan dapat dilanjutkan untuk dikemas.
d. Narkotika
PT. Kimia Farma ( Persero ) Tbk. Plant Jakarta diberi hak khusus untuk memproduksi obat-obatan narkotika dan psikotropika. Berdasarkan Kep Men kes RI No. HK 00.65.6.01986 tanggal 26 juni 1994 tentang penunjukan PT. Kimia Farma ( Persero) Tbk. Sebagai perusahaan yang diberi izin untuk melaksanakan produksi dan distribusi narkotika di Indonesia. Kep Men Kes RI No. 199/Men Kes/SK/III/1996 tentang penunjukkan PBF PT. Kimia Farma (Persero) Tbk. Depot sentral sebagai importir tunggal narkotika di Indonesia. Dalam pelaksanaannya, pemesanan narkotika dengan tujuan pendistribusian ke apotek-apotek seluruh Indonesia hanya bisa lewat PBF PT.Kimia Farma ( Persero ) Tbk. Jakarta.
Berbeda sedikit dengan alur proses produksi lainnya, untuk obat golongan narkotika terdapat perlakukan khusus. Mulai dari pembelian bahan baku oleh bagian impor harus mendapatka izin dari BPOM mengenai jumlah dan jenisnya berdasarkan kuota tiap tahun untuk Indonesia.
Tugas penanggung jawaban narkotika adalah menerima dan menyimpan bahan baku narkotika dalam gudang tersendiri kemudian dilakukan pemeriksaan, jika lulus bahan baku siap dipakai. Bagian produksi akan menyerahkan BPBB dan CPB kePenimbangan Sentral jika SPK telah dikeluarkan oleh PPPI. Proses
selanjutnya sama dengan produk lainnya dan pada setiap tahap produksi dibuatkan berita acara yang dilaporkan ke Badan Pengawasan Obat dan Makanan (BPOM). Pengiriman produk jadi ke Unit Logistik Sentral dilakukan oleh Penanggung Jawab Narkotika dan atau Asisten Apoteker Penanggung Jawab Gudang Narkotik.
Bagian Pengemasan memilki tempat khusus yang digunakan untuk pengemasan produk narkotika. Gudang narkotika maupun ruangan karantina dipisahkan dengan gudang lain dengan perlindungan khusus seperti tertutup rapat tanpa jendela, atap bertralis dan memilki dua lapis pintu besi dengan kunci yang berbeda.
2. Bagian Formulasi II
Bagian Formulasi II dipimpin oleh Asisten Manajer dan membawahi beberapa Supervisor yaitu Supervisor Cairan, Supervisor Krim.
a. Produksi Cairan
Alur produksi cairan dimulai dari diturunkannya SPK oleh PPPI kepada Bagian Formulasi II. Selanjutnya Bagian Formulasi II akan menyerahkan CPB (Catatan Pengolahan Batch) dan BPBB kepada Penimbangan Sentral. Bahan baku yang telah ditimbang dilarutkan dan dicampur dalam suatu tangki, setelah homogen cairan dimasukkan dalam Colloid Mill untuk menghaluskan partikel-partikel. Campuran yang dihasilkan disaring dengan saringan yang berukuran 200 mesh. Untuk cairan dalam bentuk suspensi, proses selanjutnya adalah pencampuran dengan suspending agent CMC Na. Massa yang terbentuk dikirim ke ruang karantina dan melewati proses pemeriksaan pH, viskositas dan kadar zat aktif oleh Laboratorium Pengujian. Setelah laboratorium menyatakan lulus
(ditandai dengan menempelkan label berwarna hijau), bagian formulasi II akan mengajukan BPBK (Bon Permintaan Bahan Kemas) untuk dilakukannya pengemasan primer atau sering disebut juga pengisian massa dalam botol. Massa yang telah dimasukkan kedalam botol, kemudian dikirim keruang karantina sebagai produk ruahan. Setelah Laboratorium Pengujian menyatakan lulus, produk tersebut dikirim kebagian pengemasan untuk segera dikemas.
b. Produksi Krim
Alur produksi cairan dimulai dari diturunkannya SPK oleh PPIC kepada Bagian Formulasi II. Selanjutnya Bagian Formulasi II akan menyerahkan CPB dan BPBB kepada Penimbangan Sentral.
Proses produksi dimulai dengan pembuatan basis krim dengan cara melarutkan fase air dan fase minyak sebagai bahan dasar. Pembuatan basis krim dilakukan dengan peleburan untuk fase minyak dan pelarutan untuk fase cair (dengan menggunakan heating tank), kemudian masing-masing fase disaring dengan nilon berukuran 200 mesh. Selanjutnya fase air dicampur dengan fase minyak dalam Planetary Mixer Miralles, sampai homogen. Campuran yang dihasilkan didinginkan sampai suhunya 30-35º C dan dilakukan penimbangan. Selanjutnya dilakukan pencampuran basis krim dengan bahan aktif, untuk membentuk massa krim. Massa krim yang diperoleh ditimbang dan dikirim ke ruang karantina. Selanjutnya Laboratorium Pengujian akan melakukan pemeriksaan homogenitas, pH, viskositas dan kadar zat aktif. Setelah Laboratorium menyatakan lulus, Bagian Formulasi II akan mengajukan BPBK untuk melakukan pengemasan primer terhadap massa krim tersebut. Massa krim yang telah dimasukkan dalam tube dikirim ke ruang karantina sebagai produk
ruahan, dan mengalami pemeriksaan oleh Laboratorium Pengujian untuk selanjutnya dikirim kebagian pengemasan.
c. Pengolahan Air Produksi
Bagian Formulasi II juga bertanggung jawab terhadap proses pengolahan air yang digunakan untuk produksi Bagian Formulasi I, Formulasi II dan Formulasi III. Air yang dihasilkan digunakan untuk pembuatan sediaan cair, sediaan injeksi, sediaan tablet dan pencucian wadah seperti botol, tutup botol dan ampul.
Proses pengolahan dimulai dari air yang berasal dari PAM yang dilewatkan ke dalam karbon filter sebanyak 2 kali. Kemudian pompa akan mendistribusikan cairan ke filter yang berlapis-lapis mulai ukuran 30 µm, 10 µm dan 5 µm. Selanjutnya hasil penyaringan dimasukkan ke dalam membran Reverse
Osmose System (RO). Sistem tersebut akan mendistribusikan air kedalam empat
bagian antara lain :
1. Bagian pertama, air akan masuk kedalam tangki-tangki penampungan yang
berkapasitas 5000 L, ait tersebut akan digunakan untuk pembuatan sediaan krim dan mencuci botol.
2. Bagian kedua, air akan disaring dengan filter yang berukuran 1,5 µm dan
0,45 µm yang kemudian digunakan untuk mencuci ampul.
3. Bagian ketiga, air akan disaring dalam filter yang berukuran 1 µm dan 0,2
µm yang kemudian digunakan untuk pembuatan sediaan cairan tablet.
4. Bagian keempat, air akan dialirkan ke tangki unit destilasi kemudian
dicatridge filter 2,5 µm dan 0,2 µm untuk proses pembuatan sediaan injeksi pada Formulasi III.
3. Bagian Formulasi III
Bagian Formulasi III dipimpin oleh seorang Asisten Manajer yang membawahi Supervisor Injeksi, Supervisor Sirup Kering dan Supervisor Kapsul. Bagian ini memproduksi injeksi, sirup kering dan kapsul.
a. Pembuatan Injeksi.
Bagian PPPI mengeluarkan SPK kepada Bagian Formulasi II untuk melakukan produksi. Bagian formulasi II menyerahkan Catatan Pengolahan Batch dan Bon Permintaan Bahan Baku kepada Penimbangan Sentral, setelah bahan baku diterima dari Penimbangan Sentral kemudian dilakukan proses pelarutan. Setelah dilakukan pelarutan kemudian ditambahkan aqua pro injeksi sampai volume tertentu dan dilakukan pengukuran pH massa injeksi kemudian massa dikirim ke KIP untuk dilakukan pemeriksaan meliputi bentuk, warna, pH dan kejernihan larutan, apabila diluluskan kemudian dilakukan penyaringan dengan filter ukuran 1,2 µ dan 0,45 µ kemudian dilakukan proses pengisian didalam ampul. Ampul dicuci dengan air Reverse Osmosis Sistem yang telah disaring menggunakan filter berukuran 1,5 µ dan 0,45 µ dan dikeringkan menggunakan
Hot Air Sterilizer pada suhu 170 ºC selama 1 jam, kemudian dilanjutkan proses
pengisian. Ampul yang telah diisi disterilkan dalam double door autoclave pada suhu 110 ºC selama 30 menit, kemudian dilakukan tes kebocoran menggunakan otoklaf selama 30 menit, dilanjutkan proses seleksi secara visual untuk memeriksa adanya partikel asing dengan menggunakan bantuan lampu TL. Produk yang diluluskan masuk ke Karantina In Proses sebagai produk ruahan, jika hasil telah memenuhi persyaratan dilanjutkan proses pengemasan.
Proses sediaan injeksi dilakukan dalam ruangan steril yang berkaca tembus pandang untuk memudahkan pengawasan dari luar ruangan. Tekanan udara di dalam ruangan steril lebih tinggi dari pada di koridor untuk menghindari kontaminasi/pencemaran yang masuk ke ruang produksi. Pegawai yang masuk ke ruang steril harus melewati tiga pintu dan jumlah orang yang berada di ruang steril terbatas untuk empat orang, hal ini dilakukan untuk menghindari pencemaran ruangan. Pemeriksaan ruang steril dilakukan setiap satu bulan oleh bagian pengujian.
Upaya pemeliharaan ruang steril dilakukan setiap hari dengan membersihkan semua ruang steril dengan alkohol, apabila pada saat proses pemeriksaan ruangan tidak memenuhi syarat maka dilakuakan fumigasi dengan sublimasi paraformaldehid didiamkan selama 24 jam, kemudian asap dikeluarkan dan untuk membersihkan sisa paraformaldehid digunakan amoniak 5% dan dilakukan pembersihan dengan aqua pro injeksi kemudian dilap dengan alkohol 70%.
b. Produksi kapsul
Bagian PPPI mengeluarkan SPK kepada Bagian Formulasi III untuk melakukan produksi. Bagian Formulasi III menyerahkan Catatan Pengolahan Batch dan Bon Permintaan Bahan Baku kepada Penimbangan Sentral, setelah bahan baku diterima dari penimbangan sentral kemudian dilakukan proses pencampuran, sebelum dicampur dilakukan proses pengayakan terlebih dahulu dengan Vibrating sieve mesh 35. Zat aktif dan zat tambahan dimasukkan ke dalam alat pencampur V-mixer selama 15 menit, kemudian ditambahkan fase luar dan dilakukan pencampuran kembali dengan V-mixer selama 5 menit. Massa kapsul
dikirim ke Karantina In Proses untuk dilakukan pemeriksaan LOD, jika dinyatakan memenuhi syarat dilanjutkan proses pengisian kapsul dengan mesin
Macofar atau MG 2. Setelah selesai pengisian produk, dilakukan proses polishing
dan seleksi kapsul kemudian dikirim ke Karantina In Proses untuk dilakukan pemeriksaan, jika diluluskan dilanjutkan ke proses pengemasan.
c. Pembuatan Sirup Kering
Bahan baku yang diterima dari Penimbangan Sentral diperiksa kesesuaiannya dengan CPB (Catatan Pengolahan Batch) dan BAP (Berita Acara Produksi) jika sesuai bahan dicampur dalam mortir porselin sampai homogen, dilakukan pengayakan dengan mesh 30 dilanjutkan pencampuran lagi dengan
intensive mixer, selanjutnya pencampuran akhir dengan V-mixer, kemudian massa
dikirim ke Karantina In Proses setelah dinyatakan lulus kemudian dilakukan pengisian kedalam botol yang telah dicuci dan dikeringkan dilemari pengering.
Selama proses dilakukan pemeriksaan keseragaman bobot dan kekerasan perekatan tutup botol dengan alat Torque meter setiap 30 menit yang bertujuan untuk mencetak kestabilan mesin. Produk yang telah selesai pengisian dikirim kembali ke Karantina In Proses untuk dilakukan pemeriksaan dan setelah dinyatakan memenuhi syarat, dilanjutkan ke proses pengemasan.
4. Bagian Pengemasan
Bagian pengemasan dipimpin oleh Asisten Manajer dan dibawahi oleh 6 supervisor yaitu Supervisor Karantina In Proses, Supervisor Pengemasan Primer I (solid), Supervisor Pengemasan Primer II (semi solid/cairan), Supervisor Penandaan, Supervisor Pengemasan Sekunder I (solid), Supervisor Pengemasan Sekunder II (semi solid dan cairan). Bagian pengemasan pengemasan akan mulai