Standarisasi dapat dilakukan dengan titrasi.Titrasi merupakan proses penentuan konsentrasi suatu larutan dengan mereaksikan larutan yang
sudah ditentukan konsentrasinya (larutan standar).
Titrasi asam basa adalah suatu titrasi dengan menggunakan reaksi asam basa
(reaksi penetralan).Pada saat terjadi perubahan warna-warna indikator, titrasi dihentikan. Indikator berubah warna pada saat titik ekuivalen.
Pada titrasi asam basa,
dikenal istilah titik ekuivalen dan titik akhir titrasi. Titik ekuivalen adalah titik pada proses titrasi ketika asam dan basatepat habis bereaksi.
Untuk mengetahui titik ekuivalen digunakan digunakan indikator. Saat perubahan warna terja di, saat itu disebut titik akhir titrasi (Sukmariah, 1990).
Proses
penentuan konsentrasi suatu larutan dipastikan dengan tepat dikenal sebagai standarisasi. Asidi dan alkalimetri termasuk reaksi netralisasiyakni reaksi antara ion indikator yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral.Netralisasi dapat juga dikatakan sebagai reaksi antara pemberi proton (asam) dengan penerima proton (basa) (Shochichah,2010).
Asidimetri adalah pengukuran konsentrasi asam dengan menggunakan larutan baku b asa,
sedangkan alkalimeteri adalah pengukuran konsentrasibasa dengan menggunakan larutan bak u asam. Oleh sebab itu, keduanya disebut juga sebagai titrasi asam-basa. Titrasi adalah proses
mengukur volume larutan yang terdapat dalam buret yang
ditambahkan kedalam larutan lain yang
diketahui volumenya sampai terjadi reaksi sempurna. Atau denganperkataan lain untuk meng ukur volume titran yang diperlukan untuk mencapai titik ekivalen.
Titik ekivalen adalah saat yang menunjukkan bahwa ekivalen perekasi-pereaksi sama.
Di dalam prakteknya titik ekivalen sukar diamati,
karenahanya meruapakan titik akhir teoritis atau titik akhir stoikometri. Hal ini diatasi dengan pemberian indikator asam - basa yang membantu sehingga titik akhir titrasi dapat diketahui. Titik akhir titrasi meruapakan keadaan di mana penambahan satu tetes zat penitrasi (titran) akan menyebabkan perubahan warna indikator (Anonim,2009).
Titrasi indic-alkalimetri menyangkut reaksi dengan asam kuat – basa kuat, asam kuat – basa lemah, asam lemah – basa kuat, asam kuat – garam dari asam lemah, basa kuat – garam dari basa lemah.Titrasi ini menggunakan indikator Phataundicatorasam-basa sebagai penanda karena memiliki sifat dapat berubah warna apabila Phlingkungannya berubah. Warna asam ialah sebutan warna indikator ketika dalam keadaan asam dan warna basa ketika dalam keadaan basa (Harjadi,1986).
Titrasi kompleksometri yaitu titrasi berdasarkan pembentukan persenyawaan kompleks (ion kompleks atau garam yang sukar mengion). Kompleksometri adalah jenis titrasi dimana titran dan titrat saling mengkompleks. Jadi membentuk hasil berupa kompleks. Senyawa kompleks adalah suatu satuan baru yang terbentuk dari satuan-satuan yang dapat berdiri tetapi membentuk suatu ikatan baru dalam kompleks itu (Khopkar, 2002).
Titrasi kompleksometri juga dikenal sebagai reaksi yang meliputi reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan. Persyaratan mendasar terbentuknya kompleks demikian adalah tingkat kelarutan tinggi. Selain titrasi komplek biasa seperti di atas, dikenal pula kompleksometri yang dikenal sebagai titrasi kelatometri, seperti yang menyangkut penggunaan EDTA (Khopkar, 2002).
Analisis kimia yang diketahui terhadap sampel yaitu analisis kualitatif dan analisis kuantitatif. Analisis kuantitatif yang paling sering diterapkan yaitu analisis titrimetri. Analisis titrimetri dilakukan dengan menitrasi suatu sampel tertentu dengan larutan standar, yaitu larutan yang sudah diketahui konsentrasinya. Perhitungan didasarkan pada volume titran yang diperlukan hingga tercapai titik ekuivalen titrasi. Analisis titrimetri yang didasarkan pada terjadinya reaksi asam dan basa antara sampel dengan larutan standar disebut analisis asidi – alkalimetri. Apabila larutan yang bersifat asam maka analisis yang dilakukan adalah analisis asidimetri. Sebaliknya jika digunakan suatu basa sebagai larutan standar, analisis tersebut disebut sebagai analisis alkalimetri. (Keenan, 1991)
Standarisasi dapat dilakukan dengan titrasi. Titrasi merupakan proses penentuan konsentrasi suatu larutan dengan mereaksikan larutan yang sudah ditentukan konsentrasinya ( larutan standar). (Syukri, 1999)
Proses penentuan konsentrasi suatu larutan dipastikan dengan tepat dikenal sebagai standarisasi. Suatu larutan standar dapat disiapkan dengan menggunakan suatu sampel zat terlarut yang diinginkan, yang ditimbang dengan tepat dalam volume larutan yang diukur dengan tepat. Zat yang memadai dalam hal ini disebut standar primer. (Day, 1998)
Suatu zat standar primer harus memenuhi persyaratan berikut : 1. Zat harus mudah diperoleh, mudah dimurnikan, mudah dikeringkan,
2. Zat harus tak berubah dalam udara selama penimbangan, kondisi-kondisi ini mengisyaratkan bahwa zat tak boleh higroskopis, tak pula dioksidasi oleh udara atau dipengaruhi karbon dioksida.
3. Zat harus dapat diuji terhadap zat-zat pengotor dengan uij-uji kuantitatif atau uji-uji lain yang kepekaannya diketahui.
4. Zat harus mempunyai ekuivalen yang tinggi, sehingga sesatan penimbangan dapat diabaikan.
5. Zat harus mudah larut pada kondisi-kondisi dalam mana ia digunakan. 6. Reaksi dengan larutan standar harus stokiometri dan praktis. Zat-zat yang biasa dipakai sebagai standar primer adalah reaksi asam basa natrium karbonat, natrium tetraborat, KH(C8H4O4), asam klorida bertitik didih konstan, dan asam benzoat.
Dalam analisis larutan asam dan basa, titrasi akan melibatkan pengukuran yang seksama volume – volumenya suatu asam dan suatu basa yang tepat akan saling menetralkan. Reaksi penentralan atau asidimetri dan alkalimetri adalah salah satu dari empat golongan utama dalam penggolongan reaksi alam analisis titrimetri. Asidi – alkalimetri ini melibatkan titrasi basa bebas atau basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah, dengan suatu standar (asidimetri) dan teori asam bebas yang terbentuk dari hidrolisis garam yang berasal dari basa lemah, dengan suatu basa standar (alkalimetri). Reaksi – reaksi ini melibatkan bersenyawaannya ion hidrogen dan ion hidroksida untuk membentuk air. (Bassett, 1994)
Tidak semua reaksi dapat digunakan sebagai reaksi titrasi. Untuk itu reaksi harus memenuhi syarat-syarat berikut :
1. Berlangsung sempurna, tunggal dan menurut persamaan yang jelas (dasar teoritis).
2. Cepat dan reversibel. Bila tidak cepat, titrasi akan memakan waktu terlalu banyak.
3. Ada penunjuk akhir titrasi (indikator).
4. Larutan baku yang direaksikan dengan analay harus mudah didapat dan sederhana menggunakannya, juga harus stabil sehingga konsentrasinya tidak mudah berubah saat disimpan.
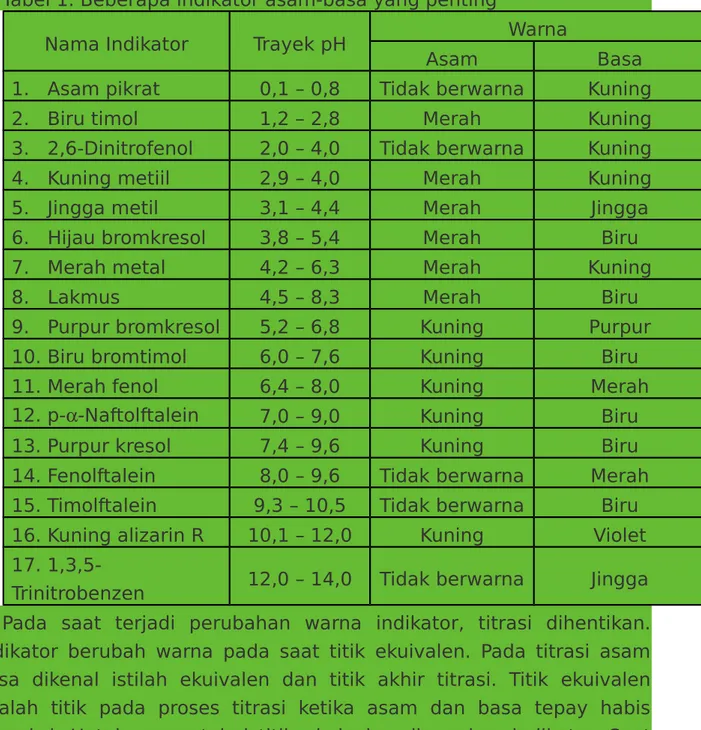
Indikator asam-basa ialah zat yang dapat berubah warna apabila pH lingkungannya berubah. Setiap indikator asam-basa mempunyai trayeknya sendiri, demikian pula warna asam dan warna basanya. Diantara indikator ada yang mempunyai satu macam warna, misalnya
fenolftalein yang berwarna merah dalam keadaan basa tetapi tidak berwarna bila keadaannya asam. Indikator satu warna menunjukkan warna yang sama, juga dalam trayeknya, akan tetapi intensitas warna tersebut berbeda sesuai dengan pHnya. Untuk fenolftalein, warnanya tampak semakin tua bila pH semakin tinggi (mendekati 9,6) dan makin muda bila semakin kecil (mendekati 8,0). Letak trayek fenolftalein diantara 8,0 sampai 9,6 sehingga pada pH dibawah 8,0 larutan tak berwarna dan diatas 9,6 warna merah tidak berubah intensitasnya. (Harjadi, 1990)
Tabel 1. Beberapa indikator asam-basa yang penting
Nama Indikator Trayek pH Warna
Asam Basa
1. Asam pikrat 0,1 – 0,8 Tidak berwarna Kuning
2. Biru timol 1,2 – 2,8 Merah Kuning
3. 2,6-Dinitrofenol 2,0 – 4,0 Tidak berwarna Kuning
4. Kuning metiil 2,9 – 4,0 Merah Kuning
5. Jingga metil 3,1 – 4,4 Merah Jingga
6. Hijau bromkresol 3,8 – 5,4 Merah Biru
7. Merah metal 4,2 – 6,3 Merah Kuning
8. Lakmus 4,5 – 8,3 Merah Biru
9. Purpur bromkresol 5,2 – 6,8 Kuning Purpur
10. Biru bromtimol 6,0 – 7,6 Kuning Biru
11. Merah fenol 6,4 – 8,0 Kuning Merah
12. p--Naftolftalein 7,0 – 9,0 Kuning Biru
13. Purpur kresol 7,4 – 9,6 Kuning Biru
14. Fenolftalein 8,0 – 9,6 Tidak berwarna Merah
15. Timolftalein 9,3 – 10,5 Tidak berwarna Biru
16. Kuning alizarin R 10,1 – 12,0 Kuning Violet
17.
1,3,5-Trinitrobenzen 12,0 – 14,0 Tidak berwarna Jingga
Pada saat terjadi perubahan warna indikator, titrasi dihentikan. Indikator berubah warna pada saat titik ekuivalen. Pada titrasi asam basa dikenal istilah ekuivalen dan titik akhir titrasi. Titik ekuivalen adalah titik pada proses titrasi ketika asam dan basa tepay habis bereaksi. Untuk mengetahui titik ekuivalen digunakan indikator. Saat
perubahan warna terjadi, saat itu disebut titik akhir titrasi. (Sukmariah, 1990)
DAFTAR PUSTAKA
Bassett, J. et al. 1994. Buku Ajar Vogel : Kimia Analitik Kuantitatif Anorganik. Kedokteran. EGC. Jakarta.
Day, R.A. dan S. Keman. 1998. Kimia Analisa Kuantitatif. Erlangga. Jakarta. Harjadi, W. 1990. Ilmu Kimia Analitik Dasar. Gramedia. Jakarta.
Syukri. 1999. Kimia Dasar 2. Bandung. ITB.
Keenan, Charles W. et al. 1991. Ilmu Kimia Untuk Universitas. Erlangga. Jakarta.
Sukmariah. 1990. Kimia Kedokteran edisi dua. Binarupa Aksara. Jakarta. 2. Untuk menentukan konsentrasi larutan suatu asam maupun basa diperlukan
suatu larutan baku. Larutan baku yang dibuat dengan menimbang zatnya lalu malarutkan sampai volime tertentu, secara langsung konsentrasinya langsung diketahui. Larutan semacam ini disebut larutan baku primer. Contohny larutan asam oksalat, larutan baku ditentukan melalui tirasi dengan larutan baku primer dimasukkan larutan baku sekunder. Conthnya : NaOH yang konsentrasinya didapatkan dengan manitrasi larutan baku asam oksalat. Pasa analisis volemetri, volume pada jumlah reagen yang ditambahkan tepat sama dengan diperlukan untuk bereaksi sempurna oleh zat yang dianalisa disebut sebagai titik ekivalen.
Metode volumetri secara garis besar dapat diklasifikasikan dalam empat kategori, yaitu :
1. Titrasi asam basa yang meliputi reaksi asam basa baik kuat maupun lemah. 2. Titrasi redoks adalah titrasi ang meliputi hampir semua reaksi ksidasi reduksi.
Sebagian basar titrasi init erliput leh dua kategri ini
3. Titrasi pengendapan adalah titrasi yang meliputi pembentukan endapan, seperti titrasi Ag dan Zn dengan K4Fe(ZN)6 dengan indikator pengadsorbsi.
4. Titrasi kompleksometri sebagian besar meliputi titrasi EDTA seperti titrasi spesifik dan juga dapat digunakan untuk melihat keadaan pH pada pengkompleksan. Dibawah ini adalah tabel titrasi asam basa :
1 2 3 4 5 6 Umum
Asam kuat basa kuat
Basa kuat asam lemah
Asam kuat basa lemah
Asam lemah basa lemah Asam lemah berbasa dua Ka > [ H+] KH > [OH-] [ HA] = [OH-] [ B ] = [ H+ ] [ B ] = [ HA ] [ HgA ]= [A-]
( Sumber: P.Lukum, Astin. 2008 . Bahan Ajar Dasar- Dasar Kimia Analitk. Gorontalo: UNG)
Titrasi asam basah merupakan teknik yang banyak dgunakan untuk menetapkan secara tetap konsentrasi asam atau basa dari suatu larutan. Titrasi ini pada dasarnya merupakan reaksi penetralan dan biasa juga disebut asidialkalimetri. Dalam titran asam basa perubahan ph sangat kecil sehingga hampir tercapai titik ekivalen. Perubahan ph yang besar dideteksi dengan zat yang dikenal sebagai indikator, yaitu suatu senyawa organik yang akan berubah warnanya dalam rentang ph tertentu. Tidak atau kondisi penambahan asam atau basa dimana terjadi perubahan indikator dalam suatu titrasi sebagai titik akhir titrasi.
(sumber :Sukarti, Tati. 2008. Kimia Analitik. Jatinangor : Widya Padjadjaran)
Kurva titrasi dengan cara memplot antara ph dengan volume asam atau basa yang ditambahkan. Ada dua jenis kurva titrasi yang biasanya digunakan untuk membuat kurva yaitu :
2. Titrasi asam lemah-basa kuat atau asam kuat basa lemah
Indikator asam basa adalah asam lemah atau basa lemah (senyawa organik) yang dalam larutannya warna molekul-molekulnya berbeda dengan warna lon-ionnya. Indikator yang digunakan harus memberikan perubahan warna yang nampak di sekitar titik ph ekuvalensi titrasi yang dilakukan, sehingga titik akhirnya masih jatuh pada trayek perubahan warna indikator itu.
(Sumber : Harjadi, W. 1986. Ilmu Kimia Analitik Dasar. Jakarta : Gramedia )
Titrasi merupakan suatu proses analisis dimana suatu volum larutan standar ditambahkan ke dalam larutan dengan tujuan mengetahui komponen yang tidak dikenal. Larutan standar adalah larutan yang konsentrasinya sudah diketahui secara pasti. Berdasarkan kemurniannya larutan standar dibedakan menjadi larutan standar primer dan larutan standar sekunder. Larutan standar primer adalah larutan standar yang dipersiapkan dengan menimbang dan melarutkan suatu zat tertentu dengan kemurnian tinggi (konsentrasi diketahui dari massa -volum larutan). Larutan standar sekunder adalah larutan standar yang dipersiapkan dengan menimbang dan melarutkan suatu zat tertentu dengan kemurnian relatif rendah sehingga konsentrasi diketahui dari hasil standardisasi (Day Underwood, 1999).
Salah satu cara dalam penentuan kadar larutan asam basa adalah dengan melalui proses titrasi asidi-alkalimetri. Cara ini cukup menguntungkan karena pelaksanaannya mudah dan cepat, ketelitian dan ketepatannya juga cukup tinggi.
Titrasi asidi-alkalimetri dibagi menjadi dua bagian yaitu asidimetri dan alkalimetri. Asidimetri adalah titrasi dengan menggunakan larutan standar asam untuk menentukan basa. Asam-asam yang biasanya dipergunakan adalah HCl, asam cuka, asam oksalat, asam borat. Sedangkan alkalimetri merupakan kebalikan dari asidimetri yaitu titrasi yang menggunakan larutan standar basa untuk menentukan asam.
Pada percobaan ini adalah penentuan kadar dengan metode asidi-alkalimetri menggunakan indikator phenopthalein dan metil jingga, hal ini dilakukan karena jika meggunakan indikator yang lain, adanya kemungkinan trayek pH-nya jauh dari titik ekivalen. Beberapa contoh larutan indikator antara lain adalah fenolptalin (pp) yang memberikan warna pink dalam lingkungan basa dan tidak berwarna dalam lingkungan asam, dan metil orange yang memberikan warna merah dalam lingkungan asam dan kuning dalam lingkungan basa. Perubahan warna indikator ini terjadi dalam rentangan pH tertentu yang disebut trayek pH. Sebagai contoh, indikator pp memiliki trayek pH : 8,0 – 9,6, dan indikator mo memiliki trayek pH : 3,1 – 4,4 (Rubinson, Judith F & Rubinson, Kenneth A, 1998:229)
Titrasi dilakukan dengan cara volume zat penitrasi (titran) yang digunakan untuk bereaksi dengan zat yang dititrasi (titrat). Jika konsentrasi salah satu diketahui, maka konsentrasi/kadar zat lain dapat dihitung. Dalam titrasi dikenal titik ekivalen dan titik akhir titrasi. Titik akhir titrasi adalah titik pada saat titrasi diakhiri/dihentikan. Dalam titrasi biasanya diambil sejumlah alikuot tertentu yaitu bagian dari keseluruhan larutan yang dititrasi
kemudian dilakukan proses pengenceran (W Haryadi, 1990). Pengenceran adalah proses penambahan pelarut yg tidak diikuti terjadinya reaksi kimia sehingga berlaku hukum kekekalan mol. Untuk mengetahui titik ekivalen secara eksperimen biasanya dibuat kurva titrasi yaitu kurva yang menyatakan hubungan antara –log [H+] atau –log [X-] atau –log [Ag+] atau E (volt) terhadap volum (W. Haryadi, 1990).
Indikator dalam asidi-alkalimetri menurut Oswaltd adalah asam organik lemah atau basa organik lemah yang warna molekulnya berbeda dengan warna ionnya.
Hind H+ + Ind
-Ind OH OH- + Ind
-Warna molekul warna ion
Setiap indikator asam basa mempunyai daerah trayek pH tertentu. Pemilihan indikator didasarkan pada pH larutan yang berada pada titik ekivalen. (Harjadi, 1986).
Tabel III.1 Indikator dengan trayek pH-nya
Indikator Perubahan warna Trayek pH
Timol biru Merah-kuning 1,2-2,8
Metil orange (MO) Merah-kuning 3,1-4,4
Metil merah (MM) Merah-kuning 4,2-6,2
Brotimol biru (BTB) Kuning-biru 6,0-7,6
Fenoftalein (PP) Tak berwarna-merah ungu 8,0-9,6 Sumber: David Harvey, (2000).
VIII. DAFTAR PUSTAKA
Day, Underwood. 1999. Kimia Analisis Kuantitatif. Jakarta: Erlangga. Haryadi, W. 1990. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia. --- 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Harvey, David. 2000. Modern Analytical Chemistry. Toronto: John Wiley & Sons.
Rubinson, Judith dan Kenneth A. 1998. Contemporary in Analytical Chemistry. Toronto: John Wiley & Sons.
Dalam analisis larutan asam dan basa, titrasi akan melibatkan pengukuran yang seksama volume-volumenya suatu asam dan suatu basa yang tepat akan saling menetra1kan (Keenan, 1994). Reaksi penetralan atau asidimetri dan alkalimetri adalah salah satu dari empat golongan utama dalam penggolongan reaksi dalam analisis titrimetri. Asidi alkalimetri ini melibatkan titrasi basa bebas atau basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah, dengan suatu standar (asidimetri) dan titrasi asam bebas yang terbentuk dari hidrolisis garam yang berasal dari basa lemah, dengan suatu basa standar (alkalimetri).
Reaksi-reaksi ini melibatkan senyawa ion hidrogen dan ion hidroksida untuk membentuk air. (Bassett, 1994). Analisis volumetri juga dikenal sebagai titrimetri, di mana zat dibiarkan bereaksi dengan zat yang lain yang konsentrasinya diketahui dan dialirkan dari buret dalam bentuk larutan.
Konsentrasi larutan yang tidak diketahui (analit) kemudian dihitung. Syaratnya adalah reaksi harus berlangsung secara cepat, reaksi berlangsung kuantitatif dan tidak ada reaksi samping. (Khopkar, 1990). Dalam menguji suatu reaksi untuk menetapkan apakah reaksi itu dapat digunakan untuk suatu titrasi, pembuatan suatu kurva titrasi akan membantu pemahaman untuk titrasi asam basa suatu kurva titrasi terdiri dari suatu alur pH atau pOH versus mL titran. Kurva semacam itu membantu dalam mempertimbangkan kelayakan suatu titrasi dan dalam memilih indikator yang tepat. (Day dan Underwood, 1999). Zat-zat anorganik dapat diklasifikasikan dalam tiga golongan penting : asam, basa dan garam. Asam didefinisikan sebagai zat yang bila dilarutkan dalam air, mengalami disosiasi dengan pembentukan ion hidrogen sebagai satu-satunya ion positif. Asam kuat berdisosiasi hampir sempurna dengan pengenceran yang sedang, karena itu ia merupakan elektrolit kuat. Asam lemah berdisosiasi hanya sedikit pada konsentrasi sedang bahkan pada konsentrasi rendah. (Svehla, 1990). Kuat relatif asam dan basa dalam larutan bergantung pada afinitas mereka terhadap proton yang berlainan. Makin kuat asam, makin lemah basa konjugatnya.
(Keenan, 1994). Dari kumpulan reaksi kimia yang dikenal relatif sedikit yang dapat digunakan sebagai dasar untuk titrasi, suatu reaksi memenuhi persyaratan berikut sebelum digunakan. 1. Reaksi harus berjalan sesuai dengan suatu
persamaan reaksi tertentu. Tidak boleh ada reaksi samping. 2. Reaksi harus berjalan sampai boleh dikatakan lengkap pada titik ekivalensi. Dengan kata lain, tetapan keseimbangan reaksi harus sangat besar. 3. Beberapa metode harus tersedia untuk menetapkan kapan titik ekivalensi tercapai. Suatu inidikator haruslah tersedia atau beberapa metode secara instrumen dapat digunakan untuk memberitahu analisis kapan penambahan titran dihentikan. 4. Reaksi berjalan cepat (dalam beberapa menit saja). (Day dan Underwood, 1999). Indikator asam basa adalah zat yang berubah warnanya atau membentuk
fluoresen atau kekeruhan pada suatu range (trayek) pH tertentu. Indikator asam basa terletak pada titik ekivalen dan ukuran dari pH. Zat-zat indikator dapat berupa asam atau basa, larut dan stabil serta akan menunjukkan perubahan warna yang kuat, biasanya merupakan zat organik (Khopkar, 1990).
Dalam analisis larutan asam dan basa, titrasi akan melibatkan pengukuran yang seksama volume-volumenya suatu asam dan suatu basa yang tepat akan saling menetra1kan. Reaksi penetralan atau asidimetri dan alkalimetri adalah salah satu dari empat golongan utama dalam penggolongan reaksi dalam analisis titrimetri. Asidi alkalimetri ini melibatkan titrasi basa bebas atau basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah, dengan suatu standar (asidimetri) dan titrasi asam bebas yang terbentuk dari hidrolisis garam yang berasal dari basa lemah, dengan suatu basa standar (alkali metri). Reaksi-reaksi ini melibatkan senyawa ion hidrogen dan ion hidroksida untuk membentuk air (Bassett, 1994).
Analisis volumetri juga dikenal sebagai titrimetri, di mana zat dibiarkan bereaksi dengan zat yang lain yang konsentrasinya diketahui dan dialirkan dari buret dalam bentuk larutan. Konsentrasi larutan yang tidak diketahui (analit) kemudian dihitung. Syaratnya adalah reaksi harus berlangsung secara cepat, reaksi berlangsung kuantitatif dan tidak ada reaksi samping (Khopkar, 1990).
Dalam menguji suatu reaksi untuk menetapkan apakah reaksi itu dapat digunakan untuk suatu titrasi, pembuatan suatu kurva titrasi akan membantu pemahaman untuk titrasi asam basa suatu kurva titrasi terdiri dari suatu alur pH atau pOH versus ml titran. Kurva semacam itu membantu dalam
mempertimbangkan kelayakan suatu titrasi dan dalam memilih indikator yang tepat (Underwood, 1999).
Zat-zat anorganik dapat diklasifikasikan dalam tiga golongan penting : asam, basa dan garam. Asam didefinisikan sebagai zat yang bila dilarutkan dalam air, mengalami disosiasi dengan pembentukan ion hidrogen sebagai satu-satunya ion positif. Asam kuat berdisosiasi hampir sempurna dengan pengenceran yang sedang, karena itu ia merupakan elektrolit kuat. Asam lemah berdisosiasi hanya sedikit pada konsentrasi sedang bahkan pada konsentrasi rendah (Svehla, 1990).
Kuat relatif asam dan basa dalam larutan bergantung pada afinitas mereka terhadap proton yang berlainan. Makin kuat asam, makin lemah basa konjugatnya. Dari kumpulan reaksi kimia yang dikenal relatif sedikit yang dapat digunakan sebagai dasar untuk titrasi, suatu reaksi memenuhi persyaratan berikut sebelum digunakan.
1. Reaksi harus berjalan sesuai dengan suatu persamaan reaksi tertentu. Tidak boleh ada reaksi samping.
2. Reaksi harus berjalan sampai boleh dikatakan lengkap pada titik ekivalensi. Dengan kata lain, tetapan keseimbangan reaksi harus sangat besar.
3. Beberapa metode harus tersedia untuk menetapkan kapan titik ekivalensi tercapai. Suatu inidikator haruslah tersedia atau beberapa metode secara instrumen dapat digunakan untuk memberitahu analisis kapan penambahan titran dihentikan.
4. Reaksi berjalan cepat (dalam beberapa menit saja) (Day dan Underwood, 1999).
Untuk indikator asam-basa biasanya dibuat dalam bentuk larutan Indikator asam basa adalah zat yang berubah warnanya atau membentuk fluoresen atau kekeruhan pada suatu range (trayek) pH tertentu. Indikator asam basa terletak pada titik ekivalen dan ukuran dari pH. Zat-zat indikator dapat berupa asam atau basa, larut dan stabil serta akan menunjukkan perubahan warna yang kuat, biasanya merupakan zat organik (Khopkar, 1990).
Air murni tidak mempunyai rasa, bau, dan warna. Bila mengandung zat tertentu, air dapat tersa asam, pahit, asin, dan sebagainya. Air yang
mengandung zat lain dapat pula menjadi warna. Cairan yang berasa asam disebut larutan asam, yang terasa asin disebut larutan garam, sedangkan yang terasa licin dan pahit disebut larutan basa (Syukri, 1999).
Zat-zat anorganik dapat diklasifikasikan dalam tiga golongan penting : asam, basa, dan garam. Asam secara paling sederhana didefinisikan sebagai zat, yang bila dilarutkan dalam air, mengalami disosiasi dengan pembentukan ion hidrogen sebagai satu-satunya ion positif. Basa, secara paling sederhana dapat didefinisikan sebagai zat, yang bila dilarutkan dalam iar, mengalami disosiasi dengan pembentukan ion-ion hidroksil sebagai satu-satunya ion negatif (Svehla, 1979).
Air mengandung ion dalam jumlah kecil sekali. Hal itu disebabkan oleh terjadinya rekasi asam basa sesama molekul air (autoionisasi) dan membentuk kesetimbangan :
H2O + H2O H3O+ +
OH-Dengan kata lain, air adalah elektrolit lemah dan bila H3O+ disederhanakan menjadi H+, maka kesetimbangan itu ditulis sebagai :
H2O H+ +
OH-Jika larutan mengandung asam, berarti menambahkan jumlah H+, dan akan menggeser kesetimbangan ke kiri sampai tercapai kesetimbangan baru. Pada kesetimbangan baru, konsentrasi H+ lebih besar dari pada OH-, tetapi
perkaliannya tetap 10-14. Hal yang sama akan terjadi bila air ditambah bas sehingga dicapai kesetimbangan baru dengan nilai [OH-] > [H+] dan
perkaliannya tetap 10-14.
Berdasarkan konsentrasi ion tersebut, larutan dibagi tiga, yaitu : Larutan asam : [H+] > [OH-]
Larutan netral : [H+] = [OH-] = 10-7 Larutan basa : [H+] < [OH-]
(Syukri, 1999).
Analisis titrimetrik adalah salah satu divisi besar dalam kimia analitik. Perhitungan yang tercakup di dalamnya berdasarkan pada hubungan stokiometrik dari reaksi kimia yang sederhana.
Analisis dengan metode titrimetrik didasarkan pada rekasi kimia seperti : aA + tT produk
Di mana a molekul analit, A, bereaksi dengan t molekul pereaksi, T. Pereaksi T, yang disebut titran, ditambahkan secara kontinu, biasanya dari sebuah buret, dalam wujud larutan yang konsentrasinya diketahui. Larutan ini disebut larutan standar, dan konsentrasinya ditentukan dengan sebuah proses yang dinamakan standarisasi. Penambahan dari titran tetap dilakukan sampai
jumlah T secara kimiawi sama dengan yang telah ditambahkan kepada A. selanjutnya akan dikatakan titik ekivalen dari titrasi telah dicapai. Agar diketahui kapan harus berhenti menambahkan titran, maka dapat
menggunakan bahan kimia, yaitu indikator, yang bereaksi terhadap kehadiran titran yang berlebih dengan melakukan perubahan warna. Perubahan warna ini bisa saja terjadi persis pada titik ekivalen , tetapi bisa juga tidak. Titik dalam titrasi dimana indikator berubah warnanya disebut titik akhir ( Day dan
Underwood).
Indikator adalah zat warna larut yang perubahan warnanya tampak jelas dalam rentang pH yang sempit. Jenis indikator yang khas adalah asam organik yang lemah yang mempunyai warna berbeda dari basa konjugatnya. Indikator yang baik mempunyai intensitas warna yang sedemikian rupa sehingga hanya beberapa tetes larutan indikator encer yang harus ditambahkan ke dalam larutan yang sedang diuji. Konsentrasi molekul indikator yang sangat rendah ini hampir tidak berpengaruh terhadap pH larutan. Perubahan warna indikator mencerminkan pengaruh asam dan basa lainnya yang terdapat dalam larutan (Oxtoby, 2001).
Reaksi kimia yang mungkin di perlakukan sebagai basis dari penentuan titrimetrik telah dikelompokan ke dalam empat tipe :
a. Asam-Basa. Ada sejumlah besar asam dan basa yang dapat ditentukan oleh titrimetri. Jika HA mewakili asam yang akan ditentukan dan B mewakili basa, rekasinya adalah sebagai berikut
HA + OH- A- + H2O dan
B + H3O+ BH+ + H2O
b. Oksidasi-reduksi (redoks). Reaksi kimia yang melibatkan oksidasi-redoksi dipergunakan secara luas dalam analitis titrimetrik. Sebagai contoh, besi dengan tingkat oksidasi +2 dapat dititrasi dengan sebuah larutan standar dari serium (IV) sulfat :
Fe2+ + Ce 4+ Fe3+ + Ce3+
c. Pengendapan. Pengendapan dari kation perak dengan anion halogen dipergunakan secara luas dalam prosedur titremetrik. Reaksinya adalah sebagai berikut
Ag+ + X- AgX (s)
d. Pembentukan kompleks. Contoh dari reaksi di mana terbentuk suatu kompleks antara ion perak dan sianida :
Ag+ + 2 CN- Ag (CN)-2 (Oxtoby, 2001).
Sejauh ini, realtif sedikit reaksi kimia yang dapat dipergunakan sebagai basis untuk titrasi. Sebuah reaksi harus memenuhi beberapa persyaratan sebelum
reaksi tersebut dapat dipergunakan :
a. Reaksi tersebut harus diproses sesuai persamaan kimiwai tertentu. Seharusnya tidak ada sampingan.
b. Reaksi tersebut harus diproses sampai benar-benar selesai pada titik ekivalensi.
c. Harus tersedia beberapa metode untuk menentukan kapan titik ekivalen tercapai.
d. Diharapkan reaksi berjalan cepat, sehingga titrasi dapat diselesaikan dalam beberapa menit (Day dan Underwood, 1999).
Reaksi penetralan atau asidimetri dan alkalimetri melibatkan titrasi basa bebas. Basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah dengan suatu asam standar (asidimetri) dan titrasi asam bebas atau asam yang terbentuk dari hidrolisis garam yang berasal dari basa lemah dengan suatu basa standar (alkalimetri). Reaksi-reaksi ini melibatkan bersenyawanya ion hidrogen untuk membentuk air (Basset, 1994:261).
Larutan baku/ larutan standar adalah larutan yang konsentrasinya sudah diketahui. Larutan baku biasanya berfungsi sebagai titran sehingga ditempatkan buret, yang sekaligus berfungsi sebagai alat ukur volume larutan baku. Larutan yang akan ditentukan konsentrasinya atau kadarnya, diukur volumenya dengan menggunakan pipet volumetri dan ditempatkan di erlenmeyer (Farx, 2011)
Indikator asam – basa ialah zat yang dapat berubah warna apabila pH lingkungannya berubah. Misalnya biru brotimol (BB) dalam larutan asam ia berwarna kuning tetapi dalam lingkungan basa warnanya biru. Warna dalam keadaan asam dinamakan warna asam dari indikator (kuning untuk bb), sedang warna yang ditunjukan dalam keadaan basa disebut warna basa (Harjadi, 1990:134).
Rentang pH indikator, indikator tidak berubah warna dengan sangat mencolok pada satu pH tertentu (diberikan oleh harga pKind-nya). Malahan, mengubah sedikit rentang pH. Terjadi perubahan kecil yang berangsur-angsur dari satu warna menjadi warna yang lain, menempati rentang pH. Secara kasar "aturan ibu jari", perubahan yang tampak menempati sekitar 1 unit pH pada tiap sisi harga pKind+ (Clark, 2007).
1. Reaksi kimia antar analit dan titrant diketahui dengan pasti dan jelas produk-produk apa yang akan dihasilkan nantinya. Mana reaktan dan produk apa yang akan dihasilkan harus jelas dan pasti
2. Reaksi harus berjalan dengan cepat
3. Harus ada sesuatu yang bisa menandakan atau mengindikasikan bahwa reaksi antara analit dengan titrant sudah equivalent secara stoikiometri, baik itu dengan perubahan warna, perubahan arus listrik, perubahan pH, dengan penambahan indicator atau apapun yang bisa digunakan untuk mengamati perubahan tersebut.
4. Tidak ada hal lain yang mengganggu reaksi antara analit dengan titrant
5. Reaksi antara analit dengan titrant harus memiliki kesetimbangan jauh kearah kanan (artinya kesetimbangannya mengarah kearah pembentukan produk) hal ini untuk memastikan secara kuantitatif reaksi bisa dihitung, dan memastikan titik akhir titrasi bisa diamati (Syarif, 2011:10-11).
Pengenceran adalah proses penambahan pelarutan terhadap larutan. Tujuan pengenceran adalah untuk memperkecil konsentrasi larutan. Pada peristiwa pengenceran jumlah zat terlarut tidak berubah. Sedangkan volume larutan berubah, akibatnya % volumenya akan kecil (Harjadi, 1990:147).
Suatu larutan standar adalah larutan yang mengandung eagensia dengan bobot yang diketahui dalam suatu volume tertentu suatu larutan. Larutan standar primer adalah suatu larutan yang konsentrasinya dapat langsung ditentukan dari berat bahan sangat murni yang dilarutkan dan volume yang terjadi, suatu zat standar primer harus memenuhi persyaratan, yaitu sebagai berikut:
1. Zat harus mudah diperoleh, mudah dimurnikan dan juga mudah dikeringkan (sebaiknya pada suhu 1100+- 1200C).
2. Zat harus tidak berubah dalam udara selama penimbangan. Kondisi-kondisi ini mengisyaratkan bahwa zat tidak boleh higroskopis, tidak pula dioksidasi udara atau dipengaruhi karbon dioksida. Standar ini juga harus dijaga agar komposisinya tidak berubah saat penyimpanan.
3. Zat harus dapat diuji terhadap zat pengotor dengan uji-uji kualitatif atau uji-uji lain yang kepekaannya diketahui (jumlah total zat-zat pengotor, umumnya tidak boleh melebihi 0, 01-0, 02 ).
4. Zat harus mempunyai ekivalen yang tinggi, sehingga sesatan penimbangan dapat diabaikan.
5. Zat harus mudah larutpada kondisi-kondisi dalam mana ia digunakan.\
6. Reaksi dengan larutan standar itu harus soikiometri dan praktis sekejap. Sesatan titrasi harus dapat diabaikan atau mudah ditetapkan dengan cermat dengan eksperimen.
Zat-zat yang biasa digunakan sebagai standar primer adalah reaksi asam basa natrium karbonat (Na2CO3), natrium tetrabonat (Na2B4O7), kalium hydrogen iodat KH(IO3)2, asam klorida bertitik didih konstan. Sedangkan standar sekunder adalah zat yang dapat digunakan untuk standarisasi dan yang kandungan zat aktifnya telah ditemukan dengan pembandingan dengan suatu standar primer (Basset, 1994:255).
Larutan yang dititrasi dalam asidmetri dan alkalimetri mengalami perubahan pH. Misalnya, bila larutan asam dititrasi dengan basa, maka pH larutan mula-mula rendah dan selama titrasi terus menerus naik. Bila pH ini diukur dengan pengukur pH pada awa titrasi yakni saat belum ditambah dengan basa dan pada saat tertentu setelah titrasi dimulai, maka pH larutan dapat dialurkan lewat grafik yang disebut kurva titrasi. Bila suatu indikator pH
kita gunakan untuk menunjukkan titik akhir titrasi maka indikator harus berubah warna tepat pada saat titran menjadi ekivalen dengan titrat agar tidak terjadi kesalahan titrasi. Perubahan warna ini harus terjadi dengan mendadak agar tidak ada keragu-raguan tentang kapan titrasi harus dihentikan. Bila perubahan warna mendadak sekali (yakni tetes terakhir menyebabkan warna sama sekali lain) maka dikatakan bahwa titik akhirnya tegas atau tajam (Harjadi, 1999:143).
Clark, Jim. 2007. Indikator Asam dan Basa http://www.chem-is-try.org
Diakses pada tanggal 5 Maret 2012
Farx. 2011. Larutan Baku (Larutan Standar) http://artikelteknikkimia.com
Diakses pada tanggal 5 Maret 2012
J. Basset dan kawan-kawan. 1994. Teknik Analisis Kuantitatif. Erlangga, Jakarta.
Harjadi, W. 1990. Ilmu Kimia Analitik Dasar. Gramedia, Jakarta.
Syarif. 2011. Syarat-Syarat Titrasi. Themegallery, Bandung.
Reaksi penetralan atau asidimetri dan alkalimetri adalah salah satu dari empat golongan utama dalam penggolongan reaksi dalam analisis titrimetri. Asidimetri dan alkalimetri ini melibatkan titrasi basa bebas atau basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah dengan suatu asam standar (asidimetri) dan titrasiasam bebas atau asam yang terbentuk dari hidrolisis garam yang berasal dari basa lemah dengan suatu basa standar (alkalimetri). Reaksi-reaksi ini melibatkan bersenyawanya ion hydrogen dan ion hidroksida
untuk membentuk air
(Basset, 1994).
Suatu larutan standar adalah larutan yang mengandung eagensia dengan bobot yang diketahui dalam suatu volume tertentu suatu larutan. Larutan standar primer adalah suatu larutan yang konsentrasinya dapat langsung ditentukan dari berat bahan sangat murni yang dilarutkan dan volume yang terjadi, suatu zat standar primer harus memenuhi persyaratan, yaitu sebagai berikut:
1. Zat harus mudah diperoleh, mudah dimurnikan dan juga mudah dikeringkan (sebaiknya pada suhu 1100+- 1200C).
2. Zat harus tidak berubah dalam udara selama penimbangan. Kondisi-kondisi ini mengisyaratkan bahwa zat tidak boleh higroskopis, tidak pula dioksidasi udara atau dipengaruhi karbon dioksida. Standar ini juga harus dijaga agar komposisinya tidak berubah saat penyimpanan.
3. Zat harus dapat diuji terhadap zat pengotor dengan uji kualitatif atau uji-uji lain yang kepekaannya diketahui (jumlah total zat-zat pengotor, umumnya tidak boleh melebihi 0, 01-0, 02 ).
4. Zat harus mempunyai ekivalen yang tinggi, sehingga sesatan penimbangan dapat diabaikan.
5. Zat harus mudah larutpada kondisi-kondisi dalam mana ia digunakan.
6. Reaksi dengan larutan standar itu harus soikiometri dan praktis sekejap. Sesatan titrasi harus dapat diabaikan atau mudah ditetapkan dengan cermat dengan
eksperimen.
Zat-zat yang biasa digunakan sebagai standar primer adalah reaksi asam basa natrium karbonat (Na2CO3), natrium tetrabonat (Na2B4O7), kalium hydrogen iodat KH(IO3)2, asam klorida bertitik didih konstan. Sedangkan standar sekunder adalah zat yang dapat digunakan untuk standarisasi dan yang kandungan zat aktifnya telah ditemukan dengan pembandingan dengan suatu standar primer (Basset, 1994).
Dalam suatu titrasi larutan yang harus dinetralkan misalnya, asam yang dimasukkan kedalam wadah atau tabung. Larutan lain, yaitu basa, dimasukkan kedalam buret kemudian kedalam asam mula-mula cepat kemudian tetes demi tetes sampai titik setara dari titrasi tersebut dicapai. Salah satu usaha untuk mencapai titik setara adalah dengan melalui perubahan warna dari indicator asam basa. Titik pada titrasi dimana indicator berubah warna dinamakan dengan titik akhir indicator. Yang diperlukan adalah memadankan titik akhir indicator dengan titik akhir penetralan. Ini dapat dicapai apabila kita dapat menemukan indicator yang sesuai dengan perubahan warnanya terjadi dalam selang pH yang sesuai dengan titik setara (Petrucci, 1987).
Indikator asam basa adalah zat yang berubah warnanya atau membentuk flouresen atau kekeruhan pada suatu range atau trayek pH tertentu. Indikator asam basa terletak pada titik ekivalen dan ukuran dari pH. Zat-zat indicator dapat berupa asam ataupun basa-larut, stabil dan menunjukkan perubahan warna yang kuat serta biasanya juga adalah zat-zat organic. Perubahan warna disebabkan oleh resonansi isomer electron. Berbagai indicator mempunyai
tetapan ionisasi yang berbeda dan akibatnya mereka menunjukkan warna pada range atau trayek pH yang berbeda (Khopkar, 1990).
Metil jingga adalah garam Na dari suatu asam sulponic dimana didalam suatu larutan banyak terionisasi dan dalam lingkungan alkali anionnya memberikan warna kuning sedangkan suasana asam metal jingga bersifat sebagai basa lemah dan mengambil ion H+, terjadi suatu perubahan struktur dam memberikan warna merah dari ion-ionnya.
Indikator adalah suatu zat yang warnanya berbeda-beda sesuai dengan konsentrasi ion hydrogen. Asam atau basa indicator yang tidak terdisosiasi mempunyai warna yang berbeda dengan hasil disosiasinya. Contohnya fenolftalein yang tergolong asam yang sangat lemah, dalam keadaan yang tidak terionisasi tersebut tidak berwarna. Jika dalam lingkungan basa, fenolftalein akan terionisasi lebih banyak dan memberikan warna yang terang karena adanya anionnya
(Keenan, 1994).
Indikator fenolftalein yang sudah dikenal merupakan asam diprotik dan tidak berwarna. Indicator ini terurai dahulu menjadi bentuk tidak berwarnanya dan kemudian, dengan hilangnya proton kedua, menjadi ion dengan system terkonjugat, menghasilkan warna merah. Metal oranye, indicator lainnya yang banyak digunakan, merupakan basa dan berwarna kuning dalam molekulnya. Penambahan proton menghasilkan kation yang berwarna merah muda (Underwood, 1998).
Pemilihan indicator untuk titrasi, harus diingat bahwa titik ekivalen titrasi yang mana anda memiliki campuran dua zat yang perbandingannya tepat sama, anda tidak pelak lagi membutuhkan pemilihan indicator yang perubahan warnanya mendekati titik ekivalen. Indicator yang dipilih bervariasi dari satu titrasi ke titrasi yang lainnya.
Asam kuat vs Basa kuat
Jika anda menggunakan fenolftalein, anda akan menitrasi sampai fenolftalein tak berwarna (pada pH 8, 8) karena itu adalah titik terdekat untuk mendapatkan titik ekivalen (Anonim, 2008).
Asidimetri dan alkalimetri adalah salah satu dari empat golongan utama
dalam penggolongan reaksi dalam analisis titrimetri. Asidimetri dan
Alkalimetri ini melibatkan titrasi basa bebas atau basa yang terbentuk
karena hidrolisis garam yang berasal dari asam lemah dengan suatu
asam standar (asidimetri) dan titrasi asam bebas atau asam yang
terbentuk dari hidrolisis garam yang berasal dari basa lemah dengan
suatu basa standar (alkalimetri). Reaksi-reaksi ini melibatkan
bersenyawanya ion hydrogen dan ion hydroksida untuk membentuk air
(Basset, 1994).
Indikator yang dipakai dalam titrasi asam basa adalah indikator yang perubahan warnanya dipengaruhi oleh pH. Penambahan indikator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes. Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik ekivalen, hal ini dapat dilakukan dengan memilih indiator yang tepat dan sesuai dengan titrasi yang akan dilakukan. Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indiator disebut sebagai titik akhir titrasi (Dyah, 2012).
Bila suatu asam dan suatu basa yang masing-masing dalam kuantitas yang ekuivalen secara kimiawi, dicampur akan dihasilkan suatu reaksi penetralan, yang menghasilkan suatu larutan garam dalam air. Larutan ini akan benar-benar netral jika asam dan basa itu sama kuat ; kalau tidak, akan diperoleh larutan asam lemah atau basa lemah. Konsentrasi suatu larutan asam atau basa yang anu (unknown) dapat ditentukan dengan titrasi dengan larutan yang konsentrasinya diketahui. Teknik semacam itu disebut analisis volumetri (Kleinfetter, 1987).
Volumetri adalah cara analisis jumlah berdasarkan pengukuran volume larutan pereaksi berkepekatan tertentu yang direaksikan dengan larutan contoh yang sedang ditetapkan kadarnya. Reaksi dijalankan dengan titrasi, yaitu suatu larutan ditambahkan dari buret sedikit demi sedikit, sampai jumlah zat-zat yang direaksikan tepat menjadi akivalen satu sama lain. Pada saat titran yang ditambahkan tampak telah ekivalen, maka penambahan titran harus dihentikan; saat ini dinamakan titik akhir titrasi. Larutan yang ditambahkan dari buret disebut titran, sedangkan larutan yang ditambah titran itu disebut titrat. Dengan jalan ini, volume atau berat titran dapat diukur dengan secara teliti dan bila konsentrasi juga diketahui, maka jumlah mol titran dapat dihitung. Karena jumlah titrat ekivalen atau sama dengan jumlah titran, maka jumlah mol titrat dapat diketahui pula berdasar persamaan reaksi dan koefisiennya. Perhatikanlah sekali lagi arti ungkapan ”pereaksi telah ekivalen”, yang berarti: telah tepat banyaknya untuk menghabiskan zat yang direaksikan. Titran dan titrat tepat saling menghabiskan; tidak ada kelebihan yang satu maupun yang lain. Ini tidak selalu berarti, bahwa pereaksi dan zat yang direaksikan telah sama banyak, baik volume maupun jumlah gram atau mol-nya. Hal ini jelas, sebab jumlah yang bereaksi ditentukan oleh persamaan reaksi (Harjadi, 1987).
Titrasi adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang diketahui dan diperlukan untuk bereaksi secara lengkap dengan sejumlah contoh tertentu yang akan di analisis. Prosedur analitis yang melibatkan titrasi dengan larutan-larutan yang konsentrasinya diketahui disebut analisis volumetri. Dalam analisis larutan asam dan basa, titrasi melibatkan pengukuran yang seksama,
volume-volume suatu asam dan suatu basa yang tepat saling menetralkan (Keenan, 1998).
Proses titrasi digunakan dalam penentuan analitis banyak, termasuk melibatkan reaksi asam-basa. Indikator adalah zat yang digunakan untuk sinyal ketika titrasi tiba di titik dimana reaktan kimia sama, seperti yang didefinisikan oleh persamaan reaksi. Larutan standar adalah larutan dengan konsentrasi tepat ditentukan. Awalnya konsentrasi larutan standar ditentukan dari jumlah yang ditimbang dari sebuah standar primer, bahkan kimia referensi yang sangat dimurnikan. Larutan standar dapat dibuat dari salah satu dari dua cara (Weiner, 2010):
1. Standar primer yang ditimbang dengan hati-hati, dilarutkan, dan diencerkan akurat
untuk volume yang diketahui. Konsentrasi dapat dihitung dari data.
2. Larutan dibuat untuk perkiraan konsentrasi dan kemudian dibakukan oleh titrasi
kuantitas akurat ditimbang dari standar primer.
Larutan yang dititrasi dalam asidimetri-alkalimetri mengalami perubahan pH. Misalnya bila larutan bersifat asam dititrasi dengan larutan bersifat basa, maka nilai pH larutan mula-mula rendah dan selama titrasi terus menerus naik. Bila pH ini diukur dengan pengukur pH (pH-meter) pada awal titrasi, yakni sebelum ditambah basa dan pada waktu-waktu tertentu setelah titrasi dimulai, maka kalau pH dialurkan lawan volume titran, kita peroleh grafik yang disebut kurva titrasi.
Bila suatu indikator pH kita pergunakan untuk menunjukkan titik akhir titrasi, maka harus dipenuhi syarat-syarat berikut ini:
1. Indikator harus berubah warna tepat pada saat titran menjadi ekivalen dengan titrat
agar tidak terjadi kesalahan titrasi.
2. Perubahan warna itu harus terjadi dengan mendadak, agar tidak ada keragu-raguan
tentang kapan titrasi harus dihentikan atau dilanjutkan.
Untuk memenuhi pernyataan (1), maka trayek indikator harus mencakup pH larutan pada titik ekivalen, atau sangat mendekatinya; untuk memenuhi pernyataan (2), trayek indikator tersebut harus memotong bagian yang sangat curam dari kurva.
Indikator asam basa ialah zat yang dapat berubah warna apabila pH lingkungannya berubah. Misalnya biru bromtimol (bb); dalam larutan asam ia berwarna kuning, tetapi dalam lingkungan basa warnanya biru. Warna dalam keadaan asam dinamakan warna asam dari indikator (kuning untuk bb), sedang warna yang ditunjukkan dalam keadaan basa disebut warna basa. Akan tetapi harus dimengerti, bahwa asam dan basa disini tidak berarti pH kurang atau lebih dari tujuh. Asam berarti pH lebih rendah dan basa berarti pH lebih besar dari trayek indikator atau trayek perubahan warna yang bersangkutan. Perubahan warna disebabkan oleh resonansi isomer elektron. Berbagai indikator mempunyai tetapan ionisasi yang berbeda dan akibatnya mereka menunjukkan warna pada range pH yang berbeda (Khopkar. 2003)
APhA. 2006. Handbook of Pharmaceutical Excipients. Pharmaceutical Press: London Departmen of Health. 2009. British Pharmacopoeia. Medicines and Healthcare products
Regulatory Agency: London
Dirjen POM. 1979. Farmakope Indonesia Edisi III. Departemen kesehatan RI: Jakarta Dirjen POM. 1995. Farmakope Indonesia Edisi IV. Departemen kesehatan RI: Jakarta Djibran. 2012. Titrasi Argentomerti (Online) (http://alandjibran.blogspot. com
/2012/01/titrasi-argentometri.html, diakses: 19 April 2013, 15:45 WITA)
Dyah, P. 2012. Asidi Alkalimetri. Universitas Islam Negeri Gunung Jati: Bandung
Ecko. 2012. Gravimetri. (Online) (http://eckho.webs.com/ddka.htm. diakses: 24 April 2013, 21:35 WITA)
Harjadi, W. 1987. Ilmu Kimia Analitik Dasar. PT. Gramedia: Jakarta
Keenan, Charles W. 1980. Ilmu Kimia untuk Universitas. Edisi VI. 422. Erlangga: Jakarta Khopkar, S.M. 2003. Konsep Dasar Kimia Analitik. Universitas Indonesia: Jakarta
Restu. 2012. Titrasi Asidimetri dan Alkalimetri (Online) (http://restuossapu
tra.blogspot.com/2012/11/laporan-titrasi-asidimetri-dan.html, diakses: 19 April
2013, 15:40 WITA)
Sastrohamidjojo, Hardjono. 2005. Kimia Dasar. Gajah Mada Universitas Press: Jogjakarta
Taher. 2013. Penentuan Kadar Asam dengan Metode titrasi asam basa. (Online)
(
http://chemist-try.blogspot.com/2013/01/penentuan-kadar-asam-dengan-metode.html. diakses: 24 April 2013, 21:27 WITA)
Weiner, Susan A. 2010. Introduction to Chemical Principles 7 th edition 268. Cengage Learning: USA
Widjaya, P. 2009. Penentuan kadar Karbonat dan Hidrogen Karbonat melalui Titrasi Asam
Basah. ITB: Bandung
Titrasi merupakan salah satu metode untuk menentukan konsentrasi suatu larutan dengan cara mereaksikan sejumlah volume larutan tersebut terhadap sejumlah volume larutan lain yang konsentrasinya sudah diketahui. Larutan yang konsentrasinya sudah diketahui disebut larutan baku. Titrasi yang melibatkan reaksi asam dan basa disebut titrasi asam-basa (Muchtaridi, 2006).
Pengertian Asidi-Alkalimetri
Asidimetri adalah penentuan konsentrasi suatu larutan basa dengan menggunakan larutan asam sebagai standarnya. Sebaliknya, Alkalimetri adalah
penentuan konsentrasi suatu larutan asam dengan menggunakan larutan basa sebagai standarnya (Suyatno, 2007).
Pengertian Larutan Standar Primer dan Sekunder
Larutan standar primer adalah larutan yang mengandung senyawa kimia stabil yang tersedia dalam kemurnian tinggi dan dapat digunakan untuk
menstandarisasi larutan standar yang digunakan di dalam titrasi (Watson, 2005). Contoh : Kalium Hidrogen Flatat, KBrO3, K2Cr2O7, AS2O3, NaCl, asamoksalat,
asambenzoat
Larutan standar sekunder adalah larutan yang telah melalui proses standarisasi dan memiliki konsentrasi tertentu (Watson, 2005).
Contoh : NaOH, HCl, AgNO3, KMnO4, Fe(SO4)2
Fungsi Bahan Dalam Praktikum
1. Fungsi asam cuka komersial berfungsi sebagai larutan yang diuji atau penirat. 2.Fungsi NaOH sebagai pemberi suasana basa
3.Fungsi HCl sebagai larutan sampel keadaan normal
4.Indikator fenolftalein ( PP ) sebagai penentu titik akhir dalam titrasi yang ditandai jika tidak ada warna menunjukkan netral sedangkan warna merah muda berarti keadaan basa dengan pH 8 – 10
5.Indikator metal orange atau jingga sebagai penentu titik akhir dalam titrasi yang ditandai jika warna kuning berarti keadan netral dengan pH 3,1 - 4,4. 6.Borak berfungsi larutan yang diuji atau penitrat
7.Asam Oksalat sebagai larutan yang di uji atau penitrat. 8.Aquades berfungsi sebagai pelarut Kristal (Widihati, 2008).
Pahari, A. K., B. S. Chauhan. 2006. Engineering Chemistry. New Delhi: Laxmi Publications.
Rohman.2007.Kimia FarmasiAnalisis.Yogyakarta :PustakaPelajar Sumardjo, Damin. 2009. PengantarKimia
:BukuPanduanKuliahMahasiswaKedokterandan Program Strata 1 FakultasBiosekta. Jakarta : EGC
Suyatno. 2007. KIMIA. Bandung: PT. Grafindo Media Pratama.
Syamsuni.2006. FarmasetikaDasardanHitunganFarmasi.Jakarta : EGC Watson, David G. 2005. Pharmaceutical Analysis, 2e. Oxford: Elsevier Limited
Wegner, Franks.2008.Encyclopedia Of Chemical Technology.New York :Johr Wiley & Sons
Widihati, I Gede.2008.”Adsorpsi Anion Cr (VI)
olehBatuPasirTeraktifasiAsamdanTersalut
itrimetri atau analisis volumetri adalah salah satu cara pemeriksaan jumlah zat kimia yang luas dalam pemakainannya. Hal ini disebabkan karena oleh beberapa alasan. Misalnya yaitu cara ini menguntungkan karena pelaksanaannya mudah dan cepat, ketelitian dan ketetapan cukup tinggi dan cara ini dapat digunakan untuk menentukan kadar beberapa zat yang mempunyai sifat yang berbeda.
Pada dasarnya cara titrimetri ini terdiri dari pengukuran volume larutan peraksi yang dibutuhkan untuk bereaksi secara stoikiometri dengan zat yang akan ditentukan. Larutan pereaksi biasanya diketahui kepekaannya dengan pasti, disebut peniter atau larutan baku. Sedangkan proses penambahan peniter tersebut ke dalam larutan zat yang akan ditentukan disebut titrasi. Dalam proses ini bagian-bagian peniterb ditambahkan ke dalam larutan zat yang akan ditentukan dengan bantuan alat yang disebut buret sampai tercapai titik kesetaraan. Titik kesetaraan adalah titik pada saat pereaksi dan zat yang ditentukan bereaksi sempurna secara stoikimetri (Rivai, 1995).
Kadang-kadang kita perlu mengetahui tidak hanya atau sekedar pH, akan tetapi perlu kita ketahui juga berapa banyak asam atau basayang terdapat didalam sampel. Sebagai contoh, seorang ahli kimia lingkungan mempelajari suatu danau dimana ikan-ikannya mati. Dia harus mengetahui secara pasti seberapa banyak asam yang
terkandung dalam suatu sampel air danau tersebut. Titrasi melibatkan suatu proses penambahan suatu larutan yang disebut tirant dari buret ke suatu flask yang berisi sampel dan disebut analit. Berhasilnya titrasi asam-basa tergantung pada seberapa akurat kita dapat mendeteksi titik stoikiometri. Pada titik tersebut, jumlah mol dari H3O+ dan OH- yang ditambahkan sebagai titrant adlah sama dengan jumlah mol dari OH- atau H3O+ yang terdapat dalam analit. Pada titik stoikiometri, larutan terdiri dari garam dan air. Larutan tersebut adalah asam apabila ion asam yang terkandung didalamnya, dan basa apabila ion basa yang terkandung didalamnya (Atkins, 1997 ).
Titrasi asam-basa sering disebut aidimetri-alkalimetri, sedang untuk titrasi atau pengukuran lain-lain sering juga dipakai akhiran –ometri menggantikan –imetri. Kata metri berasal dari bahasa Yunani dan berarti ilmu, proses atau seni mengukur; i dan o dalam hubungan dengan metri berarti sama saja, yaitu dengan atau dari (with atau of) akhiran -i berasal dari bahasa Latin da -o dari bahasa Yunani. Jadi asidimetri diartikan pengukuran jumlah asam ataupun pengukuran dengan asam (yang diukur jumlah asam atau garam). Tentu saja ini membingungkan, namun usaha untuk menetapkan arti mana yang harus dipakai tidak berasil. Maka asidimetri dan alkalimetri sebaliknya diartikan umum saja, yaitu titrasi yang menyangkut asam dan basa (Harjadi, 1990).
Seperti yang telah diketahui sebelumnya, dalam stoikiometri titrasi, titik ekivalen dari reaksi netralisasi adalah titik pada reaksi dimana asam dan basa keduanya setara, yaitu dimana keduanya tidak ada yang berlebihan. Dalam titrasi, suatu larutan yang akan dinetralkan, misal asam, ditempatkan di dalam flask bersamaan dengan beberapa tetes indikator asam basa. Kemudian larutan lainnya (misal basa) yang terdapat didalam buret, ditambahkan ke asam. Pertama-tama ditambahkan cukup banyak, kemudian dengan tetesan hingga titik ekivalen. Titik ekivalen terjadi pada saat terjadinya perubahan warna indikator. Titik pada titrasi dimana indikator warnanya berubah disebut titik akhir (Petrucci, 1997 ).
Penelitian dilanjutkan dengan proses absorbsi biogas dengan larutan penyerap NaOH secara kontinu diumpankan pada bagian atas menara pada konsentrasi dan laju alir tertentu, sementara itu biogas dialirkan pada bagian bawah kolom. Gas dan cairan akan saling kontak dan terjadi reaksi kimia. Tiap interval waktu 3 menit, larutan NaOH
setelah diabsorsi diambil untuk dianalisa. Jumlah CO2 yang terserap dianalisa dengan metode acidi-alkalimetri.
Penentuan kadar CO2 yang terserap dengan metode acidi-alkalimetri diawali dengan pengambilan 10 ml sampel, kemudian dimasukkan ke dalam Erlenmeyer. Selanjutnya ke dalam sampel ditambahkan 3 tetes indikator PP. Setelah itu, dilakukan titrasi dengan larutan HCl sampai warna merah muda hilang. Sehingga untuk kebutuhan titran dicatat sebanyak a ml. Kemudian sampel yang telah ditritasi tadi ditambahkan 3 tetes indikator MO, selanjutnya dititrasi kembali dengan HCl sampai terjadi perubahan warna. Kebutuhan titran dicatat sebanyak b ml. Setelah diketahui jumlah 4 titran yang dibutuhkan dapat dihitung kadar CO2 yang terserap. Perhitungan kadar CH4termurnikan dilakukan dengan program Hysys (Maarif, et al., 2007).
Analisis penentuan konsentrasi asam bebas di dalam larutan uranil nitrat secara potensiometrik didasarkan atas reaksi asambasa (asidimetri). Mula-mula larutan uranil nltrat yang mengandung asam bebas diencerkan keasamannya hingga sekitar 0,1-0,6 N kemudian ditambahkan 1 ml ammonium oksalat jenuh' sebagai larutan penyangga dan dititrasi dengan sodium hidroksida 0,1 N. Pada penelitian ini dilakukan standarisasi asam nitrat bebas dengan dibuat seri larutan asam nitrat dengan variasi konsentrasi sekitar 0,1-0,6 N. L~rutan tersebut selanjutnya dititrasi dengan larutan standard sekunder sodium hidroksida 0,1 N. Metoda yang digunakan adalah titrimetri menggunakan alat potensiometer. Oari data hasil penelitian dapat diketahui baik faktor koreksi analisis maupun kurva standarnya (Yudhi, 2000).
Atkins, Peter and Jones Lorette. 1997. Chemistry Molecules and Canges, 3rd Ed. New York: W. H. Freeman and Company.
Harjadi, W., 1990. Ilmu Kimia Analitik Dasar. Gramedia. Jakarta
Maarif, F., dan Januar, A.F., 2007. Absorbsi Gas Karbondioksida (CO2) dalam Biogas dengan Larutan NaOH secara Kontinyu. Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro. Semarang.
Petrucci, Ralph H and Willias S. Harwood. 1997. General Chemistry. New Jersey: Prentice Hall. Rivai, H., 1995. Asas Pemeriksaan Kimia. UI Press. Jakarta.
Yudhi, N., dan Pranjono, 2000. Analisis Asam Bebas Secara Potensiometrik Di Dalam Larutan Uranil Nitrat Murni. URANIA No. 21-22.
Titrasi adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang diketahui dan diperlukan untuk bereaksi secara lengkap dengan sejumlah contoh
tertentu yang akan dianalisis. Contoh yang akan dianalisis dirujuk sebagai yang tak diketahui. Prosedur analitis yang melibatkan titrasi dengan larutan-larutan yang konsentrasinya diketahui disebut analisis volumetric (Keenan, 1980).
Asidimetri adalah analisis volumetrik yang menggunakan larutan baku asam untuk menentukan jumlah basa yang ada. Alkalimetri adalah analisis volumetrik yang menggunakan larutan baku basa untuk menentukan jumlah asam yang ada (Daintith, 1997).
Titrasi adalah penambahan yang sangat hati-hati dari satu larutan ke yang lain dengan cara buret. Buret secara akurat mengukur volume larutan yang
dibutuhkan untuk bereaksi dengan jumlah yang secara hati-hati diukur dari zat lain yang terlarut. Ketika volume yang tepat telah tercapai, indikator perubahan warna dan operator menghentikan aliran dari buret tersebut. Fenolftalein adalah
indikator khas untuk titrasi asam-basa, tidak berwarna dalam larutan asam dan merah muda dalam larutan basa (Peters, 1990).
Proses titrasi digunakan dalam penentuan analitis banyak, termasuk melibatkan reaksi asam-basa. Indikator adalah zat yang digunakan untuk sinyal ketika titrasi tiba di titik dimana reaktan kimia sama, seperti yang didefinisikan oleh persamaan reaksi. Larutan standar adalah larutan dengan konsentrasi tepat ditentukan. Awalnya konsentrasi larutan standar ditentukan dari jumlah yang ditimbang dari sebuah standar primer, bahkan kimia referensi yang sangat dimurnikan. Larutan standar dapat dibuat dari salah satu dari dua cara;
1. Standar primer yang ditimbang dengan hati-hati, dilarutkan, dan diencerkan
akurat untuk volume yang diketahui. Konsentrasi dapat dihitung dari data. 2. 2. Larutan dibuat untuk perkiraan konsentrasi dan kemudian dibakukan oleh
titrasi kuantitas akurat ditimbang dari standar primer (Weiner, 2010). Daintith, J.,1997, Kamus Lengkap Kimia, 7, 17, Erlangga, Jakarta
Keenan, Charles W., 1980, Ilmu Kimia untuk Universitas, Edisi VI, 422, Erlangga, Jakarta
Peters, Edward I., 1990, Introduction to Chemical Principles, 5 th edition, 394, Saunders College Publishing, USA
Weiner, Susan A., 2010, , Introduction to Chemical Principles, 7 th edition, 268, Cengage Learning, USA
Asidimetri dan alkalimetri termasuk reaksi netralisasi yakni reaksi antara ion hidrogen yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral. Netralisasi dapat juga dikatakan sebagai reaksi antara donor proton (asam) dengan penerima proton (basa). Asidimetri merupakan penetapan kadar secara kuantitatif terhadap senyawa-senyawa yang bersifat basa dengan menggunakan baku asam.
Sebaliknya alkalimetri adalah penetapan kadar senyawa-senyawa yang bersifat asam dengan menggunakan baku basa.[5]
Dalam titrasi asam-basa, jumlah relatif asam dan basa yang diperlukan untuk mencapai titik ekivalen ditentukan oleh perbandingan mol asam (H+) dan basa (OH-) yang bereaksi. Untuk reaksi antara HCl dengan NaOH titik ekivalen tercapai pada perbandingan mol 1:1 tetapi untuk reaksi antara H2SO4 dengan NaOH diperlukan perbandingan mol 1:2 untuk mencapai titik ekivalen.
H2SO4(aq) + 2NaOH (aq) Na2SO4(aq) + 2H2O (l)
Dalam titrasi asam-basa perubahan pH sangat kecil hingga hampir tercapai titik ekivalen. Pada saat tercapai titik ekivalen, penambahan sedikit asam atau basa akan menyebabkan perubahan pH yang besai ini seringkali dideteksi dengan zat yang dikenal sebagai indikator. Titik atau kondisi penambahan asam atau basa dimana terjadi perubahan warna indikator dalam suatu titrasi dikenal sebagai titik akhir titrasi. Titik akhir titrasi sering disamakan dengan titik ekivalen, walaupun diantara keduanya masih ada selisih yang relatif kecil. Semua masalah yang berkaitan dengan titrasi asam basa dapat dipecahkan dengan konsep stoikiometri dan konsentrasi larutan yang dinyatakan dengan mol, perbandingan mol, molaritas atau normalitas.[6]
Dalam melakukan titrasi netralisasi kita perlu secara cermat mengamati perubahan pH, khususnya pada saat akan mencapai titik akhir titrasi, hal ini dilakukan untuk mengurangi kesalahan dimana akan terjadi perubahan warna dari indikator lihat Gambar 1.
Gambar 1. Titrasi alkalimetri dengan larutan standar basa NaOH[7]
Analit bersifat asam pH mula-mula rendah, penambahan basa menyebabkan pH naik secara perlahan dan bertambah cepat ketika akan mencapai titik ekuivalen (pH = 7). Penambahan selanjutnya menyebakan larutan kelebihan basa sehingga pH terus meningkat. Dari Gambar 1, juga diperoleh informasi indikator yang tepat untuk digunakan dalam titrasi ini dengan kisaran pH pH 7 – 10 (Tabel 1).[8]
Larutan baku asam yang sering digunakan dalam asidi-alkalimetri umumnya dibuat dari asam klorida dan asam sulfat. Kedua asam ini dapat digunakan pada hampir semua
titrasi, akan tetapi asam klorida lebih disukai daripasa asam sulfat terutama untuk senyawa-senyawa yang memberikan endapan dengan asam sulfat seperti barium hidroksida. Asam sulfat lebih disukai untuk titrasi menggunakan pemanasan karena kemungkinan terjadinya penguapan pada pemanasan asam klorida yang dapat menimbulkan bahaya. Asam nitrat selalu tidak digunakan karena mengandung asam nitrit yang dapat merusak beberapa indikator.[9]
Untuk larutan baku alkali, umumnya digunakan natrium hidroksida, kalium hidroksida dan barium hidroksida. Larutan-larutan ini mudah menyerap karbon dioksida dari udara, oleh karena itu konsentrasinya dapat berubah dengan cepat. Dengan demikian, maka larutan bali alkali dibuat bebas karbonat dan untuk melindungi itu dari pengaruh karbon dioksida dari udara maka penyimpanannya dilengkapi dengan “soda lime tube”. Semua larutan baku alkali harus sering dibakukan ulang.[10]
Menurut Indigo Morie (2008), ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa, yaitu :
1. Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan, kemudian membuat plot antara pH dengan volume titran untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalent”.
2. Memakai indikator asam basa. Indikator ditambahkan pada titran sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan dan sangat praktis.
Chadijah, Sitti Chadijah, Wa Ode Rustiah dan Anna Handayani. Penuntun Praktikum Kimia Analitik. Makassar: UIN Alauddin Makassar, 2012
Ibnu, M. Sodiq Ibnu, et al.. Kimia Analitik I . Malang: Universitas Negeri Malang, 2005 Khopkar, S. M.. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia, 2010
Mursyidi, Achmad dan Abdul Rohman. Volumetri dan Gravimetri. Yogyakarta: UGM-Press, 2008 Morie, Indigo. “Titrasi Asam Basa”, belajarkimia.com. 7 April 2008.
http://belajarkimia.com/2008/04/titrasi-asam-basa/. Diakses pada tanggal 31 Mei 2012
Wilyta, Intan Wilyta. “Asidimetri”, scribd.com. 30 Oktober 2011. http://www.scribd.com/doc/70246435/asidimetri. Diakses pada tanggal 31 Mei 2012
Zulfikar. “Titrasi Asam Basa”, Chem-is-try.org-Situs Kimia Indonesia. 27 Desember 2010.
http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/pemisahan-kimia-dan-analisis/titrasi-asam-basa/. Diakses pada tanggal 31 Mei 2012
Alkalimetri merupakan penetapan kadar senyawa-senyawa yang bersifat asam dengan menggunakan baku basa.
Asidimetri dan alkalimetri termasuk reaksi netralisasi yakni reaksi antara ion hidrogen yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral. Netralisasi dapat juga dikatakan sebagai reaksi antara pemberi proton (asam) dengan penerima proton (basa).
(http://osun.org/titrasi-alkalimetri-pdf-3.html)
Reaksi dijalankan secara titrasi, yaitu suatu larutan ditambahkan dari buret sedikit demi sedikit, sampai jumlah zat-zat yang direaksikan tepat menjadi ekivalen satu sama lain. Pada saat titran yang ditambahkan tampak telah ekivalen, maka penambahan titran harus dihentikan, saat ini dinamakan titik akhir titrasi. Larutan yang ditambahkan dalam buret disebut titran, sedangkan larutan yang ditambahkan titran itu disebut titrat.
(W. Harjadi. Ilmu Kimia Analitik Dasar, 1986)
Untuk menetapkan titik akhir pada proses netralisasi ini digunakan indikator. Menurut W. Ostwald, indikator adalah suatu senyawa organik kompleks dalam bentuk asam (Hin) atau dalam bentuk basa (InOH) yang mampu berada dalam keadaan dua macam bentuk warna yang berbeda dan dapat saling berubah warna dari warna satu ke warna yang lain.
Jalannya proses titrasi netralisasi dapat diikuti dengan melihat perubahan pH larutan selama titrasi, yang terpenting adalah perubahan pH di sekitar titik ekuivalen karena hal ini berhubungan erat dengan pemilihan indikator agar kesalahan titrasi sekecil-kecilnya.
(http://pdfqueen.com/modul-kimia)
Titrasi adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang diketahui dan diperlukan untuk bereaksi secara lengkap dengan sejumlah contoh tertentu yang akan di analisis. Prosedur analitis yang melibatkan titrasi dengan larutan-larutan yang konsentrasinya diketahui disebut analisis volumetri. Dalam analisis larutan-larutan asam dan basa, titrasi melibatkan pengukuran yang seksama, volume-volume suatu asam dan suatu basa yang tepat saling menetralkan.
Pemilihan suatu indikator untuk suatu titrasi asam basa bergantung pada kuat relatif asam dan basa yang digunakan dalam titrasi. Perhatikan dua titrasi asam kuat HCl dengan basa kuat NaOH, dan titrasi asam kuat HC2H3O2 dengan basa kuat NaOH. Berikut persamaan reaksinya:
HCl + NaOH → NaCl + HOH
(asamklorida) (natriumhidroksida) (natriumklorida) (air)
HC2H3O2 + NaOH → NaC2H3O2 + HOH
(asamasetat) (natriumhidroksida) (natriumasetat) (air)
Dalam reaksi semacam itu, titik kesetaraan adalah titik pada mana tepat cukup satu perekasi ditambahkan untuk bereaksi dengan pereaksi yang lain. Suatu titik akhir adalah titik pada saat indikator tertentu berubah warna.
(Keenan. Kimia Untuk Universitas, 1984) Titrimetri merupakan suatu metode analisis kuantitatif didasarkan pada pengukuran volume titran yang bereaksi sempurna dengan analit.
(http://osun.org/kimia-analitik.html) Reaksi-reaksi kima yang dapat diterima sebagai dasar penentuan titrimetrik asam-basa adalah sebagai berikut:
- Jika HA merupakan asam yang akan ditentukan dan BOH sebagai basa, maka reaksinya adalah:
HA + OH-→A- + H 2O
- Jika BOH merupakan basa yang akan ditentukan dan HA sebagai asam, maka reaksinya adalah:
BOH + H+ → B+ + H 2O
Dari kedua reaksi di atas dapat disimpulkan bahwa prinsip reaksi titrasi asam basa adalah reaksi penetralan, yakni: H+ + OH- → H
2O dan terdiri dari beberapa kemungkinan yaitu reaksi-rekasi antara asam kuat dengan basa kuat, asam kuat dan basa lemah, asam lemah dan basa kuat, serta asam lemah dan basa lemah.
Khusus reaksi antara asam lemah dan basa lemah tidak dapat digunakan dalam analisis kuantitatif, karena pada titik ekivalen yang terbentuk akan terhidrolisis kembali sehingga titik akhir titrasi tidak dapat diamati. Hal ini yang menyebabkan bahwa titran biasanya merupakan larutan baku elektrolit kuat seperti NaOH dan HCl.
(http://openpdf.com/metoda-asidimetri.html)
Dalam praktek laboratorium orang lazim menyiapkan dan menstandarkan satu larutan asam dan satu larutan basa. Kedua larutan ini kemudian dapat digunakan untuk analisis contoh-contoh dari asam dan basa, karena larutan asam lebih mudah disimpan daripada larutan basa.
Dalam memilih asam untuk dipakai dalam larutan standart, faktor-faktor berikut harus diperhatikan, yaitu:
- Asam harus kuat, yaitu terdisosiasi tinggi
Sebuah asam dapat didefinisikan sebagai zat yang mengalami disosiasi bila dilarutkan dalam air, dengan membentuk ion hidrogen sebagai satu-satunya ion positif.
- Asam tidak mudah menguap
Salah satu contoh asam yang tidak mudah menguap adalah asam perklorat (HClO4). - Larutan asamnya harus stabil
- Asamnya tidak merupakan suatu perekasi oksidator kuat sehingga tidak merusak senyawa-senyawa organik yang digunakan seperti indikator.
(R.A. Day Jr, AL. Underwood. Analisis Kimia Kuantitaif, 1986) (J.Basset. Kimia Analisis Kuantitatif Anorganik, 1994) Larutan titran haruslah diketahui komposisi dan konsentrasinya. Idealnya kita harus memulai dengan larutan standart primer. Larutan standart primer dibuat dengan melarutkan zat dengan kemurnian yang tinggi (standart primer) yang diketahui dengan tepat beratnya dalam suatu larutan yang diketahui dengan tepat volumenya. Apabila titran tidak cukup murni, maka perlu distandardisasi dengan standart primer. Standart yang tidak termasuk standart primer dikelompokkan sebagai standart sekunder, contohnya NaOH, karena NaOH tidak cukup murni (mengandung air, natrium karbonat dan logam-logam tertentu) untuk digunakan sebagai larutan standart secara langsung, maka perlu distandardisasi dengan asam yang merupakan standart primer misalnya kalium hidrogen ftalat (KHP).
(http://osun.org/titrasi-alkalimetri-pdf-2.html) Karakteristik standart primer, yaitu:
- Harus tersedia dengan mudah dalam suatu bentuk murni atau dalam keadaan kemurnian yang diketahui. Pada umumnya total banyaknya ketidakmurnian tidak melampaui 0,01 ke 0,02%, dan haruslah mungkin untuk memeriksa ketidakmurnian itu dengan percobaan kualitatif yang kepekaannya diketahui.
- Zat itu harus mudah dikeringkan dan tidak boleh terlalu higroskopik sehingga menarik air selama penimbangan. Tidak boleh kehilangan bobot bila dibiarkan di udara. Hidrat-hidrat garamnya biasanya tidak digunakan sebagai standart primer.
- Standart primer itu mempunyai bobot ekivalen yang tinggi agar akibat-akibat kesalahan penimbangan dapat diminimalkan.
- Asam atau basa yang digunakan harus merupakan asam atau basa kuat, artinya sangat terdisosiasi, tetapi asam atau basa lemah juga dapat digunakan sebagai standart primer tanpa