RESPON PERTUMBUHAN TUNAS SANINTEN (Castanopsis
argentea (Blume) A.DC.) TERHADAP PEMBERIAN ZAT
PENGATUR TUMBUH BAP DAN IAA SECARA IN VITRO
ESTHI LIANI AGUSTIANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Respon Pertumbuhan Tunas Saninten (Castanopsis argentea (Blume) A.DC.) terhadap Pemberian Zat Pengatur Tumbuh BAP dan IAA secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Esthi Liani Agustiani
ABSTRAK
ESTHI LIANI AGUSTIANI. Respon Pertumbuhan Tunas Saninten (Castanopsis
argentea (Blume) A.DC.) terhadap Pemberian Zat Pengatur Tumbuh BAP dan IAA
secara In Vitro. Dibimbing oleh ARUM SEKAR WULANDARI dan ERINA SULISTIANI.
Saninten (Castanopsis argentea (Blume) A.DC.) adalah salah satu anggota famili Fagaceae yang merupakan penghasil kayu dan non kayu. Perbanyakan saninten secara in vitro belum pernah dilaporkan. Penelitian ini bertujuan untuk mengidentifikasi respon pertumbuhan tunas saninten terhadap pemberian zat pengatur tumbuh (ZPT) 6-benzylaminopurine (BAP) dan indole-3-acetic-acid (IAA) dengan konsentrasi yang berbeda secara in vitro pada media woody plant medium (WPM). Penelitian dilakukan dengan rancangan acak lengkap faktorial, dengan 2 faktor yaitu macam ZPT dan konsentrasi ZPT. Macam ZPT terdiri atas 2 taraf yaitu BAP dan IAA. Konsentrasi ZPT terdiri atas 3 taraf yaitu BAP dan IAA 0 mg/L, BAP 0.5 mg/L atau IAA 0.1 mg/L, dan BAP 1.0 mg/L atau IAA 0.2 mg/L. Peubah yang diamati ialah jumlah tunas, tinggi tunas, dan pertumbuhan kalus. Kombinasi ZPT BAP (0, 0.5, 1 mg/L) dengan IAA (0, 0.1, 0.2 mg/L) belum menghasilkan pertumbuhan tunas yang optimal. Media WPM dengan BAP 0.5 mg/L mampu menghasilkan persentase eksplan bertunas, jumlah tunas, dan pertambahan tinggi tunas terbaik. Media WPM dengan IAA konsentrasi 0.1 dan 0.2 mg/L menghasilkan pertumbuhan eksplan ke arah pembentukan kalus.
Kata kunci: 6-benzylaminopurine (BAP), Castanopsis argentea, indole-3-acetic-acid (IAA), woody plant medium (WPM)
ABSTRACT
ESTHI LIANI AGUSTIANI. The growth response of Saninten (Castanopsis argentea (Blume) A.DC.) In Vitro by adding Plant Growth Regulator BAP and IAA. Supervised by ARUM SEKAR WULANDARI and ERINA SULISTIANI.
Saninten (Castanopsis argentea (Blume) A.DC.) is one of the member Fagaceae family which can produce wood and non-wood product. Micropropagation of saninten by in vitro has never been reported. This research aims to identify the growth response of saninten shoot by adding Plant Growth Regulator (PGR), they are 6-benzylaminopurine (BAP) and indole-3-acetic-acid (IAA) with different concentrations in propagation in vitro on woody plant medium (WPM). The research conducted a completely randomized design (CRD) factorial. They are PGR type and PGR concentration. The PGR type consist of two levels namely BAP and IAA. PGR concentration consist of three levels namely 0 mg/L BAP and IAA, 0.5 mg/L BAP or 0.1 mg/L IAA, and 1.0 mg/L BAP or 0.1 mg/L IAA. Parameters observed is the amount of shoot, shoot height, and callus growth. The combination of BAP (0, 0.5, 1 mg/L) and IAA (0, 0.1, 0.1 mg/L) haven’t produce optimal growth of shoot. WPM medium with 0.5 mg/L BAP was able to produce the best of percentage of shoot, the number of shoots, and shoot height growth. WPM medium with IAA concentration of 0.1 and 0.2 mg/L produce explant with callus.
Key words: 6-benzylaminopurine (BAP), Castanopsis argentea, indole-3-acetic-acid (IAA), woody plant medium (WPM)
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
RESPON PERTUMBUHAN TUNAS SANINTEN (Castanopsis
argentea (Blume) A.DC.) TERHADAP PEMBERIAN ZAT
PENGATUR TUMBUH BAP DAN IAA SECARA IN VITRO
ESTHI LIANI AGUSTIANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Alhamdulillahirabbil’alamin, puji syukur penulis panjatkan ke hadirat Allah
subhanahu wa ta’ala atas rahmat dan karunia-Nya sehingga karya ilmiah yang
berjudul ”Respon Pertumbuhan Tunas Saninten (Castanopsis argentea (Blume) A.DC.) terhadap Pemberian Zat Pengatur Tumbuh BAP dan IAA secara In Vitro” ini dapat diselesaikan dengan baik.
Penulis mengucapkan terima kasih kepada Dr Ir Arum Sekar Wulandari, MS dan Ir Erina Sulistiani, MSi selaku dosen pembimbing atas bimbingan, motivasi dan waktu untuk memberikan pengarahan, saran dan penjelasan berkaitan dengan penelitian ini. Di samping itu, penulis menyampaikan terima kasih kepada Staff laboratorium Kultur Jaringan SEAMEO BIOTROP yang telah memberikan bantuan selama pelaksanaan penelitian. Ungkapan terima kasih juga penulis sampaikan kepada keluarga, Anisatul, Audrey, Via, Exze, Rusmi, Citra, Dea, Mia, Nina, Hasan, teman-teman Silvikultur 49, dan Fahutan 49 yang telah memberikan dorongan semangat dan doa.
Semoga karya ilmiah ini bermanfaat bagi pihak-pihak yang membutuhkan.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2 METODE 2 Bahan 2 Alat 3 Prosedur Penelitian 3 Analisis Data 7HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 13
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 20
DAFTAR TABEL
1 Kombinasi konsentrasi dua macam ZPT pada media perlakuan dalam
media dasar WPM 4
2 Perbandingan prosedur metode sterilisasi pada kultur tunas saninten 5 3 Kriteria penetapan skor pada eksplan berkalus 7 4 Hasil sterilisasi eksplan saninten dengan perendaman desinfektan
(NaOCl 5.25%) konsentrasi 10% selama 15 menit pada 4 MST 8 5 Pengaruh BAP dan IAA pada media induksi (WPM) terhadap
kemunculan tunas saninten pada umur 8 MST 10
6 Pengaruh BAP dan IAA pada media induksi (WPM) terhadap kemunculan kalus, kematian eksplan dan kontaminasi eksplan pada
umur 8 MST 12
DAFTAR GAMBAR
1 Bagian tunas saninten sebagai sumber eksplan 3 2 Pengaruh metode sterilisasi terhadap eksplan saninten steril yang
dihasilkan pada 4 MST 8
3 Jenis kontaminan pada fase inisiasi tunas saninten selama 4 MST 9 4 Kondisi eksplan saninten: (a) eksplan terkontaminasi fungi, (b)
kontaminasi fungi pada media, (c) eksplan terkontaminasi bakteri, dan
(d) eksplan mati akibat browning 9
5 Pertumbuhan tunas pada eksplan saninten dalam media WPM pada umur 8 MST: (a) konsentrasi BAP 0.5 mg/L dan (b) konsentrasi BAP
1 mg/L 10
6 Pertambahan tinggi tunas saninten dalam media WPM dengan kombinasi ZPT BAP (0, 0.5, 1 mg/L) dan IAA (0, 0.1, 0.2 mg/L) pada
umur 8 MST 11
7 Kondisi eksplan pada umur 8 MST dalam media WPM: (a) tanpa ZPT
dan (b) BAP 0.5 mg/L 11
8 Kondisi kalus pada umur 8 MST: (a) eksplan berkalus dalam media WPM IAA 0.1 mg/L, (b-c) kalus berdiferensiasi menjadi akar dalam media WPM IAA 0.1 mg/L (d) eksplan berkalus pada media WPM BAP 1 mg/L dan IAA 0.1 mg/L, dan (e-f) eksplan berkalus pada WPM IAA
0.2 mg/L 12
9 Perubahan eksplan: (a) zat fenolik pada eksplan umur kultur 1 MST, (b)
DAFTAR LAMPIRAN
1 Komposisi media woody plant medium (WPM) sebagai media dasar
induksi tunas pucuk saninten 20
2 Hasil uji F pengaruh jenis ZPT dan konsentrasi ZPT terhadap jumlah
tunas pada kultur saninten selama 8 MST 21
3 Hasil uji F pengaruh jenis ZPT dan konsentrasi ZPT terhadap tinggi
tunas pada kultur saninten selama 8 MST 21
4 Hasil uji Kruskall-Wallis pengaruh ZPT terhadap pembentukan eksplan
PENDAHULUAN
Latar Belakang
Saninten (Castanopsis argentea (Blume) A.DC.) adalah salah satu anggota famili Fagaceae yang merupakan penghasil kayu dan non kayu. Kayu saninten biasanya digunakan untuk kayu pertukangan seperti balok pada bangunan perumahan dan jembatan, papan, tiang dan rusuk (Martawijaya et al. 1987). Hasil hutan non kayu dari saninten berupa buah dan bahan pewarna dari kulit buahnya. Kulit kayu (pepagan) dan kulit buah dari saninten dapat dipakai sebagai bahan penghitam rotan yang telah dikupas (Lemmens et al. 1995). Secara ekologi, saninten berperan penting dalam ekosistem pegunungan dengan tajuk yang lebar. Pohon ini menjadi tempat bagi satwa liar (terutama burung dan mamalia) untuk mencari pakan, beristirahat dan bersarang (Heriyanto et al. 2007). Jenis ini juga dapat digunakan untuk mereboisasi lahan dengan kandungan batu yang tinggi (Wibowo 2006) serta menjadi salah satu jenis tanaman yang berpotensi untuk kegiatan revegetasi lahan bekas tambang (Mansur 2013).
Manfaat dari tanaman saninten menjadi salah satu alasan pentingnya upaya perbanyakan tanaman saninten untuk menunjang keberadaan dan kebutuhan akan jenis ini. Upaya perbanyakan dapat dilakukan secara generatif maupun vegetatif. Perbanyakan secara generatif melalui permudaan alam untuk jenis ini sulit dilakukan karena buahnya yang disenangi satwa (Heriyanto et al. 2007). Perbanyakan secara vegetatif lebih banyak dipilih karena mampu menghasilkan individu tanaman yang lebih banyak, seragam, dan dalam waktu yang lebih cepat. Selain itu, lamanya pertumbuhan dan perkembangan tanaman kehutanan menjadi alasan untuk ditemukannya teknik perbanyakan secara vegetatif yang cepat dan menghasilkan individu tanaman yang unggul.
Perbanyakan saninten secara vegetatif telah dilakukan oleh Fitria (2015) melalui stek pucuk dengan persentase stek hidup sebesar 92.78% dan stek berakar sebesar 40.56% pada umur 45 hari. Namun perbanyakan dengan metode ini terkendala serangan fungi yang muncul di bagian pangkal stek pucuk pada beberapa stek yang hidup. Upaya perbanyakan vegetatif lainnya yang dapat dilakukan selain melalui teknik stek ialah melalui teknik kultur jaringan (tissue culture). Perbanyakan tanaman melalui kultur jaringan dinilai lebih baik karena dapat menghasilkan bibit tanaman berkualitas unggul, yaitu sifat genetik yang sama dengan pohon induknya serta dapat diperbanyak dalam skala besar dan waktu relatif singkat (Sulistiani dan Yani 2012).
Perbanyakan tanaman kehutanan melalui kultur jaringan telah banyak dicoba, seperti induksi eksplan dari tunas ulin (Eusideroxylon zwageri) (Dewanto 2014) dan perbanyakan tanaman gaharu (Aquilaria malaccensis Lamk.) (Azwin et al. 2006). Namun perbanyakan saninten secara in vitro belum pernah dilaporkan. Perbanyakan secara in vitro anggota famili Fagaceae telah dilakukkan pada jenis
Castanea sativa atau dikenal dengan sebutan chestnut. Perbanyakan C. sativa
menghasilkan tunas terbanyak dalam media MS (Murashige & Skoog) dengan setengah konsentrasi NO3- dan zat pengatur tumbuh (ZPT) berupa
2
broad leaved tree (BT) dengan setengah konsentrasi media woody plant medium
(WPM)) yang ditambahkan BAP 1 mg/L (Osterc et al. 2005).
Lestari (2008) menyatakan keberhasilan tanaman melalui teknik kultur jaringan dipengaruhi oleh keberadaan ZPT. Penggunaan ZPT di dalam kultur jaringan bergantung pada tujuan atau arah pertumbuhan tanaman yang diinginkan. Berdasarkan hal tersebut diperlukan adanya penelitian mengenai teknik perbanyakan saninten melalui kultur jaringan untuk mengetahui kemampuan pertumbuhan dan perkembangan jenis ini dalam perbanyakan secara in vitro dengan penambahan ZPT pada media dan penggunaan bahan tanaman yang tepat.
Perumusan Masalah
Saninten sebagai salah satu jenis penghasil hasil hutan kayu dan non kayu memiliki potensi untuk dikembangkan dan dikomersilkan. Namun, kondisinya di alam sulit ditemukan permudaan alami karena daya viabilitas biji yang rendah dan buah yang digemari oleh satwa. Oleh karena itu, metode perbanyakan secara vegetatif terutama kultur jaringan dapat menjadi pilihan agar kontinuitas ketersedian bibit dapat dipenuhi dengan cepat. Dalam perbanyakan tanaman melalui kultur jaringan perlu diketahui potensi jenis tanaman untuk diperbanyak melalui metode kultur jaringan serta kombinasi ZPT terbaik agar pertumbuhan eksplan dapat sesuai dengan yang dibutuhkan.
Tujuan Penelitian
Penelitian ini bertujuan mengidentifikasi respon pertumbuhan tunas saninten terhadap pemberian 6-benzylaminopurine (BAP) dan indole-3-acetic-acid (IAA) dengan konsentrasi yang berbeda secara in vitro.
Manfaat Penelitian
Penelitian ini bermanfaat untuk memperoleh informasi mengenai pemberian ZPT BAP dan IAA dengan konsentrasi yang optimal untuk memacu pertumbuhan tunas saninten secara in vitro.
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan September 2015 sampai dengan April 2016. Penelitian dilakukan di laboratorium Kultur Jaringan Southeast Asian
Regional Center for Tropical Biology (SEAMEO BIOTROP).
Bahan
Bahan yang digunakan dalam penelitian ini adalah tunas pucuk saninten dari bibit berumur 2 tahun yang dipelihara di rumah kaca SEAMEO BIOTROP, kertas milimeter, tissue, dan plastik. Bahan kimia yang digunakan yaitu komponen media
3 dasar woody plant medium (WPM) (Lampiran 1), zat pengatur tumbuh (ZPT) berupa 6-benzylaminopurine (BAP) dan indole-3-acetic-acid (IAA). Bahan sterilan yaitu fungisida (bahan aktif: benomil 50.4%), bakterisida (bahan aktif: streptomisin sulfat 20%), desinfektan (bahan aktif: natrium hipoklorit 5.25%), tween 20, alkohol 70% dan aquades steril.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah botol kultur, gelas ukur, labu ukur, cawan petri, pipet, pipet bulb, sendok pengaduk, pemanas, gunting, pinset, pisau (scapel), bunsen, sprayer, pH meter, karet gelang, timbangan analitik (ketelitian 10-4), magnetic stirrer, magnetic stirring bars, oven, autoklaf, laminar
air flow cabinet (LAFC), ruang transfer/subkultur, dan ruang kultur.
Prosedur Penelitian Penyiapan bahan tanaman
Bibit saninten dipangkas untuk mendapatkan tunas sebagai bahan eksplan (Gambar 1). Tunas yang tumbuh diambil dengan cara digunting. Perawatan bibit dilakukan setiap dua hari sekali dengan menyemprot tanaman menggunakan larutan desinfektan pada pagi dan sore hari. Penyemprotan menggunakan larutan desinfektan (fungisida dan bakterisida) dengan konsentrasi masing-masing 2 g/L untuk meminimalkan kontaminasi fungi dan bakteri.
Gambar 1 Bagian tunas saninten sebagai sumber eksplan
Sterilisasi alat dan bahan
Alat dan bahan yang digunakan dalam penelitian harus dalam keadaan steril. Alat-alat logam (pinset dan scapel), cawan petri, botol kultur serta bahan seperti tissue dan kertas milimeter dibungkus kertas atau plastik kemudian disterilkan menggunakan autoklaf pada suhu 121 0C selama 15 menit. Setelah tahapan sterilisasi, alat-alat disimpan dalam oven dengan suhu 80 0C sampai alat tersebut
digunakan. Alat logam disterilisasi sesaat sebelum digunakan dengan mencelupkannya ke dalam alkohol 70% lalu dipanaskan di atas bunsen yang menyala untuk memperkecil kemungkinan adanya kontaminasi.
Sterilisasi lingkungan kerja
Kondisi lingkungan kerja pada laboratorium diharuskan untuk steril guna memperkecil kemungkinan adanya kontaminasi. Kegiatan penanaman eksplan dilakukan dalam LAFC yang sebelumnya telah disemprot alkohol 70% pada permukaan dan dindingnya. Tangan pekerja disterilisasi dengan menyemprotkan
4
alkohol 70%, menggunakan jas laboratorium dan masker selama di ruang kultur untuk menghindari kontaminasi yang berasal dari pekerja.
Penyediaan aquades steril
Air yang digunakan dalam penelitian merupakan air hasil penyulingan (destilasi) yang dilakukan oleh SEAMEO BIOTROP. Aquades dimasukkan ke dalam botol kaca bertutup, kemudian disterilkan dalam autoklaf pada suhu 121 0C selama 30 menit. Aquades steril kemudian disimpan dalam ruang transfer/subkultur sebelum nantinya digunakan untuk pembilasan eksplan dan pembuatan media tanam.
Pembuatan media
Media yang digunakan dalam kegiatan inisiasi awal tunas pucuk saninten ialah media WPM ditambah ZPT sitokinin (BAP 0.5 mg/L), sedangkan media perlakuan yang digunakan ialah media WPM dengan ditambah ZPT berupa sitokinin (BAP) dan auksin (IAA). Media perlakuan terdiri dari 9 kombinasi konsentrasi kedua ZPT, sehingga didapatkan 9 media perlakuan dengan masing-masing konsentrasi berbeda dapat dilihat pada Tabel 1.
Tabel 1 Kombinasi konsentrasi dua macam ZPT pada media perlakuan dalam media dasar WPM
Media perlakuan Konsentrasi zat pengatur tumbuh (mg/L)
6-benzylaminopurine (BAP) indole-3-acetic-acid (IAA)
A 0.0 0.0 B 0.5 0.0 C 1.0 0.0 D 0.0 0.1 E 0.5 0.1 F 1.0 0.1 G 0.0 0.2 H 0.5 0.2 I 1.0 0.2
Pembuatan media inisiasi awal dilakukan dengan menyiapkan aquades ±500 mL dimasukkan ke dalam labu ukur berukuran 1000 mL. Larutan bahan baku unsur hara makro, mikro, dan vitamin (Lampiran 1) dimasukkan ke dalam labu ukur menggunakan pipet sesuai konsentrasi yang ditetapkan. ZPT berupa BAP konsentrasi 0.5 mg/L dimasukkan ke dalam larutan. Sukrosa ditambahkan sebanyak 20 g ke dalam larutan, kemudian aquades ditambahkan hingga larutan mencapai 1000 mL. Selama pembuatan media, larutan diaduk di atas magnetic stirrer dengan memasukkan magnetic stirring bars ke dalam labu ukur agar larutan homogen. Setelah itu pH diatur hingga 5.7. Apabila larutan belum menunjukkan nilai pH tersebut, dilakukan penambahan beberapa tetes NaOH 0.1 M untuk menaikkan pH atau HCl 0.1 M untuk menurunkan pH. Setelah pH sesuai kemudian dimasukkan agar-agar (phytagel) sebanyak 2 g/L sebagai bahan pemadat media. Media dipanaskan hingga mendidih. Larutan media WPM kemudian dimasukkan ke dalam botol kultur sebanyak ±20 mL. Botol kultur yang sudah berisi media ditutup plastik yang direkatkan dengan karet. Botol kultur disterilisasi di dalam autoklaf pada suhu 121 0C selama 15 menit. Dalam pembuatan media perlakuan sama dengan
5 pembuatan media insiasi, hanya saja ditambahkan ZPT sesuai dengan kombinasi yang ada pada Tabel 1.
Sterilisasi eksplan dan penanaman eksplan
Eksplan berupa tunas muda yang masih berwarna merah keunguan disterilisasi melalui 2 tahap. Tahap pertama dilakukan di luar LAFC dengan 3 macam perendaman yang dilakukan secara berurutan, yaitu perendaman dalam 100 mL aquades ditambah 3 tetes tween 20 selama 30 menit, perendaman dalam larutan fungisida (benomil 50.4%) 2 g/L ditambah 3 tetes tween 20 selama 60 menit, dan perendaman dalam larutan bakterisida (streptomisin sulfat 20%) 2 g/L ditambah 3 tetes tween 20 selama 60 menit. Setiap tahap perendaman diikuti pembilasan dengan aquades sebanyak 3 kali. Tahap kedua dilakukan perendaman dengan desinfektan berupa larutan natrium hipoklorit (NaOCl 5.25%) di dalam LAFC. Perendaman eksplan dengan NaOCl 5.25% dilakukan dengan 4 macam metode perendaman seperti yang disajikan pada Tabel 2.
Tabel 2 Perbandingan prosedur metode sterilisasi pada kultur tunas saninten Metode Konsentrasi NaOCl 5.25%* (%) Lama perendaman (menit)
1 15 15
2 15 10
3 10 15
4 10 10
* Larutan NaOCl 5.25% dicampur dengan 3 tetes tween 20.
Eksplan yang sudah melalui tahap sterilisasi ditanam (diinisiasi) dalam media WPM dengan ZPT BAP 0.5 mg/L. Pengamatan terhadap efektivitas metode sterilisasi dilakukan selama 1 bulan dengan waktu pengamatan setiap minggu. Peubah yang diamati meliputi eksplan terkontaminasi (fungi, bakteri, fungi dan bakteri), mati dan steril. Setiap peubah dihitung dengan cara:
Persentase eksplan kontaminasi = Σ eksplan terkontaminasi × 100% Σ eksplan tanam
Persentase eksplan mati = Σ eksplan mati × 100% Σ eksplan tanam
Persentase eskplan steril = 100% - (% kontaminasi + % mati)
Pemindahan eksplan ke media perlakuan
Eksplan steril yang telah diinisiasi dalam media WPM dengan BAP 0.5 mg/L kemudian diinduksi ke dalam media perlakuan. Percobaan dilakukan dengan menggunakan rancangan acak lengkap (RAL) faktorial, dengan 2 faktor yaitu macam ZPT dan konsentrasi ZPT. Macam ZPT terdiri atas 2 taraf yaitu BAP dan IAA. Konsentrasi ZPT terdiri atas 3 taraf yaitu BAP dan IAA 0 mg/L, BAP 0.5 mg/L atau IAA 0.1 mg/L, dan BAP 1.0 mg/L atau IAA 0.2 mg/L. Masing-masing perlakuan memiliki 4 ulangan dengan 2 unit amatan pada setiap ulangan. Model statistika yang digunakan ialah sebagai berikut:
Yijk = μ + αi + βj + (αβ)ij + ε ijk
Yijk = Nilai pengamatan unit percobaan pada taraf perlakuan macam ZPT ke-i, konsentrasi ZPT ke-j, dan ulangan ke-k
6
αi = Pengaruh macam ZPT ke-i βj = Pengaruh konsentrasi ZPT ke-j
(αβ)ij = Pengaruh interaksi antara perlakuan macam ZPT ke-i dan konsentrasi ZPT ke-j
εijk = Galat acak percobaan pada faktor macam ZPT taraf ke-i, faktor konsentrasi ZPT taraf ke-j, dan ulangan ke-k
i = Taraf macam ZPT (BAP dan IAA)
j = Taraf konsentrasi ZPT (BAP dan IAA 0 mg/L, BAP 0.5 mg/L atau IAA 0.1 mg/L, dan BAP 1.0 mg/L atau IAA 0.2 mg/L)
k = Ulangan (1, 2, … dan n)
Hipotesis yang diajukan dalam penelitian ini adalah: H0
H1
= =
Macam ZPT tidak memberikan pengaruh terhadap pertumbuhan eksplan.
Macam ZPT memberikan pengaruh terhadap pertumbuhan eksplan. H0 H1 H0 H1 = = = =
Konsentrasi ZPT tidak memberikan pengaruh terhadap pertumbuhan eksplan.
Konsentrasi ZPT memberikan pengaruh terhadap pertumbuhan eksplan.
Tidak terdapat interaksi antara penambahan macam ZPT dan konsentrasi ZPT terhadap pertumbuhan eksplan.
Terdapat interaksi antara penambahan macam ZPT dan konsentrasi ZPT terhadap pertumbuhan eksplan.
Pengambilan keputusan berdasarkan sidik ragam yakni: (1) tolak H0 jika nilai F hitung > F tabel, (2) terima H0 jika F hitung < F tabel.
Pemeliharaan
Botol kultur disimpan dalam rak pada ruang kultur dengan suhu udara 22−25
0C dan diletakkan di bawah lampu fluorescent 36−40 watt sebanyak 1 buah.
Lamanya penyinaran lampu diatur 16 jam menyala dan 8 jam padam.
Pertumbuhan tunas saninten
Pertumbuhan dan perkembangan eksplan kemudian diamati selama 8 minggu setelah tanam (MST). Peubah yang diukur di antaranya:
Waktu munculnya tunas. Pengamatan dilakukan setiap hari dengan melihat
perkembangan kemunculan tunas pada eksplan.
Jumlah tunas. Jumlah tunas dihitung pada saat akhir pengamatan yaitu pada
8 MST dengan cara menghitung jumlah tunas yang terbentuk.
Tinggi tunas. Tinggi tunas diukur dari selisih tinggi tunas pada akhir
pengamatan dengan tinggi tunas saat masuk media perlakuan. Pengukuran dilakukan menggunakan kertas milimeter yang diletakan di bawah cawan petri.
Waktu munculnya kalus. Pengamatan dilakukan setiap hari dengan melihat
perkembangan kemunculan kalus pada eksplan.
Ukuran kalus. Penetapan skor pada eksplan berkalus dilakukan berdasarkan
7 Tabel 3 Kriteria penetapan skor pada eksplan berkalus
Skor Kriteria
0 Eksplan hidup namun tidak membentuk kalus
1 Eksplan membentuk sangat sedikit kalus (bagian eksplan yang tertanam media menggembung hingga belah)
2 Eksplan membentuk kalus yang sedikit (terdapat bulatan kalus dengan diameter < 0.5 cm)
3 Eksplan membentuk kalus sedang (kalus muncul berbentuk remah dengan diameter kalus > 0.5−1.0 cm)
4 Eksplan membentuk kalus banyak (kalus muncul dengan diameter > 1.0 cm) 5 Eksplan membentuk kalus sangat banyak (kalus membentuk organ atau
plantlet)
Pengaruh perlakuan yang dicobakan terhadap data yang menggunakan skor dianalisis dengan menggunakan statistik non parametrik Kruskal-Wallis (Sugito 2006). Rumus yang digunakan adalah sebagai berikut:
𝐻 = 12 𝑁 + (𝑁 + 1)+ ( 𝑅12 𝑛1+ 𝑅22 𝑛2+ 𝐾 + 𝑅𝑘2 𝑛𝑘) − 3 (𝑁 + 1) keterangan:
N = jumlah total pengamatan di seluruh sampel
k = jumlah kategori sampel dalam pengujian
Rk = jumlah peringkat dalam sample ke-k
nk = ukuran sampel ke-k
Analisis Data
Data yang diperoleh dari pengamatan diuji dengan analisis ragam (uji F). Perbedaan yang berpengaruh nyata pada uji F diuji lanjut dengan menggunakan
Duncan Multiple Range Test (DMRT) pada taraf kesalahan 5%. Pengolahan data
dilakukan dengan menggunakan software SPSS (Statistical Package for Social
Sciences).
HASIL DAN PEMBAHASAN
Hasil Sterilisasi Eksplan
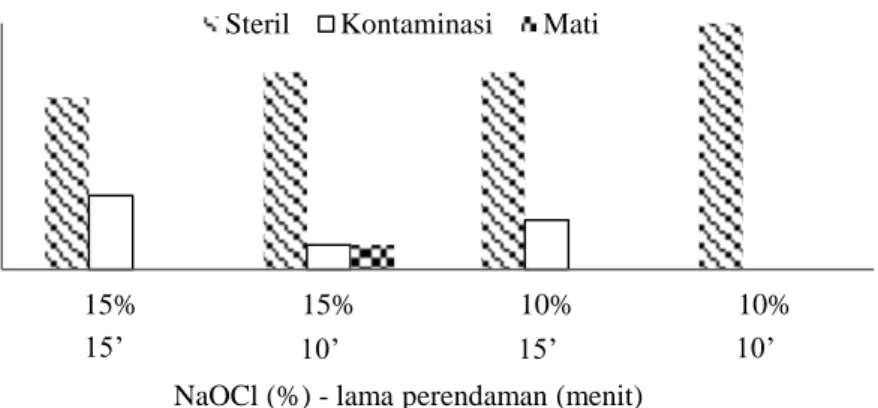
Pengamatan terhadap efektivitas metode sterilisasi dilakukan selama 4 minggu setelah tanam (MST). Tingkat kontaminasi dari metode perendaman eksplan dengan desinfektan (NaOCl 5.25%) konsentrasi 10% selama 10 menit menghasilkan eksplan steril tertinggi, yaitu 100% eksplan steril. Namun dalam pemilihan metode sterilisasi berikutnya, metode ini tidak dipilih karena setelah 4 MST terjadi perubahan kondisi eksplan berupa munculnya kontaminan pada beberapa eksplan. Hasil perbandingan metode sterilisasi eksplan pucuk saninten disajikan pada Gambar 2.
8
Gambar 2 Pengaruh metode sterilisasi terhadap eksplan saninten steril yang dihasilkan pada 4 MST
Metode sterilisasi dengan desinfektan (NaOCl 5.25%) konsentrasi 15% selama 15 dan 10 menit mampu menghasilkan eksplan steril yang cukup tinggi, namun kedua metode sterilisasi ini tidak dipilih dalam menentukan metode sterilisasi berikutnya. Hal tersebut dikarenakan pada perendaman eksplan dengan desinfektan (NaOCl 5.25%) konsentrasi 15% didapatkan eksplan steril namun mengalami pencoklatan (browning). Oleh sebab itu, penggunaan desinfektan (NaOCl 5.25%) konsentrasi 15% selama 15 dan 10 menit tidak dipilih untuk melakukan metode sterilisasi berikutnya.
Selain konsentrasi desinfektan (NaOCl 5.25%) yang tinggi, penggunaan alkohol dalam proses sterilisasi eksplan pucuk saninten juga tidak dilakukan. Perendaman eksplan pucuk saninten dengan alkohol 70% selama 1 menit saat sterilisasi pada percobaan pendahuluan didapatkan hasil sebesar 100% eksplan mengalami browning. Eksplan yang mengalami browning tersebut akhirnya mati setelah 4 MST. Dengan demikian, pada penelitian ini metode sterilisasi terbaik yang diterapkan untuk mendapatkan eksplan steril ialah metode perendaman eksplan dengan desinfektan (NaOCl 5.25%) konsentrasi 10% selama 15 menit.
Hasil sterilisasi metode perendaman dengan desinfektan (NaOCl 5.25%) konsentrasi 10% selama 15 menit disajikan pada Tabel 4.
Tabel 4 Hasil sterilisasi eksplan saninten dengan perendaman desinfektan (NaOCl 5.25%) konsentrasi 10% selama 15 menit pada 4 MST
Sterilisasi* Jumlah eksplan
Kondisi eksplan (%)
Steril Kontaminasi Mati
1 19 84.21 15.79 0.00
2 49 44.90 55.10 0.00
3 24 54.17 41.67 4.17
4 12 33.33 66.67 0.00
* Sterilisasi dilakukan pada waktu yang berbeda. Eksplan steril kemudian digunakan pada perlakuan berikutnya.
Hasil pengamatan fase inisiasi selama 4 MST didapatkan kondisi eksplan berupa eksplan steril, eksplan terkontaminasi dan eksplan mati. Persentase eksplan steril yang didapatkan berkisar antara 33.33% hingga 84.21% (Tabel 4). Adanya kontaminasi pada eksplan saninten disebabkan oleh mikroorganisme berupa fungi dan bakteri. Munculnya kontaminasi akibat fungi dan bakteri diduga terjadi akibat proses sterilisasi yang kurang optimal. Waktu munculnya kontaminan pada eksplan
0% 20% 40% 60% 80% 100% 15% 15% 10% 10% Ko n d is i ek sp lan ( %)
NaOCl (%) - lama perendaman (menit) Steril Kontaminasi Mati
9
Gambar 4 Kondisi eksplan saninten: (a) eksplan terkontaminasi fungi, (b) kontaminasi fungi pada media, (c) eksplan terkontaminasi bakteri, dan (d) eksplan mati akibat browning
berbeda-beda, namun umumnya terjadi ketika 3 hari setelah tanam. Jenis kontaminan yang paling mendominasi dalam penelitian ini ialah kontaminan oleh fungi dengan persentase kontaminasi sebesar 30.77%. Persen kontaminasi oleh bakteri sebesar 14.42%, sedangkan persen kontaminasi oleh fungi dan bakteri hanya sebesar 0.96% (Gambar 3).
Gambar 3 Jenis kontaminan pada fase inisiasi tunas saninten selama 4 MST
Keberadaan kontaminan fungi ditandai dengan kemunculan hifa yang tumbuh pada bagian pangkal ataupun tubuh eksplan. Hifa fungi tersebut bahkan dapat menyebar hingga ke seluruh bagian permukaan eksplan (Gambar 4a). Kontaminan fungi juga dapat muncul dari media tanam (Gambar 4b). Kontaminasi akibat bakteri ditandai dengan keberadaan lendir berwarna putih susu hingga pink muda pada pangkal eksplan ataupun pada permukaan media (Gambar 4c). Selain kontaminan akibat fungi dan bakteri, terdapat pula kematian eksplan akibat browning (Tabel 4). Eksplan yang mengalami browning tersebut memperlihatkan tanda-tanda kemunduran fisiologis dan akhirnya menjadi mati pada 4 MST (Gambar 4d).
30.77 14.42 0.96 0 5 10 15 20 25 30 35
Fungi Bakteri Fungi dan Bakteri
Ko n tam in asi (%) Jenis kontaminan b a d c
10
Gambar 5 Pertumbuhan tunas pada eksplan saninten dalam media WPM pada umur 8 MST: (a) konsentrasi BAP 0.5 mg/L dan (b) konsentrasi BAP 1 mg/L
Pertumbuhan Tunas
1. Jumlah Tunas
Eksplan steril hasil inisiasi disubkultur ke media induksi. Eksplan saninten yang diinduksikan ke dalam media perlakuan menunjukkan respon berupa kemunculan tunas (Tabel 5).
Tabel 5 Pengaruh BAP dan IAA pada media induksi (WPM) terhadap kemunculan tunas saninten pada umur 8 MST
BAP (mg/L) IAA (mg/L) Rentang waktu pertunasan (HST) Eksplan bertunas (%) Rentang jumlah tunas 0.0 0.0 0 0.0 0 0.5 0.0 14−42 37.5 0−8 1.0 0.0 14−28 25.0 0−3 0.0 0.1 7−10 25.0 0−2 0.5 0.1 7−14 25.0 0−2 1.0 0.1 7−14 25.0 0−2 0.0 0.2 0 0.0 0 0.5 0.2 10−14 25.0 0−3 1.0 0.2 10 12.5 0−3
Berdasarkan pengamatan, pada penelitian ini hampir seluruh perlakuan mampu menghasilkan tunas, kecuali pada media tanpa ZPT (kontrol) dan media WPM dengan IAA 0.2 mg/L (Tabel 5). Kemunculan tunas tercepat dimulai pada waktu 7 HST, dan waktu kemunculan tunas paling lama terjadi pada 42 HST. Kemunculan tunas ditandai dengan munculnya tunas aksilar pada eksplan (Gambar 5).
Hasil analisis ragam jumlah tunas saninten pada umur 8 MST menunjukkan bahwa faktor jenis ZPT, konsentrasi ZPT dan interaksi keduanya tidak berpengaruh nyata terhadap jumlah tunas yang terbentuk (Lampiran 2). Tabel 5 menunjukkan bahwa persentase eksplan bertunas tertinggi sebesar 37.5% hanya terjadi dalam media WPM dengan BAP 0.5 mg/L, sedangkan dalam media kombinasi BAP (0.5−1 mg/L) dan IAA (0.1−0.2 mg/L) menghasilkan persentase bertunas yang hampir sama yaitu 12.5% hingga 25%. Jumlah tunas tertinggi yang dihasilkan sebesar 8 tunas, terjadi pada media WPM dengan BAP 0.5 mg/L.
b a
11 2. Tinggi Tunas
Hasil analisis ragam jumlah tunas saninten pada umur 8 MST menunjukkan bahwa faktor jenis ZPT, konsentrasi ZPT dan interaksi keduanya tidak berpengaruh nyata terhadap pertambahan tinggi eksplan tunas saninten (Lampiran 3). Pada penelitian ini, pertambahan tinggi tunas saninten tidak terjadi pada semua eksplan.
Gambar 7 Kondisi eksplan pada umur 8 MST dalam media WPM: (a) tanpa ZPT dan (b) BAP 0.5 mg/L
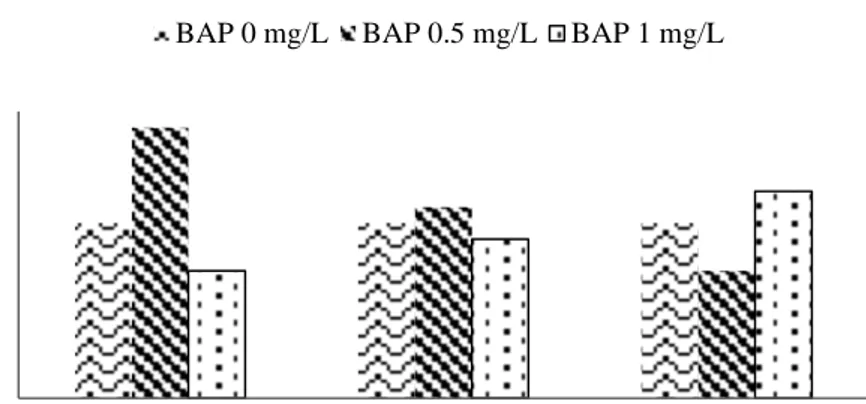
Gambar 6 memperlihatkan respon pertambahan tinggi tunas saninten pada 9 perlakuan yang diterapkan. Perlakuan media WPM BAP 0 mg/L dengan IAA pada berbagai konsentrasi (0, 0.1, 0.2 mg/L) menghasilkan pertambahan tinggi tunas yang sama, yaitu sebesar 1.1 mm. Perlakuan media WPM BAP 0.5 mg/L yang dikombinasikan dengan IAA pada berbagai konsentrasi (0, 0.1, 0.2 mg/L) menghasilkan pertambahan tinggi tunas yang semakin menurun seiring dengan penambahan konsentrasi IAA. Respon sebaliknya terjadi pada perlakuan media WPM dengan ZPT BAP 1 mg/L yang dikombinasikan dengan IAA pada berbagai konsentrasi (0, 0.1, 0.2 mg/L), terjadi peningkatan pertambahan tinggi tunas seiring dengan penambahan konsentrasi IAA. Hasil penelitian menunjukkan bahwa perlakuan terbaik dalam menghasilkan pertambahan tinggi tunas terjadi pada perlakuan media WPM dengan ZPT BAP 0.5 mg/L dengan nilai sebesar 1.7 mm (Gambar 7b). Pada penelitian ini, terdapat beberapa eksplan yang tidak memperlihatkan pertumbuhan tinggi tunas seperti pada Gambar 7a.
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 0 0.1 0.2 P er tam b ah an tin g g i (m m ) Konsentrasi IAA (mg/L)
BAP 0 mg/L BAP 0.5 mg/L BAP 1 mg/L
Gambar 6 Pertambahan tinggi tunas saninten dalam media WPM dengan kombinasi ZPT BAP (0, 0.5, 1 mg/L) dan IAA (0, 0.1, 0.2 mg/L) pada umur 8 MST
b a
12
Gambar 8 Kondisi kalus pada umur 8 MST: (a) eksplan berkalus dalam media WPM IAA 0.1 mg/L, (b-c) kalus berdiferensiasi menjadi akar dalam media WPM IAA 0.1 mg/L (d) eksplan berkalus pada media WPM + BAP 1 mg/L + IAA 0.1 mg/L, dan (e-f) eksplan berkalus pada WPM IAA 0.2 mg/L
Pertumbuhan Kalus
Hasil analisis Kruskal-Wallis terhadap skor berupa kemunculan kalus pada eksplan tunas saninten pada 8 MST menunjukkan hasil yang tidak berpengaruh nyata (Lampiran 4). Selama 8 MST terdapat beberapa kondisi kultur antara lain munculnya kalus, kematian kultur, dan kontaminasi (Tabel 6).
Tabel 6 Pengaruh BAP dan IAA pada media induksi (WPM) terhadap kemunculan kalus, kematian eksplan dan kontaminasi eksplan pada umur 8 MST BAP (mg/L) IAA (mg/L) Rentang waktu kemunculan kalus (HST) Eksplan berkalus (%) Eksplan mati (%) Eksplan terkontaminasi (%) 0.0 0.0 0 0.0 0.0 25.0 0.5 0.0 10−48 37.5 12.5 0.0 1.0 0.0 10−48 37.5 12.5 25.0 0.0 0.1 10−32 50.0 0.0 25.0 0.5 0.1 14−48 50.0 25.0 12.5 1.0 0.1 14−48 62.5 12.5 0.0 0.0 0.2 10−48 75.0 0.0 12.5 0.5 0.2 14 25.0 12.5 12.5 1.0 0.2 10−49 50.0 12.5 12.5
Respon kalus pada eksplan tunas saninten muncul hampir pada seluruh perlakuan media induksi. Hanya pada media tanpa ZPT (kontrol) respon kalus tidak terjadi. Kalus umumnya muncul pada 10 dan 14 HST. Rentang waktu kemunculan kalus pada eksplan saninten cukup lama yaitu 10−49 HST, seperti yang terjadi pada media WPM dengan BAP 1.0 mg/L + IAA 0.2 mg/L (Tabel 6).
a b c
13 Pesentase eksplan berkalus tertinggi terjadi pada media WPM dengan IAA 0.2 mg/L (Tabel 6). Pada media tersebut umumnya tumbuh kalus pada eksplan dengan kualitas kalus kompak berwarna kuning kehitaman (Gambar 8e, 8f). Media WPM + BAP 1 mg/L + IAA 0.1 mg/L memiliki persentase eksplan berkalus kedua tertinggi setelah media WPM dengan IAA 0.2 mg/L, yaitu sebesar 62.5%. Namun kualitas kalus yang baik hanya terjadi pada satu eksplan (Gambar 8d). Selain pada media WPM dengan IAA 0.2 mg/L, eksplan berkalus dengan persentase yang cukup besar dan memiliki kualitas kalus yang baik terjadi pada media WPM dengan IAA 0.1 mg/L. Pada media WPM dengan IAA 0.1 mg/L, terdapat satu eksplan dengan kalus yang berdiferensiasi menjadi akar (Gambar 8b). Eksplan tersebut kemudian memperlihatkan perubahan tunas yang menghitam seiring dengan perkembangan kalus menjadi akar (Gambar 8c).
Gambar 9 Perubahan eksplan: (a) zat fenolik pada eksplan umur kultur 1 MST, (b) kematian eksplan umur kultur 8 MST
Kematian eksplan pada penelitian ini dicirikan dengan adanya zat fenolik berupa cairan berwarna coklat yang keluar dari bagian tunas (Gambar 9a) sehingga menyebabkan warna tunas yang hijau berubah menjadi coklat lalu menghitam. Eksplan tersebut kemudian mengalami kematian pada umur kultur 8 MST (Gambar 9b). Selain kematian eksplan, terjadi kontaminasi pada beberapa kultur yang diakibatkan oleh fungi dan bakteri. Kontaminasi akibat fungi dan bakteri berasal dari bagian eksplan maupun media.
Pembahasan
Kultur jaringan tanaman merupakan metode untuk mengisolasi bagian tanaman seperti sel, sekelompok sel, jaringan atau organ, serta membudidayakannya dalam lingkungan yang terkendali (secara in vitro) dan aseptik, sehingga bagian tanaman tersebut dapat beregenerasi menjadi tanaman lengkap kembali (Sulistiani dan Yani 2012). Kultur jaringan dikembangkan berdasarkan teori totipotensi sel oleh Schwann dan Schleiden tahun 1838 yang menyatakan bahwa setiap sel merupakan suatu satuan otonomi dan mempunyai kemampuan untuk beregenerasi menjadi tanaman lengkap kembali (Zulkarnain 2009). Kegiatan dalam kultur jaringan dimulai dengan tahap sterilisasi bahan tanam (eksplan), inisiasi eksplan, induksi dan multiplikasi, kemudian dilakukan tahap aklimatisasi atau pengakaran (Hendaryono dan Wijayani 2012).
Sterilisasi eksplan merupakan langkah awal yang menentukan keberhasilan penanaman secara in vitro. Proses sterilisasi eksplan dilakukan untuk menghilangkan sumber kontaminan yang tidak diinginkan dengan gangguan seminimal mungkin pada eksplan. Secara garis besar terdapat ketentuan umum
14
untuk proses sterilisasi, namun secara spesifik metode sterilisasi yang paling tepat akan diperoleh dari trial and error (Zulkarnain 2009). Lestari (2008) menyatakan bahwa kegiatan sterilisasi biasanya dilakukan dengan cara merendam eksplan dalam larutan kimia sistemik pada konsentrasi dan waktu perendaman tertentu.
Metode sterilisasi eksplan pucuk saninten dilaksanakan menggunakan bahan sterilan berupa fungisida, bakterisida dan desinfektan. Dalam penelitian ini, desinfektan yang digunakan berupa larutan natrium hipoklorit (NaOCl 5.25%). Berdasarkan konsentrasi dan waktu perendaman eksplan dalam larutan NaOCl 5.25%, metode perendaman eksplan dalam larutan NaOCl 5.25% konsentrasi 10% selama 15 menit lebih baik karena mampu menghasilkan eksplan steril yang stabil kondisinya setelah 4 MST serta kematian eksplan akibat browning yang rendah (0.96%). Persentase eksplan steril tertinggi dari hasil sterilisasi menggunakan metode ini sebesar 84.21% dan eksplan steril terendah sebesar 33.33%. Pada sterilisasi eksplan tembesu (Fagraea fragrans Roxb) oleh Ardiansyah (2014), penggunaan larutan NaOCl 0.5% selama 15 dan 20 menit menghasilkan eksplan tembesu steril sebesar 26.67% dan 33.33%, sedangkan perendaman eksplan tembesu dalam larutan NaOCl 0.5% selama 5 dan 10 menit mengalami kontaminasi fungi dan bakteri sebesar 100%. Kondisi tersebut menunjukkan bahwa konsentrasi yang tepat dari bahan sterilan dan pemilihan waktu lamanya eksplan terpapar bahan sterilan mampu meminimalkan kerusakan eksplan dan menjaga peluang hidup eksplan.
Adanya kontaminan pada eksplan hasil sterilisasi diduga disebabkan oleh proses sterilisasi yang kurang optimal. Zulkarnain (2009) menyatakan bahwa sumber kontaminasi mikroorganisme pada sistem kultur jaringan dapat berasal dari beberapa faktor, seperti faktor medium dan alat yang tidak sempurna sterilisasinya, lingkungan kerja yang kurang steril, eksplan, dan pekerjaan yang kurang teliti. Pada kultur eksplan saninten, kontaminasi tetap terjadi dengan persentase kontaminasi tertinggi disebabkan oleh fungi sebesar 30.77%. Hal serupa juga terjadi pada penelitian yang dilakukan oleh Khairunisa (2009), kontaminasi terbesar dalam inisiasi tunas binahong (Anredera cordifolia [Ten.] Steenis) disebabkan oleh fungi. Sumber kontaminasi pada eksplan juga dapat disebabkan oleh kontaminan yang berasal dari dalam jaringan tanaman sehingga tidak dapat dihilangkan hanya dengan sterilisasi permukaan, seperti adanya bakteri endofit pada jaringan tanaman (Zulkarnain 2009). Adanya penyerapan unsur hara dari media oleh eksplan, akan mendorong bakteri endofit dalam jaringan tanaman terbawa keluar dan berkembang pada media. Kondisi lingkungan in vitro dengan unsur hara dan sukrosa dalam jumlah besar, kelembaban yang tinggi, dan suhu yang hangat dapat mendorong pertumbuhan mikroorganisme dengan cepat (Zulkarnain 2009), sehingga akan mengganggu pertumbuhan dan perkembangan eksplan hingga menyebabkan kematian.
Kondisi morfologi tunas saninten yang berbulu cukup menyulitkan proses sterilisasi sehingga dilakukan pemeliharaan bibit melalui penyemprotan fungisida dan bakterisida untuk mengurangi keberadaan sumber kontaminan pada permukaan tanaman. Selain itu, pemangkasan berulang pada tunas pucuk diterapkan dalam pemeliharaan bibit agar didapatkan sumber eksplan dari jaringan muda (juvenile). Pemangkasan berulang merupakan solusi untuk mendapatkan bagian muda dari tanaman berkayu yang umumnya memiliki regenerasi yang lambat (Lestari 2008).
15 Teknik perbanyakan kultur jaringan yang diterapkan dalam penelitian ini dilaksanakan melalui kultur tunas. Menurut Sulistiani dan Yani (2012), kultur tunas merupakan perbanyakan tanaman dengan cara merangsang pertumbuhan (proliferasi) tunas aksiler atau lateral yang sudah ada pada eksplan. Inisiasi eksplan saninten berupa bagian apeks dengan satu ruas daun pertama dalam media pre-kondisi WPM dengan BAP 0.5 mg/L ternyata mampu memunculkan tunas aksilar. Tunas aksilar tersebut tumbuh sebagai respon pemanjangan tunas ketiak pada eksplan. Sandra (2013) menyatakan bahwa eksplan dari jaringan muda mempunyai daya regenerasi yang lebih tinggi dibandingkan dengan jaringan tanaman yang lebih tua sehingga menjadi bagian penting dalam pemilihan eksplan.
Saninten merupakan jenis tanaman berkayu, sehingga dalam penelitian ini media yang digunakan ialah media WPM. Media WPM digunakan dalam perbanyakan in vitro jati oleh Suhartati dan Nursyamsi (2007) dan karet (Hevea
brasiliensis Muel.Arg) oleh Sundari et al. (2015). Kandungan sulfat dalam media
WPM lebih tinggi dibandingkan kandungan sulfat pada media MS (Alfian 2014), berfungsi untuk merangsang pembentukan tunas dan akar, serta pembentukan klorofil. Selain media dan jenis eksplan yang digunakan, penambahan ZPT juga berpengaruh pada keberhasilan kultur jaringan (Herawan et al. 2014). Zat pengatur tumbuh merupakan senyawa organik yang dalam jumlah sedikit dapat merangsang, menghambat, dan mengubah proses fisiologi tumbuhan.
Pemindahan eksplan steril hasil inisiasi ke media induksi dengan penambahan ZPT bertujuan untuk memperbanyak atau menggandakan tunas. Eksplan saninten dalam media WPM tanpa ZPT (kontrol) dan media WPM dengan IAA 0.2 mg/L tidak menghasilkan tunas. Pada media kontrol, tidak adanya kandungan ZPT eksogen yang ditambahkan ke dalam media membuat eksplan tidak mampu memproduksi tunas. Kondisi tersebut memperlihatkan bahwa secara fisiologis kandungan sitokinin endogen dalam eksplan sangat rendah. Pada media WPM dengan IAA 0.2 mg/L, tidak adanya kemunculan tunas dapat disebabkan oleh dominasi ZPT auksin eksogen yang mengalahkan kerja sitokinin endogen pada eksplan. Hendaryono dan Wijayani (2012) menyatakan bahwa pembentukan tunas akan terjadi ketika konsentrasi sitokinin lebih tinggi dari auksin.
Keseimbangan antara auksin dan sitokinin sangat penting dalam menginduksi tunas karena masing-masing zat tersebut mempunyai peranan dalam menginduksi tunas (Hendaryono dan Wijayani 2012). Media dengan kombinasi BAP (0.5−1 mg/L) dan IAA (0.1−0.2 mg/L) menghasilkan persentase bertunas dan jumlah tunas yang hampir sama. Kondisi tersebut dapat terjadi karena belum tercapainya keseimbangan konsentrasi BAP dan IAA yang ditambahkan ke dalam media untuk memunculkan tunas pada eksplan saninten. Hasil yang berbeda terjadi pada penelitian: (1) induksi tunas kemenyan (Styrax benzoine) oleh Jayusman (2006) menunjukkan bahwa konsentrasi BAP 1 ppm dan NAA 0.01 ppm memberikan respon terbaik dalam induksi tunas, (2) inisiasi dan multiplikasi jarak pagar (Jatropha curcas) secara in vitro oleh Theodora (2010), konsentrasi BAP 0.10 mg/L dan IAA 0.01 mg/L mampu menghasilkan tinggi tunas dan jumlah tunas terbaik.
Selain kemunculan tunas, pertambahan tinggi tunas pada eksplan yang dikulturkan dapat menunjukkan potensi morfogenesis dan kemampuan adaptasi tumbuhan terhadap lingkungannya, serta kapasitas pertumbuhan eksplan (Prihartini 2004). Pada penelitian ini, respon pertambahan tinggi tunas yang dihasilkan pada berbagai perlakuan belum menunjukkan hasil yang optimal. Hal tersebut
16
dikarenakan adanya eksplan yang tidak mengalami pertambahan tinggi pada umur 8 MST. Pada beberapa jenis tanaman dengan pertumbuhan lambat (slow growing), sifat pertumbuhan alami tanaman dapat mempengaruhi keberhasilan kutur in vitro, seperti yang terjadi pada kultur tanaman kulim (Scorodocarpus borneensis Becc.) (Yelnitis dan Joni 2015).
Media WPM dengan BAP tunggal mengalami penurunan tinggi tunas ketika konsentrasi BAP meningkat menjadi 1 mg/L. Pada perbanyakan gaharu, kondisi serupa terjadi akibat periode inkubasi terlalu lama (12 MST) pada media yang mengandung sitokinin sehingga menyebabkan perpanjangan tunas terhambat (Azwin et al. 2006). Pada induksi biji manggis (Harahap et al. 2014) penggunaan BAP terlalu tinggi sebesar 10 mg/L menghasilkan pertumbuhan tunas yang kerdil.
Media WPM dengan BAP 0.5 mg/L merupakan media dengan persentase bertunas, jumlah tunas dan pertambahan tinggi tunas paling baik. Konsentrasi BAP 0.5 mg/L merupakan konsentrasi ZPT yang digunakan pada media pre-kondisi awal (inisiasi). Kemungkinan eksplan tunas saninten sudah adaptif dengan kandungan ZPT BAP 0.5 mg/L sehingga mampu menghasilkan kondisi pertunasan dan pertambahan tinggi tunas paling baik. Menurut Gunawan (1992), terkadang eksplan dapat memiliki kemampuan tumbuh dan multiplikasi sel tanpa pemberian auksin ketika telah lama dipelihara dan disubkultur beberapa kali. Kemungkinan besar dalam sel-sel tersebut telah terjadi peningkatan level auksin, sehingga tidak memerlukan auksin dari luar. Sel-sel demikian disebut sel-sel yang habituated.
Respon yang diperlihatkan pada kultur saninten lainnya ialah kemunculan kalus pada eksplan. Kalus merupakan suatu kumpulan sel amorphous (tidak berbentuk atau belum terdiferensiasi) yang terjadi dari sel-sel jaringan awal yang membelah diri secara terus menerus. Beberapa kultur pada semua perlakuan dapat memunculkan kalus pada umur 8 MST, kecuali pada media tanpa ZPT (kontrol). Pembentukan kalus tidak terjadi dalam media kontrol disebabkan oleh tidak adanya ZPT auksin eksogen pada media, sehingga sel tidak terpacu untuk membentuk kalus. Kondisi serupa terjadi pada inisiasi daun Eucalypus pellita oleh Herawan et al. (2014) yang menghasilkan kalus terendah pada media MS tanpa penambahan Dicamba (0 ppm).
Waktu awal munculnya kalus terjadi pada 10−14 HST hampir terjadi pada seluruh perlakuan. Namun terdapat pula eksplan berkalus pada 32−49 HST. Pada waktu tersebut diduga eksplan telah merespon kerja auksin yang ditambahkan ke dalam media perlakuan. Pada eksplan saninten, munculnya kalus pada beberapa eksplan diawali dengan menggembungnya bagian eksplan yang tertanam pada media. Bagian eksplan tersebut kemudian membelah dan memunculkan kalus. Namun pada beberapa eksplan, kalus muncul secara langsung pada pangkal eksplan berupa bulatan kecil berwarna kuning (Gambar 8a). Akumulasi kalus pada eksplan semakin besar seiring dengan lamanya waktu eksplan berada pada media. Kondisi tersebut memperlihatkan bahwa sel terus mengalami pembelahan.
Media WPM dengan IAA 0.2 mg/L merupakan media perlakuan dengan persentase eksplan berkalus yang tinggi, yaitu 6 dari 8 eksplan mampu menunjukkan respon berkalus. Respon persentase berkalus yang tinggi pada media WPM dengan ZPT IAA tunggal (0.1−0.2 mg/L) membuktikan bahwa kultur tunas saninten dengan penambahan auksin tunggal hanya mampu menghasilkan eksplan berkalus. Hal ini sesuai dengan pernyataan Lestari (2011), pada umumnya auksin
17 digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, yaitu dengan memacu pemanjangan dan pembelahan sel.
Hingga akhir pengamatan, kalus yang terbentuk pada seluruh perlakuan (kecuali kontrol) belum mampu berdiferensiasi menjadi tunas. Diferensiasi kalus yang terjadi pada penelitian ini hanya membentuk organ berupa akar, yaitu pada satu eksplan dalam media WPM dengan IAA 0.1 mg/L (Gambar 8b, 8c). Penggunaan konsentrasi NAA secara tunggal dalam pertumbuhan dan perkembangan tunas kina (Cinchona succirubra) oleh Riyadi dan Tahardi (2005) menghasilkan pengakaran yang lebih rendah dibandingkan dengan kombinasi NAA dan IBA masing-masing konsentrasi 0.05 mg/L. Begitupun pada induksi perakaran manggis dalam media MS ½ N + IBA 3 mg/L + NAA 4 mg/L (Harahap et al. 2014) merupakan media terbaik dalam menghasilkan perakaran pada plantlet. Pada penelitian ini, pengakaran justru terjadi pada perlakuan media dengan ZPT IAA tunggal. Alfian (2014) menyatakan bahwa pembentukan akar merupakan salah satu fase penting pada tahap in vitro karena akar memiliki peranan penting dalam penyerapan nutrisi dari media. Proses pengakaran saninten pada metode perbanyakan vegetatif melalui stek pucuk yang telah dilakukan oleh Fitria (2015), hanya mampu menghasilkan stek berakar yang rendah, yaitu dengan persentase 40.56% saja. Adanya kalus yang mampu berdiferensiasi menjadi akar dalam perbanyakan saninten secara in vitro dapat menjadi peluang untuk melakukan pengakaran secara in vitro pada penelitian selanjutnya.
Penggunaan kombinasi ZPT BAP (0, 0.5, 1 mg/L) dan IAA (0, 0.1, 0.2 mg/L) untuk menggandakan tunas dalam penelitian ini menunjukkan hasil yang belum optimal. Keseimbangan konsentrasi ZPT sitokinin dan auksin yang digunakan belum memperlihatkan pertumbuhan tunas yang optimal. Menurut Mesa et al. (2002), konsentrasi BAP rendah namun mampu menghasilkan pertumbuhan tunas dapat dipilih sebagai konsentrasi yang diterapkan dalam perbanyakan tunas agar tercapai efektivitas dan efisiensi biaya.
Selama fase induksi tunas, terdapat pula perubahan eksplan berupa kematian tunas dan kontaminasi. Kematian tunas awalnya disebabkan oleh munculnya metabolit sekunder dari eksplan berupa zat fenolik. Eksplan tersebut akhirnya mengalami kematian pada umur 8 MST. Zat fenolik ini juga yang menyebabkan perubahan warna kalus pada eksplan yang semakin menghitam ketika kultur semakin lama dalam media. Kontaminasi pada beberapa kultur yang steril dapat disebabkan oleh agen kontaminan yang telah bertahan di dalam jaringan sampai kondisi yang menguntungkan untuk pertumbuhannya (kontaminan laten) (Zulkarnain 2009) maupun akibat proses subkultur eksplan ke media induksi yang kurang teliti.
SIMPULAN DAN SARAN
Simpulan
Kombinasi ZPT BAP (0, 0.5, 1 mg/L) dengan IAA (0, 0.1, 0.2 mg/L) belum menghasilkan pertumbuhan tunas yang optimal. Media WPM dengan BAP 0.5 mg/L mampu menghasilkan persentase eksplan bertunas, jumlah tunas, dan
18
Khairunisa R. 2009. Penggunaan beberapa jenis sitokinin terhadap multiplikasi tunas dan pertumbuhan binahong (Anredera cordifolia [Ten.] Steenis) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
pertambahan tinggi tunas terbaik. Media WPM dengan IAA konsentrasi 0.1 dan 0.2 mg/L menghasilkan pertumbuhan eksplan ke arah pembentukan kalus.
Saran
Perlu dilakukan pengkajian lebih lanjut dalam penggunaan BAP 0.5 mg/L dengan selang konsentrasi IAA yang lebih rendah agar didapatkan keseimbangan penggunaan ZPT dalam menghasilkan pertumbuhan tunas yang optimal.
DAFTAR PUSTAKA
Alfian R. 2014. Modifikasi unsur hara makro untuk peningkatan keragaan plantlet
Stevia rebaudiana dalam kultur in vitro [skripsi]. Bogor (ID): Institut
Pertanian Bogor.
Ardiansyah R. 2015. Mikropropagasi tembesu (Fagraea fragrans ROXB) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Azwin, Siregar IZ, Supriyanto. 2006. Penggunaan BAP dan TDZ untuk perbanyakan tanman gaharu (Aquilaria malaccensis Lamk.). Media
Konservasi 11(3):98-104.
Dewanto MW. 2014. Pengaruh zat pengatur tumbuh BAP dan NAA terhadap pertumbuhan tunas ulin (Eusideroxylon zwageri T. et B.) secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fitria NF. 2015. Stek pucuk saninten (Castanopsis argentea BLUME) menggunakan ZPT komersial dan jenis media tanam yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Gunawan LW. 1992. Teknik Kultur Jaringan Tumbuhan. Bogor (ID): PAU IPB Pr. Harahap F, Poerwanto R, Suharsono, Suriani C, Rahayu S. 2014. In vitro and rooting of mangosteen (Garcinia mangostana L.) on medium with different concentrations of plant growth regulator. Hayati J Bioscience 21(4):151-158. Hendaryono DPS, Wijayani A. 2012. Teknik Kultur Jaringan: Pengenalan dan
Petunjuk Perbanyakan Tanaman Secara Vegetatif-Modern. Yogyakarta (ID):
Kanisius.
Herawan T, Putri AI, Ardhany F, Widowati TB. 2014. Pertumbuhan dan perkembangan kalus embriogenik Eucalyptus pellita menggunakan teknik embriogenesis somatik. Dalam Prosiding Seminar Nasional Benih Unggul
untuk Hutan Tanaman, Restorasi Ekosistem, dan Antisipasi Perubahan Iklim,
2014 Nov 19-20, Yogyakarta, Indonesia. Bogor (ID): SEAMEO BIOTROP. hlm 287-294.
Heriyanto NM, Sawitri R, Subandinata D. 2007. Kajian ekologi permudaan Saninten (Castanopsis argentea (Bl) A.DC.) di Taman Nasional Gunung Gede Pangrango, Jawa Barat. Buletin Plasma Nutfah 13(1):34-42.
Jayusman. 2006. Peran media dasar dan konsentrasi hormon pertumbuhan terhadap induksi dan multiplikasi tunas pucuk kemenyan. Jurnal Penelitian Hutan
19
Zulkarnain. 2009. Kultur Jaringan: Solusi Perbanyakan Tanaman Budidaya. Jakarta (ID): Bumi Aksara.
Lemmens RHMJ, Soerianegara I, Wong WC. 1995. Plant Resources of South-East
Asia No. 5(2). Timber Tees: Minor Comercial Timbers. Bogor (ID): Prosea.
Lestari EG. 2008. Kultur Jaringan: Menjawab Persoalan Pemenuhan Kebutuhan
akan Peningkatan Kualitas Bibit Unggul dan Perbanyakan secara besar-besaran. Bogor (ID): Penerbit Akademia.
Lestari EG. 2011. Peranan zat pengatur tumbuh dalam perbanyakan tanaman melalui kultur jaringan. Jurnal AgroBiogen 7(1):63-68.
Mansur I. 2013. Teknik Silvikultur untuk Reklamasi Lahan Bekas Tambang. Bogor (ID): SEAMEO BIOTROP.
Martawijaya A, Kartasujana I, Mandang Y, Prawira SA, Kadir K. 1989. Atlas Kayu
Indonesia, Jilid II. Bogor (ID): Badan Penelitian dan Pengembangan
Kehutanan. Departemen Kehutanan Bogor.
Mesa D, Romero A, Cruz AM. 2002. Study of differnet benzylaminopurine (BAP) concentrations in the in vitro micropropagation of Leucaena leucocephala cv Peru. Cuban J Agriscience 36(3):261-264.
Osterc G, Zavrl Fras M, Vodenik T, Luthar Z. 2005. The propagation of chestnut (Castanea sativa Mill.) nodal explants. Acta agriculturae Slovenica 85(2):411-418.
Prihartini R. 2004. Pengaruh posisi penanaman eksplan terhadap pertumbuhan tunas aksilar bambu apus (Gigantochloa apus (J.A & J.H Schultes) Kurz) [skripsi]. Depok (ID): Universitas Indonesia.
Riyadi I, Tahardi. 2005. Pengaruh NAA dan IBA terhadap pertumbuhan dan perkembangan tunas kina (Cinchona succirubra). Jurnal Bioteknologi Pertanian 10(2):45-50.
Sandra E. 2013. Cara Mudah Memahami dan Menguasai Kultur Jaringan Skala
Rumah Tangga. Bogor (ID): IPB Press.
Suhartati, Nursyamsi. 2007. Pengaruh komposisi media WPM dan BAP pada pertumbuhan bibit jati (Tectona grandis L.) dengan perbanyakan secara in
vitro. Jurnal Info Hutan 4(4):379-384.
Sulistiani E, Yani SA. 2012. Produksi bibit tanaman dengan menggunakan teknik
kultur jaringan. Bogor (ID): SEAMEO BIOTROP.
Sundari L, Siregar LAM, Hanafiah DS. 2015. Respon eksplan nodus dalam inisiasi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dalam medium WPM. Jurnal Online Agroteknologi 3(1):179-187.
Theodora F. 2010. Perbanyakan tanaman jarak pagar (Jatropha curcas) melalui stek buku tunggal secara in vitro[skripsi]. Bogor (ID): Insitut Pertanian Bogor. Wibowo C. 2006. Hubungan antara keberadaan saninten (Castanopsis argentea
BLUME) dengan beberapa sifat tanah: kasus di Taman Nasional Gunung Gede Pangrango, Jawa Barat [disertasi]. Bogor (ID): Institut Pertanian Bogor. Yelnitis, Joni M. . Penggunaan BA, kinetin, dan thidiazuron dalam pembentukan tunas kulim (Scorodocarpus borneensis Becc). Dalam Prosiding Seminar
Nasional Biosains 2: Penguatan Biologi sebagai Ilmu Dasar untuk Menunjang Kemajuan Sains dan Teknologi. 2015 Nov 19-20, Denpasar,
20
Lampiran 1 Komposisi media woody plant medium (WPM) sebagai media dasar induksi tunas pucuk saninten
Komponen Konsentrasi (mg/L) Makro NH4NO3 400.00 CaCl2.2H2O 96.00 MgSO4.7H2O 370.00 KH2PO4 170.00 K2SO4 990.00 Ca(NO3).4H2O 576.00 Mikro H3BO3 6.20 MnSO4.4H2O 22.30 ZnSO4.7H2O 8.60 NaMoO4.2H2O 0.25 CuSO4.5H2O 0.25 Fe EDTA Na2.EDTA 37.30 FeSO4.7H2O 27.80 Vitamin Myo-inositol 100.00 Nicotinic acid 0.50 Thiamine HCl 0.40 Glycine 2.00 Gula (Sukrosa) 30 000.00 Agar (Phytagel) 2 000.00
21 Lampiran 2 Hasil uji F pengaruh jenis ZPT dan konsentrasi ZPT terhadap jumlah
tunas pada kultur saninten selama 8 MST
Faktor Db JK KT F hitung Pr > F Jenis ZPT 2 5.1666 2.5833 1.33 0.2816 tn Konsentrasi ZPT 2 2.0000 1.0000 0.51 0.6037 tn Interaksi 4 4.3333 1.0833 0.56 0.6956 tn
tn: tidak nyata, Db: derajat bebas, JK: jumlah kuadrat, KT: kuadrat tengah.
Lampiran 3 Hasil uji F pengaruh jenis ZPT dan konsentrasi ZPT terhadap tinggi tunas pada kultur saninten selama 8 MST
Faktor Db JK KT F hitung Pr > F Jenis ZPT 2 0.0028 0.0014 0.17 0.8410 tn Konsentrasi ZPT 2 0.0019 0.0009 0.12 0.8864 tn Interaksi 4 0.0169 0.0042 0.52 0.7194 tn
tn: tidak nyata, Db: derajat bebas, JK: jumlah kuadrat, KT: kuadrat tengah.
Lampiran 4 Hasil uji Kruskall-Wallis pengaruh ZPT terhadap pembentukan eksplan berkalus
Chi-Square df Asymp. Sig
11.377 8 0.181tn
22
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 17 Agustus 1994 dari ayah Yana Mulyana Hidayat dan ibu Mulyanah. Penulis merupakan anak pertama dari dua bersaudara. Tahun 2012 penulis lulus dari SMA Negeri 10 Bogor dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Silvikultur, Fakultas Kehutanan.
Selama mengikuti perkuliahan, penulis pernah aktif dalam organisasi Badan Eksekutif Mahasiswa (BEM) Fakultas Kehutanan periode 2013/2014 sebagai anggota Divisi Kajian Strategi dan Advokasi (KASTRAD) serta Himpunan Profesi
Tree Grower Community (TGC) periode 2014/2015 sebagai Ketua Pathology Group. Penulis telah melaksanakan Praktik Pengenalan Ekosistem Hutan (PPEH)
yang dilaksanakan di Gunung Papandayan dan Sancang Timur Garut, Praktik Pengelolaan Hutan (PPH) yang dilaksanakan di Hutan Pendidikan Gunung Walat (HPGW) Sukabumi, dan Kegiatan Ekspedisi Flora dan Studi Ilmiah (Eksplorasi) di Taman Nasional Lore Lindu Sulawesi Tengah. Pada bulan April sampai dengan Mei 2016 penulis melaksanakan Praktik Kerja Profesi di KPH Kebonharjo Tuban, Jawa Timur.
Sebagai tugas akhir, penulis melakukan penelitian dengan judul Respon Pertumbuhan Tunas Saninten (Castanopsis argentea (Blume) A.DC.) terhadap Pemberian Zat Pengatur Tumbuh BAP dan IAA secara In Vitro di bawah bimbingan Dr Ir Arum Sekar Wulandari, MS dan Ir Erina Sulistiani, MSi guna memperoleh gelar Sarjana Kehutanan IPB.