6
BAB II
LANDASAN TEORI
Dalam proses desain sistim proteksi katodik landasan teori merupakan hal yang paling utama terutama ketika tahap perhitungan. Desain sistim proteksi katodik pada jaringan pipa onshore Stasiun Talang Duku, hal-hal yang dibutuhkan sebagai landasan teori yang berhubungan dengan tugas akhir yang akan dibuat.
2.1 Proses Korosi dan Komponen Utamanya
Korosi adalah suatu bentuk degradasi material akibat interaksi dengan lingkungan. Bila material tersebut berupa kayu, maka degradasi material akibat interaksi dengan lingkungan ini berupa pelapukan, namun bila terjadi pada material berupa metal, maka disebut sebagai karat. Korosi sering diasosiasikan dengan korosi metal atau karat. Korosi pada metal ini, merupakan peristiwa degradasi material dengan mekanisme elektrokimia. Mekanisme elektrokimia dapat dijelaskan melalui diagram berikut:
7
Sel elektrokimia ini menjelaskan proses korosi yang terjadi pada metal. Proses yang sama dengan mekanisme penyepuhan. Dalam sistem di atas, ada dua material yang dimasukan dalam satu cairan dan terhubung antara keduanya dengan suatu kabel atau penghantar. Pada proses penyepuhan umumnya digunakan sumber arus berupa baterai.
Pada proses selanjutnya, maka akan ada material yang terdegradasi dan berkurang bahkan sampai akhirnya hilang. Dalam proses penyepuhan tembaga dengan kuningan, maka kuningan akan hilang dan menutupi permukaan dari tembaga tersebut.
Proses terdegradasinya material kuningan ini adalah bentuk dari korosi. Material yang ‘hilang’ ini dalam sistem elektrokimia disebut sebagai Anoda yang memiliki potensial korosi lebih tinggi (berpotensi untuk terkorosi), sedangkan tembaga adalah material yang tidak berkurang dan disebut sebagai Katoda, yang memiliki potensial korosi lebih rendah.
Kemudian dalam proses penyepuhan tersebut, kedua material harus berada dalam cairan, biasanya digunakan air garam. Cairan ini disebut elektrolit, dinamakan demikian karena cairan ini memiliki ion atau electron bebas yang dapat mengalirkan arus listrik.
Atas ketiga hal tersebut yaitu anoda, katoda dan elektrolit berikut adalah definisi yang dinyatakan oleh NACE:
8
a. Anode: “The electrode of an electrochemical cell at which oxidation occurs.
Electron flow away from the anode in the external circuit. Corrosion usually occurs and metal ions enter the solution at the anode”
Elektroda dalam sel elektrokimia yang mengalami reaksi oksidasi dan darinya elektron mengalir keluar melalui konduktor. Korosi terjadi di material ini dan ion logam tersebut masuk ke dalam elektrolit.
b. Cathode: “The electrode of an electrochemical cell at which reduction is the principal reaction. Electrons flow toward the cathode in the external circuit”
Elektroda dalam elektrolit dimana terjadi reaksi reduksi dan elektron mengalir menujunya melalui konduktor.
c. Electrolyte: “A chemical substance containing ions that migrate in an electric field”
Larutan kimia yang mengandung ion yang dapat bermigrasi dalam medan listrik.
Kunci dari elektrolit adalah ion, artinya konduktivitas. Semakin konduktif elektrolit, maka laju korosi semakin cepat. Bila elektrolit berupa tanah, maka semakin rendah tahanan tanah maka semakin korosif.
Sistem ini menggambarkan secara lengkap tentang korosi. Terlihat bahwa korosi hanya bisa terjadi bila memiliki komponen utama berikut:
a. Material anoda dan katoda b. Elektrolit
9
c. Konduktor yang menghubungkan anoda dan katoda secara elektris
Proses korosi terjadi, sebagai berikut:
Umum material logam dalam dunia ini berada dalam kondisi tidak stabil, tingginya level energi elektron di kulit terluar membuat logam selalu aktif untuk berpindah ke tempat lain dengan potensial (level energy) lebih rendah untuk mencari kestabilan.
Bila material ini berada dalam elektrolit dan membentuk sistem tersebut, material yang bersifat anodis, akan mengalami reaksi oksidasi, dimana terjadi pengurangan material:
M Mn+ + n e-
M adalah material logam, misalkan M adalah Fe, maka:
Fe Fe2+ + 2 e-
Material Fe terdesosiasi, ion Fe lepas di elektrolit. Kemudian elektron tersebut akan mengalir melalui konduktor menuju material lain yang bersifat katoda.
Katoda akan mendapatkan tambahan elektron. Naiknya jumlah elektron berarti naiknya potensial reduksi material, sehingga di katoda akan terjadi reaksi reduksi.
Bila elektrolit merupakan lingkungan bersifat asam, maka reaksi reduksi yang terjadi sebagai berikut:
10
Bila terjadi di lingkungan basa, reaksi yang terjadi adalah:
2 e- + O2 + H2O 4 (OH)-
Contoh, bila anoda berupa Fe dan ion Fe dapat menuju katoda maka akan terjadi Fe(OH)2, lapisan ini yang biasanya ada dipermukaan anoda.
Peristiwa korosi adalah peristiwa elektrokimia, karena selain terjadi reaksi kimia juga terjadi pertukaran elektron.
Bila dilihat dari peristiwa diatas, maka terlihat bahwa material yang mengalami perusakan adalah material yang bersifat anodis dalam sistem korosi dan material yang tidak mengalami perusakan adalah yang bersifat katodis.
2.2 Korosi Pada Pipa Baja yang Tertanam Dalam Tanah
Korosi terjadi dalam pipa dengan sistem korosi seperti digambarkan dalam gambar di bawah ini:
Gambar 2.2. Korosi pada pipa
11
a. Elektrolit, tanah atau air laut tempat pipa tertanam adalah elektrolit. Dan keduanya memiliki ion, terlebih lagi air laut yang memiliki tahanan sangat rendah.
b. Anoda dan katoda, perbedaan komposisi kimia dalam logam dan juga kondisi lingkungan yang berbeda akan menimbulkan perbedaan potensial. Sehingga satu bagian akan bertindak sebagai anoda dan bagian lain sebagai katoda. c. Konduktor, pipa adalah konduktor itu sendiri yang menghubungkan secara
langsung anoda dan katoda dalam pipa itu sendiri.
Jadi pipa dalam tanah atau laut tempat tertanamnya pipa akan mengalami proses korosi. Pipa kita selalu terancam korosi.
2.2.1 Hubungan Potensial, pH dan Korosi
Korosi pada logam terjadi karena memang logam secara umum tidak stabil sehingga selalu mencari tingkat energi yang lebih rendah untuk mencapai kestabilan. Salah satu petunjuk mengenai karakteristik material yang sangat diperlukan dalam rangka proteksi terhadap korosi adalah diagram Pourbaix.
Pada tahun 1938, Dr. Marcel Purbaix pertama kali memperkenalkan diagram pourbaix. Diagram ini merupakan hubungan antara potensial dan pH. Dan menunjukan beberapa area kritikal yaitu area imun, area korosi dan area pasifitas.
Area korosi adalah kondisi dengan kadar pH dan potensial tertentu akan mengalami degradasi material secara spontan. Area imun adalah area dengan
12
perlakuan sehingga material tidak akan mengalami korosi atau imun terhadap korosi, pada area ini diharapkan proteksi katodik dapat bekerja. Kemudian terdapat area pasifitas, di area ini sebenarnya material sudah mengalami korosi yang cepat dan tercipta suatu lapisan di permukaan material yang mengisolasi material dengan lingkungan atau membuat proses korosi terhenti. Aplikasi pada area ini disebut juga sebagai proteksi anodik. Pada area ini material tidak dapat dikatakan tidak terkorosi atau imun, karena korosi tetap terjadi dengan laju yang lebih rendah.
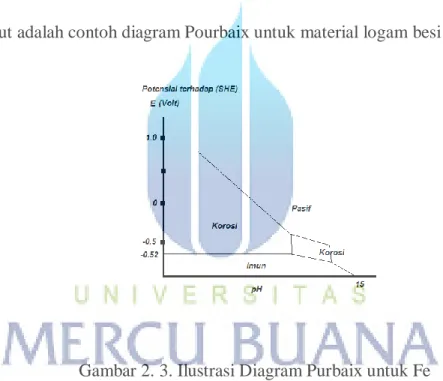
Berikut adalah contoh diagram Pourbaix untuk material logam besi (Fe).
Gambar 2. 3. Ilustrasi Diagram Purbaix untuk Fe
Untuk jenis material yang berbeda maka akan memiliki diagram Pourbaix yang berbeda-beda. Dari diagram pourbaix ini dapat kita identifikasi dua metode untuk memproteksi material dari korosi, yaitu dengan cara menurunkan potensial menuju area imun atau menaikan potensial hingga masuk ke area pasif dan memodifikasi lingkungan dengan merubah nilai pH.
13
Pada gambar 2. 3, terlihat karakteristik dari Fe, pada garis vertikal merupakan potensial terhadap elektroda referensi Hidrogen (SHE – Standard Hydrogen Electrode) untuk besi. Besi akan berhenti mengalami korosi mulai potensial – 0.52 V tehadap SHE, bila dilihat terhadap elektroda referensi Cu/CuSO4 (CSE – Copper/Copper Sulfate Standard Electrode) adalah -0.85 Volt. Sehingga kriteria proteksi katodik untuk besi adalah menjadikannya minimum -0.85 V terhadap CSE. Tiap material akan memiliki ambang proteksi minimum yang berbeda-beda.
Pengetahuan akan diagram Pourbaix untuk setiap material adalah penting. Maka disimpulkan menurunkan potensial material sampai minimum di batas daerah imun dan korosi dapat mencegah korosi.
2.3 Konsep Pengendalian korosi.
Proses korosi adalah proses alamiah yang pasti terjadi, sebagai bagian dari proses pengerusakan material dalam siklus material. Berbagai metode yang dilakukan bukan untuk menghilangkan korosi, melainkan hanya untuk memperlambat proses korosi. Proses pengendalian korosi ini bukan merupakan metode atau langkah yang dilakukan pada masa konstruksi atau masa operasi, terlebih lagi proses pengendalian korosi adalah suatu proses terintegrasi yang menyeluruh untuk melindungi aset.
Penanggulangan masalah korosi dapat berupa hal-hal berikut:
a. Design improvement
Pengendalian korosi dimulai dari tahap desain. Meningkatkan desain untuk menghindarkan terjadinya korosi. Misalkan, mencegah terjadinya genangan
14
maka permukaan didesain dengan kemiringan. Karena genangan atau air akan mempercepat terjadinya korosi atau modifikasi desain yang lebih jauh lagi.
b. Material selection
Pemilihan material harus disesuaikan dengan kondisi lingkungan dan operasi sehingga bisa mencegah terjadinya korosi. Misalkan, bila memungkinkan menggunakan material plastik, atau menggunakan stainless steel.
c. Coating and lining
Penggunaan pelapis pada material yang akan dilindungi.
d. Cathodic protection
Pengaplikasian sistem proteksi katodik baik sistem anoda korban maupun arus tanding.
e. Anodic protection
Proteksi dengan pelapisan material bersifat anodis.
f. Inhibitor
Menangkap corrosion agent dalam lingkungan, misalkan penambahan inhibitor untuk menghilangkan kandungan H2S.
g. Surface modification
Modifikasi untuk permukaan, misalkan menggunakan pelapis internal untuk memperkecil profil permukaan sehingga mengurangi korosi berupa erosi.
15
2.4 Elektroda Referensi
Pengetahuan tentang potensial material memiliki peranan yang penting dalam menentukan kriteria proteksi. Dan penentuan potensial tersebut melibatkan elektroda referensi.
Berdasarkan standard NACE, yang dimaksud dengan elektroda referensi adalah:
“An electrode whose open-circuit potential is constant under similar conditions of measurement, which is used for measuring the relative potential of other electrodes”
Jadi elektroda referensi adalah elektroda yang memiliki potensial saat rangkaian terbuka (potensial material itu sendiri) yang stabil, sehingga digunakan untuk mengukur potensial relative antara elektroda lain terhadap referensi tersebut.
Elektroda yang sering digunakan sebagai referensi adalah:
a. Cu/CuSO4,(CSE) b. Ag/AgCl
c. Hg/Hg2Cl2 d. Hidrogen (SHE) e. Zn
Hidrogen digunakan sebagai standard dengan potensial 0 Volt. Maka potensial untuk elektroda referensi lain terhadap hidrogen adalah sebagai berikut:
16 b. Ag/AgCl : 0.25 V (SHE)
c. Hg/Hg2Cl2 : 0.24 V (SHE) d. Hidrogen : 0 V
e. Zn : -0.76 V (SHE)
Gambar 2.4. Potensial elektroda referensi terhadap SHE
Tiap elektroda referensi digunakan sesuai dengan aplikasi yang berbeda-beda:
a. Cu/CuSO4 umum digunakan untuk di tanah, beberapa menggunakannya di laut. CSE yang lebih banyak digunakan karena memiliki karakteristik sangat stabil.
b. Ag/AgCl, umum digunakan untuk lingkungan air laut.
c. Hg/HgCl2, umumnya digunakan untuk lingkungan mengandung klorida, tapi lebih merupakan untuk aplikasi laboratorium
d. Zn, umumnya dapat digunakan untuk aplikasi di laut.
Pemahaman akan tipe elektroda referensi diperlukan sehingga pembacaan atau pengukuran potensial dapat dilakukan seakurat mungkin.
17
2.5 Deret Galvanik
Seperti telah dijelaskan pada bagian konsep dasar korosi, korosi dapat terjadi karena perbedaan potensial antara material. Korosi Galvanik lebih tepatnya, pada metode perlindungan dengan anoda korban adalah dengan mengadakan material lain yang memiliki potensial lebih rendah.
Pemilihan material yang salah akan membuat material yang akan dilindungi akan terkorosi. Pengetahuan akan potensial setiap material sangatlah penting. Berikut adalah deret galvanik untuk beberapa material yang umum digunakan:
Material Potensial Terhadap SHE
(Volt) Au/Au+3 + 1.5 Pt/Pt++ +1.2 Hg/Hg++ +0.85 Cu/Cu++ +0.337 H/H+ 0 Pb/Pb++ -0.126 Ni/Ni++ -0.25 Fe/Fe++ -0.44 Zn/Zn++ -0.76 Al/Al+3 -1.66 Mg/Mg+2 -2.37
18
Tabel 2.1. Deret Galvanik dengan Elektroda Referensi Hidrogen (SHE)
Dengan mengetahui deret Galvanik ini maka, pemilihan material akan tepat. Menyatukan besi dengan tembaga dalam satu instalasi maka akan terjadi korosi dan yang terkorosi adalah besi karena potensialnya lebih rendah dari tembaga.
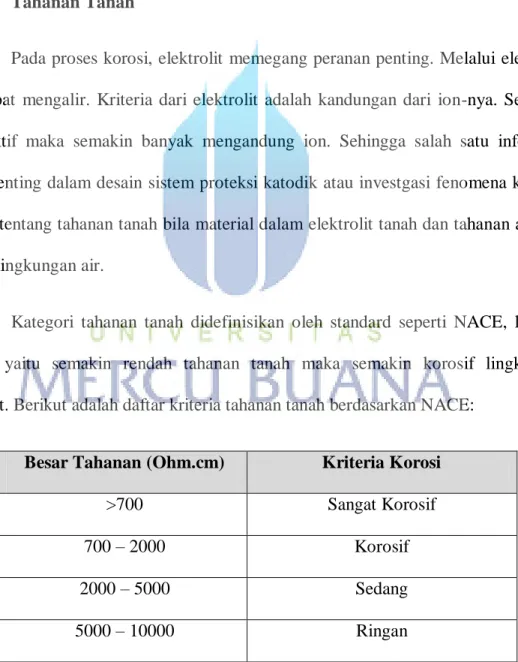
2.6 Tahanan Tanah
Pada proses korosi, elektrolit memegang peranan penting. Melalui elektrolit ion dapat mengalir. Kriteria dari elektrolit adalah kandungan dari ion-nya. Semakin konduktif maka semakin banyak mengandung ion. Sehingga salah satu informasi yang penting dalam desain sistem proteksi katodik atau investgasi fenomena katodik adalah tentang tahanan tanah bila material dalam elektrolit tanah dan tahanan air bila dalam lingkungan air.
Kategori tahanan tanah didefinisikan oleh standard seperti NACE, kriteria umum yaitu semakin rendah tahanan tanah maka semakin korosif lingkungan tersebut. Berikut adalah daftar kriteria tahanan tanah berdasarkan NACE:
Besar Tahanan (Ohm.cm) Kriteria Korosi
>700 Sangat Korosif
700 – 2000 Korosif
2000 – 5000 Sedang
19
>10000 Tidak Korosif
Tabel 2.2 Kriteria korosi berdasarkan tahanan tanah
Pengukuran tahanan tanah perlu dilakukan sepanjang jalur dengan interval minimum 1 km atau sesuai dengan medan atau kondisi lapangan yang dihadapi. Bila didapati beberapa area yang khusus misal adanya rawa, persilangan dengan fasilitas lain perlu diukur tahanan tanahnya. Metode pengukuran tahanan tanah dapat dilakukan dengan cara metode Four Wenner Electrode yang secara detail dijelaskan dalam standard ASTM G57.
2.7 Sistem Proteksi Katodik
Berdasarkan proses terjadinya korosi seperti dijelaskan dengan sel galvanik, material yang tidak akan mengalami korosi adalah material yang bertindak sebagai katodik. Maka upaya untuk membuat material yang akan dilindungi sebagai katoda adalah proteksi katodik. Mengkondisikan material sebagai katoda berarti membuat material mengalami atau memiliki kondisi katoda yaitu:
a. Katoda menerima elektron dari anoda, berarti terjadi pelimpahan elektron b. Katoda memiliki potensial reduksi yang lebih tinggi
c. Katoda menerima arus searah dari elektrolit yang berasal dari anoda.
Berdasarkan kondisi-kondisi tersebut, berikut adalah definisi proteksi katodik yang ada berdasarkan standard dan pendapat praktisi katodik:
20
“Proteksi katodik adalah pengendalian korosi dengan menjadikan material primer sebagai katoda dalam suatu sel elektrokimia”
2. Berdasarkan BS 7361:
“Imunisasi logam terhadap korosi dengan mengalirkan arus listrik searah ke dalam elektrolit menuju permukaan logam”
Dari definisi tersebut dapat digambarkan sebagai berikut:
Gambar 2.5. Definisi proteksi katodik
Dengan memperlakukan material tersebut sebagai katoda maka laju korosi dapat diperlambat. Namun sebagai catatan penting yaitu, bahwa proteksi katodik adalah proteksi korosi sekunder pada sistem material yang sudah diproteksi dengan lapis lindung atau coating.
Sistem proteksi katodik akan bekerja bila terdapat cacat pada coating yang disebut Holiday. Besarnya kecacatan lapis lindung tersebut akan menentukan besar arus proteksi yang harus disuplai oleh sistem proteksi katodik. Fenomena di lapangan menunjukan pada operasi awal biasanya kebutuhan arus untuk proteksi katodik
21
sangat kecil, seiring dengan waktu maka kebutuhan arus semakin bertambah. Dari konsep proteksi katodik tersebut maka yang dibutuhkan adalah sumber elektron untuk membanjiri struktur dalam elektrolit tersebut. Dan metode sistem proteksi katodik dibedakan secara prinsip dari sumber arus proteksi atau elektron di katoda tersebut.
Bila arus proteksi disuplai oleh material yang akan mengalirkannya berdasarkan perbedaan tegangan galvanik material. Misalkan arus proteksi mengalir dari Mg ke Fe karena perbedaan potensial keduanya. Namun umumnya material Mg yang digunakan merupakan paduan Mg. Metode yang mengandalkan perbedaan potensial ini disebut dengan metode Anoda Korban atau Sacrificial Anode Cathodic
Protection (SACP).
Karena ketergantungannya pada potensial material, maka sistem ini sangat dipengaruhi oleh besarnya tahanan yang dihadapi oleh material. Bila tahanan tanah besar maka arus yang dihasilkan sangat kecil, bahkan untuk tahanan yang sangat besar tidak akan mengeluarkan arus. Batasan tahanan tanah berdasarkan standard hanya sampai 6000 ohm.cm, namun seiring dengan perkembangan anoda yang dibuat, memungkinkan sampai 10000 ohm.cm dengan aplikasi High Potensial
Anode.
a. Kriteria proteksi katodik
Untuk membuat material yang akan kita proteksi bisa tidak terkorosi adalah dengan membuat potensial material minimum mencapai potensial ambang antara daerah korosi dan daerah imun dalam diagram Pourbaix.
22
Untuk memproteksi baja berikut adalah kriteria proteksi yang disyaratkan oleh NACE RP 0169:
Menjadikan struktur primer berpotensial minimum -850 mV terhadap CSE saat sistem proteksi katodik diaplikasikan.
Struktur metal tersebut memiliki potensial polarisasi -850 mV terhadap CSE.
Struktur metal memiliki potensial sisa polarisasi minimum -100 mV terhadap CSE.
Kriteria proteksi baja berdasarkan elektrolitnya sesuai dengan standard NACE RP 0169 sebagai berikut:
Dalam tanah:
o Memiliki potensial polarisasi minimum -850 mV terhadap CSE atau lebih rendah
o Memiliki potensial sisa polarisasi 100 mV Dalam laut:
o Memiliki potensial minimum -800mV terhadap Ag/AgCl atau lebih rendah
o Menurunkan potensial material 300 mV atau lebih
23
Memiliki potensial minimum -850 mV terhadap CSE dengan batas bawah -1200 mV untuk mencegah terjadinya kerusakan lapis lindung atau coating
Memiliki sisi polarisasi 100 mV terhadap CSE
Memiliki potensial polarisasi -750 mV terhadap CSE untuk tahanan tanah antara 100 – 1000 ohm.m
Memiliki potensial polarisasi -650 mV terhadap CSE untuk tahanan tanah lebih dari 1000 ohm.m
Sisa polarisasi 100 mV tidak berlaku bila terdapat SRB (Sulfif
Reducing Bacteria)
Untuk operasi diatas 400C, ditambahkan potensial -2mV/0C.
Terdapat perbedaan lain antara NACE dan ISO, yaitu adanya batas bawah -1200 mV. Pada konsep korosi terlihat bahwa hasil dari reaksi oksidasi di katoda adalah H2 yang
berbentuk gas. Gas hidrogen ini akan meningkat jumlahnya seiring dengan aplikasi potensial yang besar. Gas hidrogen pada katoda ini pada jumlah besar akan menimbulkan embrittlement atau kerapuhan dari coating. Walaupun dalam prakteknya, potensial untuk coating jenis 3LPE bisa lebih dari -2000mV, batasan tersebut digunakan sebagai batas aman.
24
2.8 Keuntungan dan Kerugian Sistem Proteksi Katodik Anoda Korban
Keuntungan :
Tidak memerlukan listrik Pemasangan mudah Tidak ada interferensi
Potensi kondisi over protection kecil Untuk kebutuhan arus kecil
Untuk daerah pada struktur Distribusi arusnya lebih merata Tidak memerlukan perawatan Hanya memerlukan inspeksi rutin Biaya operasi rendah
Kerugian:
Arus keluaran anoda terbatas (tergantung tahanan tanah)
Pada tahanan tanah yang besar (> 6000 ohm.m atau 10000 ohm.m) tidak efektif
Aplikasi pada struktur yang besar menjadi tidak ekonomis
2.9 Parameter Desain Sistem Proteksi Katodik Anoda Korban
Tahap awal dalam desain sistem proteksi katodik adalah kompilasi semua data yang dibutuhkan dalam mendesain sistem tersebut. Berikut adalah beberapa
25
parameter desain esensial yang harus diketahui dna perlu didapatkan dalam mendesain sistem proteksi anoda korban:
a. Dimensi struktur
Ukuran dari struktur diperlukan untuk menentukan area yang harus diproteksi. Sesuai dengan definisi dan konsep korosi dan sistem proteksi katodik, bagian yang akan diproteksi adalah luas permukaan struktur yang berada dalam elektrolit. Luas permukaan akan dihitung sesuai dengan bentuk struktur tersebut.
b. Coating breakdown
Coating breakdown adalah besaran yang menunjukan besar penurunan
kualitas atau probabilitas kerusakan coating setelah waktu tertentu. Masing – masing jenis coating akan memiliki besar coating breakdown yang berbeda – beda sesuai dengan kualitasnya. Maka tak heran untuk coating jenis 3 LPE akan memiliki nilai coating breakdown yang lebih kecil dibandingkan dengan
coating dari coaltar karena 3 LPE memiliki kualitas yang jauh lebih baik, baik
dari kekuatan fisik, kekuatan secara kimiawi terhadap lingkungann.
Semakin besar nilai coating breakdown maka semakin besar kebutuhan arus, karena berarti semakin banyak dan luas daerah struktur yang tidak terlindungi oleh coating.
Sebagai informasi untuk penentuan coating breakdown dapat merujuk pada standard seperti ISO 15589 atau DNV RP B401.
26 c. Umur desain
Berapa lama struktur tersebut harus diproteksi harus diketahui karena akan mempengaruhi kapasistas sistem proteksi katodik. Umumnya pipa PGN didesain untuk 20 tahun.
d. Kebutuhan arus proteksi
Kebutuhan arus proteksi disesuaikan dengan jenis material yang akan diproteksi. Standard yang diterima untuk pipa baja tanpa coating adalah sebesar 20mA/m2. Dengan adanya aplikasi coating kebutuhan arus proteksi ini akan jauh berkurang.
Berikut adalah contoh kebutuhan arus yang ada dalam standard ISO 15589-1 dengan tipe coating dan umur desainnya:
27
Table 2.3. Kebutuhan arus proteksi berdasarkan ISO 15589
e. Jenis anoda
Jenis anoda yang akan digunakan harus diketahui, karena pemilihan jenis anoda akan ditentukan berdasarkan kondisi lingkungan (tahanan elektrolit) dan bentuk dari struktur yang akan diproteksi.
Berikut ini adalah jenis anoda yang umum digunakan untuk sistem proteksi anoda korban:
Paduan Mg Paduan Al Paduan Zn Baja Lunak
Penggunaan anoda paduan Mg umumnya digunakan di tanah karena driving
voltage-nya yang besar. Anoda paduan AL banyak digunakan di aplikasi
instalasi bawah laut. Sedang Zn biasa digunakan di daerah tahanan rendah.
Komposisi kimia pun sangat berpengaruh karena dengan komposisi kimia yang tepat akan memberikan efisiensi anoda yang besar. Kriteria dari komposisi kimia ini terdapat di standard internasional seperti ISO 15589 dan NACE. Ada beberapa hal prinsip yang harus diketahui tentang anoda misalnya tentang komponen aktif yang harus ada di anoda paduan Al yaitu In dan juga cara fabrikasinya.
28
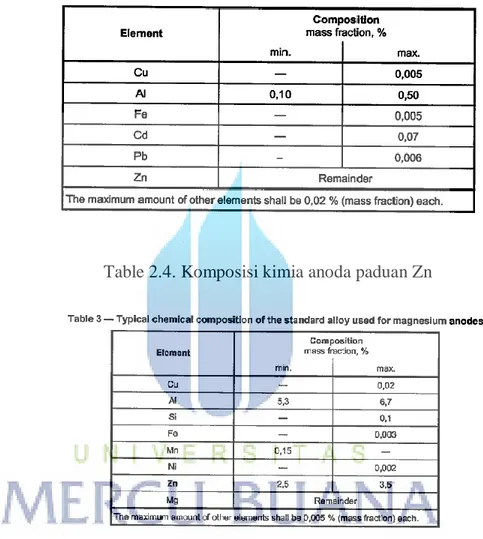
Berikut adalah kriteria komposisi kimia untuk masing-masing anoda berdasarkan ISO 15589-1:
Table 2.4. Komposisi kimia anoda paduan Zn
Gambar 2.5. Komposisi kimia untuk anoda paduan Mg
Berikut adalah batasan maksimum tambahan unsure kimia yang dapat diberikan untuk anoda jenis Al dan Zn berdasarkan DNV RP B401:
29
Tabel 2.6. Maksimum konsentrasi impurities untuk anoda Al dan Zn berdasar DNV RP B401
Sedangkan untuk bentuk anoda ada beberapa, berikut adalah contoh bentuk anoda yang ada dalam standard DNV RP B 401, untuk pipa bawah laut digunakan tipe setengah cincin pada umumnya.
Gambar 2.6 Bentuk anoda untuk aplikasi laut
30 f. Dimensi anoda
Dimensi anoda harus kita ketahui, karena untuk mengetahui besar arus keluaran anoda, komponen pentingnya adalah tahanan anoda dan dimensi digunakan untuk menghitungnya.
Dimensi anoda untuk aplikasi bawah tanah yang diperlukan adalah dimensi termasuk dengan backfill.
Untuk keperluan berat anoda, secara praktis terdapat arahan atau rule of
thumb berdasarkan besar tahanan tanah yang dihadapi yaitu sebagai berikut:
Tahanan tanah (Ohm.cm) Berat Anoda (kg) > 1500 25 1500 - 2500 15 2500 > 8
Tabel 2.7. Rule of thumb pemilihan anoda
Terlihat dari tabel semakin besar tahanan tanah, maka anoda yang direkomendasikan adalah yang semakin kecil, karena dengan demikian akan didapat anoda yang lebih besar dan terdistribusi dengan baik akan memungkin arus keluaran yang lebih besar dan merata.
31 g. Efisiensi anoda
Efisiensi anoda adalah besarnya pengurangan berat anoda dibandingkan dengan besar arus dan waktu. Informasi ini adalah tentang kinerja anoda, dan darinya dapat ditentukan berapa banyak anoda yang dibutuhkan.
h. Utilization Factor
Factor kegunaan ini menunjukan anoda dapat digunakan sampai dengan pengurangan berat berapa persen dari awal. Misalkan fator kegunaan 80% maka anoda dianggap dapat dipakai sampai dengan berkurangnya berat 80%, setelah itu harus diganti.
i. Tahanan tanah
Tahanan tanah jelas harus diketahui saat awal karena menentukan jenis sistem proteksi katodik yang akan digunakan.
j. Kondisi di ROW (Right of Way), mengenai instalasi kondisi khusus.
Survey di ROW ini selain menentukan daerah instalasi khusus seperti adanya
crossing dengan sungai, jalan kereta, jalan raya atau dengan pipa lain juga
penentuan survey elektris terhadap struktur di sekitar instalasi pipa. Misalkan adanya saluran tegangan tinggi. Kondisi – kondisi khusus ini perlu di ketahui karena memerlukan perlakuan yang berbeda.
32
2.10 Langkah – Langkah Perhitungan Proteksi Katodik Anoda Korban
Berikut adalah tahapan perhitungan yang harus dilakukan untuk aplikasi sistem proteksi katodik anoda korban pada pipa, adalah sebagai berikut :
Menentukan luas permukaan struktur yang akan diproteksi
SA = πDL ………...(1)
Dimana :
SA : Luas permukaan (m2)
D : Diameter pipa (m) L : Panjang pipa (m)
Menentukan kebutuhan arus proteksi
Arus kebutuhan proteksi untuk pipa baja tanpa coating yaitu 20 mA/m2 atau bila ditentukan lain. Sedangkan untuk pipa dengan coating, rumus yang digunakan:
Id = Ibare . coating breakdown……….(2)
Dimana:
Id : Kebutuhan arus proteksi (mA/m2)
Ibare : Kebutuhan arus proteksi pipa baja tanpa coating (mA/m2)
Menentukan kebutuhan arus proteksi total
IReg = Id . Sa……… (3)
Dimana:
33 Id : Kebutuhan arus proteksi (A/m2)
Menentukan kebutuhan total anoda
W = (IReq . t . 8760)/(η.u)………(4)
Dimana :
W : Berat total kebutuhan anoda (kg) t : umur desain (tahun)
η : efisiensi anoda (Ah/Kg. year) u : faktor kegunaan
Menentukan jumlah anoda
N = W/Wanode……… (5)
Dimana:
N : Jumlah anoda
Wanode : Berat satu anoda (Kg)
Menentukan lokasi pemasangan anoda
Spacing = L / N……….. (6)
Dimana :
L : Panjang Pipa (m)
N : Jumlah Anoda
34
Tahanan anoda ditentukan oleh beberapa faktor, yaitu dimensi anoda, tahanan tanah dan posisi instalasi. Anoda yang dipasang secara vertikal dan horizontal akan memiliki tahanan yang berbeda. Berikut adalah rumus untuk menghitung tahanan anoda: Instalasi horizontal: Rh = (/2πL)[ln (4L/D)-1]………. (7) Instalasi Vertikal: Rv = (/2πL)[ln (8L/D)-1]………. (8) Dimana:
Rh : Tahanan anoda horizontal (Ohm)
: Tahanan tanah di kedalaman anoda ditanam (Ohm.cm) L : Panjang anoda termasuk backfill (cm)
D : Diameter anoda termasuk backfill (cm) Menghitung arus keluaran anoda
Untuk mengetahui arus keluaran anoda, maka berlaku hukum Ohm, yaitu arus adalah tegangan dibagi dengan tahanannya. Setelah diketahui tahanan anoda, maka untuk tegangannya, yang berpengaruh adalah tegangan dorong (Driving
Voltage) yang merupakan selisih antara tegangan anoda dan tegangan proteksi
yang dikehendaki.
35
IAnoda = (Eanoda - EProteksi)/Ranoda………..(10)
Dimana:
Eanoda : Potensial anoda
Eproteksi : Potensial proteksi
Menghitung total arus dari jumlah anoda
Ianoda total = Ianoda . N………. (11)
Dimana :
N : Jumlah anoda Ianoda : Arus keluaran anoda
Menentukan usia proteksi homogen anoda.
Setelah seluruh arus keluaran dibandingkan dengan kebutuhan arus, maka akan kita dapat perkiraan usia anoda dengan metode berikut:
tanoda =( Ianoda total / Ireq) . tdesign life. U………. (12)
Dimana:
tdesign life : Umur desain pipa
36
2.11 Instalasi Anoda Korban
Berikut adalah gambaran sederhana pemasangan anoda korban berdasarkan KEPMEN 370K/1997 untuk kedalamannya dan jarak dengan pipa sesuai dengan pertimbangan teknis:
Gambar 2.7 Gambaran umum instalasi anoda
2.12 OPERASI DAN PEMELIHARAAN SISTEM ANODA KORBAN
Sistem anoda korban tidak memerlukan pekerjaan opersional. Sekali pasang umumnya didesain untuk masa kerja tertentu, biasanya 20 tahun atau sesuai umur disain struktur yang diproteksi. Sistem ini dapat dikatakan self adjustment, dimana keluaran arus anoda berubah sesuai dengan keperluan. Sekalipun demikian, harapan masa kerja sesuai umur disain anoda sering kurang dari umur disain.
Inspeksi dan monitoring sistem anoda korban pada jaringan pipa dilakukan untuk untuk di cross check dengan kriteria proteksi yang harus dipenuhi dalam interval tertentu, untuk mendeteksi adanya penurunan efisiensi proteksi dari anoda dan untuk pengumpulan data terkait optimasi disain selanjutnya.
37
Pengukuran Arus Proteksi (SA) Pengukuran Potensial Natural Pipa Thp. Elektroda Pembanding
Pengukuran Potensial Proteksi Pipa Thp. Elektroda Pembanding Pengukuran Potensial Anoda Thp. Elektroda Pembanding Pipa Baja Test Box Cu/CuSo4 Multimeter Cu/CuSo4 Cu/CuSo4 Test Box Test Box Test Box Anoda Korban
Anoda Korban Anoda Korban
Pipa Baja Pipa Baja Pipa Baja Multimeter Multimeter Multimeter
Frekuensi inspeksi dilakukan secara regular dalam interval tertentu minimal setiap 3 (tiga) bulan dan bisa juga tergantung pada kemungkinan-kemungkinan gangguan karena perubahan kondisi ROW atau jalur pipa.
Pada pemantauan setiap 3 (tiga) bulan dengan menggunakan alat multimeter dan elektroda pembanding pada test box yang dilustrasikan dalam gambar 2 sebagai berikut :
Pengukuran potensial :
- Pengukuran potensial pipa terhadap tanah atau base potensial (mvolt) - Potensial pipa terproteksi (mvolt)
- Potensial anoda (mvolt) Pengukuran arus anoda (mAmp)