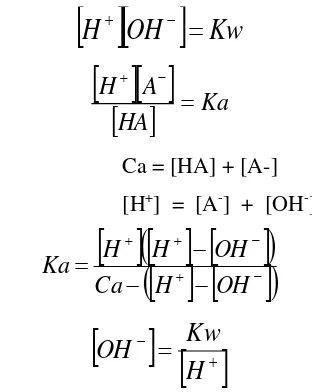i
KIMIA
SMK KESEHATAN
KELAS XI SEMESTER 1
iii Hak Cipta pada Direktorat Pembinaan SMK Kementerian Pendidikan dan Kebudayaan Dilindungi Undang-Undang
Penulis :
Astrilia Damayanti
Megawati
2017
Disusun dengan huruf Times New Roman, 11 pt
Milik Negara
Tidak Diperdagangkan
iv
KATA PENGANTAR
Undang-Undang Dasar Negara Republik Indonesia Tahun 1945 Pasal 31 ayat (3) mengamanatkan bahwa Pemerintah mengusahakan dan menyelenggarakan satu sistem pendidikan nasional, yang meningkatkan keimanan dan ketakwaan serta akhlak mulia dalam rangka mencerdaskan kehidupan bangsa, yang diatur dengan undang-undang. Atas dasar amanat tersebut telah diterbitkan Undang-Undang Republik Indonesia Nomor 20 Tahun 2003 tentang Sistem Pendidikan Nasional.
Implementasi dari undang-undang Sistem Pendidikan Nasional tersebut yang dijabarkan melalui sejumlah peraturan pemerintan, memberikan arahan tentang perlunya disusun dan dilaksanakan delapan standar nasional pendidikan, diantaranya adalah standar sarana dan prasarana. Guna peningkatan kualitas lulusan SMK maka salah satu sarana yang harus dipenuhi oleh Direktorat Pembinaan SMK adalah ketersediaan bahan ajar siswa khususnya bahan ajar Peminatan C1 SMK sebagai sumber belajar yang memuat materi dasar kejuruan.
Kurikulum yang digunakan di SMK baik kurikulum 2013 maupun kurikulum KTSP pada dasarnya adalah kurikulum berbasis kompetensi. Di dalamnya dirumuskan secara terpadu kompetensi sikap, pengetahuan dan keterampilan yang harus dikuasai peserta didik serta rumusan proses pembelajaran dan penilaian yang diperlukan oleh peserta didik untuk mencapai kompetensi yang diinginkan. Bahan ajar Siswa Peminatan C1 SMK ini dirancang dengan menggunakan proses pembelajaran yang sesuai untuk mencapai kompetensi yang telah dirumuskan dan diukur dengan proses penilaian yang sesuai.
v ajar ini merupakan penjabaran hal-hal yang harus dilakukan peserta didik untuk mencapai kompetensi yang diharapkan. Sesuai dengan pendekatan kurikulum yang digunakan, peserta didik diajak berani untuk mencari sumber belajar lain yang tersedia dan terbentang luas di sekitarnya. Bahan ajar ini merupakan edisi ke-1. Oleh sebab itu Bahan Ajar ini perlu terus menerus dilakukan perbaikan dan penyempurnaan.
Kritik, saran, dan masukan untuk perbaikan dan penyempurnaan pada edisi berikutnya sangat kami harapkan; sekaligus, akan terus memperkaya kualitas penyajian bahan ajar ini. Atas kontribusi itu, kami ucapkan terima kasih. Tak lupa kami mengucapkan terima kasih kepada kontributor naskah, editor isi, dan editor bahasa atas kerjasamanya. Mudah-mudahan, kita dapat memberikan yang terbaik bagi kemajuan dunia pendidikan menengah kejuruan dalam rangka mempersiapkan Generasi Emas seratus tahun Indonesia Merdeka (2045).
vi
PENDAHULUAN
A. Deskripsi
Bahan Ajar Kimia untuk SMK Kesehatan Kelas XI terdiri dari 2 Bahan Ajar, yaitu Bahan Ajar 1 untuk semester 1 dan Bahan Ajar 2 untuk semester 2. Bahan Ajar ini merupakan Bahan Ajar 1 yang akan mempelajari tentang larutan, teori asam basa, kesetimbangan kimia, kecepatan reaksi, termokimia, dan sifat koligatif larutan.
B.
Prasyarat
Untuk mempelajari modul tidak diperlukan prasyarat mata pelajaran tertentu.
C.
Petunjuk Penggunaan Modul
Untuk mempermudah penggunaan modul perlu diperhatikan petunjuk berikut ini: 1. Pelajari daftar isi serta peta konsep setiap materinya.
2. Perhatikan langkah-langkah dalam melakukan pekerjaan dengan benar untuk mempermudah dalam memahami suatu proses pekerjaan, sehingga diperoleh hasil yang maksimal.
3. Pahami setiap materi teori dasar yang akan menunjang penguasaan suatu pekerjaan dengan membaca secara teliti.
4. Jawablah uji kompetensi dengan jawaban yang singkat dan jelas serta kerjakan sesuai dengan kemampuan Anda setelah mempelajari Bahan Ajar ini.
5. Catatlah kesulitan yang Anda dapatkan dalam Bahan Ajar ini untuk ditanyakan pada guru pada saat kegiatan tatap muka. Bacalah referensi yang lain yang berhubungan dengan materi Bahan Ajar agar Anda mendapatkan pengetahuan tambahan.
D.
Tujuan Akhir
Setelah mempelajari Bahan Ajar ini Anda diharapkan dapat:
1. Menjelaskan tentang larutan, termokimia, dan sifat koligatif larutan., 2. Menjelaskan tentang teori asam basa,
3. Menjelaskan tentang kesetimbangan kimia, 4. Menjelaskan tentang kecepatan reaksi, 5. Menjelaskan tentang termokimia,
vii
DAFTAR ISI
KATA PENGANTAR ... iv
PENDAHULUAN ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xii
BAB 1LARUTAN ... 1
A. Tipe Larutan Berdasarkan Kejenuhan ... 1
B. Sifat Koligatif Larutan ... 5
C. Konsentrasi Larutan ... 5
D. Pengenceran ... 9
E. Sifat Larutan ... 9
1. Sifat Kimia ... 10
2. Sifat Fisika ... 12
BAB 2TEORI ASAM BASA ... 16
A. Elektrolit ... 16
B. Teori Arrhenius ... 17
C. Teori Bronsted-Lowry (Johannes Nicholas Bronsted, dan Thomas Martin Lowry, 1923) ... 18
D. Teori Lewis (Gilbert Newton Lewis, 1923) ... 20
E. Ikhtisar Teori Arrhenius, Bronsted-Lowry, Lewis ... 22
F. Beberapa Sifat Asam dan Basa ... 23
G. Reaksi Ionisasi Asam dan Basa Dalam Air ... 24
1. Derajat Ionisasi ... 26
2. Tetapan Ionisasi ... 26
3. Konsep pH ... 30
H. Asam Kuat Dan Basa Kuat ... 32
I. Asam Lemah Dan Basa Lemah ... 34
1. Asam Lemah Monoprotik ... 35
2. Basa Lemah Monoprotik ... 36
3. Asam Berbasa Banyak (Asam Poliprotik) ... 37
J. Senyawa Amfoter ... 38
viii
1. Kapasitas Buffer ... 40
2. Pembuatan Larutan Buffer ... 40
3. Indikator Asam Basa ... 40
BAB 3KESETIMBANGAN REAKSI ... 48
A. Definisi dan Prinsip Kesetimbangan Reaksi ... 48
B. Karakteristik Keadaan Setimbang ... 50
1. Reaksi Bolak-Balik ... 50
2. Sistem Tertutup ... 51
3. Bersifat Dinamis ... 51
4. Hukum Kesetimbangan ... 54
5. Konstanta Kesetimbangan ... 57
6. Makna Harga Konstanta Kesetimbangan ... 57
7. Harga Tetapan Kesetimbangan dan Tekanan Gas ... 59
8. Hubungan Kp dengan Kc ... 60
9. Tetapan Kesetimbangan Untuk Kesetimbangan Heterogen ... 62
10.Kesetimbangan Dissosiasi ... 63
11.Faktor-faktor yang mempengaruhi kesetimbangan reaksi ... 64
12.Penerapan Kesetimbangan Kimia ... 72
BAB 4KECEPATAN REAKSI ... 78
A. Pengertian Kecepatan Reaksi ... 79
1. Penjelasan Kecepatan Reaksi ... 79
2. Satuan Kecepatan Reaksi ... 80
3. Bentuk Persamaan Kecepatan Reaksi ... 81
B. Konversi Reaksi ... 83
C. Konstanta Kecepatan Reaksi ... 84
1. Kecepatan Reaksi Arrhenius ... 84
D. Orde Reaksi ... 89
1. Pengertian Orde Reaksi ... 89
2. Penerapan Orde Reaksi ... 89
3. Pengenalan Orde Reaksi ... 90
BAB 5TERMOKIMIA ... 106
A. Reaksi Eksoterm dan Endoterm ... 108
ix
C. Entalpi dan Jenis-Jenis Perubahan Entalpi Reaksi ... 111
1. Perubahan Entalpi Pembentukan Standar ... 111
2. Perubahan Entalpi Penguraian Standar ... 113
3. Perubahan Entalpi Pembakaran Standar ... 113
4. Perubahan Entalpi Netralisasi Standar ... 114
5. Perubahan Entalpi Pelarutan Standar ... 114
6. Perubahan Entalpi Molar Lain ... 115
D. Penentuan Entalpi Reaksi ... 115
1. Kalorimetri ... 115
2. Kalorimeter Bom ... 116
3. Kalorimeter Sederhana ... 117
4. Hukum Hess ... 121
5. Entalpi Pembentukan (𝜟𝑯𝒇𝒐) ... 122
6. Energi Ikatan ... 124
7. Kalor Pembakaran ... 126
8. Penentuan Kalor Bahan Bakar ... 128
BAB 6SIFAT KOLIGATIF LARUTAN ... 145
A. Hukum Raoult ... 146
1. Larutan Ideal ... 147
2. Larutan Non Ideal ... 148
B. Sifat Koligatif Larutan ... 149
1. Penurunan Tekanan Uap ... 150
2. Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) ... 154
3. Tekanan Osmotik ... 159
C. Sifat Koligatif Larutan Elektrolit ... 163
1. Disosiasi (ionisasi) ... 164
2. Asosiasi ... 165
3. Cara Menghitung Mol Elektrolit Sesudah Ionisasi ... 165
DAFTAR PUSTAKA ... 173
GLOSARIUM ... 175
INDEKS ... 179
x
DAFTAR GAMBAR
Gambar 1.1 Perbedaan larutan tidak jenuh hingga lewat jenuh ... 3
Gambar 1.2 Ilustrasi perbedaan larutan encer dan konsentrat ... 3
Gambar 1.3 Larutan elektrolit ... 4
Gambar 2.1 Larutan Elektrolit ... 17
Gambar 2.2 Larutan Nonlektrolit ... 17
Gambar 2.3 Pasangan asam basa konjugasi ... 18
Gambar 2.4 Bronsted - Lowry Fase Gas ... 19
Gambar 2.5 Teori Asam Basa Lewis ... 21
Gambar 2.6 Hujan Asam ... 24
Gambar 2.7 pH sebagai fungsi konsentrasi ... 34
Gambar 2.8 Mengukur pH dengan Menggunakan Kertas Indikator (a) dan pH Meter (b)41 Gambar 2.9 Trayek perubahan warna ... 42
Gambar 2.10 Trayek perubahan warna Indikator Universal ... 42
Gambar 3.1 Reaksi Bolak-balik (Reversible) ... 51
Gambar 3.2 Perubahan konsentrasi dan laju reaksi ... 52
Gambar 3.3 Kurva Kesetimbangan 2NO2(g) N2O4 (g) ... 53
Gambar 3.4 Proses peredaran oksigen dalam darah ... 73
Gambar 4.1 Hubungan konstanta kecepatan reaksi dengan suhu ... 86
Gambar 4.2 Katalis dalam Reaksi Kimia ... 88
Gambar 4.3 Tes Orde Reaksi Nol Dari Persamaan Reaksi A → Produk ... 91
Gambar 4.4 Tes Orde Reaksi 1 untuk persamaan reaksi berbentuk A → Produk ... 92
Gambar 5.1 Bagan pembahasan ilmu termokimia ... 107
Gambar 5.2 Ilustrasi Proses Reaksi Eksotermis dan Endotermis ... 109
Gambar 5.3 Kalorimeter bom ... 117
Gambar 5.4 Kalorimeter sederhana ... 118
Gambar 6.1 Kurva hukum raoult ... 146
Gambar 6.2 Larutan Ideal dan Penyimpangan Hukum Raoult ... 149
Gambar 6.3 Penguapan ... 150
Gambar 6.4 Penurunan tekanan uap ... 151
Gambar 6.5 Penurunan tekanan uap jenuh larutan ... 152
xi
Gambar 6.7 Diagram P-T untuk Pelarut Air ... 155
Gambar 6.8 Diagram P-T untuk pelarut dan larutan karena adanya kenaikan titik didih 156 Gambar 6.9 Proses pembekuan pelarut dan larutan ... 156
Gambar 6.10 Tekanan osmotik ... 160
Gambar 6.11 Peristiwa osmosis ... 160
Gambar 6.12 Tekanan osmotik dan tekanan uap ... 161
xii
DAFTAR TABEL
Tabel 1.1 Indikasi lampu menyala pada beberapa senyawa ... 4
Tabel 1.2 Indikasi terang lampu pada beberapa senyawa ... 4
Tabel 2.1 Perbandingan tiga teori Asam-Basa ... 23
Tabel 2.2 Harga untuk beberapa Asam ... 27
Tabel 2.3 Harga Kb untuk beberapa Basa ... 28
Tabel 2.5 Hubungan antara pH dan pOH pada 25°C ... 31
Tabel 2.6 pH Beberapa Larutan ... 31
Tabel 2.7 Contoh Asam Monoprotik dan Poliprotik ... 35
Tabel 2.8 Contoh Senyawa Amfoter ... 39
Tabel 2.9 Indikator untuk Menunjukkan Asam atau Basa ... 41
Tabel 2.10 Trayek Perubahan Warna Indikator ... 42
Tabel 3.1 Susunan kesetimbangan reaksi antara gas karbon monoksida dengan gas hydrogen membentuk metana dan uap air padasuhu 1.200 K ... 54
Tabel 3.2 Harga Kp untuk reaksi setimbang pembentukan NH3 ... 70
Tabel 3.3 Harga Kp untuk Reaksi Setimbang antara H2 dan CO2 ... 70
Tabel 4. 1 Pengaruh kenaikan suhu terhadap konstanta kecepatan reaksi pada berbagai energi aktivasi ... 86
Tabel 5.1 Perbedaan Reaksi Eksoterm dan Endoterm ... 108
Tabel 5.2 Simbol Entalpi pada Berbagai Proses ... 111
Tabel 5.3 Nilai Entalpi Pembentukan Berbagai Zat dan Persamaan Termokimia Pembentukannya ... 112
Tabel 5. 4 Entalpi pembakaran dari berbagai zat pada kondisi standar ... 114
Tabel 5.5 Entalpi pembentukan senyawa ... 123
Tabel 5.6 Energi ikat antar Atom dari berbagai Senyawa (kJ/mol) ... 124
Tabel 5.7 Komposisi dan nilai kalor dari berbagai jenis bahan bakar ... 127
Tabel 6.1 Konstanta Kenaikan Titik Didih Molal dan Penurunan Titik Beku Beberapa Pelarut ... 154
Tabel 6.2 Data Percobaan tentang Penurunan Titik Beku ... 163
1
BAB 1
LARUTAN
Peta Konsep
Larutan adalah sebuah campuran yang homogen (satu fase) dari dua atau lebih substansi dengan fase yang sama atau berbeda. Substansi yang membentuk larutan disebut dengan komponen larutan. Jika larutan terdiri dari dua komponen penyusun saja, maka larutan tersebut disebut dengan larutan biner.
Dalam sebuah larutan (solution) pasti ada komponen yang disebut sebagai solute yakni zat yang terlarut dan solvent atau komponen yang melarutkan. Dalam larutan biner, umumnya komponen yang memiliki jumlah yang lebih besar disebut sebagai pelarut atau solvent. Sedangkan komponen satunya adalah zat terlarut. Klasifikasi larutan ada banyak macam, berikut ini klasifikasi larutan dilihat dari berbagai aspek.
A.
Tipe Larutan Berdasarkan Kejenuhan
1. Larutan Tak Jenuh
Larutan yang mengandung zat terlarut kurang dari yang diperlukan untuk membuat larutan itu menjadi jenuh. Artinya zat pelarut masih ada yang belum bereaksi semuanya,
Larutan
Tipe Larutan
Berdasarkan
Kejenuhan
Sifat
Koligatif
Larutan
Konsentrasi
Larutan
Pengenceran
Sifat Larutan
Setelah mempelajari bab ini, Anda diharapkan dapat:
1.
Memahami konsep larutan dan aplikasinya pada kehidupan sehari-hari.2 masih bisa untuk melarutkan lagi karena kondisi larutan belum menjadi jenuh. larutan tak jenuh ini terjadi saat hasil kasi konsentrasi ion kurang dari Ksp.
2. Larutan Jenuh
Larutan yang jumlah pelarut dan zat terlarutnya memiliki jumlah yang tepat untuk bereaksi. Sehingga baik zat pelarut dan terlarut sudah tidak ada yang tersisa atau sudah tepat habis bereaksi semuanya. Secara perhitungan, larutan jenuh terjadi saat hasil konsentrasi ion = Ksp berarti larutan tepat jenuh.
3. Larutan Kelewat Jenuh
Larutan ini terjadi jika jumlah zat pelarut lebih kecil daripada jumlah terlarut. Larutan ini ditandai dengan adanya endapan pada larutan. Secara perhitungan, larutan lewat jenuh terjadi saat hasil konsentrasi ion > Ksp.
Ilustrasi
Jika kita akan membuat oralit sederhana, dengan melarutkan garam dan gula kedalam air, kita dapat mengamati perbedaan dari ketiga kondisi larutan diatas.
Larutan tidak Jenuh
Terdapat 100 mL air dan 30 gram NaCl + gula,
tidak terdapat endapan, air masih bisa melarutkan beberapa gram lagi
3
Sumber
:
www.mundoeducacao.comGambar 1.1Perbedaan larutan tidak jenuh hingga lewat jenuh
4.
Tipe Larutan Berdasarkan Jumlah Zat Yang Terlarut
Dalam pemakaiannya, terkadang kita mendengar istilah dilute atau larutan encer dan concentrated yang artinya adalah larutan kental. Pada larutan encer atau dilute solution artinya terdapat jumlah komponen terlarut relatif lebih kecil daripada pelarutnya.
Sumber : www.wikipedia.com
Gambar 1.2Ilustrasi perbedaan larutan encer dan konsentrat
Berikut merupakan aplikasi asam basa dalam bidang kesehatan. Di dalam tubuh kita terdapat asam lambung. Asam ini adalah larutan encer asam klorida. Di dalam perut, asam ini membantu proses pencernaan protein pada makanan. Jika kandungannya terlalu tinggi, maka akan menyebabkan masalah yang biasanya dialami oleh penderita maag.
5.
Tipe Larutan Berdasarkan Kemampuan Mengionisasi
Menurut Svante August Arrhenius, larutan dibagi menjadi 2 yakni larutan elektrolit dan larutan nonelektrolit. Hal ini dikarenakan hasil pengamatannya menunjukkan bahwa
Larutan Jenuh
Terdapat 100 mL air dan 36 gram NaCl + gula,
tidak terdapat endapan, air sudah tidak bisa melarutkan.
Larutan sangat Jenuh
Terdapat 100 mL air dan 40 gram NaCl + gula,
Terdapat 4 gram endapan yang tidak dapat melarut lagi.
36 gr NaCl+ Gula
4 larutan dapat menghantarkan arus listrik jika larutan tersebut mengandung partikel-partikel yang bermuatan listrik dan bergerak bebas di dalamnya.
Terdapat contoh pembuktian untuk teori ini. Awalnya kita siapkan rangkaian lampu kecil, kabel, batangan logam besi atau tembaga dan beberapa larutan.
Sumber : http://www.gettyimages.com Gambar 1.3Larutan elektrolit
Hasil pengamatannya adalah sebagai berikut.
Tabel 1.1 Indikasi lampu menyala pada beberapa senyawa
Senyawa Rumus Lampu menyala Lampu tidak menyala
Garam dapur NaCl ✓
Asam cuka CH3COOH ✓
Gula C12H22O11 ✓
Alcohol (etanol) C2H5OH ✓
Dari Tabel tersebut dapat dilihat bahwa garam dapur dan asam cuka dapat menghantarkan listrik, sehingga larutan ini disebut sebagai larutan elektrolit. Sedangkan gula dan etanol tidak dapat menghantarkan listrik, sehingga disebut sebagai larutan non elektrolit.
Derajat Ionisasi (α)
Dari beberapa pergantian larutan, terdapat banyak larutan yang dapat menghantarkan listrik. Namun, ada perbedaan kualitas penerangan yang dihasilkan. Hasil percobaannya seperti pada Tabel 1.2 sebagai berikut.
Tabel 1.2 Indikasi terang lampu pada beberapa senyawa
Larutan Nyala Lampu
Terang Kurang Terang
NaCl ✓
CuSO4 ✓
HNO3 ✓
CH3COOH ✓
C2H2O4 ✓
C6H8O7 ✓
5 Kuat lemahnya larutan elektrolit ini dipengaruhi oleh derajat ionisasi. Derajat ionisasi adalah banyaknya zat yang terionisasi (mol) terhadap jumlah zat mula-mula (mol).
𝛼 =
𝑚𝑜𝑙 𝑧𝑎𝑡 𝑦𝑎𝑛𝑔 𝑡𝑒𝑟𝑖𝑜𝑛𝑖𝑠𝑎𝑠𝑖𝑚𝑜𝑙 𝑧𝑎𝑡 𝑚𝑢𝑙𝑎−𝑚𝑢𝑙𝑎 (1.1)Semakin banyaknya zat yang mengalami proses ionisasi, maka semakin besar pula derajat ionisasinya, yang menghasilkan daya listrik yang semakin kuat. Untuk larutan elektrolit, harga 0 < α≤ 1. Nilai α=1, maka larutan tersebuttermasuk larutanelektrolit kuat dan larutan elektrolit lemah memiliki nilai 0 < α < 1. Sedangkan untuk larutan non elektrolit maka nilai α=0.
B.
Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat larutan yang ditentukan oleh banyaknya zat terlarut dalam suatu larutan. Dengan kata lain, sifat ini sangat dipengaruhi dari konsentrasi zat terlarut. Sifat ini hanya bergantung pada banyaknya zat terlarut, tidak tergantung pada macamnya zat terlarut.
Sifat ini dapat muncul ketika terjadi proses pelarutan, yakni proses penambahan suatu zat terlarut kedalam suatu zat pelarut. Semisal kita memiliki larutan 1 yakni pelarut air murni sebanyak 100 mL. dalam kondisi STP air ini memiliki titik didih 100oC dan titik beku 0oC. lalu kita menambahkan 100 gram gula kedalamnya. Maka, titik didih larutan
tersebut tidak lagi 100oC namun akan di atas itu. Begitu pula jika didinginkan, titik bekunya akan dibawah 0oC. perubahan nilai inilah yang disebut dengan sifat koligatif larutan.
Terdapat empat perubahan sifat koligatif larutan yaitu penurunan tekanan uap jenuh, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. Keempat sifat tersebut akan dijelaskan lebih detail pada bab 6.
C.
Konsentrasi Larutan
Jika kita ingin membuat suatu larutan, kemudian ingin mencampurkannya dengan suatu kondisi tertentu, tentunya bukan hal yang mudah jika kita tidak dapat mengidentifikasi kondisinya dalam bentuk kualitatif. Oleh karena itu, kita perlu menggambarkannya dalam sebuah ukuran yang dinamakan konsentrasi. Konsentrasi adalah sebuah besaran yang memiliki pengertian tentang jumlah zat terlarut dan pelarut.
6 ingin disampaikan konsentrasinya. Misalnya, pada botol obat sakit maag, dituliskan
“didalam setiap satu sendok (5 mL) mengandung Magnesium trisilicate 325 mg, alumunium hidroksida bentuk koloid 325 mg dan dimethicone aktif 25 mg.
Contoh lain adalah misalnya konsentrasi mengacu pada Angka Kebutuhan Kalori (AKG), sehingga dalam botol minuman tertera, dalam kemasan ini mengandung karbohidrat 6%, Natrium 8%, Kalium 3%, Magnesium 5%, Kalsium 5%, vitamin B3 50%, vitamin B6260% dan vitamin B12 200%.
Dari dua contoh diatas ada 2 macam contoh pernyataan konsentrasi yakni mg/mL dan %. Kali ini akan dibahas macam-macam penyataan konsentrasi larutan yang sering digunakan pada ilmu kimia.
1.
Persen berat
Apabila terdapat sebuah pada botol terdapat label bertuliskan 20% HCl (% berat), ini termasuk pernyataan konsentrasi persen berat. Artinya dalam botol tersebut terdapat 20 gram HCl dalam 100 gram larutan. Jika HCl tersebut dilarutkan dalam air, maka:
Massa HCl = 20 gram Massa larutan = 100 gram
Massa air = 100 – 20 = 80 gram
2.
Persen Volume
Persen volume memiliki prinsp yang sama dengan persen berat. Jika ada botol asam cuka dengan label bertuliskan, asam cuka CH3COOH 14 % (% volume) dengan
pelarut air maka:
Volume CH3COOH = 14 mL
Volume larutan = 100 mL
Volume air = 100-14 = 86 mL
3.
Fraksi Mol
Fraksi mol menyatakan rasio jumlah mol zat yang terlarut atau mol zat pelarut tiap jumlah mol keduanya. Dimisalkan, A adalah notasi untuk zat terlarut dan B adalah notasi untuk zat pelarut. Maka, fraksi mol zat terlarut (XA) adalah
𝑋𝐴= 𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵𝑚𝑜𝑙 𝐴 (1.8)
Sedangkan fraksi mol B (XB) adalah:
𝑋𝐵 = 𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵𝑚𝑜𝑙 𝐵 (1.9)
7 𝑋𝐴+ 𝑋𝐵 = 𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵𝑚𝑜𝑙 𝐴 + 𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵𝑚𝑜𝑙 𝐵 (1.10)
𝑋𝐴+ 𝑋𝐵=𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵𝑚𝑜𝑙 𝐴+𝑚𝑜𝑙 𝐵,= 1
Contoh soal :
0.1 mol NaCl dilarutkan dalam 100 gram H2O murni. Berapakah fraksi mol NaCl?
Penyelesaian :
n (H2O) = massa : MR H2O = 100 gram : 18 g/mol = 5.56 mol H2O
Fraksi mol NaCl = 𝑚𝑜𝑙 𝑁𝑎𝐶𝑙 𝑚𝑜𝑙 𝑁𝑎𝐶𝑙+𝑚𝑜𝑙 𝐻2𝑂 =
0.1 0.1+5.56 =
0.1
5.66 = 0.018 Dan jika ditanya fraksi mol H2O dapat dicari dengan 2 cara, yaitu :
Pertama adalah= 5.56
0.1+5.56 = 0.982 atau fraksi mol H2O = 1- 0.018 = 0.982 namun, untuk cara kedua hanya berlaku jika penyusun larutan hanya terdiri dari 2 zat.
4.
Molalitas
Molalitas (m) adalah besaran yang banyak digunakan terutama saat mempelajari sifat-sifat zat yang ditentukan oleh jumlah partikel misalnya kenaikan titik didih atau penurunan titik beku larutan. Molalitas menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut. Ingat, agak berbeda dengan beberapa besaran konsentrasi larutan sebelumnya, molalitas dinyatakan dalam banyaknya pelarut bukan larutan.
Contoh soal :
Jika kita memiliki 1 mol sukrosa (sekitar 342,3 gram) dan memprosesnya dengan mencampurnya dengan 1 liter air, maka gula sukrosa itu akan larut dan menjadi air gula. Kita terus mengaduknya hingga tidak ada padatan gula yang tersisa. Kita memastikan bahwa larutan tersebut benar-benar telah bercampur sempurna. Berapakah molalitas gula sukrosa tersebut?
Penyelesaian :
Pertama, kita harus mengkonversi volume air menjadi berat air. Densitas air = 1 gram/mL. Volume air adalah 1 L maka, Massa air = densitas x Volume = 1 g/mL x 1000 mL = 1000 gram air = 1 kg air.
Molalitas
=
𝑚𝑜𝑙 𝑡𝑒𝑟𝑙𝑎𝑟𝑢𝑡𝑘𝑖𝑙𝑜𝑔𝑟𝑎𝑚 𝑝𝑒𝑙𝑎𝑟𝑢𝑡
(1.11)
Molaritas
=
1 𝑚𝑜𝑙8
5.
Molaritas
Molaritas (M) adalah satuan konsentrasi yang umum digunakan. Molaritas didefinisikan sebagai berapa banyak mol terlarut dalam 1 L larutan. Satu hal penting yang harus diperhatikan adalah, volume larutan itu belum tentu sama dengan volume pelarut. Contoh soal :
Bagaimana caranya membuat 120 mL larutan potassium hidroksida (KOH) dengan konsentrasi 0.1 M didalam air?
Penyelesaian :
Jumlah mol KOH yang dibutuhkan adalah:
Volume larutan x Molaritas = 0.12 L x 0.1 mol/L = 0.012 mol
Berat molekul KOH adalah 56.1 gram/mol. Maka berat KOH yang dibutuhkan adalah: Mol KOH x BM KOH = 0.012 mol x 56.1 g/mol
= 0.67 gram
Maka, 0.67 gram harus dilarutkan dalam air hingga volume larutannya 120 mL.
Walaupun molaritas ini banyak digunakan, namun satuan konsentrasi ini memiliki kelemahan. Karena volume itu jumlahnya bergantung pada temperatur, maka 0.1 M larutan pada suhu 0oC akan memiliki konsentrasi yang berbeda pada suhu 50oC. Oleh karena itu, molaritas tidak disarankan sebagai pernyataan konsentrasi larutan pada proses yang mengandung perubahan kondisi operasi suhu atau tekanan.
6.
Normalitas
Normalitas (N) merupakan satuan konsentrasi yang memperhitungkan juga kation dan anion yang ada pada larutan. Normalitas mendefinisikan berapa banyaknya gram ekivalen zat dalam satu liter larutan. Sederhananya, Gram ekivalen adalah jumlah gram zat untuk mendapat satu muatan.
Contoh soal :
Mol H2SO4 dalam 1 L larutan, berdasarkan reaksi di bawah, maka ekivalensinya adalah 2.
Karena setelah proses ionisasi, menghasilkan 2 muatan. Penyelesaian :
H2SO4 2H+ + SO42- 1 L larutan 1 L larutan
1 mol 2 mol 1 mol
↓ 2 muatan 2 muatan
98 gram Menghasilkan masing-masing 2 muatan
9 49 gram Menghasilkan
masing-masing 1muatan
½ Molar (½M) 1 Normal (1N) Maka normalitasnya adalah:
Mol x ekuivalensi : Volume larutan = 1 mol x 2 : 1 Liter = 2 Normal
Untuk mendapatkan larutan 1 N, maka zat yang dibutuhkan hanya 49 gram H2SO4
dilarutkan kedalam 1 Liter air, karena dengan 49 gram atau 0.5 molar sudah dihasilkan satu muatan dari zat-zat yang terionisasi.
D.
Pengenceran
Di dalam pembuatan larutan, sering sekali dilakuan pengenceran. Pengenceran dilakukan dengan tujuan untuk mendapatkan konsentrasi tertentu dari suatu bahan yang telah diketahui konsentrasi awalnya. Secara kualitatif, hal tersebut sudah sering kita laksanakan. Seperti misalnya saat membuat minuman teh manis, jika rasanya terlalu manis, maka kita akan menambahkan pelarut berupa air agar konsentrasi zat terlarut yakni gulanya akan semakin kecil. Secara kuantitas, biasanya hal ini sering dilakukan di laboratorium. Biasanya kita membuat larutan induk dari bahan padat.
Misalnya kita memiliki 40 gram padatan NaOH yang dilarutkan dalam 0.5 Liter air. Sehingga didapatkan konsentrasinya adalah 2 Molar. Katakanlah, kita membutuhkan larutan NaOH 0.5 M sebagai titran untuk sebuah analisa, maka kita harus melakukan proses pengenceran. Awalnya, semisal kita ambil 2 Molar NaOH sebanyak 50 mL, maka secara matematis, kita hitung:
M1 x V1 = M2 x V2 (1.12)
2 x 50 = 0.5 x V2 V2 = 200 mL
Maka, kita harus mengencerkan 50 mL NaOH awal tadi sehingga mencapai 200 mL.
E.
Sifat Larutan
10
1.
Sifat Kimia
a.
Asam
Secara fisik, asam dapat diindikasi dari rasanya yang asam, jika termasuk asam kuat makan dapat merusak logam atau lantai dan korosif. Asam akan bereaksi dengan logam dan menghasilkan gas hydrogen. Selain itu, dapat ditandai dengan perubahan indikator. Jika memasukkan lakmus biru dalam bahan asam, maka akan mengubah warna lakmus menjadi merah.
b.
Basa
Sifat fisik basa adalah terasa getir, licin saat terkena kulit dan dapat mengubah warna lakmus merah menjadi biru.
c.
Garam
Garam merupakan senyawa yang terbentuk dari sisa asam (bermuatan negatif) dengan sisa basa atau logam (bermuatan positif) sehingga bersifat elektrolit. Pada umumnya, garam memiliki sifat netral karena adanya sisa asam dan sisa basa. Akan tetapi, terkadang garam dapat memiliki nilai pH kurang dari 7 sehingga bersifat asam atau lebih dari 7 sehingga bersifat basa. Berdasarkan sifat asam-basanya, garam dapat digolongkan menjadi tiga kelompok yaitu garam normal, garam asam, dan garam basa.
Telah kita pelajari bahwa apabila larutan asam bereaksi dengan larutan basa akan terbentuk senyawa garam. Sebaliknya, jika kita melarutkan suatu garam ke dalam air, maka ada dua kemungkinan yang akan terjadi, yaitu:
1. Ion-ion yang berasal dari asam kuat (seperti Cl-, NO3-, SO42-) atau ion-ion yang berasal
dari (seperti K+, Na+, Ca2+) tidak akan bereaksi. Hal ini karena ion tersebut tidak
memiliki kecenderungan untuk kembali ke bentuk asam atau basa asalnya. Contoh
:
Cl- + H
2O tidak bereaksi
Ca2+ + H2O tidak bereaksi
2. Ion-ion yang berasal dari asam lemah (seperti CN-, CH3COO-, S2-) atau ion-ion yang
berasal dari (seperti NH4+, Fe2+, Al3+) akan bereaksi dengan air. Hal ini terjadi karena
ion tersebut memiliki kecenderungan untuk kembali ke bentuk asam atau basa asalnya. Reaksi antara suatu ion dengan air inilah yang disebut dengan hidrolisis.
11 garam dapat dikelompokkan menjadi empat kelompok berdasarkan dari komposisi penyusun garamnya.
1)
Garam dari Asam Kuat dan Basa Kuat
Garam yang berasal dari komposisi ini tidak mengalami reaksi dengan air atau tidak terjadi hidrolisis. Ion-ion dari asam kuat maupun dari basa kuat telah mengalami reaksi ionisasi yang berkesudahan sehingga cenderung tidak akan membentuk asam atau basa asalnya lagi.
CaCl2Ca2+ + 2Cl
-Ca2+ + H2O ↛ (tidak bereaksi)
2Cl- + H2O ↛ (tidak bereaksi)
Sifat larutan garam yang tidak mengalami hidrolisis yaitu netral atau memiliki pH = 7 dan pOH = 7.
2)
Garam dari Asam Kuat dan Basa Lemah
Apabila garam dari asam kuat dan basa lemah dilarutkan ke dalam air maka ion dari asam kuat tidak akan mengalami reaksi, sedangkan ion dari basa lemah akan terhidrolisis. Jadi, larutan garam tersebut mengalami hidrolisis parsial atau hidolisis sebagian.
NH4NO3 NH4+ + NO3
-NO3- + H2O ↛ (tidak bereaksi)
NH4+ + H2O NH4OH + H+
Dari reaksi di atas terlihat bahwa larutan memiliki ion H+ bebas yang mencirikan
larutan bersifat asam (pH < 7).
3)
Garam dari Asam Lemah dan Basa Kuat
Garam yang berasal dari komposisi ini akan terjadi reaksi hidrolisis parsial untuk ion yang berasal dari asam lemah, sedangkan ion dari basa kuat tidak akan bereaksi. Contoh
:
CH3COONa CH3COO- + Na+
Na+ + H2O ↛ (tidak bereaksi)
CH3COO- + H2O CH3COOH + OH
-Ion OH- mencerminkan sifat basa pada larutan sehingga garam yang berasal dari
12
4)
Garam dari Asam Lemah dan Basa Lemah
Pada garam dengan komposisi ini, baik kation maupun anion dari garam akan dengan air sehingga terjadi hidrolisis total atau hidrolisis sempurna. Sebagai contoh, garam CH3COONH4 akan terionisasi sebagai berikut:
CH3COONH4 CH3COO- + NH4+
CH3COO- + H2O ↔ CH3COOH + OH
-NH4+ + H2O ↔ NH4OH + H+
Dari reaksi di atas terlihat bahwa hidrolisis garam menghasilkan ion H+ dan OH -sehingga garam mungkin akan bersifat asam, basa, atau netral. Oleh karena itu, pH larutan bergantung pada nilai Ka asam lemah dan Kb basa lemah:
1. Jika Ka = Kb maka larutan bersifat netral atau pH = 7 2. Jika Ka > Kb maka larutan bersifat asam atau pH < 7 3. Jika Ka < Kb maka larutan bersifat basa atau pH > 7
Ada beberapa garam yang terbentuk secara tidak normal yaitu masih mempunyai gugus asam atau basa pada garamnya. Garam jenis ini akan bersifat asam jika masih memiliki gugus H+ atau bersifat basa jika masih memiliki gugus OH-.
Contoh soal :
NaHSO4 (natrium hidrosulfat), NaH2PO4 (natrium dihidrofosfat) : garam asam
[Mg(OH)]2SO4 (magnesium hidroksi sulfat), [Al(OH)2]NO3 : garam basa.
2.
Sifat Fisika
Sifat fisika larutan meliputi tekanan uap, titik didih, titik beku dan tekanan osmotik. Sifat fisika larutan tersebut akan dibahas lebih lanjut bab 6.
UJI KOMPETENSI
1. Tentukan konsentrasi persen berat (w/w) dari sebuah larutan yang terdiri dari 4,5 gram sukrosa dalam 90 mL air?
13 2. Berapa gram kah KCl dan air yang dibutuhkan jika kita ingin membuat larutan KCl
dalam air dengan konsentrasi 20% (w/w) seberat 30 gram? A. 6 gram KCl dalam 24 mL air
B. 0.6 gram KCl dalam 24 mL air C. 6 gram KCl dalam 30 mL air D. 0.6 gram KCl dalam 30 mL air E. 0.6 gram KCl dalam 25 mL air
3. Berapa massa KOH yang dibutuhkan untuk membuat larutan KOH 0.1 M sebanyak 120 mL dalam air? (Mr KOH = 56)
A. 672 gram B. 67.2 gram C. 6.72 gram D. 0.672 gram E. 0.0672 gram
4. Hitunglah molaritas dari 60% (w/w) larutan etanol (C2H5OH) dalam air. Jika diketahui
densitas larutan ini adalah 0.8937 gram/mL. A. 11.6 M
B. 1.16 M C. 0.116 M D. 0.0116 M E. 0.00116 M
5. Lakmus biru akan menjadi merah dalam larutan: A. NH3
B. CH3COOH
C. LiOH D. Ba(OH)2
E. NaOH
6. Jika kondisi seperti nomor 4 diatas, hitunglah berapa molalitasnya. A. 12.9 m
14 7. 100.0 gram sukrosa (C12H22O11, mol. wt. = 342.3 g/mol) dilarutkan dalam 1.50 L air.
Berapakan molalitasnya? A. 0.292 m
B. 0.195 m C. 0.000292 m D. 0.000195 m E. 0.0195 m
8. Berapa gram banyaknya air yang harus digunakan untuk melarutkan 100 gram sukrosa C12H22O11 untuk menyiapkan fraksi mol sukrosa 0.02 dalam larutan?
A. 0.292 gram B. 14.308 gram C. 0.98 gram D. 258 gram E. 250 gram
9. Hitunglah pH dari 0.001 M larutan HCl
HCl H+ + Cl– HCl adalah asam kuat.
A. 2 D. 5
B. 3 E. 6
C. 4
10. NH4OH adalah basa lemah karena...
A. memiliki tekanan uap yang rendah B. terionisasi sebagian
C.
terionisasi sempurna
D. memiliki densitas yang rendah E. memiliki titik didih yang rendah
11. Hitunglah pH larutan 0.1 M CH3COOH. Jika diketahui konstanta ionisasinya 1.8 ´ 10 -5 M.
A. 1
15 12. Ketika 10–6 mol dari sebuah monobasic asam kuat dilarutkan dalam 1 Liter pelarut,
maka pH larutan menjadi ... A. 6
B. 7
C. kurang dari 6 D. lebih dari 7 E. 5
13. Saat pH larutan adalah 2, konsentrasi ion hydrogen dalam kosentrasi mol/Liter adalah ...
A. 1. 10–12
B. 1.10–2 C. 1. 10–7
D. 1. 10–4 E. 1. 10–8
14. pH larutan yang terdiri dari 0.1 N NaOH adalah ... A. 1
B. 10–1 C. 13 D. 10–13 E. 5
15. Disebut apakah larutan yang tahan terhadap perubahan pH jika ditambahkan sejumlah asam atau basa?
16
BAB 2
TEORI ASAM BASA
Peta Konsep
Setelah mempelajari bab ini, Anda diharapkan dapat:
1. Mengetahui dan mampu menjelaskan pengertian asam basa menurut Arrhenius, Bronstead-Lowry, dan Lewis.
2. Mengetahui dan mampu mengukur pH beberapa larutan asam/basa kuat dan lemah yang konsentrasinya sama dengan indikator universal.
3. Mengetahui dan mampu menyimpulkan hubungan antara besarnya harga pH terhadap kekuatan asam/basa.
4. Mengetahui dan mampu menghubungkan kekuatan asam atau basa dengan derajat ionisasi dan tetapan kesetimbangan ionisasinya.
5. Mampu menjelaskan dan menghitung pH larutan asam/basa dari data konsentrasinya. 6. Mampu menjelaskan dan mengamati trayek perubahan warna berbagai indikator
asam/basa dan memperkirakan pH suatu larutan elektrolit yang tidak dikenal.
A.
Elektrolit
Elektrolit adalah senyawa yang terdisosiasi atau terionisasi jika dilarutkan ke dalam air menghasilkan kation dan anion. (kebalikannya disebut nonelektrolit). Contoh :
NaCl → Na+(aq) + Cl-(aq)
Di dalam air garam NaCl akan terdisosiasi menghasilkan ion Na+ dan Cl- yang terhidrasi (dikelilingi oleh molekul air).
Teori Asam Basa
Elektrolit
Arrhenius
Teori
Teori
Bronsted-Lowry
Teori Lewis
Ikhtisar
Teori
Arrhenius
, Bronsted
Sifat Asam
dan Basa
Rekasi
Ionisasi
17 Untuk garam yang mengandung ion poliatomik, maka di dalam air ion tersebut tidak terdisosiasi menjadi unsur-unsur penyusunnya. Contoh: garam Na2SO4 di dalam air
akan terionisasi menjadi ion natrium dan ion sulfat.
Na2SO4 → 2Na+(aq) + SO42-(aq)
Larutan elektrolit dalam air dapat menghantarkan arus listrik (Gambar 2.1). Contoh larutan non-elektrolit :
1. Gula, dalam air tidak terionisasi. Larutan gula tidak dapat menghantarkan arus listrik (Gambar 2.2).
2. Senyawa-senyawa organik pada umumnya tidak terionisasi dalam air, sehingga bersifat nonelektrolit.
Sumber: www.wikipedia.com
B.
Teori Arrhenius
Setiap molekul HNO3 dan HCl hanya dapat menghasilkan 1 ion H+ disebut valensi
asam. Asam semacam ini disebut juga asam monoprotik. Asam yang setiap molekulnya dapat menghasilkan 2 ion H+ disebut asam diprotik, sedangkan yang menghasilkan 3 ion H+ disebut asam triprotik. Asam diprotik dan asam triprotik dikelompokkan ke dalam asam poliprotik.
Arhenius mendefinisikan bahwa:
Svante August Arrhenius pada tahun 1887 menyatakan bahwa: “Molekul-molekul elektrolit selalu menghasilkan ion-ion negatif dan positif jika dilarutkan dalam air”. Selanjutnya pada tahun 1900 ia mengemukakan teori yang dikenal sampai sekarang yaitu Teori Asam Basa Arrhenius: “Asam merupakan suatu senyawa yang dapat menghasilkam ion Hidrogen (H+) bila dilarutkan dalam air. Basa merupakan suatu senyawa yang dapat memberikan ion Hidroksida (OH-) bila dialrutkan dalam air”
18
• Asam adalah senyawa yang menghasilkan ion H3O+ (menambah konsentrasi H+) jika
dilarutkan dalam air.
• Basa adalah senyawa yang menghasilkan ion OH- jika dilarutkan di dalam air. Asam
adalah zat yang menambah konsentrasi H+ dalam larutan air.
Ikhtisar Teori Arrhenius:
1. Asam : HA ⇄ H++ A− 2. Basa : BOH ⇄ B++ OH− 3. Penetralan adalah : H+ ⇄ OH−+ H2O
C.
Teori Bronsted-Lowry (Johannes Nicholas Bronsted, dan Thomas
Martin Lowry, 1923)
Menurut Bronsted dan Lowry asam adalah zat yang dapat memberikan proton. Basa adalah zat yang dapat menerima proton.
• Asam adalah donor proton
• Basa adalah akseptor proton
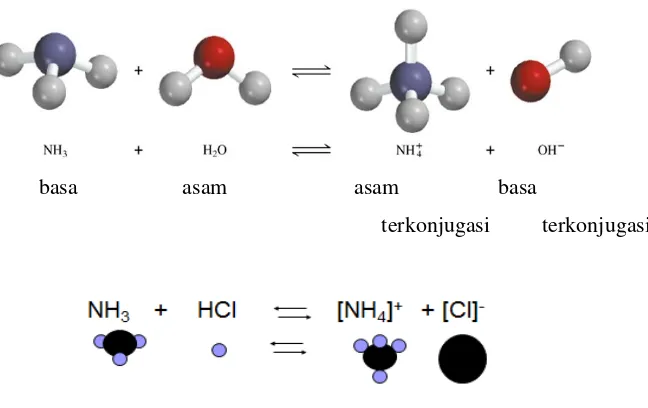
Zat yang dapat bertindak sebagai asam ataupun basa disebut amfiprotik. Banyak pelarut adalah amfiprotik jika suatu asam HA dilarutkan ke dalam suatu pelarut amfiprotik, HL, hasil ionisasinya merupakan reaksi asam-basa. Tidak hanya berlaku untuk larutan, tapi bisa untuk molekul, ion, dan gas.
Sumber: slide share/yuliasti
19 basa asam asam basa
terkonjugasi terkonjugasi
Sumber: www.slideshare.com Gambar 2.4Bronsted - Lowry Fase Gas
Sesuai dengan pengionian asam dan basa, maka reaksi asam dan basa dapat berlangsung sebagai berikut:
HA + HL ⇄ H2L+ +A− B + HL ⇄ BH++ L−
H2L + L ⇄ 2HL
Jika ketiga reaksi ini dijumlahkan diperoleh reaksi sederhana sebagai berikut: HA + B ⇄ BH++ A−
Ikhtisar Teori Bronsted-Lowry: 1. Asam : donor proton. 2. Basa : akseptor proton.
3. Reaksi penetralan adalah reaksi perpindahan proton dari asam ke basa.
(dalam air) H3O+ + OH− ⇄ H2O + H2O
(dalam amonia) NH4 + NH2 ⇄ NH3 + NH3
4. Reaksi asam-basa Bronsted dapat berlangsung dalam berbagai pelarut, ataupun juga berlangsung dalam fasa gas dimana tidak terdapat pelarut misalnya.
HCl + NH3 ⇄ NH4+ + OH−
Asam1 basa2 asam2 basa1
5. Setiap asam mempunyai basa konjugasi:
A + B ⇄ H+
20 Kedua spesi disebut pasangan konjugasi asam-basa.
A adalah asam konjugasi dari B, sedangkan B adalah basa konjugasi dari A. 6. Pelarut dapat juga berfungsi sebagai asam atau basa.
Dari contoh di bawah ini air adalah basa jika berfungsi sebagai pelarut untuk HCl, tetapi sebagai asam jika bereaksi dengan NH3.
Sifat molekul seperti air yang dapat berfungsi baik sebagai asam maupun basa disebut amfiprotik.
7. Reaksi penetralan untuk pelarut bukan air seperti amonia, etil alkohol, asam asetat dan basa sulfat ialah:
8. Semakin kuat suatu asam, semakin lemah basa konjugasinya. Semakin kuat suatu basa, semakin lemah asam konjugasinya.
D.
Teori Lewis (Gilbert Newton Lewis, 1923)
Menurut teori Lewis, asam merupkan setiap spesi yang mengandung atom yang dapat menerima pasangan elektron. Basa adalah setiap spesi yang mengandung atom yang dapat memberikan pasangan elektron.
• Asam : akseptor pasangan eletron.
•
Basa : donor pasangan elektron.
HCl
+ H
2O
⇄
H
3O
++
Cl
−asam
1basa
2asam
2basa
1NH
3+ H
2O
⇄
NH
4++
OH
−basa
1asam
2asam
1basa
2asam
1basa
2asam
2basa
1NH
4++
NH
2−⇄
NH
3+
NH
3CH
3C(OH)
2++
CH
3COO
−⇄
CH
3COOH
+
CH
3COOH
C
2H
5OH
2++
C
2H
5O
−⇄
C
2H
5OH
+
C
2H
5OH
H
3SO
4++
HSO
4−⇄
H
2SO
4+
H
2SO
4HCOOH
2++
HCOO
-⇄
HCOOH
+
HCOOH
CH
3OH
2++
CH
3O
−⇄
CH
3OH
+
CH
3OH
21
Sumber: www.wikipedia.com
Gambar 2.3 Teori Asam Basa Lewis
Macam-macam asam-basa Lewis:
2. Senyawa yang atom sentralnya mempunyai oktet tidak lengkap
3. Senyawa yang oktet atom sentralnya dapat diperluas menjadi:
22
Asam
Basa
Kompleks koordinasi
Contoh yang lain
:
SnCl4,
TiCl4,
PCl3,
SF4,
SeF4.
4.
Senyawayang mengandung pusat asamberikatan banyak.
O
C O
+
−O − H
→
−5.
Unsur dengan sektet elektron.
S + 3O
2-→
S
+
S
2−→
[S = S]
2−Asam
Basa
Kompleks koordinasi
Ikhtisar Teori Lewis:
1. Asam adalah akseptor pasangan elektron. 2. Basa adalah donor pasangan elektron.
3. Reaksi penetralan: A + :B→A + :B. Pada reaksi penetralan terbentuk ikatan kovalen koordinasi.
4. Teori Lewis dapat juga menjelaskan reaksi tradisional:
H
++
O − H
−→ H − O − H
Ataupun reaksi tanpa perpindahan proton.
E.
Ikhtisar Teori Arrhenius, Bronsted-Lowry, Lewis
Perbandingan ketiga teori asam-basa dapat dilihat Tabel 1 di bawah ini.
O C O
O
H
O
S
O O
-23
Tabel 2.1Perbandingan tiga teori Asam-Basa
Teori Arrhenius
Asam Menghasilkan H+dalam air Donor proton
Akseptor pasangan elektron
Definisi Basa
Menghasilkan OH−dalam
air Akseptor proton Donor pasangan elektron
Penetralan Pembentukan air Perpindahan proton Pembentukan ikatan kovalen koordinat
Reaksi H+ + OH−⇄ H2O HA+ B⇄ BH++ A− A + B⇄A:B
Batasan Hanya larutan air Hanya reaksi perpindahan
proton Teori yang lebih umum
F.
Beberapa Sifat Asam dan Basa
Berikut ini merupakan sifat asam dan basa.
1.
Asam• Berasa asam.
• Pada umumnya memerahkan lakmus biru.
• Beberapa jenis dapat mengkorosilogam.
• Mengubah kertas lakmus biru menjadi merah.
• Bereaksi dengan logam aktif menghasilkan garam dan gas Hidrogen (H2).
• Rasanya masam/asam.
• Menghantarkan arus listrik.
• Bereaksi dengan basa menghasilkan air dan senyawa garam.
• Contoh asam: asam sulfat, asamsitrat dalam jus lemon, asamaskorbat.
2.
Basa• Berasa pahit.
• Membirukan lakmus merah.
• Mengubah kertas lakmus merah menjadi biru.
• Terasa licin jika mengenai kulit.
• Rasanya getir / pahit.
• Menghantarkan listrik.
• Bereaksi dengan asam menghasilkan air dan senyawa garam.
• Contoh basa : Mg(OH)2 , NaOH.
3.
Asam dan basa kuat, seperti HNO3, HCl (untuk asam), NaOH, Mg(OH)2 (untuk basa),24
4.
Sebaliknya, jika asam dan basa lemah berarti hanya sebagian kecil saja yang terionisasi sehingga daya hantar listriknya pun relatif kecil elektrolit lemah.5.
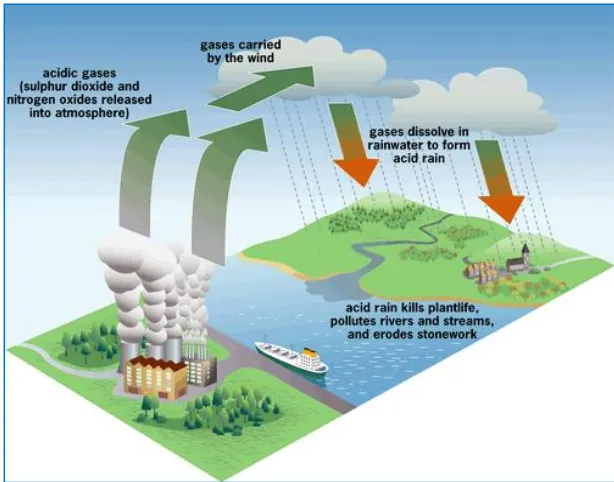
Di dalam larutan, elektrolit lemah membentuk sistem kesetimbangan antara molekul dan ion-ionnya. Contoh:CH3COOH + H2O →CH3COO-+ H+Sumber: www.ilmugeografi.com
Gambar 2.4Hujan asam
G.
Reaksi Ionisasi Asam dan Basa Dalam Air
Secara umum asam adalah senyawa molekular yang beraksi dengan air menghasilkan ion-ion, salah satunya adalah ion hidronium. Contoh, asam klorida murni adalah suatu gas dan senyawa molekular, bukanionik. Bila dilarutkan dalam air, terjadi reaksi kimia berikut, menghasilkan ion-ion yang tidak ada dalam asam klorida.
HCl (g)+ H2O → H3O++ Cl
Untuk asam poliprotik :
H2SO4(aq)+ H2O → H3O+(aq)+ HSO4-(aq)
HSO4-(aq)+ H2O → H3O+(aq)+ SO42-(aq)
Anhidrida asam :
SO3(g)+ H2O → H2SO4(aq) asam sulfat
N2O5(g)+ H2O → 2 HNO3(aq) asam nitrat
25 Basa dimasukkan dalam dua kategori :
a) Senyawa ionik yang mengandung OH- atau O2-.
b) Senyawa molekular yang bereaksi dengan air menghasilkan ionhidroksil. NaOH(s) → Na+(aq) + OH-(aq)
Anhidrida basa :
CaO(s)+ H2O → Ca(OH)2(aq)
Dalam reaksi di atas terjadi :
O2-(aq)+ H2O → 2OH-(aq)
Basa molekular :
NH3(aq)+ H2O → NH4+(aq)+ OH-(aq)
Beberapa garam yang terdiri dari kation atau anion yang dapat bereaksi dengan air dapat membentuk larutan yang bersifat asam atau basa. Reaksi antara ion dengan air disebut reaksi hidrolisis ion.
a)
Reaksi Garam yang Mengandung Anion yang Terhidrolisis.
Jika sebuah garam mengandung anion yang berasal dari asam kuat, misalnya Cl-,
maka anion ini tidak akan terhidrolisis. Mengapa? Karena Cl- adalah basa konjugat dari asam kuat sehingga bersifat basa yang sangat lemah, dan tidak mempengaruhi pH air. Namun jika sebuah garam mengandung anion yang berasal dari asam lemah, misalnya CH3COO-, maka ion ini akan terhidrolisis. Mengapa? Karena basa konjugat dari asam
lemah bersifat basayang relatif kuat sehingga dapat mempengaruhi pH air, menyebabkan air bersifat basa.
CH3COO-(aq) + H2O → CH3COOH(aq) + OH-(aq)
b)
Reaksi Garam yang Mengandung Kation yang Terhidrolisis.
Garam yang mengandung kation logam dari golongan IA atau IIA (kecuali Berilium) tidak terhidrolisis. Logam-logam lain dapat terhidrolisis menghasilkan ion H+
(larutan jadi bersifat asam). Beberapa garam mengandung kation yang bukan logam seperti garam ammonium, NH4+. Kation ini merupakan asam konjugat dari basa lemah (NH3)
sehingga bersifat relatif asam.
NH4+(aq) + H2O → NH3(aq) + H3O+(aq)
26 10-13 cm dibandingkan dengan ion-ion lainnya yang jari-jarinya sekitar 10-8 cm. Oleh karena gabungan antara proton dan molekul air eksoterm, membebaskan energi sebanyak 1260 kJ per mol diperkirakan hanya 10-190 bagian dari seluruh proton yang tidak mengalami hidrasi.
Dengan demikian tidak mungkin terdapat ion hidrogen bebas di dalam larutan air. Adanya H3O+ di dalam larutan asam kuat telah dibuktikan dengan spektroskopi inframerah
pada tahun 1957. Oleh karena mirip dengan ion amonium (NH4+), (H3O+) disebut ion hidronium. Dengan demikian ionisasi air harus ditulis,
2 H2O⇄ H3O+ + OH-
Namun telah dibuktikan juga bahwa larutan bergantung pada konsentrasi dan suhu dapat ditemukan (H5O2)+, (H7O3)+, (H9O4)+dan sebagainya. Oleh karena itu, untuk
mempermudah, digunakan H+ dalam Bahan Ajar ini dengan catatan bahwa bukan ion hidrogen bebas tetapi terhidrasi dan seharusnya ditulis H+
(aq).
1.
Derajat Ionisasi
Banyak atau sedikitnya molekul zat yang terionisasi dinyatakan dalam derajat ionisasi. Derajat ionisasi () merupakan perbandingan banyaknya molekul zat yang terurai dengan banyaknya molekul zat mula-mula. Dirumuskan dalam persamaan 1 berikut ini:
mula
Asam kuat seperti HCl sebagian besar atau seluruh molekul HCl terurai menjadi ion H+ dan ion Cl- maka derajat ionisasinya () HCl = 1.
2.
Tetapan Ionisasi
Tetapan ionisasi dapat diperoleh dari percobaan daya hantar, dari kurva titrasi atau dari percobaan sifat koligatif.
a.
Tetapan ionisasi asam dinyatakan dengan Ka.Asam lemah adalah asam yang terionisasi sebagian dalam air. Jika rumus umum untuk asam lemah adalah HA, maka di dalam air HA akan mengalami reaksi kesetimbangan sebagai berikut:
-27
(menjadi suatu tetapan), sehingga persamaan 2 menjadi persamaan 3:
Kc × [H2O] = [H3O+]×[A-] = Ka x [HA] (2.3) Asam asetat (CH3COOH) adalah asam lemah, maka sebagian kecil atau sedikit dari
molekul asam asetat terurai menjadi ion H+ dan ion CH
3COO- karena hanya sedikit terurai
menjadi ion-ionnya maka terjadu reaksi kesetimbangan:
CH3COOH ⇄ CH3COO- + H+
Tetapan ionisasi asam (Ka) dari CH3COOH dapat ditentukan sebagai berikut:
Tabel 2.2 Harga untuk beberapa asam
28 Klasifikasi kekuatan asam berdasarkan harga Ka:
• Ka < 10-3 Asam lemah
• Ka = 1 – 10-3 Asam sedang
• Ka > 1 Asam kuat
b.
Tetapan ionisasi basa dinyatakan dengan Kb.
Basa lemah Bronsted di dalam air sebagian akan berada dalam bentuk molekul dan sebagian lagi dalam bentuk ion. Molekulatau ion ini dapat menerima H+ dari H2O sehingga
yang tersisa adalah OH- menurut reaksi kesetimbangan.
Jika kita gunakan B sebagai simbol basa lemah Bronsted, maka secara umum dapat dinyatakan sebagai berikut:
B + H2O ⇄ BH++ OH
-Harga konstanta kesetimbangan ionisasi basa (Kb) dapat dinyatakan dengan persamaan 4 berikut ini:
Tabel 2.3 Harga kb untuk beberapa basa
Nama Basa Formula Kb pKb
c.
Tetapan Hasil Kali Ion Air (Kw)
Air adalah pelarut yang umum digunakan untuk melarutkan asam dan basa. Air mengalami autoionisasi melalui suatu reaksi kesetimbangan sebagai berikut:
29
Kw disebut tetapan hasil kali ion air, yaitu hasil kali konsentrasimolar pada suhu tertentu. Karena harga [H3O+] = [H+] maka Kw dapat dinyatakan dengan: Dari tabel dapat dihitung bahwa pada suhu lebih besar dari 25°C, [H+], lebih besar dari 10 -7 mol L-1. Jadi pada 40°C pH air lebih kecil dari 7.
Tabel 2.4 Harga Kw pada berbagai suhu
Suhu (oC) Kw
Kriteria Larutan Asam, Basa dan Netral:
• Larutan netral: [H+] = [ OH-]
• Larutan asam: [H+] > [ OH-]
• Larutan basa: [H+] < [ OH-] Ada dua cara untuk menentukan Kw air: a) Air terurai sesuai dengan persamaan reaksi:
H2O + H2O ⇄ H3O- + OH
-Atau singkatnya: H2O ⇄ H+ + OH
30
Untuk larutan encer, (H2O) adalah tetap.
mol
Lt
b) Dari data daya hantar
Pada 25°C diperoleh secara eksperimen, diperoleh daya hantar jenis air 5,5 x 10-8 ohm -1 cm-1.
Menurut Hukum Kohlrausch,
3.
Konsep pH
31 antara pH, pOH dan pKw pada temperatur 25oC adalah:
pH + pOH = 14.
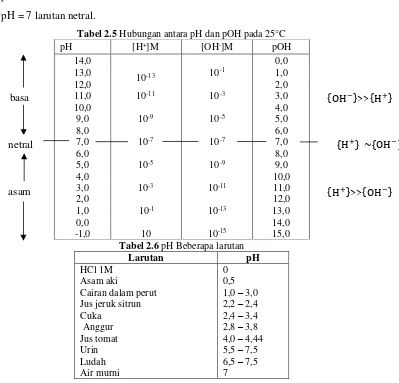
Karena pH air murni adalah 7, maka harga pH = 7 menunjukkan larutan bersifat netral. Jika pH < 7, maka larutan bersifat asamsebaliknya jika pH > 7, maka larutan bersifat basa.
• pH < 7 larutan asam.
• pH > 7 larutan basa.
• pH = 7 larutan netral.
Tabel 2.5 Hubungan antara pH dan pOH pada 25°C
Tabel 2.6 pH Beberapa larutan
32 senyawa ionik adalah elektrolit kuat. Logam hidroksida adalah senyawa ionik dan juga elektrolit kuat. Termasuk juga logam-logam golongan IA dan IIA, misalnya:
a) Golongan IA: NaOH natrium hidroksida, KOH kalium hidroksida.
b) Golongan IIA Mg(OH)2 magnesium hidroksida, Ca(OH)2 kalsium hidroksida
c) Golongan IIA sangat mudah larut dalam air membentuk ion logam dan ion hidroksil, senyawa tersebut disebut basa kuat.
Contoh soal :
asam kuat: HClO4(aq) asam perklorida, HI (aq)asam iodida, HNO3(aq) asam nitrat, HCl (aq)
asam klorida, HBr(aq) asam bromida, H2SO4(aq) asam sulfat.
Coba kamu hitung berapakah pH larutan HCl 1,5 M ?
pH = -log[H
+]= -log 1, 5
Tentu hasilnya sangat kecil (bahkan negatif). Jadi perlu kamu ingat bahwa konsep pH hanya untuk membantu menyatakan konsentrasi [H+] yang sangat kecil (lebih kecil dari 1M). Demikian pula untuk mengukur pOH basa kuat, tidak berlaku untuk [OH-] lebih besar dari 1 M.
Asam kuat dan basa kuat terurai sempurna dalam larutan air. Oleh karena itu, konsentrasi H+ dan OH- sama dengan konsentrasi zat terlarut. Apakah pH dari HCl 10-9 M
sama dengan 9. Tentu saja tidak mungkin, bahwa suatu asam ang diencerkan terus menerus akan menjadi basa. Dalam HCl 10-9 M, selain dari pada [H+] yang berasal dari asam ini,
perlu diperhitungkan H+ yang berasal dari H2O. Dalam larutan HCl dalam air terdapat tiga
spesi yaitu H+, OH dan Cl-.
34 10-6,59 = [OH-] = 2,57 x 10-7 M
Cara perhitungan konsentrasi spesi pada keadaan kesetimbangan basa kuat mirip dengan perhitungan untuk HCl. Perhitungan pH dengan cara tersebut di atas dapat dilihat pada Gambar 2.7 di bawah ini.
Sumber: www.wikipedia.com
Gambar 2.5pH sebagai fungsi konsentrasi
Karena harga Ka dan Kb pada umumnya sangat kecil, maka untuk menghindari
ketidakpraktisan dalam menuliskan angka digunakanlah pKa dan pKb (analog dengan pH).
pKa = - log Ka (2.13)
pKb = - log Kb (2.14)
pKa dan pKb untuk pasangan asam basa konjugat, sehingga pKa x pKb = Kw Pada suhu 25oC : pKa x pKb = 14,00
Kesimpulan: - Basa konjugat dari asam lemah adalah basa yang relatif kuat. - Asam konjugat dari basa kuat adalah asam yang relatif lemah. - Basa konjugat dari asam kuat adalah basa lemah
- Asam konjugat dari basa lemah adalah asam kuat.
I.
Asam Lemah Dan Basa Lemah
Asam lemah tidak terionisasi sempurna dalam air, misalnya, HC2H3O2, asam asetat
digolongkan sebagai elektrolit lemah. Dalam larutan asamnya hanya 1 % terionisasi menjadi H3O+ danC2H3O2-.
HC2H3O2(l) + H2O → H3O+(aq) + C2H3O2-(aq)
35
NH
3(l)+ H
2O → NH
4+(aq)+ OH
-(aq)Asam dan basa lemah adalah elektrolit lemah. Asam dan basa kuat adalah elektrolit kuat.
Tabel 2.7 Contoh asam monoprotik dan poliprotik
Rumus Asam Nama Asam Keterangan
HF
1.
Asam Lemah Monoprotik
HA
⇄
H
++
A
-1. Kesetimbangan air dan asam:36 Untuk mengatasi kesukaran penggunaan persamaan yang cukup rumit ini, maka untuk mempermudah perlu membandingan [OH-] terhadap [H+].
Jika, [OH-]<<< [H+] : berbeda dengan H+yang berasal dari ionisasi air.
[H+] - [OH-]<<<Ca
Sebagai pegangan untuk menghitung konsentrasi [H+] dari suatu asam lemah monoprotik,
maka dapat disarankan tahap-tahap berikut: 1) Hitung[H+] dari [H+]= (Ka.Ca)1/2
2.
Basa Lemah Monoprotik
37
3.
Asam Berbasa Banyak (Asam Poliprotik)
Asam-asam seperti H2CO3, H3PO4, H2SO4 dan H2S dapat menghasilkan lebih dari
satu hidrogen. Asam ini disebut asam poliprotik atau asam berbasa banyak atau asam polibasa. Asam-asam ini mengalami disosiasi secara bertahap. Setiap tahap dinyatakan dengan tetapan ionisiasi, Ka, sedangkan Ka1> Ka2>Ka.
Contoh untuk asam karbonat: H2CO3(aq)⇄ H+(aq) + HCO3-(aq)
Karena harga Ka1>>Ka2, maka dalam menghitung pH larutan asam poliprotik lemah yang
digunakan hanyalah Ka1 saja.
Asam fosfat. H3PO4 terurai menghasilkan ion hidrogen dalam tiga tahap, yaitu:
38
sedikit dibandingan tahap sebelumnya.
H3PO4 ⇄3 H+ + PO43− {H
+}{PO43−}
{H3PO4} = K1,2,3 = 4,6 x10
−22
Perlu dicatat bahwa konsentrasi ion hidrogen dalam asam fosfat tidak sama dengan tiga kali konsentrasi ion fosfat. Dapat dianggap bahwa hampir semua ion H+ berasal dari pengionan tahap pertama dan [H+] ≈ [H2PO4-] untuk H3PO40,1 M.
Asam Sulfat, H2SO4, terurai juga dalam tahapan yaitu:
H
2SO
4⇌ H
++
HSO
4−{H
Pada suhu kamar dan tekanan satu atom konsentrasi larutan jenuh H2S 0,1 M.
{H+}{HS– }
Beberapa zat dapat bersifat sebagai asam dalam lingkungan basa kuat dan sebagai basa dalam lingkungan asam kuat, senyawa yang memiliki sifat seperti itu disebut dengan senyawa amfoter. Reaksi senyawa amfoter dalam lingkungan basa kuat dan asam kuat:
39
basa kuat
Al(OH)3(s) + OH-(aq)→ Al(OH)4-(aq)
asam kuat
Tabel 2.8 Contoh senyawa amfoter
ASAM BASA
K.
Buffer: Larutan Penyangga pH
Larutan buffer yang juga dikenal sebagai buffer, pada umumnya terdiri atas campuran asam lemah dan garamnya misalnyaCH3COOH – CH3COONa atau basa lemah
dan garamnya misalnya NH3– NH4Cl. Cara kerja larutan buffer berkaitan dengan pengaruh
ion senama. Fakta bahwa penambahan ion senama dalam larutan asam lemah atau basa lemah menghasilkan pergeseran kesetimbangan ke arah molekul asam atau basa yang tidak terurai.
Contoh soal:
Jika kita tambahkan ekstra [H+] ke dalam bufer (dari asam kuat), basa lemah konjugatnya bereaksi:H++ A-→ HA
Penambahan asam merubah buffer basa Bronsted A- jadi asam(lemah) konjugatnya, HA. Ini mencegah naiknya [H+] yang disebabkan penambahan asam kuat.
Respon yang serupa terjadi ketika basa kuat ditambahkan kedalam buffer, OH- dari basa kuat akan menetralkan HA. Disini OH- merubah beberapa asam dalam buffer jadi basa
konjugatnya A-, ini mencegah naiknya OH- yang menyebabkan perubahan pH.
HA + OH
-→ A
-+ H
2O
Oleh karena itu, larutan buffer dapat didefinisikan sebagai campuran asam lemah dan basa konjugasinya atau basa lemahdan asam konjugasinya. pH dari larutan buffer dapat dihitung dari persamaan Henderson–Hesselbach atau persamaan Henderson.
a) Untuk buffer asam lemah HA dengan garamnya MA.
40
Sifat larutan buffer yaitu:
1)
Mempunyai pH tertentu.2)
pH- nya relatif tidak berubah jika ditambah sedikit asamatau basa.3)
pH-nya tidak berubaha jika diencerkan.1.
Kapasitas Buffer
Kapasitas buffer, yang juga disebut indeks buffer atau intensitas buffer yaitu suatu ukuran kemampuan buffer untuk mempertahankan pH-nya yang konstan jika ditambahkan asam kuat atau basa kuat. Kapasitas Buffer () didefinisikan dengan persamaan 23.
pH
Di mana: dCB dan dCA berturut-turut menyatakan jumlah mol basa kuatdan jumlah mol asam kuat yang ditambahkan ke dalam satu literlarutan buffer dan dpH adalah perubahan pH. Persamaan 9 berubah menjadi persamaan 24:
A
2.
Pembuatan Larutan Buffer
Buffer dapat dibuat dengan tiga cara, yaitu:1) Dengan mencampurkan asam lemah dengan basa konjugasinya atau basa lemah dengan asam konjugasinya.
2) Mencampur asam lemah berlebih dengan jumlah terbatas basa kuat (buffer asam). 3) Mencampur basa lemah berlebih dengan jumlah terbatas asam kuat (buffer basa).
3.
Indikator Asam Basa
41 hidroksida) untuk membersihkan saluran bak cuci. Aluminium hidroksida dan Magnesium hidroksida untuk membuat obat nyeri lambung.
Asam dan basa memiliki sifat-sifat berbeda. Untuk mengetahui suatu larutan asam atau basa digunakan kertas lakmus (indikator). pH meter adalah alat untuk mengukur tingkat keasaman atau kebasaan.
Metoda yang lebih akurat dan teliti untuk mengukur pH ialah dengan menggunakan pH meter.
(a) (b)
Sumber: sites.google.com
Gambar 2.6Mengukur pH dengan Menggunakan Kertas Indikator (a) dan pH Meter (b)
Metoda lain adalah menggunakan larutan indikator asam basa. Larutan indikator asam basa akan memberikan warna tertentu pada pH tertentu. Berikut ini adalah tabel beberapa indikator asam basa dilengkapi dengan warna dan pH terjadinya perubahan warna. Ada 2 Macam Indikator Asam dan Basa
a) Indikator Buatan, yaitu : kertas lakmus merah dan biru, indikator universal. b) Indikator Alami, yaitu : ekstrak kunyit, kol ungu, dan bunga kembang sepatu.
Tabel 2.9 Indikator untuk menunjukkan asam atau basa
Nama Indikator Warna dalam Larutan
Asam Basa
Lakmus merah Lakmus biru Fenolftalein Fenol merah Metil merah Metil kuning Metil jingga
Merah Merah
Tidak berwarna Kuning Merah Merah Merah
42
Sumber: www.kompasiana.com
Gambar 2.7Trayek perubahan warna
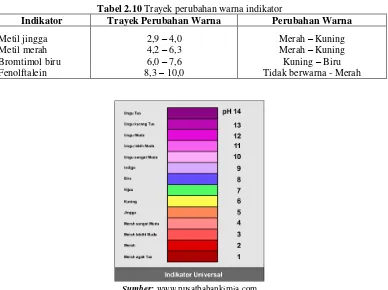
Batas-batas pH ketika indikator mengalami perubahan warna disebut Trayek Perubahan Warna. Trayek perubahan warna lakmus adalah 5,5 – 8,8 (warna lakmus merupakan kombinasi antara warna merah dengan biru). Tabel trayek perubahan warna beberapa indikator ditunjukkan pada Tabel 10 berikut ini.
Tabel 2.10 Trayek perubahan warna indikator
Indikator Trayek Perubahan Warna Perubahan Warna
Metil jingga Metil merah Bromtimol biru Fenolftalein
2,9 – 4,0 4,2 – 6,3 6,0 – 7,6 8,3 – 10,0
Merah – Kuning Merah – Kuning Kuning – Biru Tidak berwarna - Merah
Sumber: www.pusatbahankimia.com
43
• Penentuan pH dengan indikator
H
ind⇄
H
++ ind
-Intensitas warna sebanding dengan konsentrasi molekul H Ind dan intensitas warna B sebanding dengan konsentrasi ion ind-.
Mata manusia hanya dapat mengamati perubahan warna antara perbandingan 1/10 sampai 10/1 untuk [warna B] / [warna A]. Misalnya bromtimol biru mempunyai pKind
sebesar 6,3. Indikator ini mempunyai warna asam kuning dan warna basa biru. Jika [warna B] / [warna A] = 1/10 maka pH =6,3 + log 5,3
10
1
.
Pada pH lebih kecil atau sama dengan 5,3 warna larutan kuning. Warna biru sangat sedikit sehingga tidak dapat diamati. Pada pH sebesar 6,3 warna B sama banyak dengan warna A, larutan berwarna hijau.
Jika [warna B] / [warna A] adalah 10/1, pH = 6,3 + log 10 = 7,3. Pada pH lebih besar atau sama dengan 7,3 terlihat warna biru. Dalam hal ini bromtimol biru berubah warna secara teratur disekitar dua satuan pH sebesar 5,3 sampai 7,3.
Contoh soal :
Suatu indikator Hin, mempunyai Kind = 7 x 10-9. Pada pH berapakah konsentrasi warna asam sama banyaknya dengan konsentrasi warna basa ?
Penyelesaian :
44
2. Terdapat beberapa larutan asam basa: a) H2SO4
Larutan yang bersifat asam kuat, basa lemah, dan garam berturut-turut adalah? A. a, d, i
B. b, c, f C. a, c, f D. g, h, i E. b, e, f
3. Larutan HClO4 dalam CH3COOH dapat dituliskan sebagai berikut:
45 Pasangan asam basa konjugasi dari reaksi di atas adalah ...
A. HClO4 dan CH3COOH
B. CH3COOH dan ClO4
-C. HClO4 dan CH3COOH2+
D. HClO4- dan ClO4
-E. ClO4- dan CH3COOH2+
4. Dari suatu percobaan diperoleh data berikut:
Larutan Lampu Menyala Indikator Lakmus
Merah Biru
HCl + Merah Merah
NaCl + Merah Biru
Gula - Merah Biru
NaOH + Biru Biru
Etanol - Merah Biru
H2SO4 + Merah Merah
Dari data tersebut dapat disimpulkan bahwa . . .
A. Larutan NaOH adalah elektrolit yang bersifat netral B. Larutan etanol adalah elektrolit yang bersifat basa C. Larutan gula adalah nonelektrolit yang bersifat asam D. Larutan H2SO4 adalah elektrolit yang bersifat asam
E. Larutan elektrolit dapat bersifat asam, basa, maupun netral 5. Berapakah pH larutan Ca(OH)2 0,05 M?
A. 14 B. 13 C. 11 D. 12 E. 10
6. Suatu larutan CH3COOH 0,4 M derajat ionisasinya (α) 0,01. Berapa harga pH larutan
tersebut?
46 7. Larutan yang bisa membirukan lakmus merah adalah ...
A. NaOH B. CH3COOH
C. NaCl D. HCl E. AgBr
8. Berdasarkan pengujian sampel air limbah diperoleh data sebagai berikut:
Sampel Tidak Berwarna - Merah
A
9. Hasil pengujian limbah industri tekstil dengan beberapa indikator diperoleh hasil berikut:
Indikator Trayek pH Perubahan Warna
Dapat disimpulkan pH air limbah 1 dan 2 tersebut berturut-turut adalah . . . A. 4,7 ≤ pH≤ 5,8; pH ≤ 7,6
47 10. Berapa mL larutan HCl 0,05 M yang diperlukan untuk menetralkan 40 mL NaOH 0,1
M?