Kelompok :...
Nama
Kelas
: ...
...
...
...
: ...
Lembar Keja Peserta Didik (LKPD)
TEORI DOMAIN ELEKTRON
KIMIA
SMA WITAMA PEKANBARU
A. Tujuan Pembelajaran :
Dengan menganalisis model yang diberikan dan menjawab pertanyaan kunci, peserta didik mampu:
1. Menentukan bentuk molekul berdasarkan teori domain electron 2. Membuat model bentuk molekul
B. Petunjuk Penggunaan
1. Bacalah bahan ajar atau buku kimia untuk membimbing kamu menyelesaikan LKPD!
2. Berdiskusilah dengan teman sekelompokmu dan pastikan tiap-tiap anggota kelompok telah mengerti dengan jawaban dalam LKPD
3. Gunakanlah waktu yang diberikan sebaik mungkin untuk mengerjakan LKPD
4. Jawablah pertanyaan setelah menerima informasi baik dari LKPD atau sumber lainnya 5. Bantulah anggota kelompok yang belum paham dengan memberikan penjelasan 6. Buatlah kesimpulan hasil kerja kelompok
7. Tampilkanlah hasil kerja kelompok dan berilah tanggapan terhadap hasil kerja kelompok lain.
C. Uraian Materi
Bentuk Molekul Berdasarkan Teori Domain Elektron
Materi sesuai indikator Orientasi
(Pengetahuan awal yang diperlukan)
Fakta
1. Ikatan kimia merupakan interaksi antar elektro valensi
2. Bentuk molekul menggambarkan kedudukan atom-atom dalam suatu molekul
3.
Domain elektron berarti kedudukan elektron atau daerah keberadan elektron.
1. Tipe molekul yang dibentuk oleh ikatan menggunakan teori pasangan elektron di sekitar atom, baik pasangan bebas maupun pasangan ikatan.
2. Teori domain elektron adalah suatu cara meramalkan bentuk molekul berdasarkan teori tolak menolak elektron-elektron pada kulit luar atom pusat.
Konsep
1. Jumlah domain ditentukan dengan cara sebagai berikut
2. Setiap elektron ikatan (ikatan tunggal, ikatan rangkap, maupun ikatan rangkap tiga) merupakan satu domain.
3. Setiap pasangan elektron bebas merupakan satu domain 4. Dasar teori domain elektron
dalam membentuk molekul adalah sebagai berikut:
5. Antar domain akan menyusun diri, sehingga menghasilkan tolakan minimum
6. Domain elektron bebas
mempunyai gaya tolak lebih kuat, sehingga mengambil posisi yang lebih terbuka
7. Geometri domain ditentkuan oleh seluruh domain (elektron bebas dan electron ikatan)
8. Gemotri molekul hanya
ditentukan oleh domain elektron ikatan.
LEMBAR KERJA PESERTA DIDIK : Inquiri Terbimbing
I.I ndikator : Menentukan bentuk molekul berdasarkan teori VSEPR atau Teori Domain Elektron
Orientasi
Langkah-langkah dalam meramalkan bentuk geometri molekul
Teori domain elektron merupakan penyempurnaan dari teori VSEPR. Domain elektron berarti kedudukan elektron atau atau daerah keberadaan elektron, jumlah domain ditentukan oleh pasangan elektron ikatan atau pasangan elektron bebas. Secara umum molekul dibagi menjadi dua golongan yaitu : molekul yang atom pusatnya tidak memiliki pasangan elektron bebas,
Eksplorasi dan Pembentukan Konsep
Petunjuk
1. Jawablah pertanyaan berikut dengan mengikuti petunjuk yang telah ditentukan.
2. Gunakanlah sumber yang lain untuk membantu menjawab pertanyaan tersebut.
3. Tuliskan jawaban dengan rapi (kerapian tulisan termasuk salah satu bentuk penilaian ketrampilan)
Untuk menyelesaikan Soal nomor 1 sampai 5, Perhatikanlah struktur Lewis beberapa senyawa berikut ini:
NH3 CH4 H2O
Bandingkan dengan bentuk geometri molekulnya
Berdasarkan gambar di atas, jawablah pertanyaan berikut ini (Pertanyaan Kunci):
1. Apakah perbedaan kedua gambar tersebut (NH3 dan CH4) ? ( Poin 5 )
………
………
………
2. Tentukanlah atom pusat dari senyawa NH3 dan CH4 ( Poin 5 )
...
...
...
3. Apakah yang dimaksud dengan Domain Elektron Ikatan (DEI) dan Domain Elektron Bebas (DEB)? ( Poin 5 )
………
………
………
4. Ada berapa DEI dan DEB pada molekul NH3 dan CH4 ? ( Poin 5 )
Orientasi
………
………
………
5. Perhatikan tolakan antara DEB dengan DEB, DEB dengan DEI dan DEI dengan DEI, cobalah kalian urutkan tolakan dari yang terbesar sampai yang terkecil. ( Poin 5 )
………
……….
Aplikasi
Latihan 1
Dengan berbagai bahan ajar lengkapilah tabel dibawah ini ( Poin 5/item ) NO Senyawa Struktur Lewis
Jumlah DEI
(X)
Jumlah DEB
(E)
Bentuk Molekul Nama Bentuk
1. BeF2 2 Linear
2. CCl4 4
3. PCl5 0
4. SF6 Oktahedral
5. CO2
6. H2S 2
II. Indikator : Menentukan kepolaran molekul berdasarkan kepolaran ikatan dan geometri molekul serta teori hibridisasi
Kepolaran
Kepolaran suatu senyawa dapat diketahui berdasarkan bentuk molekulnya. Senyawa polar terjadi bila pasangan elektron yang digunakan untuk membentuk ikatan kovalen tertarik lebih kuat kepada salah satu atom, misalnya pada senyawa HCl
Senyawa nonpolar terjadi jika pasangan elektron yang dipakai bersama-sama dalam ikatan kovalen tertarik sama kuat ke semua atom, jadi semua muatannya terdistribusi secara simetris seperti pada senyawa CH4
Salah satu cara menentukan senyawa polar dan non-polar adalah dengan cara melihat pasangan elektron bebas (PEB) pada atom pusat.
1. Apabila atom pusat memiliki PEB maka senyawa tersebut dapat dipastikan merupakan senyawa polar.
2. Apabila atom pusat tidak memiliki PEB maka senyawa tersebut tergolong senyawa non polar.
Eksplorasi dan Pembentukan Konsep
Kepolaran
Perhatikan gambar dan data berikut ini
Dari data di atas, tentukanlah kepolaran senyawa yang diberikan A. F2 =
………
B. CF4 =
………
C. NF3 =
………..
D. BeF2 =
……….
E. BeF3 =
………..
Aplikasi
Latihan
Tentukanlah kepolara senyawa berikut ini dari teori pasanagan elektron bebasnya (Poin 8)
No Senyawa Jumlah PEB Kepolaran
1 SO2
2 Cl2
3 N2
4 MgO
Kesimpulan Tuliskanlah kesesimpulan dari materi yang telah kalian pelajari!
………
………
………
………
………
………
………
………
………
Tugas Rumah
III. Indikator : Membuat model bentuk molekul dari bahan-bahan bekas.
Teori domain elektron merupakan penyempurnaan dari teori VSEPR. Domain elektron berarti kedudukan elektron atau atau daerah keberadaan elektron, jumlah domain ditentukan oleh pasangan elektron ikatan atau pasangan elektron bebas. Secara umum molekul dibagi menjadi dua golongan yaitu : molekul yang atom pusatnya tidak memiliki pasangan elektron bebas, dan molekul yang atom pusatnya memiliki pasangan elektron bebas.
Tujuan : Menerapkan teori domain elektron untuk meramalkan bentuk molekul.
Alat/Bahan :
Tusuk Gigi (untuk sambungan antara atom besar dan kecil)
Lidi (untuk sambungan plastisin dengan ukuran paling kecil)
Jarum pentul (Sebagai pasangan elektron bebas)
Plastisin/Lilin Mainan
Kamera
Langkah Kerja
:
1. Siapkan semua alat dan bahan. Kemudian ambil sebagian plastisin yang sudah ada dan buatlah plastisin tersebut menjadi bulatan-bulatan kecil dan besar dengan jumlah sebanyak yang dibutuhkan. Gunakan plastisin dengan warna yang berbeda antara bulatan kecil dan bulatan besar untuk membedakan antara atom inti dan atom ikat.
2. Setelah plastisin tersebut selesai dibulatkan,.
3. Kemudian buatlah bentuk-bentuk molekul sesuai yang ada pada buku panduan. Misalnya bentuk molekul Linier (AB2). Siapkan dua bulatan plastisin kecil dan satu bulatan plastisin besar, kemudian tusuk gigi. Pegang plastisin besar kemudian tancapkan dengan tusuk gigi pada sisi bagian kanan atau kiri plastisin, kemudian beri plastisin kecil pada 1 bagian lagi pada ujung tusuk gigi. Begitu seterusnya sampai jadi bentuk molekul yang diinginkan.
4. Apabila terdapat pasangan elektron bebas, pasangkan jarum pentul (sebagai tanda bahwa tolakan PEB lebih besar daripada PEI).
5. Setelah jadi sebuah bentuk molekul. Simpanlah bentuk molekul tersebut sebagai suatu bentuk laporan dalam bentuk gambar. Caranya dengan memotret bentuk molekul tersebut.
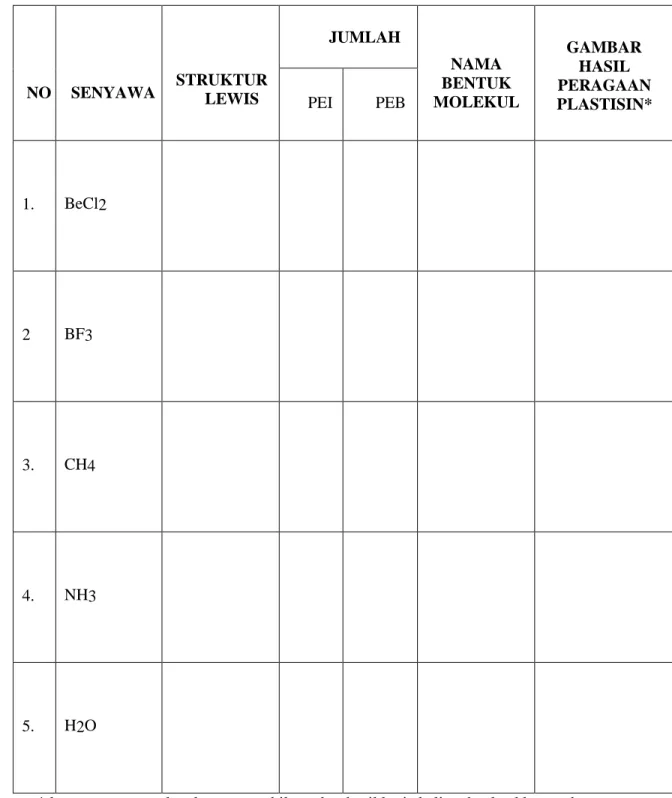
Tabel 1. Hasil Pengerjaan
NO SENYAWA STRUKTUR LEWIS
JUMLAH
NAMA BENTUK MOLEKUL
GAMBAR HASIL PERAGAAN PLASTISIN*
PEI PEB
1. BeCl2
2 BF3
3. CH4
4. NH3
5. H2O
*dengan menggunakan kamera, ambil gambar hasil kerja kalian dan letakkan pada kolom yang disediakan.
MATERI AJAR
TEORI VSEPR ATAU DOMAIN ELEKTRON
MATA PELAJARAN KIMIA KELAS XII IPA
SEMESTER I TAHUN PELAJARAN 2021/2022
SMA WITAMA PEKANBARU
2021
TEORI VSEPR DAN DOMAIN ELEKTRON
A. Petunjuk Belajar
Materi ajar ini dapat lebih bermanfaat bagi peserta didik dalam mempelajarinya dengan mengikuti alur daripada penggunaannya, sebagai berikut
a. Baca dan pahamilah dengan saksama capaian pembelajaran dan uraian materi pada materi ajar Teori VSEPR atau Domain Elektron
b. Pahamilah setiap tabel dan gambar pendukung penyerta agar dapat lebih memahami materi ajar.
c. Carilah sumber pendukung lainnya terkait materi ajar ini agar menamah kekayaan khasanah materi.
d. Buatlah catatan kecil yang dapat dikutip dari uraian materi untuk membantu menyerap informasi.
e. Perhatikanlah kembali rangkuman untuk menyegarkan dan memantapkan pemahaman terhadap materi ajar ini.
f. Kerjakanlah soal-soal tes yang tersedia pada akhir materi untuk menguji tingkat pemahaman terhadap materi ini. Bandingkanlah jawaban anda kepada kunci jawaban dengan penentuan penilaian sebagai berikut
Nilai akhir =
𝐽𝑢𝑚𝑙𝑎ℎ 𝑗𝑎𝑤𝑎𝑏𝑎𝑛 𝑏𝑒𝑛𝑎𝑟10
× 100
Jika hasil belum memuasakan, cobalah untuk mengulas kembali materi ajar dan mengulangi kembali soal – soal tersebut.
B. Capaian Pembelajaran
1. Memahami bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan hubungannya dengan kepolaran senyawa.
2. Memperkirakan bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan hubungannya dengan kepolaran senyawa
3. Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) atau Teori Domain
elektron dalam menentukan bentuk molekul
4. Membuat model bentuk molekul dari bahan-bahan bekas, misalnya gabus dan karton, atau perangkat lunak kimia.
C. Pokok Materi
1.Teori VSEPR atau Teori Domain Elektron 2.Bentuk Molekul
D. Uraian Materi
A. Fakta
Dalam penentuan bentuk atau geometri molekul, perlu diperhitungkan keberadaan elektron tak-berikatan dan elektron valensi ketika pembentukan ikatan. Teori ini disebut juga teori domain elektron, suatu pengembangan dari teori VSEPR (Valence Shell Electron Pair Repulsion).
B. Konsep
1. Prinsip-prinsip Teori VSEPR (Valence Shell Electron Pair Repulsion).
Teori VSEPR merupakan penjabaran sederahana dari rumus Lewis yang berguna untuk memprediksikan bentuk molekul poliatom berdasarkanstru ktur Lewis- nya. Teori VSEPR pertama kali dikembangkan oleh NevilSidgwick dan Herbet Powel pada tahun 1940, dan dikembangkan lebihlanjut oleh Ronald Gillespie dan Ronald Nyholm.
Ide dasar teori VSEPR adalah adanya tolakan antara pasangan elektron sehingga pasangan elektron tersebut akan menempatkan diri pada posisi sejauh mungkin dari pasangan elektron lainnya. Posisi pasangan elektron satu dengan yang lain yang semakin berjauhan akan menyebabkan tolakan antar mereka menjadi semakin kecil. Pada posisi yang paling jauh yang dapat dicapai, tolakan antar pasangan elektron menjadi minimal. Tolakan antar pasangan elektron terjadi antara pasangan elektron bebas yang terlokalisasi pada atom pusat dan elektron ikat secara ikatan koordinasi. Teori VSEPR mengasumsikan bahwa masing- masing molekul akan mencapai geometri tertentu sehingga tolakan pasangan antarelektron di kulit valensi menjadi minimal.
Pada teori ini terdapat dua jenis domain, yaitu domain elektron bebas untuk pasangan elektron bebas dan domain elektron ikatan untuk elektron dalam ikatan, dimana satu pasang elektron bebas dianggap satu domain elektron.
Satu ikatan baik itu tunggal, rangkap dua maupun tiga juga dianggap satu domain elektron.
Dari jumlah total domain inilah didapatkan bentuk-bentuk dasar untuk berbagai molekul seperti berikut:
Gambar 1. Bentuk Molekul sesuai besaran sudut
2. Prinsip-prinsip dasar dari teori domain elektron
Menurut Ralph H. Petrucci (1985), teori Domain Elektron merupakan penyempurnaan dari teori VSEPR. Teori ini adalah suatu cara meramalkan bentuk molekul berdasarkan tolak menolak elektron-elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Jumlah domain elektron ditentukan sebagai berikut:
a.
Setiap elektron ikatan (apakah ikatan tunggal, rangkap atau rangkap tiga) merupakan 1 domain.
b. Setiap pasangan elektron bebas merupakan 1 domain.
Contoh :
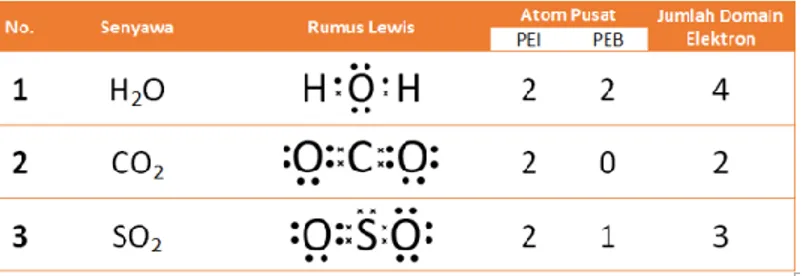
Tentukan domain elektron atom pusat pada beberapa senyawa : H2O, CO2 dan SO2! Pembahasan :
1.
Gambarkan struktur lewis masing-masing senyawa
2.
Setiap satu elektron ikatan (tunggal, rangkap dua maupun rangkap tiga merupakan satu domain
3.
Setiap pasangan elektron bebas merupakan satu domain Sehingga jumlah domainnya dapat dilihat pada tabel berikut.
Tabel 1. Domain electron pada H2O, CO2 dan SO2
Penjelasan :
1. Pada struktur lewis H
2O atom pusat O dikelilingi oleh 4 PEI sehingga jumlah domain elektron = 4
2. Pada struktur lewis CO
2atom pusat C dikelilingi oleh 2 ikatan rangkap, sehingga domain elektron = 2
3. Pada struktur lewis SO
2atom pusat S
Selain itu prinsip-prinsip dasar dari teori domain elektron adalah sebagai berikut
1. Antardomain elektron pada kulit luar atom pusat saling tolak-menolak, sehingga domain elektron akan mengatur diri sedemikian rupa untuk meminimalisir gaya tolak-menolak ini.
2. Pasangan elektron bebas (PEB) mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan.
Dari tabel 1 dapat disimpulkan, hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom, sehingga gerakannya lebih leluasa. Urutan kekuatan tolak- menolak diantara pasangan elektron adalah sebagai berikut,
Tolakan antar PEB > tolakan antara PEB dan pasangan elektron ikatan > tolakan antar pasangan elektron ikatan.
C. Prinsip
Menentukan geometri molekul
Untuk menentukan geometri molekul ikuti langkah-langkah berikut ini:
1. Menentukan tipe molekul.
Atom pusat dilambangkan dengan A, elektron ikatan dengan X dan setiap domain elektron bebas dinyatakan dengan E. Caranya berbeda tergantung jenis molekul/senyawanya.
Langkah-langkah merumuskan tipe molekul adalah:
a.
Tentukan jumlah elektron valensi atom pusat (EV)
b.
Tentukan jumlah domain elektron ikatan (X)
c.
Tentukan jumlah domain elektron bebas (E)
d.
Senyawa biner berikatan tunggal, maka setiap ikatan hanya menggunakan satu elektron dari atom pusat. Maka, jumlah PEB (E) dapat ditentukan sehingga diperoleh rumus sebagai berikut:
𝐸 =
(𝐸𝑉−𝑋)2 Persamaan …….1)
Dimana EV = jumlah elektron valensi atom pusat X = jumlah atom yang terikat pada atom pusat.
2. Menentukan geometri domain-domain elektron di sekitar atom pusat yang memberi tolakan minimum
3. Menetapkan domain elektron terikat dengan menuliskan lambang atom yang bersangkutan
4. Menentukan geometri molekul setelah mempertimbangkan pengaruh pasangan elektron bebas
2.Bentuk molekul
Kita dapat menentukan bentuk suatu molekul dari hasil percobaan atau dengan meramalkan bentuk molekul melalui pemahaman struktur elektron dalam Molekul. Teori-teori yang membahas cara meramalkan bentuk molekul berdasarkan teori tolak-
menolak elektron-elektron pada kulit luar atom pusatnya adalah Teori VSEPR (Valence
Shell Electron Pair Repulsion), Teori Domain Elektron, dan Teori Hibridisasi.Molekul adalah kumpulan 2 atom atau bahkan lebih yang ada di dalam suatu susunan tertentu yang terikat oleh gaya kimia. Molekul tersebut akan membentuk suatu susunan ruang-ruang atom yang dikenal dengan Geometri Molekul. Geometri Molekul tersebut dipengaruhi oleh pasangan elektron terikat (PEI), pasangan elektron bebas (PEB), dan domain elektron.
Untuk mengetahui PEI, PEB, dan domain electron, kita harus bisa menggambarkan struktur lewis pada suatu senyawa. Struktur lewis adalah struktur yang menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpasangan dan saling berikatan secara kovalen. Di dalam struktur lewis terdapat PEI dan PEB.
Pasangan elektron terikat (PEI) adalah pasangan elektron yang terikat antara atom pusat dengan atom lain secara kovalen. Sedangkan Pasangan elektron bebas (PEB) adalah pasangan elektron bebas pada atom pusat yang tidak terikat dengan atom lain, dan domain elektron adalah total dari pasangan elektron terikat dan bebas. Setiap pasangan elektron (ikatan rangkap 2 atau rangkap 3) akan bernilai satu domain. Contoh pembentukan senyawa PEI, PEB, dan domain Elektron menggunakan struktur lewis adalah sebagai berikut:
Gambar 2. Struktur Lewis pada molekul HCl
Dari gambar terlihat bahwa pasangan elektron pada molekul HCl yaitu terdapat: 1 pasangan elektron terikat (PEI)
3 pasangan elektron bebas (PEB)
Sehingga jumlah domain elektron = 3 + 1 = 4
Gambar 3. Molekul H2O
Dari gambar terlihat bahwa pasangan elektron pada molekul H2O yaitu terdapat:
2 pasangan elektron terikat (PEI) 2 pasangan elektron bebas (PEB)
Sehingga jumlah domain elektron = 2 + 2 = 4
Bentuk molekul senyawa kovalen ditentukan oleh susunan ruang pasangan elektron di sekitar atom pusat. Untuk bisa menentukan domain elektron maka dipergunakan Struktur Lewis.
Karena dengan struktur Lewis dapat diketahui PEI dan PEB. Berdasarkan teori domain elektron ada 5 macam bentuk dasar molekul kovalen, yaitu :
1. Linear
Bentuk melekul ini disusun oleh tiga atom yang berikatan dalam satu garis lurus dan sebuah atom yang menjadi atom pusatnya. Terdapat 2 domain dengan sudut ikatan 180
2. Segitiga Datar
Bentuk melekul ini segitiga sama sisi yang disusun oleh 4 buah atom. 1 buah atom pusat yang berikatan dengna 3 atom lainnya dengan sudut ikatan 120o
3. Tetrahedral
Bentuk melekul ini seperti piramida yang tersusun oleh 5 atom dengan 1 buah atom bertindak sebagai atom pusat yang berikatan dengan 4 elektron ikatan dengan sudut ikatan 109,5o
4. Trigonal Bipiramidal
Bentuk melekul ini seperti dua piramida yang bergabung menjadi satu dimana atom pusat dikelilingi oleh 5 atom lainnya dengan sudut 90o dan 120o
5. Oktahedral
Bentuk melekul ini terdiri atas delapan bidang yang merupakan segitiga sama sisi dimana atom pusat akan dikelilingi oleh 6 atom lainnya dengan dusut ikatan 90o
Kelima bentuk dasar molekul kovalen hanya menggambarkan geometri domain elektron yang mengandung PEI, namun dalam teori VSEPR gaya tolakan yang dihasilkan oleh pasangan elektron bebas berpengaruh terhadap bentuk molekul. Bentuk molekul diberi notasi khusus untuk menunjukkan jumlah PEI dan PEB, yaitu :
AX n E n
Dimana A = atom pusat, X = PEI, E = PEB, n = jumlah masing-masing PEI/PEB
E. Rangkuman
1. Teori yang sederhana untuk menjelaskan bentuk molekul yang mengandung ikatan pasangan elektron adalah teori tolakan pasangan elektron dalam kulit valensi atau teori VSEPR (Valence Shell Electron Pair Repulsion). Menurut teori ini, bangun suatu molekul ditentukan oleh pasangan elektron yang terdapat dalam kulit valensi atom pusat.
2. Molekul kovalen terdapat pasangan-pasangan elektron baik PEI maupun PEB. Karena pasangan-pasangan elektron mempunyai muatan sejenis, maka tolak- menolak antarpasangan elektron. Tolakan (PEB – PEB) > tolakan (PEB – PEI) > tolakan (PEI – PEI).
3. Teori Domain Elektron adalah penyempurnaan dari teori VSEPR. Domain elektron artinya kedudukan suatu elektron atau daerah keberadaan elektron, dapat ditentukan dengan jumlah domain sebagai berikut: Setiap elektron ikatan (ikatan tunggal, rangkap 2, atau rangkap 3) mempunyai 1 domain.
4. Berdasarkan teori domain elektron ada 5 macam bentuk dasar molekul kovalen, yaitu
:Linier, Segitiga datar, Tetrahedral, Trigonal Bipiramidal, Oktahedral5. ikatan terjadi akibat terbentuknya orbital hibrida, yakni orbital yang terbentuk sebagai hasil
penggabungan 2 atau lebih orbital atom.
6. Cara menentukan domain elektron :
1. Buat konfigurasi elektron masing-masing unsur dari Nomor Atomnya 2. Ketahui elektron valensi masing-masing unsur dari konfigurasinya 3. Buat struktur Lewisnya
4. Tentukan domain elektron (PEI dan PEB) pada atom pusat 5. Buat notasi VSEPR
Dalam menghitung jumlah pasangan pusat, atom H tidak diperhitungkan karena atom H hanya memiliki sebuah elektron dan tidak memiliki PEB
F. Tes Formatif
Jawablah pertanyaan berikut ini.
1. BeCl2 memiliki bentuk molekul … A. Bentuk V
B. Bentuk T C. Bentuk Linier D. Trigonal Planar E. Trigonal Piramida
2. Untuk memperkirakan geometri molekul kita menggunakan teori domain elektron. Manakah diantara pernyataan berikut yang kurang tepat?
A. Teori ini didasarkan atas gaya tolak-menolak elektron-elektron pada kulit luar atom pusat B. Teori ini hanya memperhitungkan jumlah elektron valensi setiap unsur penyusun molekul C. Domain elektron berarti daerah keberadaan electron
D. Hanya elektron ikatan (baik tunggal, rangkap atau rangkap tiga) yang dihitung sebagai satu domain
E. Sudut ikatan hanya dipengaruhi oleh tolakan pasangan elektron ikatan dan pasangan elektron bebas
3. Manakah di antara pernyataan berikut yang kurang tepat?
A. Geometri suatu molekul berhubungan dengan hibridisasi atom pusatnya
B. Teori domain elektron dapat menjelaskan bagaimana suatu molekul memperoleh bentuknya
2
C. Bila terdapat 5 domain elektron, maka terdapat 2 posisi yang tidak ekivalen yakni aksial dan ekuatorial
D. Bila terdapat 5 domain elektron, maka pasangan elektron bebas akan menempati posisi ekuatorial
E. Semua benar
4. Di antara spesi berikut manakah yang memiliki sudut ikatan paling besar?
A. PCl+4 B. PCl−6 C. SO −4 D. NO−3 E. NO−2
5 PVC adalah suatu polimer termoplastik yang penggunaannya sangat luas, antara lain sebagai pipa paralon. Berapa sudut ikatan yang dibentuk oleh atom karbon di dalam polimer ini?
A. Hanya 109∘
B. 109∘dan 120∘
C. Hanya 120∘
D. Hanya 180∘
E. 109∘,120∘,180∘
6. Unsur P (Z = 15) bersenyawa dengan unsur Cl (Z = 17) membentuk PCl3. Banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3 adalah ….
A. 0 B. 1 C. 2 D. 3 E. 4
7. Suatu molekul mempunyai 4 pasang elektron di sekitar atom pusat, 2 diantaranya merupakan PEB, maka bentuk molekul yang paling mungkin adalah ….
A. Segitiga datar B. Segiempat planar C. tetrahedron D. Bentuk T E. Tekuk
8. Sudut ikatan molekul H2O adalah 104,5 lebih kecil dari sudut tetrahedron, hal ini disebabkan oleh ….
A. adanya 2 pasangan elektron bebas B. adanya 2 pasangan elektron ikatan C. adanya ikatan hidrogen pada H2O D. adanya dipol permanen pada H2O E. pasangan elektron jauh dari atom pusat
9. Pasangan domain elektron ikatan 3 dan domain electron bebas 0, bentuk molekul dari senyawa tersebut adalah ….
A. Linear B. Tetrahedral
C. Segitiga datar
D. Oktahedral
E. Bipiramida segitiga
10. Perhatikan tabel berikut
Pernyataan yang benar hbungan antara jumlah PEI, PEB dan bentuk molekul adalah....
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3) D. (3) dan (4) E. (4) dan (5)
Daftar Pustaka
Catherine E. Housecroft, Alan G. Sharpe (2005), Inorganic Chemistry, Pearson Education, ISBN 0-13- 039913-2
Utami, Budi, dkk. 2009. Kimia untuk SMA Kelas XI. Jakarta: Pusat Perbukuan Kemdikbud.
Purba, Michael, Samiyati, E., 2016, Kimia Kelas X, Penerbit Erlangga, Jakarta
Wardaya College. Teori VSEPR. Jakarta: Wardaya College.http://www.materi78.co.nr/kimia%5B/spoiler%5D
Kunci Jawaban
1. Jawaban C.
Dalam BeCl2 terdapat 2 pasang elektron ikatan dan tidak ada pasangan elektron bebas, sehingga bentuk umumnya AX2.
2. Jawaban D.
Selain elektron ikatan, pasangan elektron bebas dihitung pula sebagai satu domain.
3. Jawaban C.
Teori domain elektron dapat memperkirakan geometri molekul, namun tidak dapat menjelaskan bagaimana suatu molekul memperoleh bentuknya itu.
4. Jawaban D
PCl+4 dan SO2−4 memiliki sudut ikatan 109,5∘ memiliki bentuk tetrahedral ( 4 domain elektron ikatan, tidak ada domain elektron bebas), PCl−6 memiliki sudut ikatan 90∘dan 180∘ (6 domain elektron ikatandan tidak ada domain elektron bebas). NO−2 sekitar 115∘ (2 domain elektron ikatan dan satu domain elektron bebas), sementara NO−3 sekitar 120∘ (2 domain elektron ikatan dan tidak ada domain elektron bebas).
5. Jawaban A.
Di dalam polimer ikatan tak jenuh dari monomer vinil klorida (CH2=CHCl) akan ‘terbuka’ untuk membentuk rantai karbon panjang sehingga hanya ada karbon dengan hibridisasi sp3 dengan sudut ikatan sekitar 109∘.
6. Jawaban B.
Unsur P (Z = 15) bersenyawa dengan unsur Cl (Z = 17) membentuk PCl3. Banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3 :
- Menentukan atom pusat
1 atom P dan berikatan dengan 3 atom Cl, maka yang sebagai atom pusat adalah atom P - Buat konfigurasi elektron dari masing-masing atom:
15P : 2 8 5 maka elektron valensi P adalah 5, ada 5 elektron untuk berikatan 17Cl : 2 8 7 maka elektron valensi Cl adalah 7, membutuhkan 1 elektron untuk berpasangan - Buat struktur lewis dari molekul tersebut!
Terdapat 1 pasangan elektron bebas pada atom pusat 7. Jawaban B.
Suatu molekul mempunyai 4 pasang elektron di sekitar atom pusat, 2 diantaranya merupakan PEB, maka bentuk molekul yang mungkin:
- Tentukan Pasangan Elektron Ikatan / PEI (X) = 4 - Tentukan Pasangan Elektron Bebas / PEB (E) = 2
- Gunakan rumus (AXnEm) maka AX4E2 sisiempat planar atau segiempat datar
8. Jawaban A.
Sudut ikatan molekul H2O adalah 104,5 lebih kecil dari sudut tetrahedron, hal ini disebabkan oleh:
1H dan 8O yang mana elektron valensi pada O ada 6 elektron, 2 digunakan untuk berikatan dengan 2 atom H, sehingga masih ada 4 elektron pada atom pusat (O) atau 2 Pasang Elektron Bebas, di mana daya tolakannya lebih besar.
H2O berarti terdapat 2 PEI dan 2 PEB 9. Jawaban C:
Suatu senyawa memiliki jumlah domain elektron ikatan 3 dan domain elektron bebas 0, AX3 trigonal planar atau segitiga datar
10. Jawaban B
Lembaran Evaluasi Pembelajaran
1. LEMBAR PENILAIAN SIKAP ILMIAH (KARAKTER)
Selama proses belajar mengajar siswa memiliki sikap (karakter) yaitu sebagai berikut:
1. Rasa ingin tahu 2. Jujur
3. Teliti
4. Bertanggung jawab
TABEL 1. PENILAIAN SIKAP ILMIAH
No. Nama Siswa
Indikator Sikap Ilmiah
Jumlah Skor
Nilai Rasa ingin
tahu Disiplin Teliti Bertanggung Jawab 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4
Jumlah Skor
%
Rubrik Penilaian:
1. Rasa ingin tahu Deskriptor :
a. Mengajukan pertanyaan.
b. Penuh perhatian selama proses pembelajaran.
c. Mempunyai banyak referensi terbaru tentang materi yang sedang dipelajari.
2. Disiplin Deskriptor :
a. Melaksanakan tepat waktu.
b. Mampu menguasai diri c. Patuh terhadap regulasi.
3. Teliti Deskriptor:
a. Selektif melontarkan pertanyaan.
b. Selektif memberi jawaban.
c. Selektif mengeluarkan pendapat.
4. Bertanggung jawab Deskriptor:
a. Melakukan diskusi dalam kelompok dengan serius.
b. Mengerjakan tugas yang diberikan guru sesuai dengan instruksi.
c. Menyelesaikan diskusi yang diberikan guru tepat waktu.
Penskoran:
Skor 4 bila tiga deskriptor muncul.
Skor 3 bila dua deskriptor muncul.
Skor 2 bila satu deskriptor muncul.
Skor 1 bila tidak ada satupun deskriptor yang muncul.
Pedoman Penilaian:
Skor maksimal = 16
Nilai produk = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒ℎ
x 100
𝐽𝑢𝑚𝑙𝑎ℎ 𝑠𝑘𝑜𝑟 𝑚𝑎𝑘𝑠𝑖𝑚𝑢𝑚
Kriteria Penilaian :
85 – 100 = sangat baik 75 – 84 = baik 65 – 74 = cukup baik< 64 = kurang
Tabel 2. Jurnal Perkembangan Sikap
No Hari/
Tanggal Nama Kejadian/
Perilaku
Butir Sikap
Pos(+)/
Neg(-)
Tindak lanjut 1
2 3 4 5
Keterangan:
1. Nomor urut
2. Hari dan tanggal kejadian
3. Nama peserta didik yang menunjukkan perilaku yang menonjol baik positif maupun negatif.
4. Catatan kejadian atau perilaku yang menonjol baik positif maupun negatif.
5. Diisi dengan butir sikap dari catatan pada kolom kejadian.
6. Diisi dengan (+) untuk sikap positif dan (–) untuk sikap negatif.
Pekanbaru, 4 Oktober 2021
Mengetahui Disusun oleh
Guru Pamong Kepala Sekolah Guru Mata Pelajaran
……… ……….. NICHOLAS Z. MANATAP
LEMBAR PENILAIAN PENGAMATAN KINERJA DALAM MENYELESAIKAN TUGAS KELOMPOK
Selama proses belajar kelompok peserta didik memiliki sikap (karakter) yaitu sebagai berikut:
1. Bekerja sama 2. Aktif
3. Menghargai pendapat teman 4. Bertanggung jawab
TABEL 3. LEMBAR PENILAIAN KERJA KELOMPOK
No.
Nama Siswa Aspek Jumlah
Skor Nilai Kerja
sama
Keaktifan Menghargai pendapat teman
Tanggung jawab 1
2 3 4 5
Rubrik Penilaian:
1. Bekerja sama Deskriptor:
a. Membagi tugas dengan anggota kelompok.
b. Tidak mendominasi pekerjaan kelompok.
c. Peduli terhadap anggota kelompok.
2. Aktif Deskriptor:
a. Aktif bertanya tentang materi pelajaran.
b. Aktif memberi jawaban.
c. Aktif memberi tanggapan atau saran 3. Menghargai pendapat
Deskriptor:
a. Mendengarkan pendapat teman.
b. Menanggapi pendapat teman.
c. Memberi peluang kepada teman untuk saling tukar pendapat.
4. Tanggung jawab Deskriptor:
a. Melakukan diskusi dalam kelompok dengan serius dan aktif dalam kelompoknya.
b. Mengerjakan tugas sesuai dengan instruksi.
c. Menyelesaikan tugas tepat waktu.
Penskoran:
Skor 4 bila tiga deskriptor muncul.
Skor 3 bila dua deskriptor muncul.
Skor 2 bila satu deskriptor muncul.
Skor 1 bila tidak ada satupun deskriptor yang muncul.
Pedoman Penilaian:
Skor maksimal = 16
Nilai produk = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒ℎ
x 100
𝐽𝑢𝑚𝑙𝑎ℎ 𝑠𝑘𝑜𝑟 𝑚𝑎𝑘𝑠𝑖𝑚𝑢𝑚
Kriteria Penilaian : 85 – 100 = sangat baik 75 – 84 = baik 65 – 74 = cukup baik
< 64 = kurang
Pekanbaru, 8 Oktober 2021
Mengetahui Disusun oleh
Guru Pamong Kepala Sekolah Guru Mata Pelajaran
……… ……….. NICHOLAS Z. MANATAP
LEMBAR PENILAIAN KINERJA DALAM
MENYELESAIKAN PRESENTASI HASIL KERJA
Selama proses belajar mengajar siswa memiliki sikap (karakter) yaitu sebagai berikut:
1. Komunikasi
2. Sistematika Penyampaian 3. Penguasaan Materi 4. Keberanian 5. Antusias
TABEL 4. PENILAIAN PRESENTASI
No. Nama Siswa
Aspek
Jumlah
Skor Nilai Komunikasi Sistematika
Penyampaian
Penguasaan
Materi Keberanian Antusias 1
2 3 4 5
Rubrik Penilaian:
1. Komunikasi
1 = Tidak komunikatif 2 = Kurang komunikatif 3 = Cukup komunikatif 4 = Sangat komunikatif 2. Sistematika Penyampaian
1 = Tidak Sistematis 2 = Kurang Sistematis 3 = Cukup Sistematis 3 = Sangat Sistematis 3. Penguasaan Materi
1 = Tidak menguasai materi 2 = Kurang menguasai materi 3 = Cukup menguasai materi 4 = Sangat menguasai materi 4 Keberanian
1 = Tidak ada berani 2 = Kurang berani 3 = Cukup berani 4 = Sangat berani 5 Antusias
1 = Tidak antusias 2 = Kurang antusias
3 = Cukup antusias tetapi kurang kontrol 4 = Sangat atusias dan terkontrol Pedoman Penilaian:
Skor maksimal = 20
Nilai produk = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒ℎ
x 100
𝐽𝑢𝑚𝑙𝑎ℎ 𝑠𝑘𝑜𝑟 𝑚𝑎𝑘𝑠𝑖𝑚𝑢𝑚
Kriteria Penilaian : 85 – 100 = sangat baik 75 – 84 = baik 65 – 74 = cukup baik
< 64 = kurang
Pekanbaru, 4 Oktober 2021
Mengetahui Disusun oleh
Guru Pamong Kepala Sekolah Guru Mata Pelajaran
……… ……….. NICHOLAS Z. MANATAP
Lampiran 5.
LEMBARAN PENILAIAN DIRI
Mata Pelajaran :...
Kelas/Semester :...
Tahun Pelajaran :...
Waktu Pengamatan :...
Petunjuk
Bacalah dengan saksama pernyataan berikut dan berilah tanda “√” pada kolom yang sesuai dengan keadaan dirimu yang sebenarnya.
No Pernyataan Ya Tidak
1 Saya memperhatikan arahan atau petunjuk dan penjelasan dari guru dengan baik
2 Saya mencatat data dan materi yang diberikan oleh guru atau dari hasil pengamatan dengan teliti dan jujur serta sesuai fakta
3 Saya menyelesaikan tugas dengan sungguh- sungguh dan tepat waktu
Keterangan
1. Skor penilaian dengan memilih Ya = 50 2. Skor penilaian dengan memilih Tidak = 25
3. Skor maksimal adalah jumlah pernyataan dikali dengan 50
4. Skor Penilaian Sikap adalah Jumlah skor dibagi skor maksimal dan dikali 100 Predikat
80,01 – 100 = Amat baik (AB) 60,01 – 80,00 = Baik (B) 30,01 – 60,00 = Cukup (C) 00,00 – 30,00 = Kurang (K)
LEMBAR PENILAIAN PENGETAHUAN
Tujuan : Mengukur pengetahuan siswa setelah pembelajaran berlangsung. Materi Pokok : Bentuk Molekul
Tabel.5. Penyusunan Soal
No. Kompetensi Dasar Materi Indikator Level Soal Skor
1
Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron dalam menentukan bentuk molekul.
Teori Domain Elektron
Memprediksikan bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan
hubungannya dengan kepolaran senyawa.
(C5)
HOTS 1 4
2
Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron dalam menentukan bentuk molekul.
Teori Domain Elektron
Menentukan bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan hubungannya dengan kepolaran senyawa.
(C2)
LOTS 2 4
3
Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron dalam menentukan bentuk molekul.
Teori Domain Elektron
Meramalkan bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan hubungannya dengan kepolaran senyawa.
C3
(LOTS) 3 4
4
Membuat model bentuk
molekul dengan
menggunakan bahan-bahan yang ada di lingkungan sekitar atau perangkat lunak komputer
Teori Domain Elektron
Membangun bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom dan hubungannya dengan kepolaran senyawa.
C6
(HOTS) 4 4
Pertanyaan
1. Diketahui Unsur P (Z = 15) bersenyawa dengan unsur Cl (Z = 17) membentuk PCl3. Prediksilah banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3.
2. Tentukan jumlah domain elektron, domain elektron ikatan, dan domain elektron bebas dalam molekul NH3! (diketahui nomor atom N = 7; H = 1)
3. Ramalkan dan gambarkan bentuk molekul dari CH4 dengan menggunakan teori domain elektron! (diketahui nomor atom C = 6; H = 1)
4. Bentuklah molekul senyawa berikut menurut teori domain elektron ! 1. CH4 2.
XeF4 3. BF3 4. PCl5 (No. atom C=6, H=1, Xe=54, F=9, B=5, P=15, Cl=17) Jawaban
Pedoman Penskoran:
1. Jawaban sesuai dengan materi dan lengkap (skor 4) 2. Jawaban sesuai dengan materi tetapi kurang lengkap (skor 3) 3. Jawaban kurang sesuai dengan materi (skor 2) 4. Jawaban tidak sesuai dengan materi (skor 1)
Pedoman Penilaian:
Skor maksimal = 16
NA = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒ℎ
x 100
𝐽𝑢𝑚𝑙𝑎ℎ 𝑠𝑘𝑜𝑟 𝑚𝑎𝑘𝑠𝑖𝑚𝑢𝑚
Kriteria Penilaian :
85 – 100 = sangat baik 75 – 84 = baik 65 – 74 = cukup baikPekanbaru, 4 Oktober 2021
Mengetahui Disusun oleh
Guru Pamong Kepala Sekolah Guru Mata Pelajaran
……… ……….. NICHOLAS Z. MANATAP