SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh:
Maria Rosa Irma Budi Cahyani NIM : 038114065
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
Yeg dt:ajutea oL! : Mada Ros lr6a Budi Cdhyei
NlM i 0381 14065
YolEB Dwialu4a lvlsi
TLSADAP -rrraiia &ai@ Iach
OI€h:
Mdir Ro$ Im Budi c.ltdi
NIM | 03El
14065
DiFtutatar di h!d4.n rditi! Penglji skip6i
lahlla!tall@iUliv€Eitar SMta Dh.m! Pad! tanggd l5 Agushts 2007
Yohr!€s
Dwidirla M.Si
L Yot aesDwiarn
t4 M.si.
2 .
4\
2. Chrisrim
P.launi M.Si.,
Apt
”Belajarlah pada-Ku
Karna Aku lembut dan rendah hati
Dan jiwa-Ku akan diam dalam damai abadi”
Kupersembahkan karya sederhana ini untuk:
Tuhan Yang Maha Esa yang selalu memberkati kehidupanku
Bapak, Ibu dan Kakakku yang senantiasa mendoakan dan mendukungku
Frederikus Adi Prasetyo yang selalu menyiramiku dengan cinta kasih
t&ya a&! b{gim oarg bia t€cuali }ug telrh diebutt ! dabn tft'p.! do dan . post kr" sebaeri@ bylkirya kary. itdiab.
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas berkat dan rahmat-Nya yang berlimpah kepada penulis, sehingga penulis dapat menyelesaikan skripsi yang berjudul TOKSISTAS AKUT EKSTRAK DIETIL ETER dan EKSTRAK METANOL-AIR dari HERBA PEGAGAN EMBUN (Hydrocotyle sibthorpioides
Lmk.) terhadap Artemia salina Leach, sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm.) pada Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Keberhasilan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan berbagai pihak, baik berupa moril, materiil maupun spirituil. Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta.
2. Bapak Yohanes Dwiatmaka, M.Si. selaku pembimbing dan dosen penguji. Terima kasih atas bimbingan, masukan, waktu dan perhatiannya selama penelitian dan penyusunan skripsi ini.
3. Ibu Christine Patramurti, M.Si., Apt. selaku dosen penguji yang telah memberikan masukan, perhatian, kritik dan saran demi kesempurnaan skripsi ini.
5. Bapak, Ibu, kakakku Indah, beserta keluarga FX. Sulistyono, S.Pd., MM yang telah memberikan dukungan baik material maupun spiritual.
6. Frederikus Adi Prasetyo, atas segala cinta dan semangat yang mampu membuatku bertahan dalam menyelesaikan skripsi ini.
7. Alm. Damianus Bramantyo Idaman, semoga kau berbahagia di sisi-Nya. Terima kasih atas segala kebersamaan yang pernah terjalin walau hanya sebentar, namun akan selalu terkenang.
8. Devi, Komank, Titien, Ratna, Anien, terima kasih atas persahabatan dan kebersamaan dalam suka maupun duka.
9. Mbak Sinta, Lia, Mbak Dika, Mas Wondo, Apri, Novi, Hartono, kkn_Merry dan kkn_Iin terima kasih kerjasama, bantuan dan dukungannya.
10.Karyawan dan laboran Laboratorium (Mas Wagiran, Mas Sigit, Mas Andre, Mas Parlan, Mas Kunto dan Pak Mukmin) yang telah banyak membantu selama penelitian ini.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran demi penyempurnaan skripsi ini. Akhirnya besar harapan penulis semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu dan berbagai pihak.
DAFTAR ISI
HALAMAN JUDUL ………... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA ... v
PRAKATA ... vi
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
INTISARI... xv
ABSTRACT ... xvi
BAB I. PENGANTAR ………... 1
A. Latar Belakang ………... 1
1. Perumusan masalah ………...…. ... 2
2. Keaslian penelitian ………...………... 3
3. Manfaat penelitian ………...………... 3
B. Tujuan Penelitian ………...………... 4
BAB II. PENELAAHAN PUSTAKA ………...………... 5
A. Pegagan Embun ..………...………... 5
2. Nama lokal ...……...………... 5
3. Uraian tanaman ...…………...………... 5
4. Kandungan kimia ... 6
B. Artemia salina Leach ... 6
1. Keterangan zoologi .. ………...………... 6
2. Morfologi ...………...…….…... 6
3. Lingkungan hidup ...………... 8
4. Perkembangan dan siklus hidup ... 9
5. Metode BST ... 10
C. Apoptosis ... 14
D. Penyarian ... 15
E. Senyawa yang Diidentifikasi ... 17
1. Terpenoid ... ………...… 17
2. Flavonoid ...………...……... 18
F. Kromatografi Lapis Tipis ... 19
G. Keterangan Empiris ... 21
BAB III. METODOLOGI PENELITIAN ... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian dan Definisi Operasional ... 21
1. Variabel penelitian ... ………... 21
2. Definisi operasional ...………...………... 21
1. Bahan penelitian... ………... 23
2. Alat Penelitian...………...………... 23
D. Tatacara Penelitian ... 24
1. Determinasi herba pegagan embun ...………... 24
2. Pengumpulan bahan ...………... 24
3. Pembuatan simplisia ...………... 24
4. Penyarian ... 25
5. Pembuatan Air Laut Buatan (ALB)...…………... 27
6. Penetasan telur ....………... 27
7. Pembuatan larutan uji ……... 28
9. Uji toksisitas akut dengan metode BST ... 28
10. Uji KLT ekstrak aktif pegagan embun ... ... 29
11. Analisis hasil ... 30
BAB IV. HASIL PENELITIAN dan PEMBAHASAN ... 31
A. Identifikasi Tanaman ... 31
B. Pengumpulan Bahan ... 31
C. Pembuatan Simplisia ... 32
D. Penyarian Herba Pegagan Embun Menggunakan Pelarut Dietil Eter dan Metanol ... 33
E. Air Laut Buatan (ALB) ……... 36
E. Penetasan Siste ... 37
G. Uji Kualitatif Ekstrak aktif dengan KLT ... 50
BAB V. KESIMPULAN dan SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN ... ... 61
DAFTAR TABEL
Tabel I. Kriteria ketoksikan akut ... ... 14 Tabel II. Persentase kematian larva artemia akibat pemberian ekstrak
Dietil eter herba pegagan embun... 46 Tabel III. Persentase kematian larva artemia akibat pemberian ekstrak
metanol-air herba pegagan embun ... 48 Tabel IV. Hasil KLT pemeriksaan terpenoid dalam ekstrak dietil eter herba
pegagan embun ... 51 Tabel V. Hasil KLT pemeriksaan flavonoid dalam ekstrak dietil eter herba
DAFTAR GAMBAR
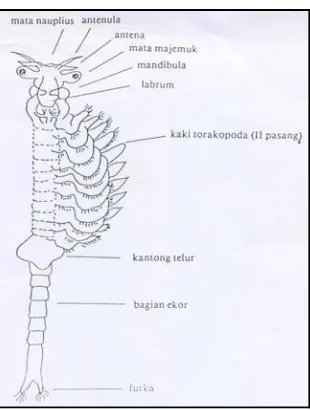
Gambar 1. Bagian-bagian tubuh artemia dewasa ... 7
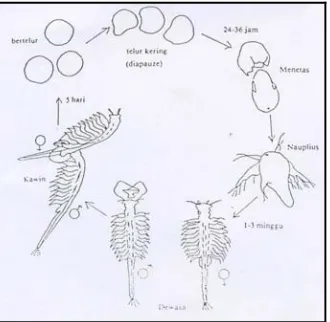
Gambar 2. Siklus hidup artemia biseksual ... 9
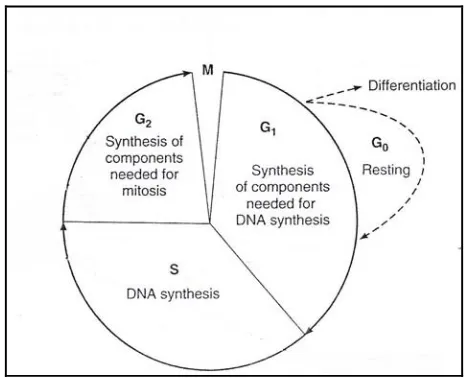
Gambar 3. Siklus sel ... 18
Gambar 4. Bagan mekanisme terjadinya apoptosis ... 41
Gambar 5. Mekanisme monoterpenoid menginduksi apoptosis ... 42
Gambar 6. Mekanisme flavonoid menginduksi apoptosis ... 43
Gambar 7. Kurva hubungan nilai probit versus log konsentrasi ekstrak dietil eter herba pegagan embun ... 47
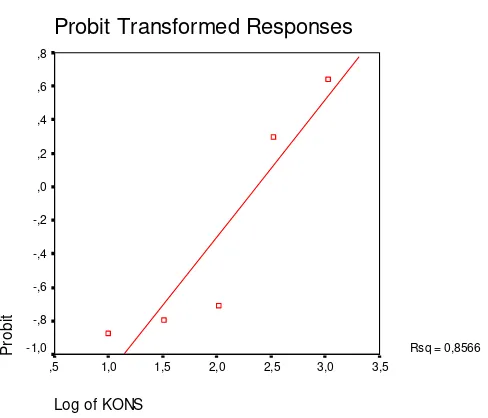
Gambar 8. Kurva hubungan nilai probit versus log konsentrasi ekstrak metanol-air herba pegagan embun ... 49
Gambar 9. Reaksi vanilin asam sulfat untuk pemeriksaan senyawa terpenoid .... 52
INTISARI
Penyakit kanker merupakan salah satu ancaman yang utama terhadap kesehatan. Kanker termasuk urutan kelima terbanyak sebagai penyebab kematian. Sedangkan sediaan antikanker hingga saat ini sangat terbatas, oleh karena itu perlu dilakukan pencarian terhadap senyawa-senyawa antikanker yang baru. Herba pegagan embun (Hydrocotyle sibthorpioides Lmk.) diduga mengandung senyawa yang berkhasiat sebagai antikanker namun sampai saat ini belum ada penelitian mengenai hal ini. Untuk mengetahui aktivitas herba pegagan embun sebagai obat antikanker maka dilakukan uji pendahuluan dengan menggunakan metode Brine Shrimp Lethalithy Test (BST), yang dinyatakan dengan harga Median Lethal Concentration
50 (LC50).
Penelitian ini merupakan eksperimental murni dengan rancangan penelitian
Posttest Only Control Group Design. Penelitian dilakukan dengan menggunakan ekstrak metanol-air dan ekstrak dietil eter herba pegagan embun. Ekstrak diperoleh dengan metode perkolasi. Sampel uji dibuat seri konsentrasi 125, 250, 500, 1000, dan 2000 µg/ml. Kontrol menggunakan air laut buatan, replikasi dilakukan 5 kali. Jumlah larva Artemia salina Leach yang mati pada tiap konsentrasi dihitung setelah 24 jam perlakuan. Nilai LC50 dihitung dengan analisis probit. Ekstrak dikatakan toksik apabila harga LC50 ≤ 1000 µg/ml. Dari ekstrak yang paling toksik ( paling aktif ) dilakukan identifikasi menggunakan kromatografi lapis tipis (KLT) untuk mengetahui golongan senyawa yang terkandung di dalamnya.
Hasil penelitian menunjukkan harga LC50 ekstrak metanol-air sebesar 769 µg/ml dan ekstrak dietil eter 229 µg/ml, sehingga ekstrak dietil eter lebih toksik dibandingkan ekstrak metanol-air. Identifikasi kandungan golongan senyawa dengan KLT menunjukkan bahwa ekstrak dietil eter mengandung flavonoid dan terpenoid. Kata kunci : Herba pegagan embun (Hydrocotyle sibthorpioides Lmk.), BST,
ABSTRACT
Cancer disease is one of the main threats for health. Cancer is included in the four biggest deathly causes. Meanwhile, the dosage of anti cancer is very limited nowadays, therefore it is necessary to find out some new anti cancer compounds.
Pagagan embun herbs (Hydrcotyle sibthorpiodes Lmk.) is considered contains merit compounds as the anti cancer, but there is no research about it until now. For knowing the activity of Pegagan embun herbs as anti cancer medicine, it needs to do a preliminary examination using Brine Shrimp Lethality Test (BST) method, which is presented with the value Median Lethal Concentration 50 (LC50).
This research is pure experimental with Posttest Only Control Group Design as the research design. This research is elaborated using water methanol extract and pegagan herbs diethyl ether extract. The extracts are gained through percolation method. Concentration serials of examination sample made are 125, 250, 500, 1000, and 2000 µg/ml. Control for the research used is artificial sea water and the replication is made 5 times. Number of Artemia salina larva Leach that dies in every concentration is counted after 24 hours of treatment. LC50 is counted using probit analysis. Extract is said to be toxic if the rate of LC50 ≤ 1000 µg/ml. From the most toxic extract (most active) is being identified using thin layer chromatography (TLC) to know the compounds type contained in it.
The result of the research shows the LC 50 rate of water methanol extract as mush as 769 µg/ml and diethyl ether extract as much as 229 µg/ml, so that diethyl ether extract is more toxic than water methanol extract. The identification of compounds type using TLC shows that diethyl ether extract contains flavonoid and terpenoid.
BAB I PENGANTAR
A. Latar Belakang
Kanker adalah suatu penyakit sel dengan ciri atau gangguan atau kegagalan mekanisme pengatur multiplikasi dan fungsi homeostatis lainnya pada organisme multiseluler dan bersifat metastatis (Tanu, 1998). Sampai saat ini penyakit kanker masih menjadi salah satu penyakit yang ditakuti masyarakat. Menurut Siswandono dan Soekardjo (2000) sampai saat ini masih sedikit sekali obat antikanker yang bekerja secara selektif untuk pengobatan jenis kanker tertentu. Berbagai usaha penganggulangan terhadap penyakit ini telah dilakukan namun hasil yang didapat belum maksimal, seperti pembedahan, terapi radiasi dan kemoterapi.
Cara lain yang dipilih sebagian masyarakat adalah dengan memanfaatkan bahan alam. Salah satu penelitiannya dilakukan terhadap herba pegagan embun. Herba pegagan embun diduga mengandung senyawa yang berkhasiat sebagai antikanker (Anonim, 2002). Herba pegagan embun mengandung beberapa senyawa antara lain terpenoid minyak atsiri (trans-β-farnesene, β-pinene, α -pinene, β-caryophyllene, α-humulene, camphene, dan ocimene yang keberadaannya dinyatakan dalam monoterpenoid dan sesquiterpenoid) dan flavonoid.
program kematian sel. Terpenoid menginduksi apoptosis melalui jalur Fas/Fas ligand (Rajesh, Rachele, Stenzel and Howard, 2003) dan flavonoid menginduksi apoptosis dengan mencegah terjadinya mutasi p53 (Albert, Johnson, Lewis, Raff, Roberts and Walter, 2002). Kelarutan senyawa monoterpenoid dan sesquiterpenoid sangat besar dalam pelarut dietil eter (Harborne, 1987), sedangkan flavonoid sangat larut dalam metanol dan air. Oleh karena itu dalam penelitian ini digunakan ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun.
Skrining aktivitas sitotoksik dari ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun dilakukan dengan metode Brine Shrimp Lethality Test
(BST). Prinsip metode ini adalah uji toksisitas akut terhadap larva Artemia salina
L. dengan penentuan nilai LC50 setelah perlakuan 24 jam (Meyer, Ferrigni, Putnam, Jacobsen, Nichols, and McLaughlin, 1982). Suatu senyawa dikatakan mempunyai potensi toksik jika nilai LC50 < 1000 μg/ml. Keberadaan senyawa monoterpenoid dan sesquiterpenoid serta flavonoid di dalam ekstrak toksik herba pegagan embun dipastikan melalui profil Kromatografi Lapis Tipis.
1. Perumusan masalah
a. Apakah ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun mempunyai potensi toksik terhadap larva artemia?
b. Ekstrak manakah yang mempunyai potensi toksik lebih tinggi terhadap larvaartemia?
2. Keaslian penelitian
Penelitian yang pernah dilakukan terhadap herba pegagan embun adalah isolasi dan identifikasi beberapa senyawa seperti monoterpenoid, sesquiterpenoid, fenol dan minyak atsiri menggunakan metode Gas Liquid Chromatography (GLC) oleh Anonim (2002). Telah diketahui bahwa kandungan dari herba pegagan embun berkhasiat sebagai antitumor (Anonim, 2002). Tetapi sejauh penelusuran pustaka, belum pernah dilakukan penelitian mengenai toksisitas akut ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun terhadap larva artemia.
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan memberikan informasi yang berguna bagi perkembangan ilmu pengetahuan terutama dalam bidang farmasi mengenai seberapa besar aktivitas ketoksikan dari ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun dengan metode BST.
b. Manfaat praktis
B. Tujuan Penelitian
1. Menetapkan nilai LC50 ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun.
2. Mengetahui ekstrak mana yang mempunyai efek toksik lebih tinggi terhadap larva artemia.
BAB II
PENELAAHAN PUSTAKA
A. Pegagan Embun
1. Keterangan botani
Pegagan embun (Hydrocotyle sibthorpioides Lmk.) mempunyai sinonim
Hydrocotyle rotundifolia, Roxb. dan Hydrocotyle formosana Masamune yang termasuk dalam familia Umbelliferae (Apiaceae) (Anonim, 2002).
2. Nama lokal
Pegagan embun, antanan beurit, antanan lembut (Sunda); Andem, katepa’n, rending, semanggi (Jawa); Salatun: take cena (Madura), tikim, patikim; Tian husui (Cina) (Anonim, 2002).
3. Uraian tanaman
4. Kandungan kimia
Herba pegagan embun yang berkhasiat untuk mengobati tumor, reumatik, infeksi saluran nafas, gangguan pencernaan, dan masalah kulit mempunyai kandungan kimiawi yang antara lain terdiri dari: terpenoid minyak atsiri (trans-β -farnesene, β-pinene, α-pinene, β-caryophyllene, α-humulene, camphene, dan ocimene yang keberadaannya dinyatakan dalam monoterpenoid dan sesquiterpenoid) dan flavonoid (quersetin 3-galaktosid) (Anonim, 2002).
B. Artemia salina Leach 1. Keterangan zoologi
Artemia (Artemia salina Leach) yang digunakan dalam penelitian ini termasuk dalam familia Artemidae (Oemarjati dan Wardhana, 1990).
1. Morfologi
a. Telur
Istilah untuk telur artemia yang benar adalah siste, yaitu telur yang telah berkembang lebih lanjut menjadi embrio dan kemudian, diselubungi oleh cangkang yang tebal dan kuat. Cangkang ini berguna untuk melindungi embrio terhadap pengaruh kekeringan, benturan keras, sinar ultraviolet dan mempermudah penguapan, sehingga ia sangat tahan terhadap keadaan lingkungan yang buruk (Mudjiman, 1989).
b. Burayak
(larva) yang dikenal dengan istilah nauplius. Dalam perkembangan selanjutnya burayak akan mengalami 15 kali perubahan bentuk (metamorfosis) setelah itu berubah menjadi artemia dewasa.
c. Artemia dewasa
Bentuk artemia dewasa lebih sempurna, dengan ukuran panjang sekitar 1 cm dan beratnya 10 mg. Bentuk artemia dewasa menyerupai udang kecil, bagian kepala berukuran lebih besar kemudian mengecil pada bagian ekor. Panjang ekor kurang lebih sepertiga dari total panjang tubuh. Dibagian kepala terdapat sepasang mata dan sepasang antenula (sungut). Pada bagian tubuh terdapat sebelas pasang kaki atau secara khusus disebut torakopoda, antara ekor dan pasangan kaki belakang terdapat sepasang alat kelamin, penis pada jantan dan ovarium pada betina (Mudjiman, 1989).
Gambar 1. Bagian-bagian tubuh artemia dewasa (Mudjiman, 1989)
Artemia tidak dapat bertahan hidup pada suhu kurang dari 6ºC atau lebih dari 35ºC. Akan tetapi, hal ini sangat jelas tergantung pada ras dan kebiasaan tempat hidup mereka. Suhu yang baik untuk pertumbuhan artemia berkisar antara 25-30º C. Telur artemia yang kering akan bertahan pada suhu -273ºC dan 100ºC. Daya tahan artemia terhadap perubahan kandungan ion-ion kimia dalam air ternyata juga sangat tinggi.
Untuk perkembangan artemia yang baik, mereka membutuhkan kadar garam yang tinggi. Sebab pada kadar garam yang tinggi dapat terhindar dari musuh-musuh yang tidak dapat hidup pada kadar garam yang tinggi. Sedangkan untuk pertumbuhan telur (siste) dibutuhkan kadar garam yang lebih rendah daripada batas tertentu. Batas ini berlainan untuk setiap jenis artemia (Mudjiman, 1989).
Agar artemia dapat hidup lebih baik, kadar oksigen terlarutnya harus mendekati titik kejenuhan, yaitu sekitar 3 ppm (bagian per juta). Terhadap perubahan-perubahan kadar oksigen terlarut ini, sebenarnya artemia sangat pandai menyesuaikan diri. Pada kadar oksigen yang hanya 1 ppm, artemia masih juga dapat bertahan. Sebaliknya, merekapun dapat hidup pada kejenuhan oksigen lebih dari 1,5 x 106 ppm (Mudjiman, 1989).
Pengaruh pH terhadap kehidupan artemia muda dan dewasa belum jelas namun berpengaruh terhadap penetasan telur. Apabila pH untuk penetasan kurang dari 8, maka efisiensi penetasan akan menurun. Siste banyak yang tidak menetas atau waktu penetasannya menjadi lebih panjang (Mudjiman,1989).
Ditinjau dari segi cara berkembang biaknya, ada dua jenis artemia yaitu jenis biseksual dan jenis partenogenetik.Jenis biseksual tidak dapat berkembang biak secara parthenogenesis, dan sebaliknya jenis partenogenetik tidak dapat berkembang biak secara biseksual (Mudjiman, 1989).
Pada perkembangbiakan biseksual maupun parthenogenesis dapat terjadi secara ovovivipar maupun ovipar. Cara ovovivipar yang keluar dari induknya sudah berupa burayak atau larva (nauplis), sedangkan cara ovipar yang keluar dari induknya berupa telur bercangkang. Sebutan yang tepat untuk telur ini yaitu siste
karena berisi embrio. Apabila telur artemia berada dalam lingkungan yang sesuai misalnya kadar garam, suhu, dan pH yang sesuai maka telur dapat memetas menjadi nauplis dalam waktu 14 hari menjadi artemia dewasa (Mudjiman, 1989).
Gambar 2. Siklus hidup artemia biseksual (Mudjiman, 1989)
a. Penggunaan artemia pada metode BST
Artemia digunakan sebagai hewan coba dalam praskrining aktivitas antikanker di National Cancer Institute (NCI), Amerika Serikat. Metode ini sering digunakan untuk skrining awal terhadap senyawa aktif yang terdapat di dalam ekstrak tanaman karena murah, cepat, mudah (tidak memerlukan kondisi aseptis), dan dapat dipercaya. Metode BST juga memiliki kekurangan karena artemia tidak mampu mendeteksi senyawa yang dalam aktivitas fisiologinya memerlukan aktivasi di dalam tubuh mamalia seperti 6-merkaptopurin dan siklofosfamida (Meyer et al., 1982). Meskipun pengujian ini tidak dapat mendeteksi senyawa yang dibutuhkan untuk aktivasi metabolik pada mamalia, tetapi uji BST ini dapat dipercaya sebagai detektor aktivitas biologik (Solis, Wright, Gupta, and Phillipson 1992).
Uji larva udang ini juga dapat digunakan untuk skrining awal terhadap senyawa-senyawa yang diduga berkhasiat sebagai antitumor karena uji ini sering sekali mempunyai korelasi yang positif dengan potensinya sebagai antitumor (Anderson, Goets, and Mc Laughin, 1991). Penggunaan larva artemia memang tidak spesifik untuk antitumor, namun dapat menunjukkan kemampuannya untuk memonitor kemungkinan adanya efek toksik secara lebih cepat dibandingkan dengan prosedur pengujian sitotoksitas menggunakan biakan sel kanker (Meyer et al., 1982).
sensitive Na+ dan K+ dependent ATPase (Solis et al., 1993), sehingga senyawa maupun ekstrak yang mempunyai aktivitas pada sistem tersebut dapat terdeteksi.
DNA-dependent RNA polymerase merupakan sistem enzim yang berperan dalam sistesis protein (polinukleotida). RNA polymerase akan berikatan dengan DNA pada tahap transkripsi di dalam nukleus. Dalam hal ini DNA berperan sebagai cetakan dalam pembuatan nukleotida RNA yang baru. RNA, khususnya RNA messenger (mRNA) inilah yang membawa pesan genetik, yang kemudian akan diterjemahkan RNA translasi (tRNA) dalam proses sintesis protein (Campbell, Recee, and Mitchell, 2002).
mengikuti sepanjang perbedaan osmotik yang diciptakan sehingga sel membengkak (Ganong, 1995). Sel yang membengkak selanjutnya dapat mengalami lisis sehingga sel tersebut mati.
Artemia dinilai sukup akurat mewakili model sel kanker, hal ini telah dibuktikan oleh Meyer (1982) lewat penelitiannya. Hasil penelitiannya menunjukkan bahwa suatu ekstrak yang berpotensi toksik dan bersifat sitotoksik, ketika diujikan pada artemia juga memberikan hasil yang sama.
b. Parameter toksisitas
Tolok ukur pengamatan potensi ketoksikan meliputi tolok ukur kualitatif dan kuantitatif. Tolok ukur kualitatif terdiri dari mekanisme efek toksik, wujud efek toksik, sifat efek toksik dan gejala klinis. Tolok ukur kuantitatif berupa LC50, yaitu konsentrasi yang dapat menyebabkan kematian pada 50% hewan uji. Dalam tolok ukur kuantitatif ini terdapat hubungan antara konsentrasi dengan ketoksikan suatu senyawa. Hubungan antara konsentrasi-respon lebih banyak digunakan dalam evaluasi ketoksikan suatu senyawa karena tujuannya lebih ditujukan pada resiko (ukuran kemungkinan timbulnya potensi toksik pada sekelompok hewan uji).
Uji toksisitas akut digunakan untuk menentukan harga LD50 atau LC50 suatu senyawa bilamana lama pengamatan tidak ditunjukkan, maka dianggap bahwa pengamatan dilakukan selama 24 jam (Donatus, 2001). Parameter LC50 digunakan dalam metode BST dan bukan LD50 karena dalam hal ini larva artemia terpejani senyawa toksik yang ada pada media hidupnya, yaitu Air Laut Buatan (ALB). Uji toksisitas akut dengan hewan uji Artemia salina Leach digunakan sebagai uji pendahuluan pada penelitian yang mengarah pada uji sitotoksik. Suatu senyawa disebut toksik jika harga LC50 dari uji toksisitas akut < 1000 µg/ml (Meyer et al., 1982).
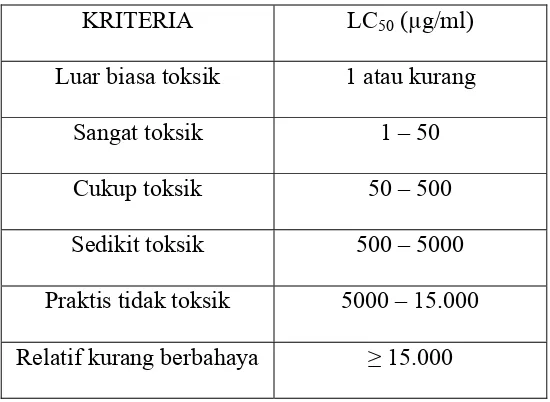
Tabel I. Kriteria ketoksikan akut (Loomis, 1978)
KRITERIA LC50 (µg/ml) Luar biasa toksik 1 atau kurang
Sangat toksik 1 – 50 Cukup toksik 50 – 500 Sedikit toksik 500 – 5000 Praktis tidak toksik 5000 – 15.000 Relatif kurang berbahaya ≥ 15.000
C. Apoptosis
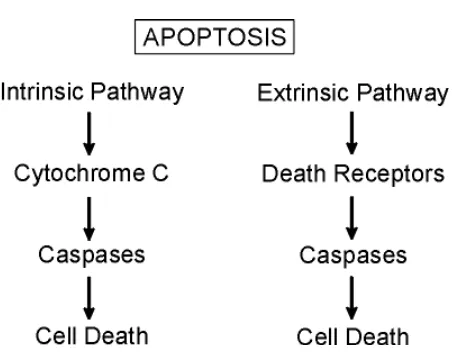
Kematian sel (apoptosis) meruoakan bagian penting dalam perkembangan manusia, yang terjadi selama proses oogenesis, perkembangan otak dan pada pembentukan kaki serta tangan. Apoptosis melibatkan gen-gen khusus dan jalur pemberi signal yang mendasari program kematian sel. Apoptosis dapat terjadi pada suatu sel tanpa menyebabkan kerusakan pada sel dan jaringan di sekitarnya (Rajesh, et al., 2003).
Karakteristik apoptosis bila ditinjau dari segi morfologi :
1. penyusutan sel : sel menjadi lebih kecil dan kehilangan kontak dengan sel- sel yang berada di sekelilingnya.
3. pemecahan sel membentuk ”badan apoptotik” dan terjadi fagositosis dari pecahan-pecahan sel ini oleh makrofag.
Apoptosis diatur oleh berbagai jalur pemberi signal yang kesemuanya itu melibatkan caspase. Caspase merupakan kelompok dari sistein protease, yaitu suatu enzim yang bertugas mencerna protein. Dalam tubuh manusia, kebanyakan caspase berada dalam bentuk inaktif yang kemudian akan diaktivasi melalui proses proteolisis menjadi bentuk yang lebih aktif.
Monoterpenoid/sesquiterpenoid berpotensi menginduksi apoptosis melalui jalur Fas/Fas ligand. Potensi monoterpenoid/sesquiterpenoid dalam menginduksi apoptosis disebabkan karena monoterpenoid/sesquiterpenoid dapat menghambat peralihan fase G2/M dalam siklus sel (Rajesh, et al 2003). Flavonoid menginduksi apoptosis dengan mencegah terjadinya mutasi p53 (Albert et al., 2002).
D. Penyarian
Perkolasi merupakan cara penyarian yang dilakukan dengan mengalirkan cairan penyarian melalui serbuk simplisia yang telah dibasahi. Metode perkolasi digunakan dalam penelitian ini karena dapat menyari zat aktif lebih optimal dibandingkan dengan menggunakan metode maserasi. Hal tersebut dikarenakan: 1. aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi
dengan larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan konsentrasi.
2. ruangan diantara butir-butir serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Oleh karena kecilnya cairan kapiler tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan atas, sehingga dapat meningkatkan perbedaan konsentrasi (Anonim, 1986).
Selain itu, perkolasi lebih efisien bila dibandingkan dengan maserasi karena prosesnya yang berkesinambungan di mana cairan penyari yang telah jenuh akan digantikan dengan cairan penyari yang lebih segar terus-menerus (Silva, Lee, Kinghorn, 1998)
tegangan permukaan, difusi osmosa, adhesi, daya kapiler dan daya geseran (Anonim, 1986).
Alat yang digunakan untuk perkolasi adalah perkolator, cairan yang digunakan untuk menyari yang disebut cairan penyari atau menstrum, larutan zat aktif yang keluar dari perkolator disebut sari atau perkolat, sedang sisa setelah dilakukan penyarian disebut ampas atau sisa perkolasi (Anonim, 1986).
E. Senyawa Yang Diidentifikasi 1. Terpenoid
Gambar 3. Siklus sel (Katzung and Trevor. 1993)
Menurut (Mursyidi, 1990), senyawa terpenoid dapat dipisahkan dengan Kromatografi Lapis Tipis (KLT). Fase gerak yang digunakan yaitu toluen-etil asetat (93:7 v/v). Sedangkan fase diam yang digunakan adalah silika gel GF254 atau selulosa. Terpenoid dideteksi dengan menggunakan pereaksi vanilin asam sulfat.
2. Flavonoid
(MeOH), butanol (BuOH), aseton, dimetilsulfoksida (DMSO) serta air. Gula yang terikat pada flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air, dengan demikian campuran pelarut dengan air merupakan pelarut yang lebih baik untuk glikosida.
Efek flavonoid terhadap macam-macam organisme sangat banyak macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional (Mursyidi, 1990). Menurut Anonim (2006), flavonoid merupakan salah satu jenis metabolit sekunder yang diduga menunjukkan adanya aktivitas sebagai antikanker. Flavonoid sebagai senyawa antikanker pada prinsipnya bersifat sitotoksik, antimetabolit, antimitotik/mitostatik, menghambat salah satu atau beberapa fase siklus metabolisme sel (Colis, 1874 cit Santa, 1998).
Adanya senyawa flavonoid dalam suatu bahan dapat dianalisis dengan KLT. Biasanya digunakan fase diam selulosa dan fase gerak seperti n-butanol-asam asetat-air (4:1:5 v/v) diambil lapisan atas, kloroform-etil asetat (60:40 v/v), dan kloroform-aseton-asam format (75:16,5:8,5 v/v). Deteksi terhadap bercak yang timbul setelah pengembangan dapat menggunakan sinar UV, pereaksi semprot seperti sitroborat, pereaksi alumunium klorida, dan antimoni triklorida (Wagner, Brady, dan Zgainski, 1984).
F. Kromatografi Lapis Tipis
dipisahkan berupa larutan, ditotolkan berupa bercak atau pita pada lempeng kromatografi, selanjutnya dikembangkan dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (Stahl, 1985).
Fase diam (lapisan penjerap) dibuat dari salah satu penjerap yang khusus digunakan untuk KLT. Penjerap yang umum digunakan adalah silika gel, alumunium oksida, kieselgur, selulosa dan lain-lain. Fase gerak ialah medium yang terdiri dari satu atau beberapa pelarut, bergerak di dalam fase diam yang merupakan lapisan berpori, yang dipengaruhi oleh gaya kapiler. Pelarut yang digunakan memiliki tingkat mutu analitik dan jika perlu dapat digunakan campuran pelarut yang terdiri dari 3 jenis pelarut (Stahl, 1985).
Deteksi senyawa pada plat KLT paling sederhana adalah jika senyawa yang menunjukkan penyerapan di daerah UV dengan panjang gelombang 254 nm (gelombang pendek) atau gelombang 365 nm (gelombang panjang) (Stahl, 1985). Deteksi senyawa pada plat KLT biasanya juga dilakukan dengan penyemprotan dan karena permukaan lebih sempit, maka penyemprotannya merupakan prosedur nisbi yang sederhana (Harborne, 1987).
Jarak titik pusat bercak dari titik awal
Rf = ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯
Jarak garis depan dari titik awal
Kelebihan khas KLT adalah keserbagunaan, kecepatan, dan kepekannya. Keserbagunaan KLT disebabkan oleh kenyataan bahwa di samping selulosa, sejumlah penjerap yang berbeda-beda dapat disaputkan pada plat kaca atau penyangga lain dan digunakan untuk kromatografi. Kecepatan KLT yang lebih besar disebabkan oleh sifat penjerap yang lebih padat bila disaputkan pada plat dan merupakan keuntungan bila digunakan untuk menelaah senyawa labil. Kepekaan KLT sedemikian rupa sehingga bila diperlukan dapat dipisahkan bahan yang jumlahnya kurang dari ukuran µg (Harborne, 1987).
G. Keterangan Empiris
Penelitian ini dilakukan untuk mendapatkan data empiris tentang potensi toksik ekstrak metanol-air dan ekstrak dietil eter herba pegagan embun terhadap larva artemia dengan metode BST yang dinyatakan dalam LC50, serta untuk memperoleh profil kromatografi lapis tipis ekstrak aktif herba pegagan embun.
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan Posttest Only Control Group Design.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas
Jenis ekstrak yang digunakan yaitu ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun dengan berbagai seri konsentrasi.
b. Variabel tergantung
Nilai LC50 ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun yang diperoleh dari analisis probit.
c. Variabel pengacau terkendali
1) Lingkungan tempat percobaan: sinar lampu 5 watt, suhu penetasan sebesar 25º C, serta pH air laut buatan antara 7-8 dengan kadar garam 5 permil
2) Umur larva artemia adalah 48 jam.
2. Definisi operasional
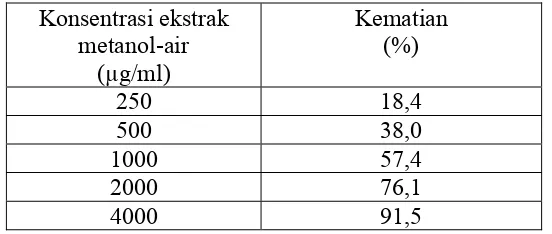
b. Konsentrasi ekstrak dietil eter herba pegagan embun yaitu 10, 32, 102, 328 dan 1049 µg/ml dan konsentrasi ekstrak metanol- air herba pegagan embun yaitu 250; 500; 1000; 2000 dan 4000 µg/ml
c. Ekstrak dietil eter merupakan sari yang diperoleh dari hasil perkolasi serbuk herba pegagan embun menggunakan penyari dietil eter
d. Ekstrak metanol-air merupakan sari yang diperoleh dari hasil perkolasi serbuk herba pegagan embun menggunakan penyari metanol-air
e. Jumlah kematian larva artemia setelah diberi perlakuan selama 24 jam.
f. Kematian artemia ditunjukkan dengan keadaan dimana tidak ada lagi pergerakkan dari artemia, baik itu tenggelam, melayang maupun mengapung.
C. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan utama penelitian ini adalah herba pegagan embun yang telah dibudidayakan dari bibit liar di lingkungan Universitas Sanata Dharma Yogyakarta, telur artemia, ragi Saccharomyces cerevisae, aquadest, selulosa, pereaksi semprot AlCl3 dan amonia, natrium klorida, magnesium sulfat, magnesium klorida, kalsium klorida, natrium hidrokarbonat, n-butanol, asam asetat, serta bahan kimia yang bila tidak disebutkan lain berderajat pro analisys
meliputi: dietil eter dan metanol.
2.Alat penelitian
mikropipet, pipet volume 5 ml (Pyrex), pipet tetes, bejana kromatografi, kertas saring, alat semprot, lampu UV 254 nm dan 365 nm, gelas ukur (Pyrex), Erlenmeyer (Pyrex), cawan porselen, batang pengaduk, sendok, blender (Retch bv), pengayak, neraca analitik (Mettler Toledo AB204).
D. Tata Cara Penelitian 1. Determinasi herba pegagan embun
Determinasi dilakukan terhadap tanaman pegagan embun dengan menggunakan buku acuan (Backer and Bakhuizen van den Brink, 1965) dengan tujuan untuk memastikan bahwa tanaman yang digunakan adalah Hydrocotyle sibthorpioides Lmk. Hasil determinasi berupa nama jenis (spesies) tanaman yang digunakan dalam penelitian ini.
2. Pengumpulan bahan
Bahan utama yang digunakan dalam penelitian ini adalah herba pegagan embun yang telah dibudidayakan dari bibit liar di lingkungan Universitas Sanata Dharma Yogyakarta dan dikumpulkan pada bulan Januari, sedangkan hewan uji yang digunakan berupa telur Artemia salina Leach (Ocean Star International, Inc.).
3. Pembuatan simplisia
simplisia yang benar-benar kering. Simplisia dapat diasumsikan kering apabila diremas dapat hancur. Setelah kering dipotong kecil-kecil dan dibuat menjadi serbuk dengan menggunakan blender kering dan kemudian diayak menggunakan ayakan tepung. Serbuk diayak sampai seluruhnya dapat melewati ayakan sehingga diperoleh serbuk yang halus.
4. Penyarian
Metode penyarian yang dilakukan pada penelitian ini yaitu dengan metode perkolasi menggunakan alat perkolator. Cairan penyari yang digunakan yaitu dietil eter dan campuran metanol-air (1:1 v/v).
a. Penyarian untuk mendapatkan ekstrak dietil eter
pada perkolat yang terakhir hasilnya negatif yang ditandai dengan tetesan terakhir yang jernih. Zat aktif diperoleh setelah perkolat diuapkan menggunakan vaccum rotary evaporator sampai kental. Agar proses penguapan dietil eter sempurna maka setelah divaccum, diuapkan di atas waterbath sampai bau dietil eter hilang menggunakan cawan porselen.
b. Penyarian untuk mendapatkan ekstrak metanol-air
5. Pembuatan Air Laut Buatan (ALB)
Komposisi bahan yang digunakan untuk pembuatan air laut buatan berkadar garam 5 permil adalah 5 gram natrium klorida (NaCl); 1,3 gram magnesium sulfat (MgSO4); 1 gram magnesium klorida (MgCl2); 0,3 gram kalsium klorida (CaCl2); 0,2 gram kalium klorida (KCl), dan 2 gram natrium hidrokarbonat (NaHCO3) dicampur dalam 1 liter aquadest. Bahan-bahan sebagian dilarutkan dalam sebagian aquadest dalam labu takar 1 liter. Khusus untuk magnesium sulfat dilarutkan dalam air panas, sedangkan natrium hidrokarbonat dilarutkan dengan air bebas CO2. Kemudian ditambahkan aquadest sampai volume tepat 1 liter. Air laut buatan berkadar garam 5 permil dan pH antara 7,3-8,4 (Mudjiman, 1989).
6. Penetasan telur artemia
Artemia diteteskan dari telurnya dengan media ALB berkadar 5 permil. ALB yang akan digunakan untuk menetaskan telur artemia diaerasi terlebih dahulu selama 2 jam. Telur artemia diteteskan dalam aquarium yang disekat menjadi dua bagian, bagian gelap dan bagian terang, dengan sekat berlubang. Bagian gelap merupakan telur artemia ditaburkan. Telur menetas kira-kira 24-36 jam kemudian menjadi nauplius (Mudjiman, 1991). Nauplius yang aktif akan bergerak menuju tempat yang terang melalui lubang pada sekat. Setelah 48 jam,
7. Pembuatan larutan uji
a. Pembuatan larutan stok
Larutan stok ekstrak dietil eter juga dipersiapkan sebagai larutan A dan larutan B. Larutan A dibuat dengan menimbang 100 mg ekstrak kental dietil eter menggunakan cawan porselen yang telah ditara, kemudian dilarutkan dengan 10 ml dietil eter p.a. Larutan B dibuat dengan mengencerkan 1 ml larutan A dengan 10 ml dietil eter p.a. Larutan stok ekstrak metanol-air dipersiapkan sebagai larutan A dan larutan B. Larutan A dibuat dengan menimbang 100 mg ekstrak kental metanol-air menggunakan cawan porselen yang telah ditara, kemudian dilarutkan dengan 10 ml metanol p.a. Larutan B dibuat dengan mengencerkan 1 ml larutan A dengan 10 ml metanol p.a.
b. Pembuatan larutan sampel
Dari larutan stok tersebut dibuat seri konsentrasi 10, 100, dan 1000 µg/ml sebagai uji awal BST (Meyer et al., 1982). Kelompok kontrol dan kelompok perlakuan masing-masing dibuat dalam tiga kali replikasi. Setelah dilakukan uji awal BST dan diperoleh hasil yang baik kemudian dibuat menjadi lima seri konsentrasi. Ekstrak dietil eter dibuat dalam seri konsentrasi 10, 32, 102, 328 dan 1049 µg/ml serta untuk ekstrak metanol-air dibuat dalam seri konsentrasi 250, 500, 1000, 2000 dan 4000 µg/ml Kelompok kontrol dan kelompok perlakuan masing-masing dibuat dalam lima kali replikasi.
9. Toksisitas akut dengan BST
masing-masing berupe ekstrak metanol-air dan ekstrak dietil eter dengan berbagai seri konsentrasi terlebih dahulu dikeringuapkan di atas waterbath. Hal ini bertujuan supaya pelarut menguap dan diharapkan hanya ekstrak herba pegagan embun yang tertinggal. Ditambahkan ± 3 ml ALB, kemudian divortex. Sepuluh ekor larva artemia yang berumur 48 jam, diambil secara acak dan dimasukkan ke dalam flakon. Kemudian ditambah ALB hingga volumenya mencapai 5 ml dan diberi 1 tetes ragi (3mg/5ml) sebagai makanan. Setiap pengujian selalu disertai dengan kontrol dan masing-masing konsentrasi dibuat dalam 5 kali replikasi. Flakon dijaga agar selalu mendapat penerangan. Setelah 24 jam, jumlah larva artemia yang mati dihitung dan dianalisis untuk mengetahui harga LC50. Larva udang dikatakan mati bila larva tersebut tidak dapat menunjukkan gerakan aktif lagi (Carballo et al., 2002).
10. KLT ekstrak aktif herba pegagan embun
Uji kualitatif ekstrak yang aktif herba pegagan dengan KLT ini bertujuan untuk mengetahui kandungan senyawa terpenoid dan flavonoid yang terdapat dalam ekstrak dietil eter dan ekstrak metanol-air daun pegagan embun.
a. Identifikasi terpenoid
b. Identifikasi flavonoid
Dalam identifikasi senyawa flavonoid dilakukan dengan menggunakan fase diam selulosa, sedangkan fase geraknya n-butanol:asam asetat:air (4:1:5 v/v). Pembanding yang digunakan yaitu rutin. Lempeng KLT dimasukkan dalam bejana berisi fase gerak yang telah jenuh lalu dielusi sampai jarak rambat 10 cm. Pengamatan bercak dilakukan di bawah sinar UV dengan panjang gelombang 254 nm dan 365 nm. Deteksi juga dilakukan dengan menggunakan uap amonia untuk memastikan keberadaan senyawa flavonoid. Caranya adalah dengan meletakkan lempeng KLT yang telah selesai dielusi dalam sebuah chamber yang di dalamnya sudah diletakkan larutan amonia. Lempeng KLT dibiarkan terkena uap dari amonia tersebut selama beberapa saat hingga muncul warna kuning.
11. Analisis hasil
Presentase kematian larva artemia dapat dihitung menggunakan rumus Abott, hal ini dilakukan karena terdapat kematian larva artemia pada kontrol (Negara, 2003).
Jml. kematian pada tes uji – Jml. Kematian pada kontrol
% kematian = ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ X 100% Jml. hewan uji – Jml. kematian pada kontrol
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Identifikasi Tanaman
Identifikasi tanaman menjadi langkah awal dalam penelitian yang menggunakan herba pegagan embun. Identifikasi tanaman dilakukan untuk memastikan kebenaran identitas tanaman menggunakan kunci determinasi menurut Backer and Bakhuizen van den Brink Jr (1965).
Berdasarkan identifikasi tanaman yang telah dilakukan (lampiran 1), diperoleh kesimpulan bahwa tanaman yang digunakan adalah benar-benar herba pegagan embun (Hydrocotyle sibthorpioides Lmk.).
B. Pengumpulan Bahan
Bahan utama yang digunakan dalam penelitian ini adalah herba pegagan embun yang telah dibudidayakan dari bibit liar di lingkungan Universitas Sanata Dharma Yogyakarta dan dikumpulkan pada bulan Januari. Herba pegagan embun yang digunakan meliputi seluruh bagian tanaman yang berada di atas tanah yaitu bunga, daun, dan batang.
pegagan embun tidak berbeda secara bermakna, begitu pula dengan bagian tanaman yang digunakan dalam penelitian ini.
C. Pembuatan Simplisia
Herba pegagan embun yang telah dikumpulkan dibersihkan dan dicuci dengan air yang mengalir dengan tujuan agar kotoran yang melekat pada daun dapat terlepas serta tidak menempel lagi. Herba dikeringkan di bawah sinar matahari secara tidak langsung dengan ditutup kain hitam sehingga senyawa aktif yang terdapat di dalam herba pegagan embun tidak rusak. Pengeringan ini menurut Anonim (1986) dimaksudkan untuk menurunkan kadar air sehingga tidak ditumbuhi jamur, mempermudah pembuatan serbuk, dan menjamin agar kualitasnya tetap baik sehingga dapat disimpan dalam waktu yang lebih lama. Reaksi enzimatis serta perubahan kimiawi dapat juga diminimalkan, sehingga senyawa aktif yang terkandung dalam herba pegagan embun tidak hilang terurai. Pengeringan dihentikan apabila apabila kadar air yang terkandung dalam simplisia kurang dari 10% karena reaksi enzimatis yang dapat menguraikan senyawa aktif sudah tidak berlangsung (Anonim, 1986). Untuk mengetahui kapan proses pengeringan dihentikan adalah dengan meremas herba sampai hancur. Jika kadar air masih tinggi, maka herba tersebut masih lembab dan tidak hancur jika diremas.
bertambah baik bila permukaan serbuk yang bersentuhan dengan cairan penyari semakin luas, sehingga semakin halus serbuk yang dihasilkan maka akan semakin baik pula penyariannya. Namun menurut Anonim (1986) pada metode perkolasi, serbuk yang terlalu halus menyebabkan cairan penyari tidak dapat mengalir sehingga mengakibatkan penyarian tidak optimal. Pada penelitian ini serbuk yang dihasilkan halus, namun tidak menyumbat perkolator sehingga cairan penyari dapat menembus pori-pori serbuk dan penyarian berlangsung dengan sempurna.
D. Penyarian Herba Pegagan Embun Menggunakan Pelarut Dietil Eter dan Metanol
senyawa terpenoid. Sedangkan penggunaan metanol yang bersifat lebih polar dibandingkan dietil eter dimaksudkan untuk menarik senyawa ataupun zat aktif yang terkandung dalam herba pegagan embun yang bersifat polar seperti flavonoid.
Maserasi pendahuluan dilakukan sekurang-kurangnya 3 jam untuk membuka pori-pori serbuk sehingga cairan penyari dapat menembus sel dan melarutkan zat aktif dengan sempurna. Serbuk simplisia yang sebelumnya telah dibasahi dengan cairan penyari yang cukup untuk mengembangkan sel dengan sempurna, maka aliran cairan penyarinya tidak akan mengalami hambatan.
Perendaman dengan dietil eter selama 24 jam pada proses perkolasi dimaksudkan supaya serbuk simplisia menjadi terbasahi dan serbuk menjadi lebih mengembang sehingga dapat tersusun dengan baik. Penyusunan dikatakan baik apabila tidak ada rongga udara dalam serbuk simplisia dan kondisi simplisia tidak terlalu padat sehingga cairan penyari dapat membasahi seluruh serbuk simplisia dengan sempurna dan dapat menyari dengan optimal. Pada penelitian ini penyusunan serbuk simplisia telah diusahakan sebaik mungkin sehingga tidak lagi terdapat rongga udara.
tetes/menit sehingga penyarian berlangsung sempurna. Kecepatan penetesan dietil eter harus sama dengan kecepatan menetesnya perkolat, supaya permukaan serbuk tidak menjadi kering sehingga penyarian zat aktif optimal. Perkolat yang dihasilkan pertama kali merupakan cairan yang berwarna sangat pekat, hal ini menandakan bahwa banyak zat aktif yang terlarut dalam dietil eter. Perkolasi dihentikan setelah perkolat terakhir yang menetes sudah tidak berwarna (jernih), hal ini menandakan bahwa sudah tidak ada lagi zat aktif yang terlarut dalam dietil eter.
Sari dietil eter diuapkan di atas waterbath untuk mendapatkan ekstrak kental menggunakan cawan porselen. Penguapan dilakukan pada suhu 60º C. Suhu 60º C merupakan suhu optimal untuk penguapan di atas waterbath karena suhu yang lebih tinggi dapat menyebabkan rusaknya zat aktif. Karena penguapan tidak selesai dalam satu hari maka sari dietil eter disimpan di kulkas untuk mencegah tumbuhnya mikroorganisme. Hasil yang diperoleh berupa ekstrak kental.
waterbath pada suhu 60º C menggunakan cawan porselen. Untuk ekstrak metanol, hasil yang didapat berupa ekstrak kental.
Ekstrak yang telah diperoleh kemudian disimpan di dalam eksikator. Dalam eksikator tidak ada lagi air dan udara yang dapat masuk, yang memungkinkan terjadinya perubahan senyawa dalam ekstrak tersebut atau dapat merusak senyawa oleh adanya bakteri atau cendawan.
E. Air Laut Buatan (ALB)
Pembuatan ALB dimaksudkan untuk menyesuaikan lingkungan hidup artemia sehingga sama seperti air laut alami. Bahan yang digunakan untuk membuat air laut buatan terdiri dari natrium klorida, magnesium sulfat, magnesium klorida, kalisum klorida dan natrium hidrokarbonat. Bahan-bahan tersebut secara keseluruhan berbentuk padat dan bersifat higroskopis. Khusus untuk magnesium klorida sebelum dicampur dengan bahan lain terlebih dahulu dilarutkan dalam air panas untuk mempermudah proses pelarutannya, sedangkan untuk natrium hidrokarbonat terlebih dahulu dilarutkan dengan air bebas karbondioksida untuk mempertahankan kebasaan atau agar pH ALB stabil (antara 8-9). Pemecahan cangkang siste dibantu oleh kegiatan enzim penetasan yang membutuhkan pH lebih dari 8, sehingga pH berpengaruh terhadap penetasan siste. Apabila pH kurang dari 8 maka efisiensi penetasannya akan menurun, siste yang tidak menetas banyak atau waktu penetasannya menjadi lebih lama.
dalam penelitian ini berkadar garam 5 permil supaya telur artemia menetas secara optimal (Mudjiman, 1989). Dalam penelitian ini, selama penetasan siste maupun pelaksanaan uji BST selalu digunakan ALB dengan kadar garam yang sama yaitu 5 permil supaya artemia hidup dalam kondisi yang sama. Dalam kondisi lingkungan hidup yang sama diharapkan siste dapat menetas dengan sempurna dan pada waktu digunakan dalam uji BST dapat memberikan hasil yang optimal, yiatu berupa kematian artemia yang harus terjadi akibat zat aktif yang terkandung dalam ekstrak dietil eter dan ekstrak metanol-air. .
F. Penetasan Siste
Siste yang digunakan dalam penelitian ini dalam bentuk kering. Siste
kering memiliki kadar air kurang dari 10% yang berisi embrio dalam keadaan
diapauze (metabolisme terhenti sementara). Untuk menetaskan siste kering, terlebih dahulu diperlukan perendaman dalam aquadest selama 1 jam yang bertujuan agar siste menyerap sejumlah air dan diperkirakan dalam waktu 1 jam kadar air di dalam siste sudah mencapai lebih dari 65%, sehingga embrio yang semula berada dalam keadaan diapauze metabolismenya dapat aktif kembali. Proses penyerapan air ke dalam telur berlangsung secara hiperosmotik (tekanan osmose di dalam telur yang lebih tinggi daripada di luarnya).
ALB yang akan digunakan untuk menetaskan siste diaerasi selama 2 jam. Aerasi ini bertujuan untuk memberikan oksigen yang cukup bagi kelangsungan hidup artemia. Kekuatan aerasi sedang, tidak terlalu kuat dan tidak terlalu lemah.
dua bagian yaitu bagian gelap dan bagian terang yang dipisahkan oleh sebuah sekat yang bercelah. ALB yang telah diaerasi dituangkan ke dalam bak penetasan pada bagian gelap dengan ketinggian melebihi bagian terbawah dari sekat. Hal ini dimaksudkan agar ketika siste ditebarkan tidak mengalir ke bagian terang. Siste
ditebarkan ke bagian yang gelap. Suhu ALB selama penetasan perlu dipertahankan antara 25-30° C untuk mempercepat pemisahan cangkang siste
dengan nauplius. Hal ini dapat dicapai dengan bantuan lampu 5 watt yang digantungkan di atas bak penetasan pada bagian yang terang. Penetasan siste
menjadi nauplius berlangsung selama 24-36 jam. Nauplius akan menuju ke bagian terang karena artemia memiliki sifat fototropik positif (tertarik pada cahaya).
Nauplius yang berada pada bagian terang inilah yang akan digunakan untuk BST, karena nauplius yang mampu bergerak menuju bagian yang terang menandakan bahwa nauplius tersebut sehat.
Nauplius dapat bertahan selama ± 2 hari setelah menetas tanpa diberi makanan. Nauplius yang baru menetas berwarna kemerah-merahan karena masih mengandung makanan cadangan, namun setelah 24 jam cadangan makanan larva habis bersamaan dengan terbentuknya mulut, saluran pencernaan dan dubur. Dengan demikian maka nauplius mulai membutuhkan lebih banyak makanan demi kelangsungan hidupnya.
penelitian. Hal ini perlu diperhatikan supaya kematian artemia benar- benar disebabkan karena bahan uji, yaitu ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun, bukan karena jamur atau bakteri.
G. Toksisitas Akut dengan Metode BST
Selain itu, penggunaan larva artemia dalam mendeteksi senyawa yang memiliki aktivitas sitotoksik berdasarkan pada adanya kesamaan sistem enzim antara artemia dengan mamalia. Sistem enzim tersebut adalah tipe DNA-dependent RNA polymerase dan oubaine sensitive Na+ and K+ dependent ATPase
(Solis et all., 1993), sehingga jika suatu senyawa antikanker berefek toksik terhadap larva artemia maka senyawa tersebut dapat digunakan pada mamalia. Tetapi perkembangan larva artemia tidak dapat dikaitkan dengan perkembangan sel kanker karena memang tidak ada penelitian yang menegaskan hal tersebut.
Senyawa yang diduga mempunyai aktivitas sitotoksik dalam herba pegagan embun adalah senyawa monoterpenoid/esquiterpenoid dan flavonoid. Namun mekanisme kedua senyawa tersebut dalam membunuh sel kanker belum diketahui secara terperinci.
Gambar 6. Bagan mekanisme terjadinya apoptosis (Rajesh et al., 2003)
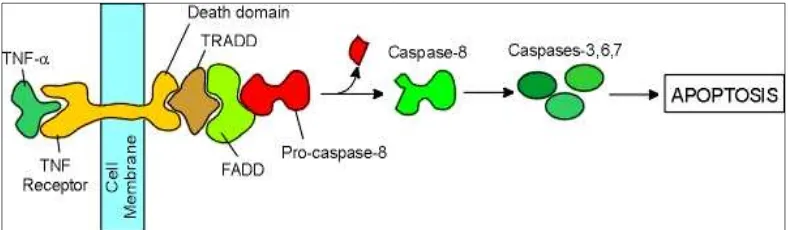
Monoterpenoid/sesquiterpenoid menginduksi apoptosis melalui jalur ekstrinsik dengan jalur Fas/Fas ligand. Dalam menjalankan tugasnya suatu Fas reseptor harus berinteraksi dengan Fas ligand. Interaksi antara Fas reseptor dan Fas ligand membentuk death-induced signaling complex (DISC). DISC terdiri dari berbagai protein di antaranya FADD, caspase 8 dan caspase 10. DISC merupakan kompleks protein yang akan memberikan sinyal untuk melakukan apoptosis.
Gambar 7. Mekanisme monoterpenoid menginduksi apoptosis (Rajesh, et al., 2003)
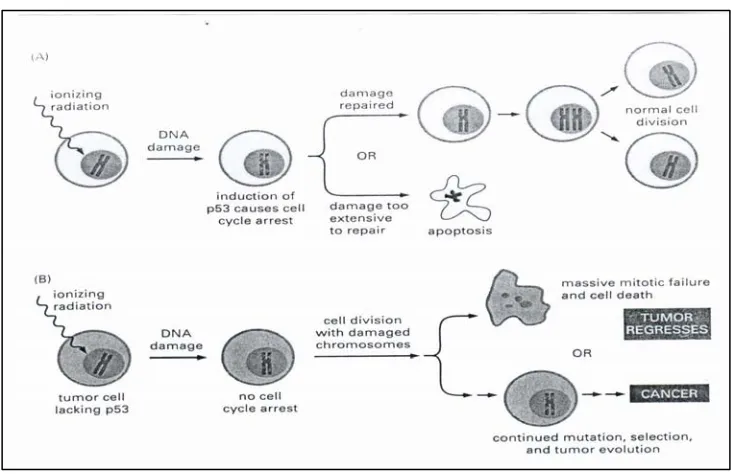
Senyawa flavonoid banyak disebut-sebut berpotensi sebagai antitumor atau antikanker. Flavonoid dapat menginduksi terjadinya apoptosis (mekanisme kematian sel yang terprogram) pada sel kanker dengan mencegah terjadinya mutasi protein 53 (p53). Pada sel normal, jika suatu sel terpapar radiasi ionisasi atau promoter-promoter lain yang dapat menyebabkan kerusakan DNA maka protein 53 bekerja dengan memutus siklus sel tersebut. Langkah selanjutnya ada dua kemungkinan yaitu sel ini akan memperbaiki kerusakan DNA sehingga menjadi sel normal kembali yang kemudian dapat membelah menghasilkan sel-sel normal atau kemungkinan kedua yaitu jika kerusakan DNA sangat parah dan tidak dapat diperbaiki lagi, maka akan terjadi kematian sel yang terprogram atau yang lebih dikenal dengan apoptosis (Albert, Johnson, Lewis, Raff, Roberts and Walter, 2002).
kemungkinan kedua yaitu sel tumor mengalami mutasi, seleksi dan evolusi yang berkepanjangan yang menyebabkan terjadinya kanker.
Gambar 8. Mekanisme flavonoid menginduksi apoptosis (Albert, et al., 2002)
merusak sistem enzim yang ada (DNA-dependent RNA polymerase atau Na+-K+ ATPase) sehingga dapat mengakibatkan kematian sel.
Sampel yang digunakan adalah ekstrak ekstrak dietil eter dengan konsentrasi 10, 32, 102, 328 dan 1049 µg/ml dan metanol dengan konsentrasi 250, 500, 1000, 2000 dan 4000 µg/ml. Konsentrasi tersebut didapatkan setelah melakukan uji BST awal dengan konsentrasi 10, 100, dan 1000 µg/ml. Setelah dilakukan pengujian dengan masing-masing ekstrak pada konsentrasi 10, 100, dan 1000 µg/ml, diperoleh jumlah larva yang mati dan kemudian digunakan untuk menghitung persentase kematian larva tersebut. Dari data persentase kematian ini diambil konsentrasi yang memberikan harga persentase kematian larva antara 20%-80% sebagai konsentrasi terendah dan konsentrasi tertinggi. Digunakan persentase kematian larva antara 20%-80% karena dengan persentase kematian tersebut sudah dapat memberikan kurva yang lebih linier, sehingga LC50 yang didapatkan pada uji BST ini lebih dapat menggambarkan hasil yang sebenarnya.
Flakon-flakon yang telah berisi larutan uji dikeringuapkan diatas
pegagan embun. Pembuatan kontrol sama dengan pembuatan sampel uji, hanya saja pada kontrol tidak berisi sampel (ekstrak dietil eter dan ekstrak metanol-air).
Suspensi ragi diberikan sebagai sumber makanan bagi larva artemia. Suspensi ragi ini dibuat dengan melarutkan 3 mg ragi dalam 5 ml ALB. Pemberian makanan pada larva artemia ini tidak boleh berlebihan cukup setetes saja pada tiap flakonnya. Hal ini dikarenakan artemia merupakan filter feeder, yaitu makan dengan cara menyaring makanannya. Sebagai filter feeder, artemia menelan apa saja yang ukurannya kecil (kurang dari 50 µm). Artemia tidak bisa membedakan mana makanan dan mana yang bukan makanan. Apabila makanan baru masuk ke dalam tubuh artemia secara terus-menerus dalam jumlah yang berlebihan, maka akan mendesak makanan yang sudah ada sebelumnya yang belum sempat dicerna dengan sempurna. Bila terjadi demikian, maka makanan yang belum sempat dicerna dengan sempurna tersebut akan keluar lagi dari usus. Keadaan seperti ini akan membuat artemia menjadi kelaparan dalam timbunan makanan dan dapat menyebabkan kematian. Hal tersebut dapat mengacaukan pengambilan data karena larva mati bukan karena pemberian perlakuan melainkan karena pemberian makanan yang berlebihan. Flakon-flakon tersebut diletakkan dalam suatu kotak yang ditutupi dengan kain supaya terhindar dari serangga dan diberi penerangan dengan lampu 5 watt supaya suhu pada waktu penelitian sama dengan suhu pada waktu penetasan siste.
terus-menerus bergerak selama larva masih hidup karena selain berfungsi sebagai alat gerak, sungut tersebut berfungsi juga sebagai alat pernafasan. Dengan menghitung larva artemia yang hidup, maka besarnya kematian larva bisa ditentukan. Hasil perhitungan dengan menggunakan rumus Abbot data yang diperoleh berupa besarnya persen kematian dikarenakan ada kontrol yang mati. Kontrol digunakan untuk mengoreksi kematian larva yang bukan disebabkan oleh pengaruh ekstrak dietil eter dan ekstrak metanol-air herba pegagan embun.
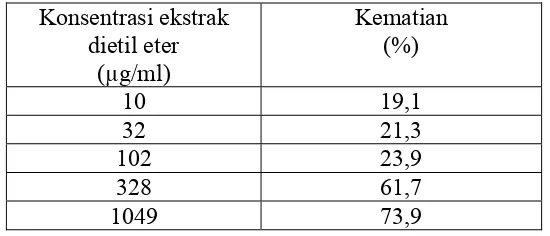
Tabel II. Persentase kematian larva artemiaakibat pemberian ekstrak dietil eter herba pegagan embun
Konsentrasi ekstrak dietil eter
(µg/ml)
Kematian (%)
10 19,1 32 21,3 102 23,9 328 61,7 1049 73,9
(nilai x), sedangkan nilai probit dari prosentase kematian ditetapkan menjadi variabel tergantung (nilai y).
Persamaan garis linear untuk ekstrak dietil eter yang diperoleh dari hasil analisis probit yaitu y = 0,83893x – 1,98107 (lampiran 4). Nilai LC50 yang diperoleh sebesar 229 µg/ml. Kurva hubungan antara nilai probit dengan log konsentrasi ekstrak dietil eter dapat dilihat pada gambar 3.
Probit Transformed Responses
Log of KONS
3,5 3,0 2,5 2,0 1,5 1,0 ,5 P robi t ,8 ,6 ,4 ,2 ,0 -,2 -,4 -,6 -,8
-1,0 Rsq = 0,8566
Gambar 4. Kurva hubungan nilai probit versus log konsentrasi ekstrak dietil eter herba pegagan embun
Konsentrasi ekstrak dietil eter herba pegagan embun dimana dapat membunuh 50% hewan uji (LC50) juga dapat diketahui dengan menggunakan kurva di atas, yaitu dengan menarik garis lurus pada probit 0,0 ke arah kanan sampai pada garis, lalu ditarik garis ke arah bawah, didapatkan log konsentrasi sebesar 2,36 sehingga konsentrasinya sebesar 229 μg/ml.
regresi linier sederhana, yaitu merupakan proporsi/presentase sumbangan x terhadap variasi (naik dan turunnya) y. Nilai Rsq yang diperoleh sebesar 0,8566, berarti bahwa presentase sumbangan x yaitu konsentrasi ekstrak dietil eter herba pegagan embun terhadap variasi yaitu respon (jumlah kematian artemia) sebesar 85,66%.
Berdasarkan kurva hubungan antara nilai probit dengan log konsentrasi ekstrak dietil eter yang dihasilkan, terdapat korelasi yang diharapkan antara konsentrasi dengan respon (nilai probit). Korelasi yang positif ditunjukkan dengan meningkatnya nilai probit seiring dengan meningkatnya log konsentrasi serta nilai koefisien korelasi yang mendekati 1 (r = 0,9255). Nilai r menggambarkan hubungan yang kuat antara variabel x dan y, yang diperoleh dengan mengambil akar dari Rsq. Pada tabel nilai r dengan taraf kepercayaan 95% didapatkan nilai r sebesar 0,88 sehingga nilai r hitung lebih besar daripada nilai r tabel. Hal ini menunjukkan adanya korelasi yang linier antara konsentrasi dengan nilai probit.
Tabel III. Persentase kematian larva artemiaakibat pemberian ekstrak metanol-air herba pegagan embun
Konsentrasi ekstrak metanol-air
(µg/ml)
Kematian (%)
sebesar 769 µg/ml. Kurva hubungan antara nilai probit dengan log konsentrasi ekstrak dietil eter dapat dilihat pada gambar 4.
Probit Transformed Responses
Log of KONS
3,8 3,6 3,4 3,2 3,0 2,8 2,6 2,4 2,2 P robi t 1,5 1,0 ,5 0,0 -,5
-1,0 Rsq = 0,9975
Gambar 5. Kurva hubungan nilai probit versus log konsentrasi ekstrak metanol-air herba pegagan embun
H. Uji Kualitatif Ekstrak Aktif dengan KLT
Uji kromatografi lapis tipis dilakukan terhadap ekstrak toksik herba pegagan embun yaitu ekstrak dietil eter dan ekstrak metanol-air. Metode KLT dipilih karena memiliki banyak kelebihan dibandingkan kromatografi lain, diantaranya yaitu membutuhkan waktu yang singkat, memerlukan jumlah cuplikan yang sedikit serta pengerjaan yang sederhana. Pemeriksaan kandungan kimia secara KLT ini bertujuan untuk mendapatkan gambaran mengenai kandungan senyawa terpenoid dan flavonoid dalam ekstrak aktif herba pegagan embun.
Pereaksi-pereaksi yang digunakan dalam KLT mampu memberikan hasil berupa informasi umum mengenai golongan senyawa terpenoid dan flavonoid yang terkandung dalam ekstrak dietil eter herba pegagan embun namun belum dapat memberikan informasi mengenai senyawa yang lebih terperinci.
1. Identifikasi terpenoid
Fase diam yang digunakan untuk mendeteksi adanya senyawa terpenoid adalah silika gel GF254. Silika gel GF254 merupakan silika gel yang mengandung
terpenoid yaitu pereaksi vanilin asam sulfat. Pada pemeriksaan senyawa terpenoid pada ekstrak dietil eter tidak digunakan pembanding karena pemeriksaan ini ditujukan untuk mengetahui keberadaan senyawa terpenoid, khususnya monoterpenoid dan sesquiterpenoid.
Tabel IV. Hasil KLT pemeriksaan terpenoid dalam ekstrak dietil eter herba pegagan embun
Vanillin asam sulfat Bercak
Rf Warna 1. Sampel 1. 0,17 Ungu
2. 0,41 Ungu keabu-abuan 3. 0,87 Ungu
Gambar 10. Kromatogram ekstrak dietil eter herba pegagan embun untuk pemeriksaan senyawa terpenoid
Keterangan :
Fase diam : Silika gel GF254
Fase gerak : Toluene-etil asetat (97:3 v/v)
Sampel : ekstrak dietil eter herba pegagan embun Deteksi : vanillin asam sulfat (110°C, 10 menit)
pemeriksaan senyawa terpenoid menggunakan peraksi vanilin asam sulfat menghasilkan bercak berwarna biru keabu-abuan, sehingga dapat disimpulkan bahwa dalam ekstrak dietil eter herba pegagan embun terdapat senyawa terpenoid, khususnya monoterpenoid atau sesquiterpenoid. Keberadaan monoterpenoid/sesquiterpenoid ini dalam ekstrak dietil eter yang memungkinkan adanya khasiat antitumor pada herba pegagan embun, karena monoterpenoid/sesquiterpenoid telah diketahui dapat mematikan sel.
CH2OH
+
O C
HO CH3
O
H
Terpenoid Vanilin
H2SO4
+
O
O
OH CH3
kompleks ungu keabu-abuan
2. Identifikasi flavonoid
Pemeriksaan senyawa flavonoid terhadap ekstrak metanol-air menggunakan fase diam selulosa. Selulosa digunakan dalam identifikasi flavonoid karena tidak mengandung logam pengotor bila dibandingkan dengan fase diam silika gel yang mengandung logam Si dan gugus hidroksil. Semakin besar jumlah gugus hidroksil pada senyawa maka akan semakin kuat senyawa itu ditahan oleh fase diam (Johnson, 1991) sehingga menyebabkan flavonoid tidak dapat ikut terelusi bersama fase gerak. Fase gerak yang digunakan yaitu n-butanol : asam asetat : air (4:1:5 v/v) diambil fase atasnya, sedangkan pembanding yang digunakan adalah rutin. Rutin merupakan suatu glikosida flavonol. Menurut Harborne (1987), kebanyakan senyawa fenol terutama flavonoid dapat dideteksi pada kromatogram berdasarkan warna atau fluoresensi di bawah sinar UV. Deteksi bercak dengan pereaksi uap ammonia menghasilkan bercak berwarna kuning (Wagner et al.,1984).
Tabel V. Hasil KLT pemeriksaan flavonoid dalam ekstrak metanol air herba pegagan embun
UV 365 nm Uap ammonia Bercak
Rf Warna Rf Warna 1. Sampel 1. 0,86 Ungu 1. 0,86 Kuning
2. Rutin 1. 0,68 Ungu 1. 0,68 Kuning
setelah diuapi dengan ammonia berubah menjadi warna kuning dengan nilai Rf 0,68. Menurut Mursyidi (1990), glikosida flavonoid biasanya memberikan warna khas ungu tua yang kemudian berubah menjadi hijau kekuningan bila diuapi ammonia dengan nilai Rf 0,6-0,8.
O
O
OH
+ NH3
-NH4+
O
O
-O
O
O
-O
komp leks warna kun ing
Gambar 9. Reaksi dengan uap amonia untukpemeriksaan senyawa flavonoid
A B
Gambar 11. Kromatogram ekstrak metanol-air herba pegagan embun untuk pemeriksaan senyawa flavonoid
Keterangan :
Fase diam : Selulosa
Fase gerak : n-butanol : asam asetat : air (4 : 1 : 5) a. Pembanding : rutin
b. Sampel : ekstrak metanol-air herba pegagan embun A. Deteksi sinar UV 365 nm.
BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Potensi toksik ekstrak dietil eter yang dinyatakan dengan nilai LC50 sebesar 229 μg/ml dan ekstrak metanol-air sebesar 769 μg/ml.
2. Ekstrak dietil eter mempunyai potensi toksik lebih tinggi daripada ekstrak metanol-air (Meyer et al, 1982). Menurut Loomis (1978), ekstrak dietil eter bersifat cukup toksik & ekstrak metanol-air bersifat sedikit toksik. 3. Ekstrak dietil eter mengandung senyawa terpenoid (khususnya mono- &
sesquiterpenoid) dan ekstrak metanol-air mengandung senyawa flavonoid
B. Saran
DAFTAR PUSTAKA
Albert, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walter. P., 2002,
Molecular Biology of The Cell, Fourth Edition, Garland Science, Taylor and Francis Group, New York.
Anonim, 1986, Sediaan Galenik, 1-17, Departemen Kesehatan Replubik Indonesia, Jakarta.
Anonim, 2002, Chemical compotition of two species of Hydrocotyle (Apiaceae), File : minijaj@usa.net. Diakses pada tanggal 22 Maret 2002.
Anonim, 2006, Flavonoid, File : http://www.en.wikipedia.org/wiki/flavonoid. diakses pada tanggal 4 Mei 2006.
Anonim, 2007, Kapsul Sarang Semut, File :
http://www.pikiranrakyat.cakrawala/index.htm. diakses pada tanggal 14 April 2007
Backer, C.A., and Bakhuizen van den Brink, R.C., 1963, Flora of Java, Vol. II, 172, Noodoff, GGroningen, The Netherlands.
Campbell, N.A., Recee, J.B., and Mitchell, L.G., 2002, BIOLOGY, diterjemahkan oleh Rahayu Lestari, Edisi 5, 322-328, Penerbit Erlangga, Jakarta.
Carballo, J. Luis, Zaira, L.H., Perez, P., Garcia Gravalos, M.D., 2002, A comparison between two brine shrimp assay to detect in vitro cytoxicity in marine natural product, http://www.biomedcentral.com/1472-6750/2/17. Diakses pada tanggal 10 Agustus 2005.
Colis, B.M., Chemotheraphy of Cancer, Asian J Mod Med., 1874, 10;52-450. Dwiatmaka, Y., 2000, Skrining Tanaman Berkhasiat Antikanker dengan Metode
BST dalam Yuswanto, (Eds), kanker, 101-115, Penerbit Sanata Dharma, Yogyakarta.
Harborne, J.B., 1987, Phytochemical Methods, Alih bahasa Padmawinata, K., Soediro, I., 13, 126-137, Institut Tehnologi Bandung, Bandung.
Ganong, W.F., 1995, Buku Ajar Fisiologi Kedokteran, diterjemahkan oleh dr. Petrus Andrianto, Edisi 14, 22-29, Penerbit Buku Kedokteran EGC, Jakarta.
Katzung, B. E., Trevor, A. J., 1993, Pharmacology, Examination and Board Review, 4th ed, 371, Prentice-Hall International Inc, USA.
Loomis, T.A., 1978, Essential of Toxicology, Edisi III, diterjemahkan oleh Imono Argo Donatus, 28-233, IKIP Semarang, Semarang.
Marby, T.J., Markham, K.R., and Thomas, M.B., 1970, The Systematic Identification of Flavonoid, 13, Springer Verlag, Berlin.
Markham, K.R., 1988, Techniques of Flavonoid Identification, diterjemahkan oleh Kosasih Padmawinata, 15-17, Penerbit ITB, Bandung.
Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nichols, D.E., and McLaughlin, J.L., 1982, Brine Shrimp : A Convinient General Bioassay Active Constituent, Planta Medica Volume 45, 31-34.
Mudjiman, A., 1989, Udang Renik Air Asin, 15-18, Bathara, Jakarta. Mudjiman, A., 1991, Makanan Ikan, 72-88, Penebar Swadaya, Jakarta.
Mursyidi, A., 1990, Analisis Metabolit Sekunder, 171-175, Penerbit UGM, Yogyakarta.
Negara, A., 2003, Penggunaan Analisis Probit Untuk Pendugaan Tingkat Kepekaan Populasi Spodoptera Exigua Terhadap Deltametrin Di Daerah Istimewa Yogyakarta
http://www.penelitian.com//pdf+abbot+rumus.html. Diakses pada tanggal 12 Januari 2007
Oemarjati, B.S., dan Wardhana, W., 1990, Taksonomi Avertebrata, 123-124, Universitas Indonesia Press, Jakarta.
Rajesh, D., Rachelle, A., Stenzel, and Howard, S.P., 2003, Perillyl Alcohol as a Radio/Chemosensitizer in Malignant Glioma
http://www.jbc.org/cgi/content/full/278/38/35968 Diakses pada tanggal 28 Juli 2007
Robinson, T., 1995, The Organic Constituent of Higher Plants, diterjemahkan oleh Kosasih Padmawinata, 71-71, 191-193, edisi VII, Penerbit ITB, Bandung.
Sirait, A.M., Soetiarto, F., Oemiati, R., 2003, Ketahanan Hidup Penderita Kanker Serviks di Rumah Sakit Dharmais Jakarta, Buletin Penelitian Kesehatan, Badan Penelitian dan Pengembangan Kesehatan, DepKes RI, Jakarta, 13-24.
Siswandono dan Soekardjo, B., 2000, Kimia Medisinal, Edisi kedua, Airlangga Univercity Press, Surabaya.
Solis, P.N., Wright, C.Q., Anderson, M.M., Gupta, M.P., and Phillipson, J.D., 1993, A Microwell Cytotoxicity Assay using Artemia salina (Brine Shrimp), Planta MedicaVolume 59, 250-252.
Stahl, E., 1985, Drug Analysis by Chromatography and Microscopy, diterjemahkan oleh Kosasih Padmawinata, 3-6, edisi VII, Penerbit ITB, Bandung.
Tanu, I., 1998, Farmakologi dan Terapi, Bagian Farmakologi Fakultas Kedokteran, Universitas Indonesia, Jakarta, 686-687.
SURAT PENGESAHAN
DETERMINASI
No: !r /LKTO/Iai-USD/ d / 07
Laboralor ium Kc bun Tananra tr O bot Fak u lbs Famlsi Un ive6 ilrs S.nara Dhalma, ncntrhkd batrsa telah melakukan dcrcminasile adrp saru contoh ranaman. denge uma:
!.lruc a 1t I e t i b t ha rp i o i.te s Lft k. (Pcsae.n Embun)
aacko.C.A,,md Backhuizen Vm dc Brirk lr., R.C.,t965, ,rlrfa o/Jo.4 Vot. , l7t-t22, N.V.p. NNrdholi 6 ron insen, 'thc Ncdftands.
Detcminasi lelah dilakukanecda benasesuai
Backer,C.A..dd Backiruizen Vdn de Brink Jr., Nod.dho crcn ingen, Thc Nedolands.
Hins$ lclaeorir jenis Gpesies)
Tar:man te^cbut dipak i drlam peneliri.n:
ToksGibs Akut Ek$ok Mchnot Air dln Eksrak Diclil sibltorpkides Lnk.) tcthtdtp /14euia satina Leaoi.
R.c't96J, ;lotu of Joa, vol. r,3-9, 25-26, N v.p.
Ercr Heda P.gdur [mbun (/trro.,,]/g
Meia l{osa ImaBudi Cahyani
Fakulbs Famasi UniveNiras Sanab Dhdma
Hdbariur disimDon Laboanoium Biologi umun, F.&uliis F.m6i UnivcNilas
Demikian su?t penBeentu deteminasi inidibu unruk dapat dipequnakm seblgoi
Lampiran 4. Foto KLT untuk pemeriksaan terpenoid ekstrak dietil eter herba pegagan embun
Keterangan :
Fas