(Dendrophthoe pentandra (L.)oMiq.)
SKRIPSI
PUTRA ANGGA WINARTA GINTING 150822042
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
(Dendrophthoe pentandra (L.)oMiq.)
SKRIPSI
Diajukan Untuk Melengkapi Tugas Dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
PUTRA ANGGA WINARTA GINTING 150822042
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
PERSETUJUAN
Judul : Uji Aktivitas Antibakteri Ekstrak Metanol, Etil Asetat, n-Heksana Dari Daun Benalu Alpukat
(Dendrophthoe pentandra (L.)oMiq.)
Kategori : Skripsi
Nama : Putra Angga Winarta Ginting
Nomor Induk Mahasiswa : 150822042
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui
Medan, September 2018
Komisi Pembimbing Pembimbing 2
Lamek Marpaung, M.Phil.PhD NIP : 195208281982031001
Pembimbing 1
Dr. Helmina br Sembiring,M.Si NIP : 197602022000122002
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
Dr. Cut Fatimah Zuhra, M.Si NIP : 197404051999032001
PERNYATAAN
UJI AKTIVITAS ANTIBAKTERI EKSTRAK METANOL, ETIL ASETAT, DAN n-HEKSANA DARI DAUN BENALU ALPUKAT
(Dendrophthoe pentandra (L.)oMiq.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2018
Putra Angga Winarta Ginting 150822042
PENGHARGAAN
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas rahmat dan karunia-Nya yang telah diberikan kepada penulis, sehingga penulis dapat menyelesaikan Skripsi ini dengan baik.
Skripsi ini disusun sebagai salah satu syarat dalam rangka menyelesaikan program Sarjana Sains di Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, yang ditulis berdasarkan penelitian dan analisa penulis dengan judul ’’UJI AKTIVITAS ANTIBAKTERI EKSTRAK METANOL,ETIL ASETAT, DAN n-HEKSAN DARI DAUN BENALU ALPUKAT (Dendrophthoe Pentandra (L.)Miq.)’’.
Skripsi ini dapat ditulis dan terwujud atas bantuan dan bimbingan dari berbagai pihak secara langsung maupun secara tidak langsung. Oleh karena itu, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Kerista Sembayang, MS selaku Dekan FMIPA USU.
2. Ibu Dr. Cut Fatimah Zuhra, M.Si dan Ibu Dr. Sovia Lenny, M.Si selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU.
3. Bapak Firman Sebayang, M.S selaku Koordinator Program S1 Kimia Ekstensi.
4. Ibu Dr. Helmina Br Sembiring, M.Si dan Bapak Lamek Marpaung, M.Phil.PhD selaku Dosen pembimbing penulis yang telah banyak memberikan panduan serta pemikiran dan saran selama penulis melakukan penelitian dan penyusunan sehingga penulis dapat menyelesaikan skripsi ini.
5. Bapak dan Ibu staf pengajar FMIPA USU serta pegawai Departemen Kimia FMIPA USU
6. Ibu Dra. Nunuk, M.Si selaku Kepala Laboratorium Mikrobiologi Departemen Biologi yang telah banyak membantu penulis dalam menyelesaikan skripsi ini.
7. Kedua orang tua saya yang sangat saya sayangi, ayah saya dr. Luther Johannes Ginting dan ibu saya Bantalit br Purba, kakak dan adik saya dan seluruh keluarga yang telah memberikan semangat serta perhatian yang cukup besar selama masa perkuliahan saya, yang telah banyak memberikan bantuan berupa doa dan dukungan moril maupun materil selama penulisan skripsi ini.
8. Sahabat penulis dan rekan-rekan mahasiswi khususnya Kimia S1 2015 yang tak tersebut namanya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, untuk itu segala saran dan kritik yang bersifat membangun demi perbaikan skripsi ini sangat penulis harapkan. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi pembaca sekalian.
Penulis
UJI AKTIVITAS ANTIBAKTERI EKSTRAK METANOL, ETIL ASETAT, DAN n-HEKSANA DARI DAUN BENALU ALPUKAT
(Dendrophthoe pentandra (L.)oMiq.)
ABSTRAK
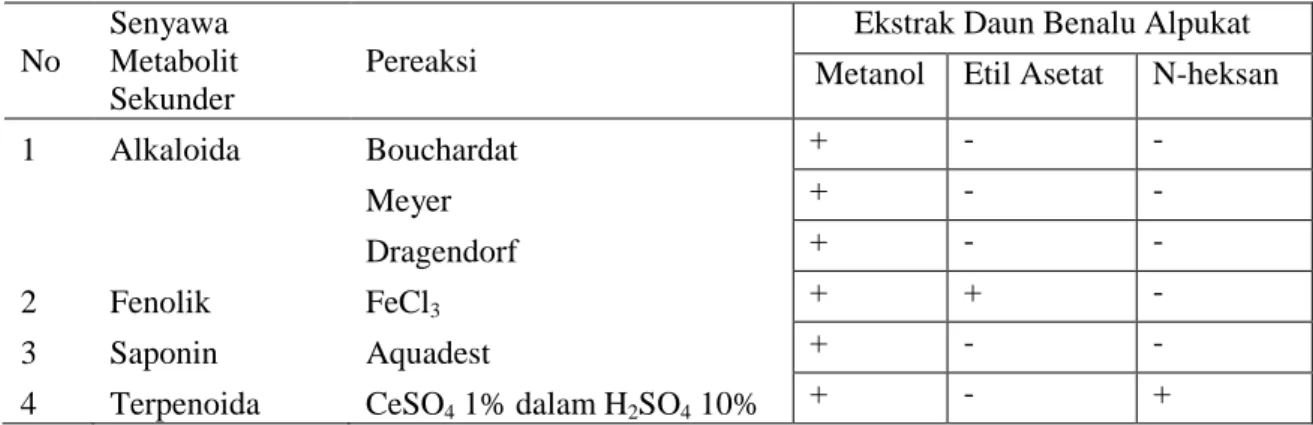
Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak metanol, etil asetat, dan n-heksana daun benalu alpukat (Dendrophthoe Pentandra (L.)Miq.) yang diperoleh dengan metode maserasi. Berdasarkan skrining fitokimia ekstrak metanol daun benalu alpukat (Dendrophthoe Pentandra (L.)Miq.) mengandung senyawa golongan alkaloid, flavonoida, saponin, tanin, dan terpenoida.
Pengujian aktivitas antibakteri dilakukan dengan melakukan metode difusi agar terhadap bakteri Escherichia coli, Streptococcus mutans, Staphylococcus aereus.
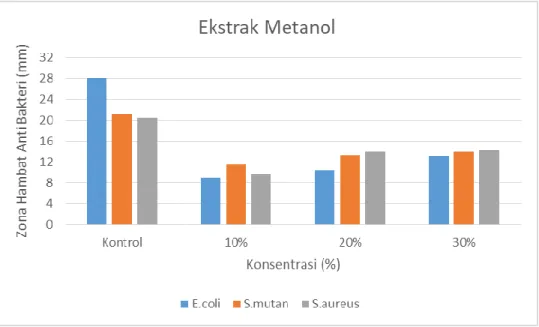
Konsentrasi ekstrak metanol, etil asetat, dan n-heksana yang digunakan terdiri dari 10%, 20%,30% . Aktivitas antibakteri menunjukkan bahwa pada ekstrak metanol,ekstrak Etil Asetat, ekstrak n-Heksan daun benalu alpukat memberikan diameter zona hambat terbesar pada konsentrasi 30%.dan yang memiliki aktivitas antibakteri yang paling besar adalah ekstrak n-heksan dari daun benalu alpukat yang memberikan diameter zona hambat terhadap bakteri Gram positif yaitu bakteri Streptococcus mutans dengan diameter zona hambat 19,5 mm. Berdasarkan Clinical and Laboratory Standart institute (2012) bahwa suatu senyawa yang memiliki aktivitas antibakteri dengan zona hambat 19,5 mm tergolong sedang (intermediate)
.
Kata kunci: Antibakteri, Maserasi, Metanol, Etil Asetat, n-Heksana, (Dendrophthoe Pentandra (L.)Miq.)
THE TESTED ANTIBACTERIAL ACTIVITY OF METHANOL, ETHYL ACETATE, AND n-HEXANE EXTRACT FROM AVOCADO PARASITES
(DENDROPTHOE PENTANDRA (L.)Miq)
ABSTRACT
This study aimed to determine the antibacterial activity of methanol, ethyl acetate, and n-hexane extract of avocado parasite (Dendrophthoe Pentandra (L.) Miq.) Obtained by maceration method. Based on phytochemical screening, methanol extract of avocado parasite leaves (Dendrophthoe Pentandra (L.) Miq.) Contains alkaloid compounds, flavonoids, saponins, tannins, and terpenoids. Antibacterial activity testing was carried out by conducting agar diffusion method against Escherichia coli, Streptococcus mutans, Staphylococcus aereus. The concentrations of methanol, ethyl acetate and n-hexane extracts used consisted of 10%, 20%, 30%.
Antibacterial activity showed that in methanol extract, ethyl acetate extract, n-hexane extract avocado parasite leaves gave the largest inhibition zone diameter at a concentration of 30%. the inhibition of Gram positive bacteria is Streptococcus mutans bacteria with a diameter of 19.5 mm inhibition zone. According to the Clinical and Laboratory Standards Institute (2012) that a compound that has antibacterial activity with a inhibitory zone of 19.5 mm is classified as intermediate.
Keywords: Antibacterials, Maceration, Methanol, Ethyl Acetate, n-Hexane, (Dendrophthoe Pentandra (L.)Miq.)
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel x
Daftar Gambar xi
Daftar Lampiran xii
BAB 1. PENDAHULUAN
1.1. Latar Belakang 1
1.2. Perumusan Masalah 2
1.3. Pembatasan Masalah 2
1.4. Tujuan Penelitian 2
1.5. Manfaat Penelitian 3
1.6. Lokasi Penelitian 3
1.7. Metode Penelitian 3
BAB 2. TINJAUAN PUSTAKA
2.1. Tumbuhan Benalu Alpukat (Dendrophthoe pentandra (L.) Miq.) 4
2.2. Kandungan Kimia Daun Benalu Alpukat 5
2.2.1. Tanin 5
2.2.2. Flavonoid 7
2.2.3. Terpenoid 8
2.2.4. Saponin 9
2.2.5 Alkaloid 10
2.3. Bakteri 11
2.3.1. PenggolonganBakteri 11
2.3.1.1 Bakteri Gram Positif 11 2.3.1.2 Staphylococcus Aereus 12
2.3.1.3 Streptococcus Mutans 13 2.3.1.4 Bakteri Gram Negatif 13 2.3.1.5 Escherichia coli 14 2.3.2 Faktor Yang Mempengaruhi Pertumbuhan Bakteri 14
2.4. Antibakteri 15
2.5. Uji Aktivitas Antibakteri 15
2.6. Ekstraksi 18
BAB 3. METODE PENELITIAN
3.1. Waktu dan Tempat 23 3.2. Metode Penelitian 23
3.2.1. Alat 23
3.2.2 Bahan 24
3.3. Prosedur Penelitian 24
3.3.1. Penyediaan Sampel 24
3.3.2..Pembuatan Ekstrak Metanol, Etil Asetat,
dan n-Heksana dari Daun Benalu Alpukat 25 3.3.3. Skrining Fitokimia Dari Daun Benalu Alpukat 25
3.3.4. Uji Tanin 25
3.3.5. Uji Terpenoida 26
3.3.6. Uji Alkaloida 26
3.3.7. Uji Saponin 26
3.3.8. Pengujian Sifat Antibakteri Ekstrak Metanol, Etil Asetat,
Dan n-heksan dari Daun Benalu Alpukat 26
3.3.8.1. SterilisasiAlat 27
3.3.8.2. Pembuatan Media Nutrient Agar (NA) 27 3.3.8.3. Pembuatan Media Agar Miring Dan Stok Kultur
Bakteri 27
3.3.8.4. Pembuatan Media Mueller Hinton Agar (MHA) 27
3.3.8.5. Pembuatan Inokulum Bakteri 27
3.3.8.6. Pembuatan Variasi Konsentrasi Ekstrak Metanol, Etil Asetat, n-Heksana dari Daun Benalu Alpukat 28 3.3.8.7 Uji Aktivitas Antibakteri Ekstrak Metanol, Etil Asetat Dan n-Heksana dari Daun Benalu Alpukat 28
3.3.9. Bagan Penelitian 29
3.3.9.1. Pembuatan Ekstrak Metanol, Etil Asetat, dan
n-Heksana dari Daun Benalu Alpukat 29
3.3.9.2. Uji Skrining Fitokimia 30
3.3.9.3. Uji Sifat Antibakteri Eksrak Metanol, Etil Asetat, Dan n-Heksana dari daun benalu alpukat 30 3.3.9.3.1. Pembuatan Media
Mueller Hinton Agar (MHA) 30 3.3.9.3.2. Pembuatan Stok Kultur Bakteri 31 3.3.9.3.3. Pembuatan Inokulum Bakteri 32 3.3.9.3.4. Pengujian Aktivitas Antibakteri
Ekstrak Metanol, Etil Asetat, dan
n-Heksana dari Daun Benalu Alpukat 33
BAB 4. HASIL DAN PEMBAHASAN
4.1. HasilPenelitian 34
4.1.1. Hasil Uji Skrining Fitokimia Ekstrak Metanol
Etil Asetat, dan n-Heksana Dari Daun Benalu alpukat 34 4.1.2. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol
Etil Asetat, dan n-Heksana dari Daun Benalu Alpukat 34
4.2. Pembahasan 37
4.2.1. Uji Skrining Fitokimia Ekstrak Metanol
Etil Asetat, dan n-Heksana dari Daun Benalu Apukat 37 4.2.2. Uji Aktivitas Antibakteri Ekstrak Metanol
Etil Asetat, dan n-Heksana dari Daun Benalu Alpukat 38
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 43
5.2. Saran 43
DAFTAR PUSTAKA 44
LAMPIRAN 48
DAFTAR TABEL
Nomor Tabel Judul Halaman 4.1 Hasil Uji Skrining Fitokimia Ekstrak
Metanol,n-Heksan dari daun benalu alpukat 34 4.2 Indeks Zona hambat ekstrak metanol
etil asetat, dan n-Heksana dari daun benalu alpukat terhadap bakteri Escherichia coli,
Streptococcus mutans,Staphylococcus aereus 36
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
2.1 Dendrophthoe pentandra (L.)oMiq 4
2.2 Strukur Tanin 6
2.3 Senyawa Flavonoid 8
2.4 Struktur Isopren 9
2.5 Struktur Saponin 10
2.6 Struktur Alkaloid 11
2.7 Bakteri Staphylococcus aureus 12
2.8 Bakteri Streptococcus mutans 13
2.9 Bakteri Escherichia coli 14
2.10 Alat perkolasi 20
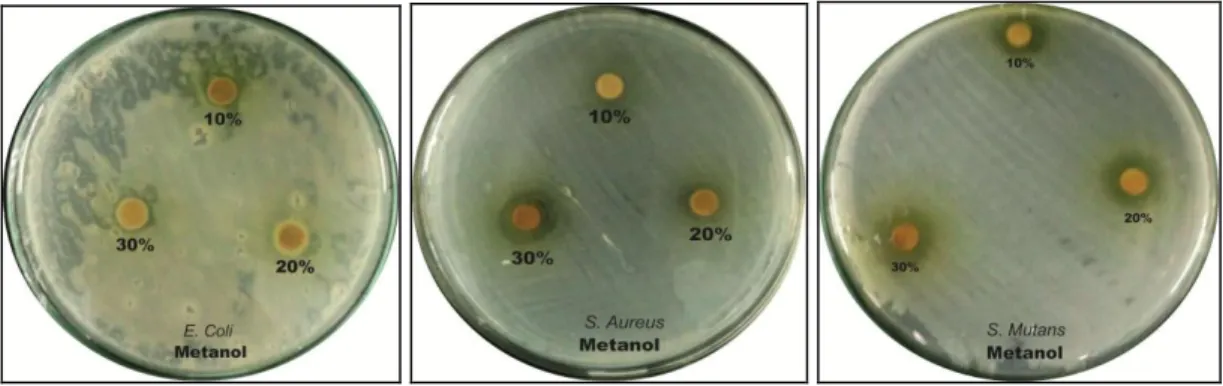
4.1 Zona Bening yang ditimbulkan oleh ekstrak metanol terhadap
bakteri (a) E.coli (b) S.aureus (c) S.Mutan 35
4.2 Zona Bening yang ditimbulkan oleh ekstrak Etil Asetat terhadap
bakteri (a) E.coli (b) S.aureus (c) S.Mutan 35
4.3 Zona Bening yang ditimbulkan oleh ekstrak n-heksan terhadap
bakteri (a) E.coli (b) S.aureus (c) S.Mutan 35
4.4 Zona hambat bakteri Kontrol negatif dan positif terhadap bakteri
(a) E.coli (b) S.aureus (c) S.Mutan 36
4.5 Grafik diameter zona hambat anti mikrobial ekstrak metanol 39 4.6 Grafik diameter zona hambat antimikrobial ekstrak etil asetat 39 4.7 Grafik diameter zona hambat antimikrobial ekstrak n-Heksana 40
DAFTAR LAMPIRAN
Nomor Lampiran Judul Halaman 1 Hasil pengukuran zona hambat uji aktivitas antibakteri
ekstrak metanol, etil asetat, dan n-Heksana daun benalu alpukat
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Benalu adalah tumbuhan seukuran perdu yang hidup menempel pada batang atau dahan tumbuhan lain dan mengisap zat-zat makanan dari tanaman yang ditumpanginya, jika dibiarkan benalu dapat bertambah banyak dan dapat menyebabkan tumbuhan inangnya kurus dan pada akhirnya kering dan tumbuhan inangnya mati (Purnomo, 2000). Benalu dengan spesies yang sama jika tumbuh pada inang yang berbeda akan memiliki kandungan senyawa metabolit sekunder yang berbeda, karena benalu memperoleh nutrisi dan senyawa metabolit sekunder yang berbeda dari inang tempat tumbuhnya untuk pertahanan dari serangan hewan herbivora (Adler, L.S, 2002).
Benalu yang menempel pada tumbuhan tertentu telah digunakan dalam pengobatan tradisional. Benalu pada umumnya digunakan sebagai obat campak, sedangkan benalu pada jeruk nipis dimanfaatkan sebagai ramuan obat untuk penyakit amandel. Benalu teh dan benalu mangga sendiri digunakan sebagai obat kanker (Purnomo, 2000).
Kandungan kimia utama dalam benalu adalah flavonoid, tanin, asam amino, karbohidrat, alkaloid, dan saponin (Pitoyo,1996 dan Kirana et al.,2001). Berdasarkan berbagai penelitian yang telah dilakukan flavonoid, tanin dan saponin tersebut memiliki aktivitas antibakteri (Artanti et al, 2003).
Penggunaan obat antibakteri untuk pengobatan penyakit infeksi yang disebabkan oleh bakteri sekarang sudah cukup banyak, namun masalah yang dihadapi sekarang adalah terjadinya efek samping bagi penggunanya, seperti diare, alergi, hingga bahaya toksik lainnya, serta konsumsi biaya perawatan yang tinggi. Banyaknya kasus infeksi akibat bakteri, timbulnya efek samping penggunaan obat antibakteri, serta konsumsi biaya perawatan yang tinggi menunjukkan perlu dilakukannya penelitian untuk mengembangkan antibakteri baru khususnya dari bahan alam (Osman, 2009).
Berdasarkan hasil penelitian dari Anita A.dkk,(2014) tentang Aktivitas Antibakteri Ekstrak Daun Benalu Jambu Air (Dendrophthoe pentandra (L.) Miq) Terhadap Bakteri Salmonella typhi bahwa daun benalu Dendrophthoe pentandra (L.)Miq mempunyai sifat toksisitas bakterisida terhadap S.typhi dan konsentrasi yang memiliki daya zona bening yang paling besar yaitu pada konsentrasi 75 %. Menurut Pitojo,(1996) daun benalu Dendrophthoe pentandra (L).Miq.) dapat dimanfaatkan bahan ramuan obat-obatan tradisional yang dipakai sebagai obat penyakit kulit,penyakit diare dan obat sakit gigi.
Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri pada ekstrak metanol, ekstrak etil asetat dan ekstrak n-heksana dari daun benalu alpukat (Dendrophthoe pentandra (L).Miq) terhadap bakteri Escherichia coli yang merupakan bakteri penyebab diare dan infeksi usus, Streptococcus mutans merupakan bakteri yang paling kondusif menyebabkan karies pada gigi,dan Staphylococcus aureus bakteri penyebab penyakit kulit (Dzulkarnain, 1996 dan Jawetz.dkk.,2001).
Metode yang digunakan untuk uji aktifitas anti bakteri dari ekstrak metanol, ekstrak etil asetat dan ekstrak n-heksana dari daun benalu alpukat (Dendrophthoe pentandra (L).Miq) adalah metode difusi agar dengan menggunakan kertas cakram.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah :
1. Golongan senyawa metabolit sekunder apakah yang terdapat didalam ekstrak metanol, etil asetat, dan n-Heksana daun benalu alpukat (Dendrophthoe pentandra (L).Miq)
2. Bagaimanakah aktivitas antibakteri ekstrak metanol, etil asetat, dan n- Heksana daun benalu alpukat (Dendrophthoe pentandra (L).Miq) terhadap bakteri Staphylococcus aureus, Streptococcus mutans dan Eschericia coli.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk menenetukan golongan senyawa metabolit yang terdapat didalam ekstrak metanol, ekstrak etil asetat dan n-Heksana daun benalu alpukat (Dendrophthoe pentandra (L).Miq)
2. Untuk menentukan aktivitas antibakteri ekstrak metanol,ekstrak etil asetat dan n-heksan daun benalu alpukat (Dendrophthoe pentandra (L).Miq) terhadap bakteri Staphylococcus aureus, Streptococcus mutans dan Eschericia coli
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada Kimia Organik Bahan Alam Hayati khususnya tentang uji aktivitas antibakteri ekstrak metanol, etil asetat, dan n-Heksana daun benalu alpukat.
1.5 Metode Penelitian
Penelitian ini dilakukan secara eksperimen laboratorium dan sebagai objek penelitian adalah benalu alpukat diperoleh dari pohon tumbuhan alpukat yang berada di Desa Jandi Kecamatan Tiga Binanga Kabupaten Karo. Daun benalu alpukat (Dendrophthoe pentandra (L).Miq) dipisahkan dari batangnya, lalu dikeringkan dalam ruangan selama 7 hari, setelah kering diblender. Kemudian diekstraksi dengan menggunakan pelarut metanol, etil asetat, dan ekstrak n-heksana.
Ekstrak yang dihasilkan diuji skrining fitokimia dan diuji aktivitas antibakterinya.
BAB 2
TINJAUAN PUSTAKA
2.1.Benalu Alpukat a. Klasifikasi
Klasifikasi Benalu Alpukat (Dendrophthoe pentandra (L.)oMiq.) adalah sebagai berikut :
Kerajaan : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Familia : Loranthaceae Genus : Dendrophthoe
Spesies : (Dendrophthoe pentandra (L.)oMiq.)
Gambar 2.1. Dendrophthoe pentandra (L.)oMiq.
Dendhropthoe pentandra (L).Miq berakar menjalar pada inang,sering kali tumpang tindih, berbatang tegak agak panjang, bulat, rapuh, warna kusam. Memiliki cabang banyak, panjang dan membentuk banyak ranting,ruas tua membesar. Daun berbentuk lanset,elips atau bulat panjang, kaku rapuh, berwarna hijau muda sampai hijau tua. Bunganya berbentuk kecil,ramping, warna mahkota kuning, merah atau
oranye, berbuah seperti peluru berwarna hijau dan setelah tua buah akan berwarna kuning.bijinya sebesar biji pepaya. (Pitojo,1996).
Benalu merupakan jenis tumbuhan yang hidupnya tidak memerlukan media tanah. Ia hidup sebagai parasit, menempel pada dahan-dahan pohon kayu lain dan mengisap mineral yang larut dalam pohon kayu yang ditempelinya. Bunga benalu berkelamin tunggal dan biji buahnya mengandung getah. Pengembangbiakannya melalui binatang atau burung yang memakan biji buah benalu. Proses pengembangbiakannya sangat sederhana, biji benalu yang bergetah itu dimakan binatang atau burung. Kemudian biji benalu tersebut melekat di dahan-dahan kayu bersama dengan kotoran burung yang memakannya, dan tumbuh di dahan itu.
Tanaman benalu ini berupa semak, bunga karang berambut, berwarna kuning sampai coklat. Ranting kecil berhadapan, bertangkai, berbentuk elips, berbentuk bulat diujung, daun sebanyak 5-9 kali dengan panjang 2-4 cm. Bunganya mepunyai kelopak sebanyak 4-6 kali yang terkumpul d dalam ketiak tangkai bunga. Kelopak bunga berbentuk kerucut terbalik dengan tinggi 3 mm, tepi kelopak bergerigi.
Mahkota bunga dewasa memiliki kuncup dengan panjangg 1,5 – 2 cm, berbentuk tabung silindris dengan ujung elips melengkung ke bawah. Akar benalu berbentuk bulat yang merupakan penghubung antara benalu dengan inangnya dan dapat menembus kulit batang/dahan tanaman. (Backer dan Van D Brink, 1968).
2.2. Kandungan Kimia pada Benalu
Tumbuhan yang berkhasiat obat pada umumnya memiliki kandungan zat tertentu untuk pengobatan kelainan tubuh atau penyakit tertentu. Kandungan zat kimia dari beberapa tumbuhan benalu antara lain flavonoid, tanin, asam amino, karbohidrat, alkaloid,Terpenoid dan saponin (Kirana et al.,2001).
2.2.1 Tanin
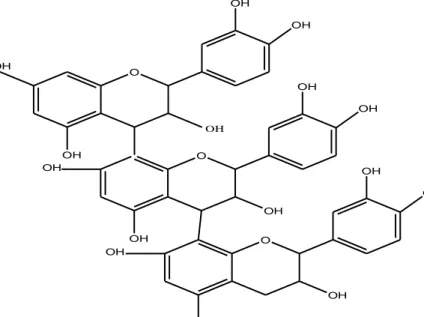
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu. Tanin dapat bereaksi dengan protein membentuk kopolimer yang tidak larut dalam air. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan yang mampu mengubah kulit hewan yang mentah menjadi kulit siap pakai karena kemampuannya menyambung silang protein (Harborne, 1987).
Adapun kerangka dari tanin adalah:
O
OH OH
OH
OH
O
OH
OH
OH
OH
O
OH
OH
OH
OH OH
OH OH
Gambar 2.2. Struktur Tanin
Secara kimia terdapat dua jenis utama tanin yang tersebar tidak merata dalam dunia tumbuhan yaitu:
1. Tanin terkondensasi (Proantosianidin tannin)
Tanin terkondensasi atau flavolan secara biosintesis dapat dianggap terbentuk dengan cara kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan kemudian oligomer yang lebih tinggi. Proantosianidin merupakan nama lain dari tanin terkondensasi karena jika direaksikan dengan asam panas, beberapa ikatan karbon penghubung satuan terputus dan dibebaskan monomer antosianidin
2. Tanin terhidrolisis
Tanin terhidrolisis mengandung ikatan ester yang dapat terhidrolisis jika dididihkan dalam asam klorida encer. Bagian alkohol dari ester ini biasanya gula dan seringkali glukosa, tetapi dalam beberapa tanin mungkin saja ada gula lain, inosistol, asam kuinat, atau senyawa sejenis lainnya. Asam elagat merupakan hasil sekunder yang terbentuk pada hidrolisis beberapa tanin yang sesungguhnya merupakan ester asam heksaoksidifenat (Robinson, 1995).
2.2.2 Flavonoid
Secara biologis, flavonoid merupakan peranan penting dalam kaitannya dengan penyerbukan pada tanaman oleh serangga. Sejumlah flavonoid mempunyai rasa pahit hingga dapat bersifat menolak sejenis ulat tertentu (Sastrohamidjojo, 1996).
Senyawa flavonoid sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoid ini berada didalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoid yang terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah. Dalam sayap kupu-kupu dengan anggapan bahwa flavonoid berasal dari tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis didalam tubuh mereka. Penyebaran jenis flavonoid pada golongan tumbuhan yang tersebar yaitu angiospermae, klorofita, fungi, briofita (Markham,1988).
Flavonoid adalah senyawa yang terdiri dari 15 atom karbon. Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Flavonoid terdapat pada seluruh bagian tumbuhan termasuk pada buah, tepung sari dan akar (Sirait, 2000).
Istilah flavonoid diberikan pada suatu golongan besar senyawa yang bersal dari kelompok senyawa yang paling umum, yaitu senyawa flavon, suatu jembatan oksigen terdapat diatara cincin A dalam kedudukan orto, dan atom karbon benzil yang terletak disebelah cincin B. Senyawa heterosiklik ini, pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan tingkat oksidasi paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa-senyawa ini (Manitto,1981).
Adapun klasifikasi dari senyawa Flavonoid adalah :
O
O A
B C
1 2
4 3 5 6 7
8 9
10
1' 2'
3' 4'
5' 6'
O
O A
B C
1 2
4 3 5 6 7
8 9
10
1' 2'
3' 4'
5' 6'
OH
Flavon
Flavonol
Gambar 2.3 Senyawa Flavonoid
2.2.3 Terpenoid
Terpenoid adalah senyawa alam yang terbentuk dengan proses biosintesis terdistribusi luas dalam dunia tumbuhan dan hewan. Terpenoid tidak saja ditemukan pada tumbuhan tingkat tinggi namun juga pada terumbu karang dan mikroba.
Struktur terpenoid dibangun oleh molekul isoprena, kerangka terpenoid terbentuk dari dua atau lebih banyak satuan unit isoprena (C5). Terpenoid yang disebut juga
isoprenoid, diklasifikasikan atas jumlah unit isoprena. Terpenoid dapat juga dikelompokkan menjadi monoterpen, seskuiterpen, diterpen, triterpen, dan tetraterpen (Sirait, 2007).
Triterpenoida merupakan golongan terpenoida yang berpotensi sebagai antimikroba. Selain itu senyawa ini banyak digunakan untuk menyembuhkan penyakit gangguan kulit. Triterpeneoida memiliki sifat antijamur, insektisida, antibakteri, dan antivirus (Robinson, 1995).Kebanyakan senyawa terpenoid terdapat bebas dalam jaringan tanaman, tidak terikat dengan senyawa–senyawa lain, tetapi banyak yang terdapat sebagai glikosida, ester dari asam organik dan dalam beberapa hal terikat dengan protein. Komposisi senyawa terpenoid ialah C10, C15, C20, C30 dan sebagainya (Sastrohamidjojo, 1996).
Gambar 2.4 Struktur Isopren
2.2.4 Saponin
Saponin berasal dari bahasa latin sapo yang berarti sabun, karena sifatnya menyerupai sabun. Saponin adalah glikosida triterpenoid dan sterol. Saponin merupakan senyawa yang berasa pahit, berbusa dalam air serta larut dalam air dan alkohol tetapi tidak larut dalam eter.Saponin adalah senyawa aktif yang menimbulkan busa jika dikocok dalam air. Saponin memiliki rasa pahit menusuk dan menyebabkan bersin serta iritasi pada lendir. Saponin merupakan racun yang dapat menghancurkan butir darah dan menyebabkan hemolisis pada darah. Dalam larutan yang sangat encer, saponin sangat beracun untuk ikan, dan tumbuhan yang mengandung saponin telah digunakan sebagai racun ikan selama beratus-ratus tahun.
Beberapa saponin bekerja sebagai antimikroba juga (Robinson, 1995).
Saponin memberikan hasil yang lebih baik sebagai antibakteri jika menggunakan pelarut polar seperti etanol 70%. Pada konsentrasi rendah, saponin menyebabkan hemolisis sel darah merah sehingga berfungsi sebagai antibakteri (Harborne, 1987).
Saponin juga telah terbukti secara signifikan mempengaruhi pertumbuhan, konsumsi masakan dan reproduksi pada binatang percobaan. Beragam senyawa struktur saponin juga telah diamati untuk membunuh protozoa, moluska, antioksidan, merusak pencernaan protein dan perembesan vitamin dan mineral dalam usus.
Menyebabkan hipoglikemia dan bertindak sebagai anti jamur dan anti virus (Yoshiki et al,1998). Peran Fisiologi saponin pada tananman belum sepenuhnya di pahami sebaliknya ada sejumlah publikasi menggambarkan identifikasi saponin dan beberapa imbas pada sel hewan, jamur dan bakteri. Hanya sedikit yang diketahui fungsi saponin untuk flora itu sendiri. Banyak saponin diketahui antimikroba untuk menghambat jamur dan untuk melindungi tumbuhan dari serangga. Saponin dianggap sebagai dari sistim pertahanan tumbuhan dan dengan demikiandimasukan dalam kelompok besar mol pelindung pada sel flora (Morrisey and Osboun,1999).
Gambar 2.5 Struktur Saponin 2.2.5 Alkaloid
Sejarah alkaloid hampir setua peradaban manusia.Manusia tlah menggunakan obat-obatan yang mengandung alkaloid dalam minuman,kedokteran,teh,dan racun selama 4000 tahun.tidak ada usaha untuk mengisolasi komponen aktif dari ramuan obat-obatan hingga permulaan abad kesimbalan belas.obat-obatan pertama yang diketemukan secara kimia adalah Apium Papaver Sammiferum.(Cordell,1981)
Pada waktu yang lampau sebagian besar sumber alkaloid adalah pada tanaman berbunga,angiosperma.pada tahun-tahun berikutnya berikutnya penemuan sejumlah besar alkaloid terdapat pada hewan,serangga organisme laut,mikroorganisme dan tanaman rendah.
Alkaloid senyawa yang mempunyai struktur heterosiklik yang mengandung atom N dalam intinya dan bersifat basa karena itu dapat larut dalam asam dan membentuk garamnya dan umumnya mempunyai aktivitas fisiologis baik terhadap
manusia maupun hewan. Alkaloid merupakan senyawa yang mengandung atom nitrogen tersebar secara terbatas pada tumbuhan (Sastrohamidjojo, 1996).
Gambar 2.6 Struktur Alkaloid 2.3 Bakteri
Bakteri merupakan uniseluler, pada umumnya tidak berklorofil, ada beberapa yang fotosintetik dan produksi aseksualnya secara pembelahan dan bakteri mempunyai ukuran sel kecil dimana setiap selnya hanya dapat dilihat dengan bantuan mikroskop. Bakteri pada umumnya mempunyai ukuran sel 0,5-1,0µm, dan terdiri dari tiga bentuk dasar yaitu bentuk bulat atau kokus, bentuk batang atau bacillus, dan bentuk spiral (Dwijoseputro, 1985).
2.3.1 Penggolongan Bakteri
Bakteri dibedakan atas dua kelompok berdasarkan komposisi dinding sel serta serta sifat pewarnaannya, yaitu bakteri Gram positif dan negatif. Selain perbedaan dalam sifat pewarnaannya, bakteri Gram positif dan bakteri Gram negatif berbeda dalam sensitivitasnya terhadap kerusakan mekanis/fisis, terhadap enzim, desinfektan dan antibiotik.
2.3.1.1 Bakteri Gram Positif
Yaitu memiliki struktur dinding sel yang tebal (15-80µm) dan berlapis tunggal dengan komposisi dinding sel terdiri atas lipid, peptidoglikan. Kandungan lipid pada bakteri Gram positif antara 1-4%. Dinding sel terdiri dari lapisan tunggal peptidoglikan yang mencapai lebih dari 50% berat kering sel bakteri. Bakteri Gram positif rentan terhadap gangguan fisik (Pelzcar & Chan, 1986).
Bakteri Gram positif lebih sensitif terhadap penisilin, tetapi lebih tahan terhadap perlakuan fisik dibandingkan bakteri Gram negatif. Bakteri Gram positif sering berubah sifat pewarnaannya sehingga menunjukkan reaksi Gram variabel.
Sebagai contoh, kultur Gram positif yang sudah tua dapat kehilangan kemampuannya untuk menyerap pewarna violet kristal sehingga dapat berwarna merah seperti
bakteri Gram negatif. Perubahan tersebut dapat juga disebabkan oleh perubahan kondisi lingkungan atau modifikasi teknik pewarnaan (Fardiaz, 1992).
Staphylococcus aureus merupakan bakteri Gram positif berbentuk bulatberdiameter 0,7-1,2 µm,tersusun dalam kelompok-kelompok yang tidak teratur seperti buah anggur,fakultatif anaerob,tidak membentuk spora,dan tidak bergerak. Bakteri ini tumbuh pada suhu optimum 37o C,tetapi membentuk pigmen paling baik pada suhu kamar (20-25o C) (Jawetz,1994).
2.3.1.2 Staphylococcus aureus
Staphylococcus aureus adalah bakteri genus kokus Gram-positif utama penyebabpenyakit. Bakteri ini bersifat positi-koagulase (memulai pembentukan bekuan fibrin), β-hemolitik, dan tolerangaram (halodurik). Staphylococcus aureus memiliki protein A pada permukaannya, yang mengikat Fc Ig (menghambatfagositosis), menghasilkan pigmen kuning dan mungkin memproduksi eksotoksin Staphylococcus aureus berdiam di mukosa hidung manusia atau di kulit; kumanini menyebar melalui tangan, bersin dan lesi kulit (Hawley, 2003).
Gambar 2.7 Bakteri Staphylococcus aureus
Penyakit yang disebabkan oleh bakteri Staphylococcus aureus terdiri atas empat jenis Keracunan makanan Staphylococcus aureus dari enterotoksin stabil terhadap panas yang terjadi akibat makanan yang kurang mendapat pendinginan dan tercemar oleh Staphylococcus aureus (misal, ham, daging yang diasinkan atau dikalengkan, kue custard, atau salad kentang). Ingesti toksin menyebabkan nyeri abdomen, muntah dan diare dengan onset cepat (1-6 jam) dan Infeksi kulit atau subkutis yang disebabkan oleh Staphylococcus aureus sering muncul sebagai nyeri
dan panas, kemerahan dan pembengkakan subkutis. Infeksi dapat menyebabkan penyakit kulit eksfoliativa (scaldedskin syndrome) bila strainnya menghasilkan eksofoliatin. (Hawley, 2003).
2.3.1.3 Streptococcus mutans
Streptococcus mutans memiliki bentuk bulat dan tersusun seperti rantai dengan diameter 0,5-0,7 mikron, tidak bergerak dan tidak memiliki spora. Streptococcus mutans dapat hidup pada daerah kaya sukrosa dan menghasilkan permukaan asam dengan menurunkan pH di dalam rongga mulut menjadi 5,5 atau lebih rendah yang membuat email mudah larut kemudian terjadi penumpukan bakteri dan mengganggu kerja saliva untuk membersihkan bakteri tersebut, sehingga jaringan keras gigi rusak dan menyebabkan terjadinya karies gigi .
Penyakit yang disebabkan adalah karies gigi, beberapa hal yang menyebabkan karies gigi bertambah parah adalah seperti gula, air liur, dan juga bakteri pembusuknya. Setelah makan sesuatu yang mengandung gula, terutama adalah sukrosa, dan bahkan setelah beberapa menit penyikatan gigi dilakukan, glikoprotein yang lengket (kombinasi molekul protein dan karbohidrat) bertahan pada gigi untuk mulai pembentukan plak pada gigi (Alfath dkk, 2013).
Gambar 2.8 Bakteri Streptococcus mutans
2.3.1.4 Bakteri Gram Negatif
Yaitu memiliki struktur dinding sel berlapis tiga dengan ketebalan 10-15µm.
Komposisi dinding sel terdiri atas lipid dan peptidoglikan yang berada dalam lapisan dengan jumlah sekitar 10% berat kering. Kandungan lipid pada bakteri Gram negatif
cukup tinggi yaitu 11-22%. Bakteri ini umumnya kurang rentan terhadap penisilin dan gangguan fisik. Selain itu, dinding sel bakteri Gram negatif lebih tipis dari pada bakteri Gram positif (Pelzcar & Chan, 1986).
Bakteri Gram negatif lebih sensitif terhadap antibiotik lainnya seperti streptomisin dan bersifat lebih konstan terhadap reaksi pewarnaan. Dinding sel bakteri Gram negatif tersusun atas satu lapisan peptidoglikon dan membran luar.
Dinding selnya tidak mengandung teichoic acid. Membran luar tersusun atas lipopolisakarida, lipoprotein dan pospolipid (Tortora, 2001).
2.3.1.5 Escherichia coli
Escherichia coli merupakan bakteri Gram negatif berbentuk batang pendek yang memiliki panjang sekitar 2 µm, diameter 0,7 µm, lebar 0,4-0,7 µm dan bersifat anaerob fakultatif. E. coli membentuk koloni yang bundar, cembung, dan halus dengan tepi yang nyata. Habitat utamanya adalah usus manusia dan hewan.
Escherichia coli dipakai sebagai organisme indikator, karena jika terdapat dalam jumlah yang banyak menunjukkan bahwa pangan atau air telah mengalami pencemaran (Gaman, 1992).
Gambar 2.9 Bakteri Escherichia coli 2.3.2 Faktor Yang Mempengaruhi Pertumbuhan Bakteri
1. Air. Bakteri memerlukan air dalam konsentrasi tinngi (cukup) disekitarnya karena diperlukan bagi pertumbuhan dan perkembagbiakan. Air merupakan pengantar semua bahan gizi yang diperlukan sel dan untuk membuang semua zat-zat yang tak diperlukan keluar sel.
2. Garam-garam anorganik, diperlukan untuk mempertahankan keadaan koloidal dan tekanan osmotik didalam sel, untuk memelihara keseimbangan
asam-basa, dan berfungsi sebagai bagian enzim atau sebagai aktivator reaksi enzim.
3. Mineral, selain karbon dan nitrogen, sel-sel hidup memerlukan sejumlah mineral-mineral lainnya untuk pertumbuhannya.
Belerang (sulfur): seperti halnya dengan nitrogen, sulfur juga merupakan substansi sel.
Fosfor-Fosfat (PO4): diperlukan sebagai komponen asam-asam nukleat dan berupa ko-enzim.
Aktivator enzim: sejumlah mineral diperlukan sebagai aktivator enzim seperti Mg, Fe juga K dan Ca.
4. Sumber Nitrogen, banyak isi sel terutama protein, mengandung nitrogen.
Pada bakteri, nitrogen mencapai 10% berat kering selbakteri. Nitrogen yang dipakai oleh bakteri diambil dalam bentuk: NO3, NO2, NH3, N2 dan R-NH2
(R-radikal organik). Kebanyakan mikroorganisme menggunakan NH3 sebagai satu-satunya sumber nitrogen.
5. CO2, diperlukan dalam proses-proses sintesis dengan timbulnya asimilasi CO2
didalam sel (Nasution, 2014).
2.4 Antibakteri
Antibakteri adalah zat yang dapat mengganggu pertumbuhan atau bahkan mematikan bakteri dengan cara mengganggu metabolisme bakteri. Antibakteri hanya dapat digunakan jika mempunyai sifat toksik selektif, artinya dapat membunuh bakteri yang menyebabkan penyakit tetapi tidak beracun bagi penderitanya. Faktor- faktor yang berpengaruh pada aktivitas zat antibakteri adalah pH, suhu stabilitas senyawa, jumlah bakteri yang ada, lamanya inkubasi, dan aktivitas metabolisme bakteri. Aktivitas antibakteri dibagi menjadi 2 macam yaitu aktivitas bakteriostatik (menghambat pertumbuhan tetapi tidak membunuh bakteri patogen) dan aktivitas bakterisidal (dapat membunuh bakteri patogen) (Bakhriansyah, 2008).
2.5 Uji Aktivitas Antibakteri
Uji aktivitas antibakteri merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak dan untuk mengetahui tingkat kerentanan bakteri terhadap zat antibakteri atau teknik untuk
mengukur berapa besar potensi atau konsentrasi suatu senyawa dapat memberikan efek bagi mikroorganisme. Aktivitas antibiotik adalah zat yang dihasilkan oleh suatu mikroba, terutama fungi, yang dapat menghambat atau dapat membasmi mikroba jenis lain dan mematikan atau menghambat pertumbuhan banyak bakteri atau pun beberapa virus besar yang toksisitasnya bagi manusia relatif kecil (Tjai, 1978). Uji aktivitas antibakteri dapat dilakukan dengan metode difusi dan metode pengenceran (dilusi). Disc diffusion test atau uji difusi cakram dilakukan dengan mengukur diameter zona bening (clear zone) yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak.
Sedangkan metode dilusi atau pengenceran adalah senyawa antibakteri diencerkan hingga diperoleh beberapa macam konsentrasi, kemudian masing-masing konsentrasi ditambahkan suspensi bakteri uji dalam media cair (Hermawan, dkk., 2007).
Pengujian aktivitas antibakteri akan diinkubasi pada suhu 37oC selama 18-24 jam dan diamati ada atau tidaknya pertumbuhan bakteri, yang ditandai dengan terjadinya kekeruhan. Larutan uji senyawa antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri uji, ditetapkan Kadar Hambat Tumbuh Minimum (KHTM) atau Minimal Inhibitory Concentration (MIC). Selanjutnya biakan dari semua tabung yang jernih diinokulasikan pada media agar padat, diinkubasikan pada suhu 37oC selama 18-24 jam, lalu diamati ada atau tidaknya koloni bakteri yang tumbuh. Media cair yang tetap terlihat jernih setelah diinkubasi ditetapkan sebagai Kadar Bunuh Minimal (KBM) atau Minimal Bactericidal Concentration (MBC) (Irianto, 2006).
Ada beberapa macam metode uji resistensi bakteri terhadap obat-obatan, antimikroba, dan lain sebagainya, antara lain :
1. Metode Dilusi
Metode dilusi, prisipnya yaitu antibiotik diencerkan sehingga diperoleh beberapa kosentrasi.
a) Dilusi cair, masing-masing konsentrasi obat ditambahkan suspensi kuman atau bakteri dalam media.
b) Difusi padat, masing-masing konsentrasi obat ditambahkan media agar, lalu ditanamin bakteri (Hermawan, dkk., 2007).
2. Metode Difusi Agar
Metode difusi agar diperkenalkan oleh William Kirby dan Alfred Bauer pada tahun 1966. Selanjutnya, metode Kirby-Bauer digunakan untuk menentukan keampuhan bahan antimikrobial. Pada uji ini, cakram kertas steril berukuran 6 mm ditetesi ekstrak tanaman dengan konsentrasi tertentu (Lay, 1994).
Metode difusi dilakukan dengan cara menginokulasi kuman kedalam media pembenihan yang berupa agar dan antibakteri uji diberikan pada permukaan agar dalam tempat tertentu sehingga antibakteri uji akan berdifusi dalam permukaan agar yang telah diinokulasi dengan kuman (Jawetz et al., 2001). Apabila efektif, maka zona hambat akan terbentuk disekitar cakram setelah inkubasi (Tortora, 2001).
Ada beberapa jenis metode difusi pada uji resistensi antibakteri, antara lain :
a) Kertas Cakram (Kirby-Bauer)
- Koloni kuman diambil dan dibiakkan dalam media agar yang sesuai dengan keperluan selama 24 jam kemudian disuspensi kedalam 1 ml BHI (Brain Heart Infussion) cair dan diinkubasikan pada suhu 37oC selama 5-8 jam. Suspensi bakteri ditambahkan dengan NaCl fisiologis sampai kekeruhan tertentu sesuai dengan standart Mc Farland 108 CFU/ml (Colony Forming Unit).
- Zona radikal atau zona bening adalah daerah disekitar disk dimana sama sekali tidak ditemukan bakteri. Daya antibakteri dinilai dengan mengukur diameter zona bening. Zona bening adalah suatu daerah disk yang menunjukkan adanya pertumbuhan bakteri yang dihambat oleh antibiotik tetapi tidak dimatikan (Darmayasa, 2008).
b) Cara Seumuran
Tahap awal sama dengan kertas cakram. Pada media Muller Hinton dibuat secara seumuran dengan garis tengah tertentu sesuai dengan
kebutuhan. Kedalaman seumuran tersebut dimasukkan atau diteteskan larutan antibiotik yang akan digunakan, kemudian diinkubasi pada suhu 37oC selama 18-24 jam, dan dibaca hasilnya sama seperti pada cara kertas cakram (Rambe, 2012).
c) Cara Pour Plate
Tahap awal sama dengan Kirby-Bauer. Satu mata ose diambil dengan menggunakan jarum ose khusus dan dimasukkan kedalam 4 ml agar base 1,5% yang mempunyai suhu 50oC. setelah suspensi kuman dibuat homogen, dituang pada media Mueller Hinton Agar dan ditunggu sampai agar membeku. Kemudian disk antibiotik dan diinkubasi pada suhu 37oC selama 18-24 jam. Suspensi kuman dibaca sesuai dengan standar masing-masing antibiotik (Darmayasa, 2008).
d) E-test
Menggunakan plastik strip yang mengandung antibiotik yang sudah diketahui konsentrasinya.
e) Gradiant test
Seperti cara seumuran, hanya saja lubang yang dibuat menyerupai garis tengah, sehingga media pada petri terbelah dua (Rambe, 2012).
2.6 Ekstraksi
Ekstraksi adalah teknik pemisahan suatu senyawa berdasarkan perbedaan distribusi zat terlarut diantara dua pelarut yang saling bercampur. Pada umumnya zat terlarut yang diekstrak bersifat tidak larut atau larut sedikit dalam suatu pelarut tetapi mudah larut dengan pelarut lain. Metode ekstraksi yang tepat ditemukan oleh tekstur kandungan air bahan-bahan yang akan diekstrak dan senyawa-senyawa yang akan diisolasi (Harborne, 1987).
Proses pemisahan senyawa dalam simplisia, menggunakan pelarut tertentu sesuai dengan sifat senyawa yang akan dipisahkan. Pemisahan pelarut berdasarkan kaidah ‘like dissolved like’ artinya suatu senyawa polar akan larut dalam pelarut polar. Ekstraksi dapat dilakukan dengan bermacam-macam metode, tergantung dari tujuan ekstraksi, jenis pelarut yang digunakan dan senyawa yang diinginkan. Metode ekstraksi yang paling sederhana adalah maserasi (Pratiwi, 2008).
Maserasi berasal dari kata ‘macerace’ yang artinya melunakkan. Maserat adalah hasil penarikan simplisia dengan cara maserasi, sedangkan maserasi adalah cara penarikan simplisia dengan merendam simplisia tersebut dalam cairan penyari dengan beberapa kali pengocokkan atau pengadukan pada tempratur kamar, sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Depkes,2000).
Tujuan ekstraksi bahan alam adalah untuk menarik komponen kimia yang terdapat pada bahan alam. Ekstraksi ini didasarkan pada prinsip perpindahan massa komponen zat kedalam pelarut, dimana perpindahan mulai terjadi pada lapisan antar muka kemudian berdifusi masuk kedalam pelarut.
Metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa cara sebagai berikut:
a. Cara Dingin
1. Ekstraksi secara Maserasi
Maserasi adalah proses pengekstrakkan simplisia menggunakan pelarut dengan beberapa kali pengocokkan/pengadukkan pada temperatur ruangan selama beberapa hari, yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk kedalam rongga sel yang mengandung zat aktif, yang akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif didalam sel dengan yang ada diluar sel, maka larutan yang terpekat akan didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar dan didalam sel. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan (Harborne, 1987).
2. Ekstraksi secara Perkolasi
Perkolasi adalah metoda ekstraksi cara dingin yang menggunakan pelarut mengalir yang selalu baru. Perkolasi banyak digunakan untuk ekstraksi metabolit sekunder dari bahan alam, terutama untuk senyawa yang tidak tahan panas (termolabil). Ekstraksi dilakukan dalam bejana yang dilengkapi kran untuk mengeluarkan pelarut pada bagian bawah. Perbedaan utama dengan maserasi terdapat pada pola penggunaan pelarut, dimana pada maserasi pelarut hanya di pakai untuk merendam bahan dalam waktu yang cukup lama, sedangkan pada
perkolasi pelarut dibuat mengalir. Perkolasi dilakukan dalam wadah berbenruk silindris atau kerucut (perkulator) yang memiliki jalan masuk dan keluar yang sesuai. Bahan pengekstaksi yang dialirkan secara kontinyu dari atas, akan mengalir turun secara lambat melintasi simplisia yang umumnya berupa serbuk kasar. Melalui penyegaran bahan pelarut secara kontinyu, akan terjadi proses maserasi bertahap banyak. Jika pada maserasi sederhana tidak terjadi ekstraksi sempurna dari simplisia oleh karena akan terjadi keseimbangan kosentrasi antara larutan dalam seldengan cairan disekelilingnya, maka pada perkolasi melalui simplisia bahan pelarut segar perbedaan kosentrasi tadi selalu dipertahnkan.
Dengan demikian ekstraksi total secara teoritis dimungkinkan (praktis jumlah bahan yang dapat diekstraksi mencapai 95%) (Voight,1995).
Perkolasi dilakukan dengan cara dibasahkan 10 bagian simplisia dengan derajat halus yang cocok, menggunakan 2,5 bagian sampai 5 bagian cairan penyari dimasukkan dalam bejana tertutup sekurang-kurangnya 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator, ditambahkan cairan penyari. Perkolator ditutup dibiarkan selama 24 jam, kemudian kran dibuka dengan kecepatan 1 ml permenit, sehingga simplisia tetap terendam. Filtrat dipindahkan kedalam bejana, ditutup dan dibiarkan selama 2 hari pada tempat terlindung dari cahaya (Harborne, 1987).
Gambar 2.10 Alat perkolasi
Cara Panas
1. Ekstraksi secara Refluks
Refluks adalah proses ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan pelarutnya akan terdestilasi menuju pendinginan dan kembali ke labu. Ekstraksi dengan cara refluks pada dasarnya adalah ekstraksi
berkesinambungan. Bahan yang akan diekstraksi direndam dengan cairan penyari dalam labu alas bulat yang dilengkapi dengan alat pendingin tegak, lalu dipanaskan sampai mendidih. Cairan penyari akan menguap, uap tersebut akan diembunkan dengan pendingin tegak dan akan kembali menyari zak aktif dalam simplisia tersebut, demikian seterusnya (Depkes, 2000).
2. Ekstraksi secara Sokletasi
Sokletasi adalah ekstraksi kontiniu yang menggunakan alat soklet, dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh membasahi dan merendam sampel yang mengisi bagian tengah pada soklet, setelah pelarut mencapai tinggi tertentu maka akan turun kedalam labu destilasi (Depkes, 2000).
Proses pemisahan berdasarkan perbedaan kelarutan bahan dapat juga disebut sebagai ekstraksi. Ekstraksi yang merupakan campuran yang dipisahkan menjadi suatu zat dengan pembagian sebuah zat terlarut antara dua pelarut yang tidak dapat tercampur untuk mengambil zat yang terlarut tersebut sering digunakan adalah metode maserasi. Metode tersebut sering digunakan karena prosedur dan peralatannya sederhana. Sedangkan metode ekstraksi secara sokletasi adalah metode lebih lanjut yang dapat menyempurnakan kelemahan dari metode ekstrak maserasi dan perlokasi. Keunggulan ekstraksi sokletasi yaitu menggunakan pelarut yang selalu baru, menggunakan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. Metode ekstraksi sokletasi merupakan suatu metode dengan pemanasan, pelarut yang digunakan akan mengalami sirkulasi dibandingkan dengan cara maserasi, ekstraksi sokletasi memberikan hasil ekstrak yang lebih tinggi. Proses ekstraksi dipengaruhi oleh suhu, ukuran partikel, jenis pelarut, waktu retensi dan metode dari ekstraksi (Prasetnyo, 2015).
Perbedaan sokletasi ekstraksi secara sokletasi dan refluk adalah perlakuan terhadap bahan baku. Pada metode sokletasi, bahan baku dimasukkan ke dalam sebuah tabung soklet dan pelarut dalam labu ekstraksi. Sedangkan pada proses ekstraksi secara refluks, bahan baku bercampur dengan pelarut dimasukkan ke dalam labu ekstraksi. Proses ekstraksi dengan pelarut sokletasi kontak antara pelarut dengan bahan baku dilakukan pemanasan, sehingga diperlukana suhu yang lebih tinggi dibandingkan pada proses refluks (Agustinus dan Halupi, 2014).
3. Ekstraksi secara Infus dan Dekok
Infus atau infusdasi yaitu ekstraksi dengan pelarut air pada temperatur penangas air, bejana infus tercelup dalam penangas air mendidih, pada temperatur terukur 96oC-98oC selama waktu tertentu (Depkes, 2000).
Dekok adalah ekstraksi dengan pelarut Air pada tempratur 96oC-98oC selama 30 menit hingga diperoleh ekstrak kental dengan menggunakan alat rotarievaporator ( Harborne,1987)
Secara umum infusa dan dekok dibuat dengan cara (Hargono, 2011)
a) Membasahi bahan bakunya, biasanya dengan air 2 kali bobot bahan, untuk bunga 4 kali bobot bahan dan untuk karagen 10 kali bobot bahan.
b) Bahan baku ditambah dengan air dan dipanaskan selama 15 menit pada suhu 900 – 980 C.
c) Umumnya untuk 100 bagian sari diperlukan 10 bagian bahan. Pada simplisia tertentu tidak diambil 10 bagian bahan. Hal ini di sebabkan karena:
1) Kandungan simplisia kelarutannya terbatas, misalnya kulit kina digunakan 6 bagian.
2) Disesuaikan dengan cara penggunaannya dalam pengobatan,.
3) Daya kerjanya keras, misalnya digitalis digunakan 1/2 bagian.
BAB 3
BAHAN DAN METODE PENELITIAN
3.1 WAKTU DAN TEMPAT
Penelitian dilakukan pada bulan Juni 2017 sampai Juli 2018. Pembuatan ekstrak methanol, n-heksan dan Tanin serta uji skrining fitokimia pada daun benalu alpukat(Dendropthoe pentandra (L).Miq.) dilakukan di Laboratorium Kimia Organik Bahan Alam Hayati FMIPA USU dan untuk uji aktivitas Anti Bakteri ekstrak methanol, n-heksan dan Tanin pada daun benalu alpukat(Dendropthoe pentandra (L).Miq.) dilakukan di Laboratorium Mikrobiologi Departemen Biologi FMIPA USU.
3.2 Alat Dan Bahan
Adapun alat yang digunakan dalam penelitian ini adalah Rotari evaporator, Oven, Inkubator, Lemari pendingin, Autoklaf, Jangka sorong, Cawan petri, Jarum ose, Neraca analitis, Belender, Erlenmeyer, Tabung reaksi, Beaker glass, Rak tabung reaksi, Pipet volum, Corong pisah, Botol vial, Hot plate,Pipet mikro, Kertas cakram, Batang pengaduk, Bunsen, Spatula, Labu destilasi
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah Daun benalu alpukat Metanol Teknis, FeCl3 5%, CeSO 1% dalam H2SO4 10%, Pereaksi Bouchardat, Pereaksi Dragendorf, Pereaksi Meyer, Mueller Hinton Agar (MHA), Nutrient Agar (NA), Nutrient Broth (NB), Dimetilsulfoksida (DMSO), Biakan Staphylococcus aureus, Biakan Streptococcus mutans, Biakan Escherichia coli
3.3 Prosedur penelitian
3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) yang diperoleh dari daerah Desa Jandi Kecamatan Tiga Binanga Kabupaten Karo. Daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) dipisahkan dari batangnya. Kemudian daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) dicuci bersih, dan dikeringkan dalam ruangan selama 6 hari, dihaluskan dengan blender sehingga dihasilkan serbuk daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) sebanyak 250 g
3.3.2 Pembuatan Ekstrak Metanol, Etil Aseatat dan n-Heksana Dari Daun benalu alpukat (Dendrophthoe pentandra (L).Miq)
Serbuk daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) ditimbang sebanyak 250 g, kemudian dimaserasi dengan metanol sebanyak ± 4 L sampai sampel terendam dan dibiarkan selama 24 jam. Maserat disaring dan diperoleh ekstrak metanol benalu alpukat. Ekstrak metanol benalu alpukat dipekatkan diatas penangas air sehingga diperoleh ekstrak pekat metanol. Ekstrak pekat metanol yang diperoleh kemudian dilarutkan dengan etil asetat dan disaring sehingga diperoleh filtrat dan residu kemudian residu di keringkan dan diuji aktivitasnya terhadap bakteri S.aureus, S.mutans dan E.coli
Lapisan metanol dan n-heksana dipekatkan kembali dengan penangas air hingga diperoleh ekstrak pekat methanol dan ekstrak pekat n-heksana. Ekstrak pekat methanol dan n-heksana dilanjutkan dengan uji antibakteri terhadap bakteri S.aureus, S.mutans, dan E.coli.
Ekstrak etil asetat dipekatkan dengan menggunakan penangas air sehingga diperoleh ekstrak pekat etil asetat, ekstrak pekat yang diperoleh diuapkan hingga semua etil asetat menguap. Ekstrak pekat tersebut dilarutkan dengan metanol dan dipartisi dengan n-heksana hingga terbentuk dua lapisan. Lapisan bawah yaitu metanol dan lapisan atas yaitu n-heksana. Partisi dilakukan kembali secara berulang- ulang menggunakan pelarut n-heksana sampai lapisan n-heksaan bening
3.3.3 Skrining Fitokimia Dari Daun Benalu Alpukat
Dipotong kecil-kecil daun benalu alpukat (Dendrophthoe pentandra (L).(Miq) segar sebanyak 50 g kemudian panaskan pada water batch hingga diperoleh ekstraknya, ekstrak yang diperoleh dilakukan uji skrining dengan beberapa tahap uji sebagai berikut:
3.3.4 Uji Fenolik
Ekstrak daun benalu alpukat (Dendrophthoe pentandra (L).Miq) dimasukkan dalam tabung reaksi, kemudian ditambahkan FeCl3 5%, jika terbentuk larutan berwarna hitam maka positif mengandung tanin.
3.3.5 Uji Terpenoida
Ekstrak daun benalu alpukat (Dendrophthoe pentandra (L).Miq) diteteskan pada plate klomatorgrafi lapis tipis ditambahkan CeSO4 1% Kemudian panaskan, jika terbentuk warna merah kecoklatan maka positif mengandung terpenoida.
3.3.6 Uji Alkaloida
Ektrak daun benalu alpukat (Dendrophthoe pentandra (L).Miq) dimasukkan dalam 3 tabung reaksi. Tabung I ditetesi pereaksi Bouchardat, jika terbentuk endapan coklat maka positif mengandung alkaloida. Tabung II ditetesi pereaksi Meyer, jika terbentuk endapan putih, maka positif mengandung alkaloida. Tabung III ditetesi pereaksi Dragendorff, jika terbentuk endapan jingga, maka positf mengandung alkaloida.
3.3.7 Uji Saponin
Ekstrak daun benalu alpukat (Dendrophthoe pentandra (L).Miq) dimasukkan kedalam tabung reaksi, lalu ditambahkan 10 ml aquadest, kemudian dikocok kuat-kuat. Jika terbentuk busa maka positif mengandung saponin.
3.3.8 Pengujian Aktivitas Antibakteri Ekstrak Metanol, Etil Asetat, dan n- Heksana Dari Daun Benalu Alpukat
3.3.8.1 Sterilisasi Alat
Alat yang digunakan dicuci sampai bersih dan dikeringkan lalu ditutup rapat dengan kapas dan kertas perkamen. Kemudian dimasukkan kedalam autoklaf dan ditutup rapat. Kemudian disterilkan selama 15 menit pada suhu 121ºC.
3.3.8.2 Pembuatan Media Nutrient Agar (NA)
Sebanyak 7 g Nutrient Agar dimasukkan dalam erlenmeyer lalu dilarutkan dalam 250 ml aquadest dan dipanaskan hingga semua larut dan mendidih. Lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit. Komposisi dari media nutrient agar adalah ekstrak beef, pepton, dan agar.
3.3.8.3 Pembuatan Media Agar Miring dan Stok Kultur Bakteri
Kedalam tabung reaksi yang steril dimasukkan 3 ml media nutrient agar steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45o. Biakan bakteri Staphylococcus aureus dari straim utama diambil dengan jarum ose steril lalu diinokulasi pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi pada suhu 35oC selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri Streptococcus mutans dan Escherichia coli.
3.3.8.4 Pembuatan Media Mueller Hinton Agar (MHA)
Sebanyak 19 g serbuk mueller hinton agar dimasukkan dalam erlenmeyer lalu dilarutkan dalam 500 ml aquadest dan dipanaskan hingga semua larut dan mendidih.
Lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit. Adapun komposisi dari media mueller hinton agar adalah ekstrak beef, asam hidrolisat kasein, agar dan aquadest.
3.3.8.5 Pembuatan Inokulum Bakteri
Sebanyak 3,25 g nutrient broth dilarutkan dengan 250 ml aquadest dalam erlenmeyer dan dipanaskan hingga semua larut dan mendidih, kemudian disterilkan di autoklaf pada suhu 121oC selama 15 menit dan didinginkan. Lalu koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media nutrient broth steril dalam tabung reaksi dan diinkubasikan pada suhu 35oC selama 3 jam, lalu diukur panjang gelombang dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 580-600 nm. Hal yang sama dilakukan untuk koloni bakteri Streptococcus mutans dan Escherichia coli.
3.3.8.6 Pembuatan Variasi Konsentrasi Ekstrak Metanol, Etil Asetat, dan n- Heksana Daun Benalu Alpukat
Ekstrak metanol, etil asetat, dan n-heksana dibuat dalam konsentrasi 10%, 20%, 30%dengan menimbang ekstrak masing-masing sebanyak 0,1 g, 0,2 g, 0,3g kemudian dilarutkan kedalam 1 ml DMSO.
3.3.8.7 Uji Aktivitas Antibakteri Ekstrak Metanol, Etil Asetat, dan n-Heksan Dari Daun Benalu Alpukat
Media MHA sebanyak 15 ml dengan suhu 45-50oC dituang ke dalaam cawan petri, Kemudian dibiarkan sampai memadat. Diambil bakteri dari inokulum bakteri dengan menggunakan cotton bad steril, kemudian di goreskan ke media MHA lalu dimasukkan kertas cakram yang telah dicelupkan dengan ekstrak pekat metanol, etil asetat, dan n-heksana benalu alpukat dengan berbagai variasi konsentrasi kedalam cawan petri yang telah berisi bakteri, kemudian diinkubasi dalam inkubator pada suhu ± 35oC selama 24 jam. Selanjutnya diukur diameter zona hambat disekitar kertas cakram dengan jangka sorong. Dilakukan perlakuan yang sama terhadap bakteri S.mutans, dan E.coli.dalam inkubator pada suhu ± 35oC selama 24 jam. Hal yang sama dilakukan untuk koloni bakteri Streptococcus mutans dan Escherichia coli.
3.3.9 Bagan Penelitian
3.3.9.1 Pembuatan Ekstrak Metanol, Etil Asetat, dan n-Heksana dari Daun Benalu Alpukat
250 g serbuk benalu alpukat
dimaserasi dengan metanol sebanyak 4 L didiamkan selama ± 24 jam
disaring
Filtrat
dipekatkan dengan rotari evaporator
ekstrak pekat metanol
ditambahkan dengan etil asetat disaring
filtrat
residu
diuji aktivitas antibakteri diuapkan dengan penangas air
ekstrak padat etil asetat
dilarutkan dengan metanol dipartisi dengan n-Heksana
lapisan n-Heksana
diuapkan dengan penangas air
ekstrak padat n-Heksana
diuji aktivitas antibakteri
hasil lapisan metanol
diuapkan dengan penangas air ekstrak padat metanol
diuji aktivitas antibakteri
hasil
residu diskrining fitokimia
Hasil
diskrining fitokimia
diskrining fitokimia diskrining fitokimia
diaduk
dikeringkan diatas penangas air
3.3.9.2 Uji Skrining Fitokimia
Ekstrak Metanol Daun Benalu Alpukat
dimasukkan 3 ml kedalam tabung reaksi
Tabung I + pereaksi Bouchardat Tabung II + pereaksi Meyer
Tabung III + pereaksi Dragendroff
ditotolkan pada plat KLT
disemprotkan dengan CeSO4
ditambahkan FeCl3 5%
ditambahkan aquadest
dikocok kuat-kuat Tabung I
ditetesi NaOH 10%
Tabung II + serbuk Mg dan HCL pekat
Alkaloid Flavonoid Terpenoid Tanin Saponin
3.3.9.3 Uji Sifat Antibakteri Eksrak Metanol, Etil Asetat, dan n-Heksana Daun Benalu Alpukat
3.3.9.3.1Pembuatan Media Mueller Hinton Agar (MHA)
19 g Media Mueller Hinton Agar (MHA)
dilarutkan dengan 500 ml aquadest kedalam erlenmeyer
dipanaskan sambil diaduk hingga larut dan mendidih
disterilkan dalam autoklaf pada suhu 121
oC selama 15 menit
Media Mueller Hinton Agar
(MHA) Steril
3.3.9.2 Pembuatan Stok Kultur Bakteri
7 g Media Nutrient Agar (NA)
dilarutkan dengan 250 ml aquadest dalam erlenmeyer
dipanaskan sambil diaduk hingga larut dan mendidih
disterilkan dalam autoklaf pada suhu 121
oC selama 15 menit
Media Nutrient Agar (NA) Steril
dituangkan sebanyak 10 ml kedalam tabung reaksi
dibiarkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45
oC
diambil biakan bakteri Staphylococcus aureus dari strain utama dengan jarum ose lalu digoreskan pada
media Nutrient Agar (NA) yang telah memadat diinkubasi pada suhu 35
oC selama 18-24 jam
Stok Kultur Bakteri
Staphylococcus aureusDilakukan hal yang sama untuk bakteri Streptococcus Mutans dan Escherichia coli
3.3.9.3 Pembuatan Inokulum Bakteri
3,25 g Media Nutrient Broth (NB)
dilarutkan dengan 250 ml aquadest kedalam erlenmeyer
dipanaskan sambil diaduk hingga larut dan mendidih
disterilkan dalam autoklaf pada suhu 121
oC selama 15 menit
Media Nutrient Broth (NB) Steril
dimasukkan sebanyak 10 ml kedalam tabung reaksi
diambil koloni bakteri Staphylococcus aureus dari stok kultur bakteri dengan jarum ose
disuspensikan kedalam media Nutrient Broth (NB) diinkubasi pada suhu 35
oC selama ± 3 jam
dibandingkan kekeruhannya dengan kekeruhan standar Mcfarland (panjang gelombang 580 nm pada Spektrofotometri Visible hingga diperoleh 25% Transmitan) Inokulum Bakteri Staphylococccus aureus
Dilakukan hal yang sama untuk koloni bakteri Streptococcus Mutans dan Escherichia coli.
3.3.9.4 Pengujian Aktivitas Antibakteri Ekstrak Metanol, Etil Asetat, dan n-Heksana Daun Benalu Alpukat
Inokulum Bakteri
dimasukkan media MHA kedalam cawan petri steril dengan suhu 45-50oC
dibiarkan sampai memadat
digoreskan kedalam media MHA yang telah memadat
Diameter Zona Bening
diambil cotton bad steril, lalu dicelupkan kedalam inokulum bakteri
dimasukkan kertas cakram yang telah direndam
dengan ekstrak metanol daun benalu alpukat dengan berbagai konsentrasi kedalam cawan petri yang telah berisi bakteri diinkubasi selama 18-24 jam pada suhu 35oC
diukur diameter zona bening disekitar cakram dengan jangka sorong
Dilakukan untuk bakteri Streptococcus Mutans, Escherichia coli dan Staphylococcus Aereus Kemudian dilanjutkan dengan prosedur yang sama untuk ekstrak etil asetat dan n- Heksana.