BAB II
TINJAUAN PUSTAKA
2.1 Susu
Susu merupakan bahan makanan yang sangat penting untuk kebutuhan manusia, karena mengandung zat yang sangat diperlukan oleh tubuh, seperti protein, karbohidrat, lemak, vitamin dan mineral. Kecuali susu merupakan bahan asal untuk produk olahan susu, seperti susu kental manis, susu bubuk, susu skim,
butter, ice cream, keju, yogurt dan lain-lain. Susu mudah rusak oleh lingkungan, baik oleh temperatur udara ataupun udara sekitarnya, sehingga perlu perhatian khusus untuk penanganan pada waktu pemerahan ataupun sesudah pemerahan agar diperoleh susu yang berkualitas baik, memenuhi standar susu yang telah ditentukan dan masih layak dikonsumsi (Soeparno, 2011).
2.2 Yogurt
Menurut SNI 01– 2981–1992, yogurt adalah produk yang diperoleh dari susu yang telah dipasteurisasi kemudian difermentasikan dengan bakteri tertentu sampai diperoleh keasaman, bau, dan rasa yang khas, dengan atau tanpa penambahan bahan lain yang diizinkan.
Yogurt secara komersial diproduksi di era tahun 1970-an. Konsumsi yogurt sejak tahun 1975 semakin meningkat dan menjadi bisnis besar. Pada tahun 1975, konsumsi yogurt di Inggris telah mencapai 23 ml/orang per minggu. Konsumsi yogurt di Amerika Serikat meningkat 4,5 kali lipat dalam kurun waktu 10 tahun, dari tahun 1970 sampai tahun 1980 (Wahyudi dan Samsundari, 2008).
hasil penelitian Carter dan Collin pada tahun 1978. Hasil penelitian ini menunjukkan bahwa dengan infeksi 10 sel Salmonella enteridis dapat membunuh marmot bebas mikroba, tetapi dibutuhkan 109 sel untuk membunuh marmot normal yang secara alami memiliki mikroba dalam saluran pencernaannya (Wahyudi dan Samsundari, 2008).
2.2.1 Sifat-Sifat Yogurt
Yogurt yang baik memiliki tekstur yang halus, lembut, konsisten dan tidak ada sineresis. Komposisi bahan baku dan formulasi yang tepat serta proses pengolahan yang benar dibutuhkan untuk menghasilkan yoghurt dengan tekstur dan konsistensi yang baik. Dewasa ini yoghurt telah mengalami perkembangan dalam proses pembuatannya sehingga menghasilkan yogurt dengan aroma dan citarasa yang semakin baik dan bervariasi. Citarasa khas pada yogurt disebabkan oleh terbentuknya asam laktat, asam asetat, karbonil, diasetil, dan asetaldehid (Widodo, 2002).
2.2.2 Komposisi Yogurt
Yogurt merupakan produk olahan susu dari hasil fermentasi dari Bakteri Asam Laktat (BAL) sebagai starter, yakni Streptococcus thermophilus dan
Lactobacillus bulgaricus yang hidup bersimbiosis. Lama proses fermantasi akan
berakibat pada turunnya pH yogurt dengan rasa asam yang khas, selain itu dihasilkan
asam asetat, asetal dehid, dan bahan lain yang mudah menguap. Komposisi yogurt secara adalah protein 4-6%, lemak 0,1-1%, laktosa 2-3%, asam laktat 0,6-1,3%, pH 3,8-4,6% (Susilorini dan Sawitri, 2007), vitamin A, vitamin B kompleks diantaranya vitamin B1 (tiamin), vitamin B2 (riboflavin), vitamin B3 (niasin),
2.2.3 Manfaat Yougrt
Yogurt bermanfaat bagi manusia sebagai makanan fungsional (probiotik), berfungsi meningkatkan gizi makanan, membantu pertumbuhan, membantu proses pencernaan, meningkatkan kekebalan tubuh, meningkatkan konsumsi vitamin B (termasuk vitamin B12), menyediakan asam lemak omega–3, enzim pencernaan, laktase dan asam laktat, serta dapat menyerang bakteri berbahaya dan sel kanker (Wahyudi dan Samsundari, 2008).
2.2.4 Syarat Mutu Yogurt
Menurut SNI 01–2981–1992, syarat mutu yogurt adalah sebagai berikut: Tabel 1. Syarat Mutu Yogurt
No. Kriteria Uji Satuan Persyaratan
1.
Bahan kering tanpa lemak, %, b/b Protein (N × 6,37), %, b/b
Abu
2.3 Protein
Protein adalah suatu polipeptida yang mempunyai bobot molekul yang sangat bervariasi, dari 5000 hingga lebih dari satu juta. Di samping berat molekul yang berbeda-beda, protein mempunyai sifat yang berbeda-beda pula. Ada protein yang mudah larut dalam air, tetapi ada juga yang sukar larut dalam air (Poedjiadi dan Supriyanti, 2006).
2.3.1 Penggolongan Protein
Protein adalah molekul yang sangat vital untuk organisme dan terdapat di semua sel. Protein merupakan polimer yang disusun oleh 20 macam asam amino standar. Rantai asam amino dihubungkan dengan ikatan kovalen yang spesifik. Struktur & fungsi ditentukan oleh kombinasi, jumlah dan urutan asam amino sedangkan sifat fisik dan kimiawi dipengaruhi oleh asam amino penyusunnya. Penggolongan protein berdasarkan strukturnya ada empat macam, yaitu struktur primer, sekunder, tersier dan kuarterner.
Struktur primer (struktur utama), terdiri dari asam-asam amino yang dihubungkan satu sama lain secara kovalen melalui ikatan peptida.
Gambar 1. Struktur Primer Protein
pada orientasi ikatan hidrogennya. Ada dua jenis struktur sekunder, yaitu: α-heliks dan β-sheet.
Gambar 2. Struktur Sekunder Protein α-Heliks (A) dan β-Sheet (B)
Struktur tersier, terbentuk karena adanya pelipatan membentuk struktur yang kompleks. Pelipatan distabilkan oleh ikatan hidrogen, ikatan disulfida, interaksi ionik, ikatan hidrofobik, ikatan hidrofilik.
Gambar 3. Struktur Tersier Protein
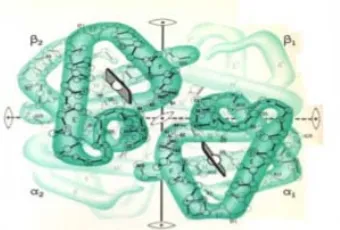
Struktur kuartener, terbentuk dari beberapa bentuk tersier, dengan kata lain multi sub unit. Interaksi intermolekul antar sub unit protein ini membentuk struktur keempat/kuartener.
2.3.2 Sifat-Sifat Protein
Berat molekul protein sangat besar, ribuan sampai jutaan, sehingga merupakan suatu makromolekul. Seperti senyawa polmer lain (misalnya: pati), protein dapat pula dihidrolisis oleh asam, basa, atau enzim tertentu dan menghasilkan campuran asam-asam amino (Yazid dan Nursanti, 2006).
Sifat fisikokimia protein berbeda satu sama lain, tergantung pada komposisi dan jenis asam amino penyusunnya. Sebagian besar protein bila dilarutkan dalam air akan membentuk dispersi koloidal dan tidak dapat berdifusi bila dilewatkan melalui membran semipermeabel. Beberapa protein mudah larut dalam air, tetapi ada pula yang sukar larut. Namun, semua protein tidak dapat larut dalam pelarut organik, seperti eter, klorofom, atau benzena (Yazid dan Nursanti, 2006).
Pada umumnya, protein sangat peka terhadap pengaruh-pengaruh fisik dan zat kimia, sehingga mudah mengalami perubahan bentuk. Perubahan atau modifikasi pada struktur molekul protein disebut denaturasi. Hal-hal yang dapat menyebabkan terjadinya denaturasi adalah panas, pH, tekanan, aliran listrik, dan adanya bahan kimia seperti urea, alkohol, atau sabun. Proses denaturasi terkadang berlangsung secara reversible, tetapi ada pula yang irreversible, tergantung pada penyebabnya. Protein yang mengalami denaturasi akan menurunkan aktivitas biologinya dan berkurang kelarutannya, sehingga mudah mengendap (Yazid dan Nursanti, 2006).
protein akan bereaksi dengan ion H+, sehingga protein bermuatan positif. Sebaliknya, dalam larutan basa, gugus karboksilat bereaksi dengan ion OH–, sehingga protein bermuatan negatif. Adanya muatan pada molekul protein menyebabkan protein bergerak di bawah pengaruh medan listrik (Yazid dan Nursanti, 2006).
Setiap jenis protein dalam larutan mempunyai pH tertentu yang disebut titik isoelektrik (TI). Pada pH isoelektrik (pI), molekul protein mempunyai muatan positif dan negatif yang sama, sehingga saling menetralkan atau bermuatan nol. Akibatnya, protein tidak bergerak di bawah pengaruh medan listrik. Pada titik isoelektris, protein akan mengalami pengendapan atau pemurnian suatu protein (Yazid dan Nursanti, 2006).
2.3.3 Manfaat Protein
Menurut (Priyani dan Mizawarti, 2006), protein berfungsi sebagai berikut: 1. Sebagai enzim yang mengkatalisis semua reaksi kimia dalam metabolisme 2. Sebagai regulator untuk aktivitas enzim (merupakan komponen dari enzim)
ataupun sebagai messanger kimia dalam hormon maupun reseptor untuk hormon tersebut
3. Berperan dalam transpor berbagai senyawa penting, seperti ion logam, O2, glukosa, lipid dan lain-lain
4. Berperan dalam gerak, seperti kontraksi serabut otot ataupun gerakan mekanis dalam pemisahan kromosom selama proses pembelahan sel
5. Dibutuhkan untuk fungsi sensor, rhodopsin, protein dalam retina, diperlukan dalam proses sel saraf
7. Bagian struktural yang memberikan sifat karakteristik kuat, keras seperti kolagen yang merupakan penyusun tulang, tendon, maupun ligamen.
2.4 Akibat Kekurangan dan Kelebihan Protein 2.4.1 Akibat Kekurangan Protein
1. Kwashiorkor
Istilah “kwashiorkor” pertama kali diperkenalkan oleh Dr. Cecily Wiliams pada tahun 1993 di Ghana, Afrika. Penyakit ini lebih banyak terdapat pada usia dua hingga tiga tahun yang komposisi gizi makanannya tidak seimbang, terutama dalam hal protein (Yuniastuti, 2008).
Menurut (Widodo, 2009 dan Ellya, 2010), gejala penyakit kwashiorkor adalah sebagai berikut:
a. Pertumbuhan terhambat b. Otot-otot berkurang dan lemah
c. Pembengkakan (edema) terutama pada perut (pembesaran hati), kaki dan tangan
d. Muka bulat seperti bulan (moonface) e. Gangguan psikomotorik
f. Nafsu makan berkurang
g. Rambut halus, jarang dan pirang kemerahan kusam
h. Kulit tampak kering (xerosis) dan memberi kesan kasar dengan garis-garis permukaan yang jelas
2. Marasmus
Marasmus berasal dari kata Yunani yang berarti wasting (merusak). Marasmus umumnya merupakan penyakit pada bayi (12 bulan pertama) karena terlambat diberi makanan tambahan. Merasmus adalah penyakit kelaparan, banyak terdapat diantara kelompok sosial ekonomi rendah di sebagian besar negara sedang berkembang dan lebih banyak dari kwashiorkor (Yuniastuti, 2008).
Menurut (Widodo, 2009), gejala penyakit kwashiorkor adalah sebagai berikut:
a. Pertumbuhan yang terhambat b. Lemak dibawah kulit berkurang c. Otot-otot berkurang dan melemah d. Muka seperti orang tua (Oldman’s face) 2.4.2 Akibat Kelebihan Protein
Jika terlalu berlebihan mengkonsumsi protein, maka dapat memberatkan ginjal dan hati yang harus memetabolisme dan mengeluarkan kelebihan nitrogen dan juga dapat menyebabkan asidosis, dehidrasi, diare, kenaikan amonia darah, kenaikan ureum darah, dan demam. Makanan yang tinggi proteinnya biasanya tinggi lemak sehingga menyebabkan obesitas, maka diet protein tinggi dianjurkan untuk menurunkan berat badan (Ellya, 2010).
2.5 Analisis Protein 2.5.1 Analisis Kualitatif
1. Reaksi Xantoprotein
Larutan asam nitrat pekat ditambahkan dengan hati-hati ke dalam larutan protein. Setelah dicampur terjadi endapan putih yang dapat berubah menjadi kuning apabila dipanaskan. Reaksi yang terjadi ialah nitrasi pada inti benzena yang terdapat pada molekul protein. Reaksi ini positif untuk protein yang mengandung tirosin, fenilalanin dan triptofan.
2. Reaksi Hopkins-Cole
Larutan protein yang mengandung triptofan dapat direaksikan dengan pereaksi Hopkins-Cole yang mengandung asam glioksilat. Pereaksi ini dibuat dari asam oksalat dengan serbuk magnesium dalam air. Setelah dicampur dengan pereaksi Hopkins-Cole, asam sulfat dituangkan perlahan-lahan sehingga membentuk lapisan di bawah larutan protein. Beberapa saat kemudian akan terjadi cincin ungu pada batas antara kedua lapisan tersebut. 3. Reaksi Millon
Pereaksi Millon adalah larutan merkuro dan merkuri nitrat dalam asam nitrat. Apabila pereaksi ini ditambahkan pada larutan protein, akan menghasilkan endapan putih yang dapat berubah menjadi merah oleh pemanasan. Pada dasarnya reaksi ini positif untuk fenol-fenol, karena terbentuknya senyawa merkuri dengan gugus hidroksifenil yang berwarna. 4. Reaksi Natriumnitroprusida
2.5.2 Analisis Kuantitatif
Menurut (Sudarmadji, dkk., 1989), metode analisis kuantitatif protein, yaitu: 1. Metode Lowry
Konsentrasi protein diukur berdasarkan Optical Density (OD) pada panjang gelombang 600 nm. Untuk mengetahui banyaknya proteindalam larutan, lebih dahulu dibuat kurva standar yang melukiskan hubungan antara konsentrasi dengan OD (absorbansi). Larutan Lowry ada dua macam, yaitu Lowry A yang terdiri dari fosfotungstat-fosfomolibdat (1:1) dan Lowry B yang terdiri dari natrium karbonat (Na2CO3) 2% dalam natrium hidroksida (NaOH) 0,1 N, cupri sulfat (CuSO4) dan natrium kalium tartrat (Na-K-tartrat) 2%. Cara penentuannya adalah 1 ml larutan protein ditambahkan 5 ml Lowry B, dikocok dan didiamkan selama 10 menit. Kemudian ditambah 0,5 ml Lowry A, dikocok dan didiamkan selama 20 menit. Selanjutnya, diamati absorbansinya pada panjang gelombang 600 nm.
2. Metode Spektrofotometer UV
Sebagian besar protein mengabsorbansi sinar ultraviolet maksimum pada panjang gelombang 280 nm. Hal ini terutama oleh adanya asam amino tiroosin, triptophan, dan fenilalanin yang ada pada protein tersebut. Pengukuran protein berdasarkan absorbansi sinar UV adalah cepat, mudah, dan tidak merusak bahan.
3. Metode Turbidimetri atau Kekeruhan
kekeruhan diukur dengan alat Turbidimeter. Cara ini hanya dipakai untuk bahan protein yang berupa larutan, tetapi biasanya hasilnya kurang tepat, sehingga jarang dipakai untuk penetapan kadar protein.
4. Metode Pengecatan
Beberapa bahan pewarna, misalnya orange G, orange 12 dan amido black dapat membentuk senyawa berwarna dengan protein dan menjadi tidak larut. Dengan mengukur sisa bahan pewarna yang tidak bereaksi dalam larutan (dengan kolorimeter), maka jumlah protein dapat ditentukan dengan cepat.
5. Titrasi Formol
Larutan protein dinetralkan dengan basa (NaOH), kemudian ditambahkan formalin akan membentuk dimenthiol. Dengan terbentuknya dimenthiol, ini berarti gugus aminonya sudah terikat dan tidak akan mempengaruhi reaksi antara asam (gugus karboksil) dengan basa (NaOH) sehingga akhir titrasi dapat diakhiri dengan tepat. Indikator yang digunakan adalah fenolftalein, akhir titrasi bila tepat terjadi perubahan warna menjadi merah muda yang tidak hilang dalam 30 menit. Titrasi formol ini hanya tepat untuk menentukan suatu proses terjadinya pemecahan protein dan kurang tepat untuk penentuan protein.
6. Metode Kjeldahl
maupun proses pengolahan lain yang biasa dilakukan pada makanan. Metode ini digunakan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung karena senyawa yang dianalisisnya adalah kadar nitrogennya. Dengan mengalikan hasil analisis tersebut dengan faktor konversi 6,25, diperoleh nilai protein dalam bahan uji tersebut.
Penentuan kadar protein dengan metode ini memiliki kelemahan karena adanya senyawa lain yang bukan protein yang mengandung N akan terdeteksi sehingga kadar protein yang diperoleh langsung dengan metode Kjeldahl ini disebut dengan kadar protein kasar (Crude Proteint).
Menurut (Bintang, 2010; Yazid dan Nursanti, 2006), metode Kjeldahl dilakukan dengan beberapa tahapan kerja, yaitu:
a. Tahap Destruksi
Pada tahap ini sampel dipanaskan dengan asam sulfat (H2SO4) pekat sehingga terjadi destruksi menjadi unsur-unsur, diamana seluruh nitrogen (N) organik diubah menjadi N anorganik, yaitu elemen karbon (C) teroksidasi menjadi karbon dioksida (CO2) dan hidrogen (H) teroksidasi menjadi air (H2O), sedangkan elemen nitrogennya akan berubah menjadi amonium sulfat [(NH4)2SO4]. Asam sulfat yang dipergunakan untuk destruksi harus dalam jumlah yang cukup dan diperhitungkan untuk dapat mengurai bahan protein, lemak, dan karbohidrat di dalam sampel.
maka titik didih asam sulfat akan ditinggikan sehingga proses destruksi akan berjalan dengan cepat. Tiap satu gram kalium sulfat akan mampu meningkatkan titik didih asam sulfat 30C. Suhu destruksi berkisar antara 3700 – 4100C. Proses destruksi diakhiri jika larutan telah menjadi warna hijau jernih.
Reaksi yang terjadi proses destruksi adalah:
Protein + H2SO4 (NH4)2SO4 + CO2↑ + SO2↑ + H2O↑
b. Tahap Destilasi
Pada tahap ini, amonium sulfat [(NH4)2SO4] yang terbentuk pada setiap tahap destruksi dipecah menjadi amonia (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Amonia yang dibebaskan selanjutnya akan ditangkap oleh larutan baku asam. Larutan baku asam yang dipakai adalah asam sulfat. Agar kontak antara asam dan amonia berjalan sempurna, maka ujung selang pengalir destilat harus tercelup ke dalam larutan asam. Destilasi diakhiri bila semua amonia terdestilasi sempurna yang ditandai dengan destilasi tidak bereaksi basa.
Reaksi yang terjadi pada tahap destilasi:
(NH4)2SO4 + 2 NaOH Na2SO4 + 2 H2O + 2 NH3↑
c. Tahap Titrasi
Penampung destilat yang digunakan adalah asam sulfat berlebih, maka sisa asam sulfat yang tidak bereaksi dengan amonia dititrasi dengan NaOH 0,1 N menggunakan indikator Mengsel. Titik akhir
titrasi dapat ditandai dengan perubahan warna dari warna ungu menjadi hijau.
Rekasi yang terjadi pada tahap titrasi: NH3 + H2SO4 (NH4)2SO4
Kelebihan H2SO4 + 2 NaOH Na2SO4 + 2 H2O Kadar protein dihitung dengan persamaan berikut:
𝑘𝑎𝑑𝑎𝑟𝑝𝑟𝑜𝑡𝑒𝑖𝑛 (%) = 𝑁×𝑉×𝐵𝐸×𝐹𝑝×𝐹𝑘
𝑤 × 100%
Fk = Faktor konversi atau perkalian = 6,25