1
PERAN APOPTOSIS
PADA KEJADIAN KETUBAN PECAH DINI
dr. I G N Suryantha, Sp.OG
BAGIAN / SMF OBSTETRI DAN GINEKOLOGI FK UNUD / RSUP SANGLAH
DENPASAR 2014
2 BAB I
PENDAHULUAN
Selaput ketuban merupakan jaringan elastis avaskuler yang terdiri dari amnion dan korion. Amnion adalah bagian yang berhadapan langsung dengan kavitas amnion sedangkan korion merupakan lapisan yang lebih tebal dan melekat pada desidua maternal. Pada awalnya amnion dan korion adalah dua lapisan yang terpisah hingga akhirnya akan mengalami fusi di akhir minggu ke 14 kehamilan.1 Pada perkembangan selanjutnya amnion dan korion akan dihubungkan oleh jaringan ikat yang kaya akan kolagen. Selaput ketuban berfungsi menahan cairan amnion, mensekresi substansi ke dua arah sekaligus yaitu ke dalam cairan amnion dan juga ke luar ke arah uterus, selain itu ia juga berfungsi melindungi janin dari infeksi asenden yang berasal dari saluran reproduksi bagian distal. Secara fisiologis sepanjang kehamilan terjadi proses remodelling jaringan, berupa perubahan tipe dan komposisi kolagen serta perubahan pada matriks interseluler. Remodelling ini penting untuk mengakomodasi perubahan tekanan dan volume selaput ketuban selama berkembangnya kehamilan. Namun perubahan ini juga sekaligus menyebabkan pelemahan struktur selaput ketuban, yang lebih tampak nyata pada daerah internal servikal os.2
Secara normal selaput ketuban akan pecah pada saat persalinan berlangsung, yaitu pada saat adanya kontraksi yang bersifat reguler. Ketuban pecah dini didefinisikan sebagai pecahnya selaput ketuban sebelum proses persalinan dimulai.
3 Pada usia kehamilan aterm, 8 hingga 10 persen ibu hamil datang dengan diagnosis ketuban pecah dini, dengan risiko yang tinggi untuk terjadi infeksi intrauterin. Sedangkan pecahnya selaput ketuban sebelum usia kehamilan 37 minggu disebut sebagai ketuban pecah dini preterm (preterm premature rupture of membrane /
PPROM). Ketuban pecah dini preterm didapatkan pada sekitar 1 persen dari
keseluruhan kehamilan dan dikaitkan dengan 30 hingga 40 persen persalinan preterm dan komplikasi yang menyertainya (sindrom distres nafas, infeksi neonatus dan perdarahan intraventrikuler).2 Meskipun saat ini perawatan perinatal sudah banyak mengalami kemajuan pesat, ketuban pecah dini preterm masih merupakan komplikasi obstetri yang penting.
Dahulu, pandangan konvensional mengaitkan pecahnya selaput ketuban dengan adanya kekuatan mekanis berupa kontraksi selama persalinan yang melemahkan selaput ketuban. Namun, pandangan ini terbantahkan karena tidak mampu menjelaskan kejadian pecah ketuban sebelum munculnya kontraksi. Saat ini bukti dan penelitian terakhir menunjukkan pecahnya selaput ketuban berkaitan dengan proses biokimia yang melibatkan kerusakan kolagen pada matriks ekstraseluler amnion dan korion, serta kematian sel terprogram (apoptosis) dari sel-sel yang terdapat pada sel-selaput ketuban, dimana peristiwa-peristiwa tersebut terjadi sebelum kontraksi muncul.
Apoptosis merupakan bagian yang normal dari perkembangan dan pemeliharaan dari suatu organisme multiseluler. Kematian sel ini merupakan respon terhadap berbagai stimulus, baik intrinsik maupun ekstrinsik, yang menyebabkan
4 perubahan histologi berupa fragmentasi kromatin inti sel, penonjolan sitoplasma yang membentuk apoptotic body dan pada akhirnya fagositosis oleh makrofag.3 Apoptosis berbeda dengan nekrosis dimana terjadi kematian secara tidak terkontrol, pada kondisi ini sel yang menjelang kematian kromatin pada inti selnya akan mengalami penggumpalan, pembengkakan organela dan akhirnya kerusakan membran sel. Bukti penelitian mendukung dugaan bahwa proses apoptosis berperan pada kejadian ketuban pecah dini. Saglam dkk. menemukan bahwa caspase-3, suatu famili protein yang berperan dalam rangkaian proses apoptosis, kadarnya meningkat pada wanita hamil dengan ketuban pecah dini preterm.4 Fortunato dkk melakukan pemeriksaan pada selaput ketuban pada kasus ketuban pecah dini yang dibandingkan dengan kontrol, hasilnya ditemukan adanya peningkatan ekspresi gen yang bersifat proapoptosis, yaitu p53 dan bax disertai penurunan ekspresi gen antiapoptosis bcl-2 pada kasus ketuban pecah dini, baik aterm maupun preterm.5 Berbagai penelitian lain juga memberikan hasil yang konsisten bahwa selaput ketuban dari ibu hamil dengan ketuban pecah dini menunjukkan indeks apoptosis yang lebih tinggi dibandingkan dengan selaput ketuban dari persalinan aterm maupun preterm dengan selaput ketuban yang masih utuh.
5 BAB 2
TINJAUAN PUSTAKA
2.1 Definisi Ketuban Pecah Dini
Ketuban pecah dini didefinisikan sebagai pecahnya selaput ketuban sebelum proses persalinan dimulai. Sedangkan apabila pecahnya selaput ketuban sebelum proses persalinan dimulai tersebut terjadi sebelum usia kehamilan 37 minggu, disebut sebagai ketuban pecah dini preterm (preterm premature rupture of membrane /
PPROM).2
2.2 Angka Insiden Ketuban Pecah Dini
Pada usia kehamilan aterm, angka insiden ketuban pecah dini adalah 8 hingga 10 persen. Sedangkan ketuban pecah dini preterm didapatkan pada sekitar 1 persen dari keseluruhan kehamilan. Ketuban pecah dini preterm dikaitkan dengan 30-40% kelahiran prematur dan diidentifikasikan penyebab utama kelahiran prematur, dan terjadi pada sekitar 150.000 kehamilan setiap tahun di Amerika Serikat. Ketika ketuban pecah dini preterm terjadi, risiko yang signifikan terjadi baik untuk janin dan ibu.2
Korioamnionitis ditemukan pada 9% kehamilan dengan ketuban pecah dini aterm, dimana risikonya dapat meningkat hingga 24% apabila pecah ketuban terjadi lebih dari 24 jam. sedangkan pada kehamilan preterm angka insidennya jauh lebih besar yaitu antara 13 hingga 60%. Solusio plasenta terjadi pada 4 hingga 12 %
6 kehamilan dengan ketuban pecah dini. Maternal sepsis (0,8%) yang menyebabkan kematian (0,14%) merupakan komplikasi yang jarang terjadi. Risiko pada janin utamanya berkaitan dengan infeksi intrauterin, penekanan tali pusat dan solusio plasenta. Kematian janin dilaporkan pada 3 hingga 22% kasus pecah ketuban dini preterm dengan usia kehamilan 16 hingga 28 minggu.1
2.3 Komposisi Selaput Ketuban
Selaput ketuban terdiri dari beberapa lapisan yang berbeda secara morfologi. Lapisan yang paling dekat dengan fetus terdiri dari sel epitel amnion yang tersusun di atas membran basal yang kaya kolagen IV dan glikoprotein non-kolagen. Dibawah membran basal terdapat lapisan kompakta tersusun atas kolagen tipe I, III dan V yang dihasilkan oleh sel mesenkim pada lapisan fibroblas. Lapisan berongga (spongy) terdapat dibawah lapisan fibroblas, terdiri dari proteoglikan dan glikoprotein serta kolagen tipe III. Lapisan ini memisahkan amnion dengan korion. Lapisan korion terdiri dari sitotrofoblas yang terbenam dalam matriks kolagen tipe IV dan V, melekat erat dengan jaringan desidua uterus.6
Distribusi komponen matriks ekstraseluler, termasuk kolagen tipe I, III, IV, V dan VI pada selaput ketuban aterm telah dipelajari dengan menggunakan tehnik imunohistokimia. Kolagen tipe I dan III dapat ditemukan pada hampir semua lapisan selaput ketuban, kecuali pada lapisan trofoblas dari korion. Fibronectin, laminin, dan kolagen tipe I dan IV terdapat pada bagian dari matriks ekstraseluler yang menyelubungi sel-sel sitotrofoblas korion. Kolagen tipe V juga ditemukan pada
7 lapisan retikuler dan trofoblas. Kolagen tipe VI utamanya ditemukan pada amnion dan lapisan retikuler. Fibulin 1, 3 dan 5 ditemukan pada amnion, dan kepadatannya berkurang pada bagian amnion yang lemah. Sel mesenkim merupakan tempat sintesis kolagen pada amnion. Kadar subunit mRNA prokolagen a1(I), a2(I) dan a1(III), serta aktivitas enzim prolyl 4-hidroksilase dan lysil hidroksilase yang dibutuhkan dalam sintesis kolagen mencapai puncaknya pada amnion di awal kehamilan, mulai menurun setelah usia kehamilan 12 -14 minggu dan mencapai kadar terendahnya pada saat aterm.7 Kepadatan sel mesenkim pada amnion menurun setelah trimester pertama kehamilan. Oleh karenanya peningkatan rasio antara sel epitel dan sel mesenkim merupakan suatu fungsi yang menggambarkan usia kehamilan. Perubahan pada komposisi matriks ekstraseluler dan selaput ketuban secara umum disebabkan oleh enzim yang mendegradasi matriks, yaitu utamanya kelompok enzim matriks metalloproteinase.
Pemeliharaan terhadap kemampuan daya regang selaput ketuban membutuhkan keseimbangan antara sintesis dan degradasi komponen-komponen matriks ekstraseluler. Perubahan pada selaput ketuban termasuk menurunnya kadar kolagen, perubahan struktur kolagen, dan peningkatan aktivitas kolagenolisis dikaitkan dengan ketuban pecah dini.2
8 Gambar 2.1 Skema Struktur Selaput Ketuban Aterm. 2
2.4 Patofisiologi Ketuban Pecah Dini
Secara fisiologis sepanjang kehamilan terjadi proses remodelling jaringan, berupa perubahan tipe dan komposisi kolagen serta perubahan pada matriks interseluler.
Remodelling ini penting untuk mengakomodasi perubahan tekanan dan volume
selaput ketuban selama berkembangnya kehamilan. Namun perubahan ini juga sekaligus menyebabkan pelemahan struktur selaput ketuban, yang lebih tampak nyata pada daerah internal servikal os.
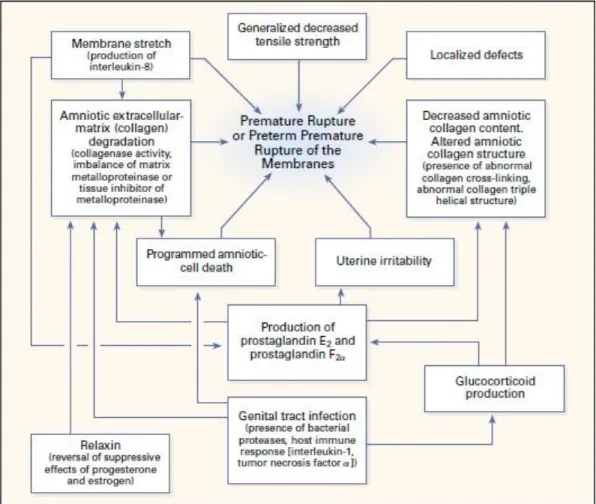
9 Kelemahan selaput ketuban dapat dipicu oleh paparan terhadap matrix metalloproteinase (MMP), penurunan kadar tissue inhibitors of matrix metalloproteinase (TIMP)serta peningkatan pemecahan poly (ADP-ribose) polymerase (PARP). Kontraksi uterus aterm atau preterm juga dapat menyebabkan pecahnya selaput ketuban akibat peningkatan tekanan secara mendadak yang disebabkan oleh peningkatan tekanan intraamniotik dan reflek mengedan.1
Gambar 2.2 Diagram Berbagai Mekanisme yang Diduga Berperan pada Kejadian Ketuban Pecah Dini. 2
10 Pada ketuban pecah dini preterm terdapat beberapa faktor yang menyebabkan kelemahan selaput terjadi lebih dini. Peningkatan sitokin lokal atau ketidakseimbangan antara MMP dan TIMP sebagai respon dari kolonisasi mikroba.6 Terdapat bukti spesifik yang mengaitkan antara infeksi saluran urogenital dengan ketuban pecah dini preterm. Hasil kultur cairan amnion setelah pecah ketuban seringkali menunjukkan hasil yang positif (25 hingga 35%), dan evaluasi histologi menunjukkan adanya reaksi peradangan akut dan kontaminasi bakteri pada korio-desidua. Patogen saluran genitalia yang dikaitkan dengan ketuba pecah dini adalah Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, dan group B β-hemolytic streptococcus.1
Efek fisik yang berkaitan dengan kontraksi prematur dan prolaps selaput ketuban dengan adanya dilatasi servik prematur merupakan predisposisi terjadinya pecah ketuban, begitupula peningkatan tekanan intrauterin seperti yang dapat dijumpai pada polihidramnion. Kelainan jaringan ikat tertentu (misalnya pada sindrom Ehlers-Danlos) dapat menyebabkan kelemahan selaput ketuban secara intrinsik. Faktor lain yang berkaitan dengan ketuban pecah dini preterm meliputi status sosial ekonomi yang rendah, ibu dengan BMI yang rendah (<19,8 kg/m2), defisiensi nutrisi (misalnya tembaga, asam askorbat) dan riwayat konisasi serviks. Selama kehamilan, merokok, sirklase serviks, riwayat kontraksi prematur, dan overdistensi uterus seperti pada polihidramnion dan kehamilan ganda dikaitkan dengan ketuban pecah dini preterm.1 Progesteron dan estradiol menekan proses remodeling matriks ektraseluler pada jaringan reproduktif. Kedua hormon ini dapat menurunkan konsentrasi MMP-1 dan MMP-3 serta meningkatkan konsentrasi
11 TIMP pada fibroblas serviks. Tingginya konsentrasi progesteron menyebabkan penurunan produksi kolagenase. Hormon relaxin diproduksi oleh sel desidua dan plasenta berfungsi mengatur pembentukan jaringan ikat, dan mempunyai aktivitas yang berlawanan dengan efek inhibisi oleh progesteron dan estradiol dengan meningkatkan aktivitas MMP-3 dan MMP-9 pada selaput ketuban.
Saat ini bukti dan penelitian terakhir menunjukkan pecahnya selaput ketuban tidak hanya berkaitan dengan faktor mekanis dan kimia namun di dalamnya berperan serta pula adanya proses kematian sel terprogram (apoptosis) dari sel-sel yang terdapat pada selaput ketuban, dimana peristiwa-peristiwa tersebut terjadi sebelum kontraksi muncul. Berbagai penelitian memberikan hasil yang konsisten bahwa selaput ketuban dari ibu hamil dengan ketuban pecah dini menunjukkan indeks apoptosis yang lebih tinggi dibandingkan dengan selaput ketuban dari persalinan aterm maupun preterm dengan selaput ketuban yang masih utuh.
2.5 Apoptosis
Apoptosis merupakan suatu mekanisme yang kompleks, melibatkan suatu kaskade pada tingkat molekuler. Apoptosis tidak memerlukan suatu proses transkripsi atau translasi. Molecular machine yang dibutuhkan untuk kematian sel dianggap hanya mengalami dormansi dan hanya diperlukan pengaktifan kembali yang cepat. Secara garis besar proses apoptosis dibagi menjadi 4 tahap, yaitu :
1. Adanya sinyal kematian (penginduksi apoptosis)
12 yang berhubungan)
3. Tahap pelaksanaan apoptosis (fragmentasi DNA, penguraian sel) 4. Fagositosis.
Berbagai pemicu intrinsik dan ekstrinsik dapat menginduksi terjadinya apoptosis, diantaranya stimulus yang menyebabkan cedera sel seperti radiasi dan radikal bebas (yang menyebabkan kerusakan DNA dan aktivasi p53), aktivasi intrinsik (misalnya pada saat embriogenesis), withdrawal dari growth factor, ligasi reseptor (misalnya FAS dan TNF) atau pelepasan granzyme oleh sel-T sitotoksik. Selanjutnya sinyal kematian dihubungkan dengan pelaksanaan apoptosis oleh tahap integrasi atau pengaturan. Pada tahap ini terdapat molekul regulator positif atau negatif yang dapat menghambat, atau memicu apoptosis, sehingga menentukan apakah sel tetap hidup atau mengalami apoptosis.8
Hingga saat ini para peneliti menemukan terdapat dua jalur / pathway utama apoptosis, yaitu jalur ekstrinsik (death receptor pathway) dan jalur intrinsik (mitochondrial pathway). Jalur ekstrinsik dipicu oleh pelepasan molekul signal yang disebut ligan oleh sel lain tetapi bukan berasal dari sel yang akan mengalami apoptosis. Ligan tersebut berikatan dengan death receptor yang terletak pada membran sel target yang kemudian menginduksi apoptosis. Sedangkan apoptosis jalur intrinsik diinduksi oleh stress mitokondria yang disebabkan oleh senyawa kimia atau withdrawal dari growth factor, sehingga menyebabkan gangguan pada mitokondria dan terjadi pelepasan sitokrom c. Bukti terakhir menyebutkan
13 sesungguhnya kedua jalur ini saling terkait dan molekul-molekul pada salah satu jalur dapat mempengaruhi jalur yang lain.
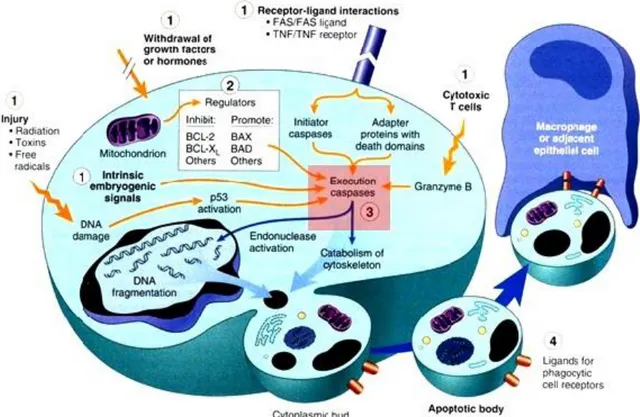
Gambar 2.3 Skema yang Menggambarkan Rangkaian Proses pada Apoptosis. 8 Label (1) adalah berbagai rangsangan yang dapat memicu apoptosis. Sebagian rangsangan (misalnya sel-T sitotoksik) secara langsung mengaktivasi caspase pada jalur eksekusi. sementara yang lainnya bekerja melalui protein adapter atau pelepasan sitokrom C oleh mitokondria. (2) adalah protein-protein regulator famili BCL-2 yang dapat mempromosikan maupun menghambat kematian sel. (3) adalah caspase eksekusi yang mengaktivasi endonuklease sitoplasma dan protease yang mengurai protein sitoskeletal dan nukleus. Hasil akhirnya adalah pembentukan apoptotic bodies yang mengandung organela intraseluler dan benda sitosol lainnya, apoptotic bodies ini mengekspresikan ligan baru (semisal fosfatidilserin) yang memperantarai pengikatan dan fagositosis oleh sel fagosit.
Selain dua jalur utama tersebut, terdapat pula jalur tambahan yang melibatkan sitotoksisitas yang dimediasi oleh sel T (T-cell mediated cytotoxity) dan kematian sel
14 yang tergantung perforin-granzyme (perforin-granzyme-dependent killing of the
cell). Jalur perforin-granzyme dapat menginduksi apoptosis melalui granzyme A atau
granzyme B. Jalur ekstrinsik, intrinsik dan granzyme B akan bertemu di satu titik terminal yang sama, yaitu tahap eksekusi. Tahap eksekusi dimulai dengan pembelahan caspase-3 dan menyebabkan fragmentasi DNA, degradasi protein-protein sitoskeletal dan inti sel, cross-linking protein-protein, pembentukan apoptotic body, ekspresi ligan baru yang memicu pembentukan reseptor sel fagosit dan akhirnya terjadi fagositosis oleh sel-sel fagosit. Jalur granzyme A sendiri mengaktivasi suatu jalur berbeda, yang tidak bergantung pada caspase (caspase independent pathway).
2.5.1 Jalur Ekstrinsik
Sinyal ekstrinsik yang memicu apoptosis melibatkan interaksi transmembran yang diperantarai oleh reseptor. Diantaranya termasuk death receptor yang merupakan bagian dari superfamili gen reseptor tumor necrosis factor (TNF). Anggota dari famili reseptor TNF memiliki domain ekstraseluler serupa yang kaya akan sistein, serta memiliki domain sitoplasmik yang terdiri dari 80 asam amino yang disebut
death domain. Death domain berperan untuk menyampaikan sinyal kematian dari
permukaan sel ke dalam jalur intraseluler. Saat ini ligan dan reseptor kematiannya yang berhubungan adalah diantaranya FasL / FasR, TNF-α, Apo3L / DR3, Apo2L/ DR4 dan Apo2L/ DR5.3
Setelah terjadi ikatan ligan, protein adapter pada sitoplasma yang memiliki
15 ligan Fas dengan reseptor Fas akan berlanjut dengan pengikatan protein adapter FADD sedangkan pengikatan ligan TNF dengan reseptor TNF akan mengakibatkan pengikatan protein adapter TRADD dan rekrutmen FADD dan RIP. FADD kemudian bergabung dengan procaspase-8 melalui dimerisasi domain death effector. Pada titik ini, terbentuk death-inducing signaling complex (DISC), mengakibatkan aktivasi autokatalitik procaspase-8. Setelah caspase-8 teraktivasi, fase eksekusi dari apoptosis akan dimulai. Apoptosis yang diperantarai oleh death receptor dapat dihambat oleh protein yang disebut c-FLIP yang akan berikatan dengan FADD dan caspase-8 sehingga keduanya menjadi inefektif.5
2.5.2 Jalur Intrinsik
Jalur intrinsik melibatkan beberapa proses yang berbeda yaitu adanya rangsangan yang menghasilkan sinyal intraseluler tanpa diperantarai reseptor, dan bekerja langsung pada target yang berada dalam sel dan juga proses yang dimulai dari dalam mitokondria. Rangsangan yang memicu jalur intrinsik menghasilkan sinyal intraseluler yang dapat bekerja secara positif maupun negatif. Sinyal negatif berupa penekanan beberapa growth factor, hormon dan sitokin yang berakibat pada kegagalan supresi program kematian, sehingga memicu apoptosis. Dengan kata lain, adanya withdrawal beberapa faktor, hilangnya supresi apoptosis dan aktivasi tahap apoptosis selanjutnya. Rangsangan lain yang bekerja secara positif termasuk diantaranya radiasi, toksin, hipoksia, hipertermia, infeksi virus dan radikal bebas. Kesemua rangsangan ini menyebabkan perubahan di dalam membran mitokondria
16 dengan efek berupa terbukanya pori mitochondrial permeability transition (MPT), hilangnya potensial transmembran mitokondria dan pelepasan dua kelompok utama protein pro-apoptosis dari ruang intermembran ke dalam sitosol.3
Kelompok pertama terdiri dari sitokrom c, Smac / DIABLO, dan protease serine HtrA2 / Omi. Protein-protein ini akan mengaktivasi jalur mitokodria yang bersifat caspase-dependent. Sitokrom c berikatan dan mengaktivasi Apaf-1 dan juga procaspase-9, membentuk suatu apoptosome dan caspase-9 menjadi aktif. Smac/ DIABLO dan HtrA2/ Omi menyebabkan apoptosis dengan cara menghambat aktivitas IAP (inhibitors of apoptosis proteins).3,5 Beberapa protein mitokondria juga telah diketahui dapat menghambat kerja IAP, namun dari beberapa penelitian menunjukkan bahwa pengikatan IAP semata tidak akan menyebabkan protein mitokondria menjadi pro-apoptosis.
Kelompok kedua protein pro-apoptosis adalah AIF, endonuklease G dan CAD, dilepaskan dari mitokondria selama apoptosis. Kerja AIF maupun endonuklease G bersifat caspase-independent. 3AIF mengalami translokasi ke dalam nukleus dan menyebabkan fragmentasi DNA dan kondensasi kromatin. Terbentuknya kondensasi nukleus ini disebut sebagai kondensasi tingkat I. Endonuklease G juga mengalami translokasi ke dalam nukleus dimana ia akan menyebabkan pembelahan kromatin nukleus menghasilkan fragmen DNA oligonukleosomal. CAD kemudian dilepaskan dari mitokondria dan mengalami translokasi ke nukleus, dimana setelah sebelumnya dipecah oleh caspase-3,
17 menyebabkan kondensasi kromatin oligonukleosomal. Kondensasi kromatin ini disebut sebagai kondensasi tingkat II.4
Pelepasan protein intermembran tersebut diatas diatur oleh protein-protein famili Bcl-2. Bukti terakhir menyebutkan bahwa protein yang bersifat proapoptosis dari famili ini menyebabkan peningkatan permeabilitas membran mitokondria tanpa menyebabkan kerusakan memran itu sendiri. Mekanise kerja lain protein famili Bcl-2 pada mitokondria adalah dengan mempengaruhi kadar Ca2+ yang dapat dilepaskan oleh retikulum endoplasma sehingga kadar Ca2+ dilepaskan dalam jumlah yang banyak untuk memenuhi mitokondria sehingga terjadi pecahnya membran mitokondria dan terlepasnya protein intermembran.3,4
2.5.3 Tahap Eksekusi
Baik jalur intrinsik dan ekstrinsik keduanya berakhir pada satu titik yang sama yaitu berupa tahap eksekusi, yang dianggap sebagai jalur akhir apoptosis. Aktivasi dari caspase eksekusi merupakan tahap yang memulai tahap ini. Caspase eksekusi mengaktifkan endonuklease sitoplasmik, yang akan mengurai material nukleus dan protease yang mengurai protein sitoskeletal dan nukleus. Caspase-3, caspase-6 dan caspase-7 berfungsi sebagai caspase eksekutor, membelah berbagai substrat termasuk sitokeratin, PARP, protein nuklear NuMA dan lain-lain, yang pada akhirnya akan menyebabkan perubahan morfologi dan biokimia seperti yang biasadiamati pada sel yang mengalami apoptosis.
18 Caspase-3 disebut sebagai caspase eksekutor yang paling penting, diaktifkan oleh caspase inisiator (caspase-8, caspase-9, caspase-10).5 Caspase-3 secara spesifik mengaktifkan endonuklease CAD. Pada sel yang sedang berproliferasi CAD membentuk kompleks dengan inhibitornya, ICAD. Pada sel yang mengalami apoptosis, caspase-3 yang telah teraktivasi membelah ICAD sehingga melepaskan CAD. CAD kemudian akan menguraikan kromosom DNA di dalam nukelus dan menyebabkan kondensasi kromatin, caspase-3 juga memicu reorganisasi sitoskeletal dan disintegrasi sel membentuk apoptotic bodies. Proses fagositosis merupakan tahap terakhir dari apoptosis. Asimetrisitas fosfolipid dan eksternalisasi fosfatidilserin pada permukaan sel yang mengalami apoptosis merupakan penanda fase ini. Adanya fosfatidilserin pada permukaan sel apoptotik memfasilitasi proses pengenalan fagositosis noninflamatorik dan berikutnya terjadi proses fagositosis oleh sel fagosit.3
2.5.4 Jalur Perforin / Granzyme
T-cell mediated cytotoxicity merupakan varian dari hipersensitivitas tipe IV dimana
sel CD8+ membunuh sel-sel yang mengandung antigen. Limfosit T sitotoksik mampu membunuh sel target melalui jalur ekstrinsik dan interaksi FasL/ FasR merupakan metode yang utama pada proses apoptosis yang diperantarai oleh Limfosit T sitotoksik ini. Namun efek sitotoksik terhadap sel tumor dan sel yang terinfeksi virus juga dapat terjadi melalui jalur lain yang melibatkan sekresi molekul perforin transmembran yang bersifat pore forming dan selanjutnya pelepasan granul
19 sitoplasma melalui pori yang terbentuk, menuju ke target sel. Protease serin granzyme A dan granzyme B adalah komponen terpenting di dalam granul-granul tersebut.3
Granzyme B akan memecah protein pada residu aspartat dan kemudian akan mengaktifkan pro caspase-10 yang akan memecah faktor-faktor seperti ICAD (Inhibitor of Caspase Activated DNAse). Laporan lain menyebutkan dapat menggunakan jalur mitokondrial untuk mengamplifikasi death signal dengan secara spesifik memecah Bid dan menginduksi pelepasan sitokrom c. Granzyme B dapat pula secara langsung mengaktivasi caspase-3.3 Kerja granzyme B melalui jalur mitokondrial dan juga aktivasi langsung caspase-3 adalah hal penting dalam proses pembunuhan sel yang diinduksi oleh granzyme B.
Granzyme A juga penting dalam proses apoptosis oleh sel T sitotoksik dan mengaktifkan jalur caspase independent. Di dalam sel granzyme A menyebabkan pemotongan DNA melalui DNAse NM23-H1, suatu produk dari gen tumor supresor. DNAse ini memiliki peranan penting dalam immune surveillance untuk mencegah kanker melalui induksi apoptosis pada sel tumor. Nukleosome yang menyusun protein SET secara fisiologis menghambat gen NM23-H1. Granzyme A protease memecah kompleks SET yang kemudian meyebabkan inhibisi NM23-H1, dengan hasil berupa degradasi DNA. Sebagai tambahan, selain menghambat MM23-H1, kompleks SET memiliki fungsi penting dalam struktur kromatin dan perbaikan DNA. 4,5
Protein-protein yang menyusun kompleks SET (SET, Ape1, pp32 dan HMG2) nampaknya bekerja bersama-sama untuk mempertahankan struktur kromatin dan
20 DNA. Sehingga inaktivasi kompleks ini oleh granzyme A akan berperan pada terjadinya apoptosis dengan menghambat usaha mempertahankan integritas struktur kromatin dan DNA.3
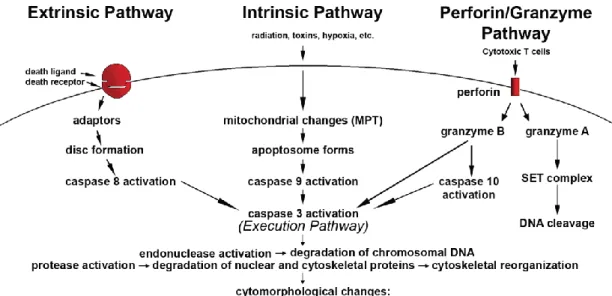
Gambar 2.4 Jalur pada Apoptosis. 3
Dua jalur utama apoptosis adalah ekstrinsik dan intrinsik juga jalur perforin/ granzyme. Masing-masing membutuhkan sinyal pemicu yang spesifik untuk memulai kaskade. Masing-Masing-masing jalur akan mengaktivasi caspase inisiatornya dan pada akhirnya akan mengaktifkan caspase eksekutor yaitu caspase-3. Kecuali granzyme A yang bekerja dengan tidak bergantung pada caspase. Jalur eksekusi akan menyebabkan munculnya gambaran khas sitomorfologi sel apoptotik, berupa pengerutan sel, kondensasi kromatin, pembentukan cytoplasmic bleb dan apoptotic bodies, dan pada akhirnya fagositosis apoptotic bodies oleh sel parenkim yang berdekatan, sel neoplastik ataupun makrofag.
2.6 Mekanisme Terjadinya Pecah Ketuban
Pecahnya selaput ketuban merupakan bagian integral dari onset dan perjalanan persalinan. Meskipun pecah ketuban biasanya terjadi akibat adanya kontraksi uterus, terdapat 10% kejadian pecah ketuban sebelum munculnya kontraksi uterus pada
21 kehamilan aterm dan 40% pada kehamilan preterm. Hal ini menunjukkan bahwa kekuatan kontraksi yang menyebabkan peregangan bukan merupakan faktor satu-satunya penyebab pecahnya selaput ketuban.2
Pecahnya selaput ketuban yang terjadi pada saat intrapartum disebabkan oleh penurunan kekuatan secara merata, pada seluruh bagian, akibat adanya kontraksi uterus dan peregangan yang berulang. Hal ini dibuktikan oleh percobaan Rangswamy dkk., yang menyimpulkan bahwa terdapat penurunan daya regang dari selaput ketuban yang sudah mengalami proses persalinan dibanding daya regang selaput ketuban yang belum mengalami proses persalinan.9
Kemudian muncul pertanyaan, apakah yang menyebabkan selaput ketuban pecah sebelum adanya kekuatan kontraksi? Berbagai penelitian yang telah dilakukan menemukan bahwa pada selaput ketuban yang pecah sebelum inpartu (ketuban pecah dini) ditemukan adanya defek yang bersifat fokal. Area yang berdekatan dengan lokasi ruptur dideskripsikan sebagai “restricted zone of extreme altered
morphology” yang ditandai oleh adanya pembengkakan dan kerusakan jaringan
fibriler kolagen pada masing-masing lapisan kompak, fibroblas dan lapisan berongga.10
2.6.1 Terbentuknya Paracervical Weak Zone pada Selaput Ketuban Aterm Model pada tikus percobaan menunjukkan bahwa amnion, sebagai komponen terkuat dari selaput ketuban, memiliki kekuatan 6-9 kali lebih kuat dibandingkan korion yang hanya berkontribusi sebesar 10-15 persen dari kekuatan
22 selaput ketuban.11 Penelitian oleh Lei dkk., menyimpulkan bahwa apoptosis dan degradasi matriks ekstraselluler pada selaput ketuban hewan coba tikus terjadi sebelum onset persalinan. Akibat dari kedua proses ini terjadi perubahan bentuk fisik amnion dari lembaran yang elastis menjadi jeli tidak berbentuk, sebelum onset persalinan akibat kematian sel epitel amnion dan juga lisis matriks kolagen di bawahnya.12 Akhirnya selaput ketuban menjadi semakin lemah dan semakin rentan untuk pecah mendekati akhir masa kehamilan.
Malak dan Bell pada tahun 1994 adalah yang pertamakali menemukan adanya sebuah area yang disebut dengan “high morphological change” pada selaput ketuban pada daerah di sekitar serviks. Daerah ini merupakan 2-10% dari keseluruhan permukaan selaput ketuban. Bell dan kawan-kawan kemudian lebih lanjut menemukan bahwa area ini ditandai dengan adanya peningkatan MMP-9, peningkatan apoptosis trofoblas, perbedaan ketebalan membran, dan peningkatan myofibroblas.10 Penelitian lain oleh Rangaswamy dkk. mendukung konsep
paracervical weak zone tersebut. Mereka menemukan bahwa selaput ketuban daerah
paraservikal pecah dengan hanya 20-50% dari kekuatan yang dibutuhkan untuk menimbulkan robekan di area selaput ketuban lainnya.9 Dengan menggunakan pemeriksaan histologi hematoksilin-eosin tampak gambaran perubahan yang sesuai dengan gambaran histologi khas apoptosis yang terutama terjadi pada daerah supraservikal.13 Berbagai penelitian tersebut mendukung konsep adanya perbedaan zona pada selaput ketuban, khususnya zona di sekitar serviks yang secara signifikan lebih lemah dibandingkan dengan zona lainnya seiring dengan terjadinya perubahan
23 pada susunan biokimia dan histologi. Paracervical weak zone ini telah muncul sebelum terjadinya pecah selaput ketuban dan berperan sebagai initial breakpoint.
2.6.2 Peran Apoptosis Pada Terbentuknya Paracervical Weak Zone
Proses apakah yang menyebabkan pemebentukan paracervical weak zone? Seperti yang telah diungkapkan sebelumnya, selain proses remodeling, ini berkaitan erat dengan proses apoptosis, dimana beberapa penelitian yang telah dilakukan mendukung teori ini. Penelitian oleh El Khwad menemukan adanya peningkatan MMP-9 dan cleaved PARP, serta penurunan TIMP-3 pada weak zone.14 Penelitian lain oleh Reti dan kolega menunjukkan bahwa selaput ketuban di daerah supraservikal menunjukkan peningkatan aktivitas petanda apoptosis yaitu cleaved-caspase-3, cleaved-caspase-9, dan penurunan Bcl-2. Metode lain untuk membuktikan adanya proses apoptosis dilakukan oleh Kataoka, dkk. dengan cara mengukur derajat fragmentasi DNA dengan densitometer. Didapatkan hasil laju apoptosis ditemukan lebih tinggi pada amnion dari pasien dengan ketuban pecah dini dibandingkan pasien tanpa ketuban pecah dini, dan laju apoptosis ditemukan paling tinggi pada daerah sekitar serviks dibandingkan dengan daerah fundus.15
Baik jalur intrinsik maupun ekstrinsik keduanya dapat menginduksi aktivasi caspase, namun Reti dkk. berpendapat bahwa jalur intrinsik merupakan jalur yang dominan berperan pada proses apoptosis pada selaput ketuban aterm. Hal ini dibuktikan dengan temuan penelitian mereka yang menyatakan bahwa terdapat perbedaan kadar yang signifikan pada Bcl-2, cleaved caspase-3, cleaved caspase-9
24 pada daerah supraservikal, dimana protein-protein tersebut merupakan protein yang berperan pada jalur intrinsik. Fas- dan ligannya, Fas-L menginisiasi apoptosis jalur ekstrinsik. Meskipun pada penelitian tersebut Fas dan Fas-L juga dapat ditemukan pada seluruh sampel selaput ketuban namun ekspresinya tidak berbeda bermakna antara daerah supraservikal dengan daerah distal. Karenanya diduga jalur ekstrinsik tidak berperan banyak pada remodelling selaput ketuban.13 Meskipun tidak ditemukan perbedaan yang bermakna pada ekspresi Bax, protein yang bersifat proapoptosis, namun protein antiapoptosis Bcl-2 ditemukan mengalami
downregulation pada daerah paraservikal dibandingkan dengan daerah lainnya. Hasil
lain yang mendukung bahwa jalur intrinsik berperan pada ketuban pecah dini didapatkan oleh Menon, dimana didapatkan peningkatan ekspresi gen proapoptosis, p53 dan penurunan ekspresi pada gen antiapoptosis Bcl-2 pada wanita dengan ketuban pecah dini.16 Penelitian oleh Suhaimi, menemukan hal yang sama bahwa dengan pemeriksaan ELISA didapatkan kadar protein p53 yang lebih tinggi pada pasien dengan ketuban pecah dini dibandingkan dengan pasien dengan persalinan normal.17 Perubahan ekspresi protein pro dan antiapoptosis pada daerah paraservikal menyebabkan kelemahan integritas struktur selaput ketuban dan meningkatkan risiko terjadinya pecah ketuban. Bersamaan dengan proses ini kemungkinan dapat juga terjadi proses inflamasi yang menyebabkan pelepasan sitokin dan aktivasi MMP.
25 2.6.3 Regulator Apoptosis Pada Selaput Ketuban
Seperti yang telah diungkapkan sebelumnya jalur intrinsik merupakan jalur yang dominan berperan pada proses apoptosis pada selaput ketuban aterm. Jalur intrinsik terpusat pada mitokondria, dengan regulator utamanya adalah famili protein Bcl-2.13 Protein-protein famili Bcl-2 dapat bersifat pro-apoptosis ataupun anti-apoptosis. Hingga saat ini dikenal 25 gen sebagai famili Bcl-2. Beberapa protein yang bersifat antiapoptosis termasuk Bcl-2, Bcl-x, Bcl-xL, Bcl-xS, Bcl-w, BAG, sedangkan yang bersifat proapoptosis termasuk Bcl-10, Bax, Bak, Bid, Bad, Bim, Bik dan Blk. Peran protein-protein ini sangat bermakna, karena dapat menentukan apakah sel ditujukan pada kematian atau dibatalkan prosesnya.
Protein-protein yang termasuk dalama anggota famili Bcl-2 memiliki kesamaan pada satu atau lebih karakter domain yang disebut dengan domain Bcl-2
homology (BH) (disebut BH1, BH2, BH3 dan BH4). Domain BH amat penting
dalam menjalankan fungsinya, misalnya delesi pada salah satu domain ini akan mempengaruhi laju apoptosis. Protein yang bersifat antiapoptosis seperti Bcl-2 dan Bcl-xL memiliki keempat domain BH. Perbedaan domain BH ini ini juga digunakan untuk membagi protein Bcl-2 yang bersifat proapoptosis menjadi protein yang mengandung beberapa domain BH (misalnya Bax dan Bak) atau yang hanya mengandung domain BH3 saja (misalnya Bim, Bid dan BAD). Tempat kerja utama protein-protein Bcl-2 ini adalah membran luar mitokondria. Dimana pada membran ini tersimpan faktor apoptogenik, yang apabila dilepaskan akan mengaktifkan eksekutor dari apoptosis, yaitu caspase. Protein apoptogenik yang dilepaskan ini
26 termasuk sitokrom c, Smac, Diablo, AIF dan endonuklease G. Smac, Diablo dan sitokrom C terlibat dalam aktivasi caspase. Sedangkan AIF dan endonukelase G berperan dalam menginduksi jalur apoptosis yang bersifat caspase-independent. Protein famili Bcl-2 yang bersifat antiapoptosis menghambat pelepasan faktor apoptogenik ini, sebaliknya anggota kelompok yang bersifat proapoptosis memicu pelepasan tersebut.18
Bukti terakhir menyebutkan bahwa protein yang bersifat proapoptosis dari famili ini bekerja dengan cara menyebabkan peningkatan permeabilitas membran mitokondria tanpa menyebabkan kerusakan membran itu sendiri. Kerja ini diperankan oleh Bax dan Bak. Bax dan Bak yang diaktivasi oleh Bid atau Bim membentuk pori lipid berukuran besar pada membran mitokondria. Mekanise kerja lain protein famili Bcl-2 pada mitokondria adalah dengan mempengaruhi kadar Ca2+ yang dapat dilepaskan oleh retikulum endoplasma sehingga kadar Ca2+ dilepaskan dalam jumlah yang banyak untuk memenuhi mitokondria sehingga terjadi pecahnya membran mitokondria dan terlepasnya faktor apoptogenik.19
Protein supresor tumor p53 memegang peranan penting dalam hal regulasi protein famili Bcl-2. p53 merupakan faktor transkripsi spesifik yang dapat diaktifkan oleh berbagai macam rangsangan stres seluler. Penemuan mengenai kemampuan p53 untuk dapat mempromosikan apoptosis terjadi 10 tahun sejak penemuan p53 pertamakali. Pada penelitian awal diperkirakan aktivitas proapoptosis p53 berkaitan dengan fungsinya sebagai faktor transkripsi. Satu dekade kemudian penelitian telah difokuskan untuk mengetahu target kerja p53 berkaitan dengan perannya pada
27 apoptosis. Saat ini telah diketahui bahwa fungsi utama p53 pada apoptosis adalah melalui regulasi aktivitas protein-protein famili Bcl-2, baik secara langsung maupun tidak langsung.20 Dari berbagai penelitian dapat ditemukan bahwa terdapat beberapa mekanisme hubungan antara p53 dan protein-protein famili Bcl-2. Mekanisme pertama hubungan antara p53 dan famili Bcl-2 adalah melalui salah satu anggota proteinnya yang bersifat proapoptosis, yaitu Bax. p53 secara langsung dapat menginduksi transkripsi Bax.21 Efek induksi Bax oleh p53 ini dapat menghambat efek antiapoptosis dari Bcl-2. Pada sel-sel yang sedikit mengandung Bax maka sel tersebut bersifat resisten terhadap apoptosis yang diperantarai oleh p53.20 Maka dapat dikatakan p53 dapat menentukan nasib sebuah sel dalam merespon suatu stres dengan cara mengatur rasio kadar protein Bax dibanding Bcl-2. p53 juga memiliki mekanisme lainnya dalam meregulasi Bcl-2, yaitu pada keadaan tertentu ia dapat menekan transkripsi Bcl-2. Selain itu p53 secara langsung dapat mempengaruhi aktivitas Bcl-2 dimana p53 sitoplasma sendiri akan berikatan dengan protein proaptosis dari famili Bcl-2 yang mengakibatkan peningkatan permeabilitas mitokondria dan akhirnya terjadi apoptosis.22 Jadi p53 dapat berperan secara langsung maupun tidak langsung dalam mengatur famili protein Bcl-2. Variasi mekanisme p53 dalam mengatur famili protein Bcl-2 ini dibutuhkan untuk menjamin efektifitasnya dalam menjalankan “mesin” kematian sel.
Dari literatur dan penelitian yang sudah dilakukan, sepengetahuan kami masih sangat terbatas penelitian yang memfokuskan bagaimana mekanisme pasti suatu agen atau stimulan dapat memicu apoptosis pada sel epitel amnion selaput
28 ketuban. Salah satu penelitian tersebut adalah yang dilakukan oleh Menon pada tahun 2011. Pada kesimpulan penelitiannya Menon menunjukkan bahwa merokok dapat menginduksi stres oksidatif dan apoptosis pada selaput ketuban, dan mekanisme pecah ketuban yang dipicu oleh merokok ini berbeda dengan mekanisme pecah ketuban dini yang disebabkan oleh infeksi.
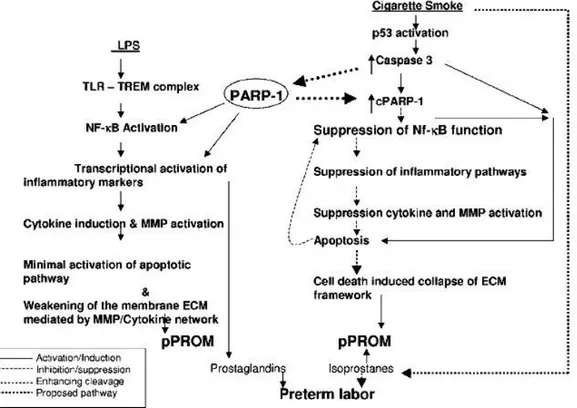
Gambar 2.5 Perbedaan Jalur Pecah Ketuban Dini Setelah Pemberian Stimulasi invitro Berupa Infeksi (LPS) dan Merokok.23
29
Pada percobaan ini Menon menggunakan bahan berupa selaput ketuban (amnion dan korion) yang didapat dari ibu hamil aterm paska seksio sesarea yang kemudian dibagi menjadi tiga kelompok. Kelompok pertama diberikan ekstrak asap dari rokok, kelompok kedua diberikan lipopolisakarida (LPS) dari Escherichia coli dan kelompok ketiga diberikan keduanya. Setelah pemberian stimulasi tersebut 24 jam kemudian dilakukan pemeriksaan petanda infeksi yaitu sitokin, TNF dan pemeriksaan MMP, serta pemeriksaan petanda apoptosis yaitu p53, caspase-3 dan cPARP-1. Disimpulkan bahwa infeksi (dalam hal ini diperankan oleh LPS) memperantarai pembentukan toll like receptor (TLR) dan tissue receptor of myeloid
cells (TREM) yang kemudian memicu proses inflamasi (peningkatan sitokin / MMP)
yang menyebabkan degradasi matriks ekstraseluler dan pecahnya selaput ketuban. Berikutnya persalinan preterm terjadi akibat perantara prostaglandin. Sedangkan pada asap rokok akan menyebabkan kerusakan DNA, stress oksidatif dan apoptosis yang menyebabkan pelemahan matriks ekstraseluler dan akhirnya pecah ketuban. Respon inflamasi dalam hal ini dihambat oleh pembelahan PARP-1 dan efek inhibisi langsung apoptosis terhadap NF-KB. Selanjutnya insisiasi persalinan preterm terjadi dengan diperantarai isoprostan.23
2.6.4 Interrelasi Apoptosis dan Aktivasi MMP pada Kejadian KPD
Perubahan morfologi pada daerah supraservikal yang telah dijelaskan sebelumnya sangat berkaitan dengan peningkatan aktivitas MMP dan apoptosis. Kekuatan dari selaput ketuban dan korion sebagian besar diperankan oleh kolagen. Kolagen I, III,
30 IV, V dan VI ditemukan pada berbagai lapisan amniokorion. Degradasi kolagen dikendalikan oleh matrix metalloproteinase yang memiliki spesifisitas berbeda untuk tiap tipe kolagen, matrix metallproteinase sendiri dapat dimodulasi oleh tissue
inhibitor of matrix metalloproteinases (TIMPs). Rasio MMP / TIMP pada kolagen
menentukan apakah kolagen tersebut akan mengalami degradasi atau tidak. Degradasi, yang diikuti dengan deposisi kolagen baru berupa fibroblas, menentukan hasil akhir kekuatan sebuah jaringan. 1, 2, 3, 8 dan MMP-9 telah ditemukan pada amniokorion. MMP-1 adalah MMP yang dominan sebelum dimulainya kontraksi. MMP-2 kadarnya menetap dan tidak berespon terhadap sitokin atau perubahan yang berkaitan dengan ketuban pecah dini preterm atau persalinan. Sedangkan bentuk aktif dan laten MMP-9 menunjukkan peningkatan kadar pada cairan ketuban pasien dengan ketuban pecah dini preterm dan persalinan yang diinduksi dengan sitokin. MMP-9 pada selaput ketuban juga dapat diinduksi oleh PGE2, PGF2α, TNF-α dan reactive oxygen species (ROS). TIMP-1 yang mengontrol aktivitas MMP-9 telah secara luas dipelajari pada selaput ketuban, dimana ditemukan kadarnya menurun pada ketuban pecah dini dan pada saat persalinan. Oleh karenanya disimpulkan bahwa MMP-9 memainkan peranan yang penting pada proses
remodelling, pelemahan dan pecahnya selaput ketuban. Kadar MMP-9 merupakan
petanda kekuatan selaput ketuban yang sangat baik.24
Aktivasi MMP dan apoptosis seringkali bersifat interrelasi / saling mempengaruhi. Matriks ekstraseluler berperan utama sebagai faktor penyeimbang pada banyak sistem jaringan. Stabilitas ini menjadi terganggu apabila aktivasi MMP
31 mengakibatkan kerusakan matriks ekstraseluler dan menyebabkan apoptosis. MMP juga dapat menginduksi terjadinya apoptosis melalui pemecahan sitokin yang terikat membran, termasuk TNF-α dan FasL. Apoptosis dapat juga menginduksi aktivasi MMP, sebagai tambahan, agen yang dapat menyebabkan apoptosis pada jaringan selaput ketuban juga dapat mengaktivasi dan meningkatkan transkripsi MMP, khususnya MMP-1, MMP-9. Dilaporkan pula bahwa terjadinya peningkatan prostaglandin dengan induksi apoptosis pada epitel amnion dan mesenkim oleh agen apoptosis non-fisiologis (actinomycin D, cycloheximide, staurosporin) dan fisiologis (ceramide, lactosylceramide, metabolit PGJ2). Prostaglandin juga menginduksi transkripsi dan mengaktivasi MMP pada kebanyakan jaringan. Proses apoptosis berpotensi melemahkan selaput ketuban dengan mengeliminasi sel fibroblast, yang berfungsi menyusun kolagen baru, dan secara simultan mengaktivasi sistem enzim yang mengurai kolagen yang ada. Aktivasi MMP selanjutnya akan meningkatkan apoptosis, yang secara simultan memberikan umpan balik berupa peningkatan lebih banyak lagi aktivasi MMP. Aktivasi MMP dan apoptosis telah menunjukkan kerja yang bersifat sinergis untuk menyebabkan terjadinya pecah ketuban.
Mekanisme fisiologis yang menginisiasi aktivasi MMP dan apoptosis pada selaput ketuban masih belum banyak diketahui. Banyak zat yang terkandung dalam cairan ketuban yang jumlahnya semakin meningkat seiring dengan bertambanya usia kehamilan, atau akibat infeksi, atau karena pecah ketuban (TNF-α, IL-1ß, lactosylceramide, dan lain-lain) menyebabkan apoptosis pada sel yang didapatkan
32 dari selaput ketuban yang masih intak. Sebagian besar agen apoptosis ini juga menyebabkan peningkatan atau aktivasi MMP, khususnya MMP-9.24
2.7 Pencegahan Pelemahan dan Pecahnya Selaput Ketuban
Terdapat optimisme pada para peneliti bahwa pelemahan prematur pada selaput ketuban dapat dicegah. Untuk dapat diterima secara medis dan etika semua penelitian yang dilakukan wanita hamil untuk mencegah pelemahan selaput ketuban harus benar-benar tidak berbahaya dan dilakukan pada wanita yang benar-benar memiliki risiko untuk terjadinya pecah ketuban dini preterm. Untuk itu kelompok wanita berisiko itu harus dapat diidentifikasi terlebih dahulu.
Kelahiran preterm spontan akibat persalinan preterm atau pecah ketuban dini berkaitan dengan berbagai macam kondisi klinis dan juga temuan abnormal pada pemeriksaan penunjang (misalnya panjang serviks yang pendek pada pemeriksaan sonografi transvaginal, hasil positif pada penapisan fetal fibronectin servikovaginal). Namun seringkali pemeriksaan ini memiliki sensitifitas dan spesifitas yang kurang baik apabila diterapkan pada wanita yang asimtomatik.25 Sehingga masih sulit untuk mengidentifikasi wanita mana yang akan mengalami pecah ketuban dini sebelum hal itu terjadi. Penelitian lain menunjukkan bahwa kelompok ras afrika amerika, kelompok dengan insiden yang tinggi untuk terjadinya ketuban pecah dini, memiliki insiden yang lebih tinggi adanya polimorfisme berupa MMP dan sitokin proinflamasi yang lebih aktif.26 Sehingga sangat dimungkinkan dan dibenarkan untuk melakukan penelitian pada kelompok wanita ini yang telah membawa risiko secara genetika.
33 Tanpa adanya faktor risiko atau risiko minimal, pemberian vitamin C atau kombinasi dengan vitamin E telah disarankan untuk dapat mencegah ketuban pecah dini preterm, hal ini berkaitan dengan efek keduanya sebagai antioksidan.27 Namun terdapat keraguan mengenai apakah vitamin C dapat meningkatkan atau menurunan apoptosis bergantung pada sistem sel, dosis dan adanya ko-efektor. Dapat ditunjukkan bahwa vitamin C tidak menghambat apoptosis dan mungkin justru mengeksaserbasi apoptosis yang diinduksi H2O2 pada kultur sel amnion. Terdapat tiga penelitan besar yang menunjukkan bahwa terjadi peningkatan kejadian ketuban pecah dini baik pada aterm ataupun preterm pada kelompok yang diberikan suplementasi vitamin.28,29,30 Peringatan khusus telah disertakan pada penelitian-penelitian tersebut mengenai penggunaan vitamin C/ E setidaknya mengenai dosis yang digunakan. Berdasarkan penelitian oleh Rangaswamy dkk, pada percobaan in vitro vitamin C tidak mencegah pelemahan selaput ketuban yang diperantarai oleh TNF-α, bahkan vitamin C dosis tinggi dapat secara nyata meningkatkan aktivitas MMP-9 dan melemahkan selaput ketuban.9 Dari peneliti yang sama sebaliknya ditemukan bahwa asam lipoat (lipoic acid) dengan kemampuan antioksidan dan inhibisi NFkB yang dimilikinya dapat mencegah pelemahan selaput ketuban yang diperantarai oleh TNF-α, serta sekaligus mencegah peningkatan MMP-9 dan PGE2.9 Asam lipoat merupakan kandidat yang menjanjikan untuk digunakan secara klinis dalam pencegahan pecah ketuban dini preterm. Berbagai uji klinik tengah dijalani oleh asam lipoat dengan tanpa adanya efek samping buruk yang dilaporkan, meskipun uji klinik ini belum dilakukan pada wanita hamil. Namun uji toksisitas
34 pada hewan mencit hamil memberikan hasil yang menggembirakan. Penggunaan asam lipoat pada ibu hamil masih memerlukan berbagai ujicoba termasuk untuk memastikan bagaimana mekanisme pasti asam lipoat dalam pencegahan pelemahan selaput ketuban.
35 BAB III
RINGKASAN
Ketuban pecah dini didefinisikan sebagai pecahnya selaput ketuban sebelum proses persalinan dimulai. Sedangkan pecahnya selaput ketuban sebelum usia kehamilan 37 minggu disebut sebagai ketuban pecah dini preterm (preterm premature rupture of
membrane / PPROM). Meskipun pecah ketuban biasanya terjadi akibat adanya
kontraksi uterus, terdapat 10% kejadian pecah ketuban sebelum munculnya kontraksi uterus pada kehamilan aterm dan 1% pada kehamilan preterm. Hal ini menunjukkan bahwa kekuatan kontraksi yang menyebabkan peregangan bukan merupakan faktor satu-satunya penyebab pecahnya selaput ketuban. Terdapat perubahan yang menyebabkan pelemahan struktur selaput ketuban yang nyata diluar remodelling yang fisiologi.
Pada selaput ketuban yang pecah sebelum inpartu (ketuban pecah dini) defek yang ditemukan lebih bersifat fokal dan dideskripsikan sebagai “restricted
zone of extreme altered morphology”. Zona ini secara histologi ditandai oleh adanya
pembengkakan dan kerusakan jaringan fibriler kolagen pada masing-masing lapisan kompak, fibroblas dan lapisan berongga. Zona ini ditemukan pada daerah selaput ketuban supraservikal yang muncul sebelum terjadinya pecah selaput ketuban. Secara fisika selaput ketuban pada daerah ini memiliki kekuatan yang jauh lebih rendah dibandingkan dengan area lainnya dan berperan sebagai initial breakpoint.
36 Perubahan morfologi pada daerah supraservikal ini sangat berkaitan dengan peningkatan aktivitas MMP dan apoptosis. Apoptosis merupakan bagian yang normal dari perkembangan dan pemeliharaan dari suatu organisme multiseluler. Kematian sel ini merupakan respon terhadap berbagai stimulus, baik intrinsik maupun ekstrinsik. Apoptosis terjadi melalui dua jalur utama, yaitu jalur intrinsik dan ekstrinsik. Jalur intrinsik merupakan jalur yang dominan berperan pada proses apoptosis pada selaput ketuban aterm. Jalur intrinsik terpusat pada mitokondria, dengan regulator utamanya adalah famili protein Bcl-2. Protein-protein famili Bcl-2 dapat bersifat pro-apoptosis ataupun anti-apoptosis. Tempat kerja utama protein-protein Bcl-2 ini adalah membran luar mitokondria. Dimana pada membran ini tersimpan faktor apoptogenik (sitokrom c, Smac, Diablo, AIF dan endonuklease G), yang apabila dilepaskan akan mengaktifkan eksekutor dari apoptosis, yaitu caspase. Protein famili Bcl-2 yang bersifat antiapoptosis menghambat pelepasan faktor apoptogenik ini, sebaliknya anggota kelompok yang bersifat proapoptosis memicu pelepasan tersebut.
Apoptosis dan degradasi matriks ekstraselluler pada selaput ketuban menyebabkan perubahan bentuk fisik amnion dari lembaran yang elastis menjadi jeli tidak berbentuk, sebelum onset persalinan. Akhirnya selaput ketuban menjadi semakin lemah dan semakin rentan untuk pecah.
37 DAFTAR PUSTAKA
1. Mercer BM. Premature Rupture of Membrane. In : (Creasy RK, Resnik R, Iams JD, Lockwood CJ, Moore TR) Creasy & Resnik’s Maternal-Fetal Medicine, 6th edition, Saunders Elsevier ; 2009: 599-612
2. Parry S, Strauss JF. Premature Rupture of Membrane. The New England Journal
of Medical 2006; 338 (10) : 663-70
3. Elmore S. Apoptosis : A Review of Programmed Cell Death. Toxicologic
Pathology 2007: 35:495–516
4. Saglam A, Ozgur C, Derwig E, et al. The Role of Apoptosis in Preterm Premature Rupture of the Human Fetal Membranes. Arch Gynecol Obstet 2013; 288 (3) : 501-5
5. Fortunato SJ, Menon R, Bryant C. Programmed Cell Death (Apoptosis) as a Possible Pathway to Metalloproteinase Activation and Fetal Membrane Degradation in Premature Rupture of Membranes. Am J Obstet Gynecol 2000 ; 182 (6) : 1468-76
6. Menon R, Fortunato SJ. The Role of Matrix Degrading Enzymes and Apoptosis in Rupture of Membrane. J Soc Gynecol Investig 2004 ; 11(7): 427-37
7. Strauss JF. Extracellular Matrix Dynamics and Fetal Membrane Rupture.
Reproductive Sciences 2003 ; 20(2) 140-153
8. Kumar V, Abbas AK, Fausto N. Neoplasia. In : Robbins and Cotran Pathology Basis of Disease, 7th edition. Saunders Elsevier ; 2005 : 1041-52
9. Rangaswamy N, Kumar D, Moore RM, et al. Weakening and Rupture of Human Fetal Membranes – Biochemistry and Biomechanics. In : (Morrison J, ed) Preterm Birth – Mother and Child, Intech : 2012; 152-82
38 10. McLaren J, Malak TM, Bell SC. Structural Characteristics of Term Human Fetal Membranes Prior to Labour: Identification of an Area of Altered Morphology Overlying the Cervix. Human Reproduction 1999; 14(1) : 237–241
11. Oxlund H, Helmig R, Halaburt JT, et al. Biomechanical Analysis of Human Chorioamniotic Membranes. Eur J Obstet Gynecol Reprod Biol 1990 ; 34 : 247– 255
12. Lei H, Furth E, Kalluri R, et al. Program of Cell Death and Extracellular Matrix Degradation Is Activated in the Amnion before the Onset of Labor. J Clin Invest 1996 ;98 : 1971-8.
13. Reti NG, Lappas M, Riley C, et al. Why do membranes rupture at term? Evidence of Increased Cellular Apoptosis in the Supracervical Fetal Membranes.
Am J Obstet Gynecol 2007 ; 196 : 484.e1-484.e10
14. El Khwad M, Stetze B, Moore RM, et al. Term Human Fetal Membranes Have a Weak Zone Overlying the Lower Uterine Pole and Cervix Before Onset of Labor. Biology of Reproduction 2005; 72:720-26
15. Kataoka S, Furuta I, Yamada H, et al. Increased Apoptosis of Human Fetal Membranes in Rupture of the Membranes and Chorioamnionitis. Placenta 2002 ; 23 : 224–231
16. Fortunato S, Menon R. Distinct Molecular Events Suggest Different Pathways for Preterm Labor and Premature Rupture of Membranes. Am J Obstet Gynecol 2001 ; 1399-1406
17. Suhaimi, D. Protein p53 Sebagai Faktor Risiko Terjadinya Ketuban Pecah Dini.
Indonesian Journal of Applied Sciences 2012 ; 2 (2) ;83-85
18. Tsujimoto Y. Bcl-2 Family of Proteins: Life-or-Death Switch in Mitochondria. Bioscience Reports 2002 ; 22 (1) : 1-12
19. Kuwana T, Newmeyer D. Bcl-2-family Proteins and the Role of Mitochondria in Apoptosis. Current Opinion in Cell Biology 2003; 15:1–9
39 20. Hemann MT, Lowe SW. The p53-Bcl-2 Connection. Cell Death and
Differentiation 2006 ; 13 : 1256-59
21. Miyashita T, Reed J. Tumor Supressor p53 is a Directional Transcriptional Activator of the Human bax Gene.Cell 1995 ; 80 : 293-299
22. Moll U, Wolff S, Speidel D, et al. Transcription-independent Pro-apoptotic Functions of p53. Current Opinion in Cell Biology 2005 ; 17:1–6
23. Menon R, Fortunato SJ. Distinct Pathophysiologic Pathways Induced by in vitro Infection and Cigarette Smoke in Normal Human Fetal Membranes. Am J Obstet Gynecol 2009;200:334.e1-334.e8.
24. Kumar D, Fung W, Moore RM, et al. Proinflammatory Cytokines Found in Amniotic Fluid Induce Collagen Remodeling, Apoptosis, and Biophysical Weakening of Cultured Human Fetal Membranes. Biology of Reproduction 2006 ; 74 : 29-34
25. Mercer BM. Preterm Premature Rupture of the Membranes. In : High Risk Pregnancy Series : An Expert Review, Elsevier ; 2003 ; 101(1) : 178-93
26. Hernandez-Guerrero C, Monzon-Bordonaba F, Jimenez-Zamudio L, et al. In-vitro Secretion of Proinflammatory Cytokines by Human Amniochorion Carrying Hyper-responsive Gene Polymorphisms of Tumour Necrosis Factor-α and Interleukin-1ß. Molecular Human Reproduction 2003 ; 9(10) : 625-29 27. Casanueva E, Ripoll C, Tolentino M, et al. Vitamin C Supplementation to
Prevent Premature Rupture of the Chorioamniotic Membranes: a Randomized Trial. Am J Clin Nutr 2005 ; 81: 859–63.
28. Hauth JC, Clifton RG, Roberts JM, et al. Vitamin C and E Supplementation to Prevent Spontaneous Preterm Birth. Obstet Gynecol. 2010 ; 116(3) : 653–658 29. Xu H, Perez-Cuevas R, Xiong X, et al. An International Trial of Antioxidants in
the Prevention of Preeclampsia (INTAPP). Am J Obstet Gynecol 2010 ; 202 : 239.e1-10.
40 30. Spinnato JA II, Freire S, Pinto e Silva JL, et al. Antioxidant Supplementation and Premature Rupture of the Membranes: a Planned Secondary Analysis. Am J