SKRIPSI
KEMAMPUAN BERTAHAN SALMONELLA SELAMA PROSES PEMBEKUAN ES
Oleh : FITRI YULIATIN
F24103018
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Fitri Yuliatin. F24103018. Kemampuan Bertahan Salmonella Selama Proses Pembekuan Es. Di bawah bimbingan: Dr. Ir. Ratih Dewanti-Hariyadi, MSc.
RINGKASAN
Penyakit akibat Pangan (PAP) merupakan masalah kesehatan masyarakat yang utama di semua negara, termasuk Indonesia. Berdasarkan laporan Jejaring Intelijen Pangan (2004) Salmonella, E. coli, dan Clostridium botulinum sering tercatat pada kasus-kasus penyakit karena pangan baik di Negara industri maupun Negara berkembang. Keamanan es batu dan minuman es merupakan hal penting yang harus diperhatikan. Penelitian yang dilakukan oleh kelompok studi TIFOID di daerah Jatinegara, Jakarta melaporkan bahwa konsumsi minuman es berhubungan signifikan dengan demam tifus dan paratifus (JIP, 2004). Penelitian Supali (2001) menunjukkan prevalensi karier Salmonella Typhi dan Paratyphi pada pedagang es keliling di Kodya Semarang mencapai 2,3%. Sebanyak 87,2% air yang digunakan untuk memproduksi es positif terkontaminasi E. coli dalam kadar yang jauh melebihi ambang batas yang diperkenankan, sedangkan produk es yang terkontaminasi E. coli mencapai 46,4%.
Penelitian ini bertujuan untuk mengetahui kemampuan bertahan beberapa galur bakteri patogen Salmonella selama proses pembekuan es. Galur Salmonella yang digunakan terdiri atas Salmonella Enteritidis, Salmonella Paratyphi, Salmonella Lexington, dan campuran antara ketiga galur tersebut (Koktil Salmonella). Metode penelitian mencakup tahap konfirmasi kultur Salmonella, penyegaran dan pengawetan kultur, persiapan inokulum, pembuatan es, inokulasi kultur, dan evaluasi kemampuan bertahan Salmonella pada es. Es yang dibuat terdiri dari tiga jenis yaitu es batu, es mambo dan es susu. Kultur Salmonella yang diinokulasikan terdiri dari dua konsentrasi yaitu 3 log CFU/ml dan 5 log CFU/ml. Es dibekukan pada kisaran suhu -20oC sampai -25oC. Kultur yang telah diinokulasikan pada es dihitung jumlahnya dalam interval waktu pembekuan tertentu yaitu pada 0 jam, 24 jam, dan 48 jam.
Kemampuan bertahan ketiga galur dan Koktil Salmonella terlebih dahulu diujikan pada es batu. Hasil penelitian menunjukkan bahwa ketiga galur dan Koktil Salmonella memiliki perilaku yang sama selama proses pembekuan, yaitu mengalami penurunan. Penurunan jumlah sel tertinggi terjadi pada galur Salmonella Paratyphi. Sel Salmonella yang tumbuh pada media NA adalah sel yang sehat dan sel yang mengalami kerusakan subletal sedangkan pada media HEA sel yang tumbuh adalah sel yang sehat saja. Pada konsentrasi inokulum awal 3 log CFU/ml, penurunan jumlah Salmonella Paratyphi pada media NA sebesar 0,0167 log CFU/ml per jam sedangkan pada media HEA sebesar 0,0183 log CFU/ml per jam. Pada konsentrasi inokulum awal 5 log CFU/ml, penurunan jumlah Salmonella Paratyphi sebesar 0,0083 log CFU/ml per jam pada media NA dan sebesar 0,0133 log CFU/ml per jam pada media HEA. Penurunan sel terjadi karena sel mengalami kematian karena pengaruh pembekuan. Hasil penelitian menunjukkan bahwa Salmonella Paratyphi paling rentan terhadap pembekuan dibandingkan dua galur uji lainnya.
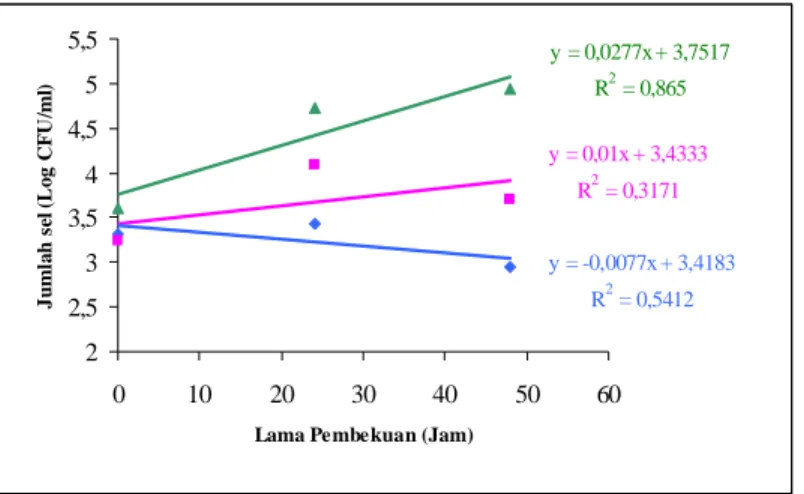
Hasil uji kemampuan bertahan Koktil Salmonella pada es batu, es mambo, dan es susu menunjukkan terjadinya peningkatan jumlah Koktil Salmonella pada es mambo dan es susu namun terjadi penurunan pada es batu. Peningkatan jumlah Koktil Salmonella pada es susu lebih tinggi dibandingkan pada es mambo yaitu sebesar 0,0277 log CFU/ml per jam pada media NA dan 0,019 log CFU/ml per jam pada media HEA untuk konsentrasi inokulum 3 log CFU/ml. Sementara itu untuk konsentrasi inokulum 5 log CFU/ml, laju kenaikan jumlah Koktil Salmonella sebesar 0,0154 log CFU/ml per jam pada media NA dan 0,0006 log CFU/ml per jam pada media HEA. Hasil penelitian ini menunjukkan bahwa kandungan nutrisi pada produk es sangat mempengaruhi ketahanan sel selama proses pembekuan.
Baik untuk konsentrasi inokulum awal 3 log CFU/ml maupun 5 log CFU/ml, tingkat kerusakan subletal yang terjadi pada ketiga galur Salmonella yang dibekukan pada es batu dan Koktil Salmonella yang dibekukan pada es batu, es mambo dan es susu tidak mencapai 1 log CFU/ml. Hal ini menunjukkan bahwa Salmonella cukup resisten selama proses pembekuan.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KEMAMPUAN BERTAHAN SALMONELLA SELAMA PROSES PEMBEKUAN ES
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu Dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh : Fitri Yuliatin
F24103018
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KEMAMPUAN BERTAHAN SALMONELLA SELAMA PROSES PEMBEKUAN ES
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu Dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh : Fitri Yuliatin
F24103018
Dilahirkan pada tanggal 17 Juli 1985 Di Ponorogo, Jawa Timur Tanggal lulus : Januari 2008
Menyetujui,
Dr. Ir. Ratih Dewanti-Hariyadi, MSc. Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah, MSc. Ketua Departemen ITP
RIWAYAT HIDUP
Penulis bernama lengkap Fitri Yuliatin. Penulis adalah anak kedua dari Bapak Tukiran dan Ibu Karimah yang dilahirkan di Ponorogo pada tanggal 17 Juli 1985. Penulis menempuh pendidikan dasar di SDN Winong II Jetis (1991–1997), pendidikan menengah pertama di SLTPN 1 Jetis (1997– 2000) dan pendidikan menengah lanjutan di SMUN 1 Ponorogo (2001–2003). Penulis diterima di Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor melalui jalur USMI pada tahun 2003.
Selama mengikuti perkuliahan penulis aktif di DKM Al Hurriyyah divisi Pembinaan Umat (Islamic Student Center) periode 2005-2007 dan LDF Forum Bina Islami Fateta (2005). Selain itu penulis aktif dalam berbagai kepanitiaan antara lain Masa Orientasi Mahasiswa Fateta (Techno-F 2005), Lepas Landas Sarjana Fateta (LLS Fateta 2005), Masa Orientasi Mahasiswa TPG (BAUR 2005), dll. Penulis juga aktif dalam kegiatan Program Kreativitas Mahasiswa. Salah satu proposal PKM bidang penelitian yang berjudul ”Pembuatan Madumongso plus, Makanan Khas Daerah dengan Penambahan Serat Bekatul” didanai oleh DIKTI. Penulis juga pernah menjadi asisten praktikum mata kuliah Pendidikan Agama Islam (2005-2006) dan mata kuliah Mikrobiologi Pangan (2007).
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, penulis melakukan penelitian yang berjudul ”Kemampuan Bertahan Salmonella Selama Proses Pembekuan Es” di bawah bimbingan Dr. Ir. Ratih Dewanti-Hariyadi, MSc.
KATA PENGANTAR
Bismillahirrahmanirrahim.
Segala puji dan syukur penulis panjatkan kepada sumber ilmu pengetahuan -Allah SWT- yang telah memberikan berkah dan hidayah-Nya sehingga penulis dapat menyelesaikan kuliah di Departemen Ilmu dan Teknologi Pangan dan menyusun skripsi ini dengan baik. Shalawat dan salam semoga selalu tercurahkan kepada Nabi Besar Muhammad SAW yang menjadi teladan selama ini.
Terima kasih yang sebesar-besarnya dan penghargaan yang dalam penulis sampaikan pada semua pihak yang telah banyak membantu penyelesaian skripsi ini yaitu:
1. Bapak, Ibu, dan kakak tercinta, atas doa, kepercayaan, dan kasih sayang yang senantiasa tercurahkan tiada henti.
2. Dr. Ir. Ratih Dewanti-Hariyadi, MSc selaku dosen pembimbing atas bimbingan, wawasan, motivasi dan dukungan yang selalu diberikan kepada penulis.
3. Dra. Suliantari, MS dan Dr.Ir. Dede Robiatul Adawiyah, Msi selaku dosen penguji yang telah memberikan saran dan masukan untuk penyempurnaan skripsi ini.
4. Seluruh dosen dan staf Departemen Teknologi Pangan dan Gizi yang telah memberikan ilmu dan mendukung kemajuan penulis.
5. Sofah, Mbak Ari, Pak Gatot, Pak Rozak, Pak Koko, Abah, Ibu Entin, Ibu Rohana, dan seluruh teknisi Lab. yang telah banyak membantu penulis. 6. Pustakawan-pustakawan perpustakaan Fateta, PAU, dan LSI. Terimakasih
atas segala bantuannya.
7. Teman-teman ITP 40, teman-teman sebimbingan (Indah, Chusni, Adi), Mbak asih, Equs, Dhani, Primus, Bos, Maya, Lala, Hany, Angel, Lina, Hayuning, Teteh, Tilo, Lichan, Marto, Rahmat, Fauzan, Helmi, Santo, Sarwo. Terimakasih atas persahabatan dan dukungannya selama ini.
8. Pembina dan pengurus Lembaga Amil Zakat Al-Hurriyyah (Bapak Arif Hartoyo, Kak Fauzan, Kak Imam, dan Kak Rudi). Terimakasih atas bantuan dan motivasinya.
9. Teman-teman BSP (Best Student Program) LAZ Al-Hurriyyah (Rika, Eni, Amel, Ariz plus Hadi, Arofik, Adi Bone, Marto, dan Mada). Sungguh persahabatan ini tulus karenaNya.
10. Teman-teman LDF se-IPB, terutama FBI Fateta, Keluarga Ramadhan 1&2 (Esti, Lala, Hany, mba Ari, mbak Leni, mba Siti, mba Dhenok, mba Ummi, Dhani, Erven, Anis, Uyui, Irma), Murtaqi dan Diah. Terimakasih atas kebersamaan dan bantuannya selama ini.
11. Pihak-pihak yang tidak dapat disebutkan satu per satu. Terimakasih yang sebesar-besarnya atas bantuan yang diberikan.
Penulis menyadari bahwa masih banyak kekurangan dalam skripsi ini, oleh sebab itu masukan dan kritik yang membangun selalu penulis tunggu. Semoga skripsi ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, 30 Januari 2008
DAFTAR ISI Halaman ABSTRAK... HALAMAN PENGESAHAN... RIWAYAT HIDUP... KATA PENGANTAR... DAFTAR ISI... DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... I. PENDAHULUAN... A. LATAR BELAKANG... B. TUJUAN PENELITIAN... II. TINJAUAN PUSTAKA... A. ES... 1. Sifat Fisik dan Struktur Es... 2. Mikrobiologi Es... B. PEMBEKUAN... 1. Jenis Pembekuan... 2. Perubahan Fisik dan Mikrobiologis Bahan Pangan Selama Pembekuan... C. PENGARUH PEMBEKUAN TERHADAP SEL ORGANISME... 1. Cold Shock Proteins... 2. Kerusakan Subletal... 3. Penyembuhan dan Perhitungan Sel yang Mengalami Kerusakan Subletal... D. SALMONELLA... 1. Karakteristik Salmonella... 2. Salmonella Pada Produk Pangan Bersuhu Rendah... E. SALMONELLOSIS...
III METODOLOGI PENELITIAN... A. BAHAN DAN ALAT... B. METODE PENELITIAN... 1. Konfirmasi Kultur Salmonella... 2. Penyegaran dan Pengawetan Kultur... 3. Persiapan Inokulum... 4. Pembuatan Es dan Inokulasi Kultur... 5. Evaluasi Kemampuan Bertahan Salmonella... IV HASIL DAN PEMBAHASAN... A. KONFIRMASI KULTUR SALMONELLA... B. KEMAMPUAN BERTAHAN GALUR SALMONELLA PADA ES BATU... 1. Perilaku Galur Salmonella Selama Proses Pembekuan Es Batu... 2. Kerusakan Subletal Galur Salmonella Selama Proses Pembekuan Es Batu... C. KEMAMPUAN BERTAHAN KOKTIL LA PADA ES BATU, ES MAMBO, DAN ES SUSU... 1. Perilaku Koktil Salmonella Selama Proses an Es Batu, Es Mambo, dan Es Susu... 2. Kerusakan Subletal koktil Salmonella Selama Proses Pembekuan Es Batu, Es Mambo, dan Es Susu... V. KESIMPULAN DAN SARAN... A. KESIMPULAN... B. SARAN... DAFTAR PUSTAKA... LAMPIRAN...
DAFTAR TABEL
Halaman Tabel 1. Keracunan pangan karena konsumsi produk es...
Tabel 2. Perbandingan antara pembekuan cepat dan pembekuan lambat... Tabel 3. Distribusi serovar dalam genus Salmonella... Tabel 4. Kemampuan bertahan berbagai serovar Salmonella pada suhu pembekuan... Tabel 5. Kemampuan bertahan kultur murni organisme enterik pada
DAFTAR GAMBAR
Halaman Gambar 1. Penurunan jumlah Salmonella (inokulum awal 3 log CFU/ml)
selama pembekuan es batu pada media NA... Gambar 2. Penurunan jumlah Salmonella (inokulum awal 3 log CFU/ml)
selama pembekuan es batu pada media HEA... Gambar 3. Penurunan jumlah Salmonella (inokulum awal 5 log CFU/ml)
selama pembekuan es batu pada media NA. ... Gambar 4. Penurunan jumlah Salmonella (inokulum awal 5 log CFU/ml)
selama pembekuan es batu pada media HEA... Gambar 5. Perbandingan tingkat kerusakan subletal Salmonella (inokulum awal 3 log CFU/ml) pada es batu. ... Gambar 6. Perbandingan tingkat kerusakan subletal Salmonella
(inoku-lum awal 5 log CFU/ml) pada es batu... Gambar 7. Perilaku Koktil Salmonella (inokulum awal 3 log CFU/ml) se-lama pembekuan es batu, es mambo, dan es susu pada media NA... Gambar 8. Perilaku Koktil Salmonella (inokulum awal 3 log CFU/ml)
se-lama pembekuan es batu, es mambo, dan es susu pada media HEA... Gambar 9. Perilaku Koktil Salmonella (inokulum awal 5 log CFU/ml)
se-lama pembekuan es batu, es mambo, dan es susu pada media NA... Gambar 10. Perilaku Koktil Salmonella (inokulum awal 5 log CFU/ml) se-lama pembekuan es batu, es mambo, dan es susu pada media HEA... Gambar 11. Perbandingan tingkat kerusakan Koktil Salmonella (inokulum
awal 3 log CFU/ml) pada ketiga jenis es... Gambar 12. Perbandingan tingkat kerusakan Koktil Salmonella (inokulum
DAFTAR LAMPIRAN
Halaman Lampiran 1. Data jumlah sel Salmonella Lexington (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es batu……… Lampiran 2. Data jumlah sel Salmonella Enteritidis (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es batu... Lampiran 3. Data jumlah sel Salmonella Paratyphi (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es batu... Lampiran 4. Data jumlah sel Koktil Salmonella (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es batu... Lampiran 5. Data jumlah sel Salmonella Lexington (tingkat inokulasi 5
Log CFU/ml) selama pembekuan es batu... Lampiran 6. Data jumlah sel Salmonella Enteritidis (tingkat inokulasi 5
Log CFU/ml) selama pembekuan es batu... Lampiran 7. Data jumlah sel Salmonella Paratyphi (tingkat inokulasi 5
Log CFU/ml) selama pembekuan es batu... Lampiran 8. Data jumlah sel Koktil Salmonella (tingkat inokulasi 5
Log CFU/ml) selama pembekuan es batu... Lampiran 9. Data jumlah sel Koktil Salmonella (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es mambo... Lampiran 10. Data jumlah sel Koktil Salmonella (tingkat inokulasi 5
Log CFU/ml) selama pembekuan es mambo... Lampiran 11. Data jumlah sel Koktil Salmonella (tingkat inokulasi 3
Log CFU/ml) selama pembekuan es susu... Lampiran 12. Data jumlah sel Koktil Salmonella (tingkat inokulasi 5
I. PENDAHULUAN
A. Latar Belakang
Masalah keamanan pangan merupakan isu strategis saat ini. Isu mengenai keamanan pangan (food safety) banyak menjadi perhatian dalam upaya meningkatkan kualitas kesehatan dan kualitas hidup masyarakat. Laporan dari berbagai negara menunjukkan bahwa kasus keracunan dan penyakit melalui makanan masih selalu terjadi di berbagai negara (Fardiaz 1996).
Pangan disebut aman jika memenuhi kriteria dari beberapa aspek seperti fisika, kimia, radioaktivitas maupun mikrobiologi. Suatu produk pangan dapat disebut aman dari aspek mikrobiologi jika tidak mengandung mikroba patogen yaitu mikroba yang dapat menyebabkan gangguan kesehatan pada manusia yang mengkonsumsinya.
Berbagai macam jenis minuman es seperti es mambo, es lilin, es teler, es buah dan lain sebagainya merupakan makanan jajanan anak sekolah yang sering dikonsumsi oleh anak-anak. Selain penggunaan bahan tambahan pangan yang melebihi batas dari laporan juga ditemukan bahwa dalam es-es mambo kemasan plastik banyak ditemukan mikroba. Hal ini disebabkan air untuk membuat es tidak dimasak terlebih dahulu (Anonim, 2007).
Es memiliki suhu yang rendah dimana pada suhu tersebut aktivitas mikroba, termasuk mikroba patogen dapat menurun atau berhenti. Hal ini disebabkan semua reaksi metabolisme pada mikroorganisme dikatalisis oleh enzim dimana kecepatan reaksi katalisis enzim sangat dipengaruhi oleh suhu (Jay, 2000). Hal ini menimbulkan anggapan bahwa es batu relatif aman dikonsumsi padahal beberapa penelitian menunjukkan tidak terjaminnya keamanan es batu dan minuman es lainnya untuk dikonsumsi.
Penelitian yang dilakukan oleh kelompok studi TIFOID di daerah Jatinegara, Jakarta melaporkan bahwa konsumsi minuman es berhubungan signifikan dengan demam tifus dan paratifus (JIP, 2004). Penelitian Supali (2001) menunjukkan prevalensi karier Salmonella Typhi dan Paratyphi pada pedagang es keliling di Kodya Semarang mencapai 2,3%. Sebanyak 87,2% air
yang digunakan untuk memproduksi es positif terkontaminasi E. coli dalam kadar yang jauh melebihi ambang batas yang diperkenankan, sedangkan produk es yang terkontaminasi E. coli mencapai 46,4%.
Penelitian Hartini (2005) melaporkan bahwa sampel es batu yang dijual di sekitar kampus IPB mengandung E. coli tetapi tidak terdapat Salmonella. Meskipun demikian Salmonella yang mengkontaminasi es dapat bertahan pada suhu rendah dengan dua macam pola yaitu pola I dimana Salmonella cenderung mengalami peningkatan sampai es batu berada dalam keadaan setengah cair dan kemudian konstan sampai keadaan dua jam setelah es batu mencair. Pola II menunjukkan terjadinya peningkatan jumlah Salmonella yang terus-menerus setelah es batu yang mencair dibiarkan selama dua jam.
Berdasarkan uraian di atas jelas bahwa masih dibutuhkan banyak informasi yang diperlukan untuk meningkatkan keamanan pangan produk es. Penelitian dasar mengenai pengujian kemampuan bertahan Salmonella selama proses pembekuan es ini perlu dilakukan sehingga hasilnya dapat dimanfaatkan oleh masyarakat untuk menjamin keamanan pangan.
B. Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan bertahan beberapa galur bakteri patogen Salmonella selama proses pembekuan es.
II. TINJAUAN PUSTAKA
A. ES
Es batu merupakan masa padat hasil pembekuan air minum (SNI 01-3839-1995). Es batu sering ditambahkan pada berbagai jenis minuman untuk memberi kesan dingin dan segar. Untuk beberapa jenis minuman seperti es doger, es cincau dan es campur, es batu tidak hanya berfungsi untuk memberi cita rasa dingin dan segar, tetapi merupakan bagian dari minuman tersebut, sehingga penggunaan es batu tidak dapat digantikan dengan menyimpan minuman tersebut dalam lemari pendingin.
Produk minuman es yang umum terdapat dimasyarakat adalah es krim, es mambo, es doger, es cincau, es teller, es buah dan lain sebagainya. Es dan es krim merupakan produk pangan beku komersial yang digemari oleh masyarakat luas. Menurut Marshal dan Arbuckle (2000) es krim merupakan produk formulasi susu, pemanis, penstabil, emulsifier dan flavor yang dibekukan. Bahan lain yang sering ditambahkan adalah telur, pewarna dan pati terhidrolisa. Sebelum dibekukan, formulasi tersebut dipasteurisasi dan dihomogenisasi terlebih dahulu.
1. Sifat Fisik dan Struktur Es
Es merupakan air yang berada dalam fase padat (kristal) yang diperoleh dari hasil pendinginan dan pembekuan air. Menurut Bragg (1922), es merupakan suatu senyawa yang terdiri dari molekul-molekul H2O (HOH) yang tersusun sedemikian rupa sehingga 1 atom H terletak di satu sisi antara sepasang atom oksigen molekul-molekul air lainnya, membentuk suatu heksagon simetrik. Satu molekul HOH dapat mengikat 4 molekul HOH yang berdekatan dan jarak atom O-O yang berdampingan sebesar 2.76 Ao.
Menurut deMan (1997) molekul air dapat mengikat empat molekul air lain membentuk susunan tetrahedron. Bentuk ini menghasilkan kisi kristal heksagonal dalam es. Kisi terbentuk longgar dan mempunyai rongga yang nisbi besar, hal ini mengakibatkan volume jenis tinggi. Dalam
ikatan hidrogen, atom hidrogen berjarak 0,1 nm dari atom oksigen dan 0,176 nm dari atom hidrogen yang satu lagi. Jika es meleleh, beberapa ikatan hidrogen putus dan molekul air tersusun lebih rapat lagi.
Bragg (1922) menjelaskan bahwa bila suhu air diturunkan, pelepasan panas akan mengakibatkan pergerakan molekul-molekul air diperlambat dan volumenya mengecil. Bila air didinginkan sampai suhu 4oC, suatu pola baru ikatan hidrogen terbentuk. Volume air sebaliknya mengembang ketika diturunkan suhunya dari 4oC sampai 0 oC. Ketika panas dilepas lagi setelah air mencapai 0oC, terjadilah kristal, dan ketika air es berubah menjadi kristal es, volume mendadak mengembang.
Laju pertumbuhan kristal es menurun dengan menurunnya suhu. Berbagai jenis zat terlarut dalam jumlah sedikitpun akan sangat memperlambat pertumbuhan kristal es. Pembekuan secara perlahan-lahan akan mengakibatkan terbentuknya kristal es yang besar di daerah ekstrasel secara ekslusif. Pembekuan secara cepat mengakibatkan terbentuknya kristal es yang kecil baik di daerah ekstrasel maupun intrasel (deMan,1997).
2. Mikrobiologi Es
Es merupakan produk pangan yang memiliki suhu yang rendah. Meski demikian, es dapat menjadi sumber penyakit pada manusia, seperti gastroenteritis, demam, dan sebagainya yang disebabkan oleh bakteri patogen. Bakteri patogen pada es dapat berasal dari sumber air yang digunakan untuk membuat es maupun dari kontaminasi silang saat penanganan seperti kontaminasi dari pekerja, alat dan kendaraan untuk mengangkut es (truk, gerobak, dan sebagainya).
Potensi es dan minuman es untuk menyebabkan penyakit pada manusia menjadi lebih besar karena es termasuk ke dalam produk pangan yang siap santap dan tidak memerlukan proses pemanasan terlebih dahulu sebelum dikonsumsi. Meskipun bahan baku yang digunakan telah dipanaskan atau dimasak terlebih dahulu namun penanganan atau
distribusinya sering tidak dilakukan dengan baik. Hal inilah yang dapat menjadi sumber penyakit pada manusia.
Jika es yang telah terkontaminasi oleh bakteri patogen seperti Salmonella dikonsumsi oleh manusia maka kemungkinan untuk terjadi infeksi menjadi lebih besar karena Salmonella dapat bertahan sampai ke usus halus. Hal ini dapat disebabkan karena waktu transit air pada lambung relatif singkat sehingga bakteri ini hanya sebentar terpapar dengan suasana asam (pH 2) dan enzim pencernaan pada lambung.
Keamanan es yang dijual dipasaran perlu dipertanyakan karena dari beberapa hasil penelitian diketahui bahwa es merupakan produk pangan yang sering menyebabkan penyakit baik didalam maupun di luar negeri. Penelitian yang dilakukan oleh kelompok studi TIFOID di daerah Jatinegara, Jakarta melaporkan bahwa konsumsi minuman es berhubungan signifikan dengan demam tifus dan paratifus (JIP, 2004). Penelitian Supali (2001) menunjukkan prevalensi karier Salmonella Typhi dan Paratyphi mencapai 2,3% pada pedagang es keliling di Kodya Semarang. Sebanyak 87,2% air yang digunakan untuk memproduksi es positif terkontaminasi E. coli dalam kadar yang jauh melebihi ambang batas yang diperkenankan, sedangkan produk es yang terkontaminasi E. coli mencapai 46,4%.
Firlieyanti (2005) melaporkan hasil analisa terhadap 31 sampel es batu di Bogor. Jumlah total mikroba berkisar antara 2,8x102 CFU/ml sampai 1,1x106 CFU/ml, koliform berkisar antara 1,5x102 MPN/100ml sampai 1,2x106 MPN/100ml. Sebanyak 31 sampel (100%) positif koliform dimana 14 sampel (45%) positif koliform fekal dan 3 sampel (10%) positif E. coli. Penelitian tersebut menunjukkan bahwa es batu di Bogor belum memenuhi standar mutu mikrobiologis yang ditetapkan oleh SNI dan Kepmenkes RI (tidak mengandung koliform dan E. coli dalam 100 ml), serta mengindikasikan kurang baiknya penerapan sanitasi dalam penanganan es batu di Bogor.
Hartini (2005) melakukan penelitian pada es batu dengan menggunakan lima sampel yang ada di sekitar kampus IPB, Dramaga, Bogor. Analisis yang dilakukan menunjukkan bahwa total mikroba pada
sampel es batu berkisar antara 2,8 CFU/cm2 sampai 1,3x102 CFU/cm2 pada saat sampel dalam keadaan beku. Setelah es mencair, jumlah mikroba berkisar antara 4,5x102 CFU/ml sampai 9,8x103 CFU/ml. Bakteri yang teridentifikasi dengan menggunakan API® 20E pada sampel es batu tersebut adalah E. coli, Enterobacter sp dan Enterobacter cloacae, Pseudomonas sp., Citrobacter dan Klebsiella.
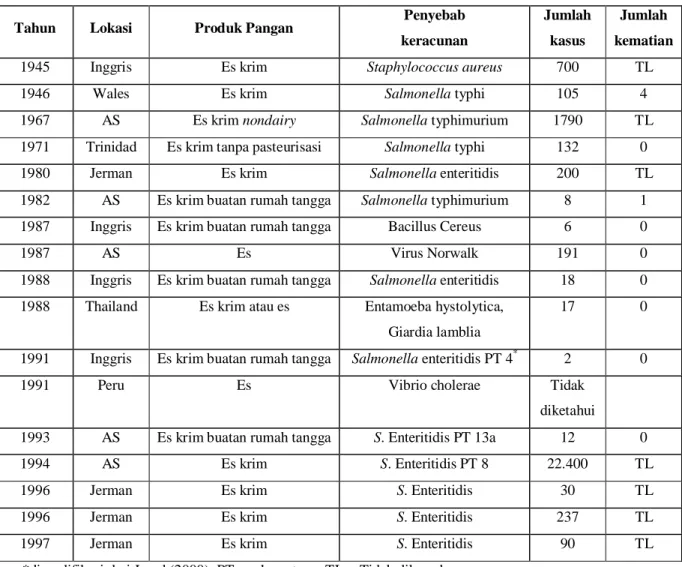
Beberapa kasus keracunan pangan akibat konsumsi produk es yang terjadi di beberapa negara dapat dilihat pada Tabel 1.
Tabel 1. Keracunan pangan karena konsumsi produk es*
Tahun Lokasi Produk Pangan Penyebab
keracunan
Jumlah kasus
Jumlah kematian
1945 Inggris Es krim Staphylococcus aureus 700 TL
1946 Wales Es krim Salmonella typhi 105 4
1967 AS Es krim nondairy Salmonella typhimurium 1790 TL 1971 Trinidad Es krim tanpa pasteurisasi Salmonella typhi 132 0
1980 Jerman Es krim Salmonella enteritidis 200 TL
1982 AS Es krim buatan rumah tangga Salmonella typhimurium 8 1 1987 Inggris Es krim buatan rumah tangga Bacillus Cereus 6 0
1987 AS Es Virus Norwalk 191 0
1988 Inggris Es krim buatan rumah tangga Salmonella enteritidis 18 0 1988 Thailand Es krim atau es Entamoeba hystolytica,
Giardia lamblia
17 0
1991 Inggris Es krim buatan rumah tangga Salmonella enteritidis PT 4* 2 0
1991 Peru Es Vibrio cholerae Tidak
diketahui
1993 AS Es krim buatan rumah tangga S. Enteritidis PT 13a 12 0
1994 AS Es krim S. Enteritidis PT 8 22.400 TL
1996 Jerman Es krim S. Enteritidis 30 TL
1996 Jerman Es krim S. Enteritidis 237 TL
1997 Jerman Es krim S. Enteritidis 90 TL
Pada tahun 1994, Departemen kesehatan Minnesota, Amerika Serikat mencatat sebanyak 29.100 orang menderita sakit dan kurang lebih 224.000 orang terinfeksi setelah mengkonsumsi es krim. Vought dan Tatini (1998) menganalisis sebanyak dua puluh batch produksi es krim yang mengakibatkan outbreak salmonellosis tersebut. Sebanyak tiga batch produksi dinyatakan positif Salmonella Enteritidis. Jumlah sampel yang diambil pada setiap batch produksi yang positif adalah sembilan buah es krim dengan nilai MPN/g Salmonella Enteritidis berkisar antara 0,004 sampai 0,46 MPN/g.
B. PEMBEKUAN
Pembekuan adalah suatu unit operasi dimana suhu bahan diturunkan hingga dibawah titik bekunya, dan hampir semua bagian air dari produk tersebut diubah menjadi es. Secara mikrobiologi, pembekuan dimaksudkan agar aktivitas metabolisme mikroorganisme pada makanan dapat diperlambat atau dihentikan sama sekali. Seperti diketahui aktivitas metabolisme organisme merupakan reaksi yang dikatalisis oleh enzim-enzim tertentu dan kecepatan reaksi ini sangat dipengaruhi oleh suhu.
Bila suhu meningkat, kecepatan reaksi akan meningkat dan bila suhu menurun, kecepatan reaksi menurun pula. Pada sistem biologi, peningkatan suhu sebesar 10°C pada konsentrasi yang tepat akan meningkatkan kecepatan reaksi sebesar dua kali. Demikian pula sebaliknya, setiap penurunan suhu sebesar 10°C mengakibatkan penurunan kecepatan reaksi sebesar dua kali. Penurunan suhu sampai taraf tertentu dapat menyebabkan terhentinya metabolisme mikroorganisme, yang selanjutnya berakibat kerusakan atau kematian sel (Fennema et al., 1976).
Menurut Johnston et al. (1994) proses pembekuan terjadi secara bertahap dari permukaan sampai pusat bahan. Pada permukaan bahan, pembekuan berlangsung lebih cepat, sedangkan pada bagian dalam, laju pembekuan lebih lambat. Proses ini terbagi menjadi tiga tahap yaitu:
a. Tahap pertama, suhu bahan menurun dengan cepat hingga tercapai titik beku. Tahap ini dikenal sebagai supercooling periode.
b. Tahap kedua, suhu bahan turun secara perlahan yang disebabkan oleh dua hal: 1) penarikan panas dari bahan mengakibatkan pembekuan air di dalam bahan; dan 2) terbentuknya es pada bagian luar/permukaan bahan merupakan penghambat bagi proses pembekuan dari bagian-bagian di dalamnya.
c. Tahap ketiga, suhu bahan diturunkan sampai di bawah titik beku, yang idealnya adalah mendekati suhu penyimpanan beku.
1. Jenis Pembekuan
Menurut Jay (1978) terdapat dua metode dasar dalam pembekuan produk pangan yaitu pembekuan cepat dan pembekuan lambat. Pembekuan cepat merupakan proses pembekuan dimana suhu produk pangan diturunkan dibawah titik beku dalam waktu 30 menit. Pembekuan lambat adalah proses penurunan suhu sampai dibawah titik beku dalam waktu yang relatif lama biasanya 3 sampai 72 jam. Tabel 2. dibawah ini menunjukkan perbandingan dua metode pembekuan tersebut.
Tabel 2. Perbandingan antara pembekuan cepat dan pembekuan lambat*
Pembekuan cepat Pembekuan lambat
1 Kristal es yang terbentuk kecil 1 Kristal es yang terbentuk besar 2 Menghalangi atau menekan metabolisme 2 Merusak hubungan metabolisme 3 Sel terpapar pada pengaruh osmosis
dalam waktu yang singkat
3 Sel terpapar pada pengaruh osmosis dalam waktu yang lama
4 Tidak ada adaptasi terhadap suhu dingin 4 Adaptasi terhadap suhu dingin secara berangsur-angsur
5 Sel mengalami thermal shock 5 Tidak ada pengaruh thermal shock * Jay (1978)
Laju pembekuan merupakan salah satu faktor kritis yang menentukan mutu produk beku yang dihasilkan. Menurut Jay (1978) pembekuan cepat lebih baik daripada pembekuan lambat terutama terhadap kualitas produk yang dihasilkan karena kristal es yang terbentuk kecil dan terletak di dalam sel, sedangkan pada pembekuan lambat kristal es yang terbentuk besar dan berada di luar sel sehingga dapat merusak dinding sel dan tekstur produk pangan.
2. Perubahan Fisik dan Mikrobiologis Bahan Pangan Selama Pembekuan
Perubahan fisik pada bahan pangan selama pembekuan terkait dengan pembentukan dan pertumbuhan kristal es. Pembentukan kristal es menyebabkan pengkonsentrasian padatan terlarut, dan konsekuensinya adalah penurunan titik beku dari padatan terlarut tersebut. Perubahan lain yang terjadi selama pembekuan adalah penurunan pH sebesar 0,3-2,0 unit pH. Pembentukan es diasosiasikan dengan peningkatan volume dan tekanan substansial, yang dapat menyebabkan keretakan pada beberapa bahan pangan (Lund, 2000).
Pada pembentukan es terjadi perubahan fisik pada produk meliputi perubahan konsentrasi zat terlarut dan aw yang akan mempengaruhi ketahanan mikroba. Menurut Lund (2000) pada suhu -5oC produk pangan yang dibekukan akan memiliki aw senilai dengan 0,9526, ketika suhu diturunkan menjadi -10oC nilai aw menjadi 0,9074 dan pada suhu -15oC nilai awmenurun menjadi 0,8642.
Pembekuan merupakan metode yang efektif untuk menghambat pertumbuhan mikroba. Selama pembekuan mikroorganisme terkonsentrasi di dalam bagian cairan tak terbekukan. Seiring dengan penurunan suhu, air yang membeku akan semakin banyak sehingga terjadi peningkatan konsentrasi padatan terlarut didalam cairan tak terbekukan tersebut. Akibatnya, air di dalam sel mikroba akan berdifusi keluar (Lund, 2000).
Faktor-faktor yang diduga menyebabkan kerusakan mikroorganisme selama pembekuan antara lain: (1) suhu yang sangat rendah; (2) pembentukan es ekstraseluler dan intraseluler; (3) konsentrasi padatan terlarut ekstraseluler dan intraseluler. Selanjutnya pengaruh faktor-faktor ini ditentukan oleh laju pembekuan dan pelelehan.
Penurunan suhu akan meningkatkan pembentukan kristal es baik ekstraseluler maupun intraseluler. Laju pembekuan yang sangat lambat dapat meningkatkan konsentrasi padatan terlarut intraseluler. Peningkatan konsentrasi padatan terlarut menyebabkan air intraseluler berdifusi dari sel. Apabila air tidak dapat berdifusi keluar sel, maka air tersebut akan
mengalami supercooling dan akhirnya membeku. Selain itu, perubahan sebagian besar air dalam produk pangan menjadi es menyebabkan persedian air menjadi sangat terbatas (penurunan aw) sehingga mikroorganisme akan kesulitan untuk menyerap makanan (Lund, 2000).
C. PENGARUH PEMBEKUAN TERHADAP SEL MIKROORGANISME Fardiaz (1990) menyatakan bahwa proses pembekuan dapat menyebabkan kematian atau kerusakan subletal pada sebagian sel. Lund (2000) menyatakan bahwa ketahanan mikroorganisme selama pembekuan dipengaruhi oleh jenis mikroorganisme dan komposisi medium pembekuan. Selain itu faktor lain yang berpengaruh adalah status nutrisi, fase pertumbuhan mikroba sebelum dibekukan, kecepatan pembekuan, suhu pembekuan, lama pembekuan, kecepatan thawing, metode yang digunakan untuk menentukan jumlah sel yang hidup, dan media yang digunakan.
Menurut Fardiaz (1990) selama pembekuan, air bebas akan membentuk kristal es, sedangkan air terikat tetap tidak membeku. Pada kecepatan pembekuan yang lambat, kristal es yang terbentuk umumnya terdapat di luar sel (ekstraseluler), sedangkan pada kecepatan pembekuan cepat terbentuk kristal-kristal es di dalam sel (intraseluler). Karena air bebas membeku, maka selama pembekuan sel mengalami dehidrasi. Pembekuan cepat menyebabkan shok terhadap mikroorganisme, dan pengaruh terbesar shok ini terjadi pada organisme termofilik, kemudian mesofilik, dan yang paling tahan adalah organisme psikrofilik.
Fardiaz (1990) menyatakan bahwa pembekuan air menyebabkan peningkatan viskositas komponen-komponen sel dan lepasnya gas-gas yang terdapat di dalam sitoplasma seperti O2dan CO2karena kelarutannya di dalam air menurun. Kehilangan O2pada sel-sel aerobik ini mengakibatkan reaksi respirasi menurun. Pembekuan juga menyebabkan perubahan pH dari komponen-komponen sel. Beberapa peneliti melaporkan perubahan pH selama pembekuan mencapai 0.3-2.0 unit.
Pembekuan akan meningkatkan konsentrasi elektrolit di dalam sel karena air bebas membeku membentuk kristal es dan merusak sistem koloidal
dari protoplasma (misalnya sistem koloid protein). Pembekuan juga menyebabkan denaturasi protein di dalam sel. Denaturasi protein ini diduga disebabkan oleh beberapa hal, diantaranya hilangnya grup sulfhidril (-SH) selama pembekuan, pecahnya lipoprotein, dan meningkatnya konsentrasi elektrolit selama pembekuan.
Ketahanan sel mikroorganisme terhadap proses pembekuan dipengaruhi oleh kemampuan mikroorganisme tersebut untuk tetap hidup selama dehidrasi pada waktu medium membeku. Ukuran sel mikroorganisme yang demikian kecil mengakibatkan sel mengalami dehidrasi selama pembekuan. Oleh karena itu mekanisme ketahanan sel terhadap proses pembekuan kemungkinan sama dengan mekanisme ketahanan sel terhadap dehidrasi atau awrendah.
1. Cold Shock Proteins
Semua makhluk hidup harus beradaptasi dengan perubahan lingkungan. Adaptasi terhadap pengaruh tekanan lingkungan sangat penting untuk ketahanan organisme tersebut. Perubahan yang dramatis seperti cold shock akan mengakibatkan kematian pada kebanyakan organisme. Sebagian besar mikroorganisme akan bereaksi melawan penurunan suhu yang tiba-tiba (dari suhu 30oC ke suhu 10 oC) yang disebut cold shock response.
Menurut Ulusu dan Tezcan (2001) bagian yang sangat penting dari mekanisme mikroorganisme terhadap suhu dingin terjadi pada konsentrasi membran sitoplasma. Efek cold shock menyebabkan komposisi dan organisasi membran berupaya memelihara fungsi optimum membran. Hal ini karena cold shock akan menyebabkan keluarnya materi intraseluler dari sel dan merusak sifat permeabilitas membran sitoplasma bakteri (Cava et al., 2006).
Penurunan suhu pertumbuhan menyebabkan sel berada dalam fase lag. Selama fase lag ini mikroorganisme mengubah komposisi membran dan mensintesis protein spesifik yang disebut cold shock proteins. Menurut Craig et al. (1998) pada kondisi suhu pendinginan Salmonella akan memproduksi cold shock proteins yang berfungsi sebagai pengantar
dan pelindung enzim, protein, asam nukleat dan ribosom di dalam sel. Gen cold shock proteins (CSPs) pada Salmonella terdiri dari cspA, cspB, cspC, cspE, dan cspH (Ulusu dan tezcan, 2001).
Menurut Jeffreys et al. (1998) beberapa penelitian membuktikan bahwa terjadi peningkatan jumlah sel yang bisa bertahan ketika Salmonella Enteritidis dipindahtumbuhkan dari suhu 10oC ke suhu pembekuan. Analisis Western blot pada CspA Escherichia coli dan analisis protein radiolabeled dari Salmonella Enteritidis setelah cold shock pada suhu 10oC dan 5oC menunjukkan peningkatan sintesis cold shock proteins 7.4-kDa (CS7.4) yang berukuran sama dengan yang dimiliki oleh E. coli.
Menurut Ulusu dan Tezcan (2001) protein CspA atau CS7.4 merupakan 7400 Da Protein sitoplasma. Jika suhu pertumbuhan diturunkan, mRNA dari CspA meningkat. Hal ini mengindikasikan bahwa sintesis protein ini diatur pada konsentrasi transkripsi. Jeffreys et al. (1998) menambahkan bahwa sampai saat ini mekanisme dari CS7.4 dalam melindungi S. Enteritidis dari efek kerusakan sel akibat pendinginan dan pembekuan belum diketahui.
2. Kerusakan Subletal
Sel disebut mengalami kerusakan subletal dan tidak mati jika sel tersebut mengalami kerusakan tetapi tetap masih mempunyai kemampuan untuk melakukan metabolisme pada kondisi yang tidak menghambat dan kemudian kembali ke keadaan fisiologi yang normal sehingga akhirnya dapat tumbuh secara normal dan berkembang biak (Fardiaz, 1990).
Menurut Fardiaz (1990) kerusakan subletal pada sel sering ditandai dengan meningkatnya sensitifitas sel terhadap senyawa selektif, senyawa antimikroba, atau senyawa sejenis lainnya yang terdapat di dalam medium pertumbuhan. Sebagai contoh, ketahanan terhadap garam akan hilang pada sel S. aureus, B. subtilis, E. coli dan S. typhimurium yang mengalami kerusakan subletal. Deosikholat dapat menghambat pertumbuhan sel E. coli dan S. typhimurium yang mengalami kerusakan subletal.
Sel yang mengalami kerusakan subletal seringkali mengalami kebocoran sehingga komponen-komponen sel akan keluar ke medium di sekelilingnya. Beberapa penelitian membuktikan bahwa sel E. coli yang dibekukan akan kehilangan sebagian asam amino, asam ribonukleat dengan berat molekul rendah, dan peptida.
S. aureus yang mengalami kerusakan subletal oleh pemanasan dilaporkan akan kehilangan sebagian ion kalium, asam amino, protein dan senyawa-senyawa lainnya. Sel E. coli yang mengalami kerusakan oleh proses pemanasan akan kehilangan lipoplisakarida. Hal ini menunjukkan bahwa telah terjadi kerusakan membran bagian luar (Fardiaz, 1990).
Kerusakan yang disebabkan oleh hilangnya sebagian komponen-komponen sel mengakibatkan sel kehilangan kemampuan untuk tumbuh dan berkembang biak. Jika kerusakan ini tidak dapat diperbaiki kembali pada saat sel ditumbuhkan pada kondisi yang baik, maka sel akan tetap kehilangan kemampuan untuk berkembang biak.
Kerusakan subletal akan menyebabkan terjadinya perubahan aktifitas metabolisme sel. Perubahan-perubahan tersebut dapat berupa penurunan kemampuan dalam memecah senyawa-senyawa yang dibutuhkan sel, kehilangan kemampuan untuk melakukan transpor melalui membran, atau penurunan aktifitas enzim-enzim yang penting dalam metabolisme (Fardiaz, 1990).
Krioprotektan merupakan senyawa yang dapat mengurangi kerusakan sel akibat pembekuan dan thawing. Fungsi krioprotektan adalah mencegah terbentuknya kristal-kristal es akibat dehidrasi sel yang berlebihan dari dalam sel dan menstabilkan membran plasma sel sehingga dapat melindungi kerusakan fisik dan fungsional sel selama proses pembekuan (Leibo, 1992) dan memodifikasi struktur kristal sehingga tidak merusak organel-organel sel (Amann, 1999). Menurut Lund (2000) beberapa jenis makanan secara alami mengandung senyawa krioprotektan. Senyawa krioprotektan yang biasanya terdapat dalam makanan adalah gula, garam, polihidroksi alkohol, dan gliserol.
Menurut Douzou (1977) selain senyawa alami, senyawa non-biologi seperti dimetil sulfoksida, etilen glikol, dan propilen glikol dapat digunakan sebagai senyawa krioprotektan. Suatu senyawa dapat digunakan sebagai senyawa krioprotektan apabila tidak bersifat toksik, memiliki kemampuan untuk berpenetrasi ke dalam membran sel dan memiliki sifat elektrolit. Semua senyawa krioprotektan memiliki grup ikatan hidrogen (OH, NH, =O) dan memiliki ikatan yang kuat dengan air sehingga mencegah terjadinya pembekuan pada suhu 0oC.
3. Penyembuhan dan Perhitungan Sel yang Mengalami Kerusakan Subletal
Menurut Fardiaz (1990) sel yang mengalami kerusakan subletal harus terlebih dahulu disembuhkan dengan medium penyembuhan agar dapat tumbuh secara normal dan berkembang biak. Fardiaz (1990) menambahkan bahwa medium penyembuhan yang digunakan dalam proses penyembuhan sel adalah medium yang baik dan kaya akan nutrien, tetapi tidak mengandung komponen selektif atau senyawa yang bersifat menghambat.
Menurut Fardiaz (1992) proses penyembuhan sel yang rusak merupakan proses perbaikan bagian-bagian sel yang rusak atau pengembalian senyawa-senyawa sel yang telah hilang atau bocor karena proses pengolahan. Berbagai kerusakan sel dapat diperbaiki dan senyawa-senyawa sel yang hilang dapat dikembalikan pada keadaan normal setelah sel diinkubasi pada medium penyembuhan. Ray dan Speck (1972) menambahkan bahwa selama penyembuhan terjadi regenerasi ribosoma yang telah mengalami degradasi, sintesis DNA, RNA, ATP, enzim, fosfolipid, protein, dan sebagainya.
Untuk mendeteksi sel Salmonella yang mengalami kerusakan subletal, Andrew (1985) dalam Tiwow (1991) melaporkan dapat digunakan beberapa medium penyembuhan seperti Lactose Broth, TSB, Non Fat Dry Milk (NFDM), Nutrient Broth atau Buffered Peptone Water (BPW). Fardiaz (1992) menyatakan bahwa suhu inkubasi yang digunakan
untuk penyembuhan sel yang mengalami kerusakan subletal bervariasi yaitu antara 25-37oC, dimana suhu yang lebih tinggi akan lebih efektif untuk kebanyakan organisme mesofil.
Waktu yang dibutuhkan untuk proses penyembuhan juga bervariasi, yaitu antara 1 – (4-5) jam, sedangkan untuk sel yang mengalami stress karena panas diperlukan waktu yang lebih lama. Bernard (2000) menyatakan juga bahwa lama waktu penyembuhan bagi sel yang mengalami kerusakan akibat pembekuan pada umumnya 4-5 jam pada kondisi optimum.
Beberapa peneliti melakukan perhitungan jumlah sel Salmonella yang mengalami kerusakan subletal dengan melihat perbandingan sel-sel yang tumbuh pada medium yang mengandung senyawa penghambat (medium selektif) dan medium yang tidak mengandung senyawa penghambat (medium non selektif). Ray et al. (1971) dalam Tiwow (1991) menggunakan xylose lysine peptone (XLP) sebagai medium nonselektif dan xylose lysine desoxycholate peptone (XLDP) sebagai medium selektif untuk mempelajari kerusakan subletal S. anatum karena pembekuan dan pengeringan beku. Mackey dan Derrick (1982) dalam Tiwow (1991) menemukan terjadinya kerusakan subletal S. typhimurium akibat pembekuan dengan menggunakan medium TSA sebagai medium nonselektif dan minimal agar (MA) sebagai medium selektif.
D. SALMONELLA
1. Karakteristik Salmonella
Salmonella merupakan bakteri yang menjadi indikator keamanan pangan (food safety) karena keberadaannya dalam bahan pangan dapat menyebabkan penyakit pada manusia. Menurut Bergey’s Manual of Determinative Bacteriology, Eight Edition di dalam Alcamo (1983), Salmonella termasuk ke dalam golongan Enterobacteriaceae yang berbentuk batang, bersifat fakultatif anaerobik dan merupakan bakteri Gram negatif. Salmonella berukuran relatif kecil, sekitar 0,7-1,5 x 2,0-5,0 µm (Bell dan Kyriakides, 2003).
Salmonella umumnya tidak mampu memfermentasi laktosa, sukrosa, dan salicin, akan tetapi mampu memfermentasi glukosa dan monosakarida lainnya dengan menghasilkan gas (Jay, 2000). Menurut Hanes (2003) Salmonella mampu menggunakan sitrat sebagai satu-satunya sumber karbon disaat genus lainnya membutuhkan sumber karbon kompleks sebagai sumber nutrisinya. Semua Salmonella kecuali Salmonella typhi memproduksi gas selama proses fermentasi. Salmonella mampu mengubah nitrat menjadi nitrit dan tidak membutuhkan NaCl untuk pertumbuhannya.
Salmonella tumbuh pada kisaran suhu 8oC sampai 45oC pada rentang pH 4-9 dan membutuhkan aw diatas 0,94. Salmonella sensitif terhadap pemanasan dan umumnya mati pada suhu 70oC atau diatasnya. Salmonella tumbuh dengan optimum pada suhu 35 oC sampai 37oC, mampu mengkatabolisme berbagai macam karbohidrat menjadi asam dan gas, memproduksi H2S dan mendekarboksilasi lisin dan ornithin menjadi kadaverin dan putrescin (D’Aoust, 2000).
Salmonella biasanya bersifat motil dan mempunyai flagella peritrikus, kecuali S. Pullorum dan S. Gallinarum yang tidak memiliki flagela. Selain karena tidak memiliki flagela, jenis Salmonella yang tidak bersifat motil disebabkan karena kesalahan pemasangan subunit flagela atau kekurangan fungsi motorik pada anggota selnya (D’Aoust, 2000).
Bakteri ini tidak dapat dibedakan dengan E. coli jika dilihat dengan mikroskop ataupun dengan menumbuhkannya pada media yang mengandung nutrient yang umum. Salmonella sp. dapat tumbuh optimum pada media pertumbuhan yang sesuai dan memproduksi koloni yang tampak oleh mata dalam jangka waktu 24 jam pada suhu 37oC. Salmonella sp. dapat tumbuh pada kisaran pH, dan aw yang lebih luas jika tumbuh pada substrat yang lebih baik (Jay, 2000).
Bakteri ini sensitif terhadap panas, sehingga dapat mati pada suhu pasteurisasi. Akan tetapi, bakteri ini relatif tahan pada suhu rendah. Matches dan Liston (1968) dalam (Jay, 2000) melaporkan bahwa suhu terendah yang masih memungkinkan pertumbuhan adalah 5,3oC untuk Salmonella Heidelberg dan 6,2oC untuk Salmonella Typhimurium.
Skema Kauffmann-White mengklasifikasikan Salmonella berdasarkan antigen somatik (antigen O) dan flagelar (antigen H). Antigen O berhubungan dengan lipopolisakarida pada permukaan luar membran terluar sel. Antigen O ini stabil terhadap panas, resisten terhadap alkohol dan larutan asam. Antigen H berhubungan dengan flagela peritrikus. Antigen H ini tidak tahan terhadap panas. Tabel 3. berikut menunjukkan distribusi serovar dalam genus Salmonella.
Tabel 3. Distribusi serovar dalam genus Salmonella*
Spesies Sub spesies Jumlah Serovar
Salmonella enterica Salmonella bongori enterica salamae arizonae diarizonae houtenae indica 1.427 482 94 319 69 11 20 Total 2.422
*Sumber : D’Aoust, J.Y. (2000) Di dalam : Lund et al., (2000)
2. Salmonella Pada Produk Pangan Bersuhu Rendah
Bakteri memiliki kemampuan bertahan yang berbeda-beda terhadap suhu pendinginan. Menurut Georgala dan Hurst (1963) bakteri cocci umumnya lebih tahan terhadap pendinginan dibandingkan dengan bakteri Gram negatif berbentuk batang. Untuk bakteri patogen, Salmonella relatif kurang resisten jika bandingkan dengan S. aureus atau sel vegetatif Clostridia, dimana endospora dan toksin tidak efektif pada suhu rendah.
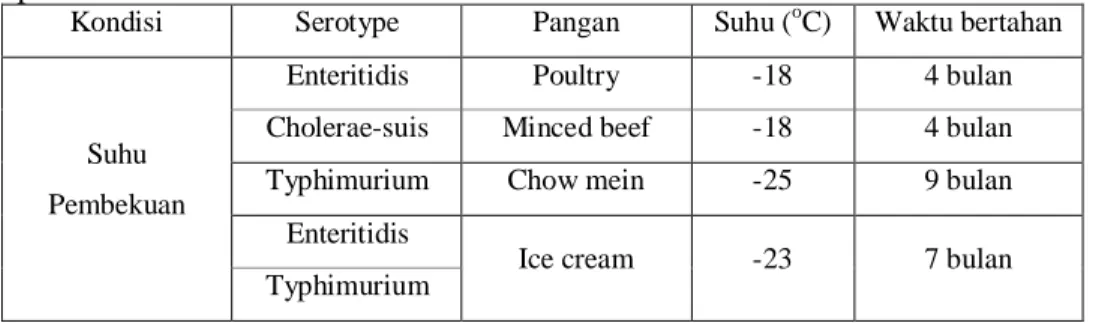
Bell dan Kyriakides (2003) menyatakan bahwa dalam makanan beku atau pangan yang memiliki aktifitas air yang rendah, Salmonella dapat bertahan sampai berbulan-bulan, bahkan sampai bertahun-tahun. Tabel 4. berikut menunjukkan ketahanan berbagai serovar Salmonella pada suhu rendah.
Tabel 4. Kemampuan bertahan berbagai serovar Salmonella pada suhu pembekuan*
Kondisi Serotype Pangan Suhu (oC) Waktu bertahan
Enteritidis Poultry -18 4 bulan
Cholerae-suis Minced beef -18 4 bulan Typhimurium Chow mein -25 9 bulan
Enteritidis Suhu
Pembekuan
Typhimurium
Ice cream -23 7 bulan *D’Aoust (1989) dalam Blackburn dan McClure (2003)
Penelitian yang dilakukan oleh Dickens et al. (1985) menunjukkan bahwa bakteri enteropatogenik seperti Salmonella dapat bertahan pada es dalam minuman. Jumlah mikroorganisme akan menurun pada saat pembekuan, akan tetapi tidak semua organisme mati pada keadaan ini.
Hartini (2005) melakukan penelitian untuk melihat kemampuan bertahan Salmonella pada es batu. Salmonella yang diujikan terdiri dari sepuluh serovar yaitu S. Kentucky, S. Kirkee, S. O Grup C, S. Paratyphi, S. Infantis, S. Lexington, S. Enteritidis, S. Hadar, S. Heidelberg dan S. Typhimurium. Kultur Salmonella diinokulasikan ke dalam es batu dengan cara perendaman dan jumlah sel yang bertahan dievaluasi pada saat es batu dalam keadaan beku, setengah cair, cair, dan 2 jam setelah mencair.
Hasil analisis menunjukkan dua pola pertumbuhan yang terjadi pada kesepuluh serovar tersebut. Pola I terjadi pada S. Kentucky, S. Kirkee, S. O Grup C, dan S. Paratyphi dimana Salmonella cenderung mengalami peningkatan sampai es batu berada dalam keadaan setengah cair dan kemudian konstan sampai keadaan dua jam setelah es batu mencair. Pola II terjadi pada S. Infantis, S. Lexington, S. Enteritidis, S. Hadar, S. Heidelberg dan S. Typhimurium, pada pola II terjadi peningkatan jumlah sel Salmonella yang terus-menerus sehingga kurva yang dihasilkan memiliki gradien positif (kurva naik).
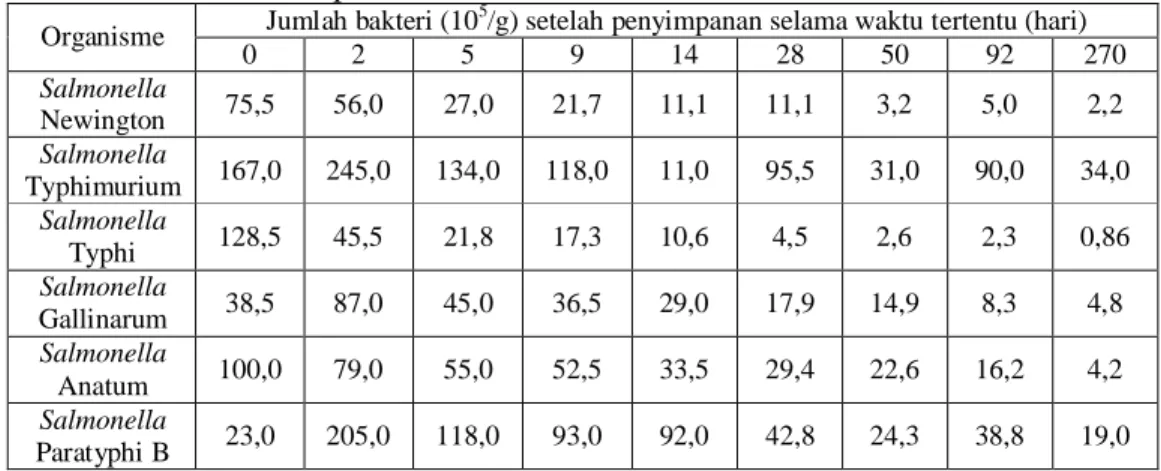
Gunderson dan Rose (1948) melakukan penelitian untuk melihat kemampuan bertahan enam serovar bakteri Salmonella pada produk chicken chow mein yang disimpan selama 270 hari pada suhu -25,5oC. Hasil penelitian menunjukkan adanya dua pola pertumbuhan yang terjadi
pada keenam serovar Salmonella tersebut. Pola pertama terjadi pada Salmonella Typhimurium, Salmonella Gallinarum, dan Salmonella Paratyphi B dimana Salmonella mengalami peningkatan yang besar sampai masa penyimpanan dua hari kemudian mengalami penurunan sampai penyimpanan 270 hari. Pola kedua terjadi pada Salmonella Newington, Salmonella Typhi, dan Salmonella Anatum dimana Salmonella mengalami penurunan yang terus-menerus selama masa penyimpanan (Tabel 5.).
Tabel 5. Kemampuan bertahan kultur murni organisme enterik pada Chicken Chow Mein pada suhu -25,5oC*
Jumlah bakteri (105/g) setelah penyimpanan selama waktu tertentu (hari) Organisme 0 2 5 9 14 28 50 92 270 Salmonella Newington 75,5 56,0 27,0 21,7 11,1 11,1 3,2 5,0 2,2 Salmonella Typhimurium 167,0 245,0 134,0 118,0 11,0 95,5 31,0 90,0 34,0 Salmonella Typhi 128,5 45,5 21,8 17,3 10,6 4,5 2,6 2,3 0,86 Salmonella Gallinarum 38,5 87,0 45,0 36,5 29,0 17,9 14,9 8,3 4,8 Salmonella Anatum 100,0 79,0 55,0 52,5 33,5 29,4 22,6 16,2 4,2 Salmonella Paratyphi B 23,0 205,0 118,0 93,0 92,0 42,8 24,3 38,8 19,0 *Gunderson dan Rose, 1948
Menurut D’Aoust (2000), ketahanan Salmonella selama penyimpanan beku tergantung jenis Salmonella dan jenis produk pangannya. Jumlah sel akan berkurang secara berangsur-angsur selama penyimpanan beku suhu -20oC. Ketahanan Salmonella saat pembekuan juga tergantung kondisi fisiologi sel sebelum dibekukan. Adaptasi S. Enteritidis selama 30 menit pada suhu rendah (5oC sampai 10oC) sebelum pembekuan cepat (suhu -78oC) akan mempertinggi jumlah sel yang bertahan. Kemampuan Salmonella untuk beradaptasi pada suhu rendah diinduksi oleh adanya sintesis gen csp-A yang disandi oleh cold shock protein. Gen ini belum diketahui pasti fungsi spesifiknya pada perlindungan Salmonella terhadap suhu pembekuan.
E. SALMONELLOSIS
Semua spesies dan strain Salmonella diperkirakan bersifat patogen pada manusia. Salmonella merupakan bakteri penyebab infeksi. Jika tertelan dan masuk ke dalam tubuh akan menimbulkan gejala yang disebut salmonellosis. Gejala salmonellosis yang paling sering terjadi di Negara maju sampai di Indonesia adalah gastroenteritis. Selain gastroenteritis, beberapa spesies Salmonella juga dapat menimbulkan gejala penyakit lainnya, misalnya demam enterik seperti demam tifoid dan demam paratifoid serta infeksi lokal.
Menurut del Portillo (2000) penyakit yang diakibatkan oleh Salmonella dibagi menjadi dua grup besar yaitu non-typhoid salmonellosis atau gastroenteritis dan typhoid salmonellosis atau demam enterik. Pada gastroenteritis infeksi bakteri terbatas pada ephitelium usus sedangkan pada demam enterik infeksi bakteri terjadi pada keseluruhan sistem.
Gejala yang ditimbulkan pada gastroenteritis adalah diare, sakit perut, demam, dan muntah dengan periode inkubasi 12-36 hari dan lama sakit 1-4 hari. Gejala yang ditimbulkan oleh demam enterik adalah sakit kepala, batuk, sakit perut, konstipasi, dan demam yang meningkat. Periode inkubasi berfariasi dari 1-7 hari dan sakit selama 1-8 minggu.
Pada umumnya orang yang terinfeksi Salmonella mengalami sakit kepala, demam, kejang perut, mencret, mual dan muntah. Gejala sering mulai 6-72 jam setelah infeksi dan biasanya berlangsung selama 4-7 hari atau lebih lama. Bayi, orang lansia dan yang sistem ketahanannya lemah lebih cenderung menjadi sakit parah (NSW Health Departement, 2002).
Menurut Yousef dan Carlstrom (2003) infeksi Salmonella bisa diakibatkan oleh termakannya 1-10 sel Salmonella. Gejala infeksi Salmonella dimulai dari masuknya sejumlah sel Salmonella ke dalam saluran pencernaan dan masuk ke dalam saluran usus. Bakteri ini dapat melakukan penetrasi pada saluran usus, terutama pada ileum dan sedikit pada usus besar sehingga menimbulkan reaksi inflamasi. Sel-sel Salmonella kadang-kadang dapat menembus sistem pertahanan mukosal dan limfatik dan dapat mencapai saluran darah sehingga menyebabkan bakterimia atau abses.
III. METODOLOGI
A. BAHAN DAN ALAT
1. Bahan Baku Es
Bahan baku yang digunakan dalam pembuatan es adalah aquades yang diperoleh dari Laboratorium Mikrobiologi Seafast Center, gula dan susu UHT yang diperoleh dari Toko Citra Usaha, Babakan Raya, Darmaga, Bogor.
2. Kultur
Kultur yang digunakan dalam penelitian ini adalah Salmonella Enteritidis, Salmonella Paratyphi, Salmonella Lexington, dan campuran antara antara ketiga galur tersebut (Koktil Salmonella) dengan perbandingan 1:1:1. Salmonella Enteritidis diperoleh dari Fakultas Kedokteran Hewan, IPB, Bogor yang diisolasi dari hati ayam. Salmonella Paratyphi dan Salmonella Lexington diperoleh dari Laboratorium Mikrobiologi Seafast Center yang diisolasi dari udang pada pedagang pengumpul dan tambak udang di Kabupaten Karawang.
3. Media
Media-media yang digunakan adalah Lysine Iron Agar (LIA), Triple Sugar Iron Agar (TSIA), dan Hektoen Enteric Agar (HEA) untuk konfirmasi Salmonella. Nutrient Agar (NA) dan Nutrient Broth (NB) untuk pertumbuhan Salmonella. Lactose Broth (LB) sebagai media penyembuhan Salmonella. Peptone Water (PW) sebagai pembawa inokulum.
4. Bahan kimia
Bahan-bahan kimia yang digunakan yaitu NaCl 0,85% sebagai larutan pengencer, paraffin cair (mineral oil) steril, gliserol dan manik-manik untuk mengawetkan kultur, alkohol 70% sebagai desinfektan, aquades untuk melarutkan berbagai macam media, spiritus, minyak imersi untuk melihat bakteri pada mikroskop dengan perbesaran 1000 kali,
bahan-bahan untuk pewarnaan Gram seperti pewarna kristal violet, iodium (lugol), safranin, dan alkohol 95%.
5. Alat
Alat yang digunakan dalam penelitian ini adalah autoklaf, oven, sentrifus berpendingin, mikroskop, neraca analitik, inkubator bersuhu 37oC dan 55oC, bulb penghisap, sudip, hot plate, vortex, pipet mikro, tips, sudip, ose bulat dan tusuk, kantung plastik tahan panas, lemari pendingin (chiller dan freezer), bunsen, rak tabung reaksi, selongsong pipet, tutup kapas, aluminium foil, tabung sentrifuse 15 ml, alat semprot, dan alat-alat gelas seperti cawan petri, pipet tetes, gelas objek, tabung vial, manik-manik, tabung reaksi, Erlenmeyer, gelas piala, gelas ukur, labu takar, corong gelas, pipet mohr dan gelas pengaduk.
B. METODE PENELITIAN
Metode penelitian mencakup tahap konfirmasi kultur Salmonella, penyegaran dan pengawetan kultur, persiapan inokulum, pembuatan es, inokulasi kultur, dan evaluasi kemampuan bertahan Salmonella pada es.
1. Konfirmasi Kultur Salmonella (BAM FDA, 2006)
Tahap konfirmasi dilakukan untuk memeriksa kemurnian kultur yang akan digunakan. Konfirmasi kultur Salmonella diawali dengan tahap pewarnaan gram. Konfirmasi kultur dilanjutkan dengan tahap-tahap identifikasi Salmonella. Uji lengkap Salmonella mengacu pada BAM (Bacteriological Analytical Manual). Metode tersebut mencakup lima langkah utama yaitu 1) preenrichment dengan menggunakan media Lactose Broth, 2) selective enrichment dengan menggunakan media Rappaport-Vassiliadis, 3) isolasi Salmonella pada media selektif (HEA, XLDA, atau BSA), 4) identifikasi dan konfirmasi biokimia dengan media TSIA dan LIA.
Penumbuhan Salmonella pada media selektif diawali dengan menginokulasikan 1-2 ose kultur yang berasal dari NA miring ke dalam NB, kemudian diinkubasi pada suhu 37oC selama 24 ± 2 jam. Satu ose
hasil positif dari NB digoreskan pada media HEA lalu diinkubasi pada suhu 37oC selama 24 ± 2 jam. Koloni tipikal kemudian digores dan ditusuk pada agar miring TSIA dan LIA untuk kemudian diinkubasi pada suhu 37oC selama 24 ± 2 jam.
2. Penyegaran dan Pengawetan Kultur (Dewanti-Hariyadi et al., 2001) Kultur Salmonella pada NA miring disegarkan setiap 2 minggu sekali. Penyegaran dilakukan dengan mengambil 1 ose kultur, digores langsung pada NA miring yang baru, kemudian diinkubasi pada suhu 37oC selama 24 ± 2 jam. Setelah 24 jam, kemudian kultur disimpan pada suhu rendah di dalam lemari es.
Pengawetan kultur dilakukan dengan cara imobilisasi menggunakan manik-manik. Satu ose kultur pada NA miring diinokulasikan pada media NB dan diinkubasi pada suhu 37oC selama 24 ± 2 jam. Sejumlah volume suspensi kultur dari media NB diambil lalu ditambahkan pada gliserol steril sehingga perbandingan kultur dengan gliserol adalah 8 banding 2. Campuran tersebut kemudian divorteks lalu dimasukkan ke dalam tabung vial steril yang telah berisi manik-manik sehingga seluruh manik-manik terendam. Sisa suspensi dibuang dan kultur yang telah terperangkap dalam manik-manik disimpan pada suhu pembekuan (-40oC).
3. Persiapan Inokulum
Sebanyak 1-2 ose kultur dari NA miring dipindahkan ke dalam media NB dan diinkubasi selama 24 jam di inkubator bersuhu 37 oC. Setelah diinkubasi selama 24 jam, akan diperoleh Salmonella sekitar 109 CFU/ml. Hasil positif dari media NB kemudian diencerkan dengan NaCl sampai pengenceran 104. Kultur hasil pengenceran diambil sebanyak 1 ml dan dimasukkan ke dalam 9 ml NB sehingga diperoleh kultur sekitar 103 CFU/ml.
Suspensi kultur tersebut kemudian diinkubasi pada suhu 37oC sampai fase log akhir masing-masing galur. Berdasarkan penelitian Hartini (2005) Salmonella Enteritidis dan Salmonella Lexington memiliki fase log
akhir setelah 20 jam inkubasi sedangkan Salmonella Paratyphi memiliki fase log akhir setelah 16 jam inkubasi.
Setelah fase logaritmik akhir tercapai (sekitar 109 CFU/ml), maka kultur siap dipanen dengan cara disentrifuse dingin pada suhu 4oC pada kecepatan 3500 rpm selama 15 menit. Bagian supernatan dibuang dan dari endapan yang tersisa (sekitar 1010 CFU/ml) kemudian ditambah PW sebanyak 10 ml dan dikocok dengan vortex. Pengenceran dilanjutkan sampai konsentrasi 107CFU/ml dan 105 CFU/ml.
Koktil Salmonella diperoleh dengan jalan mencampurkan ke-3 kultur Salmonella masing-masing sebanyak 1 ml dengan penambahan PW. Pencampuran dilakukan untuk mendapatkan Koktil Salmonella yang seragam. Koktil Salmonella yang diperoleh kemudian diencerkan lagi agar mencapai konsentrasi 107 CFU/ml dan 105 CFU/ml. Penginokulasian Salmonella pada es dilakukan pada konsentrasi 103 CFU/ml dan 105 CFU/ml.
4. Pembuatan es dan Inokulasi kultur
Semua sampel es yang digunakan dalam penelitian ini dalam kondisi steril. Es batu dibuat dengan memipet aquades (pH 6,13) sebanyak 39 ml ke dalam kantong plastik tahan panas kemudian disterilisasi. Es mambo (kadar gula 14%) dibuat dengan melarutkan gula sebanyak 14% kedalam aquades. Kemudian larutan gula dipipet sebanyak 39 ml ke dalam plastik tahan panas untuk disterilisasi.
Es susu (kadar gula 14%, kadar protein 2% dan kadar lemak 2%) dibuat dengan penambahan gula dan susu UHT (kadar protein 3,2 % dan kadar lemak 3,2%). Untuk mendapatkan larutan yang memiliki kadar gula 14%, kadar protein 2% dan kadar lemak 2% sebanyak 250 ml maka dibutuhkan gula sebanyak 35 gram dan susu UHT sebanyak 156,25 ml. Air aquades dan gula disterilisasi terlebih dahulu baru kemudian ditambahkan dengan susu UHT. Larutan yang sudah tercampur homogen dipipet secara aseptik sebanyak 39 ml ke dalam kantong plastik steril.
Masing-masing sampel es dibuat dalam dua konsentrasi inokulasi yaitu 3 log CFU/ml dan 5 log CFU/ml. Untuk mendapatkan sampel es dengan konsentrasi inokulum 5 log CFU/ml, sebanyak 1 ml kultur Salmonella yang diperkirakan terdapat 107 CFU/ml diinokulasikan pada sampel sehingga konsentrasi akhir sel dalam es 105 cfu/ml. Untuk mendapatkan sampel es dengan konsentrasi inokulum 3 log CFU/ml, sebanyak 1 ml kultur Salmonella yang diperkirakan terdapat 105CFU/ml diinokulasikan pada sampel sehingga konsentrasi akhir sel dalam es 103 CFU/ml. Pembekuan es dilakukan pada freezer dengan kisaran suhu -20oC sampai -25oC.
5. Evaluasi Kemampuan Bertahan Salmonella
Salmonella yang telah diinokulasikan pada es dihitung jumlahnya dalam interval waktu pembekuan tertentu yaitu pada 0 jam, 24 jam, dan 48 jam. Sampel es diberi perlakuan thawing dalam waterbath pada suhu 30oC selama 2 menit.
Sampel es yang telah mencair dipipet sebanyak 10 ml dan dimasukkan kedalam erlenmeyer yang berisi 90 ml Lactose Broth dengan tujuan menyembuhkan sel subletal Salmonella setelah mengalami proses pembekuan. Proses penyembuhan tersebut dilakukan pada suhu 37oC selama 4 jam. Menurut Bernard (2000) lama waktu penyembuhan bagi sel yang mengalami kerusakan akibat pembekuan pada umumnya 4-5 jam pada kondisi optimum.
Pengenceran dilanjutkan sampai 10-4 dan dipupukkan sampai konsentrasi yang dikehendaki dengan menggunakan medium NA sebagai medium nonselektif dan HEA sebagai medium selektif. Cawan yang berisi media dan sampel tersebut kemudian diinkubasi terbalik pada suhu 37oC selama 48 jam.
Jumlah koloni yang terbentuk pada cawan dihitung sehingga dapat dilihat kemampuannya bertahan terhadap pembekuan dengan cara membandingkan jumlah Salmonella dari masing-masing interval waktu
yang dilakukan. Perhitungan jumlah Salmonella dilakukan menggunakan Standar Plate Count.
Σ C N =
[ (1* n1) + (0,1* n2) +.... ]* (d)
Dimana
Perhitungan Sel yang Mengalami Kerusakan Subletal
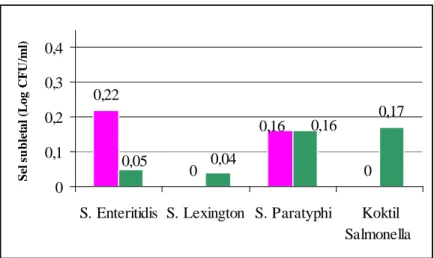
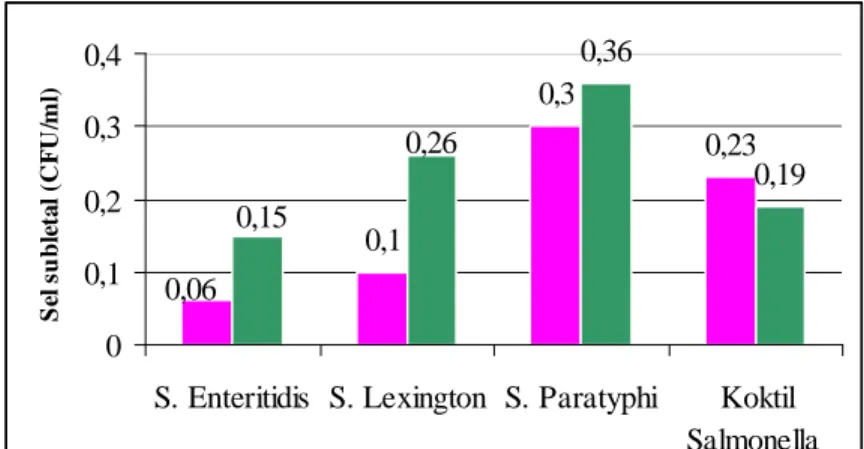
Beberapa peneliti melakukan perhitungan jumlah sel Salmonella yang mengalami kerusakan subletal dengan melihat perbandingan sel-sel yang tumbuh pada medium yang mengandung senyawa penghambat (medium selektif) dan medium yang tidak mengandung senyawa penghambat (medium non selektif) (Fardiaz, 1990). Pada penelitian ini hectoen enteric agar (HEA) digunakan sebagai medium selektif dan nutrient agar (NA) sebagai medium nonselektif.
Pada media NA sel yang bisa tumbuh adalah sel-sel yang rusak dan sel-sel yang normal, sedangkan yang dapat tumbuh pada HEA hanyalah sel-sel yang normal. Jumlah sel yang mengalami kerusakan subletal merupakan selisih antara jumlah sel yang tumbuh pada NA dan jumlah sel yang tumbuh pada HEA.
N = Jumlah koloni per ml atau per g produk
Σ C = Jumlah semua koloni yang dihitung n1 = Jumlah cawan pada pengenceran pertama n2 = Jumlah cawan pada pengenceran kedua D = Pengenceran pertama yang dihitung
IV. HASIL DAN PEMBAHASAN
A. KONFIRMASI KULTUR SALMONELLA
Konfirmasi terhadap kultur Salmonella berguna untuk memeriksa kemurnian kultur yang digunakan dalam penelitian. Konfirmasi dilakukan dengan menggunakan uji lengkap (metode konvensional) Salmonella dan pewarnaan Gram. Uji lengkap Salmonella mengacu pada BAM (Bacteriological Analytical Manual) FDA. Metode tersebut mencakup lima langkah utama yaitu 1) preenrichment dengan menggunakan media Lactose Broth, 2) selective enrichment dengan menggunakan media Rappaport-Vassiliadis, 3) isolasi Salmonella pada media selektif (HEA, XLDA, atau BSA), 4) identifikasi dan konfirmasi biokimia dengan media TSIA dan LIA (BAM, 2006).
Pada penelitian ini tahap preenrichment dan selective enrichment tidak dilakukan karena kultur yang dipakai berasal dari kultur murni Salmonella. Tahap selanjutnya adalah konfirmasi Salmonella dengan membuat goresan kuadran pada media selektif HEA (inkubasi selama 24 ± 2 jam pada suhu 37oC). Hasil uji menunjukkan pertumbuhan koloni tipikal Salmonella yang ditandai dengan warna hijau kehitaman pada koloni.
Tahap selanjutnya adalah uji biokimia dengan menggores dan menusuk koloni tipikal Salmonella dari media HEA ke media TSIA dan LIA. Inkubasi dilakukan selama 24 ± 2 jam pada suhu 37oC. Hasil uji biokimia ini menunjukkan bahwa kelima kultur positif Salmonella. Pada media TSIA terbentuk warna merah dibagian permukaan dan warna hitam dibagian dasar tabung (menghasilkan H2S). Warna merah terjadi karena Salmonella dapat memfermentasi glukosa yang jumlahnya terbatas dalam media, sehingga jika glukosa habis bakteri ini menggunakan peptone sebagai sumber energi yang terjadi dipermukaan agar dan menghasilkan produk sampingan berupa basa (merah). Warna hitam terjadi karena Salmonella dapat menghasilkan gas H2S dari pembentukan Fe-sulfida.
Pada media LIA terbentuk warna ungu di bagian permukaan dan berwarna hitam di bagian dasar tabung (menghasilkan H2S). Warna ungu
terjadi karena Salmonella dapat mendekarboksilasi lisin menghasilkan amin kadaverin yang ditunjukkan dengan berubahnya indikator pH bromkresol ungu menjadi warna ungu. Warna hitam terjadi karena Salmonella dapat menghasilkan H2S dari pembentukan Fe-sulfida.
Hasil konfirmasi dengan menggunakan pewarnaan Gram menunjukkan bahwa ketiga kultur yang digunakan adalah bakteri Gram negatif (yang ditandai dengan terlihatnya warna merah dibawah mikroskop) dan berbentuk batang pendek sesuai dengan pernyataan Bell dan Kyriakides (2003).
B. KEMAMPUAN BERTAHAN GALUR SALMONELLA PADA ES BATU Proses pembekuan dapat menyebabkan kematian atau kerusakan subletal pada sebagian sel yang menyebabkan penurunan jumlah sel mikroba (Fardiaz, 1990). Penurunan jumlah sel selama pembekuan dapat diketahui dengan cara menghitung jumlah sel pada interval waktu tertentu. Pada penelitian ini perhitungan jumlah Salmonella dilakukan pada interval waktu pembekuan 0 jam, 24 jam, dan 48 jam.
Sampel es diberi perlakuan thawing terlebih dahulu sebelum dilakukan proses penyembuhan. Berdasarkan ketentuan yang terdapat dalam BAM FDA (BAM, 2006) thawing untuk semua produk beku dilakukan pada suhu di bawah 45oC selama kurang dari 15 menit atau pada suhu 2-5oC selama 18 jam. Pada penelitian ini sampel es diberi perlakuan thawing dalam water bath pada suhu 30oC selama 2 menit. Menurut Jay (1978) semakin cepat proses thawing, semakin banyak jumlah bakteri yang bertahan.
Setelah proses thawing sampel es yang mengandung kultur Salmonella diberi perlakuan penyembuhan dengan cara menumbuhkan pada media lactose broth. Lactose broth berfungsi sebagai media penyembuhan bagi Salmonella yang mengalami kerusakan subletal saat pembekuan. Menurut Fardiaz (1990) sel yang mengalami kerusakan subletal harus terlebih dahulu disembuhkan dengan medium penyembuhan supaya dapat tumbuh secara normal dan berkembang biak.
Proses penyembuhan sel yang mengalami kerusakan subletal memerlukan medium yang baik dan kaya akan nutrien, tetapi tidak
mengandung komponen selektif atau senyawa yang bersifat menghambat. Yousef dan Carlstrom (2003) menyatakan bahwa Lactose broth merupakan media yang sering digunakan dalam tahap preenrichment. Laktosa yang terdapat dalam medium tersebut mendorong penyembuhan lambat bagi sel Salmonella yang mengalami kerusakan karena penyimpanan beku.
Proses penyembuhan Salmonella pada penelitian ini dilakukan pada suhu inkubasi 37oC selama 4 jam. Bernard (2000) menyatakan bahwa lama waktu penyembuhan bagi sel yang mengalami kerusakan akibat pembekuan pada umumnya 4-5 jam pada kondisi optimum. Suhu inkubasi yang digunakan untuk penyembuhan sel yang mengalami kerusakan subletal bervariasi, yaitu antara 25-37oC, dimana suhu yang lebih tinggi akan lebih efektif untuk kebanyakan organisme mesofil (Fardiaz, 1992).
Plating untuk menghitung jumlah sel dilakukan setelah proses penyembuhan selesai. Plating dilakukan dengan menggunakan media NA dan HEA. Sel Salmonella yang tumbuh pada media NA adalah sel-sel yang rusak dan sel-sel yang normal, sedangkan yang bisa tumbuh pada media HEA hanyalah sel Salmonella yang normal saja. Hasil perhitungan dari kedua media tersebut digunakan untuk mengetahui kemampuan bertahan Salmonella selama proses pembekuan dan tingkat kerusakan subletal yang terjadi.
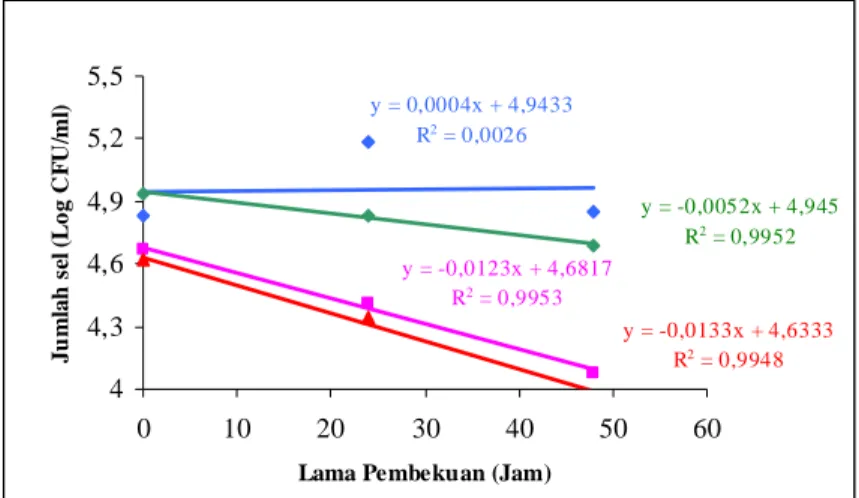
1. Perilaku Galur Salmonella Selama Proses Pembekuan Es Batu
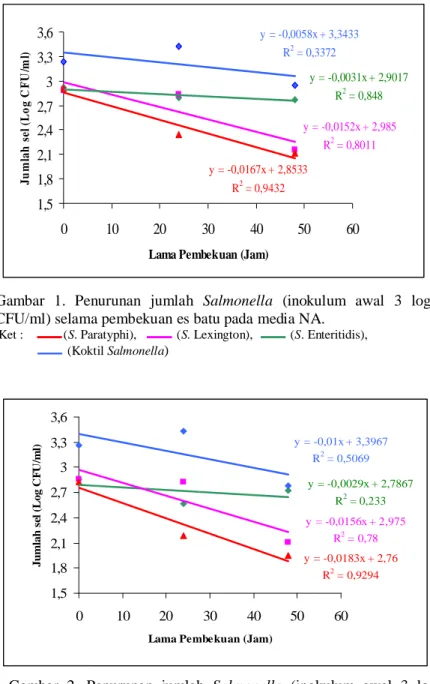
Ketiga galur dan Koktil Salmonella mengalami penurunan selama pembekuan es batu. Gambar 1 dan 2 dibawah menunjukkan penurunan Salmonella (inokulum awal 3 log CFU/ml) yang terdeteksi pada media NA dan HEA.
y = -0,0167x + 2,8533 R2 = 0,9432 y = -0,0152x + 2,985 R2 = 0,8011 y = -0,0031x + 2,9017 R2 = 0,848 y = -0,0058x + 3,3433 R2 = 0,3372 1,5 1,8 2,1 2,4 2,7 3 3,3 3,6 0 10 20 30 40 50 60
Lama Pembekuan (Jam)
Ju m lah sel (Lo g C FU /m l)
Dari Gambar 1 dan 2 diatas terlihat bahwa pada konsentrasi inokulum 3 log CFU/ml ketiga galur dan Koktil Salmonella mengalami penurunan selama pembekuan baik yang terdeteksi di media NA maupun HEA. Sel Salmonella yang tumbuh pada media NA adalah sel yang sehat dan sel yang mengalami kerusakan subletal karena pengaruh pembekuan. Sementara itu, sel Salmonella
Gambar 1. Penurunan jumlah Salmonella (inokulum awal 3 log CFU/ml) selama pembekuan es batu pada media NA.
Ket : (S. Paratyphi), (S. Lexington), (S. Enteritidis), (Koktil Salmonella)
Gambar 2. Penurunan jumlah Salmonella (inokulum awal 3 log CFU/ml) selama pembekuan es batu pada media HEA.
Ket: (S. Paratyphi), (S. Lexington), (S. Enteritidis), (Koktil Salmonella) y = -0,0183x + 2,76 R2 = 0,9294 y = -0,0029x + 2,7867 R2 = 0,233 y = -0,0156x + 2,975 R2 = 0,78 y = -0,01x + 3,3967 R2 = 0,5069 1,5 1,8 2,1 2,4 2,7 3 3,3 3,6 0 10 20 30 40 50 60
Lama Pembekuan (Jam)
Jumlah se l (Log C F U /m l)
yang tumbuh pada media HEA adalah sel yang sehat saja karena pada media tersebut mengandung senyawa penghambat sehingga sel Salmonella yang mengalami kerusakan subletal tidak mampu untuk tumbuh. Secara berturut-turut, laju penurunan jumlah sel dari yang tertinggi ke yang terendah baik di media NA maupun HEA adalah Salmonella Paratyphi, Salmonella Lexington, Koktil Salmonella, dan Salmonella Enteritidis.
Laju penurunan Salmonella Paratyphi sebesar 0,0167 log CFU/ml per jam di media NA dan 0,0183 log CFU/ml per jam di media HEA. Sementara itu, laju penurunan Salmonella Enteritidis sebesar 0,0031 log CFU/ml per jam di media NA dan 0,0029 log CFU/ml per jam di media HEA. Selama pembekuan jumlah Salmonella Enteritidis relatif konstan. Koktil Salmonella yang merupakan campuran dari ketiga galur memiliki laju penurunan yang lebih tinggi daripada Salmonella Enteritidis tetapi lebih rendah daripada Salmonella Lexington dan Salmonella Paratyphi yaitu 0,0058 log CFU/ml per jam pada media NA dan 0,01 log CFU/ml per jam pada media HEA.
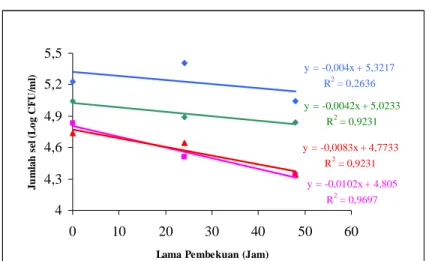
Gambar 3 dan 4 dibawah menunjukkan penurunan Salmonella (inokulum awal 5 log CFU/ml) yang terdeteksi di media NA dan HEA.
Gambar 3. Penurunan jumlah Salmonella (inokulum awal 5 log CFU/ml) selama pembekuan es batu pada media NA.
Ket : (S. Paratyphi), (S. Lexington), (S. Enteritidis), (Koktil Salmonella) y = -0,0102x + 4,805 R2 = 0,9697 y = -0,0083x + 4,7733 R2 = 0,9231 y = -0,0042x + 5,0233 R2 = 0,9231 y = -0,004x + 5,3217 R2 = 0,2636 4 4,3 4,6 4,9 5,2 5,5 0 10 20 30 40 50 60
Lama Pembekuan (Jam)
Ju mlah s el (Lo g C FU /m l)