SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
MUH.UMAR AL MOKHTAR G0005136
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
PENGESAHAN SKRIPSI
Skripsi dengan judul : Pengaruh Pemberian Jus Tomat (Lycopersicum esculentum Mill.) terhadap Kadar Kolesterol LDL
Tikus Putih (Rattus norvegicus)
Muh.Umar Al Mokhtar, NIM : G0005136, Tahun 2008 Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi
Fakultas Kedokteran Universitas Sebelas Maret Pada Hari Kamis Tanggal 27 November 2008
Sri Wahjono, dr., M.Kes. Dr. A.A. Subiyanto, dr., MS.
NIP : 030 134 646 NIP : 030 134 565
PERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, 27 November 2008
PERSETUJUAN
Proposal Penelitian/Skripsi dengan judul: Pengaruh Pemberian Jus Tomat(Lycopersicum esculentum Mill.) Terhadap Kadar
Kolesterol LDL Tikus Putih(Rattus norvegicus)
Muh.Umar Al Mokhtar, G0005136, Tahun 2008
Telah disetujui untuk dipertahankan di hadapan Tim Ujian Skripsi Fakultas Kedokteran Universitas Sebelas Maret Surakarta
Pada Hari………… , Tanggal November 2008
Pembimbing Utama Penguji Utama
Dian Ariningrum, dr., SpPK, MKes. P. Murdani K, dr., MHPEd.
NIP: 132 319 202 NIP: 130 786 875
Pembimbing Pendamping Anggota Penguji
Kustiwinarni, Dra., Apth. Sri Hartati H, Dra., Apt., SU.
Tim Skripsi
PRAKATA
Penulis mengucapkan puji syukur kehadirat Allah SWT atas berkat, kasih, karunia dan penyertaan-Nya sehingga penulis dapat menyelesaikan skripsi berjudul “ Pengaruh Pemberian Jus Tomat (Lycopersicum esculentum Mill.) Terhadap Kadar Kolesterol LDL Tikus Putih (Rattus norvegicus)”.
Selama proses penyelesaian skripsi ini tentunya tidak lepas dari bantuan dan dukungan dari berbagai pihak. Maka pada kesempatan ini perkenankanlah penulis menyampaikan rasa terima kasih kepada :
1. Dr. A.A. Subijanto, dr., MS, selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret, Surakarta.
2. Sri Wahjono, dr., M. Kes, selaku Ketua Tim Skripsi FK UNS
3. Dian Ariningrum, dr., SpPK, M. Kes, selaku Pembimbing Utama yang telah meluangkan waktu dan tenaga untuk memberikan bimbingan penyusunan skripsi.
4. Kustiwinarni, Dra., Apth., selaku Pembimbing Pendamping yang telah meluangkan waktu dan tenaga untuk memberikan bimbingan penyusunan skripsi.
5. P. Murdani K, dr., MHPEd., selaku Penguji Utama yang telah memberikan bimbingan, kritik dan saran penulisan skripsi.
6. Sri Hartati H., Dra., Apt., SU., selaku Penguji Pendamping yang telah memberikan bimbingan, kririk dan saran penulisan skripsi.
7. Staf Laboratorium Biokimia (Bapak Widayaka dan Ibu Sumiyati) Fakultas Kedokteran UNS yang telah memberikan bantuan penyelesaian skripsi. 8. Bagian skripsi FK UNS (Bapak Sunardi dan Ibu Enny, S.H., M.H.) yang
turut membantu penyusunan skripsi.
9. Kedua orangtuaku tercinta dan adikku yang telah memberikan doa dan dukungan baik material maupun spiritual.
10. Bapak Samidi dan Bapak Sugito, selaku staf LPPT Unit IV UGM yang telah membantu pengambilan data penelitian.
11. Ismawardi, teman senasib seperjuangan dengan kebersamaan, dukungan dan perhatian yang diberikan kepada penulis telah membantu penyelesaian skripsi.
12. Mas Udin yang telah membantu pengolahan data dengan Program SPSS Windows.
E. Identifikasi Variabel Penelitian ... 25
F. Definisi Operasional Variabel ... 26
G. Alur Penelitian ... 32
H. Alat, Bahan dan Cara Kerja ... 33
I. Langkah Penelitian ... 37
J. Analisis Statistik... 39
BAB IV HASIL PENELITIAN... 41
BAB V PEMBAHASAN... 47
BAB VI SIMPULAN DAN SARAN ... 64
A. Simpulan ... 64
B. Saran. ... 64
DAFTAR GAMBAR
Halaman
Gambar 1. Metabolisme Kolesterol LDL 7
Gambar 2. Mekanisme Karotenoid dan Flavonol Tomat 15 terhadap Penurunan Kolesterol LDL
Gambar 3. Struktur Kimia dan Metabolisme Likopen 16
Gambar 4. Struktur Kimia dan Metabolisme β-karoten 17
Gambar 5. Distribusi Data Kolesterol LDL Kedua Kelompok 43
sebelum Perlakuan
Gambar 6. Distribusi Data Kolesterol LDL Kedua Kelompok 44 setelah Perlakuan
Gambar 7. Rerata Kadar Kolesterol LDL Tikus Putih 46
sebelum dan sesudah Perlakuan (mg/dl)
Gambar 8. Siklus Diurnal Hiperkolesterolemia 48
Gambar 9. Hubungan Pakan Hiperkolesterolemik dengan 49 Peningkatan Aktivitas ACAT
Gambar 10. Pengaruh Hormon T3 terhadap Reseptor Kolesterol LDL 50
Gambar 11. Hubungan Pemberian Larutan PTU 0,1 % terhadap 51 Reseptor Kolesterol LDL
Gambar 12. Metabolisme Asam Empedu 59
Gambar 13. Jalur Absorpsi dan Metabolisme Karoten 61 DAFTAR TABEL
Halaman
Tabel 1. Profil Kolesterol LDL 8
Tabel 2. Rerata Berat Badan Tikus Putih
sebelum Perlakuan 41
Tabel 3. Rerata Kadar Kolesterol LDL Tikus Putih
sebelum Perlakuan pada Kedua Kelompok 43
Tabel 4. Rerata Kadar Kolesterol LDL Tikus Putih
setelah Perlakuan pada Kedua Kelompok 44 Tabel 5. Rerata Kadar Kolesterol LDL Tikus Putih
sebelum dan setelah Perlakuan Kelompok I 45 Tabel 6. Rerata Kadar Kolesterol LDL Tikus Putih
DAFTAR LAMPIRAN
Lampiran A Cara Pembuatan Jus Tomat Lampiran B Perhitungan Dosis Jus Tomat. Lampiran C Perhitungan Dosis PTU
Lampiran D Perhitungan Dosis Pakan Hiperkolesterolemik
Lampiran E Data Biologi Tikus Putih
Lampiran F Volume Maksimal Lambung Tikus Putih Lampiran G Komposisi Pelet 21
Lampiran H Komposisi Zat Tomat
Lampiran I Konversi Perhitungan Dosis untuk Berbagai Jenis Hewan dan Manusia
Lampiran J Biosintesis Flavonoid dan Flavonol Tomat
Lampiran K Biosintesis Likopen
Lampiran L Kadar Kolesterol LDL Berdasarkan Umur Tikus Putih Lampiran M Metabolisme Kolesterol dan Lipoprotein
Berdasarkan Strain Tikus Putih
Lampiran N Pengaruh ACAT terhadap Esterifikasi Kolesterol Lampiran O Pengaruh Hiperkolesterolemia terhadap abnormalitas Lipoprotein dan Sekresi Empedu
Lampiran P Kandungan Polyenoic Acid pada Beberapa Pakan Hiperkolesterolemik.
Penurunan Kadar Kolesterol LDL
Lampiran R Hubungan Lama Pemanasan terhadap Penurunan Likopen dan Pengaruh Lama Pemanasan pada Suhu Sedang
terhadap Peningkatan Likopen
Lampiran S Hasil Pengukuran Berat Badan Tikus Putih sebelum Perlakuan
Lampiran T Hasil Pengukuran kadar kolesterol LDL Tikus Putih sebelum Perlakuan.(sebelum eliminasi data ekstrim) Lampiran U Hasil Pengukuran Kadar kolesterol LDL Tikus Putih setelah Perlakuan (sebelum eliminasi data ekstrim) Lampiran V Uji Normalitas Data Berat Badan dan Kolesterol LDL Tikus Putih sebelum dan sesudah Perlakuan
(sebelum eliminasi data ekstrim)
Lampiran W Grafik Normalitas Berat Badan tikus Putih Lampiran X Grafik Normalitas Kadar Kolesterol LDL Kelompok I sebelum dan setelah Perlakuan (sebelum eliminasi data ekstrim)
Lampiran Y Grafik Normalitas Kadar Kolesterol LDL Kelompok II sebelum dan setelah Perlakuan (sebelum eliminasi data ekstrim)
Lampiran Z Hasil Pengukuran kadar kolesterol LDL Tikus Putih sebelum Perlakuan.(setelah eliminasi data ekstrim) Lampiran AA Hasil Pengukuran Kadar kolesterol LDL Tikus Putih setelah Perlakuan (setelah eliminasi data ekstrim) Lampiran BB Uji Normalitas Data Berat Badan dan Kolesterol LDL Tikus Putih sebelum dan sesudah Perlakuan
(setelah eliminasi data ekstrim)
Lampiran CC Uji t Berat Badan tikus Putih sebelum Perlakuan Lampiran DD Uji t Kadar Kolesterol LDL Tikus Putih Kelompok I sebelum dan setelah Perlakuan
sebelum dan setelah Perlakuan
Lampiran FF Uji t Kadar Kolesterol LDL Tikus Putih Kelompok I dan II sebelum Perlakuan Lampiran GG Surat Ijin Penelitian
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Peningkatan kesejahteraan penduduk dan ketersediaan pangan mengakibatkan perubahan pola konsumsi ke jenis-jenis makanan kaya lemak dan rendah serat (Tsalissavrina, 2006). Penyakit Jantung Koroner (PJK) merupakan penyebab utama morbiditas dan mortalitas di negara maju maupun di negara berkembang (Sargowo,1995). PJK menempati urutan pertama penyebab kematian penduduk di Indonesia (Sitopoe, 1992).
Aterosklerosis merupakan penyebab PJK (Priyana, 2007). Aterosklerosis merupakan gangguan pembuluh darah koroner akibat penimbunan plak lipid di dinding arteri (Tsalissavrina, 2006). Proses aterosklerosis dimulai sejak usia anak-anak. Proses tersebut dimulai dengan pembentukan fatty streak pada umur 3 tahun, fibrous plaque pada masa remaja dan menyebabkan komplikasi lesi berupa kalsifikasi dinding pembuluh darah. Proses tersebut sangat dipengaruhi oleh peninggian kadar kolesterol Low DensityLipoprotein (LDL) (Saap, 2007).
PJK merupakan masalah komplek dan multifaktorial sehingga memerlukan perhatian dan penanganan secara holistik secara farmakologik dan farmakologik (Maryanto dan Fatimah, 2006). Aspek non-farmakologik merupakan faktor terpenting penanganan penyakit jantung (Waspadji, 2006). Salah satu penanganan non-farmakologik adalah konsumsi sayuran dan buah (Maryanto dan Fatimah, 2006).
Berdasarkan penelitian di Universitas Oulu, konsumsi jus tomat menurunkan kolesterol LDL sebesar 13% (Silaste et al, 2007). Namun, berdasarkan penelitian Briviba et al (2004) dan Hininger et al (2001), konsumsi jus tomat tidak mempunyai efek terhadap penurunan kolesterol LDL teroksidasi dan penurunan lipid peroksidase plasma (Basu dan Imrhan, 2006).
Perbedaan hasil penelitian tersebut terjadi karena perbedaan waktu pemberian jus tomat, beberapa zat karotenoid jus tomat yang saling menghambat aktivitas antarkelompok karotenoid lain, aktivitas pH lambung yang berperan mengisomerasi karotenoid, pengaruh enzim pencernaan melarutkan karotenoid dan pengaruh hormon tiroid yang mengatur metabolisme lemak (Olson, 1994). Hal inilah yang mendasari peneliti untuk meneliti lebih lanjut pengaruh pemberian jus tomat terhadap kadar kolesterol LDL tikus putih.
B. Perumusan Masalah
Apakah ada pengaruh pemberian jus tomat (Lycopersicum esculentum
Mill) terhadap kadar kolesterol LDL tikus putih (Rattus norvegicus)?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian jus tomat (Lycopersicum esculentum Mill) terhadap kadar kolesterol LDL tikus putih (Rattus norvegicus).
D. Manfaat Penelitian 1. Manfaat teoritis
Penelitian ini memperkaya pengetahuan di Bidang Biokimia dan berbagai disiplin ilmu terkait penggunaan tanaman obat Indonesia, khususnya tomat yang mempunyai efek menurunkan kadar kolesterol LDL.
2. Manfaat aplikatif
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1. Tomat
a. Deskripsi Tomat 1) Akar
Akar tunggang dengan akar samping yang menjalar tanah. 2) Batang
Batang bulat menebal pada buku-bukunya, berambut kasar dan berwarna hijau keputihan.
3) Daun
Daun berukuran 10-40 cm dan berwarna hijau muda. Daun bersifat majemuk dan menyirip, letak berseling, berbentuk bundar telur sampai memanjang, ujung runcing dan pangkal membulat. Daun yang besar bertepi lekuk, sedangkan daun yang lebih kecil bertepi gerigi.
4) Bunga
5) Buah
Buah buni, berdaging, berkulit tipis, mengkilap, beragam dalam bentuk maupun ukurannya dan berwarna kuning atau merah. 6) Biji
Biji banyak, pipih dan berwarna kuning kecokelatan Tomat diperbanyak dengan menggunakan biji (Dalimartha, 2003 ; Trisnawati dan Setyawan, 1994).
b. Taksonomi Tomat
Sistematika kedudukan tomat secara botanis (Rukmana,1994): Kingdom : Plantae
Divisio : Spermatophyta Sub divisio : Angiospermae Klas : Dicotyledoneae Sub Klas : Metaclamidae Ordo : Tubiflorae Famili : Solanaceae Genus : Lycopersicum
c. Kandungan Kimia dalam Tomat
Tomat mengandung alkaloid solanin, saponin, asam folat, asam malat, asam sitrat, flavonoid, protein, lemak, gula (glukosa dan fruktosa), adenin, trigolenin, kolin, tomatin, mineral (Ca, Mg, P, K, Na, Fe, sulfur dan klorin), vitamin (B111, B2, B6, C, E dan niasin) dan histamin (Dalimartha, 2003). Tomat juga mengandung provitamin A, asam folat, kaumarin, serat dan beta karoten (Arab dan Steck, 2002 dan Wirakusumah, 2006).
Selain itu, tomat mengandung kelompok flavonol dan karotenoid. Kelompok flavonol seperti kaemferol, quercetin, myrisetin dan isohamnetin, sedangkan kelompok karotenoid seperti likopen (25-76 %), fitoeten (10-12%), γ-karoten (10-11%), neurosporen (7-9%), fitofluen (4-5%), β-karoten (1-2%) dan sedikit lutein (Clinton, 1998 ; Haytowitz et al, 2007).
2. Kolesterol LDL (Low Density Lipoprotein)
Lipoprotein disintesis di hepar. Proporsi liporotein terdiri atas seperempat sampai sepertiga bagian adalah protein dan sisanya lemak (Almatsier, 2004). Lipoprotein adalah partikel berbentuk bola dan mempunyai inti hidrofobik yang mengandung ester kolesterol dan trigliserida. Inti hidrofobik tersebut dikelilingi oleh selapis kolesterol tidak teresterifikasi, fosfolipid dan protein spesifik (apolipoprotein) (Katzung,1998). Apolipoprotein (Apo) mempertahankan struktur lipoprotein dan mengarahkan lipoprotein ke metabolisme lemak (Murray, 2003). Dari beberapa macam apolipoprotein, hanya ApoB-100 dan ApoE yang dapat dikenali oleh reseptor membran sel (Kamaluddin,1993).
Gambar 1. Metabolisme Kolesterol LDL
(Sumber: Murray, 2003)
Kamaluddin, 1993). Kolesterol LDL merupakan lipoprotein yang meneruskan kolesterol ke reseptor kolesterol LDL di jaringan ekstrahepatik. Kebutuhan kolesterol sel-sel tubuh akan terpenuhi melalui reseptor tersebut. Reseptor tersebut juga berperan sebagai faktor penghambat sintesis kolesterol endogen di hepar (Tjokroprawiro, 1989). Tabel 1. Profil Kolesterol LDL (Ariantini dan Suryaatmadja, 2000)
dengan reseptor ApoE di hepar (Linder, 1992). Remnant kolesterol VLDL atau IDL tidak hanya mengandung trigliserida, kolesterol, ApoB dan ApoE, tetapi juga menjadi kolesterol LDL apabila kehilangan trigliserida dan ApoE (Pusparini,2006). Faktor-faktor yang mempengaruhi pembersihan kolesterol LDL di plasma yaitu:
a. Reseptor kolesterol LDL
Kolesterol LDL berikatan dengan reseptor kolesterol LDL. Reseptor kolesterol LDL adalah reseptor permukaan sel yang berisi ApoB-100. Selain itu, permukaan sel terdapat reseptor ApoE yang mempunyai afinitas kuat terhadap remnant kolesterol VLDL, khususnya di hepar. Peningkatan reseptor ApoE menurunkan kolesterol LDL (Halim, 2006).
Komplek reseptor-kolesterol LDL memasuki sel melalui endositosis. Di dalam endosom (lisosom), kolesterol LDL dan ApoB-100 dipisahkan dari reseptornya. Reseptor kolesterol LDL yang sudah terpisah dari komplek reseptor-kolesterol LDL kembali ke permukaan sel. Molekul kolesterol LDL sendiri dihancurkan menjadi beberapa asam amino dan kolesterol bebas (Halim, 2006).
kolesterol LDL (down regulation). Aktivitas down regulation
menyebabkan peningkatan kolesterol LDL (Halim, 2006).
Mutasi reseptor kolesterol LDL sangat berpengaruh terhadap kolesterol LDL. Mutasi tersebut meningkatkan kolesterol LDL. Peningkatan kolesterol LDL menyebabkan sistem scavenger makrofag bekerja keras membersihkan kolesterol LDL (Halim, 2006). Hal tersebut menyebabkan makrofag membentuk sel-sel busa (foam cell).
Pembentukan foam cell merupakan salah satu prediktor aterosklerosis. Oleh karena itu, reseptor kolesterol LDL sebagai competitor inhibitor
pembersihan kolesterol LDL melalui sistem scavenger (Tjokroprawiro, 1989).
Lima macam mutasi reseptor kolesterol LDL (Halim, 2006):
1) Mutasi Null (Rº) menyebabkan sintesis protein reseptor kolesterol LDL di retikulum endoplasmik berkurang atau tidak terbentuk. 2) Mutasi yang menyebabkan kelainan transpor intraseluler dan
kelainan kolesterol LDL di aparatus golgi.
3) Mutasi yang menyebabkan kelainan ligand ekstraseluler dan kelainan pengikatan kolesterol LDL.
4) Mutasi (R+) menyebabkan kelainan endositosis.
b. Partikel kolesterol LDL
Partikel kolesterol LDL mempunyai ukuran, densitas dan komponen kimia heterogen. Pola kolesterol LDL dibagi menjadi dua fenotip, yaitu fenotip A dan fenotip B. Fenotip A berukuran besar disebut kolesterol LDL peak partikel diameter. Kolesterol LDL tersebut merupakan kolesterol LDL utama. Kolesterol LDL fenotip A berjalan lambat sehingga memperpanjang waktu pembersihan kolesterol LDL. Sebaliknya, kolesterol LDL fenotip B atau small dense
LDL (sd-LDL) sangat mudah berikatan oleh jaringan perifer sehingga pembersihan kolesterol LDL berjalan cepat (Ariantini dan Suryaatmadja, 2000 dan Pusparini, 2006).
Pembentukan sd-LDL dikatalisis oleh enzim Cholesteryl Ester Transfer Protein (CETP). Peningkatan aktivitas CETP terjadi pada keadaan hiperkolesterolemia. CETP menukarkan trigliserida dari kolesterol VLDL dan IDL ke kolesterol HDL dan LDL. Kolesterol HDL dan LDL mengandung trigliserida disebut lipoprotein kaya trigliserida (TGrL). TGrL mengalami hidrolisis menjadi sd-LDL (Halim, 2006).
c. Kolesterol bebas
bebas menghambat enzim HMG Ko A reduktase. Penurunan HMG KoA reduktase meningkatkan pemasukan kolesterol LDL dengan meningkatkan sintesis reseptor kolesterol LDL (Halim, 2006).
d. Lipoprotein lipase
Sekresi lipoprotein dipengaruhi oleh aktivitas enzim lipoprotein lipase. Perangsangan enzim tersebut meningkatkan pembersihan kilomikron dan kolesterol VLDL. Penurunan kolesterol VLDL menurunkan kolesterol LDL (Kamaluddin, 1993).
e. Sintesis garam empedu
Stimulasi aktivitas enzim 7-α hidroksilase mengakibatkan perubahan kolesterol endogen menjadi garam empedu. Peningkatan sintesis asam empedu menyebabkan penurunan kolesterol endogen di hepar. Penurunan kolesterol endogen di hepar meningkatkan reseptor kolesterol LDL untuk memenuhi kebutuhan kolesterol di hepar. Peningkatan kebutuhan kolesterol LDL di hepar menurunkan kolesterol LDL (Fikriah dkk, 2005).
f. Karbamilasi dan glikosilasi kolesterol LDL
dengan antibodi. Ikatan kolesterol LDL terglikosilasi dengan antibodi merusak sel endotel pembuluh darah (Tjokroprawiro, 1989).
g. Stres
Stres meningkatkan kolesterol LDL (Nyam News, 2004). Stres tikus putih disebabkan oleh perlakuan berulang kali dalam jangka waktu lama, kandang penuh dan suhu dingin. Keadaan tersebut merangsang pelepasan epinefrin (Ganong, 2003).
Epinefrin merangsang pelepasan insulin. Insulin merangsang pengeluaran enzim lipoprotein lipase. Enzim lipoprotein lipase meningkatkan kolesterol remnant VLDL. Peningkatan remnant VLDL meningkatkan kadar kolesterol LDL (Murray, 2003).
h. Genetik
Heterogenitas genetik tikus putih sebagai hewan percobaan mempengaruhi metabolisme kolesterol LDL. Faktor genetik tidak dapat dikendalikan sepenuhnya. Peneliti berusaha mengendalikannya dengan menggunakan tikus putih dari strain yang sama yaitu strain Wistar sehingga sampel bersifat homogen.
i. Kerusakan sel hepar
Kerusakan sel hepar mempengaruhi kolesterol LDL. Kolesterol LDL sebagian besar berasal dari kolesterol VLDL. Kerusakan sel hepar mengakibatkan defisiensi Microsomal Triacylglycerol Transfer Protein
Defisiensi MTTP menganggu pembentukan kolesterol VLDL. Gangguan perakitan polipeptida mencegah pembentukan ApoB-100. Penurunan sintesis kolesterol VLDL dan ApoB-100 menurunkan kadar kolesterol LDL. Dengan demikian, kerusakan sel hepar menurunkan kolesterol LDL (Murray, 2003 dan Shepherd, 2001).
j. Kerusakan sel beta pankreas
Kerusakan sel beta pankreas menurunkan insulin. Penurunan insulin menurunkan enzim lipoprotein lipase. Penurunan lipoprotein lipase menghambat pembentukan kolesterol remnant VLDL. Penurunan kolesterol remnant VLDL menurunkan kolesterol LDL (Murray, 2003).
k. Hormon tiroid
Hormon tiroid mempengaruhi metabolisme karbohidrat, protein dan lemak (Sacker dan McPherson, 2004). Tikus normal bersifat hipertiroid (Martin et al, 1983). Hormon tiroid meningkatkan jumlah reseptor kolesterol LDL di hepar (Ganong, 2003). Peningkatan jumlah reseptor kolesterol LDL di hepar menurunkan kolesterol LDL.
3. Mekanisme Penurunan Kolesterol LDL oleh Tomat
Gambar 2. Mekanisme Karotenoid dan Flavonol Tomat terhadap Penurunan Kolesterol LDL
(Sumber: Zern L.T dan Fernandez L.M. 2005 )
a. Likopen (C40 H56)
Likopen merupakan pigmen berwarna merah. Likopen ditemukan pada buah dan sayuran, seperti tomat, semangka, anggur merah, pepaya, jambu merah, wortel, ubi merah, apel dan aprikot (Agarwal dan Rao, 2000 dan Shi dan Maguer, 2000). Kandungan likopen paling banyak di tomat (Campbell et al, 2004).
Gambar 3. Struktur Kimia dan Metabolisme Likopen dalam Tubuh (Sumber: Quan Hu et al. 2005)
Metabolisme likopen dalam tubuh terjadi bersamaan dengan metabolisme lemak. Setelah lemak dicerna oleh enzim lipase pankreas di dalam duodenum dan diemulsi oleh garam empedu menjadi misel- misel, misel yang mengandung likopen memasuki mukosa sel usus melalui difusi pasif. Setelah misel diserap oleh usus, likopen dibawa oleh kilomikron ke aliran darah melalui sistem limfatik. Likopen didistribusikan ke jaringan terutama melalui kolesterol LDL (Clinton, 1998).
HMG-KoA reduktase dan peningkatan reseptor kolesterol LDL di hepar menurunkan kolesterol LDL.
b. Beta karoten (C40H56)
Beta karoten merupakan karotenoid hidrokarbon dengan rantai ujung berstruktur sikloheksena. Beta karoten adalah produk dari reaksi siklisasi rantai ujung asiklik likopen (Paiva et al,1999).
Gambar 4. Metabolisme dan Struktur β-karoten
(Sumber: Haila K. 1999)
c. Niasin (Vitamin B3)
Niasin berpengaruh secara tidak langsung terhadap kadar kolesterol LDL. Niasin menekan sekresi kolesterol Very low Density Lipoprotein (VLDL) di hepar melalui penurunan inhibisi aliran asam lemak bebas di jaringan adiposa. Keadaan tersebut mengurangi pembentukan kolesterol VLDL, IDL dan LDL (Rahayu, 2005). Apabila kolesterol VLDL menurun, maka kolesterol LDL akan menurun. Selain itu, niasin menurunkan trigliserida (Kamaluddin, 1993).
d. Narigenin (C15H12O5)
Narigenin adalah flavonoid utama tomat. Kandungan kimia tersebut banyak ditemukan di kulit tomat. Narigenin secara simultan dibentuk bersamaan dengan pematangan buah. Selain itu, narigenin masih ditemukan di daging tomat berbentuk glikosida (Verhoeyen et al, 2001).
e. Esculeogenin A
Esculeogenin A merupakan senyawa sapogenol baru tomat. Berdasarkan penelitian Yukio et al (2007), esculeogenin A merupakan bentuk aglikon dari esculoside A karena esculeogenin A merupakan senyawa spirosolane tipe glikosida. Kandungan senyawa tersebut 4 kali lebih tinggi daripada likopen tomat. Manfaat utama esculeogenin A adalah penurunan kolesterol. Esculeogenin A menghambat esterifikasi kolesterol di makrofag dengan mekanisme penghambatan enzim ACAT-1 dan ACAT-2. Penghambatan ACAT menurunkan kadar kolesterol LDL (World Intelectual Organization, 2000).
f. Flavonol
Buah dan sayuran merupakan sumber utama flavonol. Flavonol menurunkan kolesterol LDL teroksidasi di makrofag. Ada lima macam flavonol yang penting menurunkan insidensi penyakit jantung, seperti
quercetin, myricetin, kaemferol, rutin dan morin. Flavonol tersebut secara in vitro menurunkan kolesterol LDL terglikosilasi (Ghafari dan Mojab, 2006).
Mekanisme kaemferol dan myricetin menurunkan kadar kolesterol LDL terjadi secara tidak langsung melalui penghambatan glikosilasi dan karbamilasi kolesterol LDL dan secara langsung menghambat enzim HMG Ko-A reduktase dan ACAT. Pada keadaan terglikosilasi, kolesterol LDL tidak dapat dikenali oleh reseptor kolesterol LDL di hepar sehingga kadar kolesterol LDL meningkat (Ghafari dan Mojab, 2006).
Keterangan:
: memacu
: menghambat
: meningkatkan
: menurunkan
: Variabel yang akan diteliti
: Zat penginduksi hiperkolesterolemik
LDL : Low Density Lipoprotein
HMG : Hydroxy Methyl Glutaril
C. Hipotesis
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian:
Penelitian bersifat eksperimental laboratorik dengan pre and post test controlled group design.
B. Lokasi Penelitian:
Pemberian perlakuan dan pengukuran kadar kolesterol LDL tikus putih dilakukan peneliti di Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Unit II Universitas Gadjah Mada Yogyakarta.
C. Subjek Penelitian:
Tikus diperoleh dari LPPT Unit II UGM berupa tikus putih (Rattus norvegicus) jantan, Strain Wistar, tidak kawin, sehat dan mempunyai aktivitas normal, berumur kurang lebih 3 bulan dengan berat badan 180-200 gram.
D. Teknik Sampling:
Rumus Federer:
Keterangan:
n= besar sampel tiap kelompok t= banyaknya kelompok
( n – 1 ) x ( 2– 1) > 15
( n – 1) x 1 >15
( n – 1 ) > 15
n > 16
Dengan demikian, setiap kelompok terdapat minimal 17 ekor tikus putih sehingga jumlah seluruh subjek penelitian sebanyak 34 ekor tikus putih. E. Identifikasi Variabel Penelitian:
1. Variabel bebas : Jus tomat
2. Variabel tergantung : Kadar kolesterol LDL 3. Variabel rancu atau variabel luar :
a. Dapat dikendalikan :
1) Pakan dan minuman yang diberikan selama perlakuan. 2) Faktor hormonal.
3) Stress terhadap adaptasi lingkungan percobaan.
b. Tidak dapat dikendalikan : 1) Penyakit hepar.
2) Penyakit pankreas. 3) Mutasi reseptor LDL
F. Definisi Operasional Variabel Penelitian: 1. Jus tomat (Lycopersicum esculentum Mill.)
Jus tomat yang digunakan penelitian adalah jus dari buah tomat segar yang sebelumnya dipanaskan dalam air, lalu diblender dan disaring. Pemilihan bentuk jus tomat bertujuan untuk memudahkan penyondean ke dalam lambung tikus putih. Dosis jus tomat mempunyai Skala Pengukuran Rasio.
2. Kolesterol LDL
3. Pakan hiperkolesterolemik
Peneliti menggunakan pakan hiperkolesterolemik berupa campuran pakan standar, kuning telur itik, minyak babi, minyak kelapa dan kristal kolesterol (Krause et al, 2008 ; Saap, 2007).
4. Hormon tiroid
Hormon tiroid adalah hormon yang mengatur metabolisme karbohidrat, protein dan lemak (Sacker dan McPherson, 2004). Tikus putih normal bersifat hipertiroid (Martin et al, 1983). Hormon tiroid meningkatkan jumlah reseptor kolesterol LDL di hepar terutama triiodotironin (T3). Hormon T3 meningkatkan jumlah reseptor kolesterol LDL sebanyak 25 % setelah 4 jam dan 30 % setelah 9 jam (Ganong, 2003 dan Salter et al, 1991). Peningkatan jumlah reseptor kolesterol LDL di hepar menurunkan kolesterol LDL (Kamaluddin, 1993).
5. Minuman
Minuman tikus putih berupa larutan propiltiourasil (PTU) 0,1 %
menggunakan larutan PTU 0,1 % agar pengaruh penurunan kolesterol LDL yang terjadi bukan disebabkan oleh aktivitas tiroid, tetapi penurunan kolesterol LDL disebabkan oleh pengaruh jus tomat. 6. Umur
Umur tikus putih sangat mempengaruhi penelitian. Kolesterol tikus putih meningkat pada umur 6 minggu dan menurun pada beberapa minggu. Kadar kolesterol minimum pada usia 12 minggu, setelah itu kadarnya meningkat lagi (lampiran 11). Peneliti memilih umur tikus putih berusia 3 bulan agar memudahkan pemberian pakan hiperkolesterolemik (Saap, 2007).
7. Jenis kelamin
Jenis kelamin tidak hanya dipengaruhi oleh metabolisme kolesterol LDL, tetapi juga dipengaruhi oleh faktor hormonal. Untuk mengendalikan faktor tersebut, maka peneliti menggunakan tikus putih jantan, Strain Wistar, dewasa dan kurang lebih berumur 3 bulan dengan berat badan 180-200 gram.
estrogen meningkatkan katabolisme kolesterol LDL sehingga kadarnya menurun di plasma (Ganong, 2003).
8. Stres
Stres meningkatkan kolesterol LDL di plasma (Nyam News, 2004). Stres disebabkan oleh perlakuan, kandang penuh bisa dan suhu dingin. Keadaan tersebut merangsang pelepasan epinefrin (Ganong, 2003).
Epinefrin merangsang pelepasan insulin. Insulin merangsang pengeluaran enzim lipoprotein lipase. Enzim lipoprotein lipase meningkatkan kolesterol remnant VLDL. Peningkatan kolesterol
remnant VLDL meningkatkan kadar kolesterol LDL (Murray, 2003). Peneliti mengendalikan faktor stres dengan mengisi setiap kandang 1 ekor tikus putih dan menjaga suhu kandang tetap 22-25°C (Lafay et al, 2006).
9. Genetik
10. Mutasi Reseptor Kolesterol LDL
Mutasi reseptor kolesterol LDL menyebabkan peningkatan kadar kolesterol LDL. Pemeriksaan mutasi reseptor kolesterol LDL tikus putih membutuhkan biaya mahal sehingga peneliti tidak dapat mengendalikan variabel tersebut (Halim, 2006).
11. Kerusakan Sel Hepar
Kerusakan sel hepar tikus putih merupakan salah satu faktor yang tidak dapat dikendalikan oleh peneliti karena pendeteksian dini sulit dan biaya pemeriksaan mahal (Saap, 2007). Kerusakan sel hepar mempengaruhi kolesterol LDL. Kolesterol LDL sebagian besar berasal dari kolesterol VLDL. Kerusakan sel hepar akan mengakibatkan defisiensi Microsomal Triacylglycerol Transfer Protein (MTTP) dan gangguan perakitan polipeptida nascent ApoB-100 (Murray, 2003).
Defisiensi MTTP menganggu pembentukan kolesterol VLDL. Gangguan perakitan polipeptida mencegah pembentukan ApoB-100. Penurunan sintesis kolesterol VLDL dan ApoB-100 menurunkan kadar kolesterol LDL. Dengan demikian, kerusakan sel hepar menurunkan kolesterol LDL (Murray, 2003 dan Shepherd, 2001). 12.Kerusakan Sel Beta Pankreas
G. Alur Penelitian
-pemberian pakan hiperkolesterolemik 100 gr/Kg BB ad libitum -pemberian kuning telur itik 7,5 mL/Kg BB per sonde
-pemberian PTU 0,1% secara ad libitum
Keterangan:
K I : Kelompok kontrol sebanyak 17 ekor tikus putih K II : Kelompok perlakuan sebanyak 17 ekor tikus putih
1. Pemberian kuning telur itik 1,5 mL/200 grBB per sonde dengan dua kali pemberian pada pagi hari (jam 08.00) dan sore hari (jam 16.00).
2. Jus tomat diberikan sebanyak 30 mL/KgBB/hari dengan dosis terbagi
b. Bahan-bahan yang digunakan: 1) 500 gr buah tomat
2) Akuades
3) Larutan propiltiourasil 0,1% 4) Pakan standar pellet 21
5) Pakan hiperkolesterolemik terdiri dari campuran pakan standar, kuning telur itik, kristal kolesterol, minyak babi dan minyak kelapa 6) Reagen pemeriksaan kolesterol LDL (merk Roche Diagnostic
cat.no.1489232)
2. Cara Kerja:
a. Pembuatan Jus Tomat
Lima ratus gram buah tomat diperoleh dari pasar, kemudian disortir terlebih dahulu. Buah busuk, terlalu matang atau ketidaknormalan lainnya harus dipisahkan agar menjaga kandungan tomat. Setelah itu, tomat dicuci dengan air sampai bersih. Tomat ditimbang sampai beratnya mencapai 350 gram, kemudian tomat diblanching atau dipanaskan dengan merendamnya ke dalam 100 mL air panas bersuhu 82-93°C dengan termometer selama 5-10 menit. Pemanasan bertujuan untuk melunakkan bahan dan memudahkan pemblenderan (Dania dan Hidayat, 2005 ; Gunawan, dkk., 2004).
kemudian diblender dan disaring lagi sampai didapatkan dosis optimal jus tomat sebanyak 350 mL (Dania dan Hidayat, 2005 ; Gunawan, dkk., 2004 ; Trisnawati dan Setyawan, 1994).
Kelompok perlakuan diberi jus tomat selama 2 minggu sebanyak 30 mL/KgBB dengan dosis terbagi pada pagi (jam 08.00) dan sore hari (jam 16.00). Cara pembuatan dan dosis jus tomat dapat dilihat di lampiran A dan lampiran B.
b. Pembuatan Pakan Hiperkolesterolemik
Pemberian pakan hiperkolesterolemik ad libitum terdiri dari campuran pakan standar, minyak babi, minyak kelapa dan kristal kolesterol sebanyak 100 gr /Kg BB (Krause et al, 2008 ; Maryanto dan Fatimah, 2004 ; Saap, 2007), sedangkan pemberian kuning telur itik 7,5 mL/Kg BB per sonde pada jam 08.00 dan jam 16.00. Kedua jenis pakan hiperkolesterolemik tersebut diberikan selama 4 minggu. Cara pembuatan dan penentuan dosis pakan hiperkolesterolemik akan dijelaskan peneliti di lampiran 4. Pakan hiperkolesterolemik bertujuan agar keadaan hiperkolesterolemia tercapai. Komposisi pakan hiperkolesterolemik terdiri dari:
1) Kuning telur itik
2) Lemak hewan
Lemak hewan yang digunakan penelitian adalah lemak babi. Lemak babi diperoleh dari LPPT Unit II UGM Yogyakarta. Lemak babi dipanaskan dalam wajan sampai terbentuk minyak babi yang cair.
3) Minyak kelapa
Minyak kelapa diperoleh dari LPPT Unit II UGM Yogyakarta. Minyak kelapa mengandung lemak jenuh, seperti asam laurat, asam palmitat dan asam miristat. Minyak kelapa menekan reseptor
mediated clearance kolesterol LDL sehingga katabolisme kolesterol LDL terganggu (Mihardja, 1999).
4) Kristal kolesterol
Kristal kolesterol didapatkan dari Laboratorium Biokimia UNS bentuk sediaan padat. Kristal kolesterol dihaluskan menjadi serbuk kemudian dicampur dengan pakan standar.
c. Pengukuran Kadar Kolesterol LDL
kilomikron yang mengganggu pengukuran kolesterol LDL (Ragland et al, 2000 dan Widijanti dkk., 2008).
Peneliti mengukur kadar kolesterol LDL dengan mengambil darah tikus putih melalui vena orbitalis menggunakan tabung mikrokapiler sebanyak 1 ml tiap ekor. Peneliti mengumpulkan darah tikus putih secara terpisah di tabung sentrifugasi tanpa anti koagulan, kemudian peneliti mengukur kadar kolesterol LDL. Pengukuran kolesterol LDL dilakukan di LPPT Unit II UGM.
Peneliti memeriksa kolesterol LDL secara langsung dengan Metode Direk Homogenous yaitu satu ml darah tikus putih dipusingkan dengan kecepatan 1500 rpm selama 15-20 menit untuk memisahkan serum dari darah. Peneliti mengambil 10 µL serum kemudian ditambah 1000 µL reagen pengukuran LDL (merk Roche Diagnostic cat.no.1489232). Setelah itu, tabung sampel diinkubasi selama 20 menit pada suhu 20-25ºC atau pada suhu 37°C selama 10 menit. Peneliti memasukkan sampel serum ke dalam spektrofotometer dan hasil pembacaan bersatuan mg/dL dengan panjang gelombang 500nm (Rosari, 2004).
I. Langkah penelitian
mengadaptasikan semua subjek penelitian selama 1 minggu di laboratorium dan memberikan pakan standar sebanyak 100 gr/Kg BB/hari dan akuades ad libitum (Herlambang, 2007).
2. Peneliti memberikan pakan hiperkolesterolemik kepada semua subjek penelitian sebanyak 100 gr/Kg BB ad libitum sedangkan pemberian kuning telur itik per sonde 7,5 mL/Kg BB sebelum perlakuan. Kedua jenis pakan tersebut diberikan peneliti selama 2 minggu untuk meningkatkan kadar kolesterol LDL sebelum perlakuan. Kuning telur itik diberikan peneliti pada pagi hari (jam 08.00) dan sore hari (jam 16.00). Selain itu, kelompok I dan kelompok II diberikan larutan PTU 0,1 % ad libitum.
3. Peneliti mempuasakan subjek penelitian selama 12 jam setelah 2 minggu. Peneliti mengambil sampel darah tikus putih melalui vena orbitalis mata dengan tabung mikrokapiler sebanyak 1 mL setiap ekor, kemudian sampel tersebut dikirim peneliti ke UPPT Unit II UGM Yogyakarta untuk mengukur kadar kolesterol LDL, kemudian peneliti mendapatkan hasil pengukuran kolesterol LDL sebelum perlakuan. 4. Penelitian tersebut dilanjutkan peneliti dengan pemberian pakan
pagi hari (jam 08.00) dan sore hari (jam 16.00) untuk kelompok perlakuan dan kelompok kontrol serta dilakukan pengukuran berat badan setiap minggunya untuk penyesuaian dosis. Pemberian pakan dengan dosis sebagai berikut:
a) Kelompok kontrol :
Diet hiperkolesterolemik 100 gr/Kg BB(campuran pakan standar, minyak kelapa, minyak babi dan kristal kolesterol ) ad libitum + kuning telur itik 7,5 mL/Kg BB per sonde + plasebo akuades 30 mL/KgBB/hari per sonde + larutan PTU 0,1 % adlibitum.
b) Kelompok perlakuan:
Diet hiperkolesterolemik 100 gr/KgBB (campuran pakan standar, minyak kelapa, minyak babi dan kristal kolesterol) ad libitum + kuning telur itik 7,5 mL/Kg BB per sonde + jus tomat 30 mL/KgBB/hari per sonde + larutan PTU 0,1 % ad libitum.
5. Peneliti mempuasakan semua subjek penelitian selama 12 jam. Peneliti mengambil darah tikus putih, mengukur kolesterol LDL dan mendapatkan hasil kolesterol LDL post test.
6. Peneliti menganalisis hasil pengukuran kolesterol LDL pretest dan postest.
J. Analisis Statistik
Shapiro Wilk Test melalui Program SPSS Window 13.0. Pengujian normalitas data tersebut bertujuan untuk menentukan uji statistik yang sesuai dengan keadaan distribusi data yang diperoleh peneliti. Apabila distribusi data sesuai Kurva Gaussian (kurva normal), maka uji statistik menggunakan Uji Statistik Parametrik. Uji Statistik Parametrik yang digunakan penelitian ini adalah uji t berpasangan dan independen. Uji t berpasangan adalah uji yang membandingkan perbedaan rerata masing-masing kelompok sedangkan uji t independen adalah uji yang membandingkan perbedaan rerata antarkelompok (Handoko, 2007). Namun, apabila distribusi data tidak sesuai dengan Kurva Gaussian,
maka uji statistik yang digunakan peneliti adalah Uji Statistik Non-Parametrik, yaitu Uji Wilcoxon (Murti, 1994).
BAB IV
HASIL PENELITIAN
Peneliti menggunakan tikus putih (Rattus norvegicus) jantan sebanyak 34 ekor dari Strain Wistar, berumur kurang lebih 3 bulan dengan berat badan 180 – 200 gram dibagi menjadi 2 kelompok. Kelompok I merupakan kelompok kontrol dan kelompok II merupakan kelompok perlakuan masing-masing sebanyak 17 ekor tikus putih. Kedua kelompok diadaptasikan dalam lingkungan tempat penelitian selama satu minggu. Setiap kelompok ditempatkan di kandang berbeda yang mempunyai faktor lingkungan (suhu dan kelembapan) sama agar faktor-faktor luar yang menganggu penelitian dapat dikendalikan seminimal mungkin.
Semua tikus putih ditimbang terlebih dahulu sebelum perlakuan agar peneliti mengetahui rerata berat badan tikus putih. Hasil penimbangan berat badan tikus putih (lampiran S) dianalisis secara statistik sehingga peneliti mendapatkan rerata berat badan tikus putih dan simpangan baku (SB) (tabel 2).
Perhitungan berat badan semua subjek penelitian dengan uji t independen dan mendapatkan nilai p : 0,224 (p>0,05). Hal tersebut menunjukkan bahwa berat badan tikus putih antara kelompok I dan II tidak berbeda secara signifikan (lampiran CC).
Setelah peneliti menimbang berat badan tikus putih, semua subjek penelitian diberikan pakan hiperkolesterolemik 100 g/Kg BB ad libitum, kuning telur itik 7,5 mL/Kg BB per sonde dan larutan PTU 0,1 % ad libitum
untuk mendapatkan keadaan hiperkolesterolemia selama 2 minggu. Setelah 2 minggu, peneliti mempuasakan semua subjek penelitian selama 12 jam kemudian peneliti memeriksa kadar kolesterol LDL untuk mendapatkan data kadar kolesterol LDL sebelum perlakuan. Peneliti mengambil sampel darah tikus putih dengan tabung mikrokapiler sebanyak 1 mL melalui vena orbitalis. Pemeriksaan kadar kolesterol LDL sebelum perlakuan sangat penting agar peneliti mengetahui keseragaman kadar kolesterol LDL tikus putih dari kedua kelompok.
140
Gambar 5. Distribusi Data Kolesterol LDL sebelum Perlakuan pada K I (kiri) dan K II (kanan).
Rerata kadar kolesterol LDL kedua kelompok sebelum perlakuan dapat dilihat pada tabel 3.
Tabel 3.Rerata Kadar Kolesterol LDL Kedua Kelompok Tikus Putih sebelum Perlakuan
Kelompok Rerata Kadar Kolesterol LDL sebelum Perlakuan
(mg/dL) p (p>0,05). Hal tersebut menunjukkan bahwa kadar kolesterol LDL tikus putih antara kelompok I dan II sebelum perlakuan tidak berbeda secara signifikan (lampiran FF).
Setelah peneliti mendapatkan data kolesterol LDL sebelum perlakuan, maka peneliti memberikan perlakuan kepada semua subjek penelitian.
120
Kelompok I tetap hiperkolesterolemia dan diberi larutan PTU 0,1% seperti sebelumnya. Kelompok II diberi jus tomat 30 mL/Kg BB per sonde, di samping mendapatkan perlakuan yang sama dengan kelompok I. Perlakuan tersebut dilaksanakan selama 2 minggu. Kemudian peneliti memeriksa kadar kolesterol LDL untuk mendapatkan data kolesterol LDL setelah perlakuan. Peneliti melakukan eliminasi data kolesterol LDL setelah perlakuan antara kedua kelompok dari grafik normalitas data karena terdapat satu subjek penelitian dengan data kolesterol LDL setelah perlakuan yang bernilai ekstrim antara kedua kelompok sehingga hanya 16 data kolesterol LDL setelah perlakuan yang diuji t independen (gambar 6).
300
Normal Q-Q Plot of Jus tomat Sesudah Perlakuan
Gambar 6. Distribusi Data Kolesterol LDL setelah Perlakuan pada K I (kiri) dan K II (kanan).
Tabel 4. Rerata Kadar Kolesterol LDL Tikus Putih setelah Perlakuan pada Kedua Kelompok
Kelompok Rerata Kadar Kolesterol LDL setelah Perlakuan (mg/dL)
I (n=16) II (n=16)
Setelah peneliti mendapatkan rerata kadar kolesterol LDL tikus putih sebelum dan setelah perlakuan antara kedua kelompok, peneliti dapat membandingkan rerata kadar kolesterol LDL sebelum dan setelah perlakuan masing-masing kelompok. Peneliti menggunakan uji t berpasanganterhadap kelompok I (tabel 5) dan mendapatkan nilai p: 0,250 (p>0,05) sehingga peneliti menyimpulkan bahwa rerata kadar kolesterol LDL kelompok I sebelum dan setelah perlakuan tidak berbeda secara signifikan (lampiran DD).
Tabel 5. Rerata Kadar Kolesterol LDL Tikus Putih sebelum dan setelah Perlakuan pada Kelompok I
Rerata Kadar Kolesterol LDL (mg/dL)
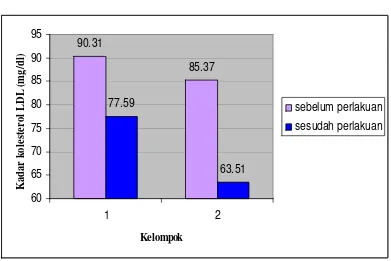
Kelompok I Sebelumperlakuan Setelah perlakuan p
n=16 90,31 ± 21,40 77,59 ± 29,59
0,250
Tabel 6. Rerata Kadar Kolesterol LDL Tikus Putih sebelum dan setelah Perlakuan pada Kelompok II
Rerata Kadar Kolesterol LDL (mg/dL)
Kelompok II Sebelum perlakuan Setelah perlakuan p
n=16 85,37 ± 13,67 63,51 ± 12,83
BAB V
PEMBAHASAN
Peneliti mendapatkan rerata berat badan tikus putih kelompok I adalah 189,71 ± 7,2 gram dan kelompok II adalah 193,28 ± 9,4 gram dari data penimbangan berat badan tikus putih (Rattus norvegicus) sebelum perlakuan (tabel 2). Setelah peneliti melakukan analisis statistik dengan uji normalitas
Shapiro Wilk Test, peneliti mendapatkan data berat badan tikus putih berdistribusi normal pada kelompok I bernilai p: 0,224 (p>0,05) dan kelompok II bernilai p: 0,101 (p>0,05) sehingga peneliti menyimpulkan bahwa data berat badan tikus putih antara kedua kelompok dengan kurva Gaussian (kurva normal) tidak berbeda secara signifikan (lampiran V). Karena data berat badan tikus putih berdistribusi normal, maka peneliti dapat menggunakan uji t independen untuk membandingkan berat badan tikus putih antara kedua kelompok sebelum perlakuan dan mendapatkan nilai p: 0,224 (p>0,05). Hal tersebut menunjukkan bahwa berat badan tikus putih antara kedua kelompok tidak berbeda secara signifikan (lampiran CC). Peneliti melakukan analisis statsitik terhadap berat badan bertujuan agar data berat badan tikus putih sesuai kriteria inklusi.
kolesterol LDL sebelum perlakuan (lampiran Z). Hal tersebut dilakukan peneliti untuk mengetahui keseragaman kadar kolesterol LDL yang akan digunakan penelitian. Peneliti mendapatkan rerata kadar kolesterol LDL sebelum perlakuan pada kelompok I 90,31 ± 21,40 mg/dL dan kelompok II 85,37 ± 13,67 mg/dL (tabel 3). Data tersebut menunjukkan bahwa kedua kelompok telah mencapai keadaan hiperkolesterolemia karena berdasarkan penelitian Matos et al (2005), rerata kadar kolesterol LDL normal tikus putih adalah 35,04 ± 13,64 mg/dL. Peningkatan kadar kolesterol LDL semua subjek penelitian sebelum perlakuan disebabkan oleh:
A. Waktu pemberian pakan hiperkolesterolemik
Berdasarkan penelitian Rand dan Queckenbush (2008), waktu pemberian pakan hiperkolesterolemik menentukan siklus diurnal hiperkolesterolemia. Pemberian pakan hiperkolesterolemik pada jam 08.00 dan jam 16.00 meningkatkan kapasitas lambung sebanyak 35 %. Peningkatan kapasitas lambung memperlama pengosongan lambung sehingga keadaan hiperkolesterolemia baru tercapai setelah 6 jam (gambar 8).
Gambar 8. Siklus Diurnal Hiperkolesterolemia
B. Efek pakan hiperkolesterolemik
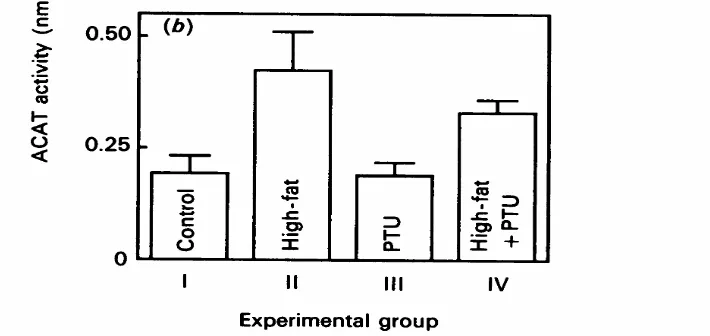
Pemberian pakan hiperkolesterolemik meningkatkan aktivitas ACAT secara signifikan (p<0,005) dan meningkatkan respon hiperkolesterolemia pada kromosom autosom nomor 3, 5 dan 14 secara signifikan (p<0,05) (Asahina et al, 2008 dan Salter et al, 1991). Peningkatan aktivitas ACAT karena pakan hiperkolesterolemik meningkatkan kejenuhan kadar kolesterol eksogen (gambar 9) (Salter et al, 1991).
Gambar 9. Hubungan Pakan Hiperkolesterolemik dengan Peningkatan Aktivitas ACAT.
(Sumber: Salter et al, 1991)
(2008), peningkatan ACAT akan menyebabkan peningkatan sintesis ester kolesterol LDL di sisterna golgi dan vesikel hepar serta plasma.
C. Larutan PTU 0,1 %
Hormon triiodotironin (T3) meningkatkan ekspresi reseptor kolesterol LDL di hepar sebanyak 25 % setelah 4 jam dan 30 % setelah 9 jam (gambar 10) sehingga peneliti membutuhkan larutan PTU 0,1 % untuk menghambat sintesis hormon T3 yang berakibat akan menurunkan ekspresi reseptor kolesterol LDL di permukaan sel hepar (Salter et al, 1991).
Gambar 10. Pengaruh hormon T3 terhadap Reseptor Kolesterol LDL
(Sumber: Salter et al, 1991)
Larutan PTU 0,1 % menurunkan translasi mRNA menjadi reseptor kolesterol LDL di hepar. Penurunan translasi mRNA menjadi reseptor kolesterol LDL menurunkan ekspresi reseptor kolesterol LDL di permukaan hepar dan mengakibatkan hepar meningkatkan translasi mRNA menjadi
Gambar 11. Hubungan Pemberian Larutan PTU 0,1 % terhadap Reseptor Kolesterol LDL (Sumber: Salter et al, 1991)
Peneliti melakukan analisis statistik dengan uji t independen terhadap kadar kolesterol LDL tikus putih sebelum perlakuan antara kedua kelompok karena distribusi data kolesterol LDL kedua kelompok sebelum perlakuan normal (lampiran BB). Dari analisis statistik tersebut, peneliti mendapatkan nilai p: 0,442 (>0,05). Hal tersebut menunjukkan bahwa rerata kadar kolesterol LDL sebelum perlakuan antara kedua kelompok tidak berbeda secara signifikan (lampiran FF) sehingga peneliti dapat melanjutkan perlakuan terhadap subjek penelitian karena kolesterol LDL sebelum perlakuan antara kedua kelompok seragam.
Hal tersebut dilakukan khususnya pada data kolesterol LDL kelompok I setelah perlakuan karena berdistribusi tidak normal (gambar 6). Hal tersebut sesuai dengan uji normalitas Shapiro Wilk Test yang menyatakan bahwa distribusi data kadar kolesterol LDL kelompok I setelah perlakuan mempunyai nilai p: 0,000 (p<0,05) sehingga peneliti menyimpulkan bahwa antara kurva data kolesterol LDL kelompok I setelah perlakuan dan Kurva Gaussian berbeda secara signifikan (lampiran V). Setelah peneliti mengeliminasi data kolesterol LDL setelah perlakuan yang eksterim kemudian peneliti melakukan uji normalitas lagi data kolesterol LDL kelompok I setelah perlakuan dan mendapatkan nilai p: 0,058 (p>0,05). Hal tersebut menunjukkan bahwa antara kurva data kolesterol LDL kelompok I setelah perlakuan dan Kurva Gaussian tidak berbeda secara signifikan (lampiran BB) sehingga peneliti dapat membandingkan rerata kolesterol LDL kelompok I sebelum dan setelah perlakuan dengan uji t berpasangan. Dari analisis statistik tersebut, peneliti mendapatkan nilai p: 0,250 (p>0,05) sehingga peneliti menyimpulkan bahwa rerata kolesterol LDL kelompok I sebelum dan setelah perlakuan tidak berbeda secara signifikan (lampiran DD). Hal tersebut terjadi karena rerata kolesterol LDL kelompok I setelah perlakuan menurun (gambar 7). Penurunan kolesterol LDL kelompok I setelah perlakuan disebabkan oleh:
A. Larutan PTU 0,1 %.
meningkatkan kadar kolesterol VLDL dan menurunkan kadar kolesterol LDL sedangkan keadaan hipotiroid kadar kolesterol LDL dan kolesterol VLDL meningkat secara signifikan (p<0,01).
Menurut penelitian Riley et al (1980), pada keadaan eutiroid, pemberian pakan hiperkolesterolemik dan PTU 0,1 % menyebabkan usus menyekresikan kolesterol IDL yang membawa ApoA-I dan ApoB. Saat kolesterol IDL berubah menjadi kolesterol LDL, ApoA-I ditukarkan dengan ApoE yang berasal dari kolesterol HDL2+3 sehingga kolesterol LDL menjadi jenuh ApoE. Peningkatan ApoE pada kolesterol LDL menyebabkan kolesterol LDL mudah dikenali oleh reseptor ApoE di hepar sehingga kadar kolesterol LDL menurun (Dolphin, 2008). Hal tersebut dibuktikan juga oleh Davidson et al (1988) bahwa pemberian larutan PTU 0,1 % meningkatkan sintesis ApoE, menurunkan sintesis asam lemak, menurunkan sekresi trigliserol ke dalam kolesterol VLDL di hepar, meningkatkan lipoprotein lipase dan meningkatkan katabolisme trigliserol. Keadaan tersebut menurunkan kolesterol LDL (Salter et al, 1991).
B. Pakan hiperkolesterolemik
Pemberian pakan hiperkolesterolemik menyebabkan abnormalitas sekresi lipoprotein dan apolipoprotein di hepar. Pada keadaan hiperkolesterolemia terjadi peningkatan ApoA-I dan ApoA-IV serta penurunan ApoB-240 (lampiran O). Pakan hiperkolesterolemik akan meningkatkan sekresi kolesterol ß-VLDL dan HDLc (HDL1). Lipoprotein tersebut hanya mengandung ester kolesterol. (Swift et al, 2008).
Kolesterol ß-VLDL mengandung lebih dari 60 % Apo-IV dan sisanya mengandung ApoA-I. Apo-I dan Apo-IV pada kolesterol β-VLDL berfungsi sebagai penukar apolipoprotein dengan ApoE yang berasal dari kolesterol HDLc. Pelekatan ApoE pada kolesterol β –VLDL menyebabkan
kolesterol β-VLDL mudah dikenali oleh reseptor ApoE di hepar sedangkan HDLc sendiri berfungsi sebagai pemberi ApoE pada semua macam lipoprotein termasuk kolesterol LDL. Apabila kolesterol LDL dilekati ApoE, maka kolesterol tersebut juga mudah dikenali oleh hepar akibatnya konsentrasi kolesterol LDL menurun (Swift et al, 2008).
C. Komposisi asam lemak pakan hiperkolesterolemik
lemak dari pakan hiperkolesterolemik sangat mempengaruhi kolesterol LDL.
Peneliti membuat pakan hiperkolesterolemik dari pakan standar, minyak kelapa, minyak babi, kristal kolesterol dan kuning telur. Pakan hiperkolesterolemik diberikan ad libitum adalah campuran pakan standar, minyak kelapa, minyak babi dan kristal kolesterol, sedangkan kuning telur itik diberikan per sonde. Asam palmitat, asam miristat dan asam laurat yang terkandung dalam pakan hiperkolesterolemik merupakan asam lemak jenuh terpenting untuk meningkatkan kolesterol LDL. Tidak hanya asam lemak jenuh yang terkandung di dalam pakan hiperkolesterolemik, tetapi juga asam lemak tak jenuh. Asam lemak tak jenuh menganggu peningkatan kadar kolesterol LDL.
Penggunaan campuran pakan standar, kuning telur, minyak babi, minyak kelapa dan kristal kolesterol sebagai pakan hiperkolesterolemik mempunyai beberapa alasan bagi peneliti sendiri. Berdasarkan penelitian Bartov et al (2008), penggunaan kuning telur dan kristal kolesterol meningkatkan kadar kolesterol LDL. Hal tersebut dibuktikan peneliti secara tidak langsung dengan mengukur sekresi asam empedu tikus putih (lampiran O). Peningkatan sekresi asam empedu dari kolesterol endogen merupakan kompensasi hepar dalam merespon peningkatan kolesterol LDL.
Polyenoic acid merupakan asam lemak tak jenuh yang mendepresi kadar kolesterol plasma sehingga keadaan hiperkolesterolemia tidak tercapai dan menyebabkan penurunan kadar LDL (lampiran P) (Bartov et al, 2008). Peneliti memberikan kuning telur per sonde bertujuan agar kandungan asam lemak jenuh tidak teroksidasi oleh udara. Apabila kuning telur itik diberikan ad libitum, maka asam lemak jenuh yang terkandung di dalamnya teroksidasi dan mengganggu efek peningkatan kadar kolesterol LDL.. Selain itu, pencampuran kristal kolesterol dengan minyak babi memperlambat penyerapan kristal kolesterol di usus (Bartov et al, 2008). Penggunaan minyak kelapa dan minyak babi sebagai pakan hiperkolesterolemik karena mengandung asam lemak jenuh sangat tinggi terutama asam miristat, asam laurat dan asam palmitat (Mihardja, 1999). D. Metode pengukuran kolesterol LDL
Hasil pengukuran kolesterol LDL dengan Metode Direk Homogenous lebih rendah daripada Metode Indirek Friedewald karena pada metode direk, kolesterol LDL dipisahkan dari kolesterol IDL dan Lp(a). Kolesterol IDL dan Lp(a), yang mempunyai kontribusi meningkatkan hasil pengukuran kolesterol LDL, menjadi tidak ikut terukur (Widijanti, dkk., 2008).
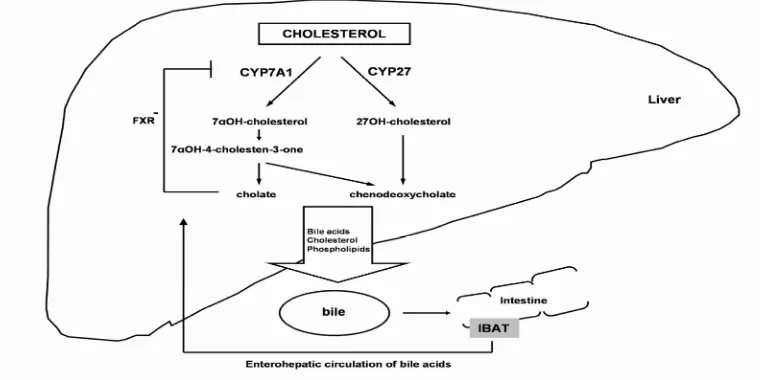
E. Polimorfisme gen promoter CYP7A1
Polimorfisme gen promoter CYP7A1 A278C mempengaruhi peningkatan enzim 7-α-hidroksilase. Enzim tersebut berpengaruh dalam sintesis asam empedu yang sensitif terhadap peningkatan kadar kolesterol LDL. Pengaturan aktivitas gen promoter CYP7A1 secara tidak langsung dilakukan oleh Hepatocyte Nucleus Factor 3 (HNF-3). HNF-3 mengatur gen promoter sekuen DNA di regio 432 base pair (bp) dan 220 bp. Gen promoter tersebut mempunyai efek meningkatkan polimorfisme gen promoter CYP7A1 di regio 278 bp. Dengan demikian, regulasi transkripsi mRNA untuk enzim 7-α hidroksilase dikendalikan oleh HNF-3 (Hofman, 2005)
Dimer CC sangat sensitif terhadap peningkatan kadar kolesterol LDL. Tikus putih berdimer CC di gen promoter CYP7A1 menurunkan kolesterol LDL sampai -1,44 ± 1,18 mmol/dL dibandingkan dengan dimer AA yang menurunkan kolesterol LDL sampai 0,13 ± 0,14 mmol/dL dan dimer AC yang menurunkan kolesterol LDL sampai 0,38 ± 0,99 mmol/dL (lampiran Q). Sensitivitas dimer CC diwujudkan dengan peningkatan sintesis enzim 7-α-hidroksilase. Enzim tersebut meningkatkan produksi asam empedu dari kolesterol LDL (Hofman, 2005).
Peningkatan kolesterol LDL merangsang hepar mengeluarkan Sterol Regulatory Element Binding Protein (SREBP). SREBP meningkatkan reseptor kolesterol LDL. Peningkatan reseptor kolesterol LDL menurunkan kolesterol LDL. Selain gen CYP7A1, terdapat juga gen CYP27 dan gen IBAT yang mengatur sintesis asam empedu dari kolesterol endogen (Hofman, 2005).
sintesis asam empedu dari kolesterol LDL sehingga keadaan tersebut akan meningkatkan kolesterol LDL (gambar 12) (Hofman, 2005).
Gambar 12. Metabolisme Asam Empedu
(Sumber: Hofman, 2005)
F. Keseimbangan reseptor nukleus di hepar
Keseimbangan reseptor nukleus sel hepar sangat mempengaruhi sintesis asam empedu dari kolesterol endogen dan kolestrol LDL. Reseptor nukleus sel hepar ada 2 macam, Liver XReceptor (LXR) dan Farnesoid X Receptor (FXR). LXR merangsang transkripsi gen CYP7A1 sehingga sintesis empedu dari kolesterol endogen meningkat. Peningkatan sintesis tersebut mengakibatkan peningkatan reseptor kolesterol LDL di hepar. Peningkatan reseptor kolesterol LDL di hepar menurunkan kolesterol LDL. FXR meningkatkan Small Heterodimer Partner (SHP). SHP menyekat
menurunkan sintesis asam empedu dari kolesterol LDL sehingga kolesterol LDL meningkat (Hofman, 2005).
Berdasarkan uji normalitas data Shapiro Wilk Test, data kadar kolesterol LDL kelompok II sebelum dan setelah perlakuan berdistribusi normal karena kolesterol LDL kelompok II sebelum perlakuan mempunyai nilai p: 0,887 (p>0,05) dan kadar kolesterol LDL kelompok II setelah perlakuan mempunyai nilai p: 0,298 (p>0,05) (lampiran V). Dengan demikian, peneliti dapat menyimpulkan bahwa antara kurva data kolesterol LDL kelompok II sebelum dan sesudah perlakuan dengan Kurva Gaussian tidak berbeda secara signifikan. Setelah data kolesterol LDL kelompok II sebelum dan setelah perlakuan berdistribusi normal, maka peneliti dapat membandingkannya dengan uji t berpasangan dan mendapatkan nilai p: 0,000 (p<0,05). Dengan demikian, peneliti dapat menyimpulkan bahwa antara rerata kadar kolesterol LDL kelompok II sebelum dan setelah perlakuan berbeda secara signifikan (lampiran EE).
Gambar 13. Jalur absorpsi dan metabolisme karotenoidC, carotene; X, xanthophyll; LPL, lipoprotein lipase; HDL, high density lipoprotein; VLDL, very low density lipoprotein; LDL, low density lipoprotein
(Sumber: Deming dan Erdman, 1999)
Pemanasan tomat selama perlakuan lebih dari 5 menit meningkatkan kehilangan likopen sebanyak 1,1 %. Semakin lama pemanasan dan semakin tinggi suhu menghilangkan likopen sebanyak 17,1%. Namun, apabila tomat dipanaskan pada suhu sedang (82-93ºC) selama 15 menit meningkatkan kandungan likopen sehingga peneliti memanaskan buah tomat pada suhu sedang sebelum pembuatan jus tomat (lampiran R). Pemanasan tomat dan pengaruh asam lambung meningkatkan isomerasi beberapa zat seperti likopen, β-karoten,
quercetin, kaemferol dan narigenin (Hedges dan Lister, 2005).
Proses pemanasan menyebabkan perubahan bentuk all trans-likopen dan β -karoten menjadi bentuk 9-cis dan 13-cis. Bentuk 9-cis dan 13-cis meningkatkan penyerapan likopen, tetapi bentuk tersebut memperlambat penyerapan β-karoten. Bentuk quercetin konjugat berubah menjadi bentuk quercetin bebas sebanyak 30 % sehingga bentuk tersebut mempermudah penyerapan. Bentuk narigenin
chalcon berubah menjadi narigenin glikosida sehingga juga mempermudah penyerapan. Namun, apabila pemanasan buah tomat sangat lama melumerkan kulit tomat dan meningkatkan kehilangan 80 % qurcetin, kaemferol dan narigenin karena ketiga zat tersebut terkandung di kulit tomat (Hedges dan Lister, 2005).
sebagai pengangkut utama zat karotenoid seperti α-karoten, β-karoten dan likopen (Olson, 1994).
Pakan hiperkolesterolemik secara tidak langsung meningkatkan lipoprotein abnormal HDLc yang hanya mengandung ester kolesterol dan Apo-E. Apo-E dari HDLc diberikan kepada kolesterol LDL sehingga kolesterol LDL mudah dikenali oleh hepar (Swift et al, 2008). Dengan demikian, bersamaan katabolisme kolesterol LDL di hepar terjadi peningkatan akumulasi karotenoid di hepar. Keadaan tersebut menimbulkan efek penurunan kolesterol LDL kelompok II.
BAB VI
SIMPULAN DAN SARAN
A. Simpulan
Pemberian jus tomat (Lycopersicum esculentum Mill.) sebanyak 30 mL/KgBB/hari selama 2 minggu menurunkan kolesterol LDL tikus putih (Rattus norvegicus) secara signifikan (p<0,05).
B.Saran
1. Peneliti perlu melakukan pemeriksaan genetik tikus putih agar pengaruh genetik terhadap kadar kolesterol LDL dapat ditekan seminimal mungkin.
2. Peneliti perlu melakukan pengukuran kandungan karotenoid dan flavonoid tomat dengan Metode High Performance Liquid Chromatography (HPLC) untuk mengetahui kandungan tersebut secara optimal di dalam tomat.
3. Peneliti perlu pemberian dosis jus tomat yang bervariasi dengan perbandingan dosis yang besar.
4. Peneliti perlu mengombinasikan jus tomat dengan bentuk sediaan lain tomat agar efek penurunan kolesterol LDL terlihat lebih nyata. 5. Peneliti perlu melakukan penelitian lebih lanjut dengan sampel dan
DAFTAR PUSTAKA
Agarwal dan Rao. 2000. Tomato lycopene and its role in human health and chronic diseases.Can Med Assoc.163:6. denseLDL) sebagai faktor aterogenik.Ind J Path. 7:10-17.
Asahina M., Sato M. dan Imaizumi K. 2008.Genetic analysis of diet-induced hypercholesterolemia in exogenously hypercholesterolemic rats.The Journal of Nutrition.
Atherton and Rudich.1989.Tomato Crop.London Weinheim:Chapman and Hall,pp: 240-280.
Bartov I., Reiser R dan Henderson.2008.Hypercholesterolemic effect in female rat of egg tolk versus crystalline cholesterol dissolved in lard.The Journal of Nutrition.
Basu A. dan Imrhan V. 2006. Tomatoes versus lycopene in oxidative stress and carcinogenesis: conclusions from clinical trials. Eur J Nutr.1:6. Bull S. dan Pitts G. 2008. Gastric Capacity and Energy Absorption in The
Force-Fed Rat. University of Virginia: Departement of Physiology, pp 1-7.
Campbell J.K., Canene-Adams K., Lindshield B.L., Boileau T.W, Clinton S.K. dan Erdman J.W. 2004. Tomato phytochemicals and prostate cancer risk Am J Nutr.134: 3486-92.
Clinton S.K. 1998. Lycopene: chemistry, biology, and implications for human health and disease. JNutr Rev.56:35-51.
Dalimarta S. 2003. Atlas Tanaman Obat Indonesia Jilid 3. Jakarta: Trubus Agriwidya, hal:175-9.
polyphenols alter cholesterol homeostasis and increase LDL receptor activity in human cell in vitro. Am J Nutr.136: 1766-73.
Deming dan Erdman, 1999.Bioavaibility of carotenoid in human. Bioch J. Dina P..A. dan Hidayat H.N.2005. Minuman Berkarbonasi dari Buah
Segar.Surabaya:Trubus Agrisarana,hal:1-47
Dolphin P.J. 2008. Serum and hepatic nascent lipoproteins in normal and hypercholesterolemic rats.The Journal of LipidResearch
Ferreira ALA., Yeum K-J., Liu C., Smith D., Krinsky NI., Wang X-D. dan Russell RM. 2000. Tissue distribution of lycopene in ferrets and rats after lycopene supplementation. J Nutr .130: 1256-1260.
Fikriah I., Kalim H. dan Drajat R.S. 2005. Pengaruh cucurmin terhadap kadar kolesterol total, LDL kolesterol, jumlah F2-isoprostan dan sel busa (foam cell) dinding aorta pada tikus dengan diet aterogenik. Braw J Kedokt.
21::55-61.
Fuhrahman B., Elis A. dan Aviram M. 1997. Hypocholesterolemic effect of lycopene and ß-carotene is related to suppression of cholesterol synthesis and augmentation of LDL receptor activity in macrophage. Biochem Biophys Res Com. 233: 658-62.
Ganong F,W. 2003. Buku Ajar Fisiologi Kedokteran. Editor Bahasa Indonesia: Djauhari Wijayakusumah. Jakarta:EGC., hal:293-296.
Ghaffari M.A. dan Mojab S. 2006.Influence of flavonols as in vitro on low density lipoprotein glycation. Ir J Biomed.11:185-191.
Gillaspy G., David H dan Gruissem W.1993. A fruit ripening. Am J Agrc.5:
Halim H. 2006. Mutasi reseptor LDL penyebab hiperkolesterolemia familier.
Majalah Kedokteran Damianus. 5:171-176
Handoko P. 2007. Pengaruh Pemberian Ekstrak Brokoli Per Oral Terhadap Kadar Glukosa Tikus Putih. Skripsi FK UNS. Surakarta.