SENYAWA ANTIBAKTERI DARI MIKROALGA Dunaliella sp.
PADA UMUR PANEN YANG BERBEDA
Oleh:
Andri Parna Yudha
C 34103057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2008
RINGKASAN
ANDRI PARNA YUDHA. C34103057. Senyawa Antibakteri dari Mikroalga
Dunaliella sp. pada Umur Panen yang Berbeda. Dibawah bimbingan IRIANI SETYANINGSIH dan PIPIH SUPTIJAH.
Mikroalga sebagai salah satu komoditi hasil perairan dewasa ini telah menjadi alternatif untuk dikembangkan karena memiliki potensi yang besar untuk dimanfaatkan, misalnya sebagai antibakteri. Salah satu mikroalga yang memiliki aktivitas antibakteri adalah Dunaliella. Penelitian tentang produksi antibakteri dari Dunaliella belum banyak diungkap. Tujuan penelitian ini adalah mendapatkan kurva pertumbuhan Dunaliella sp., mengetahui komposisi kimia Dunaliella sp., mendapatkan senyawa antibakteri dari Dunaliella sp. pada umur panen yang berbeda, mempelajari aktivitas antibakteri ekstrak Dunaliella sp. terhadap bakteri patogen, mengetahui komponen dari ekstrak Dunaliella sp. dengan kromatografi lapis tipis.
Mikroalga Dunaliella sp. diperoleh dari Pusat Riset Oseanografi LIPI-Ancol, Jakarta Utara. Pelarut yang digunakan adalah pelarut heksana (non polar), etil asetat (semi polar), dan metanol (polar). Penelitian ini terdiri dari penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan terdiri dari penentuan kurva pertumbuhan Dunaliella sp. Penelitian utama terdiri dari kultivasi Dunaliella sp., analisis proksimat, ekstraksi senyawa antibakteri, uji aktivitas senyawa antibakteri, dan uji kromatografi lapis tipis (KLT).
Dunaliella sp. memiliki pola pertumbuhan yang dimulai dari fase log yang terjadi pada hari ke-0 sampai ke-8, fase penurunan laju pertumbuhan dicapai pada hari ke-9 sampai ke-11, fase stasioner terjadi pada hari ke-12 sampai ke-29, dan fase menuju kematian mulai hari ke-30 sampai ke-34. Kultur dilakukan pada suhu ruang dengan intensitas cahaya 3000 lux dan penyinaran 24 jam. Kandungan air, protein, lemak, abu, dan karbohidrat dari Dunaliella sp. adalah 65,22 %, 18,12 %, 1,60 %, 6,17 %, dan 8,89 %. Berat biomassa kering pada umur panen fase stasioner adalah 1,54 gram dan pada fase log adalah 1,10 gram. Rendemen ekstrak kering pada fase log yang diperoleh dari ekstraksi dengan pelarut heksana, pelarut etil asetat, dan pelarut metanol berturut-turut sebesar 1,81 %, 4,54 %, dan 5,45 %. Rendemen ekstrak kering pada fase stasioner yang dihasilkan dari ekstraksi dengan pelarut heksana, pelarut etil asetat, dan pelarut metanol berturut-turut nilainya adalah 1,29 %, 1,94 %, dan 2,59 %.
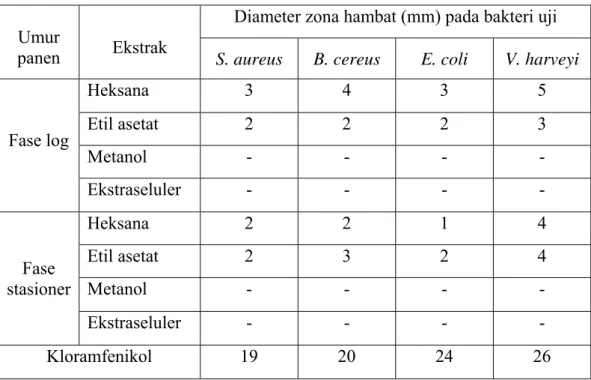
Ekstrak-metanol dan ekstraseluler tidak menunjukkan adanya aktivitas antibakteri. Hasil uji aktivitas antibakteri ekstrak-heksana dan ekstrak-etil asetat pada fase log terhadap bakteri uji Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Vibrio harveyi menghasilkan diameter zona bening di sekitar paper disc berturut-turut sebesar 3, 4, 3, 5 mm, serta 2, 2, 2, 3 mm. Hasil uji aktivitas antibakteri ekstrak-heksana dan ekstrak-etil asetat pada fase stasioner terhadap bakteri uji yang sama berturut-turut nilainya adalah 2, 2, 1, 4 mm, serta 2, 3, 2, 4 mm. Ekstrak-heksana dan etil asetat termasuk kategori yang memiliki aktivitas lemah. Hasil pengujian KLT menunjukkan bahwa ekstrak-heksana terdiri dari empat komponen aktif dan ekstrak-etil asetat terdiri dari tiga komponen aktif.
SENYAWA ANTIBAKTERI DARI MIKROALGA Dunaliella sp.
PADA UMUR PANEN YANG BERBEDA
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh:
Andri Parna Yudha
C 34103057
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2008
Judul : SENYAWA ANTIBAKTERI DARI MIKROALGA Dunaliella sp. PADA UMUR PANEN YANG BERBEDA
Nama : Andri Parna Yudha NRP : C34103057
Menyetujui,
Pembimbing I Pembimbing II
Ir. Iriani Setyaningsih, M.S Dra. Pipih Suptijah, MBA
NIP. 131 578 853 NIP. 131 476 638
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Indra Jaya, M.Sc
NIP. 131 578 799
Pernyataan Mengenai Skripsi dan Sumber Informasi
Dengan ini saya menyatakan bahwa skripsi Senyawa Antibakteri dari Mikroalga Dunaliella sp. pada Umur Panen yang Berbeda adalah karya saya
sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal dari atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Januari 2008
Andri Parna Yudha C 34103057
RIWAYAT HIDUP
Penulis dilahirkan di Aceh, pada tanggal 22 Februari 1985. Penulis merupakan anak pertama dari 4 bersaudara dari Bapak Lasper Nahampun dan Ibu Emmi Marbun. Penulis memulai jenjang formal pada pendidikan Sekolah Dasar Negeri 1 Gunung Sitoli, Nias (1993-1997). Kemudian penulis melanjutkan di SLTP Katolik Fatima Sibolga (1997-2000), dan melanjutkan di SMU Negeri 1 Sibolga (2000-2003).
Penulis masuk Institut Pertanian Bogor melalui jalur SPMB pada tahun 2003 dan diterima sebagai mahasiswa Fakultas Perikanan dan Ilmu Kelautan pada Program Studi Teknologi Hasil Perikanan. Selama menjalani pendidikan akademik penulis pernah mengikuti beberapa organisasi, diantaranya Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) pada tahun 2004/2005 sebagai anggota di Departemen Kesejahteraan Manusia dan Pengabdian Masyarakat, dan juga sebagai Wakil Koordinator bidang Ekstern (Wakil II) UKM Persekutuan Mahasiswa Kristen (PMK) tahun 2006/2007. Dalam bidang akademik penulis juga merupakan asisten dosen pada mata kuliah agama Kristen Protestan 2004/2005 dan 2005/2006, Avertebrata Air 2005/2006 dan 2006/2007, Fisiologi Hewan Air 2005/2006, Mikrobiologi Hasil Perairan 2006/2007 dan 2007/2008, Teknologi Proses Thermal Hasil Perairan 2006/2007, Teknologi Refrigerasi Hasil Perairan 2006/2007, Biokimia Hasil Perairan 2006/2007, dan
Gizi Ikani 2006/2007. Penulis juga pernah melaksanakan magang di PT. Arabikatama Khatulistiwa Fishing Industry selama 1 bulan di Denpasar,
Bali.
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu kelautan, penulis melakukan penelitian dengan judul Senyawa Antibakteri dari Mikroalga Dunaliella sp. pada Umur Panen yang Berbeda sebagai salah satu
syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
KATA PENGANTAR
Puji syukur kepada Bapa di sorga atas segala rahmat dan kasih-Nya sehingga penulis dapat menyelesaikan penelitian ini dengan judul Senyawa antibakteri dari mikrolaga Dunaliella sp. pada umur panen yang berbeda.
Penelitian ini merupakan salah satu syarat untuk memperoleh gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan skripsi ini :
1. Ibu Ir. Iriani Setyaningsih, MS dan Ibu Pipih Suptijah, MBA selaku dosen pembimbing atas segala bimbingan, nasihat, serta segala penjelasan yang telah diberikan kepada penulis sehingga penulis dapat menyelesaikan skripsi ini. Terima kasih atas kesabaran, pengertian, kasih sayang, dan pelajaran hidup yang luar biasa bagi penulis.
2. Ibu Desniar, SPi, MSi dan Ibu Ir. Winarti Zahiruddin, MS selaku dosen penguji tamu atas segala saran dan kritik yang diberikan demi sempurnanya skripsi ini.
3. Ibu Ir. Komariah Tampubolon, MS yang telah meluangkan waktunya sebagai moderator pada seminar hasil penelitian.
4. Dosen-dosen dan staf THP yang telah membantu, membentuk, dan memberi ilmu yang tidak terhingga selama penulis menempuh pendidikan. 5. Lasper Nahampun dan Emmy Marbun sebagai orang tua yang telah
mendidik dan memberikan kasih sayang yang begitu besar. Adik-adik: Riko, Wira, dan Evo yang selalu mendukung dan memberi semangat. Terima kasih atas dukungan doa dan pengorbanannya.
6. Ibu Ema (Lab Mikrobiologi THP), Ibu Ita, Mbak Esthi, Pak Wahyu di Lab Terpadu, FKH terima kasih atas segala pengetahuan dan bantuannya selama melaksanakan penelitian
7. Helda, Dithya, Fitria, Astari, Lisda, Lianny, Ira, Pisuko, Angling, Johan, Gami, Indra, Aal, Sigit, Tomy, Windo, Tenjo, Tobias, Setyo, Deden, David, Nono, Hilman, Rama, Rudy, Finda, Ma’suf terima kasih atas segala
bantuan dan dukungannya selama seminar dan sidang. Terima kasih atas segala persahabatan, canda, kejutan indah yang luar biasa serta pengalaman yang mendewasakan.
8. Teman-teman THP 40: Tendi, Ghea, Merry, Dian, Riri, Wida, Yunita, Lusi, Yulya, Irma, Nola, Eni, Dimas, Ricci, Ida, Taufik, Chacha, Po, Juhli, Udin, Iqbal, Ahmad, Novi, Sahrul, Budi yang telah berjuang dan belajar bersama selama menempuh pendidikan dengan segala warna kehidupan didalamnya. Terima kasih juga untuk teman-teman THP 39, 41, 42, dan 43 atas dukungan dan bantuannya selama ini.
9. Ari Supriyatna dan Aris Munandar yang menjadi sahabat sejak di asrama. Terima kasih untuk persahabatan yang saling mengerti dan terjaga hingga sekarang.
10.Teman-teman sepelayanan: Meidy, Ita, Ria, Septi. Terima kasih atas dukungan doa, sharing, dan kasih yang selalu menguatkan. Kak Yeye, kak Disney, kak Posma, bang Ode dan bang Leo, terima kasih untuk selalu memberi saran, doa, dan nasihatnya.
11.Trifena Honestin, terima kasih untuk bantuannya mencari bahan pustaka. 12.Keluarga Yeremia (Stanley, Kezchia, Dita, Juni, Ivan, Ronal, Franz, Desy,
Doris), Kelompok kecil (Arnos, Ase, Stanley, Dian, Ganda), BPH 41(Prita, Yenni, Vera, Benny, Julie), Keluarga Sibolga (Nana, Roy) yang senantiasa mendukung dan memotivasi penulis dalam segala hal.
13.Semua pihak yang telah membantu dalam penelitian dan penulisan skripsi yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu penulis mengharapkan saran dan kritik yang bersifat membangun. Semoga skripsi ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Januari 2008
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR... x DAFTAR LAMPIRAN... xi 1. PENDAHULUAN... 1 1.1. Latar Belakang ... 1 1.2. Tujuan Penelitian ... 3 2. TINJAUAN PUSTAKA ... 4 2.1. Mikroalga ... 42.2. Pola Pertumbuhan Mikroalga... 7
2.3. Dunaliella sp. ... 8
2.4. Senyawa Antibakteri ... 10
2.5. Mekanisme Kerja Senyawa Antibakteri... 13
2.6. Ekstraksi Senyawa Antibakteri ... 15
2.7. Bakteri ... 17
2.7.1. Staphylococcus aureus ... 19
2.7.2. Bacillus cereus ... 20
2.7.3. Escherichia coli ... 21
2.7.4. Vibrio harveyi ... 22
2.8. Kromatografi Lapis Tipis ... 23
3. METODOLOGI ... 24
3.1. Waktu dan Tempat ... 24
3.2. Bahan dan Alat ... 24
3.3. Metode Penelitian ... 25
3.3.1. Penelitian pendahuluan ... 25
1) Pembuatan kurva pertumbuhan ... 26
3.3.2. Penelitian utama ... 26
1) Kultivasi Dunaliella sp ... 26
2) Ekstraksi senyawa antibakteri ... 27
3) Uji aktivitas antibakteri... 29
4) Pengujian kromatografi lapis tipis ... 29
3.4. Prosedur Analisis ... 29
3.4.1 Penghitungan jumlah sel ... 29
3.4.2 Analisis proksimat ... 30
1) Analisis kadar air ... 30
3) Analisis kadar protein... 31
4) Analisis kadar lemak ... 31
5) Analisis kadar karbohidrat... 32
3.4.3 Penghitungan rendemen ekstrak ... 32
3.4.4 Pengujian aktivitas senyawa antibakteri ... 32
4. HASIL DAN PEMBAHASAN ... 35
4.1. Kurva Pertumbuhan Dunaliella sp. ... 35
4.2. Komposisi Kimia ... 38
4.3. Ekstraksi Senyawa Antibakteri ... 40
4.4. Aktivitas Senyawa Antibakteri... 44
4.5. Kromatografi Lapis Tipis (KLT)... 50
5. KESIMPULAN DAN SARAN ... 52
5.1. Kesimpulan. ... 52
5.2. Saran ... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Nomor Halaman
1. Kandungan kimia Dunaliella ... 9
2. Beberapa pelarut organik dan sifat fisiknya... 16
3. Komposisi kimia Dunaliella sp... 39
4. Berat ekstrak Dunaliella sp. dengan jenis pelarut... 42
DAFTAR GAMBAR
Nomor Halaman
6. Kurva pertumbuhan mikroalga ... 8
7. Morfologi sel Dunaliella sp. ... 9
8. Struktur kloramfenikol... 12
9. Struktur dinding sel bakteri Gram negatif dan Gram positif... 18
10.Bakteri Staphylococcus aureus ... 19
11.Bakteri Bacillus cereus. ... 20
12.Bakteri Escherichia coli ... 21
13.Bakteri Vibrio harveyi ... 22
14.Proses kultivasi Dunaliella sp. pada medium Guillard... 26
15.Skema ekstraksi senyawa antibakteri Dunaliella sp. ... 28
16.Kurva pertumbuhan Dunaliella sp. ... 35
17.Warna kultur Dunaliella sp. pada hari yang berbeda ... 38
18.Filtrat dan biomassa kering . ... 41
19.Ekstrak Dunaliella sp. yang diperoleh dengan menggunakan berbagai pelarut... 43
DAFTAR LAMPIRAN
Nomor Halaman
21.Medium Guillard yang telah dimodifikasi ... 60
22.Medium Guillard yang belum dimodifikasi... 61
23.Perhitungan nilai rendemen ekstrak... 62
24.Perhitungan konsentrasi ekstrak... 62
25.Nilai kepadatan sel Dunaliella sp. ... 63
1. PENDAHULUAN
1.1 Latar Belakang
Keanekaragaman sumberdaya di perairan Indonesia merupakan kekayaan alam yang kemungkinan besar masih sangat sedikit dimanfaatkan oleh manusia. Wilayah perairan Indonesia mencapai sekitar 5,8 juta km2 serta mempunyai garis pantai yang panjangnya sekitar 81.000 km, sehingga pemanfaatan sumberdaya laut selayaknya dilakukan secara optimal. Wilayah pesisir dan lautan Indonesia memiliki keanekaragaman hayati tertinggi di dunia. Tingginya keanekaragaman hayati di laut dapat merefleksikan potensi ekonomi perairan pesisir dan lautan tersebut, dalam artian bahwa semakin tinggi keanekaragaman hayati yang terkandung, semakin besar potensi yang dapat dikembangkan (Dahuri 2003)
Mikroalga sebagai salah satu komoditi hasil perairan dewasa ini telah menjadi alternatif untuk dikembangkan karena memiliki potensi yang besar untuk dimanfaatkan. Mikroalga merupakan mikroorganisme atau jasad renik dengan tingkat organisasi sel termasuk dalam tumbuhan tingkat rendah. Mikroalga dikelompokkan dalam filum Thallophyta karena tidak memiliki akar, batang, dan daun sejati, namun memiliki zat pigmen klorofil yang mampu melakukan fotosintesis (Kabinawa 2001). Selain itu, air dan karbon dioksida dengan adanya energi surya dari matahari dan garam-garam hara dapat menghasilkan senyawa organik seperti karbohidrat. Karena kemampuannya membentuk zat organik dari zat anorganik, maka disebut sebagai produsen primer (Nontji 1993)
Seiring perkembangan bioteknologi mikroalga, sejumlah penelitian mulai ditujukan untuk menghasilkan produk bermanfaat yang bernilai tinggi diantaranya sebagai sumber bahan kimia yang dapat menghasilkan produk seperti gliserol, vitamin, protein, pigmen, enzim, dan bahan-bahan bioaktif lain. Bahan-bahan bioaktif yang telah diketahui dapat dihasilkan dari mikroalga yaitu antioksidan, toksin, bahan obat-obatan, dan zat pengatur pertumbuhan (Kabinawa 1994).
Aplikasi bioteknologi sumberdaya perairan berperan dalam mengetahui sekaligus menghasilkan bahan aktif termasuk antimikroba sehingga diperoleh bahan aktif yang dapat dimanfaatkan untuk manusia dan lingkungan. Spesies
biota laut yang memiliki potensi menghasilkan obat-obatan diperkirakan lebih dari 35.000 dan yang dimanfaatkan baru sekitar 5.000 spesies (Dahuri 2003). Jumlah yang besar tersebut seyogyanya dimanfaatkan seoptimal mungkin. Potensi sumber daya alam terutama mikroalga belum banyak diungkap dan diteliti, sehingga informasi yang dapat diperoleh masih sangat terbatas. Penelitian tentang aktivitas senyawa antibakteri dari mikroalga masih sedikit (Matsueda et al. 1988; Shklar dan Schwartz 1988 diacu dalam Chang et al. 1993). Berbagai hasil penelitian mengenai bahan aktif termasuk antimikroba dari mikroalga telah dilaporkan oleh para pakar. Pratt (1942) menemukan bahwa Chlorella sp. diketahui memiliki potensi sebagai antibakteri, Chlorella vulgaris mengandung zat antibakteri yang disebut chlorellin (Hashimoto 1979 diacu dalam Indhira 2004).
Dunaliella merupakan salah satu mikroalga yang cukup banyak diteliti terutama sebagai sumber β-karoten dan gliserol. Pemanfaatan Dunaliella cukup beragam mulai dari sebagai makanan kesehatan seperti yang telah dipasarkan di negara-negara maju. Dunaliella salina juga dapat dimanfaatkan sebagai jasad pakan yang cukup baik (Isnansetyo dan Kurniastuty 1995). Chang et al. (1993) telah melakukan pemurnian sebagian komponen antibiotik Dunaliella primolecta yang memiliki aktivitas antibiotik terhadap bakteri Staphylococcus aureus, Bacillus subtilis, Bacillus cereus, dan Enterobacter aerogenes. Ekstrak Dunaliella tertiolecta menunjukkan hasil positif sebagai antibakteri (Becker 1994).
Spesies dari genus Dunaliella ini cukup banyak diantaranya Dunaliella viridis, Dunaliella primolecta, Dunaliella salina, Dunaliella sp., Dunaliella acidophila, Dunaliella bardawil, Dunaliella parva,. Penelitian tentang produksi antibakteri dari Dunaliella belum banyak diungkap. Oleh karena itu, perlu dilakukan penelitian lebih lanjut tentang senyawa antibakteri dari Dunaliella sp. yang dipanen pada waktu yang berbeda serta mengetahui komponen ekstrak Dunaliella sp. dengan kromatografi lapis tipis.
1.2 Tujuan
Tujuan penelitian ini adalah :
1) Mendapatkan kurva pertumbuhan Dunaliella sp. 2) Mengetahui komposisi kimia Dunaliella sp.
3) Mendapatkan senyawa antibakteri dari Dunaliella sp. pada umur panen yang berbeda.
4) Mempelajari aktivitas antibakteri ekstrak Dunaliella sp. terhadap bakteri patogen.
5) Mengetahui komponen ekstrak Dunaliella sp. dengan metode
2. TINJAUAN PUSTAKA
2.1 Mikroalga
Mikroalga merupakan mikroorganisme atau jasad renik dengan tingkat organisasi sel termasuk dalam tumbuhan tingkat rendah. Mikroalga dikelompokkan dalam filum Thallophyta karena tidak memiliki akar, batang, dan daun sejati, namun memiliki zat pigmen klorofil yang mampu melakukan fotosintesis. Mikroalga memiliki klorofil sehingga mampu melakukan fotosintesis dengan bantuan air, CO2 dan sinar matahari, serta menggunakan bahan anorganik
seperti NO3-, NH4-, dan PO4-, sehingga menghasilkan energi kimiawi dalam
bentuk biomassa seperti karbohidrat, lemak, protein, dan lain-lain. Kemudian energi tersebut digunakan untuk biosintesis sel, pertumbuhan dan pertambahan sel, bergerak dan berpindah serta reproduksi (Kabinawa 2001).
Tumbuhan ini umumnya terdiri dari satu sel atau berbentuk seperti benang. Mikroalga dapat ditemukan di seluruh massa air mulai dari permukaan laut sampai pada kedalaman dengan intensitas cahaya yang masih memungkinkan terjadinya proses fotosintesis. Dominasi kelompok mikroalga tertentu dapat menyebabkan perairan tampak berwarna indah sesuai dengan zat warna atau pigmen yang dikandungnya. Warna hijau muda disebabkan oleh Dunaliella sp. dan Chlorella sp. Ada juga warna kuning kecoklatan yang disebabkan oleh Chaetoceros sp., Skletonema sp., Nitzschia sp. serta berbagai jenis lainnya.
Mikroalga mengandung bahan-bahan organik seperti polisakarida, hormon, vitamin, mineral dan juga senyawa bioaktif. Potensi mikroalga sangat besar sebagai sumber berbagai produk, diantaranya (1) sebagai sumber protein yang dapat diperoleh dari Chlorella dan Dunaliella, (2) produksi pigmen, sebagai bahan pewarna dari Spirulina, Haematococcus (Borowitzka dan Borowitzka 1988), (3) sebagai pakan larva ikan dan non ikan, diperoleh dari Tetraselmis dan Chaetoceros (Isnansetyo dan Kurniastuty 1995), serta (4) produksi antimikroba, dihasilkan Chlorella vulgaris, Chaetoceros gracilis.
Sejumlah penelitian dilakukan untuk mengetahui bahan aktif termasuk antibakteri dari mikroalga. Chlorella sp. diketahui memiliki aktivitas antibakteri (Pratt 1942 diacu dalam Chang et al. 1993), Chlorella vulgaris mengandung zat
antibakteri yang disebut chlorellin, zat ini dapat menghambat pertumbuhan bakteri (Hashimoto 1979 diacu dalam Indhira 2004). Dunaliella primolecta juga diketahui memiliki potensi sebagai antibakteri (Chang et al. 1993).
Kultur mikroalga dalam skala laboratorium biasanya memerlukan kondisi lingkungan yang terkendali. Pertumbuhan mikroalga sangat erat kaitannya dengan ketersediaan hara makro dan mikro serta dipengaruhi oleh kondisi lingkungan. Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan mikroalga, antara lain cahaya, suhu, pH air, dan salinitas (Isnansetyo dan Kurniastuty 1995). a. Unsur hara
Unsur hara yang dibutuhkan mikroalga terdiri atas unsur hara makro (N, P, K, S, Fe, Mg, Si dan Ca) dan unsur hara mikro (Mn, Zn, Co, Bo, Mo, B, Cu, dan lain-lain.). Setiap unsur hara mempunyai fungsi-fungsi khusus yang ditunjukkan pada pertumbuhan dan kepadatan yang dicapai. Unsur N, P, dan S penting untuk pembentukan protein. Nitrogen yang dibutuhkan untuk media kultur dapat diperoleh dari: KNO3, NaNO3, NH4Cl, dan lain-lain. Fosfor juga
merupakan bahan dasar pembentuk asam nukleat, enzim, dan vitamin. Unsur fosfor dapat diperoleh dari KH2PO4, NaH2PO4, Ca3PO4 dan unsur sulfur dapat
diperoleh dari NH4SO4, CuSO4 (Tjahjo et al. 2002).
Unsur K berfungsi dalam metabolisme karbohidrat dan juga sebagai kofaktor untuk beberapa koenzim. Unsur kalium dapat diperoleh dari KCl, KNO3, KH2PO4. Unsur Fe berperan dalam pembentukan klorofil dan sebagai
komponen esensial dalam proses oksidasi. Unsur ini dapat diperoleh dari FeCl3,
FeSO4, FeCaH5O7. Unsur Si dan Ca merupakan bahan untuk pembentukan
dinding sel atau cangkang. Vitamin B12 banyak digunakan untuk memacu
pertumbuhan melalui rangsangan fotosintetik (Isnansetyo dan Kurniastuty 1995). Unsur hara mikro dibutuhkan untuk menjalankan berbagai fungsi dalam pertumbuhan mikroalga, misalnya Mn, Zn diperlukan untuk fotosintesis, unsur Mo, Bo, Co diperlukan untuk metabolisme nitrogen, serta unsur Mn, B, Cu untuk fungsi metabolik lainnya (Eyster 1964 diacu dalam Krisanti 2003). Unsur hara mikro dibutuhkan dalam jumlah kecil tetapi harus ada dan untuk menstabilkan fungsi hara mikro biasanya ditambahkan senyawa sitrat atau EDTA (Kabinawa 1994).
b. Cahaya
Mikroalga merupakan organisme autotrof yang mampu membentuk senyawa organik dari senyawa anorganik melalui proses fotosintesis. Keberadaan cahaya menentukan bentuk kurva pertumbuhan bagi mikroalga yang melakukan fotosintesis. Cahaya matahari dapat diganti dengan sinar lampu TL dan kisaran optimum intensitas cahaya bagi mikroalga antara 2000-8000 lux. Pada mikroalga hijau, pigmen yang menyerap cahaya adalah klorofil a, disamping pigmen lain seperti karotenoid dan xantofil (Tjahjo et al. 2002).
c. Suhu
Suhu secara langsung mempengaruhi efesiensi fotosintesis dan faktor yang menentukan dalam pertumbuhan. Pada kondisi laboratorium, perubahan suhu air dipengaruhi oleh temperatur ruangan dan intensitas cahaya. Suhu optimum untuk kultur mikroalga di laboratorium antara 25-32 oC (Fogg 1975). Kenaikan temperatur akan meningkatkan kecepatan reaksi. Umumnya setiap kenaikan 10 oC dapat mempercepat reaksi 2-3 kali lipat. Akan tetapi, temperatur tinggi yang melebihi temperatur maksimum akan menyebabkan proses metabolisme sel terganggu.
d. pH
Proses fotosintesis mengambil karbondioksida terlarut dari dalam air, yang berakibat penurunan kandungan CO2 terlarut di air. Penurunan ini akan
meningkatkan pH berkaitan dengan kesetimbangan CO2 terlarut, bikarbonat
(HCO3-) dan ion karbonat (CO32-) dalam air. Oleh karena itu, laju fotosintesis
akan terbatas oleh penurunan karbon dalam hal ini karbondioksida. (Talling 1976 diacu dalam Krisanti 2003). Umumnya pH optimum bagi pertumbuhan mikroalga adalah 8-8,5.
e. Salinitas
Fluktuasi salinitas secara langsung menyebabkan perubahan tekanan osmosis di dalam sel mikroalga. Salinitas yang tinggi atau rendah dapat menyebabkan tekanan osmosis di dalam sel juga menjadi lebih rendah atau lebih tinggi sehingga aktivitas sel menjadi terganggu. Hal ini dapat mempengaruhi pH sitoplasma sel dan menurunkan kegiatan enzim di dalam sel. Salinitas optimum bagi pertumbuhan mikroalga antara 25-35 ‰ (Tjahjo et al. 2002).
2.2 Pola Pertumbuhan Mikroalga
Pertumbuhan mikroalga dalam kultur dapat ditandai dengan bertambah besarnya ukuran sel atau bertambah banyaknya jumlah sel. Sampai saat ini kepadatan sel digunakan secara luas untuk mengetahui pertumbuhan mikroalga (Isnansetyo dan Kurniastuty 1995). Pertumbuhan mikroalga dalam kultur sangat dipengaruhi oleh kondisi cahaya, suhu, aerasi dan nutrisi.
Pertumbuhan mikroalga dibagi dalam lima fase pertumbuhan, yaitu fase lag, fase logaritmik atau eksponensial, fase penurunan laju pertumbuhan, fase stasioner, dan fase kematian (Fogg 1975). Kurva pertumbuhan mikroalga dapat dilihat pada Gambar 1.
1. Fase lag
Fase ini ditandai dengan peningkatan populasi yang tidak nyata. Fase ini disebut juga sebagai fase adaptasi karena sel mikroalga sedang beradaptasi terhadap media tumbuhnya. Lamanya fase lag tergantung pada umur inokulum yang dimasukkan. Sel-sel yang diinokulasikan pada awal fase log akan mengalami fase lag yang singkat. Inokulum yang berasal dari kultur yang sudah tua akan mengalami fase lag yang lama, karena membutuhkan waktu untuk menyusun enzim-enzim yang tidak aktif. Ukuran sel pada fase lag ini pada umumnya meningkat. Organisme mengalami metabolisme, tetapi belum terjadi pembelahan sel sehingga kepadatan sel belum meningkat.
2. Fase logaritmik atau eksponensial
Fase ini diawali oleh pembelahan sel dan ditandai dengan naiknya laju pertumbuhan hingga kepadatan populasi meningkat. Laju pertumbuhannya meningkat dengan pesat dan selnya aktif berkembang biak. Ciri metabolisme pada fase ini adalah tingginya aktivitas fotosintesis yang berguna untuk pembentukan protein dan komponen-komponen penyusun plasma sel yang dibutuhkan dalam pertumbuhan.
3. Fase penurunan laju pertumbuhan
Fase ini ditandai dengan penurunan laju pertumbuhan. Selain itu terjadi penurunan pertambahan populasi per satuan waktu bila dibandingkan dengan fase eksponensial sehingga fase ini disebut juga fase decline.
4. Fase stasioner
Pada fase ini, pertumbuhan mengalami penurunan dibandingkan fase logaritmik. Laju reproduksi sama dengan laju kematian. Dengan demikian penambahan dan pengurangan jumlah mikroalga relatif sama atau seimbang sehingga kepadatannya tetap. Jumlah sel cenderung tetap diakibatkan sel telah mencapai titik jenuh.
5. Fase kematian
Fase ini ditandai dengan kepadatan populasi selnya yang terus berkurang. Keterangan:
1. Fase lag
2. Fase logaritmik
Jumlah sel 3. Fase penurunan laju pertumbuhan
(sel/ml) 4. Fase stasioner
5. Fase kematian
Umur kultur (hari)
Gambar 1. Kurva pertumbuhan mikroalga (Becker 1994).
2.3 Dunaliella sp.
Secara morfologi, Dunaliella sp. merupakan mikroalga yang bersifat uniseluler, mempunyai sepasang flagella yang sama panjangnya, sebuah kloroplast berbentuk cangkir, dan tidak memiliki dinding sel (Borowitzka dan Borowitzka 1988). Dunaliella sering juga disebut sebagai flagellata uniseluler hijau (green unicellulair flagellata). Gambar morfologi sel Dunaliella sp. ditunjukkan pada Gambar 2. Bentuk selnya juga tidak stabil dan beragam, dapat berbentuk lonjong, bulat silindris, ellip, dan lain-lain. Hal ini sangat dipengaruhi oleh kondisi lingkungan, pertumbuhan, dan intensitas sinar matahari (Isnansetyo dan Kurniastuty 1995).
Dunaliella memiliki kisaran toleransi pH yang luas mulai dari pH 1 (Dunaliella acidophila) sampai pH 11 (Dunaliella salina). Demikian halnya
juga dengan suhu, mulai dari -35 ºC sampai 40 ºC (Borowitzka dan Borowitzka 1988). Spesies Dunaliella sp. dapat tumbuh optimal pada pH 6-6,5 dan kisaran suhu antara 22-25 ºC dengan salinitas air 30-35 ‰ (Redjeki dan Ismail 1993 diacu dalam Tjahjo et al. 2002).
Dunaliella termasuk kelompok Chlorophyceae (alga hijau) yang mengandung klorofil a dan b serta karotenoid yang umumnya berupa β-karoten (Borowitzka dan Borowitzka 1988).
A B
Keterangan: A = Sel Dunaliella sp. (Dokumentasi pribadi) B = Sel Dunaliella (Anonim 2007)a
Gambar 2. Morfologi sel Dunaliella sp.
Klasifikasi Dunaliella (Bougis 1979 diacu dalam Isnansetyo dan Kurniastuty 1995), sebagai berikut:
Phylum : Chlorophyta
Kelas : Chlorophyceae
Ordo : Volvocales
Famili : Polyblepharidaceae Genus : Dunaliella
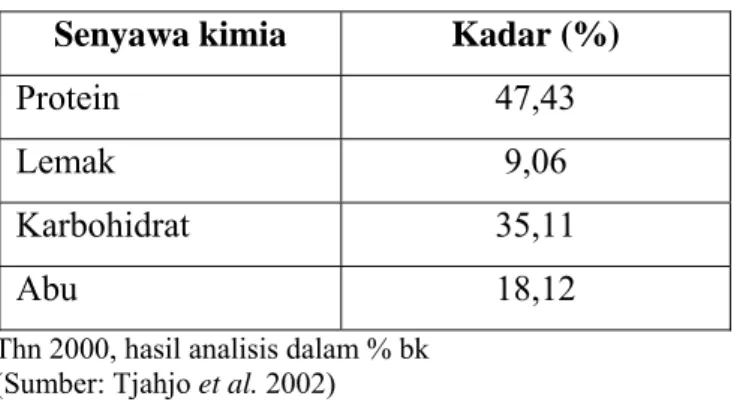
Genus Dunaliella banyak dimanfaatkan sebagai makanan kesehatan seperti halnya dengan Chlorella karena kandungan proteinnya yang tinggi. Komposisi kimia Dunaliella dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia Dunaliella
Senyawa kimia Kadar (%)
Protein 47,43 Lemak 9,06 Karbohidrat 35,11
Abu 18,12
Thn 2000, hasil analisis dalam % bk
(Sumber: Tjahjo et al. 2002)
Spesies dari genus Dunaliella ini cukup banyak dan telah dimanfaatkan diantaranya Dunaliella viridis, D. primolecta, D. salina, D. acidophila, D. bardawil, D. parva, dan Dunaliella sp. Pemanfaatan Dunaliella cukup beragam
mulai dari sebagai makanan kesehatan seperti yang telah dipasarkan di negara-negara maju, Dunaliella salina juga sebagai jasad pakan yang cukup
baik dan mendapat perhatian besar di beberapa negara seperti Australia, Amerika, dan Israel karena menghasilkan gliserol dan β-karoten (Isnansetyo dan Kurniastuty 1995). Selain itu, Chang et al. (1993) menyebutkan bahwa Dunaliella primolecta, Dunaliella tertiolecta, Dunaliella sp. berpotensi sebagai antibakteri.
Reproduksi dilakukan secara vegetatif dan generatif. Reproduksi secara aseksual terjadi dengan pembelahan secara memanjang. Saat proses pembelahan inti, maka pirenoid akan melebar melintang dan menyebabkan dua flagella saling berjauhan. Pada pirenoid dan kloroplas akan terbentuk suatu lekukan yang kemudian akan membelah dan menjadi individu-individu baru, masing-masing dengan satu flagella dan satu sel anak yang belum mempunyai stigma. Stigma yang terbentuk ini merupakan hasil proses metamorfosis dari kromatofora (Tjahjo et al. 2002).
Reproduksi seksual terjadi dengan cara melakukan isogami melalui konjugasi. Zigot berwarna merah atau hijau dikelilingi oleh dinding sporollenin yang halus dan sangat tipis. Nukleus zigot akan membelah secara meiosis. Pembelahan ini terjadi setelah tahap istrahat dan terbentuk lebih dari 32 sel yang dibebaskan melalui retakan atau celah pada dinding sel induk (Isnansetyo dan Kurniastuty 1995).
2.4 Senyawa Antibakteri
Antimikroba adalah senyawa kimia yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Antimikroba sebagai substansi dapat berupa senyawa kimia sintetik atau produk alami (Brock dan Madigan 2003). Senyawa antibakteri merupakan salah satu senyawa antimikroba yang didefinisikan sebagai senyawa biologis atau kimia yang dapat membunuh atau menghambat pertumbuhan dan aktivitas bakteri (Pelczar dan Reid 1979). Berdasarkan aktivitasnya, senyawa antibakteri dapat dibedakan atas senyawa yang bersifat bakterisidal (membunuh bakteri) seperti penisilin, basitrasin, neomisin, dan senyawa yang bersifat bakteristatik (menghambat pertumbuhan bakteri) seperti tetrasiklin, kloramfenikol, novobiosin (Pelczar dan Chan 2005).
Senyawa antibakteri dalam menghambat pertumbuhan bakteri dipengaruhi oleh berbagai faktor, antara lain (1) konsentrasi zat antibakteri, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba meliputi jenis, umur, konsentrasi, dan keadaan mikroba (Frazier dan Westhoff 1988).
Aktivitas senyawa antibakteri ditandai dengan terbentuknya zona bening di sekitar paper disc. Faktor-faktor yang mempengaruhi ukuran daerah penghambatan, yaitu sensitivitas organisme, medium kultur, kondisi inkubasi, dan kecepatan difusi agar. Faktor-faktor yang mempengaruhi kecepatan difusi agar, yaitu konsentrasi mikroorganisme, komposisi media, suhu inkubasi, dan waktu inkubasi (Schlegel dan Schmidt 1994).
Antimikroba sebagai substansi dapat berupa senyawa sintetik atau produk alami. Antimikroba sintetik diperoleh dengan membuat suatu senyawa yang sifatnya mirip dengan aslinya yang dibuat secara besar-besaran, seperti penisilin, cephalosporin, glikopeptida, tetrasiklin, kloramfenikol, aminoglikosida, sulfonamida, dan quinolones (Brock dan Madigan 2003). Pemakaian antimikroba sintetik diketahui cukup berbahaya karena dapat meningkatkan resistensi bakteri terhadap zat antimikroba tersebut (Lohner dan Austria 2001). Pemberian dosis antibiotik yang rendah dan berulang-ulang dapat menyebabkan resistensi. Penyebab terjadinya resistensi bakteri (Brock dan Madigan 2003), antara lain: (1) tidak adanya struktur bakteri yang menjadi sasaran antibiotik, (2) bakteri tersebut mungkin bersifat impermeabel terhadap antibiotik, dan (3) bakteri tersebut mampu mengubah antibiotik menjadi bentuk yang inaktif.
Antimikroba alami umumnya berasal dari tanaman, hewan, maupun organisme dengan melakukan proses pengekstrakan misalnya pada mikroalga. Antibakteri dari alga umumnya belum banyak teridentifikasi, namun beberapa telah diketahui komponen penyusunnya. Ada yang terdiri dari asam lemak, asam organik, bromofenol, penghambat fenolat, tannin, terpenoid, polisakarida, alkohol (Metting dan Pyne 1986 diacu dalam Setyaningsih et al. 2000)
Senyawa antibakteri yang terkandung dalam berbagai jenis ekstrak tanaman diketahui dapat menghambat beberapa bakteri patogen maupun perusak pangan (Branen 1993). Senyawa antibakteri yang berasal dari tanaman, sebagian besar diketahui merupakan metabolit sekunder tanaman, terutama dari golongan
fenolik dan terpen dalam minyak atsiri dan alkaloid. Sebagian besar metabolit sekunder dihasilkan dari metabolit primer seperti dari asam-asam amino, asetik ko-A, asam mevalonat, dan metabolit antara (Herbert 1995). Selain itu, beberapa senyawa yang bersifat antibakteri alami yang berasal dari tanaman diantaranya adalah fitoaleksin, asam organik, minyak esensial (atsiri), fenolik dan beberapa kelompok pigmen tanaman atau senyawa sejenis (Nychas dan Tassou 2000 diacu dalam Parhusip 2006).
Zat yang digunakan sebagai antibakteri harus mempunyai beberapa kriteria antara lain tidak bersifat racun, ekonomis, tidak merubah flavor, cita rasa, dan aroma makanan jika digunakan dalam bahan pangan, tidak mengalami penurunan aktivitas selama proses dan penyimpanan, tidak menyebabkan galur resisten dan sebaiknya membunuh dibandingkan menghambat pertumbuhan mikroba (Frazier dan Westhoff 1988).
Beberapa kelompok utama bahan antibakteri kimiawi adalah fenol dan persenyawaan fenolat, alkohol, halogen, logam berat dan persenyawaannya, deterjen, aldehide, dan kemosterilisator gas (Pelczar dan Chan 2005). Kloramfenikol merupakan salah satu jenis antibakteri yang banyak digunakan dan memiliki spektrum aktivitas antibakteri yang luas karena aktif terhadap bakteri Gram negatif dan juga bakteri Gram positif. Struktur kloramfenikol dapat dilihat pada Gambar 3.
Gambar 3. Struktur kloramfenikol (Greenwood et al. 1995)
Kloramfenikol mulanya diisolasi dari Streptomyces venezuelae, tetapi saat ini dapat disintesa secara kimia tanpa tahap biosintesa dan lebih murah (Fardiaz et al. 1988). Kloramfenikol bekerja dengan cara menghambat sintesa protein dengan mengganggu transfer peptida ke asam amino. Resistensi bakteri terhadap kloramfenikol terjadi karena adanya asetilasi yang membuat kloramfenikol tidak aktif. Kloramfenikol termasuk antibiotik yang paling stabil dan dalam air dengan
pH 6 menunjukkan kecenderungan terurai yang paling rendah. Antibiotik ini masih banyak digunakan khususnya di negara-negara berkembang karena harganya yang relatif lebih murah dibandingkan dengan antibiotik-antibiotik lainnya (Fardiaz 1992).
Penggunaan kloramfenikol relatif tidak beracun bagi mamalia bila digunakan secara terapeutik, namun antibiotik ini dapat menyebabkan efek samping yaitu idiosyncratic aplastic anemia dan hingga saat ini belum ada informasi tentang dosis kloramfenikol yang menyebabkan aplastic anemia. Aplastic anemia merupakan penyakit yang menyebabkan sumsum tulang berhenti memproduksi sel darah yang baru baik sel darah merah maupun sel darah putih. Oleh sebab itu, pemakaiannya baru dianjurkan pada kasus-kasus yang tidak dapat diobati secara efektif dengan antibiotik lain (Pelczar dan Chan 2005). Hal tersebut juga menyebabkan kloramfenikol tidak diizinkan sebagai antibiotik yang ditambahkan pada bahan makanan (FDA 2004).
2.5 Mekanisme Kerja Senyawa Antibakteri
Cara kerja penghambatan dan kerusakan mikroba oleh senyawa antimikroba berbeda-beda. Mekanisme senyawa antimikroba dalam menghambat pertumbuhan mikroba dibagi menjadi beberapa cara (Branen dan Davidson 1993), yaitu : kerusakan pada dinding sel, perubahan permeabilitas sel, penghambatan sintesis protein dan asam nukleat, dan menghambat enzim-enzim metabolik. 1) Kerusakan pada dinding sel
Dinding sel bakteri mengandung peptidoglikan yang terdiri dari turunan gula yaitu asam N-asetilglukosamin, asam N-asetilmuramat, dan suatu peptida yang terdiri dari asam amino yaitu L-alanin, D-alanin, D-glutamat, dan lisin (Fardiaz 1992). Lapisan peptidoglikan merupakan suatu molekul raksasa. Bakteri Gram positif memiliki 40 lapisan peptidoglikan yang merupakan 50 % dari bahan dinding sel sedangkan bakteri Gram negatif hanya ada 1-2 lapisan peptidoglikan dan merupakan 10 % dari bahan dinding sel (Pelczar dan Chan 2005).
Antimikroba dapat menghambat sintesa dinding sel mikroba yaitu dengan menghambat pembentukan peptidoglikan yang merupakan komponen penting dari dinding sel mikroba. Mekanisme kerusakan dinding sel dapat juga disebabkan oleh adanya akumulasi komponen lipofilik yang terdapat pada dinding sel atau
membran sel, sehingga menyebabkan perubahan komposisi penyusun dinding sel (Nychas dan Tassou 2000 diacu dalam Parhusip 2006). Contohnya penisilin dan sefalosporin
2) Perubahan permeabilitas sel
Senyawa antimikroba dapat menyerang membran sitoplasma dan mempengaruhi integritasnya. Membran sitoplasma berperan pada keutuhan sel dimana mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar masuknya bahan-bahan lain (Pelczar dan Chan 2005). Kerusakan pada membran ini mengakibatkan peningkatan permeabilitas dan terjadi kebocoran sel yang diikuti dengan keluarnya materi intraseluler. Mekanisme minyak atsiri (karvakrol, sitral, dan geraniol) adalah mengganggu lapisan fosfolipid dari membran sel yang menyebabkan peningkatan permeabilitas dan kehilangan unsur penyusun sel (Kim et al. 1995 diacu dalam Parhusip 2006). Contoh antimikroba ini adalah polimiksin dan golongan polien.
3) Penghambatan sintesis protein dan asam nukleat
Síntesis protein adalah pembentukan rantai polipeptida dari asam-asam amino melalui ikatan peptida. Senyawa antimikroba mampu menghambat sintesis protein bakteri yaitu senyawa tersebut dapat bereaksi dengan komponen sel ribosom 50 S yang pada akhirnya menyebabkan terjadinya sintesis protein dan dilanjutkan terbentuknya pasangan yang tidak tepat dan akhirnya mengganggu pembentukan protein (Nychas dan Tassou 2000 diacu dalam Parhusip 2006). Contohnya tetrasiklin, kloramfenikol, dan eritromisin. Senyawa antimikroba juga dapat menghambat sintesa asam nukleat (DNA dan RNA) dengan cara menghambat DNA girase yang berfungsi dalam penataan kromosom sel mikroba. Contohnya enrofloksasin (Setiabudy dan Ganiswara 1995)
4) Menghambat enzim-enzim metabolik
Enzim yang berperan dalam metabolisme dan pertumbuhan sel mikroba dapat dihambat aktivitasnya oleh komponen antibakteri yang berakibat terganggunya aktivitas maupun pertumbuhan mikroba. Konsentrasi antibakteri yang tinggi dapat juga menyebabkan koagulasi enzim (Brown 1962 diacu dalam Parhusip 2006). Komponen antibakteri dapat menghambat pertumbuhan atau membunuh mikrooganisme melalui inaktivasi enzim-enzim metaboliknya.
Senyawa antibakteri sulfit, nitrit, dan asam benzoat dapat menginaktivasi berbagai enzim metabolik bakteri.
2.6 Ekstraksi Senyawa Antibakteri
Ekstraksi adalah suatu proses penarikan komponen yang diinginkan dari suatu bahan ataupun proses pemisahan satu atau beberapa zat yang diinginkan dari campurannya dengan bantuan pelarut. Adapun beberapa faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yang digunakan. Hal yang perlu diperhatikan dalam pemilihan jenis pelarut adalah daya melarutkan, titik didih, sifat toksik, mudah tidaknya terbakar, dan sifat korosif terhadap peralatan ekstraksi (Karger et al. 1973).
Ekstraksi dapat dibedakan menjadi tiga cara pengoperasiannya yaitu (1) ekstraksi dengan menggunakan pelarut (solvent extraction), (2) ekstraksi dengan penekanan yang sering disebut penekanan mekanik, dan (3) ekstraksi dengan pemanasan (rendering). Menurut jenis pelarutnya, solvent extraction dapat dilakukan dengan dua cara yaitu aqueous phase (dilakukan dengan menggunakan air) dan organic phase (dilakukan dengan menggunakan pelarut organik) (Winarno et al. 1973).
Metode ekstraksi dapat dikelompokkan menjadi dua yaitu ekstraksi sederhana dan ekstraksi khusus (Harborne 1987). Ekstraksi sederhana terdiri atas:
a) Maserasi yaitu metode ekstraksi dengan cara merendam bahan dalam pelarut dengan atau tanpa pengadukan
b) Perkolasi yaitu metode ekstraksi secara berkesinambungan
c) Reperkolasi yaitu perkolasi dimana hasil perkolasi digunakan untuk melarutkan sampel dalam perkolator sampai senyawa kimianya terlarutkan d) Evakolasi yaitu perkolasi dengan pengurangan tekanan udara
e) Diakolasi yaitu perkolasi dengan penambahan tekanan udara. Ekstraksi khusus terdiri atas :
a) Sokletasi yaitu metode ekstraksi secara berkesinambungan untuk melarutkan sampel kering dengan menggunakan pelarut yang bervariasi b) Arus balik yaitu metode ekstraksi secara berkesinambungan dimana
c) Ultrasonik yaitu ekstraksi dengan menggunakan alat yang menghasilkan frekuensi bunyi atau getaran antara 25-100 kHz.
Prinsip ekstraksi adalah zat yang akan diekstrak hanya dapat larut dalam pelarut yang digunakan, sedangkan zat lainnya tidak akan larut. Oleh karena itu, pemilihan pelarut yang sesuai akan sangat penting. Gaya yang bekerja dalam proses ekstraksi adalah perbedaan konsentrasi antara larutan di dalam sel dengan cairan ekstraksi di luar sel. Bahan pelarut mengalir ke dalam ruang sel sehingga menyebabkan protoplasma membengkak dan menyebabkan kandungan sel akan berdifusi ke luar sel (Achmadi 1992).
Metode ekstraksi tergantung pada polaritas senyawa yang akan diekstrak. Suatu senyawa menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda. Bahan dan senyawa kimia akan mudah larut pada pelarut yang relatif sama kepolarannya. Semakin besar konstanta dielektrik, maka semakin polar pelarut tersebut. Beberapa pelarut organik dan sifat fisiknya dapat dilihat pada Tabel 2.
Tabel 2. Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih (ºC) Titik beku (ºC) Konstanta
dielektrik Heksana 68 -94 1,8 Dietil eter 35 -116 4,3 Kloroform 61 -64 4,8 Etil asetat 77 -84 6,0 Aseton 56 -95 20,7 Etanol 78 -117 24,3 Metanol 65 -98 32,6 Air 100 0 80,2
Sumber : Nur dan Adijuwana (1989)
Prinsip metode ekstraksi dengan menggunakan pelarut organik adalah bahan yang akan diekstrak kontak langsung dengan pelarut selama waktu tertentu, kemudian diikuti dengan pemisahan bahan yang telah diekstrak. Ekstraksi bertingkat dilakukan secara berturut-turut dimulai dengan pelarut non polar (misalnya heksana atau kloroform) lalu dilanjutkan dengan pelarut yang kepolarannya menengah (misalnya etil asetat atau dietil eter), kemudian
dilanjutkan dengan pelarut polar (misalnya metanol atau etanol). Pelarut non polar akan melarutkan senyawa non polar, pelarut polar akan melarutkan senyawa polar, sedangkan pelarut semi polar akan melarutkan senyawa antara polar maupun non polar. Proses ekstraksi ini akan diperoleh ekstrak kasar (crude extract) yang berturut-turut mengandung senyawa non polar, semi polar,
dan polar (Hostettmann et al. 1997)
Hasil ekstrak yang diperoleh tergantung pada beberapa faktor yaitu kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama waktu ekstraksi dan perbandingan jumlah pelarut terhadap jumlah sampel (Harborne 1987).
2.7 Bakteri
Bakteri adalah sel prokariot yang bersifat uniseluler. Sel bakteri ada yang berbentuk bulat, batang, atau spiral. Umumnya ukuran diameter bakteri yaitu antara 0,5 sampai 1,0 µm, dan panjangnya 1,5 sampai 2,5 µm (Pelczar dan Chan 2005). Bahan sel bakteri (sitoplasma dan intinya) dikelilingi oleh membran sitoplasma yang berfungsi mengendalikan keluar masuknya suatu bahan ke dalam sel. Bagian luar yang menutupi membran sitoplasma ialah dinding sel yang kaku yang mengandung peptidoglikan. Peptidoglikan ini yang memberikan bentuk dan kakunya dinding sel (Lay dan Hastowo 1992). Berdasarkan perbedaan komposisi dan struktur dinding selnya maka bakteri dibedakan menjadi bakteri Gram positif dan bakteri Gram negatif (Pelczar dan Chan 2005). Gambar 4 menunjukkan perbedaan struktur dinding sel bakteri Gram positif dan Gram negatif. Perbedaan susunan dinding sel dapat menyebabkan perbedaan kesensitifan bakteri terhadap senyawa tertentu.
Bakteri Gram positif memiliki struktur dinding sel yang tebal (15-80 nm) dan mempunyai lapisan tunggal (mono). Peptidoglikan sebagai lapisan tunggal yang merupakan komponen utama dimana lebih dari 50 % berat kering pada beberapa bakteri (Pelczar dan Chan 2005). Dinding selnya mengandung lipid yang rendah (1-4 %) dan bakteri Gram positif ini mengandung sejumlah besar asam teikoat yang dapat merupakan 50 % dari bobot kering dinding sel. Asam teikoat merupakan polimer yang bersifat asam yang mengandung ribitol fosfat atau gliserol fosfat. Asam teikoat ini bermuatan negatif sehingga menyebabkan
muatan negatif pada permukaan sel bakteri Gram positif (Lay dan Hastowo 1992). Pertumbuhan bakteri ini dapat dihambat oleh zat-zat warna dasar dan lebih rentan terhadap penisilin. Persyaratan nutrisi relatif rumit pada banyak spesies serta lebih resisten terhadap gangguan fisik. Contoh bakteri yang termasuk dalam bakteri Gram positif ini adalah Staphylococcus aureus dan Bacillus cereus.
Gambar 4. Struktur dinding sel bakteri Gram negatif dan Gram positif (Moat dan Foster 1988)
Bakteri Gram negatif memiliki struktur dinding sel yang tipis (10-15 nm) dan berlapis tiga (multi). Peptidoglikan terdapat pada lapisan kaku sebelah dalam dan jumlahnya sedikit, sekitar 10 % berat kering. Bakteri Gram negatif mempunyai lapisan membran luar yang menyebabkan dinding selnya mengandung lipid yang tinggi (11-22 %). Lapisan membran luar ini tidak hanya terdiri dari fosfolipida saja tetapi juga mengandung lipida lainnya, polisakarida, dan protein. Bakteri Gram negatif ini tidak memiliki asam teikoat. Pertumbuhannya kurang dapat dihambat oleh zat-zat warna dasar dan kurang rentan terhadap penisilin. Persyaratan nutrisi relatif lebih sederhana serta kurang resisten terhadap gangguan fisik. Contoh bakteri yang termasuk dalam bakteri Gram negatif ini adalah Escherichia coli dan Vibrio harveyi (Pelczar dan Chan 2005).
2.7.1 Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif anaerob fakultatif dan termasuk famili Micrococcaceae. Bakteri ini berbentuk kokus dengan diameter 0,5-1,5 µm, terdapat dalam bentuk tunggal, berpasangan atau berkelompok membentuk anggur. Selain itu, Staphylococcus aureus bersifat nonmotil, tidak memiliki kapsul dan tidak berspora (Fardiaz 1992). Bakteri ini dapat tumbuh dan berkembang biak pada kisaran suhu 6,7-45,5 oC dan kisaran pH 4,0-9,8 sedangkan suhu optimum pertumbuhan bakteri ini adalah 35-37 oC dengan kisaran pH optimumnya 7,0-7,5 (Pelczar dan Chan 2005).
Staphylococcus aureus biasanya terdapat di berbagai bagian tubuh manusia termasuk hidung, tenggorokan, dan kulit sehingga mudah memasuki makanan. Bila kita memakan makanan yang tercemar bakteri ini maka dapat menyebabkan rasa mual, muntah, pusing, dan diare. Bakteri ini bersifat patogen yang dapat menyebabkan keracunan dan penyakit pada hewan peliharaan. Bakteri ini banyak mencemari pangan karena tindakan yang tidak higienis dalam penanganan pangan (Adam dan Moss 1995).
Gambar 5. Staphylococcus aureus ( Anonim 2007)b Produk bahan pangan yang telah dimasak seperti daging dan ayam yang dimasak, udang kupas yang dimasak, ham, bacon, lunch meats, serta produk-produk susu seperti kue krim, keju, dan custard pies biasanya berhubungan dengan keracunan bahan pangan yang tercemar bakteri Staphylococcus aureus (Buckle et al. 1985). Staphylococcus aureus umumnya sensitif terhadap antibiotik β-laktam, tetrasiklin, dan kloramfenikol tetapi resisten terhadap polimiksin dan polynes (Pelczar dan Chan 2005). Bakteri ini juga relatif resisten terhadap pengeringan, panas (tahan terhadap suhu 50 oC selama 30 menit), resisten terhadap NaCl 9 % tetapi mudah dihambat oleh zat kimia tertentu seperti heksaklorofen 3 %.
2.7.2 Bacillus cereus
Bakteri ini berbentuk batang, bersifat aerob sampai anaerob fakultatif, katalase positif, dan sebagian besar bersifat Gram positif. Ukuran diameter Bacillus cereus adalah 1,0-1,2 µm dan panjang 3,0-5,0 µm (Fardiaz 1989). Kisaran suhu minimum pertumbuhan bakteri ini adalah 4-5 oC dan suhu maksimumnya 48-50 oC sedangkan suhu optimumnya adalah 30-45 oC. Kisaran pH optimumnya adalah 4,9-9,3 (Granum dan Baird Parker 2000). Bacillus cereus mampu memproduksi spora tahan panas sehingga pemanasan tidak dapat menghilangkan Bacillus cereus secara maksimum. Bakteri ini bersifat patogen meskipun sebagian besar golongan Bacillus bersifat non-patogen.
Bakteri ini dapat menyebabkan beberapa penyakit infeksi dan intoksikasi. Jenis toksin yang dihasilkan dapat digolongkan menjadi toksin emetik dan toksin diargenik (Fardiaz 1989). Makanan yang berhubungan dengan gejala emetik adalah pangan berkarbohidrat seperti nasi dan pasta, sedangkan makanan yang berhubungan dengan diargenik adalah produk daging, sup, sayuran, puding, dan saus (Adam dan Moss 1995). Bacillus cereus sering ditemukan pada produk daging beku, susu pasteurisasi, dan sayur-sayuran.
Gambar 6. Bacillus cereus (Anonim 2007)c
Keracunan pangan oleh Bacillus cereus terjadi secara intoksikasi, yaitu masuknya enterotoksin yang diproduksi oleh Bacillus cereus ke dalam tubuh. Gejala yang muncul adalah diare atau muntah dalam jangka waktu 2-16 jam setelah makanan dikonsumsi. Bakteri ini peka terhadap antibiotik streptomisin, penisilin G, sedangkan beberapa antibiotik lain lebih resisten (Friedman et al. 2004 diacu dalam Parhusip 2006).
2.7.3 Escherichia coli
Escherichia coli merupakan golongan bakteri patogen Gram negatif anaerob fakultatif. Bakteri ini termasuk famili Enterobacteriaceae yang memiliki bentuk seperti batang dengan ukuran panjang 2,0-6,0 µm dan lebar 1,1-1,5 µm serta tunggal dan berpasangan. Kisaran suhu pertumbuhannya adalah 10-40 ºC dengan suhu optimum 37 ºC sedangkan kisaran pH optimumnya adalah 7,0-7,5 (Fardiaz 1992). Gambar Escherichia coli ditunjukkan pada Gambar 7. Kemampuannya yang dapat hidup pada kisaran suhu yang luas sehingga kemungkinan pangan tercemar bakteri ini sangat besar bila penanganan bahan pangan kurang memadai.
Escherichia coli umumnya hidup di perairan, tanah, makanan, air seni, dan tinja manusia (Fardiaz 1992). Keberadaan Escherichia coli dalam bahan pangan dapat mengindikasikan bahwa telah terjadi kontaminasi dari feses manusia atau hewan. Pertumbuhan bakteri ini dalam media padat ditunjukkan dengan adanya koloni bundar, berwarna putih, dan halus. Sedangkan dalam media cair, pertumbuhannya berupa supernatan yang jernih dengan endapan yang tidak dapat larut dengan pengocokan.
Gambar 7. Escherichia coli (Anonim 2007)d
Escherichia coli merupakan penghuni normal dalam usus halus bagian bawah manusia dan mamalia termasuk burung, yang pada keadaan tertentu dapat bersifat patogen, tetapi selama tidak memiliki elemen genetik sebagai faktor virulensnya, bakteri ini bersifat komensal (Pelczar dan Chan 2005). Bakteri Escherichia coli juga diketahui sebagai salah satu penyebab utama diare akut yang sering terjadi pada pendatang baru di negara-negara asing tertentu (travelers diarrhea) (Jay 2000). Bakteri ini sensitif terhadap antibiotik jenis kloramfenikol, kanamisin, penisilin dan sulfonamid (Tortora et al. 1989).
2.7.4 Vibrio harveyi
Bakteri ini termasuk bakteri Gram negatif dan bersifat fermentatif. Bentuk selnya adalah berbentuk batang pendek, bersel tunggal, dengan ukuran panjangnya 1,4-5,0 µm dan lebar 0,3-1,3 µm, bersifat motil dan mempunyai flagella untuk bergerak (Lavilla-Pitogo 1995). Vibriosis merupakan jenis penyakit yang sering ditemukan pada budidaya windu sebagai akibat infeksi bakteri Vibrio.
Vibrio harveyi termasuk bakteri patogen yang menempel kuat pada dinding kulit larva dan sebagai virulensinya menggunakan protein ekstraseluler, kondisi ini menyebabkan kematian larva udang sebelum dipanen. Bakteri patogen dapat dibedakan atas dua tipe, yaitu patogen obligat dan patogen non obligat. Patogen obligat, yaitu patogen yang dapat menimbulkan penyakit setiap kali kontak dengan inangnya, sedangkan patogen non obligat yaitu patogen yang dapat hidup dan berkembang biak di dalam inang ataupun bebas di luar inang, seperti Vibrio sp. (Boer dan Zafran diacu dalam Naiborhu 2002). Jenis bakteri ini juga mampu menyebabkan penyakit kunang-kunang (Rukyani 1992).
Gambar 8. Vibrio harveyi (Anonim 2007)e
Bakteri Vibrio harveyi dapat tumbuh baik pada medium dengan kadar garam 0,5 % NaCl, dan seperti halnya bakteri Vibrio berpendar lain, bakteri ini tumbuh dan berpendar pada medium Tiosulphate-Citrate-Bile-salt (TCBS). Pendaran ini terjadi karena bakteri ini mempunyai enzim lusiferase yang dapat mengkatalisis reaksi yang memancarkan cahaya dengan menggunakan substrat berupa senyawa aldehid yang disebut lusiferin (Meighen 1991 diacu dalam Lailati 2007). Vibrio harveyi sensitif terhadap antibiotik rifampisin, kloramfenikol, oksitetrasilin, dan hampir semua antibiotik, tetapi pemakaian yang berlebihan akan menyebabkan Vibrio harveyi menjadi resisten (Greenwood et al. 1995).
2.8 Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan metode kromatografi cair yang sederhana yang mampu memisahkan senyawa-senyawa yang berbeda seperti senyawa organik alam dan senyawa organik sintetik, kompleks anorganik-organik, dan bahkan ion anorgaik (Gritter et al. 1991). Pemakaian KLT dilakukan dengan dua tujuan. Pertama, KLT dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif. Kedua, KLT dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi.
Kromatografi lapis tipis (KLT) menggunakan fase diamnya berupa lapisan tipis dan fase geraknya mengalir karena kerja kapiler. Lapisan tipis dengan ketebalan 0,1-2 mm terdiri atas bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya terbuat dari kaca, tetapi dapat pula terbuat dari pelat polimer atau logam. Lapisan melekat pada permukaan dengan bantuan bahan pengikat, biasanya kalsium sulfat atau amilum (pati). Lapisan ini biasanya berfungsi sebagai permukaan padat yang menjerap (cair-padat), walaupun dapat pula dipakai sebagai penyangga zat cair (Gritter et al. 1991).
Selanjutnya ada yang disebut juga sebagai fase gerak yaitu medium angkut dan terdiri atas satu atau beberapa pelarut. Fase gerak ini bergerak dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya kapiler. Pelarut yang digunakan adalah pelarut bertingkat mutu analitik dan bila diperlukan sistem pelarut multikomponen ini harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl 1985).
Beberapa kelebihan penggunaan KLT dalam proses fraksinasi dan pemisahan lanjut adalah waktu operasinya relatif cepat (20-40 menit), sensitif dengan limit deteksi mencapai 10-9 g, relatif dapat diaplikasikan pada sistem kromatografi kolom preparatif dengan kondisi yang relatif sama, peralatan yang diperlukan cukup sederhana dan parameter-parameter percobaan mudah divariasikan untuk mendapatkan hasil pemisahan yang maksimal (Pomeranz dan Meloan 1994)
3. METODOLOGI
3.1 Waktu dan Tempat
Penelitian dilakukan mulai dari bulan Mei sampai Desember 2007 di laboratorium Mikrobiologi Hasil Perairan dan Bioteknologi Hasil Perairan 2, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Terpadu, FKH, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan yang digunakan terdiri dari mikroalga Dunaliella sp., bakteri Gram positif, bakteri Gram negatif, serta bahan penunjang lainnya. Mikroalga Dunaliella sp. diperoleh dari Pusat Riset Oseanografi LIPI-Ancol, Jakarta Utara.
Bakteri yang digunakan adalah bakteri Gram positif yaitu Staphylococcus aureus, Bacillus cereus diperoleh dari laboratorium Mikrobiologi dan Biokimia, PAU, IPB serta bakteri Gram negatifnya adalah Escherichia coli yang diperoleh dari laboratorium Mikrobiologi dan Biokimia, PAU, IPB dan Vibrio harveyi diperoleh dari laboratorium Kesehatan Ikan, Departemen Budidaya Perairan.
Bahan lain yang digunakan adalah medium Guillard yang telah dimodifikasi, media Tryptone Soya Agar (TSA), media Mueller-Hinton Broth (MHB), media Mueller-Hinton Agar (MHA), kertas label, kapas, aluminium foil, paper disc berdiameter 6 mm, pelarut organik heksana (pro analyst), etil asetat p.a, metanol p.a, kertas saring Whatman no.42, garam fisiologis, kloramfenikol, petroleum ether, selenium, H2SO4, NaOH, asam borat, HCl.
Peralatan yang digunakan untuk kultur dan penentuan kurva pertumbuhan mikroalga Dunaliella sp. adalah erlenmeyer 1 liter, lampu TL 40 watt, aerator, selang udara, tabung reaksi, pipet tetes, mikroskop, mikropipet 10-100 µl, hemasitometer, autoklaf. Peralatan yang digunakan untuk panen dan ekstraksi Dunaliella sp. adalah sentrifuse, freeze dryer, magnetic stirrer, erlenmeyer ukuran 100 ml.
Peralatan yang digunakan untuk analisis proksimat antara lain labu kjeldahl, labu destilasi, alat FATEX-S, oven, dan desikator. Peralatan yang digunakan untuk uji aktivitas antibakteri dari Dunaliella sp. antara lain cawan
petri, tabung reaksi, gelas piala, pinset, kompor listrik, mikropipet 10-100 µl, inkubator, autoklaf, dan clean bench. Peralatan yang digunakan untuk pengujian kromatografi lapis tipis adalah aluminium yang berlapiskan silika gel. Peralatan penunjang lainnya adalah timbangan, gelas ukur, batang pengaduk, dan bunsen.
3.3 Metode Penelitian
Penelitian ini dilakukan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian utama.
3.3.1 Penelitian pendahuluan
Penelitian pendahuluan terdiri dari penentuan kurva pertumbuhan Dunaliella sp.
1) Pembuatan kurva pertumbuhan
Tahap penelitian ini bertujuan untuk menentukan kurva pertumbuhan serta umur panen dari mikroalga Dunaliella sp. dalam medium Guillard. Penghitungan jumlah sel dilakukan dengan cara kultivasi Dunaliella sp. dalam skala kecil (1000 ml). Parameter yang diamati berupa penghitungan jumlah sel dari awal kultivasi sampai akhir kultivasi (fase kematian). Penelitian ini dijadikan sebagai dasar dalam melakukan penelitian utama.
Mikroalga Dunaliella sp. ditumbuhkan dalam medium Guillard sejumlah 300 ml pada suhu kamar 27-30 oC. Medium Guillard yang digunakan pada penelitian ini dapat dilihat pada Lampiran 1. Sebelumnya air laut yang digunakan sebanyak 300 ml dalam erlenmeyer disterilisasi dengan menggunakan autoklaf pada suhu 121 oC. Dunaliella sp. sebanyak 30 ml diinokulasi ke dalam 300 ml medium cair Guillard steril secara aseptik. Selanjutnya Dunaliella sp. dikultivasi selama 7 hari pada suhu kamar, diaerasi secara terus menerus dengan aerator dan menggunakan lampu neon 40 watt sebagai sumber cahaya dengan intensitas cahaya 3000 lux serta lama penyinaran 24 jam.
Setelah dikultivasi selama 7 hari, kultur Dunaliella sp. ditingkatkan secara bertahap dan aseptik yaitu mengambil kultur Dunaliella sp. sebanyak 100 ml diinokulasi ke dalam 1000 ml medium Guillard dalam wadah erlenmeyer. Kultivasi dilakukan pada suhu kamar, diaerasi dengan aerator dan dilengkapi
lampu neon 40 watt sebagai sumber cahaya dengan intensitas cahaya 3000 lux dan penyinaran 24 jam. Proses kultivasi Dunaliella sp. dapat dilihat pada Gambar 9.
Stok Dunaliella sp.
Inokulasi 30 ml ke dalam 300 ml medium Guillard steril (kultivasi selama 7 hari, aerasi, suhu kamar, lampu neon 40 watt)
Inokulasi 100 ml ke dalam 1000 ml medium Guillard steril (aerasi, suhu kamar, lampu neon 40 watt)
Sampling
Gambar 9. Proses kultivasi Dunaliella sp. pada medium Guillard
Penghitungan jumlah sel mulai dari awal kultivasi sampai akhir kultivasi (fase kematian). Sampling dilakukan setiap hari untuk mengetahui jumlah sel Dunaliella sp.
3.3.2 Penelitian utama
Penelitian utama terbagi atas empat tahap yaitu kultivasi Dunaliella sp., ekstraksi senyawa antibakteri, uji aktivitas antibakteri, dan pengujian kromatografi lapis tipis (KLT).
Kultivasi Dunaliella sp. dilakukan pada skala besar (10 liter) yang bertujuan mendapatkan biomassa pada fase log dan fase stasioner. Ekstraksi senyawa antibakteri Dunaliella sp. dilakukan dengan pelarut secara bertingkat yang menggunakan pelarut yang berbeda. Pelarut heksana sebagai pelarut non polar, etil asetat sebagai pelarut semi polar, dan metanol sebagai pelarut polar. Pengujian aktivitas senyawa antibakteri dilakukan pada bakteri Gram positif yaitu Staphyllococcus aureus dan Bacillus cereus serta bakteri Gram negatif yaitu Escherichia coli dan Vibrio harveyi.
1) Kultivasi Dunaliella sp.
Kultivasi ini bertujuan untuk mendapatkan biomassa pada fase log dan fase stasioner. Kultivasi Dunaliella sp. dilakukan dalam 2000 ml medium Guillard steril dalam wadah toples kaca. Kultur dibuat sebanyak 5 buah dengan perlakuan yang sama seperti penelitian pendahuluan.
Penentuan umur panen dilakukan berdasarkan pola pertumbuhan yang diperoleh dari penelitian pendahuluan. Panen dilakukan pada saat kultur berada pada fase log dan fase stasioner.
Hasil dari kultivasi ini dilakukan analisis proksimat dan ekstraksi senyawa antibakteri. Analisis proksimat dilakukan pada biomassa sel Dunaliella sp. yang dipanen saat kultur berada pada fase log, meliputi analisis kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat. Ekstraksi senyawa antibakteri dilakukan pada filtrat dan biomassa sel Dunaliella sp. yang dipanen saat kultur berada pada fase log dan fase stasioner.
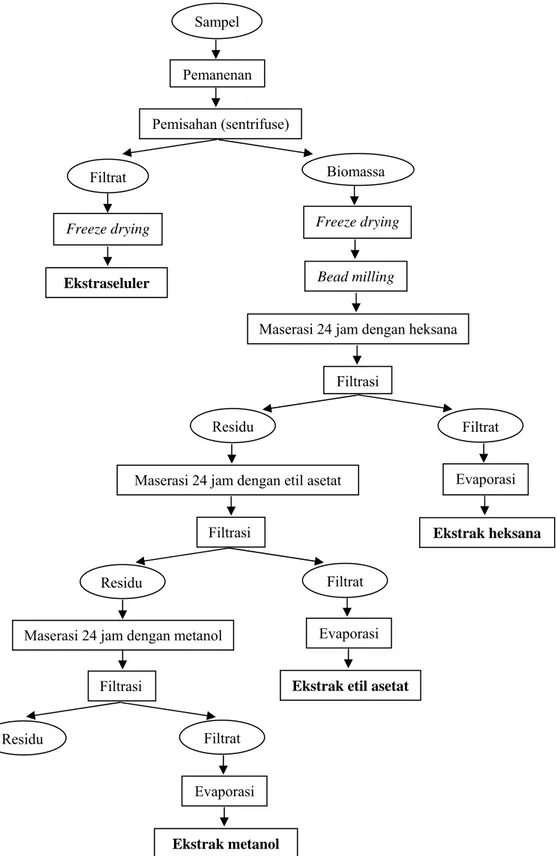
2) Ekstraksi senyawa antibakteri (Quinn 1988 dan Pratt 1945 diacu dalam Setyaningsih et al. 2000)
Proses ekstraksi dilakukan pada fase log dan fase stasioner. Ekstraksi senyawa antibakteri dari biomassa Dunaliella sp. dilakukan dengan modifikasi metode Quinn (1988) dan ekstraksi senyawa antibakteri dari filtrat dilakukan dengan modifikasi metode Pratt (1945)
Kultur Dunaliella sp. dipanen pada saat mencapai fase log dan fase stasioner yang kemudian dilakukan pemisahan filtrat dan biomassa sel dengan menggunakan sentrifuse selanjutnya filtrat (120 ml) dan biomassa dikeringbekukan. Filtrat yang telah dikeringbekukan disebut sebagai ekstraseluler. Biomassa dilakukan pemecahan sel menggunakan glass bead selama 10 menit. Selanjutnya biomassa tersebut dimasukkan dalam erlenmeyer 100 ml ditambahkan heksana dengan perbandingan 1:25 (b/v) dan ditutup dengan aluminium foil untuk dilakukan maserasi. Proses maserasi menggunakan magnetic stirrer dan kecepatan 50 rpm selama 24 jam pada suhu ruang. Setelah itu, dilakukan penyaringan dengan kertas Whatman no 24 dan filtratnya disebut sebagai filtrat ke-1.
Residu hasil penyaringan tersebut ditambahkan etil asetat untuk dilakukan maserasi kembali dengan perlakuan yang sama dengan sebelumnya dan hasil penyaringannya berupa filtrat disebut sebagai filtrat ke-2. Residu hasil penyaringan tersebut ditambahkan metanol dan dilakukan kembali maserasi dan penyaringan sehingga diperoleh filtrat yang disebut sebagai filtrat ke-3. Masing-masing filtrat tersebut dievaporasi dengan menggunakan alat rotary
evaporator vacuum (Buchi) pada suhu 35 ºC dan kecepatan 100 rpm. Hasilnya berupa ekstrak kasar intraseluler dalam heksana, etil asetat, dan metanol. Bagan ekstraksi senyawa antibakteri dapat dilihat pada Gambar 10.
Pemanenan Pemisahan (sentrifuse) Filtrat Biomassa Residu Filtrat Residu Filtrat
Freeze drying Freeze drying
Ekstraseluler Bead milling
Maserasi 24 jam dengan heksana Filtrasi
Evaporasi
Ekstrak heksana Maserasi 24 jam dengan etil asetat
Maserasi 24 jam dengan metanol Evaporasi
Filtrasi
Filtrasi Ekstrak etil asetat
Sampel
Residu Filtrat
Evaporasi Ekstrak metanol
Gambar 10. Skema ekstraksi senyawa antibakteri Dunaliella sp. (Quinn 1988 dan Pratt 1945 diacu dalam Setyaningsih et al. 2000)
3) Uji aktivitas antibakteri
Uji aktivitas senyawa antibakteri dari ekstraseluler dan ekstrak kasar intraseluler dalam pelarut heksana, etil asetat, dan metanol dilakukan pada bakteri Gram positif yaitu Staphyllococcus aureus dan Bacillus cereus serta bakteri Gram negatif yaitu Escherichia coli dan Vibrio harveyi.
4) Pengujian kromatografi lapis tipis
Kombinasi pelarut yang digunakan untuk uji kromatografi lapis tipis adalah pelarut heksana dan etil asetat dengan perbandingan 2:1 (v/v). Ekstrak dilarutkan dalam pelarutnya, kemudian ditotolkan pada plat silika gel dengan panjang 20 cm. Kemudian diletakkan dalam wadah berisi eluen tersebut, selanjutnya dibiarkan selama 20 menit sampai menghasilkan pengembangan spot. Hasil pengembangan spot tersebut diamati di bawah sinar UV dengan panjang gelombang 365 nm.
3.4 Prosedur Analisis
Analisis yang dilakukan pada penelitian ini meliputi penghitungan jumlah sel, analisis proksimat, penghitungan rendemen ekstrak, dan pengujian aktivitas senyawa antibakteri.
3.4.1 Penghitungan jumlah sel
Penghitungan jumlah sel dalam kultur dilakukan setiap hari dengan pengamatan langsung menggunakan mikroskop dan hemasitometer. Penghitungan ini dilakukan mulai dari awal kultivasi sampai mencapai fase kematian. Penghitungan jumlah sel dilakukan dengan menggunakan metode hitungan langsung (Hadioetomo 1993), yaitu :
a. Suspensi biakan Dunaliella sp. hasil pengambilan contoh dikocok, diambil sebanyak 10 µl dengan menggunakan mikropipet.
b. Suspensi tersebut diteteskan pada permukaan hemasitometer, kemudian ditutup dengan kaca penutup.
c. Hemasitometer diletakkan di atas pentas mikroskop. Jumlah sel yang terdapat dalam 80 kotak kecil berukuran 0,2 mm2 dihitung dengan perbesaran 40 x.
Penghitungan jumlah sel dilakukan sebanyak 2 kali ulangan.
Keterangan : N = kepadatan sel (sel/ml)
Σ N1 = jumlah sel dalam 80 kotak kecil (ulangan ke-1)
Σ N2 = jumlah sel dalam 80 kotak kecil (ulangan ke-2)
1 mm = panjang hemasitometer dalam 80 kotak kecil 0,2 mm = lebar hemasitometer dalam 80 kotak kecil 0,1 mm = tinggi hemasitometer
1 mm3 = faktor konversi dari satuan mm3 ke satuan ml 10-3 ml
N = ( ΣN1 + ΣN2 ) x 1 x 1 mm3
2 1 mm x 0,2 mm x 0,1 mm 10-3 ml
e. Hasil perhitungan diplotkan pada grafik sehingga diperoleh kurva pertumbuhan dimana umur (hari) sebagai sumbu x dan log kepadatan sel sebagai sumbu y.
3.4.2 Analisis proksimat
Analisis proksimat yang dilakukan pada biomassa sel Dunaliella sp. untuk mengetahui kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat.
1) Analisis kadar air (AOAC 1995)
Cawan porselen dikeringkan terlebih dahulu kira-kira 1 jam dalam oven pada suhu 105 oC, lalu didinginkan dalam desikator, kemudian ditimbang. Sampel ditimbang sebanyak 2-3 gram, dimasukkan ke dalam cawan kemudian dikeringkan dalam oven selama 4-6 jam pada suhu 105 oC. Cawan tersebut didinginkan dalam desikator, lalu ditimbang. Perhitungan kadar air dengan menggunakan rumus sebagai berikut :
Kadar air = (x – y) x 100 % z
Keterangan : z = Berat sampel (gram)
x = Berat (sampel + cawan) sebelum dikeringkan (gram) y = Berat (cawan + sampel) setelah dikeringkan (gram).
2) Analisis kadar abu (AOAC 1995)
Sampel ditimbang sebanyak 2-3 gram dan dimasukkan ke dalam cawan porselen yang telah diketahui beratnya. Setelah itu diarangkan di atas nyala pembakar sampai tidak berasap lagi lalu dimasukkan ke dalam tanur listrik dengan suhu 400-600 oC sampai pengabuan sempurna. Kemudian diangkat dan