SKRIPSI
RIRIN APRIANI PAKPAHAN 170822020
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI BUNGA TUMBUHAN KERSEN
(Muntingia calabura L)
SKRIPSI
Diajukan Untuk Melengkapi Tugas Dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
RIRIN APRIANI PAKPAHAN 170822020
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
UNIVERSITAS SUMATERA UTARA
ii
PERNYATAAN ORISININALITAS
ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI BUNGA TUMBUHAN KERSEN
(Muntingia calabura L)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2020
Ririn Apriani Pakpahan 170822020
UNIVERSITAS SUMATERA UTARA
PENGHARGAAN
Puji dan Syukur penulis panjatkan kepada Tuhan Yesus Kristus atas Berkat dan Kasih Karunia-Nya yang senantiasa menyertai sehingga penulis dapat menyelesaikan perkuliahan, penelitian, dan penulisan skripsi ini dengan judul Isolasi dan Identifiksi Golongan Senyawa Fenolik dari Bunga Tumbuhan Kersen (Muntingia calabura L) .
Ucapan terimakasih penulis sampaikan kepada Bapak Drs. Albert Pasaribu,M.Sc selaku Dosen pembimbing yang telah membimbing dan mengajar penulis selama penyusunan skripsi ini dan kepada Bapak Dr. Lamek Marpaung M.Phil yang juga telah banyak memberi arahan dan bimbingan kepada penulis selama penelitian. Terimakasih kepada Ibu Dr.Cut Fatimah Zuhra, M.Si selaku Ketua Program studi Kimia beserta Ibu Dr.Sovia Lenny, M.Si selaku sekretaris program studi Kimia FMIPA USU. Terimakasih kepada ibu Dr.Helmina Br. Sembiring,M.Si selaku Dosen dan Kepala laboratorium kimia bahan alam hayati. Terimakasih kepada Dr. Firman Sebayang M.S selaku koordinator Kimia Ekstensi dan beserta seluruh Staf, Dosen, dan Pegawai Departemen Kimia FMIPA USU.
Ucapan terima kasih secara khusus penulis sampaikan dengan segala kerendahan hati kepada Orangtua tercinta penulis, Bapak Rasman Pakpahan serta Ibu Erri Anni Hutabarat dan juga abang kakak penulis Binsar, Ika, Dosdo, Dame, Putri atas Kasih Sayang, motivasi, beserta dukungan Doa dan dana yang telah diberikan kepada penulis.
Ucapan terima kasih penulis sampaikan kepada sahabat penulis Bang Hardi, Ka Sabeth, Winda, Jiah, Wardah, beserta seluruh teman seperjuangan S1 kimia Ekstensi angkatan 2017, dan teman persekutuan di Zeal Campus Ministry yang telah mendukung penulis dalam penelitian dan penulisan skripsi.
Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi penelitian dan kemajuan ilmu pengetauhan.
Medan, Juni 2020
Ririn Apriani Pakpahan
iv
ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI BUNGA TUMBUHAN KERSEN
(Muntingia calabura L)
ABSTRAK
Isolasi dan identifikasi golongan senyawa fenolik yang terkandung di dalam bunga tumbuhan kersen (Muntingia calabura L) telah dilakukan. Bunga tumbuhan kersen sebanyak 2060 g diekstraksi maserasi dengan pelarut metanol lalu disaring kemudian dipekatkan. Ekstrak pekat metanol dilarutkan dengan etilasetat secara berulang- ulang sampai negatif terhadap FeCl3 5% lalu dipekatkan. Kemudian ekstrak etil asetat dilarutkan kembali dengan metanol dan dipartisi dengan n-heksan sampai bening. Ekstrak metanol dipisahkan dengan kromatogafi kolom dengan fase diam silika gel 40 (70-230 mesh) dan fase gerak eluen kloroform : metanol dengan perbandingan 90:10, 80:20, 70:30, 60:40 (v/v). Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis preparatif menghasilkan padatan amorf berwarna kuning sebanyak 8,03 mg dengan harga Rf = 0,27 menggunakan eluen kloroform:
etil asetat (80:20) v/v. Berdasarkan spektrum UV-Visibel dengan pelarut metanol menunjukkan panjang gelombang (λ mak) 276 nm dengan adsorbansi 0,99887.
Spektrum Inframerah (FT-IR) menunjukkan adanya gugus OH, C-H sp2 dari proton aromatis, C-H sp3 dari OCH3, C=O ester, C=C aromatis dan gugus C-O. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) menunjukkan adanya proton H-2 dan H- 6 pada cincin aromatis senyawa aromatis senyawa fenolik, dan proton dari OCH3. Berdasarkan data yang diperoleh diduga bahwa senyawa hasil isolasi yang diperoleh adanya senyawa fenolik golongan asam fenolat yaitu metil galat.
Kata Kunci : Asam Fenolat, Bunga tumbuhan kersen (Muntingia calabura L) Fenolik, Metil Galat, Isolasi.
UNIVERSITAS SUMATERA UTARA
ISOLATION AND IDENTIFICATION OF PHENOLICS COMPOUNDS FROM THE FLOWER OF KERSEN PLANT
(Muntingia calabura L)
ABSTRACT
Isolation and identification of phenolics which contained from the flower of the kersen plant (Muntingia calabura L) has been done. Flower of the kersen plant 2060 g were extracted maceration by methanol solvent. The concentrated methanol extract was dissolved with ethyl acetate repeatedly until negative to 5% FeCl3 then concentrated. Then the ethyl acetate extract was dissolved again with methanol and partitioned with n-hexane until it was clear. Methanol extract was separated by column chromatogaphy with silica gel 40 silent phase (70-230 mesh) and mobile phase chloroform : methanol in the ratio of 90:10, 80:20, 70:30, 60:40 ( v /v). The compound obtained was purified by preparative thin layer chromatography to produce 8,03 mg of amorphous yellow solid with Rf 0,27 use eluent chroloform : ethyl acetate (80:20) v/v Based on UV-Visible spectrum showed the presence of OH groups, C-H sp2 from aromatic protons, C-H sp3 from OCH3, C=O ester, C=C aromatic and C-O groups. Based on the magnetic resonance (1H-NMR) spectrum of the proton nucleus shows the presence protons H-2 and H-6 in the aromatic ring of phenolic compounds, and protons from –OCH3 From these dat, it was estimated that the compound phenolic was estimated as phenolic acid of methyl gallate.
Keywords: Phenolic Acid, Flower of the Kersen Plant (Muntingia Calabura L), Phenolic, Methyl Gallate, Isolation.
vi
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI I
PERNYATAAN ORISINALITAS Ii
PENGHARGAAN Iii
ABSTRAK Iv
ABSTRACT V
DAFTAR ISI Vi
DAFTAR TABEL Viii
DAFTAR GAMBAR Ix
DAFTAR LAMPIRAN X
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Tujuan Penelitian 2
1.4. Manfaat Penelitian 3
1.5. Metodologi Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1. Tumbuhan Kersen 4
2.2.1. Morfologi Tumbuhan Kersen 4
2.2.2. Kandungan dan Manfaat Tumbuhan Kersen 5
2.2.3. Sistematika Tumbuhan Kersen 5
2.2. Senyawa Organik Bahan Alam 6
2.3. Senyawa Fenolik 6
2.3.1. Klasifikasi Senyawa Fenolik 7
2.3.2. Manfaat Senyawa Fenolik 13
2.4. Teknik Pemisahan 14
2.4.1. Ekstraksi 15
2.4.2. Partisi 15
2.4.3. Kromatogafi 15
2.4.3.1. Kromatogafi Lapis Tipis 16 2.4.3.2. Kromatogafi Lapis Tipis Preparatif 19 2.4.3.3. Kromatogafi Kolom 19
2.5. Teknik Spektroskopi 20
2.5.1.Spektrofotometri Ultraviolet (UV-Vis) 21 2.5.2.Spektrofotometri Inframerah (FT-IR) 22 2.5.3.Spektrofotometri Resonansi Magnetik Inti
Proton(1HNMR)
23
UNIVERSITAS SUMATERA UTARA
BAB 3 METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian 25
3.2. Alat dan Bahan Penelitian 25
3.2.1. Alat Penelitian 25
3.2.2. Bahan Penelitian 26
3.3. Penyediaan Sampel 27
3.3.1 Uji Pendahuluan Terhadap Ekstrak Bunga Tumbuhan Kersen
27 3.3.2 Ekstraksi Bunga Tumbuhan Kersen 27 3.3.3 Analisis Kromatogafi Lapis Tipis 27 3.3.4 Pemisahan Senyawa Fenolik denganKromatogafi
Kolom
28
3.3.5 Pemurnian 29
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatogafi Lapis Tipis
29
3.4. Identifikasi Senyawa Hasil Isolasi 29
3.4.1. Identifikasi dengan Spektrofotometer Ultraviolet Visible (UV-Vis)
29 3.4.2. Identifikasi dengan Spektrofotometer
Inframerah (FT-IR)
30 3.4.3. Identifikasi dengan Spektrofotometer
Resonansi Magnetik Inti Proton (1H-NMR)
30
3.5. Bagan Penelitian 31
3.5.1. Bagan Skrinning Fitokimia 31
3.5.2. Bagan Isolasi Senyawa Fenolik 32
BAB 4 HASIL DAN PEMBAHASAN
4.1.Hasil Penelitian 33
4.2.Pembahasan 36
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 40
5.2. Saran 40
DAFTARPUSTAKA 41
LAMPIRAN 44
viii
DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 Panjang Gelombang UV-Visible Senyawa Hasil Isolasi 34 4.2 Hasil Analisis Spektrum FT-IR Senyawa Hasil Isolasi 35 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi 36
UNIVERSITAS SUMATERA UTARA
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Tumbuhan Kersen (Muntingia calabura L). 4
2.2 Bunga Tumbuhan Kersen 5
2.3 Struktur Senyawa Fenol 7
2.4 Stuktur Floroglukinol 8
2.5 Struktur Asam Galat 8
2.6 Struktur(a)metil galat (b)fenil galat( c)fenil galat (d)trimetil asam galat metil ester (e)etil galat
9
2.7 Struktur 2-hidroasefenon 10
2.8 Struktur (a)asam p-kumarat (b)p-koumaril aldehid (c)p-koumaril alkohol
10
2.9 Struktur Junglon 10
2.10 Struktur Xanton 11
2.11 2.12 2.13 2.14 2.15
Stuktur Stiben Struktur Flavonoida Struktur Koniferil Alkohol Struktur Hinokiflavon Struktur Tanin
11 12 12 13 13
4.1 Padatan amorf hasil isolasi 33
4.2 Spektrum UV-Visible Senyawa Hasil Isolasi 34
4.3 Spektrum Inframerah (FT-IR) Senyawa HasilIsolasi 35
4.4 Spektrum 1H-NMR Senyawa Hasil Isolasi 36
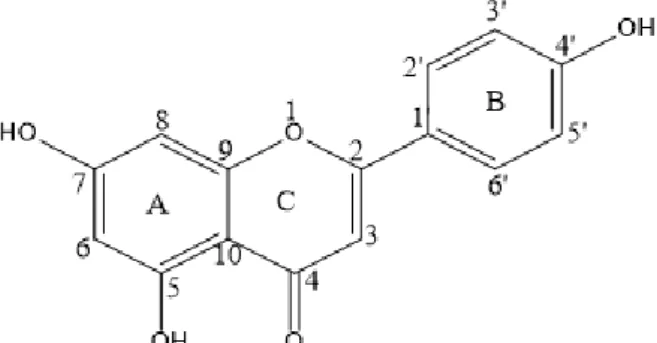
4.5 Struktur Senyawa fenolik turunan Asam Fenolat 39
x
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Hasil Determinasi Tumbuhan Kersen 45
2 Kromatogram Lapis Tipis Ekstrak Pekat Etil Asetat Tumbuhan kersen Sebelum Kromatogafi Kolom
46 3 Kromatogram Lapis Tipis ekstrak Kulit Batang
Tumbuhan Kersen Setelah Penggabungan Fraksi
47 4 Kromatogram Lapis Tipis Senyawa Murni Hasil Isolasi 48 5 Spektrum 1H-NMR Senyawa Pembanding Metil Galat 49
UNIVERSITAS SUMATERA UTARA
1.1 Latar Belakang
Indonesia merupakan salah satu negara yang kaya akan tumbuhan obat yang mengandung senyawa bioaktif dan telah digunakan secara tradisional dari generasi ke generasi untuk penyembuhan penyakit (Keller et al, 2011). Setiap tumbuhan memiliki senyawa kimia yang terkandung didalam tumbuhan. Beragam jenis dan senyawa kimia yang terkandung dalam tumbuhan akan memiliki khasiat dan manfaat. Upaya pencarian tumbuhan berkhasiat obat telah lama dilakukan, baik untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada. (Djauhariya dan Hernani, 2004).
Senyawa metabolit sekunder terbagi menjadi beberapa bagian, diantaranya adalah senyawa fenolik. Istilah fenol meliputi aneka ragam senyawa yang berasal dari tumbuhan, yang mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua subtituen hidroksil. Senyawa fenol merupakan senyawa metabolit sekunder terbesar persebarannya dalam tanaman (Cheynier et al, 2013). Saat ini sudah lebih dari 8000 struktur fenolik yang dilaporkan yang terdapat pada kingdom tumbuhan. Tumbuhan mengandung jumlah yang sangat besar variasi turunan dari fenolik, grup fenolik yang dilaporkan sangat bersangkutan bagi kesehatan manusia yaitu asam fenol, flavonoid, (flavonon, flavononon, flavonol, 3- flavonol, isolflavon, antosianin) lignan, dan stiben (Watson, 2014).
Muntingia calabura L yang dikenal dengan tumbuhan kersen atau seri merupakan tumbuhan yang mengandung senyawa metabolit sekunder yang terdiri dari memiliki buah kecil dan manis, berwarna hijau ketika masih muda dan berwarna merah setelah tua dan matang. Pohon kersen termasuk ke dalam tumbuhan liar yang rindang dan mudah berkembang biak walaupun pada suhu panas, tingginya mampu mencapai 12 meter. Pohon ini mudah dijumpai di sepanjang jalan sebagai penyerap polusi udara dan peneduh. Selain bermanfaat sebagai tumbuhan peneduh, kersen juga memiliki banyak manfaat untuk kesehatan manusia (Laswati dkk, 2017). Pohon kersen termasuk ke dalam tumbuhan jenis neotropik yaitu tumbuhan yang hidup dengan baik dengan iklim tropis seperti Indonesia. Kersen berasal dari Filipina dan menyebar ke Indonesia sekitar abad ke-19. Berdasarkan klasifikasi botani, kersen
2
termasuk ke dalam famili Malvales (Rosandari dkk, 2011). Kersen sendiri adalah spesies tunggal dari genus Muntingia. Pemanfaatan kersen sebagai bahan obat- obatan dan pangan sendiri di Indonesia masih belum optimal karena dianggap tidak memiliki nilai ekonomis dan pengetahuan yang masih kurang tentang tumbuhan ini, padahal memiliki manfaat yang sangat tinggi (Vembriarto dan Rahmad 2014). Daun kersen memiliki senyawa fitokimia yang menunjukkan aktivitas antioksidatif dan antimikroba (Haki, 2009).
Penelitian terdahulu oleh Nenden Nurhasanah (2012) melaporkan isolasi senyawa antioksidan ekstrak metanol daun kersen mengandung flavonoid minor jenis flavanon. Selanjutnya Muhammad Walid dkk (2019) melakukan isolasi dan identifikasi senyawa kimia aktif kulit batang kersen terhadap artemia salina melaporkan bahwa Identifikasi terhadap isolat fraksi 4.5.5 patut diduga merupakan senyawa metabolit sekunder dari golongan flavonoid yaitu 5- (7,8-dimetoksi-3,4- dihidro-2H-1-benzopiran-2-yl)- 2,3-dimetoksifenol, yang mempunyai potensi untuk dikembangkan sebagai obat antikanker.
Dari uraian diatas dan studi literatur yang telah dilakukan terhadap tumbuhan Kersen, maka peneliti tertarik untuk melakukan isolasi dari bunga tumbuhan Kersen dan menentukan golongan senyawa fenolik yang terdapat dalam bunga tumbuhan Kersen.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah golongan senyawa fenolik apakah yang terkandung dalam bunga tumbuhan Kersen?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menentukan golongan senyawa fenolik yang terkandung pada bunga tumbuhan Kersen.
1.4 Manfaat Penelitian
Dari Hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang golongan senyawa fenolik yang terkandung dalam bunga tumbuhan Kersen.
UNIVERSITAS SUMATERA UTARA
1.4.1 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa fenolik dilakukan terhadap bunga tumbuhan Kersen segar yang sudah dihaluskan sebanyak 2060 gram. Tahap awal dilakukan uji skrining fitokimia untuk senyawa fenolik dari ekstrak metanol dengan menggunakan pereaksi FeCl3 5%. Tahap isolasi yang dilakukan yaitu ekstraksi maserasi dilanjutkan dengan menggunakan pelarut metanol lalu dipekatkan dengan rotarievaporator dan diuapkan hingga semua pelarut metanol menguap. Ekstrak metanol yang diperoleh kemudian dilarutkan menggunakan etil asetat dipekatkan kembali dengan rotarievaporator dan diuapkan sehingga diperoleh ekstrak pekat etil asetat. Ekstrak pekat etil asetat yang diperoleh dilarutkan dengan metanol lalu dipartisi dengan n-heksan hingga bening. Lapisan metanol dipekatkan lalu dikromatografi kolom dengan fasa diam silika gel dan fasa gerak merupakan campuran pelarut kloroform : metanol dari perbandingan (90:10v/v), (80:20v/v), (70:30v/v), (60:40v/v), sehingga dihasilkan fraksi – fraksi fenolik. Fraksi-fraksi yang diperoleh dianalisi kromatografi lapis tipis. Fraksi-fraksi dengan harga Rf yang sama lalu digabungkan, diuapkan dan dimurnikan. Kemudian dianalisis dengan spektrofotometer UV-Visibel, spektrofotometer Infra Merah FT-IR, serta spektrofotometer resonansi magnetik inti proton 1H-NMR.
TINJAUAN PUSTAKA
2.1 TUMBUHAN KERSEN (Muntingia calabura L).
2.2.1 Morfologi Tumbuhan Kersen
Kersen termasuk ke dalam tumbuhan tahunan dengan tinggi mencapai 12 m (Gambar 2.1). Batang tumbuhan ini berkayu, tegak, dan bulat. Lembaran daunnya memiliki pangkal yang nyata dan tidak simetris dengan ukuran mencapai 14 cm x 4 cm (Tjitroseopomo, 2016). Daun berwarna hijau muda dengan bulu rapat di permukaan bawah daun. Batangnya dapat tumbuh hingga mencapai tinggi 12 cm, namun pada umumnya berkisar antara 1-4 m, percabangannya mendatar dan membentuk naungan yang rindang. Sedangkan bunganya berwarna putih terletak di ketiak sebelah kanan atas daun, memiliki tangkai yang panjang, mahkota bertepi rata, bentuk telur bundar, jumlah benang sarinya banyak antara 10-100 belai. Buah kersen berbentuk bulat, rasanya manis, berwarna hijau pada waktu muda dan merah setelah matang. Di beberapa negara kersen dikenal dengan beberapa nama: datiles, aratiles, manzanitas (Filipina), khoomsomz, takhob (laos), krakhop barang (Kamboja), kerup siam (Malaysia), capulin blanco, cacaniqua, niqua, iguito (Spanyol), jamaican cherry, panama berry, singapore cherry (Inggris) dan japanese kers (Belanda) (Kosasih dkk, 2013).
Gambar 2.1 Tumbuhan Kersen
UNIVERSITAS SUMATERA UTARA
Berikut merupakan gambar bunga tumbuhan kersen (Gambar 2.2)
(Gambar 2.2 Bunga Tumbuhan Kersen) 2.2.2 Kandungan Fitokima dan Pemanfaatan Kersen
Tumbuhan kersen ini mengandung begitu banyak senyawa kimia yang bermanfaat bagi kesehatan manusia (Kosasih dkk, 2013). Kersen termasuk salah satu tumbuhan obat-obatan yang diduga memiliki substansi aktif sebagai anti diabetes yaitu asam askorbat, serat, niasin dan betakaroten (Verdayanti, 2009). Daun kersen digunakan sebagai obat sakit kepala dan anti radang dikarenakan kandungan senyawa kimianya yang beragam yaitu; flavonoid, tannin, triterpenoid, saponin dan polifenol yang menunjukkan aktivitas antioksidatif dan antimikroba. Selain itu tumbuhan kersen sangat bermanfaat sebagai obat batuk, obat sakit kepala, antiimflamasi, antioksidan, antikanker, antinosiseptik, antibakteri dan kardioprotektif (Lim, 2012).
2.2.3 Sistematika Tumbuhan Kersen Kingdom : Plantae
Divisi : Spermatophyta Anak divisi : Angiospermae
Kelas : Dicotyledoneae Anak Kelas : Dialypetalae
Family : Malvales/Columniferae Ordo : Elaeocarpaceae
Genus : Muntingia
Spesies : Muntingia calabura L.
(Sari, 2012)
6
2.2 Senyawa Organik Bahan Alam
Bahan alam didefinisikan sebagai senyawa organik dengan bobot molekul antara 100 hingga 2000. Istilah bahan alam juga dapat digunakan untuk senyawa ruahan dari alam, seperti bahan tanaman mentah, bahan makanan, resin, dan eksudat tanaman (misalnya myrrh dan frankincense) atau ekstrak bahan tanaman (ekstrak air atau alkohol) (Heinrich, 2009). Kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Contoh yang dapat segera diketahui adalah pembuatan bahan makanan, perwarnaan benda, obat-obatan atau stimulan, dan sebagiannya (Sastrohamidjojo,1996). Senyawa alami secara umum adalah molekul kimia berupa mineral, metabolit primer, dan metabolit sekunder. Bahan alam dibedakan menjadi dua berdasarkan fungsi terhadap makluh hidup pembuatnya yakni metabolit primer dan metabolit sekunder yaitu:
1. Metabolit Primer
Metabolit primer pada semua organisme sama meskipun berbeda genetiknya polisakarida, protein, lemak dan asam nukleat merupakan penyusun utama mahluk hidup.
2. Metabolit Sekunder
Metabolit sekunder adalah senyawa yang disintesis oleh mahluk tumbuhan, mikrobia atau hewan melewati proses biositesis yang digunakan unruk menunjang kehidupan namun tidak vital sebagaimana gula, asam amino dan asam lemak.
Metabolit ini memiliki aktifitas farmakologi dan biologi. Dibidang farmasi secara khusus, metabolit sekunder digunakan dan dipelajari sebagai bahan obat (Saifudin, 2014)
2.3 Senyawa Fenolik
Senyawa fenolik adalah senyawa yang mempunyai satu atau lebih gugus hidroksil pada cincin aromatiknya. Senyawa fenolik merupakan metabolit sekunder yang paling banyak didistribusikan dan secara universal terdapat dalam kingdom tumbuhan. Lebih dari 8000 jenis fenolik yang berbeda telah diidentifikasi (Nollet dan Gutierrez, 2018 ).
UNIVERSITAS SUMATERA UTARA
Senyawa fenolik secara umum memiliki potensi sebabagi bakterisidal, antiseptik, antioksidan, dan sebagainya (Pangelly, 2006). Senyawa ini dapat digolongkan sebagai antioksidan karena senyawa ini berkemampuan untuk membersihkan spesies oksigen dan nitrogen reaktif (Firdaus dkk, 2013).
Gambar 2.3 Struktur Senyawa Fenol
Fenolik memiliki banyak kemiripan dengan alkohol alifatik dimana kelompok hidroksil terikat pada rantai karbon. Gugus hidroksil pada fenolik dipengaruhi oleh cincin aromatiknya dimana hidrogen pada fenolik bersifat labil menyebabkan fenol bersifat asam lemah. Senyawa fenolik dapat dikarakterisasi dari tanaman dan biasanya ditemukan dalam bentuk ester dan glikosida bukan sebagai senyawa bebas (Vermerris et al., 2006).
2.3.1. Klasifikasi Senyawa Fenolik 1. C6: Fenolik Sederhana
Secara umum senyawa fenolik mempunyai sifat sebagai bakterisidal, antiseptik, dan antihelmintik (Pengelly, 2006). Senyawa dari gugus ini merupakan hasil substitusi dari gugus fenol, dimana substituennya dapat berupa substitusi dalam posisi orto, meta atau para. Contoh asam fenolik sederhana adalah Floroglukinol (Gambar 2.4) (Vermerris et al, 2006).
Gambar 2.4 Struktur Floroglukinol 2. C6-C1 : Asam Fenolat
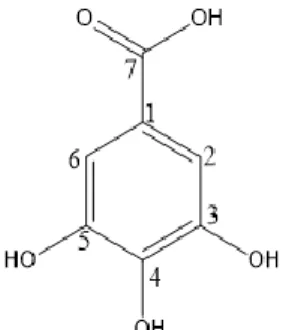
Senyawa fenolik dari golongan asam fenolat adalah fenol yang tersubstitusi oleh gugus karboksil. Contohnya adalah asam galat (Gambar 2.5) yang merupakan
8
trifenol yang biasa terdapat dalam daun teh dalam bentuk teresterifikasi bersama katekin ( Vermerris et al, 2006 ).
Gambar 2.5 Struktur Asam Galat 2.1 Asam Galat
Asam galat atau nama lain 3,4,5-trihidroxyi benzoic acid merupakan salah satu seyawa fenol yang memiliki aktifitas antijamur, antivirus dan antioksidan (Sohi et al, 2003). Asam galat merupakan salah satu senyawa aktif yang banyak dimanfaatkan dibidang medis. Senyawa ini terdapat sebagai metabolit sekunder pada tanaman (Vazirian et al., 2011). Salah satu antioksidan alami yaitu asam galat. Asam galat termasuk dalam senyawa fenolik dan memiliki aktivitas antioksidan yang kuat.
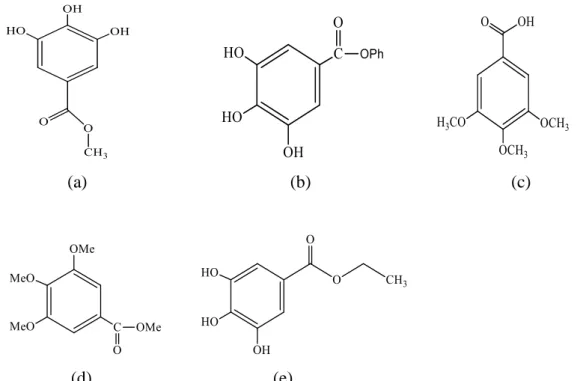
Estimasi kandungan fenolik total dapat dilakukan dengan menggunakan pereaksi Folin-Ciocalteau. Metode ini berdasarkan kekuatan mereduksi dari gugus hidroksi fenolik. Semua senyawa fenolik termasuk fenol sederhana dapat bereaksi dengan reagen Folin-Ciocalteau. Kandungan fenolik total dalam tumbuhan dinyatakan dalam GAE (gallic acid equivalent) yaitu jumlah kesetaraan miligram asam galat dalam 1 gram sampel (Huang, dkk 2005). Asam galat dan sejenisnya umumnya hadir dalam berbagai buah dan jumlah tanaman, selain itu sejumlah besar turunan asam galat yang disintesis juga tersedia. Berikut struktur dari beberapa turunan asam galat.
(Nayeem et al, 2016) :
UNIVERSITAS SUMATERA UTARA
(a) (b) (c)
(d) (e)
Gambar 2.6 Struktur (a) Metil Galat, (b) Fenil Galat , (c) 3,4,5 Triaseton Asam Galat, (d) Trimetil Asam Galat Metil Ester, (e) Etil Galat
3. C6-C2 : Asetofenon dan Asam Fenilasetat
Asetofenon dan asam Fenilasetat jarang ditemukan dialam. Asetofenon dikenal dengan adanya gugus karboksil, berbeda dengan asam fenolat dimana gugus karboksil dari asetofenon tidak berikatan langsung dengan cincin aromatiknya ( Vermerris et al, 2006 ).
Gambar 2.7 Struktur 2-hidroasetofenon
4. C6-C3 : Asam Sinamat, sinamil aldehid, dan sinamil alkohol
Keberadaan senyawa fenolik ini berlimpah di tanaman. Asam sinamat memiliki ciri-ciri dengan rangka cincin benzen terikat pada atom yang terikat dengan gugus karboksil. Sinamil aldehid dan sinamil alkohol memiliki struktur yang sama dengan asam sinamat namun gugus karboksil diganti dengan gugus aldehid dan
10
hidroksil. Contoh asam sinamat, sinamil aldehid, sinamil alkohol berturut-turut seperti pada (gambar 2.8)
Gambar 2.8 (a) Struktur Asam p-kumarat; (b) Struktur p-koumaril Aldehid;
(c) Struktur p-koumaril Alkohol 5. C6-C4 : Naptakoinon
Naftokuinon adalah senyawa fenolik yang tersebar luas pada tanaman, jamur, dan bakteri. Naftokuinon di biosintesis melalui jalur asetat dan mevalonate yang dipadukan dengan jalur sikimat. Beberapa contoh naftokuinon adalah plumbagin, lawson,dan alkanin ( Nollet, 2015 ).
Gambar 2.9 Struktur Junglon 6. C6-C1-C6 : Xanton
Xanton adalah senyawa metabolit sekunder yang terdapat dalam tanaman, jamur, dan lumut. Kerangka dasar dari xanton C6-C1-C6 yang mengandung dua buah cincin aromatik yang terikat oleh atom O ( Nollet, 2015 ). Xanton yang ditemukan di tanaman Garcinia dulcis diketahui memiliki kemampuan menghampar pertumbuhan Palmadium falciparum. Dua jenis benzofenon yaitu guttiferon dan gambogenon memiliki sifat sitotoksi pada kanker usus (Vermerris et al 2006).
UNIVERSITAS SUMATERA UTARA
Gambar 2.10 Struktur Xanton
7. C6-C2-C6 : Stilben dan Antrakuinon
Stilben dan Antrakuinon merupakan senyawa fenolik dengan kerangka dasar C6-C2-C6 dengan dua buah cincin aromatik yang terhubung oleh jembatan etilen (Nollet, 2015). Stilben merupakan senyawa yang memiliki aktivitas antifungal (Vermerris et al, 2006)
Gambar 2.11 Stuktur Stilben
8. C6-C3-C6 : Flavonoid dan Isoflavonoid
Senyawa flavonoid adalah suatu kelompok senyawa fenol yang terbesar yang ditemukan di alam. Flavonoid mempunyai kerangka dasar karbon yang terdiri dari 15 atom karbon, dimana 2 cincin benzene (C6) terikat pada suatu rantai propane (C3) sehingga bentuk susunan Co C-C6 senyawa-senyawa flavonoid terdiri dari beberapa jenis tergantung pada tingkat oksidasi dari rantai propane dari sistem 1,3- diarilpropana. Enam jenis flavonoid utama, yaitu: anthocyanidins, flavanols, flavanones, flavones. flavonols dan isoflavons. (Khoddami, A. 2006)
12
Gambar 2.12 Struktur Flavonoida
9. (C6-C3)2 : Lignan dan Neolignan
Lignan merupakan dimer atau oligomer dari monolignol. Istilah lignan dan neolignan dibedakan berdasarkan posisi ikatan monolignol dengan monolignol lainnya. Berbeda dengan lignin dan neolignan, lignin merupakan polimer dari monolignol. Berikut gambar dari struktur koniferil alkohol. (Markham, 1988) :
Gambar 2.13 Struktur Koniferil Alkohol
10. (C6-C3-C6)2 : Bioflavonoid
Merupakan senyawa fenolik yang memiliki rangka yang disusun atas 30 atom karbon dan merupakan dimer dari flavon. Flavon merupakan salah satu anggota dari flavonoid (Vermerris et al, 2006)
UNIVERSITAS SUMATERA UTARA
Gambar 2.14 Struktur Hinokiflavon
11. Tanin
Tanin merupakan senyawa aktif metabolit sekunder yang diketahui mempunyai beberapa khasiat yaitu sebagai astringen, anti diare, anti bakteri dan antioksidan. Tanin merupakan komponen zat organik yang sangat kompleks, terdiri dari senyawa fenolik yang sukar dipisahkan dan sukar mengkristal, mengendapkan protein dari larutannya dan bersenyawa dengan protein tersebut (Desmiaty et al, 2008).
Gambar 2.15 Struktur Tanin 2.3.2. Manfaat Senyawa Fenolik
Senyawa fenol merupakan kelas utama antioksidan yang berada dalam tumbuh-tumbuhan .Kandungan senyawa fenolik banyak diketahui sebagai terminator radikal bebas dan pada umumnya kandungan senyawa fenolik berkolerasi positif
14
terhadap aktivitas antiradikal (Marinova et al, 2011). Fenol berperan sebagai scavenger (pemakan) radikal peroksil karena fenol memiliki struktur molekul penting yaitu cincin aromatik dan gugus hidroksil yang mengandung hidrogen yang dapat berpindah. Selain itu, kemampuan fenol juga diketahui dapat mengurangi radikal bebas melalui pembentukan khelat dengan ion-ion yang bervalensi dua seperti logam Cu, Fe, Zn, dan Mn yang menyebabkan terjadinya peroksidasi lipid. Antioksidan fenolik (ArOH) berperan dalam memutus reaksi inisiasi radikal bebas oleh transfer atom hidrogen atau oleh transfer elektron dengan cara membentuk kation radikal fenoksil (Ar OH') yang secara cepat dan reversibel mengalami deprotonasi dan membentuk radikal fenoksil (ArO'). Suatu radikal fenoksil dapat bergabung dengan radikal peroksil (ROO) membentuk produk yang non- radikal. (Khoddami, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenol yang dapat berupa golongan flavonoida,turunan asam sinamat, kumarin tokofenol dan asam-asam organik polifungsional. Senyawa antioksidan alami polifenolik ini bersifat multifungsional karena dapat bereaksi sebagai penangkap radikal bebas, pengkelat logam dan perendam terbentuknya singlet oksigen (Trilaksani, 2003)
2.4 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen- komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995)
2.4.1. Ekstraksi
Ekstraksi merupakan salah satu teknik pemisahan kimia untuk memisahkan atau menarik satu atau lebih komponen atau senyawa-senyawa dari suatu sampel
UNIVERSITAS SUMATERA UTARA
dengan menggunakan pelarut tertentu yang sesuai (Leba, 2017). Beberapa metode ekstraksi dapat digunakan untuk mengekstrak atau konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi, perkolasi, ekstaraksi sokletasi, ekstraksi dengan refluks, dan didestilasi uap dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut.
(Sarker, 2006) Terdapat juga metode ekstraksi sederhana yakni ekstraksi dingin.
Ekstaksi dingin dilakukan dengan cara merendam sampel dengan pelarut yang sesuai dalam suhu kamar. Keuntungan cara ini merupakan metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan alam menjadi terurai (Heinrich et al, 2010).
2.4.2. Partisi
Ekstraksi cair-cair atau disebut juga ekstraksi pelarut merupakan metode yang didasarkan pada fenomena distribusi atau partisi berdasarkan analit dari dua pelarut yang tidak saling bercampur. Ekstraksi ini dilakukan untuk mendapatkan suatu senyawa dari campuran berfasa cair dengan pelarut lain yang juga merupakan perbedaan kelarutan suatu senyawa dalam dua pelarut cair. Ekstraksi cair-cair ditentukan oleh distribusi Nernst yang Hukum Distribusi Nernst menyatakan pada suhu dan tekanan yang konstan, komposisi-komposisi akan terdistribusi dalam proporsi yang sesuai dengan dua pelarut yang tidak saling bercampur. Pada ekstrasi cair-cair alat yang digunakan adalah corong pisah. Corong pisah adalah yang digunakan untuk memisahkan komponen-komponen dalam campuran antara fasa pelarut dengan densitas atau massa jenis yang berbeda yang tidak saling dicampur.
(Leba, 2017)
2.4.3. Kromatografi
Kromatogafi adalah suatu metode fisik untuk pemisahan yang didasarkan atas perbedaan afinitas senyawa-senyawa yang sedang dianalisis terhadap dua fasa yaitu fasa stasioner/fasa diam dan fasa mobil/fasa gerak. Jadi, campuran senyawa-senyawa dapat mengalami adsorpsi dan desorpsi oleh fasa dalam secara berturut-turut sehingga secara berurutan fasa gerak juga akan melarutkan senyawa-senyawa tersebut dan proses pemisahan dapat terjadi karena campuran senyawa memiliki
16
kelarutan yang berbeda di antara dua fasa tersebut. Fasa diam yang digunakan dalam kromatogafi dapat berupa zat padat juga berupa zat cair. Silika dan alumina merupakan contoh zat padat yang sering digunakan sebagai fasa diam berkat kemampuannya dalam mengadsorpsi bahan-bahan yang akan dipisahkan (sebagai adsorben). (Endarini, 2016)
Kromatogafi didefiniskan sebagai prosedur pemisahan zat terlarut oleh suatu proses migasi diferensial dinamis dalam sistem yang terdiri atas dua fase atau lebih.
Salah satu fase bergerak secara bersinambungan dalam arah tertentu dan didalamnya, zat-zat terlarut menunjukkan perbedaan mobilitas yang disebabkan oleh perbedaan adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion (Harmita, 2009).
2.4.3.1. Kromatografi Lapis Tipis
Kromatogafi lapis tipis (KLT) merupakan salah satu metode yang paling banyak digunakan dan paling mudah untuk memurnikan sejumlah kecil komponen.
Metode ini menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan penyerap (misalnya silika gel) dengan ketebalan tertentu tergantung pada jumlah bahan yang akan dimuat ke dalam lempeng analisis biasanya memiliki ketebalan 0,2 mm; lempeng preparatif dapat memiliki ketebalan hingga 1-2 cm (Heinrich et al, 2010).
Fenomena yang terjadi pada KLT adalah berdasar pada prinsip adsorpsi.
Setelah sampel ditotolkan di atas fasa diam, senyawa-senyawa dalam sampel akan terelusi dengan kecepatan yang sangat bergantung pada sifat senyawa-senyawa tersebut (kemampuan terikat pada fasa diam dan kemampuan larut dalam fasa gerak), sifat fasa diam (kekuatan elektrostatis yang menarik senyawa di atas fasa diam) dan sifat fasa gerak (kemampuan melarutkan senyawa). Pada KLT, secara umum senyawa-senyawa yang memiliki kepolaran rendah akan terelusi lebih cepat daripada senyawa-senyawa yang memiliki kepolaran rendah akan terelusi lebih cepat daripada senyawa-senyawa polar karena senyawa polar terikat lebih kuat pada bahan silika yang mengandung silanol (SiOH2) yang pada dasarnya memiliki afinitas yang kuat terhadap senyawa polar. (Endarini, 2016)
UNIVERSITAS SUMATERA UTARA
Dalam pembuatan lapisan tipis digunkan plat-plat kaca yang memiliki ukuran 20 x 5 cm atau 20 x 20 cm, dan ukuran ini dianggap “standart”. Plat ini dicuci terlebih dahulu dengan air dan detergen kemudian dikeringkan dengan aseton.
Selanjutnya membuat penyerap menjadi bubur dengan air, biasanya dalam perbandingan x g penyerap dan 2x ml air. Bubur diaduk dengan baik dan dibentangkan di atas plat kaca dengan berbagai cara. Tebal “standart” adalah 250 mikron. Lapisan-lapisan yang lebih tebal (0,5 – 2,0 mm) digunakan untuk pemisahan-pemisahan yang sifatnya besar, dengan menggunakan penyerap hingga 250 mg untuk plat dengan ukuran 20 x 20 cm. Salah satu keukaran dengan lapisan tebal ialah adanya tendensi mengelupas bila kering (Sastrohamidjojo, 1985).
Beberapa contoh penyerap yang digunakan untuk pemisahan dalam kromatogafi lapis tipis adalah sebagai berikut :
1. Silika gel
Ada beberapa jenis silika gel, yaitu : a. Silika gel G
Silika gel G adalah silika gel yang mengandung 13 % kalsium sulfat sebagai perekat. Jenis silika gel ini biasanya mengandung ion logam, terutama ion besi.
Kandungan ion besi dapat dihilangkan dengan mengembangkan plat TLC silika gel G dengan sstem pelarut metanol : asam HCl pekat 9 : 1.
b. Silika gel H
Perbedaan silika gel G dan silika gel H ialah, bahwa silika gel H tidak menngandung perekat kalsium sulfat. Silika gel H dipakai untuk pemisahan yang bersifat spesifik, terutama lipida netral
c. Silika gel PF
Jenis silika gel ini diketemukan belakangan, yang dibuat sedemikian rupa sehingga senyawa-senyawa organik terikat pada plat ini dapat mengadakan fluoresensi. Oleh karena itu visualisasinya dapat dikerjakan dengan menempatkan plat yang telah dikembangkan di dalam ruangan gelap atau dengan sinar ultra violet yang bergelombang pendek.
2. Alumina
Penggunaan alumina dalam TLC, yang semula diperkenalkan oleh peneliti dari Cekoslowakia, tidak sesering silika gel. Sebenarnya alumina netral mempunyai
18
kemampuan untuk memisahkan bermacam-macam senyawa, seperti terpena, alkaloid, steroid, dan senyawa-senyawa alisklik, alifatik, serta aromatik. Sebagai zat perekat alumina tidak mengandung zat perekat, mempunyai sifat alkalis dan dapat digunakan baik tanpa maupun dengan aktivasi.
3. Kieselguhr
Kieselguhr merupakan adsorben yang lebih lemah dari silika gel dan alumina, oleh karena itu lebih cocok untuk memisahkan senyawa-senyawa polar (Adnan, 1997). Nilai utama KLT pada penelitian ialah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit.
Menurut Markham, KLT memiliki peranan penting dalam metode pemisahan dan isolasi yaitu :
a. Mencari pelarut untuk kromatogafi kolom
b. Analisis fraksi yang diperoleh dari kromatogafi kolom
c. Menyigi arah atau perkembangan reaksi seperti hidrolisis atau metilasi d. Identifikasi flavonoida secara ko-kromatogafi
e. Isolasi flavonoida murni skala kecil.
Mengidentifikasi noda-noda dalam lapisan tipis lazim menggunakan harga Rf yang diidentifikasikan sebagai perbandingan antara jarak perambatan suatu zat dengan jarak perambatan pelarut yang dihitung dari titik penotolan pelarut zat. Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembimbing.
Rumus:
Rf = 𝐽𝑎𝑟𝑎𝑘𝑦𝑎𝑛𝑔𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ𝑠𝑜𝑙𝑢𝑡 𝐽𝑎𝑟𝑎𝑘𝑦𝑎𝑛𝑔𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ𝐹𝑎𝑠𝑒𝑔𝑒𝑟𝑎𝑘
Beberapa banyak diantaranya faktor yang mempengaruhi harga Rf adalah:
1. Struktur senyawa yang dipisahkan
2. Sifat dari adsorben dan derajat aktivitasnya 3. Tebal dan kerataan permukaan adsorben 4. Kemurnian pelarut
5. Derajat kejenuhan uap pelarut dalam bejana pengembangan 8. Jumlah cuplikan
9. Temperatur (Rubiyanto, 2017)
UNIVERSITAS SUMATERA UTARA
2.4.3.2. Kromatografi Lapis Tipis Preparatif
KLTP merupakan salah satu metode pemisahan yang memerlukan pembiayaan paling murah dan memakai peralatan paling dasar. Walaupun KLTP dapat memisahkan bahan dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah milligram. Ketebalan plat yang sering dipakai adalah 0,5-2 mm.
ukuran plat biasanya 20 x 20 cm atau 20 x 40 cm. Untuk jumlah sampel 10-100 mg, dapat dipisahkan menggunakan KLTP dengan adsorben silika gel atau aluminium oksida dengan ukuran 20 x 20 cm dan tebal 1 mm. jika tebalnya diduakalikan, maka banyaknya sampel yang dapat dipisahkan bertambah 50%. Seperti halnya KLT biasa, adsorben yang paling umum pada KLTP adalah silika gel. (Endarini, 2016)
Sebelum ditotolkan pada plat KLT Preparatif, sampel dilarutkan terlebih dahulu dalam sedikit pelarut. Pelarut yang baik adalah pelarut yang mudah menguap, misalnya n-heksana, diklorometana atu etil asetat. Karena jika pelarut yang digunakan tidak mudah menguap, maka akan terjadi pelebaran pita. Konsentrasi sampel juga sebaiknya hanya 5-10%. Sampel yang ditotolkan harus berbentuk pita yang sesempit mungkin karena baik tidaknya pemisahan juga bergantung pada lebarnya pita (Rohman, 2007).
2.4.3.3. Kromatografi Kolom
Kromatogafi kolom adalah suatu teknik pemisahan yang didasarkan pada peristiwa adsorpsi. Sampel yang biasanya berupa larutan pekat diletakkan pada ujung atas kolom. Eluen atau pelarut dialirkan secara kontinu ke dalam kolom. Dengan adanya gravitasi atau karena bantuan tekanan, maka eluen/pelarut akan melewati kolom dan proses pemisahan akan terjadi. Seperti pada umumya, eluen/pelarut akan digunakan dimulai dari yang paling non polar dan dinaikkan secara gadien kepolarannya hingga pemisahan dapat terjadi. (Endarini, 2016) Kromatogafi kolom merupakan peralatan yang sangat penting dalam pemisahan flavonoida. Adapun fase diam yang pada umumnya digunakan dalam kromatogafi kolom yaitu silica gel, sephadex, polyamida dan selulosa dimana fase gerak yang biasa digunakan yaitu campuran antara pelarut organik polar dan pelarut oganik nonpolar dengan menggunakan metode elusi gadient (Bhat, 2005).
20
Untuk dapat diperoleh pemisahan yang sempurna perlu dilakukan pemisahan fasa diam dan fasa gerak secara tepat dan sesuai. Faktor yang menjadi ukuran pemilihan terhadap kedua fase tersebut antara lain polaritas dan kelarutan.
Teknik Kromatografinya:
1. Dibuat bubur adsorben yang berasal dari padatan yang telah kita pilih.
2. Bubur adsorben dituangkan kedalam kolom gelas ukuran tinggi ± 40 cm dan diameter ± 2 cm yang dibagian ujung bawahnya dilengkapi dengan kran, secara hati-hati. Bagian bawah ditahan dengan glass wool atau sejenisnya untuk menghindari lolosnya adsorben dari dalam kolom.
3. Dijaga jangan sampai terjadi gelembung udara pada bagian dalam kolom.
Hasil akhir penuangan bubur adsirben berbentuk padat tanpa retakan.
4. Padatan kolom yang terbentuk dijaga supaya tetap basah oleh pelarut dengan menuangkan pelarut dengan hati-hati dan terhindar dari kekeringan permukaan.
5. Bila akan digunakan pelarut yang berbeda sebagai fase gerak maka kolom harus diuci terlebih dahulu dengan pelarut yang dimaksud dengan cara mengalirkan secara berulang-ulang pelarut tersebut kedalam kolom serta didiamkan beberapa saat sebagai langkah aktivasi kolom
6. Pada saat penuangan cuplikan dilakukan melalui bagian tepi tabung kolom secara perlahan-lahan, tidak langsung ke permukaan padatan karena dapat merusak permukaan padatan
7. Laju alir fase gerak diatur dengan menentukan kecepatan penetesan cairan setiap satuan waktu. Fraksi yang ditampung diharapkan akan bervolume sama dalam selang waktu tertentu (Rubiyanto, 2017)
2.5 Teknik Spektroskopi
Spektroskopi adalah alat analisis yang menggunakan radiasi (sinar) sebagai sumber energi. Spektroskopi digunakan untuk menganalisis senyawa organik secara kualitatif, kuantitatif dan yang paling penting adalah pelacakan atau elusidasi struktur (Sitorus, 2009).
UNIVERSITAS SUMATERA UTARA
2.5.1. Spektroskopi Ultraviolet (UV-Vis)
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer .
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau deuterium untuk pengukuran uv dan lampu tungsten untuk pengukuran pada cahaya tampak.
Panjang gelombang dari sumber cahaya akan dibagi oleh pemisah panjang gelombang (wavelength separator) seperti prisma atau monokromator. Spektrum didapatkan dengan cara scanning oleh wavelength separator sedangkan pengukuran kuantitatif bisa dibuat dari spektrum atau pada panjang gelombang tertentu. Ketika suatu atom atau molekul menyerap cahaya maka energi tersebut akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Tipe eksitasi tergantung pada panjang gelombang cahaya yang diserap. Sinar ultraviolet dan sinar tampak akan menyebabkan elektron tereksitasi ke orbital yang lebih tinggi.
Sistem yang bertanggung jawab terhadap absorbsi cahaya disebut dengan kromofor.
Beberapa istilah penting :
1. Kromofor; merupakan gugus tak jenuh (pada ikatan kovalen) yang bertanggung jawab terhadap terjadinyaabsorbsi elektronik (misalnya C=C, C=O, dan NO2).
2. Auksokrom; merupakan gugus jenuh dengan adanya elektron bebas (tidak terikat), dimana jika gugus ini bergabung dengan kromofor, akan mempengaruhi panjang gelombang dan intensitas absorban.
3. Pergeseran Batokromik; merupakan pergeseran absorban ke daerah panjang gelombang yang lebih panjang karena adanya substitusi atau efek pelarut.
22
4. Pergeseran Hipsokromik; merupakan pergeseran absorban ke daerah panjang gelombang yang lebih pendek karena adanya substitusi atau efek pelarut.
5. Efek Hiperkromik; merupakan peningkatan intensitas absorban.
6. Efek Hipokromik; merupakan penurunan intensitas absorban. (Dachriyanus, 2004)
2.5.2. Spektroskopi Infra Merah (FT-IR)
Spektrofotometer inframerah pada umumnya digunakan untuk menentukan gugus fungsi suatu senyawa organik dan mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya. Jika suatu frekuensi tertentu dari radiasi inframerah dilewatkan pada sampel suatu senyawa organik maka akan terjadi penyerapan frekuensi oleh senyawa tersebut. Detektor yang ditempatkan pada sisi lain dari senyawa akan mendeteksi frekuensi yang dilewatkan pada sampel yang tidak diserap oleh senyawa. Banyaknya frekuensi yang melewati senyawa (yang tidak diserap) akan diukur sebagai persen transmitan. (Dachriyanus, 2004).
Spektrum infra merah merupakan plot antara transmitans dengan frekuensi atau bilangan gelombang. Spektrum ini juga menunjukkan banyaknya puncak absorpsi (pita) pada frekuensi atau bilangan gelombang yang karakteristik. Daerah bilangan gelombang yang sering digunakan pada spektrum infra merah berkisar antara 4000-670 cm-1(2,5-15 µm). (Swarya, 2015)
Faktor-faktor yang berpengaruh pada frekuensi vibrasi adalah sebagai berikut:
1. PenggandenganVibrasi Ikatan-ikatan C-H pada gugus metilen saling mengalami penggandengan
sehingga mempunyai dua pita vibrasi ulur, yaitu simetris dan asimetris.
Frekuensi kedua pita ini berbeda.
2. Ikatan hidrogen
Ikatan hidrogen pada gugus karbonil akan memperpanjang ikatan C=O, misalnya dalam asam salisilat. Akibatnya, kekuatan ikatan C=O berkurang sehingga pita vibrasi muncul pada frekuensi yang lebih rendah.
3. Efek induksi
Unsur yang bersifat elektronegatif cenderung menarik elektron ke antara atom karbon dan oksigen dalam ikatan C=O sehingga ikatan tersebut menjadi lebih
UNIVERSITAS SUMATERA UTARA
kuat. Akibatnya, pita vibrasi ikatan C=O muncul pada frekuensi yang lebih tinggi.
4. Efek resonansi
Adanya ikatan C=C yang bertetangga dengan gugus karbonil menyebabkan terjadinya delokalisasi elektron pada ikatan C=O dan ikatan rangkap.
Akibatnya, ikatan C=O akan lebih bersifat sebagai ikatan tunggal dan kekuatan ikatannya melemah sehingga pita vibrasi akan muncul pada frekuensi yang lebih rendah.
5. Sudut ikatan
Cicin berkeanggotaan enam yang memilki gugus karbonil tidak begitu tegang sehingga pita vibrasi ikatan C=O muncul seperti ikatan C=O dalam keton normal.
6. Efek medan
Keberadaan dua gugus dalam satu molekul sering kali saling mempengaruhi frekuensi vibrasi masing-masing gugus tersebut karena terjadi interaksi ruang, yang dapat bersifat elektrostatik dan atau sterik (Harmita, 2009).
2.5.3. Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometer resonansi magnetik inti (Nuclear Magnetic Resonance), yang disingkat sebagai NMR, merupakan instrumen yang sangat panting untuk memperoleh informasi senyawa kimia, juga dapat menyelesaikan dan memecahkan masalah atau informasi yang sebelumnya sulit untuk diperoleh. NMR mempunyai peranan panting dalam ilmu kimia, disebabkan oleh dua faktor.Pertama, penerapan NMR yang terbaru dimana hasil peningkatan selama beberapa tahun terakhir. Kedua, spektrometer NMR merupakan instrumen yang tersedia di pasaran berkembang terus, dan memenuhi standar sensitivitas, fleksibilitas, efsiensi, kecanggihan komputasi, dan harga yang sesuai dipasaran (Jenie, 2014).
Fenomena 1H-NMR terjadi jika inti yang searah dengan medan magnet eksternal dibuat mengabsorpsi energi (berupa radiasi elektromagnetik) sehingga orientasi spinnya berubah. Dalam suatu molekul, tiap proton berada dalam lingkungan kimia yang sedikit berbeda. Akibatnya, proton-proton itu mempunyai perisai elektronik yang tingkatnya atau jumlahnya sedikit berdeda. Dengan demikian,
24
proton-proton tersebut akan beresonansi pada frekuensi yang sedikit berbeda. Harga freakuensi absolut masing-masing proton yang berbeda sangat sulit diukur hingga presisi yang sedemikian kecil. Dalam 1H-NMR, yang diukur adalah perbedaan antara frekuensi resonansi suatu jenis proton dan frekuensi resonansi proton senyawa pembanding (Harmita, 2009).
Inti atom-atom tertentu akan mempunyai spin, yang berputar dan menghasilkan momen magnetik sepanjang aksis spin. Jika inti yang berputar ini diletakkan didalam medan magnet, maka sesuai dengan kalkulasi kuantum mekanik, momen magnetiknya akan searah (paralel; mempunyai energi yang rendah) atau berlawanan arah (antiparalel, mempunyai energi yang tinggi) dengan arah medan magnet yang diberikan. Spektrometer resonansi magnet inti proton pada umumnya digunakan untuk mentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu senyawa organik dan mengetahui informasi mengenai struktur suatu senyawa organik (Dachriyanus, 2004).
UNIVERSITAS SUMATERA UTARA
3.1 Waktu dan Tempat Penelitian
Sampel yang diteliti adalah bunga tumbuhan kersen diperoleh dari daerah Padang Bulan, Sumatera Utara. Kemudian diidentifikasi sampel dilakukan di Laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara (lampiran 1). Isolasi senyawa fenolik dilakukan pada bulan September sampai Januari 2020 di Laboratorium Kimia Organik Bahan Alam dan Laboratorium Pascasarjana FMIPA USU. Identifikasi senyawa hasil isolasi yang meliputi analisa spektrofotometer UV-Vis, FT-IR dan Spektrofotometer 1H-NMR dilakukan di Laboratorium Kimia Bahan Alam FMIPA ITB.
3.2.1 Alat dan Bahan Penelitian 3.2.2 Alat Penelitian
Nama Alat Ukuran Merk
1. Spektroskopi 1H-NMR 500MHZ Jeol/Delta2NMR
2. Spektrofotometer FT-IR Shimadzu
3. Spektrofotometer UV-Vis Shimadzu
4. Lampu UV 254nm/ 356nm UVGL 58
5. Rotarievapotaror Bűchi R-114
6. Labu Rotarievaporator 1000 mL Schoot/ Duran
7. Kolom Kromatogafi Pyrex
8. Neraca Analitis Mettler AE 200
9. Alat Destilasi
10. Corong Pisah 1000 mL Pyrex
11. Chamber
12. Beaker glass 500ml/1000ml Pyrex
13. Erlenmeyer 250ml Pyrex
14. Gelas Ukur 100ml Pyrex
15. Corong Kaca 16. Pipet Tetes
26
17. Spatula
18. Batang Pengaduk 19. Statif dan Klem 20. Penangas Air
21. Pipa Kapiler 75 mm Nesco
22. Botol Vial 12 mL
23. Pipet Tetes
3.2.2 Bahan Penelitian
Nama Bahan Ukuran Merek
1. Bunga Tumbuhan Kersen 2060 g
2. Metanol Teknis
3. Etil Asetat Teknis
4. Kloroform p.a.E.Merck
5. n-heksana Teknis
6. Silika Gel 40 (70-230 mesh) ASTM E.Merck KgA 7. Plat KLT Silika Gel 60 F254 E.Merck.Art 554 8. Plat KLT Preparatif
9. Aluminium Foil 8 m x 30 cm Klin Pak
10. Kapas
11. Kertas Saring 12. FeCl3 5%
UNIVERSITAS SUMATERA UTARA
3.3 Penyedian Sampel
Bunga tumbuhan kersen segar dihaluskan menggunakan blender sampai diperoleh serbuk bunga tumbuhan Kersen sebanyak 2060 gram.
3.3.1 Uji Pendahuluan Terhadap Ekstrak Bunga Tumbuhan Kersen
Serbuk segar halus bunga tumbuhan Kersen diidentifikasi dengan menggunakan cara skrining fitokimia. Untuk membuktikan adanya senyawa fenolik yang terdapat dalam Bunga Tumbuhan Kersen maka dilakukan uji pendahuluan secara kualitatif dengan reaksi warna dengan cara merendam 10 g serbuk segar halus bunga tumbuhan Kersen ke dalam gelas Erlenmeyer menggunakan pelarut metanol sebanyak 100ml, kemudian diekstraksi maserasi dan didiamkan selama 1 malam lalu didekantasi larutan dan dimasukkan kedalam tabung reaksi. Ditambahkan dengan FeCl3 5% menghasilkan koloid berwarna hitam.
3.3.2 Ekstraksi Bunga Tumbuhan Kersen
Serbuk Bunga Tumbuhan Kersen ditimbang sebanyak 2060 g, kemudian dimaserasi dengan metanol sebanyak ± 20 L sampai sampel terendam seluruhnya, dibiarkan selama ± 48 jam. Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol dan diuji dengan FeCl3 5%. Kemudian diuapkan dengan penangas air hingga semua pelarut metanol menguap. Lalu dilakukan pemisahan tanin dengan cara melarutkan ekstrak pekat metanol dengan pelarut etil asetat secara berulang- ulang hingga negatif fenolik diuji dengan FeCl3 5%. Filtrat kemudian dirotarievaporator lalu diuapkan dengan penangas air hingga semua pelarut etil asetat menguap. Lalu ekstrak pekat etil asetat diuji dengan FeCl3 5%. Ekstrak pekat etil asetat dilarutkan dengan metanol dan diekstraksi partisi berulang-ulang dengan n-heksan sampai lapisan n-heksan bening.
Lapisan metanol dipisahkan dari lapisan n-heksan, lalu diuji dengan FeCl3 5% dan dipekatkan kembali dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ekstrak padat lapisan metanol sebanyak 30 g.
3.3.3 Analisis Kromatogafi Lapis Tipis
Analisis Kromatogafi Lapis Tipis dilakukan terhadap ekstrak metanol dengan menggunakan fase diam silika gel 60F254 Merck. Analisis ini dilakukan untuk
28
menentukan sistem dan perbandingan pelarut yang sesuai untuk kromatogafi kolom.
Fase gerak yang digunakan adalah campuran pelarut kloroform : metanol dengan perbandingan 90:10; 80:20; 70:30; 60:40 (v/v).
Dimasukkan 10 ml campuran larutan fase gerak kloroform : metanol 90:10 (v/v) kedalam chamber, kemudian dijenuhkan. Ditotolkan ekstrak pekat metanol pada plat KLT yang telah diaktifkan. Dimasukkan plat kedalam chamber yang telah berisi campuran pelarut yang telah dijenuhkan, lalu ditutup dan dielusi hingga pelarut mencapai batas yang telah ditentukan. Plat yang telah dielusi, dikeluarkan dari bejana, lalu dikeringkan. Diamati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut kloroform : metanol dengan perbandingan 80:20; 70:30; 60:40 (v/v).
3.3.4 Pemisahan Senyawa Fenolik dengan Kromatogafi Kolom
Pemisahan senyawa fenolik dilakukan dengan kolom kromatogafi terhadap ekstrak padat metanol. Fase diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan fase gerak yaitu kloroform 100%, campuran pelarut kloroform:metanol dengan perbandingan 90:10, 80:20, 70:30, 60:40 (v/v).
Terlebih dahulu dirangkai alat kromatogafi kolom. Kemudian dibuburkan silika gel 60 (70-230 mesh) ASTM dengan menggunkan kloroform, diaduk-aduk hingga homogen lalu dimasukkan kedalam kolom kromatogafi. Kemudian dielusi dengan menggunakan kloroform 100% hingga silika gel padat dan homogen.
Dibuburkan 7 g ekstrak padat metanol ditambahkan dengan silika gel kemudian dilarutkan dengan pelarut metanol, lalu dikeringkan. Kemudian dimasukkan kedalam kolom kromatogafi yang telah berisi bubur silika gel, lalu ditambahkan fase gerak kloroform:metanol 90:10 (v/v) secara perlahan-lahan dan diatur sehingga aliran fase yang keluar dari kolom sama banyaknya dengan penambahan fase gerak dari atas.
Ditingkatkan kepolaran dengan menambahkan fase gerak kloroform:metanol dengan perbandingan 80:20 (v/v), 70:30 (v/v), 60:40 (v/v). Hasil yang diperoleh ditampung dalam botol vial setiap ± 10 mL, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk pasta.
UNIVERSITAS SUMATERA UTARA
3.3.5 Pemurnian
Pasta yang diperoleh dari isolasi dengan kromatogafi kolom dilarutkan kembali dengan metanol lalu dianalisis KLT untuk mengetahui apakah senyawa yang diperoleh sudah murni atau belum sekaligus mencari fase gerak yang sesuai untuk KLT preparatif. Kloroform: Etil asetat 80:20 (v/v) adalah fase gerak yang menunjukkan pemisahan yang paling baik untuk digunakan KLT preparatif. Pasta yang telah dilarutkan ditotolkan secara perlahan-lahan dan sama rata disepanjang tepi bawah plat KLT yang telah diaktifkan. Plat dimasukkan kedalam bejana yang berisi campuran pelarut yang telah dijenuhkan, kemudian ditutup. Setelah dielusi, plat dikeluarkan dari bejana, dikeringkan, dan hasilnya diperiksa dibawah sinar UV. Tiap zona diberi tanda dan digerus lalu dielusi dengan metanol: etil asetat (1:1). Hasil elusi diuapkan hingga diperoleh padatan amorf berwarna kuning.
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatogafi Lapis Tipis (KLT) Uji kemurnian pasta dilakukan dengan kromatogafi lapis tipis dengan menggunakan fase diam silika gel 60 F254 dengan fase gerak dan kloroform: etil asetat 80:20 (v/v).
Dimasukkan 10 mL larutan fase gerak kedalam bejana kromatogafi lapis tipis, lalu dijenuhkan. Ditotolkan pasta yang sebelumnya dilarutkan dengan etil asetat pada plat KLT. Dimasukkan plat KLT tersebut kedalam bejana kromatogafi lapis tipis yang telah jenuh. Setelah pelarut fase gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, diamati dibawah sinar UV, dan difiksasi dengan menggunakan pereaksi FeCl3 5% menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa fenolik dan dihitung harga Rf yang diperoleh.
3.4 Identifikasi Senyawa Hasil Isolasi
Analisis kemurnian senyawa hasil isolasi dilakukan uji dengan tiga jenis spektroskopi yaitu Spektofotometer UV-Visible, Spektrofotometer Infra Merah (FT- IR), dan Spektrofotometer Resonansi Magnet Inti Proton (1HNMR).
3.4.1 Identifikasi dengan Spektrofotometer Ultraviolet Visible(UV-Vis)
Identifikasi dilakukan dengan alat spektrofotometer Ultraviolet Visible menggunakan pelarut metanol, dengan :
30
Nama Alat : UV
Spesifikasi : Agilent Technologies 8453 series Waktu Pengerjaan : 16 Januari 2020
Operator : Lanang Solakhudin
3.4.2 Identifikasi dengan Spektrofotometer Infra Merah (FT-IR)
Identifikasi dilakukan dengan alat Spektrofotometer FT-IR menggunakan pelarut metanol, dengan:
Nama Alat : FT-IR PRESTIGE 21SHIMADZU
Spesifikasi : FT-IR merk FTIR prestige 21 shimadzu, made in Japan Waktu Pengerjaan : 16 Januari 2020
Operator : Lanang Solakhudin
3.4.3 Identifikasi dengan Spektrofotometer Resonansi Magnetik Inti Proton Identifikasi dilakukan denganSpektrofotometer Resonansi Magnetik Inti Proton menggunakan pelarut metanol, dengan:
Nama Alat : Resonansi Magnetik Inti Proton (1H-NMR)
Spesifikasi : Merek Agilent 500 MHz dengan sistem konsol DD2, Frekuensi 500MHz (1H) dan 125 MHz (13C)
Waktu Pengerjaan : 20 Januari 2020 Operator : Dr. Elvira Hermawati
UNIVERSITAS SUMATERA UTARA
3.5 Bagan Penelitian
3.5.1 Uji Skrining Fitokimia Menggunakan Pelarut Metanol
32
3.5.2 Bagan Isolasi Senyawa Fenolik Bunga Tumbuhan Kersen (M. calabura L)
UNIVERSITAS SUMATERA UTARA
4.1 Hasil Penelitian
Berdasarkan hasil skrining fitokimia terhadap ekstrak metanol dari bunga tumbuhan kersen dengan penambahan pereaksi FeCl3 5% menghasilkan koloid hitam, menunjukkan bahwa positif fenolik. Hasil elusi dari perbandingan eluen kloroform : metanol 90:10 (v/v) pada fraksi 26-50, dilakukan KLT preparatif dengan eluen kloroform: etil asetat 80:20 (v/v) untuk mendapatkan senyawa murni berupa padatan amorf berwarna kuning seberat 8,03 mg (Gambar 4.1) dan Rf= 0,27 dengan eluen kloroform : etil asetat 80:20 (v/v)
Gambar 4.1 Padatan amorf hasil isolasi
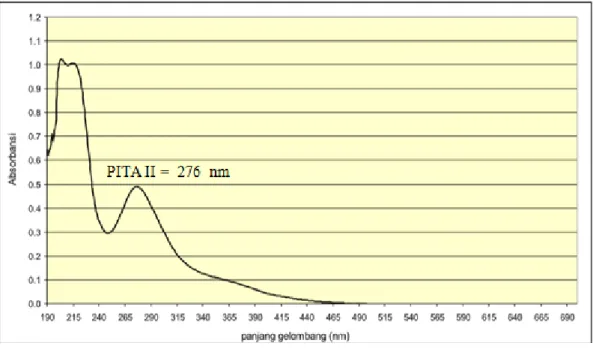
Untuk menentukkan struktur digunakan metode spektroskopi yaitu UV-Vis untuk melihat lamda (λ) maksimum dari hasil isolasi. Dari sini terlihat adanya gugus kromofor yaitu (C=O) dan ikatan rangkap (C=C) dari benzena. Spektrum UV-Visible senyawa hasil isolasi dengan menggunakan pelarut metanol ditunjukkan pada gambar 4.2 dibawah ini
34
Gambar 4.2 Spektrum UV-Vis Senyawa Hasil Isolasi
Dari hasil analisis menggunakan Spektrofotometer UV-Vis menunjukkan adanya satu serapan panjang gelombang maksimum yang ditunjukkan pada tabel 4.1 dibawah ini :
Tabel 4.1 Panjang Gelombang UV-Visible Senyawa Hasil Isolasi
Puncak PanjangGelombang (nm) Absorbansi
I 276 0.99887
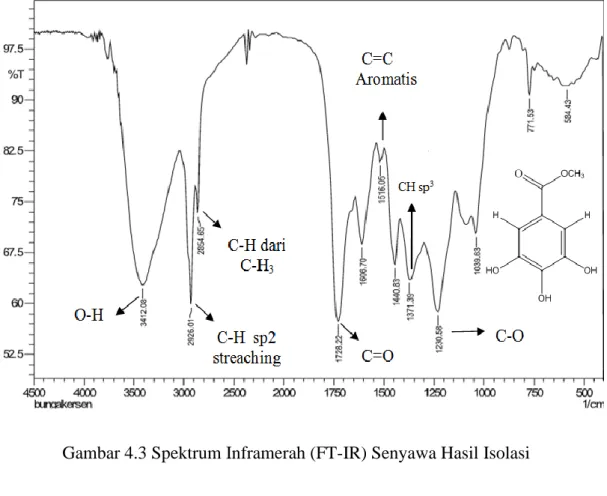
Kemudian FT-IR untuk melihat gugus – gugus fungsi dari senyawa yang diisolasi. Vibrasi dari gugus fungsi ini terlihat pada spektrum FT-IR. Spektrum FT- IR senyawa hasil isolasi dengan menggunakan pelarut metanol dapat dilihat pada gambar 4.3
UNIVERSITAS SUMATERA UTARA
Gambar 4.3 Spektrum Inframerah (FT-IR) Senyawa Hasil Isolasi
Hasil analisis spektrofotometer FT-IR padatan amorf hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada tabel 4.2
Tabel 4.2 Hasil Analisis Spektrum FT-IR Senyawa Hasil Isolasi Bilangan
Gelombang (cm-1)
Bilangan Gelombang (cm-1) (Pavia et al,1979)
Tipe Vibrasi Gugus Fungsi Intensitas
3412.08 3200-3500 Streaching O-H Tajam
2926.01 3000-2850 Streaching CH Sp2 dari proton aromatis
Tajam
2854.65 3000-2850 Streaching CH dari CH3 Tajam
1728.22 1800-1600 Streaching C=O Ester Tajam
1516.05 1600-1475 Streaching C=C aromatis Tajam
1371.39 1450-1365 Bending CH Sp3 Tajam
1230.58 1300-1000 Streaching C-O Tajam
Kemudian data dari 1H-NMR untuk melihat peak dari proton, ada yang posisi downfield dan upfield. Hasil ini dapat dilihat pada spektrum Gambar 4.4
36
Gambar 4.4 Spektrum H-NMR Senyawa Hasil Isolasi
Hasil analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut metanol dan TMS sebagai standar yang memberikan signal-signal pergeseran kimia dengan penjelasan pada tabel 4.3 berikut :
Tabel 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Atom H δ H Senyawa Hasil Isolasi Jenis Peak
H-2, H-6 7.0425 Puncak Singlet
H dari OCH3 3.8108 Puncak Singlet
4.2 Pembahasan
Hasil isolasi senyawa fenolik dari Bunga Tumbuhan Kersen mulai dari proses ekstraksi maserasi dengan metanol karena sampel bersifat polar diperoleh ekstrak pekat metanol 422,3 g kemudian dilarutkan menggunakan etil asetat secara berulang- ulang sampai bening untuk melarutkan tanin karena tanin tidak larut dalam etil asetat. Filtrat etil asetat dipekatkan kembali dengan rotarievaporator dan diuapkan sehingga diperoleh ekstrak pekat etil asetat 60,2 g. Ekstrak pekat yang diperoleh dilarutkan dengan metanol kemudian diekstraksi partisi dengan menggunakan pelarut
UNIVERSITAS SUMATERA UTARA