BAB 2
TINJAUAN PUSTAKA
2.1. Metabolisme Hormon Glukokortikoid
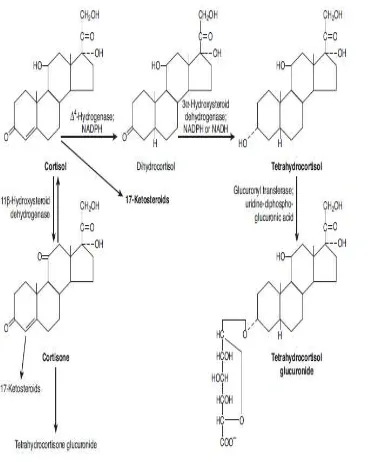
Metabolisme kortisol terjadi di hati, yang merupakan tempat katabolisme glukokortikoid, hormon kortisol direduksi menjadi dihidrokortisol kemudian menjadi tetrahidrokortisol, yang dikonjugasikan dengan asam glukoronat. Glokorinil transferase merupakan enzim yang bertanggung jawab pada konversi ini, juga mengkatalisis pembentukan glukoronida dari bilirubin. Hati dan jaringan lain mengandung enzim 11β-hidroksikortikosteroid dehidrogenase. Terdapat paling sedikit dua bentuk dari enzim ini. Jenis pertama mengkatalisis perubahan kortisol menjadi kortison dan reaksi sebaliknya, fungsi primer tersebut sebagai enzim reduktase. Tipe kedua mengkatalisis hampir secara eksklusif konversi satu arah kortisol menjadi kortison (Barret, Barman, Boitano, dan Brooks, 2012).
Kortison adalah glukokortikoid aktif karena kortison mengkonversikannya menjadi kortisol, dan telah populer karena penggunaannya telah banyak digunakan pada praktik dokter sehari-hari. Kortison tidak disekresikan dalam jumlah banyak pada kelenjar adrenal. Kortison disintesis di hati dan memasuki sirkulasi, kemudiaan kortison dengan cepat di reduksi dan dikonjugasikan untuk membentuk tetrahidrokortison glukoronida yang tidak berikatan dengan protein, sehingga cepat di ekskresikan melalui urin (Barret, Barman, Boitano, dan Brooks, 2012)
ventrolateral. CRH disekresikan kedalam sirkulasi portal hipofisis dan mengikat diri pada ikatan reseptor CRH tipe 1 (CRH-R1) di hipofisis anterior untuk menstimulasi transkripsi pro-opiomelanocortin (POMC) melalui proses yang melibatkan aktivasi adenilatsiklase (Bronstein, 2011).
Adapun fungsi CRH adalah menstimulasi transkripsi gen POMC secara invivo dan invitro sebagai respon dari stres dan adrenalektomi. ACTH yang disintesis didalam hipofisis anterior sebagai bagian besar dari prekursor POMC241-aminoacid adalah hormon utama dalam memproses biosintesis dan sekresi glukokortikoid adrenal. Angiotensin-II, aktivin, inhibin, dan sitokin (TNF-β dan leptin) bersinergi dengan menghambat ACTH dari korteks adrenal (Bronstein, 2011).
Aksis hipotalamus-hipofisis adrenal juga diatur oleh irama biologis yang dihasilkan oleh interaksi kompleks genetik dari pemicu sirkardian endogen dan lingkungan. ACTH disekresi secara pulsatil dengan irama sirkardian yang menyebabkan kadar tertinggi saat bangun pagi dan menurun sepanjang hari, sehingga mencapai titik terendah pada saat malam hari. Pengatur Aksis HPA lainnya adalah stres, merupakan komponen utama dari CRH dan sistem autonom locus coeruleus-norepinephrine yang merupakan pemicu bagi aksis tersebut (Bronstein, 2011).
Stres yang menginduksi aktivitas aksis HPA dihambat oleh umpan balik negatif dari glukokortikoid. Glukokortikoid dan katekolamin mempengaruhi fungsi utama dari sel penyaji antigen, proliferasi dan migrasi leukosit, sekresi sitokin dan antibodi, dan melakukan seleksi dari T helper-1 terhadap T helper-2. Sitokin proinflamatori khususnya interleukin-1, interleukin-6, tumor necrosis factor- β, dan Leukemia inhibitory factor, juga meningkatkan sekresi ACTH secara langsung atau juga dengan menambah efek dari CRF (Bronstein, 2011).
Aspek penting lainnya dari regulasi aksis HPA adalah kontrol umpan balik negatif yang dilakukan oleh glukokortikoid yang menghambat ekspresi basal dari CRH dan sintesis dan sekresi AVP mRNA di hipotalamus dan juga menghambat transkripsi gen POMC di hipofisis anterior. Efek glukokortikoid diperoleh dengan mengaktivasi reseptor sitosol yang termasuk kelompok reseptor nuklear kortikosteroid tipe 1 atau mineralokortikoid dan glukokortikoid tipe 2. Beberapa mekanisme lainnya paling banyak melibatkan regulasi secara transkripsi ekspresi gen (Bronstein, 2011).
Salah satu faktor terpenting pengaturan akses dari glukokortikoid endogen ke reseptornya adalah melalui metabolisme lokal dari steroid didalam sel target oleh enzim 11β-hidroksikortikosteroid dehidrogenase (11 β-HSD), sebuah fenomena yang kadang-kadang ditentukan oleh metabolisme prereseptor. Kortisol/kortikosteron bertanggung jawab untuk memelihara homeostasis garam dan air, kontrol tekanan darah, dan mempengaruhi metabolisme karbohidrat, protein, lemak, dan tulang. Kortisol juga pengatur utama dari sistem pertahanan tubuh dan proses inflamasi yang memerlukan banyak proses yang berkaitan dengan pertahanan host. Disisi lain terapi glukokortikoid jangka panjang dan lama menimbulkan kerusakan besar bagi tubuh (Bronstein, 2011).
2.2. Fisiologi Hormon Glukokortikoid
2.2.1. Efek hormon glukokortikoid pada metabolisme 2.2.1.1. Perangsangan Glukoneogenesis
Sejauh ini metababolisme yang paling terkenal dari kortisol dan glukokortikoid lainnya terhadap metabolisme adalah kemampuan kedua hormon ini untuk merangsang proses glukoneogenesis (pembentukan karbohidrat oleh protein dan beberapa zat lain) oleh hati, meningkatkan kecepatan glukoneogenesis sebesar 6 sampai 10 kali lipat. Keadaan ini terutama disebabkan oleh dua efek kortisol (Guyton dan Hall, 2006).
Pertama kortisol meningkatkan semua enzim yang dibutuhkan untuk mengubah asam-asam amino menjadi glukosa dalam sel-sel hati. Hal ini dihasilkan dari efek glukokortikoid untuk mengaktifkan transkripsi DNA didalam inti sel hati dalam cara yang sama dengan fungsi aldosteron didalam sel-sel tubulus ginjal, disertai dengan pembentukan RNA messenger yang selanjutnya dapat dipakai untuk menyusun enzim-enzim yang dibutuhkan dalam proses glukoneogenesis (Guyton dan Hall, 2006).
2.2.1.2. Penurunan pemakaian glukosa oleh sel
Kortisol juga menyebabkan penurunan kecepatan pemakaian glukosa oleh sel-sel tubuh. Walaupun penyebab penurunan ini tidak diketahui, sebagian ahli fisiologi percaya bahwa pada suatu tempat yang terletak diantara tempat masuknya glukosa kedalam sel dan tempat pecahnya kortisol yang terakhir, secara langsung memperlambat kecepatan pemakaian glukosa. Dugaan mekanisme ini didasari pada pengamatan yang menunjukkan bahwa glukokortikoid menekan proses oksidasi nikotinamid-adenin dinukleotida (NADH) untuk membentuk NAD+ . Oleh karena NADH harus dioksidasi agar menimbulkan glikolisis, efek ini dapat berperan dalam mengurangi pemakaian glukosa oleh sel (Guyton dan Hall, 2006).
2.2.1.3. Efek kortisol terhadap metabolisme protein
Salah satu efek utama dari kortisol terhadap sistem metabolisme tubuh adalah kemampuannya untuk mengurangi penyimpanan protein diseluruh tubuh kecuali protein dalam hati. Keadaan ini disebabkan oleh berkurangnya sintesis protein dan meningkatnya katabolisme protein yang sudah ada didalam sel. Penelitian terakhir yng diisolasi bahwa kortisol menekan efek pengangkutan asam-asam amino ke sel-sel otot dan mungkin juga ke sel-sel ekstrahepatik lainnya (Guyton dan Hall, 2006). Berkurangnya asam amino yang diangkut ke sel-sel ekstrahepatik akan mengurangi konsentrasi asam amino intraseluler dan akibatnya akan mengurangi sintesis protein. Namun proses katabolisme protein yang terjadi didalam sel terus melepaskan asam amino dari protein yang sudah ada, dan asam amino ini akan berdifusi keluar dari sel-sel tubuh untuk meningkatkan konsentrasi asam amino dalam plasma (Guyton dan Hall, 2006).
menyebabkan timbulnya pengaruh seperti (1) peningkatan kecepatan deaminasi asam amino oleh hati, (2) peningkatan sintesis asam amino oleh hati, (3) peningkatan pembentukan protein plasma oleh hati, dan (4) peningkatan perubahan asam amino menjadi glukosa-yaitu meningkatkan glukoneogenesis (Guyton dan Hall, 2006). 2.2.1.4. Efek pada metabolisme lemak.
Pada kelenjar adiposa terlihat efek yang dominan berupa peningkatan lipolisis dengan melepaskan gliserol dan asam lemak bebas. Efek tersebut merupakan stimulasi lipolisis secara langsung oleh glukokortikoid, tetapi hal ini juga diakibatkan oleh penurunanan ambilan glukosa oleh efek glukokortikoid yang bertindak sebagai hormon lipolisis (Greenspan dan Gardner, 2001).
Walaupun hormon glukokortikoid bertindak sebagai hormon lipolisis, tetapi dapat bertindak juga sebagai deposisi lemak yang merupakan manifestasi klasik sebagai kelebihan hormon glukokortikoid. Kejadian yang berlawanan ini mungkin disebabkan oleh peningkatan nafsu makan yang disebabkan oleh kelebihan kadar steroid dan juga oleh efek lipogenik akibat hiperinsulinemia yang terjadi pada keadaan tersebut (Guyton dan Hall, 2006).
2.2.1.5. Peran adaptasi terhadap stres
digunakan untuk memperbaiki jaringan jika terjadi cedera fisik. Karena itu terjadi peningkatan cadangan glukosa, asam amino, dan asam lemak yang dapat digunakan sesuai kebutuhan (Sherwood, 2009)
2.2.1.6. Efek glukokortikoid sebagai anti-inflamasi dan anti-alergi
Glukokortikoid menghambat respon inflamasi pada jaringan yang rusak. Glukokortikoid juga menekan terjadinya manifestasi alergi karena pelepasan histamin dari sel mast dan basofil. Kedua efek tersebut mememerlukan kadar glukokortikoid disirkulasi yang tinggi. Pengurangan inflamasi lokal terjadi akibat penurunan pelepasan enzim fosfolipase A2 oleh hormon tersebut. Hal ini mengakibatkan pengurangan pelepasan asam arakidonat dari jaringan fosfolipid dan sebagai konsekuensinya adalah penurunan pembentukan leukosit, tromboksan, prostaglandin, dan prostasiklin (Barret, Barman, Boitano, dan Brooks, 2012).
2.2.2. Pengaturan sekresi glukokortikoid
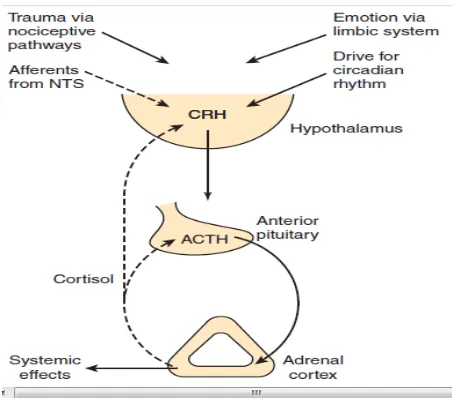
Sekresi kortisol oleh korteks adrenal diatur oleh sistem umpan balik negatif yang melibatkan hipotalamus dan hipofisis anterior. ACTH dari hipofisis anterior merangsang korteks aadrenal untuk mengeluarkan kortisol. ACTH berasal dari sebuah molekul prekursor besar, propriomelanokortin, yang diproduksi oleh reticulum endoplasma sel-sel penghasil ACTH hipofisis anterior. Sebelum sekresi, prekursor besar ini dipotong menjadi ACTH dan dan beberapa peptida lain yang aktif secara biologis, yaitu, melanocyte-stimulating hormone (MSH) dan suatu bahan mirip-morfin, β-endorfin (Sherwood, 2009).
kortisol pada sekresi CRH dan ACTH masing-masing oleh hipotalamus dan hipofisis anterior (Sherwood, 2009).
Sistem umpan balik negatif untuk kortisol mempertahankan kadar sekresi hormon ini relatif konstan disekitar titik patokan. Pada kontrol umpan balik dasar ini terdapat dua faktor tambahan yang mempengaruhi konsentrasi plasma dengan mengubah titik patokan: irama diurnal dan stres, dimana keduanya bekerja pada hipotalamus untuk mengubah tingkat sekresi CRH (Sherwood, 2009).
2.2.3. Ritme sirkardian dari sekresi glukokortikoid
Kecepatan sekresi CRH, ACTH, kortisol semuanya tinggi pada awal pagi hari, tetapi rendah pada akhir sore hari, kadar kortisol plasma berkisar antara kadar paling tinggi kira-kira 20 �g/dL, satu jam sebelum matahari terbit dipagi hari dan paling rendah kira-kira 5 �g/dL, sekitar tengah malam. Efek ini dihasilkan dari perubahan siklus sinyal dari hipotalamus selama 24 jam yang menimbulkan sekresi kortisol. Bila seseorang mengubah kebiasaan tidur sehari-harinya, maka akan timbul perubahan siklus ini juga ( Guyton dan Hall, 2006).
2.3. Sindrom Cushing 2.3.1. Pengertian
Sindrom Cushing adalah sindroma klinik yang disebabkan oleh kelebihan glukokortikoid secara kronik sebagai hasil dari paparan jangka lama organisme dari glukokortikoid eksogen atau ACTH, atau secara endogen karena hipersekresi dari kortisol, ACTH atau CRH. Hipersekresi ACTH endogen yang berasal dari hipofisis dinamakan Cushing’s desease (penyakit Cushing) (Linos dan Heerden, 2005).
2.3.2. Klasifikasi dan Etiologi
2.3.2.1. Sindrom Cushing tergantung ACTH
Pada tipe ini hipersekresi glukokortikoid disebabkan oleh hipersekresi ACTH. Hipersekresi kronik ACTH menyebabkan hiperplasia zona fasikulata dan zona retikularis korteks adrenal. Hiperplasia ini menyebabkan hipersekresi hormon adrenokortikal yaitu glukokortikoid dan androgen, sehingga pada tipe ini ditemukan peningkatan kadar hormon adrenokortikotropik dan kadar glukokortikoid dalam darah. Yang termasuk sindrom ini adalah adenoma hipofisis dan sindrom ACTH ektopik (Batubara, Tridjaja, dan Pulungan, 2010).
2.3.2.2. Sindrom Cushing tidak tergantung ACTH
Pada tipe ini tidak ditemukan adanya pengaruh sekresi ACTH terhadap hipersekresi glukokortikoid, atau hipersekresi glukokortikoid tidak berada dibawah pengaruh jaras hipotalamus-hipofisis (Batubara, Tridjaja, dan Pulungan, 2010).
1. Tumor adrenokortikal
Tumor adrenokortikal primer seperti adenoma ataupun karsinoma yang mensekresi glukokortikoid secara berlebihan, menyebabkan kadar glukokorikoid plasma meningkat (Batubara, Tridjaja, dan Pulungan, 2010).
2. Hiperplasia adrenal nodular
Yang dapat menyebabkan keadaan ini antara lain, primary pigmented nodular adreokortikal disease dan sindrom McCune Albright (Batubara, Tridjaja, dan Pulungan, 2010).
3. Iatrogenik
Pemberian obat-obatan glukokortikoid dalam jangka lama dapat menyebabkan meningkatnya kadar glukokortikoid dalam darah (Batubara, Tridjaja, dan Pulungan, 2010).
Tabel 2.1. Klasifikasi sindrom Cushing Sindrom Cushing tergantung ACTH
2.4. Patofisiologi
Keadaan hiperglukokortikoid pada sindrom Cushing menyebabkan katabolisme protein yang berlebihan sehingga tubuh kekurangan protein. Kulit dan jaringan subkutan menjadi tipis, pembuluh darah menjadi rapuh sehingga tampak sebagai striae berwarna ungu di daerah abdomen, paha, bokong, dan lengan atas. Otot-otot menjadi lemah dan sukar berkembang, mudah memar, luka sukar sembuh, serta rambut tipis dan kering (Batubara, Tridjaja, dan Pulungan, 2010).
Sindrom Cushing atau disebut juga kelebihan glukokortikoid telah lama diketahui sebagai penyebab hipertensi, tetapi mekanisme terperinci yang menghasilkan peningkatan tekanan darah masih belum diketahui. Peningkatan sensitivitas pembuluh darah perifer terhadap agonis adrenergik mungkin mempunyai peranan penting pada hipertensi vaskular (Avner, Harmon, dan Niaudet, 2009). Pada sindrom Cushing terjadi pengaktifan sintesis angiotensinogen oleh hati yang menstimulus sistem renin-angiotensinogen, sedangkan fosfolipase A2 yang melepaskan asam arakidonat dari fosfolipid yang berperan penting dalam sintesis vasodilator prostaglandin menjadi terhambat. Glukokortikoid juga mengurangi aktivitas dari depresor sistem kalikrein-kinin sehingga meningkatkan sensitivitas vasokonstriktor endogen (epinefrin dan angiotensin-II) dan meningkatkan masuknya natrium kedalam sel-sel otot polos vaskular (Avner, Harmon, dan Niaudet, 2009). Hipertensi dapat disebabkan oleh peningkatan sekresi angiotensinogen akibat kerja langsung glukokortikoid pada arteriol atau akibat kerja glukokortikoid yang mirip mineralokortikoid sehingga menyebabkan peningkatan retensi air dan natrium, serta sekresi kalium. Retensi air ini juga menyebabkan wajah yang bulat menjadi tampak pletorik (Batubara, Tridjaja, dan Pulungan, 2010).
reabsorbsi matriks protein tulang. Selain itu terdapat peningkatan ekskresi kalsium dan penurunan absorbsi kalsium pada lumen usus. Terjadinya hipokalsemia ini dikompensasi dengan peningkatan ringan sekresi PTH. Pada waktu yang sama PTH meningkatkan aktivitas osteoklas. Sehingga, efek keseluruhannya adalah osteopenia yang nyata (Lifshitz, 2007).
Pada sindrom Cushing terdapat peningkatan kadar trigliserida dan kolestrol total, sedangkan HDL dapat bervariasi. Sindrom Cushing yang nyata dan subklinis memberikan banyak gambaran dengan sindrom metabolik termasuk resistensi insulin, kadar gula darah puasa yang abnormal, hipertensi, obesitas, dan dislipidemia. Patogenesisnya melibatkan banyak faktor, termasuk aktivitas kortisol secara langsung dan tidak langsung pada lipolisis, pergantian dan produksi asam lemak bebas, sintesis very-low-density lipoprotein (VLDL), dan akumulasi lemak di hati. Protein kinase yang diaktivasi oleh AMP memperantarai perubahan metabolik yang diinduksi oleh glukokortikoid (Acton, 2012).
Resistensi insulin memiliki peran kunci yang menentukan abnormalitas lemak. Perubahan hormonal lainnya melibatkan growth hormone, testosteron pada laki-laki, estrogen pada perempuan, katekolamin, dan sitokin. Pada studi invitro, kortisol meningkatkan lipoprotein lipase didalam jaringan lemak dan terutama di lemak viseral, dimana lipolisis diaktivasi, menghasilkan pelepasan asam lemak bebas ke dalam sirkulasi (Acton, 2012).
2.5. Diagnosis
2.5.1. Manifestasi Klinis
berat dan lebih jelas dibandingkan pada anak (Batubara, Tridjaja, dan Pulungan,- 2010).
Hampir semua dokter mengenal gambaran klinis sindrom Cushing. Obesitas sentral, “moon face”, hirsutisme, dan kemerahan pada wajah dijumpai pada lebih dari 80% orang dewasa penderita sindrom Cushing. Striae, hipertensi, kelemahan otot, nyeri punggung, distribusi lemak “buffalo hump”, gangguan psikologis, jerawat, dan mudah memar merupakan gambaran yang sangat lazim (35-80%). Namun ini merupakan tanda dan tampilan penyakit Cushing yang sudah lanjut (Rudolph dan Hoffman, 2007).
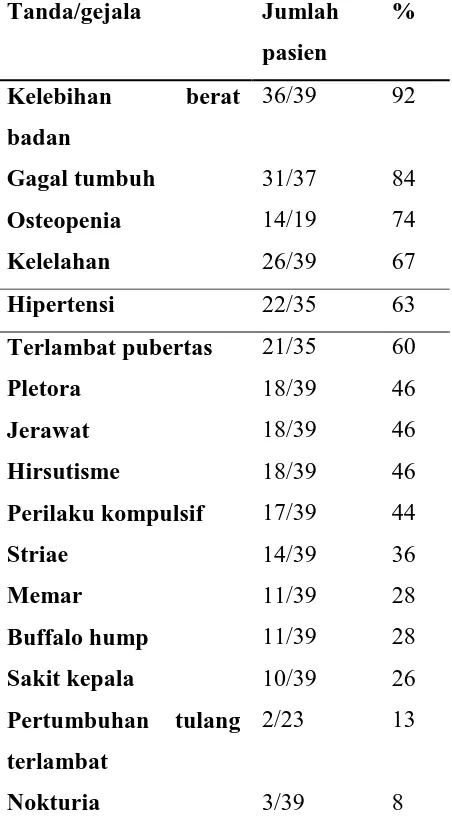
Tabel 2.2. Temuan klinis 39 pasien anak penderita sindrom Cushing Tanda/gejala Jumlah
pasien
%
Kelebihan berat badan
36/39 92
Gagal tumbuh 31/37 84
Osteopenia 14/19 74
Kelelahan 26/39 67
Hipertensi 22/35 63
Terlambat pubertas 21/35 60
Pletora 18/39 46
Jerawat 18/39 46
Hirsutisme 18/39 46
Perilaku kompulsif 17/39 44
Striae 14/39 36
Memar 11/39 28
Buffalo hump 11/39 28
Sakit kepala 10/39 26
Pertumbuhan tulang terlambat
2/23 13
Nokturia 3/39 8
2.5.2. Pemeriksaan Laboratorium
2.5.2.1. Pemeriksaan Kadar Kortisol Plasma
Kadar kortisol dalam darah normalnya meningkat pada pukul 8 pagi dan menurun sampai kurang dari 50% pada pukul 8 malam, kecuali pada anak yang belum berusia 3 tahun karena irama diurnal mereka tidak selalu ada. Pada pederita sindrom Cushing, irama diurnal ini hilang dan kadar kortisol pada pukul 8 malam biasanya meningkat (Kliegman, Behrman, Stanton, dan Jenson, 2007).
2.5.2.2. Kadar kortisol bebas urin 24 jam
Ekskresi kortisol bebas urin 24 jam (berdasarkan luas permukaan tubuh) adalah tes langkah awal yang penting. Dengan nilai yang konsisten lebih dari 300�g/ hari merupakan diagnostik yang sebenarnya pada sindrom Cushing. Kadar kortisol bebas dalam urin tetap konstan sepanjang hidup sesuai dengan indeks masa tubuh. Nilai yang normal terletak kurang dari 70�g/m2/hari atau kurang dari 80�g/m2/hari berdasarkan dari sumber yang berbeda (Linos dan Heerden, 2005).
2.5.2.3. Tes Supresi Deksametason Dosis Tunggal
Pada anak diberikan deksametason dengan dosis 15��/kg berat badan (dosis maksimal 1mg) diberikan pada tengah malam dan penentuan kadar kortisol darah dilakukan esok harinya pada pukul 08.00 pagi. Kadar kortisol plasma pada pagi hari yang lebih besar dari 5mg/dL setelah pemberian deksametason pada tengah malam berarti terdapat hiperkortisolime (Linos dan Heerden, 2005).
2.5.2.4. Pemeriksaan kadar ACTH plasma
kadar plasma lebih dari 10 pg/mL, maka penyebabnya adalah tipe tergantung ACTH (Batubara, Tridjaja, dan Pulungan, 2010).
Pada kelainan hipofisis, diperlukan pemeriksaan lanjutan menggunakan Magnetic Resonance imaging (MRI) dan CT scan kepala. Bila masih dicurigai adenoma hipofisis tetapi belum ditemukan pada pemeriksaan, maka perlu dilakukan evauasi secara periodik. Pada sindrom ACTH ektopik dilakukan pemeriksaan lanjutan berupa CT scan toraks dan abdomen untuk menemukan lokasi tumor nonendokrin yang menyebabkan peningkatan kadar ACTH plasma. Sedangkan pada kelainan adrenokortikal dilakukan pemeriksaan CT scan adrenal (Batubara, Tridjaja, dan Pulungan, 2010).
2.6. Diagnosis banding
Sindrom Cushing sering dicurigai pada anak dengan obesitas, terutama jika terdapat striae dan hipertensi. Diagnosis banding dipersulit oleh kenyataan bahwa peningkatan kadar kortikosteroid urin sering kali akibat obesitas itu sendiri. Anak dengan obesitas sederhana biasanya berperawakan tinggi, tetapi mereka yang dengan sindrom Cushing berperawakan pendek atau angka pertumbuhannya melambat eksresi kortikosteroid urin dengan cepat tertekan dengan pemberian oral deksametason dosis rendah pada orang obesitas tidak terkomplikasi (Behrman, Kliegman dan Arvin, 2000).
Kecurigaan terhadap sindrom Cushing pada anak biasanya muncul bila terdapat kenaikan berat badan, pertumbuhan yang terlambat, perubahan suasana hati, dan perubahan tampilan wajah (pletora, jerawat, hirsutisme). Diagnosis penyakit ini seringkali dibuat pada tahap yang relatif dini dari perjalanan alamiahnya sehingga diagnosis penyakit Cushing mungkin kurang jelas dan sulit. Peningkatan absolut diatas “batas yang dianggap normal” untuk konsentrasi ACTH dan kortisol plasma sering kali tidak ada (Rudolph dan Hoffman, 2007).
Dibandingkan menemukan konsentrasi kortisol pagi hari >20�g/dL atau ACTH >100pg/mL, akan lebih khas untuk mendapatkan peningkatan kadar kortisol siang dan malam hari yang ringan tetapi sering kali kurang jelas. Hilangnya irama diurnal ini dibuktikan oleh sekresi ACTH dan kortisol yang berkesinambungan sepanjang siang, sore dan malam hari, yang biasanya indeks laboratorium yang paling dini yang dapat dipercaya untuk penyakit Cushing (Brook, Clayton, dan Brown, 2005).
Sebaliknya nilai untuk ACTH dan kortisol biasanya sangat tinggi pada sindrom ACTH ektopik, sedangkan pada tumor adrenal dan hiperplasia adrenal multinodular kadar kortisol meningkat, tetapi ACTH menurun (Rudolph dan Hoffman, 2007). 2.7. Penatalaksanaan
Pada sindrom Cushing iatrogenik harus dilakukan penghentian dari terapi steroid atau menggunakan dosis efektif minimal atau juga dengan mengganti regimen jika terapi penghentian steroid tidak memungkinkan (Goel dan Gupta, 2012).
injeksi ataupun secara topikal. Lebih baik, pilihlah glukokortikoid dengan waktu paruh yang pendek atau menengah. Ketika keadaan penyakit memungkinkan, berikan dosis minimal yang diperlukan untuk mengontrol penyakit (Chrousos, 2014).
Pada pasien yang diterapi dengan glukokortikoid jangka panjang, pertimbangkan untuk mengubah dosis harian. Ketika penyakit dasar tidak memungkinkan untuk melakukan penurunan dosis, maka pertimbangkan untuk menambah agen pengganti glukokortikoid misalnya, siklofospamid pada sindom nefrotik yang resisten terhadap steroid, metotreksat dan agen imunosupresi lainnya pada artritis rematoid juvenile (Chrousos, 2014).
Ketika pengobatan glukokortikoid jangka panjang diperlukan, pastikan efek samping seminimal mungkin, termasuk memastikan asupan kalsium dengan suplemen jika diperlukan dan suplementasi vitamin D pada bentuk tablet multivitamin. Lakukan pemantauan ekskresi kalsium urin untuk memastikan bahwa pasien tidak dalam keadaan hiperkalsiuria yang merupakan predisposisi timbulnya batu saluran kemih. Pada kasus-kasus yang berkomplikasi menjadi osteoporosis (dengan kepadatan mineral tulang yang rendah), atau juga terjadinya fraktur, pertimbangkan untuk memberikan bisfosfonat. Hindari juga pengobatan yang menyebabkan iritasi lambung, termasuk anti inflamasi nonsteroid, dan oral bisfosfonat. Ketika obat-obatan tersebut tidak dapat terhindarkan, berikan terapi profilaksis dengan antagonis histamine 2 (H2) atau proton pump inhibitor (Chrousos, 2014).