Prosiding KIMIA FMIPA - ITS
SINTESIS MCM-41 MENGGUNAKAN SUMBER SILIKA DARI ABU LAYANG BATUBARA PT. IPMOMI
PAITON DENGAN VARIASI KOMPOSISI DAN WAKTU HIDROTERMAL
Dalia Novrinda Wiyanti*, Ratna Ediati1
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
ABSTRAK
Penelitian ini diawali dengan proses leaching pada abu layang batubara yang dilanjutkan dengan proses alkali fusi abu layang dengan NaOH. Sintesis MCM-41 yang menggunakan sumber silika dari abu layang batubara PLTU Paiton dilakukan dengan variasi komposisi yang menggunakan dua perbandingan mol gel, yakni CTAB : Si : H2O adalah (A) 0,027 : 0,1 : 30 dan (B) 0,15 : 1 : 167 dan variasi waktu hidrotermal, yakni 96, 144, 192, dan 240 jam pada temperatur 100°C. Padatan hasil sintesis dikarakterisasi menggunakan XRD dan FTIR. Difraktogram menunjukkan puncak karakteristik pada 2θ sekitar 1,5-2,36°, 3,6-4,0°, 4,36-4,6°, dan 5,96-6,1° yang hampir sama dengan puncak karakteristik dari material MCM-41 . Adsorpsi/desorpsi isoterm Nitrogen menunjukkan bahwa padatan hasil sintesis memiliki luas permukaan spesifik 815,70-887,50 m2/g; dan diameter pori 34,03-34,06 Ǻ. Hasil foto SEM menunjukkan bahwa padatan hasil sintesis merupakan kumpulan butiran-butiran partikel dengan morfologi seragam berdiameter kurang lebih 200 nm. Pengukuran sifat keasaman pada padatan hasil sintesis menggunakan FTIR piridin juga menunjukkan bahwa MCM-41 memiliki sisi asam Lewis dan sisi asam Brønsted karena adanya logam dalam kerangka MCM-41.
Kata kunci :
abu layang batubara, MCM-41, perbandingan mol gel, waktu hidrotermal
I PENDAHULUAN
Pembakaran batubara menghasilkan limbah yang berupa limbah padat, cair dan gas. Limbah padat yang dihasilkan berupa abu layang (fly ash = 80-90%) dan abu tungku/abu dasar (bottom ash = 10-20%) (Perera, 2006). Komponen utama dari abu layang batubara yang berasal dari pembangkit listrik adalah silika (SiO2), alumina (Al2O3), dan besi oksida (Fe2O3), sisanya adalah karbon, kalsium, magnesium, dan belerang. Abu layang batubara mempunyai sifat
pozzolanic dan fase mineral yang terdiri atas
komponen utama yaitu silika (60-70%) dan alumina (16-20%) dalam bentuk kuarsa dan mullit, dengan jejak oksida logam transisi (Chang et al., 2000).
Abu layang batubara umumnya dibuang di lahan tanah atau ditumpuk begitu saja di dalam area industri. Penumpukkan abu layang batubara ini menimbulkan masalah bagi lingkungan (Kumar et al., 2001). Sudut pandang terhadap abu layang harus dirubah, abu layang adalah bahan baku potensial yang dapat digunakan sebagai adsorben murah. Selain itu, berbagai penelitian mengenai pemanfaatan abu layang batubara sedang dilakukan untuk meningkatkan nilai ekonomisnya serta mengurangi dampak buruknya terhadap lingkungan. Saat ini, umumnya abu layang batubara digunakan dalam pabrik semen sebagai salah satu bahan campuran pembuat beton.
Pemanfaatan lain dari abu layang batu bara adalah sebagai penimbun lahan bekas pertambangan;
recovery magnetit, cenosphere, dan karbon; bahan
baku keramik, gelas, batu bata, dan refraktori; bahan penggosok (polisher); zat aditif dalam pengolahan limbah, dan lain-lain.
Pada tahun 1992 dilaporkan sintesis dari anggota baru keluarga mesopori (~ 20 – 500 Å) molekular sieve (M41S). Silika mesopori dengan daerah permukaan dan volume pori yang tinggi memperoleh perhatian sejak penemuan molecular
sieve mesopori (M41S) oleh ilmuwan pada Mobil Oil
(Beck et. al, 1992 dan Kresge et al., 1992).Oleh karena berhubungan dengan kandungan yang tinggi dari penggunaan silika dan alumina dalam abu layang batubara, maka untuk menyempurnakan nilai ekonomisnya dan memulihkan penggunaan mineral dilakukan aplikasi dalam industri. Beberapa studi didasarkan pada metode hidrotermal untuk mengkonversi abu layang batubara ke dalam silika mesopori khususnya MCM-41 (Mimura et al., 2001; Querol et al., 2002; Mouhtaris et al., 2003).
Mokaya (2000) telah melakukan sintesis MCM-41 dengan variasi waktu hidrotermal, yakni 48, 96, 120, 144, dan 168 jam pada temperatur 150°C. Pengaruh waktu hidrotermal pada sintesis MCM-41 akan mempengaruhi struktur MCM-41 yang terbentuk dan dilaporkan bahwa MCM-41 hasil sintesis menghasilkan struktur dan morfologi yang berbeda, yakni dari partikel yang berbentuk bola menjadi partikel yang memanjang atau menyerupai tali dan Prosiding Skripsi Semester Ganjil 2009/2010
Prosiding KIMIA FMIPA - ITS
tergantung pada lamanya waktu kristalisasi. Transformasinya disertai dengan formasi/bentuk dari dinding pori silika terkondensasi yang sangat tebal dan tinggi (Mokaya, 2000). Disamping itu, Misran et al, (2006) juga telah melakukan sintesis MCM-41 dengan sumber silika dari abu layang batubara yang diawali dengan proses alkali fusi abu layang batubara karena penting untuk mengekstraksi silika dari kuarsa dalam abu layang batubara.
Pada penelitian kali ini akan dilakukan sintesis MCM-41 menggunakan sumber silika dari abu layang batubara PT. IPMOMI Paiton dengan menggunakan cetyltrimethylammonium bromide
(CTABr) sebagai templat, yang menggunakan dua perbandingan mol gel yang berbeda yakni: (A) CTAB : Si : H2O adalah 0,027 : 0,1 : 30 dan (B) 0,15 : 1 : 167 dengan variasi waktu hidrotermal, yakni 96, 144, 192, dan 240 jam pada temperatur 100ºC.
II METODE PENELITIAN 2.1 Prosedur Kerja
2.1.1 Pencucian Abu Layang dari Pengotornya
Abu layang ditimbang 100,0031 gr lalu dimasukkan ke dalam gelas beker dan ditambahkan 500 ml aquades (panas) sambil diaduk-aduk, kemudian dibiarkan mengendap. Setelah mengendap, lalu didekantasi. Proses tersebut diulangi sebanyak tiga kali. Abu layang yang telah dicuci tersebut kemudian dimasukkan ke dalam oven pada suhu 100°C selama 12 jam dan diulangi beberapa kali sampai berat konstan. Hasilnya dianalisa menggunakan alat XRF dan XRD.
2.1.2 Proses Leaching dari Abu Layang
Abu layang yang telah dicuci, ditimbang sebanyak 10,0028 gr dimasukkan ke dalam gelas beker dan ditambahkan larutan asam klorida (HCl) 10% dengan perbandingan HCl sebanyak 250 ml. Selanjutnya diaduk menggunakan pengaduk magnetik stirer pada kecepatan 300 rpm pada suhu 80 °C selama 1 jam. Kemudian disaring menggunakan corong Buchner. Hasil residunya dicuci dengan aquades (panas) lalu dimasukkan ke dalam oven pada suhu 100°C selama 24 jam, dan hasilnya dianalisa dengan menggunakan alat XRF.
2.1.3 Proses Alkali Fusi dari Abu Layang
Residu abu layang dari proses leaching, ditimbang sebanyak 10,0023 gr dan dimasukkan ke dalam gelas beker lalu ditambahkan natrium hidroksida pellet (NaOH) yang telah dihaluskan sebelumnya sebanyak 12,0042 gr. Kemudian diaduk hingga tercampur merata, lalu dikalsinasi dalam furnace pada suhu 750°C selama 12 jam. Selanjutnya didinginkan dalam desikator lalu ditumbuk sampai halus, dimasukkan dalam botol polipropilen dan ditambahkan 127,5 ml aqua DM. Kemudian diaduk menggunakan pengaduk magnetik strirer pada kecepatan 300 rpm selama 24 jam, lalu disaring menggunakan corong Buchner. Hasil filtratnya
(larutan ekstrak Na2SiO3) dianalisa dengan menggunakan alat ICP-AES untuk mengetahui konsentrasi Si, Al, dan Na terlarut.
2.1.4 Sintesis MCM-41
Material katalis MCM-41 disintesis dengan menggunakan metode hidrotermal. Untuk mensintesis MCM-41, dilakukan dengan menggunakan dua perbandingan mol gel dari CTAB : Si : H2O = 0,027 : 0,1 : 30 dan 0,15 : 1 : 167.
2.1.4.1 Sintesis MCM-41 dengan Perbandingan Mol Gel (A) CTAB : Si: H2O = 0,027 : 0,1
: 30
Untuk perbandingan mol gel (A) CTAB : Si : H2O = 0,027 : 0,1 : 30, sebanyak 3,0632 gr CTAB dilarutkan dalam 107 ml aqua DM dan diaduk selama 15 menit dengan pengaduk magnetik strirer pada kecepatan 300 rpm. Kemudian larutan ekstrak Na2SiO3 sebanyak 65,22 ml ditambahkan sedikit demi sedikit ke dalam larutan CTAB dengan menggunakan pipet tetes sambil tetap diaduk. Setelah semua ditambahkan, campuran dua larutan tersebut diaduk pada kecepatan 300 rpm selama 30 menit. Setelah pengadukan 30 menit akan terbentuk gel dengan perbandingan mol gel (A) CTAB : Si : H2O = 0,027 : 0,1 : 30, kemudian diturunkan pHnya sekitar 10,5 dengan menambahkan asam sulfat (H2SO4) 2N dan akan terbentuk suspensi. Selanjutnya suspensi yang dihasilkan dimasukkan ke dalam 4 botol polipropilen dan dimasukkan ke dalam oven dengan variasi waktu, yakni: 96, 144, 192, dan 240 jam pada suhu 100 °C. Setelah itu suspensi dalam botol polipropilen didinginkan sebelum disaring dan dicuci. Setelah dingin, suspensi disaring dan dicuci dengan aqua DM dan etanol berulang-ulang, sambil dicek pH filtratnya adalah 7. Setelah pH tercapai, material dipindahkan ke dalam cawan dan dimasukkan ke dalam oven pada suhu 100 °C selama 12 jam. Material didinginkan dan dihaluskan, sebelum dikalsinasi dalam furnace pada suhu 550 °C selama 6 jam. Hasil yang diperoleh dikarakterisasi dengan XRD, SEM, FTIR, FTIR-piridin dan adsorpsi/desorpsi nitrogen.
2.1.4.2 Sintesis MCM-41 dengan Perbandingan Mol Gel (B) CTAB: Si : H2O = 0,15 : 1 :
167
Untuk perbandingan mol gel (B) CTAB : Si : H2O = 0,15 : 1 : 167, sebanyak 6,8044 gr CTAB dilarutkan dalam 130,5 ml aqua DM dan diaduk selama 15 menit dengan pengaduk magnetik strirer pada kecepatan 300 rpm. Kemudian larutan ekstrak Na2SiO3 sebanyak 260 ml ditambahkan sedikit demi sedikit ke dalam larutan CTAB dengan menggunakan pipet tetes sambil tetap diaduk. Setelah semua ditambahkan, campuran dua larutan tersebut diaduk pada kecepatan 300 rpm selama 30 menit. Setelah pengadukan 30 menit akan terbentuk gel dengan perbandingan mol gel (B) CTAB : Si : H2O = 0,15 : 1 : 167, kemudian diturunkan pHnya sekitar 10,5 dengan menambahkan asam sulfat (H2SO4) 2N dan
Prosiding KIMIA FMIPA - ITS
akan terbentuk suspensi. Selanjutnya suspensi yang dihasilkan dimasukkan ke dalam 4 botol polipropilen dan dimasukkan ke dalam oven dengan variasi waktu, yakni: 96, 144, 192, dan 240 jam pada suhu 100 °C. Setelah itu suspensi dalam botol polipropilen didinginkan sebelum disaring dan dicuci. Setelah dingin, suspensi disaring dan dicuci dengan aqua DM dan etanol berulang-ulang, sambil dicek pH filtratnya adalah 7. Setelah pH tercapai, material dipindahkan ke dalam cawan dan dimasukkan ke dalam oven pada suhu 100 °C selama 12 jam. Material didinginkan dan dihaluskan, sebelum dikalsinasi dalam furnace pada suhu 550 °C selama 6 jam. Hasil yang diperoleh dikarakterisasi dengan XRD, FTIR, FTIR-piridin, adsorpsi/desorpsi Nitrogen, dan SEM.
III HASIL DAN PEMBAHASAN
3.1 Identifikasi Kandungan Mineral Abu Layang Batubara dari PT. IPMOMI Paiton
Hasil analisa komposisi kimia dan kandungan fasa mineral dari abu layang dapat dilihat pada Tabel 3.1 dan Gambar 3.1. Dari Tabel 3.1 menunjukkan bahwa silika merupakan senyawa utama yang terkandung dalam abu layang batubara Paiton sebesar 33,3%, sedangkan alumina hanya sekitar 14%. Jadi total kandungan silika-aluminanya hanya 47,3%. Komposisi senyawa lain yang tidak dibutuhkan dalam sintesis MCM-41 justru lebih besar dari total komposisi silika-aluminanya, terutama Fe
2O3 dan CaO. Besi oksida (Fe
2O3) diketahui kandungannya mencapai 26,2 % dan kalsium oksida (CaO) 22,1 %. Fe
2O3 dan CaO dalam abu layang akan berpengaruh negatif terhadap sintesis MCM-41 karena akan menghambat proses kristalisasi yang menyebabkan proses kristalisasi tidak stabil.
Penggolongan abu layang didasarkan pada kandungan kimianya. Tabel 3.1 menunjukkan total kandungan SiO
2 dan Al2O3 sebesar 47,3 %, kandungan CaO sebesar 22,1 %, dan total kandungan SiO
2, Al2O3 dan Fe
2O3 sebesar 73,5 %. Berdasarkan ASTM (2004) abu layang dengan kandungan SiO
2, Al2O3 dan Fe2O3 lebih besar dari 70 % termasuk abu layang kelas F dan abu layang yang digunakan pada penelitian ini telah memenuhi syarat sebagai abu layang kelas F. Menurut, Sindhunata (2006), abu layang dengan total kandungan SiO
2 dan Al2O3 kurang dari 80% adalah termasuk abu layang kelas C, dan abu layang yang digunakan pada penelitian ini memiliki kandungan SiO
2 dan Al2O3 sebesar 47,3 %. Selain itu, jenis abu layang juga dibedakan berdasarkan kandungan CaO nya. Sedangkan, menurut Hoffman (2000), abu layang dengan kandungan CaO lebih dari 15 % termasuk abu layang kelas C. Maka abu layang batubara Paiton yang digunakan pada penelitian ini adalah termasuk abu layang kelas C.
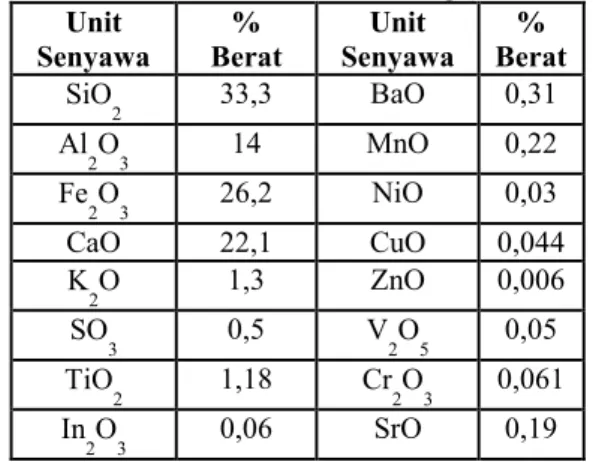
Tabel 3.1 Komposisi Kimia Abu Layang dari PT. IPMOMI Paiton Sebelum Proses Leaching (Metode XRF)
Unit Senyawa % Berat Unit Senyawa % Berat SiO 2 33,3 BaO 0,31 Al 2O3 14 MnO 0,22 Fe 2O3 26,2 NiO 0,03 CaO 22,1 CuO 0,044 K 2O 1,3 ZnO 0,006 SO 3 0,5 V2O5 0,05 TiO 2 1,18 Cr2O3 0,061 In 2O3 0,06 SrO 0,19 Kandungan fasa mineral abu layang ditunjukkan pada Gambar 3.1. Fasa kristal yang teridentifikasi, yakni kuarsa (SiO
2) pada 2θ = 20,80 ; 26,42 ; 36,38 ; 40,70 dan mullit (3Al
2O3.2SiO2) pada 2θ = 31,04 ; 33,12 ; 35,32 serta kalsit (CaO) pada 2θ = 42,76. Keberadaan mineral-mineral tersebut sesuai dengan data PDF nomor 05-0490 untuk kuarsa dan 01-0613 untuk mullit.
Gambar 3.1 Pola XRD dari Abu Layang Batubara PT. IPMOMI Paiton
(Q = kuarsa ; M = Mullit ; C = Kalsit)
Komponen SiO
2 dan Al2O3 selain fasa kristal juga terdapat fasa amorf yang ditunjukkan dengan adanya hump di daerah sekitar 2θ = 14,9°-33,4° pada Gambar 3.1. Hump ini mengindikasikan adanya campuran SiO
2, Al2O3 dan komponen lain yang berada dalam fasa amorf (Inada et al., 2005; Mondragon et al., 1989; dan Somerset et al., 2007). Adanya kandungan mineral dalam abu layang diperkirakan berasal dari hasil pembakaran lignite atau
subbituminous batubara atau dihasilkan dari proses
pembakaran abu layang selama melewati konveyor sampai ke pembuangan (Hui dan Chao., 2006).
3.2 Proses Leachingpada Abu Layang
Hasil dari proses leaching terdapat pada Tabel 3.2. Dari tabel 3.2 menunjukkan bahwa
Prosiding KIMIA FMIPA - ITS kandungan Fe
2O3 telah berhasil dikurangi dari 26,2% menjadi 14,9% maka dengan proses leaching ini mampu mengurangi kandungan Fe
2O3 abu layang sekitar 11,3% dan meningkatkan kandungan SiO
2 sebesar 29,7%.
Tabel 3.2 Data Kandungan Kimia Abu Layang Sebelum dan Sesudah Proses Leaching (Metode XRF)
Unit Senyawa Sebelum proses leaching (% berat) Sesudah proses leaching (% berat) SiO 2 33,3 63 Al 2O3 14 14 Fe 2O3 26,2 14,9 CaO 22,1 3,16
Hasil yang didapatkan dari perlakuan ini, jika dibandingkan dengan hasil yang dilakukan oleh Molina dan Poole ternyata hasil berkurangnya kandungan Fe
2O3 lebih kecil. Hasil yang dilakukan Molina dan Poole (2004) pada proses leaching dengan metode pemisahan magnetik sistem dinamis telah berhasil mengurangi kandungan besi sekitar 65%. Perbedaan ini dimungkinkan karena pemisahan magnetik dengan sistem statis kurang baik dan kuat medan magnet yang digunakan kurang kuat sehingga proses pemisahan kandungan besi abu layang tidak optimal dan masih banyak kandungan besi dalam abu layang yang belum terpisah.
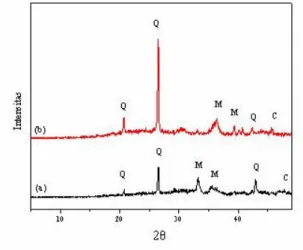
Selain itu, perbandingan pola XRD antara abu layang sebelum dan sesudah proses leaching juga ditunjukkan pada Gambar 3.2.
Gambar 3.2 Pola XRD dari Abu Layang
(a) sebelum proses leaching dan (b) sesudah proses
leaching
(Q = kuarsa ; M = Mullit ; C = Kalsit)
Pada Gambar 3.2 menunjukkan bahwa proses
leaching dengan metode pemisahan magnetik
menyebabkan perubahan intensitas puncak difraksi abu layang terutama pada puncak kuarsa (SiO
2) 2θ = 26,5; dimana abu layang hasil pemisahan magnetik
puncaknya lebih tinggi, tetapi secara keseluruhan tidak menunjukkan adanya perubahan pola difraksi. Hal ini disebabkan karena abu layang mengalami perubahan kandungan kimianya setelah proses
leaching, terutama akibat pengurangan kandungan
besinya dan terjadi peningkatan pada kandungan kuarsanya. Perubahan ini sesuai dengan hasil pada Tabel 3.2, dimana kuarsa (SiO
2) meningkat dari 33,3% menjadi 63%.
3.3
Sintesis MCM-41 dari Abu Layang
Batubara
3.3.1 Ekstraksi Silika dari Abu Layang dengan NaOH (Metode Alkali Fusi)
Metode alkali fusi ini bertujuan untuk mengaktivasi komponen SiO
2 dan dan Al2O3 dalam abu layang dengan basa NaOH pada suhu yang tinggi, sehingga diharapkan komponen abu layang akan berubah struktur dan menjadi garam yang mudah larut dalam air.
Menurut Ojha et al., (2004), reaksi fusi yang terjadi antara komponen abu layang SiO
2 dan Al2O3 dengan NaOH adalah sebagai berikut:
2NaOH (s) + Al 2O3 (s) fusi 2NaAlO 2 (s) + H2O (g) 2NaOH (s) + SiO 2 (s) Na2SiO3 (s) + H2O (g) 10NaOH(s)+2SiO
2.3Al2O3(s) 2Na2SiO3 (s) + 6NaAlO2(s)
+ O
2(g) ……(3.1)
Alkali fusi dilakukan dengan mencampurkam abu layang hasil dari proses leaching dengan NaOH sebagai aktivatornya, dengan perbandingan abu layang : NaOH adalah (1:1,2). Abu layang dicampur dengan NaOH dalam stainles steel krusibel hingga tercampur merata, lalu dimasukkan dalam furnace dan dipanaskan pada suhu 750oC selama semalam. Selanjutnya, didinginkan dalam desikator dan dihaluskan. Penggunaan stainles steel krusibel sebagai tempat reaksi fusi bertujuan untuk menghindari kontaminasi dengan tempat reaksinya, dimana stainles steel mempunyai sifat kestabilan yang kuat terhadap pemanasan pada suhu tinggi. Sedangkan NaOH yang digunakan berfungsi sebagai mineralizer yang dapat meningkatkan proses pelarutan. Hal ini disebabkan karena kapasitas air murni sebagai pelarut seringkali tidak mampu melarutkan Si dan Al dalam proses pelarutan abu layang pada temperatur tinggi.
Hasil yang diperoleh dari perlakuan alkali fusi disebut massa fusi. Massa fusi yang didapatkan berupa padatan berwarna hijau keabu-abuan. Ini menunjukkan bahwa komponen abu layang dengan NaOH telah mengalami reaksi peleburan dan telah berubah struktur menjadi garam alkali. Warna hijau pada massa fusi ini kemungkinan diakibatkan oleh adanya komponen besi pada abu layang yang mengalami perubahan bilangan oksidasi dari Fe3+ menjadi Fe2+ ketika proses pendinginan setelah reaksi
Prosiding KIMIA FMIPA - ITS
fusi. Hal ini diperkuat dengan hasil yang telah dilakukan sebelumnya, dimana proses leaching pada abu layang hanya mampu mengurangi kandungan besi sekitar 11,3 % dari berat awal dan dari Tabel 3.2 yang menunjukkan kandungan besi pada abu layang masih tinggi.
Massa fusi yang diperoleh dimasukkan ke dalam botol polipropilena dan ditambahkan aqua DM sebanyak 127,5 ml, lalu distirer pada kecepatan 300 rpm selama 24 jam pada suhu kamar (Misran et al., 2006). Penggunaan botol polipropilena bertujuan untuk menghindari terjadinya kontaminasi silika terlarut dari sumber lain seperti peralatan kaca ketika proses desilifikasi. Menurut Ojha et al., (2004), proses pelarutan massa fusi campuran abu layang-NaOH dengan aquades ditunjukkan pada persamaan reaksi yang berikut :
Na
2SiO3(s) + H2O(l ) Na2SiO3(aq)
NaAlO
2(s) + 2H2O(l) NaAl(OH)4(aq)..…(3.2)
Massa fusi yang didapatkan mengandung garam natrium metasilikat (Na
2SiO3) dan natrium aluminat (NaAlO
2). Natrium metasilikat merupakan garam alkali yang mempunyai sifat mudah larut dalam air pada suhu rendah dan hanya dapat bereaksi dalam air pada suhu tinggi. Sedangkan natrium aluminat adalah garam yang mempunyai sifat mudah larut dalam air meskipun pada suhu rendah.
Campuran hasil pelarutan Si dan Al kemudian difiltrasi untuk mendapatkan filtratnya. Filtrat yang telah terpisah dari endapannya diambil sebagian untuk dianalisa konsentrasi Si, Al dan Na terlarutnya menggunakan metode ICP-AES. Hasil analisanya ditampilkan pada Tabel 3.3. Filtrat yang didapatkan berupa cairan berwarna hijau. Kemungkinan warna hijau ini diakibatkan oleh adanya besi (Fe) yang ikut larut ketika proses pelarutan Si dan Al. Besi yang menyebabkan warna larutan menjadi hijau adalah ion Fe2+ yang mempunyai sifat tidak stabil dan teroksidasi oleh udara menjadi Fe3+. Ini terbukti ketika filtrat dibiarkan beberapa saat, warnanya berubah menjadi kuning dan pada dasar larutan terdapat endapan berwarna coklat. Endapan coklat tersebut diperkirakan merupakan endapan dari Fe(OH)
3 (s).
Tabel 3.3 Data Konsentrasi Si, Al, dan Na Terlarut (Metode ICP-AES).
No Unsur Terlarut Konsentrasi Filtrat
(ppm)
1 Si 134,061
2 Al 8,204
3 Na 553,489
3.3.2 Sintesis MCM-41 dengan Perbandingan Mol Gel (A) CTABr : Si : H2O = 0,027 : 0.1 : 30
dan (B) 0,15 : 1 : 167 dengan Metode Hidrotermal
Sintesis MCM-41 dengan perbandingan mol gel (A) CTABr : Si : H2O = 0,027 : 0.1 : 30, diawali dengan melarutkan 3 gr CTABr sebagai templat pengarah (prekursor) susunan heksagonal MCM-41 dengan cara membentuk misel-misel dalam 107 ml aqua DM dan distirer pada kecepatan 300 rpm selama 30 menit. Sedangkan untuk sintesis dengan perbandingan mol gel (B) CTABr : Si : H2O = 0,15 : 1 : 167, diawali dengan melarutkan 6,8 gr dalam 130,5 ml aqua DM. Peningkatan konsentrasi misel selanjutnya akan mengubah misel-misel yang berbentuk seperti tabung menjadi struktur kristal cair yang merupakan struktur MCM-41 (Zhao et al., 1996). Selanjutnya, masing-masing ditambahkan larutan ekstrak Na
2SiO3 65,22 ml untuk perbandingan mol gel (A) dan 260 ml untuk perbandingan mol gel (B) sedikit demi sedikit menggunakan pipet tetes untuk menyempurnakan penyebaran Si ke semua bagian misel yang terbentuk. Campuran homogen yang jernih berubah menjadi gel dan menghasilkan gel dengan komposisi molar berbeda, yakni: (A) CTABr : Si : H2O = 0,027 : 0.1 : 30 dan (B) 0,15 : 1 : 167. Seperti yang telah dilaporkan oleh Zhaoet al., (1996), fenomena ini menunjukkan terjadinya keseluruhan mekanisme proses sintesis MCM-41 yang dapat terjadi melalui dua kemungkinan mekanisme, yakni : (1) melalui mesofase kristal cair yang terbentuk sebelum ditambahkan spesi silika, dan (2) melalui penambahan spesi silika pada campuran reaksi sebelum pembentukan kristal cair yang dapat mempengaruhi keteraturan dari misel yang berbentuk seperti tangkai/batang pada fase kristal cair yang diinginkan, seperti misalnya mesofase heksagonal. Pada perlakuan ini memungkinkan terjadinya proses sintesis MCM-41 melalui mekanisme yang kedua, dimana keteraturan misel yang berbentuk seperti tangkai/batang secara acak berinteraksi dengan spesi silika dari interaksi Coulombic pada campuran reaksi optimal untuk menghasilkan kira-kira dua atau tiga
monolayer dari penggumpalan silika disekitar
permukaan eksternal misel (Zhao et al., 1996). Selanjutnya ditambahkan asam sulfat (H2SO4) 2N secara pelan-pelan untuk menurunkan pHnya sampai mencapai pH 10-11 sambil terus distirer pada kecepatan 300 rpm selama 30 menit. Campuran reaksi berubah menjadi suspensi. Spesi organik yang ditambahkan dalam reaksi gel dapat dilarutkan ke dalam bagian hidrofobik dari misel, yang menyebabkan peningkatan diameter misel sehingga dapat meningkatkan ukuran pori dari MCM-41 yang terbentuk (Beck et al., 1992).
Setelah itu, suspensi yang dihasilkan dengan komposisi gel (A) dan (B) dimasukkan ke dalam 4 botol polipropilen dengan pembagian yang sama rata dan ditutup rapat, kemudian dipanaskan dalam oven dengan variasi waktu hidrotermal, yakni : 96, 144,
Prosiding KIMIA FMIPA - ITS
192, dan 240 jam pada suhu 100 °C. Pada perlakuan ini terjadi proses kristalisasi yang diharapkan terbentuknya material mesopori MCM-41 dengan struktur dan morfologi yang teratur. Mokaya, (2001) melaporkan bahwa dengan meningkatnya waktu kristalisasi hidrotermal dapat mempengaruhi struktur dan transformasi morfologi dari MCM-41 selama proses sintesis.
Hasilnya lalu didinginkan pada suhu kamar, lalu difiltrasi dan dicuci dengan aqua DM dan etanol berulang kali sambil diperiksa pH filtratnya mencapai 7. Proses pencucian bertujuan untuk menghilangkan sebagian surfaktan dan pengotor lain agar material padatan tidak bercampur dengan mineral-mineral lain yang terdapat dalam air. Material padatan yang diperoleh dipindahkan ke cawan lalu dikeringkan pada suhu 100oC selama 12 jam untuk menghilangkan sisa reaktan dan air yang masih ada dalam padatan tersebut. Setelah dikeringkan, padatan didinginkan dan dihaluskan lalu dikalsinasi dalam furnace pada suhu 550°C selama 6 jam. Hasil akhir yang diperoleh merupakan material mesopori MCM-41, yang berupa serbuk berwarna putih.
Hasil kalsinasi dari sintesis MCM-41 dengan dua perbandingan mol berbeda yang diperoleh, dikarakterisasi dengan menggunakan XRD, SEM, FT-IR, adsorpsi/desorpsi Nitrogen, dan dikarakterisasi sifat keasamannya dengan FTIR piridin.
3.4 Karakterisasi MCM-41
3.4.1 Hasil Karakterisasi MCM-41 dengan XRD
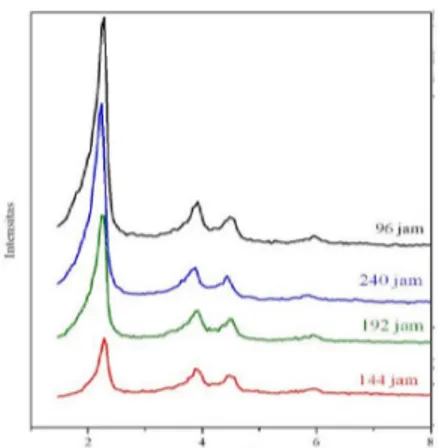
Pola difraksi sinar-X (XRD) dari sampel MCM-41 dengan perbandingan mol gel (A) ditunjukkan pada gambar 3.3. yang menunjukkan adanya puncak karakteristik MCM-41 dengan variasi waktu hidrotermal, yakni : 96, 144, 192, dan 240 jam terjadi pada 2θ = 1,5-6,01°. Puncak karakteristik yang tajam pada 2θ = 1,5-2,3° menunjukkan indikasi terbentuknya struktur MCM-41 yang merupakan refleksi bidang [100]. Sedangkan tiga puncak lainnya pada 2θ = 3,6-3,95° merupakan refleksi bidang [110]; 2θ = 4,36-4,6° refleksi bidang [200]; dan 2θ = 5,96-6,01° refleksi bidang [210]. Teramatinya keempat puncak tersebut mengindikasikan struktur pori heksagonal yang dimiliki oleh MCM-41. (Misran et al., 2006).
Pola difraksi sinar-X (XRD) dari sampel MCM-41 dengan perbandingan mol gel (B) dengan variasi waktu hidrotermal, yakni : 96, 144, 192, dan 240 jamditunjukkan pada gambar 3.4. Seperti terlihat pada gambar, teramati adanya puncak karakteristik MCM-41 yang muncul pada 2θ = 1,5-6,01°. Puncak karakteristik yang tajam mengindikasikan terbentuknya struktur MCM-41, terjadi pada 2θ = 1,5-2,36° yang merupakan refleksi bidang [100] dan tiga puncak lainnya pada 2θ = 3,6-4,0° refleksi bidang [110]; 2θ = 4,36-4,6° refleksi bidang [200]; dan 2θ = 5,96-6,1° refleksi bidang [210] (Misran et al., 2006).
Gambar 3.3 Pola XRD MCM-41 dengan Perbandingan Mol Gel (A) CTABr : Si : H2O = 0,027 : 0.1 : 30
Hasil Sintesis Variasi Waktu Hidrotermal 96, 144, 192, dan 240 jam
Gambar 3.4 Pola XRD MCM-41 dengan Perbandingan Mol Gel (B) CTABr : Si : H2O = 0,15 : 1 : 167
Hasil Sintesis Variasi Waktu Hidrotermal 96, 144, 192, dan 240 jam
Dari hasil karakterisasi MCM-41 dengan perbandingan mol gel (A) dan (B) hasil sintesis dengan XRD, keduanya hampir memiliki persamaaan dalam teridentifikasinya puncak karakteristik dari kedua hasil sintesis MCM-41 dengan perbandingan mol gel yang berbeda. Hasil karakterisasi dari MCM-41 hasil sintesis dengan XRD menunjukkan bahwa MCM-41 yang disintesis dengan waktu hidrotermal 96 jam dari kedua perbandingan mol gel yang berbeda (A) dan (B) memiliki intensitas puncak paling tinggi dibandingkan dengan MCM-41 yang disintesis dengan waktu hidrotermal 144, 192, dan 240 jam. Fenomena ini sesuai dengan hasil penelitian yang telah dilakukan oleh Mokaya, (2000) yang melaporkan bahwa waktu kristalisasi yang paling optimal untuk sintesis MCM-41 terjadi pada waktu hidrotermal 96 jam. Hal ini mengindikasikan bahwa waktu kristalisasi yang paling optimal untuk sintesis MCM-41 yang menggunakan sumber silika dari abu layang terjadi pada waktu hidrotermal 96 jam.
Semakin lama waktu hidrotermal, maka semakin tinggi intensitas puncak karakteristiknya. Fenomena ini sesuai dengan hasil penelitian yang telah dilakukan oleh Mokaya, (2000) yang melaporkan bahwa intensitas puncak karakteristik
Prosiding KIMIA FMIPA - ITS
hasil sintesis MCM-41 akan semakin meningkat seiring dengan semakin lamanya waktu hidrotermal. Semakin tinggi intensitas puncak, strukturnya makin bersifat kurang amorf (Gaydhankar et al., 2006). Maka struktur MCM-41 yang disintesis dengan waktu hidrotermal 144 jam bersifat lebih amorf dibandingkan dengan struktur MCM-41 yang disintesis dengan waktu hidrotermal 96, 192, 240 jam.
Selain intensitas puncak yang meningkat, juga terjadi pergeseran puncak 2θ dan d-spacing yang terjadi setelah proses kalsinasi dari kedua hasil sintesis MCM-41 dengan perbandingan mol gel yang berbeda. Untuk nilai 2θ bergeser ke nilai lebih besar dan nilai
d-spacing bergeser ke nilai lebih rendah. Beck et al.,
(1992) dan Chen et al., (1993), melaporkan bahwa peningkatan intensitas puncak setelah kalsinasi mengindikasikan bahwa terjadi reorganisasi atom selama penghilangan molekul surfaktan pada proses kalsinasi dan terjadi kontraksi (penyusutan) dari kisi yang disebabkan oleh hilangnya molekul templat yang selanjutnya terjadi kondensasi gugus silanol (Si-OH) (Chang et al., 1999; Zhao et al., 1996).
Selain itu, hasil karakterisasi MCM-41 menggunakan XRD mengindikasikan bahwa telah diperoleh struktur dengan jarak-panjang dan pori heksagonal dua dimensi yang teratur dari MCM-41, yang diperoleh setelah penghilangan molekul surfaktan (Misran et al., 2006). Hal ini menunjukkan keberhasilan pembentukan struktur pori heksagonal dua dimensi menggunakan natrium silikat yang diperoleh dari material limbah industri, yakni abu layang batubara.
3.4.2 Hasil Karakterisasi MCM-41 dengan FTIR
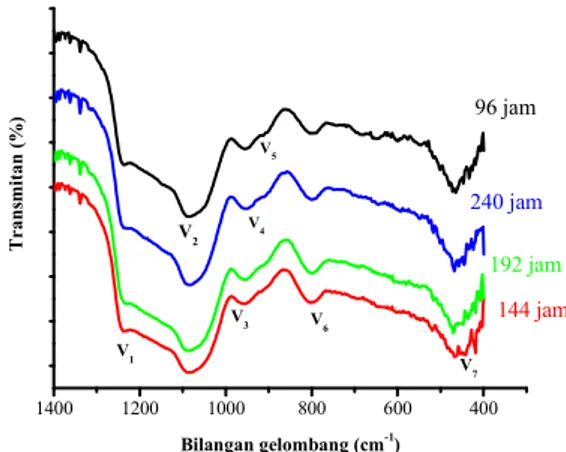
Spektra FTIR dari sampel MCM-41 dengan perbandingan mol gel (A) variasi waktu hidrotermal yang berbeda, yakni 96, 144, 192, dan 240 jam ditunjukkan pada Gambar 3.5.
1400 1200 1000 800 600 400 T r a n sm it a n ( % ) Bilangan gelombang (cm-1 ) 96 jam 192 jam 240 jam 144 jam V7 V1 V2 V3 V4 V6 V 5
Gambar 3.5 Spektra FTIR dari MCM-41 41 dengan Perbandingan Mol Gel (A) CTABr : Si : H2O
= 0,027 : 0.1 : 30
Karakterisasi hasil sintesis MCM-41 dengan FTIR hampir memiliki kesamaan dari keempat variasi waktu hidrotermal tersebut dalam teridentifikasinya
pita absorpsi disekitar 1082-1085 cm-1 (V2) merupakan pita vibrasi ulur Si-O asimetris dari kerangka SiO4 (TO4) yang tampak sebagai pita kuat pada spektra semua silika. Menurut Kresge et al.,
(1992), adanya pergeseran pita absorpsi sekitar 1082-1085 cm-1 setelah proses kalsinasi mengindikasikan terjadinya kontraksi dari ikatan Si-O yang terbentuk selama proses kalsinasi. Pada pita absorpsi 796-800 cm-1 (V6) merupakan pita vibrasi ulur Si-O simetris. Pada pita absorpsi 464-470 cm-1 (V7) merupakan pita vibrasi tekuk dari permukaan gugus Si-O-. Dengan adanya daerah serapan pada gugus Si-O-, maka atom O akan berikatan dengan atom H yang merupakan serapan spesifik dari MCM-41 (Jermi dan Pandurangan, 2006).
Pada pita absorpsi 912-954 cm-1 (V3 , V4 ,dan V5) merupakan pita vibrasi ulur dari permukaan gugus Si-O- dengan adanya gugus silanol (Si-OH) pada sisi
defect dan mengindikasikan masuknya heteroatom ke
dalam jaringan MCM-41 (Laha, 2002). Pada pita absorpsi 912-954 cm-1 (V3 , V4 ,dan V5) juga dapat ditetapkan sebagai vibrasi ulur Si-O dari gugus SiO-R+, dimana R+ = H+ setelah proses kalsinasi. Sedangkan pada pita absorpsi 1230-1236 cm-1 (V1) merupakan pita vibrasi ulur Si-O-Si, terjadinya pengurangan intensitas dari pita serapan tersebut mengindikasikan kemungkinan terjadinya penyusunan ulang dari dinding struktur MCM-41 pada suhu tinggi selama proses kalsinasi (Chang et al., 1999). Hal tersebut juga sesuai dengan yang dilaporkan oleh Hui dan Chao (2006), Chen et al., (1993) dan Chaudhari, (2000) juga melaporkan bahwa pada daerah pita serapan antara 400-1300 cm-1 terdeteksi lima puncak utama dengan daerah pita absorpsi sekitar 1230-1236, 1082-1085, 912-954, 796-800 dan 464-470 cm-1 yang merupakan spektra dari silika amorf.
Sedangkan spektra FTIR dari sampel MCM-41 dengan perbandingan mol gel (B) variasi waktu hidrotermal yang berbeda, yakni 96, 144, 192, dan 240 jam ditunjukkan pada Gambar 3.6.
1400 1200 1000 800 600 400 10 15 20 25 30 35 40 45 T ra n sm it a n ( % ) Bilangan gelombang (cm-1) 96 jam 192 jam 240 jam 144 jam V1 V2 V3 V4 V5 V 6 V7
Gambar 3.6 Spektra FTIR dari MCM-41 41 dengan Perbandingan Mol Gel (B) CTABr : Si : H2O
Prosiding KIMIA FMIPA - ITS
Hasil karakterisasi dengan FTIR terhadap hasil sintesis MCM-41 dengan perbandingan mol gel (B) juga hampir sama dengan hasil sintesis MCM-41 dengan perbandingan mol gel (A) yang dapat terlihat dari kesamaan puncak pita absorpsinya, seperti yang telah dijelaskan dengan adanya pita absorpsi yang spesifik dari hasil sintesis MCM-41 dengan perbandingan mol gel CTABr : Na
2SiO3 : H2O = 0,027 : 0.1 : 30.
3.4.3 Hasil Karakterisasi Sifat Keasaman MCM-41 dengan FTIR Piridin
Sifat keasaman sampel MCM-41 hasil sintesis dilakukan pengukuran dengan menggunakan adsorpsi piridin sebagai molekul penyelidik (probe)
yang didesorpsi pada suhu 150°C dibawah kondisi vakum selama 2 jam. Sebelum adsorpsi piridin, semua sampel MCM-41 diprotonasi dengan dehidrasi dalam kondisi aliran gas N2 pada suhu 300 °C selama 2 jam (Muhamed, 2005). Keasaman sampel MCM-41 hasil sintesis dikarakterisasi dengan FTIR pada panjang gelombang 1400-1700 cm-1.
Tipe sisi keasaman hasil sintesis MCM-41 dengan perbandingan mol gel (A) variasi waktu hidrotermal 96, 144, 192, dan 240 jam dan perbandingan mol gel (B) variasi waktu hidrotermal 144 jam ditunjukkan pada gambar 3.7.
Gambar 3.7 Spektra FTIR Piridin MCM-41 dengan Perbandingan Mol Gel (A) CTABr : Si : H2O
= 0,027 : 0.1 : 30 Variasi Waktu Hidrotermal (a) 96 jam, (b) 144 jam, (c) 192 jam, (d) 240 jam; dan Perbandingan Mol Gel (B) CTABr : Si : H2O = 0,15 : 1 : 167 Variasi Waktu
Hidrotermal (e) 144 jam.
Pada Gambar 3.7. terlihat adanya tiga puncak pada bilangan gelombang 1446 cm-1 (sisi asam Lewis), 1491 cm-1 (sisi asam Brønsted dan Lewis), dan 1548 cm-1 (sisi asam Brønsted). Adanya puncak pada 1446 cm-1 pada spektra FTIR piridin MCM-41 merupakan puncak dari piridin terkoordinasi yang mengindikasikan adanya sisi asam Lewis. Adanya puncak pada 1548 cm-1 pada spektra FTIR piridin MCM-41 mengindikasikan adanya sisi asam Brønsted dari puncak vibrasi ulur ion piridinium (Mäki et al., 2004; Mokaya dan Jones, 1997). Sedangkan adanya puncak pada 1491 cm-1 pada spektra FTIR piridin
MCM-41 mengindikasikan adanya piridin yang berikatan dengan gabungan asam Lewis dan asam Brønsted (Selvaraj dan Pandurangan, 2004). Selain itu, Gambar 3.7. juga menunjukkan bahwa MCM-41 hasil sintesis pada perbandingan mol gel (B) memiliki sifat keasaman yang lebih tinggi jika dibandingkan dengan MCM-41 hasil sintesis pada perbandingan mol gel (A). Hal ini ditunjukkan dengan spektra FTIR pada variasi waktu hidrotermal 144 jam dari kedua perbandingan mol gel yang berbeda tersebut.
Namun, spektra FTIR adsorpsi piridin dari material mesopori MCM-41 mengindikasikan bahwa MCM-41 memiliki sisi asam (sisi asam Lewis dan asam Brønsted ) yang lemah dan kekuatan sisi asam menengah, yang hampir sama dengan silika-aluminium amorphous. Hal ini sesuai dengan penelitian yang dilaporkan oleh Corma et al., (1994) yang melaporkan bahwa spektra adsorpsi piridin untuk MCM-41 terjadi pada puncak 1540 cm-1 yang mengindikasikan adanya sisi asam Brønsted dan pada puncak 1450 cm-1 mengindikasikan adanya sisi asam Lewis. Kedua pengamatan ini sebanding dengan MCM-41 dengan rasio silika-alumina (Si/Al = 2,5). Hal ini juga sesuai dengan hasil karakterisasi menggunakan TPD-NH3, dimana keduanya (hasil spektra adsorpsi piridin dan TPD-NH3) menunjukkan bahwa material MCM-41 yang menggunakan aluminium silikat memiliki sisi asam (sisi asam Lewis dan asam Brønsted ) yang lemah dan kekuatan sisi asam menengah (Corma et al., 1994).
3..4.4 Hasil Karakterisasi MCM-41 dengan
Adsorpsi/Desorpsi Nitrogen
Metode adsorpsi/desorpsi isoterm Nitrogen digunakan untuk mengetahui luas permukaan spesifik, volume pori, dan diameter pori karakteristik dari material mesopori MCM-41. Dengan menggunakan teori BET (Brunauer Emmet Teller) dapat ditentukan luas permukaan spesifik material mesopori MCM-41 (Misran et al., 2006). Luas permukaan spesifik dapat dihitung melalui adsorpsi nitrogen yang didasarkan pada perbedaan kuantitas gas antara sebelum dan sesudah adsorpsi. Dengan cara memplotkan nilai P/Po terhadap 1/{W[Po/P-1]} akan diperoleh nilai slope (S) dan intersep (i) yang digunakan untuk menghitung nilai Wm (jumlah gas nitrogen yang teradsorp pada satu lapisan) dan luas permukaan area permukaan spesifik (∑s).
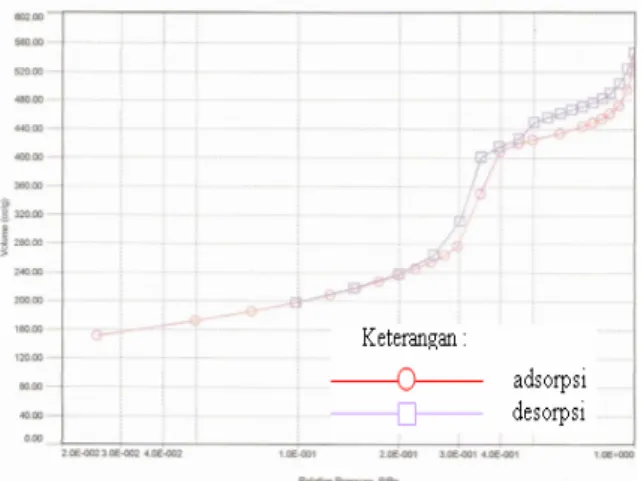
Gambar adsorpsi/desorpsi isoterm Nitrogen hasil sintesis MCM-41 untuk perbandingan mol gel (B) dengan waktu hidrotermal 96 jam dan 144 jam ditunjukkan pada gambar 3.8. dan 3.9. yang diukur dengan nitrogen cair pada temperatur 77,35 K. Dari kedua gambar tersebut menunjukkan kurva adsorpsi tipe IV, yang merupakan bentuk tipe kurva dari mesopori MCM-41 dengan distribusi ukuran pori yang sempit (Hui dan Chao, 2006).
Prosiding KIMIA FMIPA - ITS
Gambar 3.8 Adsorpsi/desorpsi Nitrogen dari MCM-41 (96 jam) hasil sintesis
Gambar 3.9 Adsorpsi/desorpsi Nitrogen dari MCM-41 (144 jam) hasil sintesis
MCM-41 hasil sintesis dengan perbandingan mol gel (B) dengan waktu hidrotermal 96 jam memiliki kurva adsorpsi tipe IV yang berada pada tekanan relatif (P/Po) 0,25-0,6. Sedangkan MCM-41 hasil sintesis dengan perbandingan mol gel (B) dengan waktu hidrotermal 144 jam juga memiliki kurva adsorpsi tipe IV yang berada pada tekanan relatif (P/Po) 0,35 - 0,7. Hal ini mengindikasikan karakteristik dari kondensasi kapiler (pengisian) ke dalam mesopori yang seragam. Selain itu, isoterm dari sampel MCM-41 (96 dan 144 jam) setelah proses kalsinasi menunjukkan hysteresis, yang merupakan karakteristik dari sampel MCM-41 (Mokaya, 2000).
Diameter pori sampel MCM-41 (96 dan 144 jam) dapat ditentukan dengan metode BJH (Barret-Joyner-Halenda) dan luas permukaan sampel MCM-41 (96 dan 144 jam) dapat ditentukan dengan metode isoterm BET (Brunauer Emmet Teller) yang hasilnya ditunjukkan pada Tabel 3.4. Pada Tabel 3.4. menunjukkan bahwa hasil sintesis MCM-41 (96 jam) memiliki luas permukaan sebesar 815,70 m2/g dan diameter pori sebesar 34,03 Å. Sedangkan hasil sintesis MCM-41 (144 jam) memiliki luas permukaan sebesar 887,50 m2/g dan diameter pori sebesar
34,06Å. Fenomena ini mengindikasikan bahwa dengan meningkatnya waktu kristalisasi maka luas permukaan spesifik dan ukuran pori (diameter dan volume pori) juga semakin meningkat, yang disertai dengan meningkatnya ketebalan dinding (Mokaya, 2000).
Tabel 3.4 Data Luas Permukaan, Diameter, dan Volume Pori Sampel MCM-41 dengan Perbandingan Mol Gel (B) CTABr : Si : H2O = 0,15 : 1 : 167
(96 dan 144 jam)
Jika dibandingkan dengan hasil sintesis MCM-41 yang dilakukan oleh Misran et al., (2006) dengan menggunakan sumber silika murni, maka luas permukaan spesifik dan diameter pori dari MCM-41 dengan sumber silika murni sebesar 1100 m2/g dan 2,7 nm, sedangkan luas permukaan spesifik dan diameter pori dari MCM-41 dengan sumber silika dari abu layang sebesar 732 m2/g dan 2,5 nm. Hal ini menunjukkan bahwa luas permukaan spesifik dari MCM-41 dengan sumber silika dari abu layang lebih rendah 33% jika dibandingkan dengan luas permukaan spesifik dari MCM-41 dengan sumber silika murni. Fenomena ini mengindikasikan bahwa luas permukaan spesifik dari hasil material mesopori sangat bergantung pada kereaktifan dari sumber silika yang dipilih, dengan prekursor silika murni menghasilkan luas permukaan spesifik yang lebih tinggi. Namun diameter pori dari kedua material tersebut sebanding, yakni sebesar 2,5 nm dan 2,7 nm (Misran et al., 2006).
3.4.5 Hasil Karakterisasi MCM-41 dengan SEM
Foto SEM sampel MCM-41 dengan perbandingan mol gel (A) dengan waktu hidrotermal 144 jam dan sampel MCM-41 dengan perbandingan mol gel (B) dengan waktu hidrotermal 240 jam ditunjukkan pada Gambar 3.10, yang ditampilkan dalam pembesaran 10.000x dan 20.000x. Sebagai pembanding juga diperlihatkan foto SEM dari MCM-41 dengan perbandingan mol gel CTABr : Na
2SiO3 : H2O = 0,15 : 1 : 167 (120 jam) setelah kalsinasi (Misran et al., 2006).
Pada Gambar 3.10., terlihat morfologi hasil sintesis MCM-41 dengan perbandingan mol gel (A) dengan waktu hidrotermal 144 jam dan perbandingan mol gel (B) dengan waktu hidrotermal 240 jam sama dengan morfologi dari MCM-41 yang dilaporkan oleh Misran et al., (2006) yang merupakan morfologi karakteristik dari material MCM-41. Hasil foto SEM sampel MCM-41 dengan sumber silika dari abu layang menunjukkan bahwa padatan hasil sintesis
MCM-41 hasil sintesis variasi waktu hidrotermal Luas permu-kaan BET (m2/g) Diame-ter pori (Ǻ) Volume pori (cm3/g) 96 jam 815,70 34,03 0,18 144 jam 887,50 34,06 0,27
Prosiding KIMIA FMIPA - ITS
merupakan kumpulan butiran-butiran partikel dengan morfologi seragam berdiameter kurang lebih 200 nm (Misran et al., 2006).
Gambar 3.10 Foto SEM dari MCM-41 (a1 dan a2)
Perbandingan Mol Gel (A) CTABr : Si : H2O = 0,027 : 0.1 : 30 (144 jam), (a3 dan
a4) Perbandingan Mol Gel (B) CTABr : Si
: H2O = 0,15 : 1 : 167 (240 jam), dan (b)
Perbandingan Mol Gel CTABr : Si : H2O =
0,15 : 1 : 167 (120 jam) (Misran et al., 2006).
IV KESIMPULAN
MCM-41 telah berhasil disintesis menggunakan sumber silika dari abu layang batubara PT. IPMOMI Paiton dengan dua perbandingan mol gel yang berbeda yakni: (A) CTAB : Si : H2O = 0,027 : 0,1 : 30 dan (B) 0,15 : 1 : 167 dan variasi waktu hidrotermal, yakni 96, 144, 192, dan 240 jam pada temperatur 100°C telah berhasil dilakukan. Padatan hasil sintesis berupa serbuk putih. Hasil karakterisasi menggunakan XRD, FTIR, dan adsorpsi/desorpsi isoterm Nitrogen menunjukkan bahwa padatan hasil sintesis memiliki karakter sama dengan padatan MCM-41 yang ditandai dengan adanya puncak karakteristik difraktogram pada 2θ sekitar 1,5-2,36°, 3,6-4,0°, 4,36-4,6°, dan 5,96-6,1°; memiliki luas permukaan spesifik 815,70-887,50 m2/g; dan diameter pori 34,03-34,06 Ǻ. Hasil foto SEM menunjukkan bahwa padatan hasil sintesis merupakan kumpulan butiran-butiran partikel dengan morfologi seragam berdiameter kurang lebih 200 nm. Waktu kristalisasi optimum untuk sintesis MCM-41 terjadi pada waktu hidrotermal 96 jam. Pengukuran sifat keasaman dengan FTIR piridin menunjukkan bahwa padatan hasil sintesis MCM-41 memiliki sisi asam Lewis dan sisi asam Brønsted karena adanya logam dalam kerangka MCM-41 yang dapat meningkatkan sifat keasamannya.
DAFTAR PUSTAKA
Beck, J.S.; Vartuli, J.C.; Roth, W.J.; Leonowicz, M.E.; Kresge, C.T.; Schmitt, K.D.; Chu, C.T-W.; Olson, D.H.; Sheppard, E.C.T-W.; McCullen, S.B.; Higgins, J.B.; Schlenker, J.L., (1992), A New Family of Mesoporous Molecular Prepared with Liquid Crystal Templates, American Chemichal Society, Vol. 144, pp. 10834-10843
Chang, H.L.; Chun C.M; Aksay I.A.; Shih W.H., (1999), Conversion of Fly Ash into Mesoporous Aluminosilicate, Industrial Engineering Chemistry Research, Vol.38, pp. 973-977
Chang, H.L.; Shih W.S., (2000), Synthesis of Zeolites A and X from Fly Ashes and their Ion-Exchange Behaviour with Cobalt Ions, Industrial Engineering Chemistry Research, Vol.39, pp. 4185-4191
Chaudhari, K., (2000), Synthesis, Characterization and Catalytic Properties of Mesoporous Molecular Sieves, Thesis for The Degree of Doctor of Philosophy, Catalysis Division, University of Pune India
Chen, C.Y.; li. H.Y.; Davis, M.E., (1993), Studies on
Mesoporous Materials II: Synthesis
Mechanism of MCM-41, Microporous
Material, Vol. 2, pp. 27
Gaydhankar, T.R.; Samuel, V.; dan Joshi, P.N., (2006), Hydrothermal Synthesis of
MCM-41 Using Differently Manufactured
Amorphous Dioxosilicon Sources, Material Letters, Vol. 60, pp. 957-961
Hoffman, G.K., (2000), Fly Ash Usage in the Western United States, NM Bureau of
Mines & Mineral Resources,
http://www.wrashg.org
Hui, K.S.; Chao, C.H.Y., (2006), Synthesis of MCM-41 from Coal Fly Ash by Green Approach: Influence of Sythesis pH, Journal of Hazardous Material B, Vol. 137, pp. 1135-1148
Inada, M.; Tsujimoto, H.; Eguchi, Y.; Enomoto, E.; dan Hojo, J., (2005), Microwave-Assisted Zeolite Synthesis From Coal Fly Ash in Hydrothermal Process, Fuel, Vol. 84, pp. 1482-1486
Jermi, Rabindran B., dan Pandurangan, A., (2006), Al-MCM-41 as an Efficient Heterogeneous
Catalyst in the Acetalization of
Cyclohexanone with Methanol, Ethylene Glycol and Pentaerythritol, Journal of
(a1) (a2)
Prosiding KIMIA FMIPA - ITS
Moleculer Catalysis A: Chemical,Vol. 256, pp. 184-192
Kresge, C.T.; Leonowicz, M.E.; Roth, W.J.; Vartuli, J.C.; Beck, J.S., (1992), Ordered
Mesoporous Crystalline Material, US
Patent, Vol. 5, pp. 359, 710
Kresge, C.T.; Leonowicz, M.E.; Roth, W.J.; Vartuli, (1992), Synthetic Mesoporous Crystalline Material, US Patent, Vol. 5, 098, 684 Kumar, P.; Mal, N.; Oumi, Y.; Yamana, K.; Sano, T.,
(2001), Mesoporous Materials Prepared using Coal Fly Ash as the Silicon and Aluminium Source, Journal of Material Chemistry, Vol. 11, pp. 3285-3290
Laha, S.C., (2002), Mosoporous and Microporous
Metalo-Silicate & Organo-Silicate
Molecular Sieves: Synthesis,
Characterization and Catalytic Properties, Thesis for The Deggree of Doctor of Philosophy University ofPune India
Mimura, H.; Yokota, K.; Akiba, K.; Onodera, Y., (2001), Alkali Hydrothermal Synthesis of Zeolites from Coal Fly Ash and their uptake Properties of Cesium Ion, Journal of Nuclear Science Technology, Vol. 38, pp. 766-772
Misran, Halina; Singh, Ramesh; Begu, Shahida; Yarmo, M.A., (2006), Processing of Mesoporous Silica Materials (MCM-41) from Coal Fly Ash, Journal of Material Processing Technology, Vol. 186, pp. 8-13 Mokaya, Robert, (2000), Hydrothermally-Induced
Morphological Transformation of
Mesoporous MCM-41 Silica, Microporous Mesoporous Material, Vol. 44-45, pp. 119-127
Molina, A. dan Poole, C., (2004), A Comparative Study Using Two Methods To Produce
Zeolites from Fly Ash, Minerals
Engineering, Vol. 17, pp. 167–173
Mondragon, F.; Rincon, F.; Sierra, L.; Escobar, J.; Ramirez, J.; dan Fernandez, J., (1989), New Perspectives For Coal Fly Ash Utilization: Synthesis of Zeolite Material, Departement of Chemistry, University of Antioquia, Columbia
Mouhtaris, T.; Charistos, D.; Kantiranis, N.; Fillipidis, A.; Kassoli-Fournaraki, A.; Tsirambidis, A., (2003), GIS-Type Synthesis from Greek Lignite Sulphocalcic Fly Ashes Promoted
by NaOH Solution, Microporous
Mesoporous Material, Vol. 61, pp. 57-67 Ojha, K.; Pradhan, N.; dan Samanta, A. N., (2004),
Zeolite from Fly Ash: Synthesis and Characterization, Bulletin MaterialScience, Indian Academy of Sciences, Vol. 27 (6), pp. 555-564
Perera, S. Dan.;Trautman; Rachel, L., (2006),
Geopolymers with the Potential for Use as Refractory Castables, Azojomo, Vol. 2, pp. 127-135
Querol, X.; Moreno, N.; Umana, J.C.; Alastuey, A.; Hernandez, E.; Lopez-Soler, A.; Plana, F., (2002), Synthesis of Zeolites from Fly Ash in Pilot Plant Scale: Examples of Potential Enviromental Applications, Coal Geology, Vol. 50, pp. 413-423
Sindhunata, (2006), A Conceptual Model of
Geopolymerisation Department of
Chemical and Biomolecular Engineering, The University of Melbourne, Australia Somerset, V.; Petrik, L.; dan Iwuoha, E., (2007),
Alkaline Hydrothermal Conversion of Fly Ash Precipitates Into Zeolites: The Removal of Mercury and Lead Ions From Waste Water, Journal of Environment Management, Vol. 01, pp. 1-7
Zhao, Xiu S.; Lu, G.Q. (Max); Millar; Graeme J., (1996), Advances in Mesoporous
Molecular Sieve MCM-41, Industrial
Engineering Chemistry Research, Vol. 35, pp. 2075-2090
UCAPAN TERIMA KASIH
1. Ibu Dra. Ratna Ediati, MS, Ph.D, selaku dosen pembimbing atas segala diskusi, bimbingan, arahan dan semua ilmu yang bermanfaat.
2. Abi, mama, dan adik-adikku trcinta, atas semua doa, motivasi, dan kasih sayangnya
3. Rekan-rekan tugas akhir (tim penelitian MCM-41) S1 dan S2 Kimia ITS
4. Serta pihak-pihak lain yang tidak dapat disebutkan satu persatu.