PENDAHULUAN
Latar Belakang
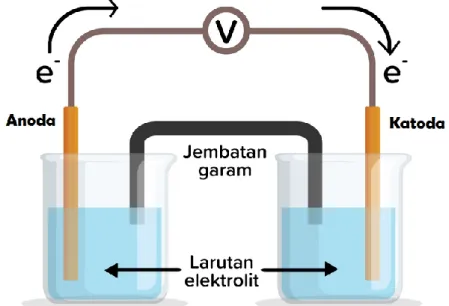
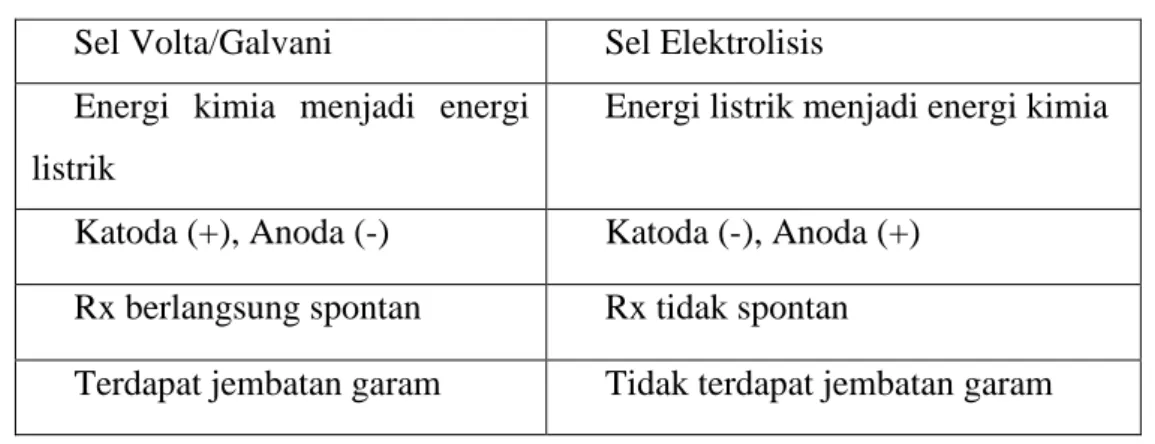
Perubahan zat berupa reaksi kimia terjadi pada sel elektrokimia yang merupakan reaksi redoks. Oleh karena itu, elektrolisis adalah proses penguraian suatu senyawa dengan mengalirkan arus listrik melaluinya. Dalam sel volta, reaksi redoks terjadi secara spontan dan energi kimia yang menyertai reaksi kimia tersebut diubah menjadi energi listrik.
Sedangkan elektrolisis merupakan reaksi sebaliknya dimana potensial sel bernilai negatif atau dapat dikatakan pada kondisi normal tidak akan terjadi reaksi dan reaksi akan berlangsung jika diinduksi dengan energi listrik luar (Afandi, Rijal, & Aziz, 2017). Hal ini disebabkan karena banyak zat yang tidak terdapat secara bebas di alam, melainkan terkandung dalam senyawa. Contoh zat yang dihasilkan melalui elektrolisis adalah logam alkali, aluminium, unsur halogen, NaOH dan H2O2.
Selain itu, elektrolisis juga dapat digunakan untuk galvanisasi, yang ingin melindungi logam dari karat dan meningkatkan daya tariknya.
Tujuan Percobaan
Sasaran Percobaan
TINJAUAN PUSTAKA
- Elektrokimia
- Sel Volta
- Elektrolisis
- Elektroda
- Elektrolit
- Efisiensi Arus
- Overpotensial Minimum
- Aturan Reaksi Elektrolisis
- Rumus yang Digunakan
Dalam sel volta/galvani, reaksi oksidasi-reduksi terjadi secara spontan dan energi kimia yang menyertai reaksi kimia tersebut diubah menjadi energi listrik. Sedangkan elektrolisis merupakan reaksi kebalikan dari sel volta/galvanik, dimana potensial sel bernilai negatif atau dengan kata lain dalam keadaan normal tidak terjadi reaksi, dan reaksi dapat terjadi apabila diinduksi dengan listrik dari luar (Sari , 2014). ). Proses elektrolisis memisahkan molekul air menjadi hidrogen dan oksigen dengan mengalirkan arus listrik ke elektroda, tempat larutan elektrolit (air dan katalis) berada.
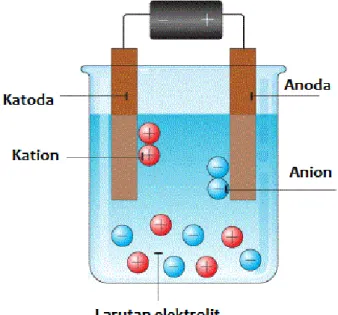
Reaksi elektrolisis tergolong dalam reaksi redoks non spontan, reaksi tersebut dapat berlangsung karena pengaruh energi listrik (Tjatur, 2009). Elektroda adalah konduktor yang digunakan untuk menghubungi bagian atau media non-logam dalam suatu rangkaian (misalnya semikonduktor, elektrolit, atau vakum). Reaksi kimia yang terjadi pada elektroda dalam keadaan konduksi listrik disebut elektrolisis, dan alat yang digunakan untuk reaksi ini disebut sel elektrolitik.
Air merupakan pelarut yang baik untuk senyawa ionik dan memiliki sifat menghantarkan arus listrik. Dalam keadaan tertentu terjadi reaksi oksidasi dengan ion negatif di anoda dengan bahan inert (Au, C dan Pt).
METODOLOGI PERCOBAAN
Alat dan Bahan
- Alat
- Bahan
Variable Percobaan
- Variable Bebas
- Variabel Terikat
Diagram Alir Percobaan
- Persiapan Bahan
- Penentuan Efisiensi Arus dan Konsumsi Energi
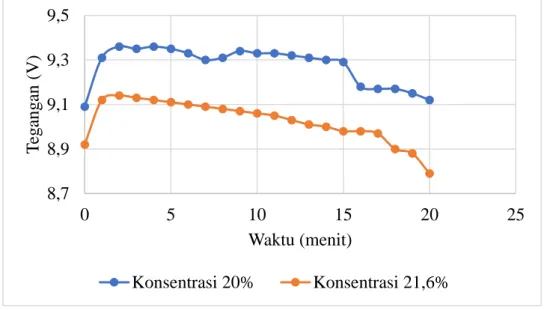
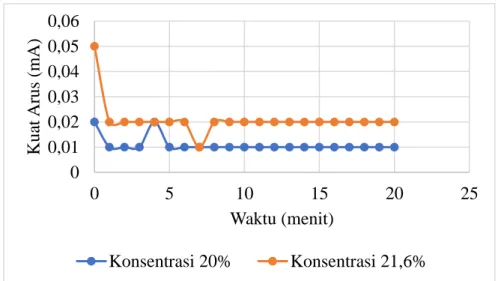
Data yang diperoleh menunjukkan bahwa konsumsi energi untuk larutan elektrolit dengan konsentrasi 21,6% lebih tinggi dibandingkan dengan konsentrasi 20%, yang berarti terdapat hubungan berbanding lurus antara konsentrasi elektrolit dengan konsumsi energi yang dihasilkan. . Nilai efisiensi arus yang diperoleh setelah melakukan perhitungan selanjutnya adalah 108,97% pada konsentrasi elektrolit 20% dan 100,27% pada konsentrasi elektrolit 21,6%. Dari data yang diperoleh pada grafik diatas dapat disimpulkan bahwa semakin lama waktu yang dibutuhkan untuk melakukan proses elektrolisis air maka arus yang dihasilkan tidak mengalami perubahan.
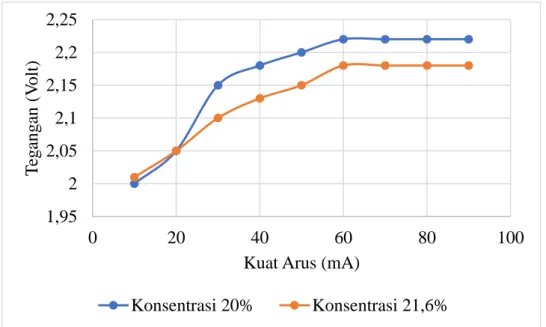
Secara teori, semakin lama waktunya maka arus yang dihasilkan akan semakin berkurang. Dalam percobaan dengan konsentrasi 20% dan kuat arus 10 hingga 60 mA, tegangan meningkat dari 2 volt menjadi 2,2 dan tetap konstan pada 2,22 volt. Selanjutnya pada konsentrasi 21,6% dengan kuat arus 10 sampai 60 mA juga terjadi kenaikan tegangan sebesar 2,01 volt dan tegangan konstan sebesar 2,18 volt.
Semakin lama waktu yang diperlukan untuk melakukan proses elektrolisis air maka arus yang dihasilkan akan semakin kuat, tidak beraturan, setelah berkurang maka akan bertambah lagi. Gas yang dihasilkan pada proses elektrolisis di katoda adalah gas hidrogen (H2) masing-masing sebanyak 1,5 ml pada konsentrasi 20% dan 2,6 ml pada konsentrasi 21,6%, sedangkan di katoda adalah gas klor (Cl2) masing-masing 1 .ml pada konsentrasi 20% dan 0,5 ml pada konsentrasi 21,6.
HASIL DAN PEMBAHASAN
Penentuan Konsumsi Energi (E)
Pada percobaan ini ditentukan konsumsi energi, dimana pada percobaan ini digunakan larutan elektrolit 20% dan 21,6% dengan elektroda batang karbon. 1 Grafik Hubungan Tegangan (V) Dengan Waktu (t) Dari grafik diatas terlihat hubungan waktu kerja dan tegangan pada anoda batang karbon dan katoda karbon dengan konsentrasi larutan elektrolit 20%. Hal ini terjadi karena baterai yang digunakan pada percobaan pertama adalah baterai baru, sedangkan untuk percobaan kedua menggunakan baterai bekas dari percobaan pertama yang seharusnya diperoleh pada saat praktikum yaitu tegangan yang dihasilkan terhadap 'Seharusnya persentase sebesar 21,6% lebih besar dibandingkan pada konsentrasi 20% karena pada saat elektrolisis arus listrik juga dipengaruhi oleh konsentrasi dan waktu yang dibutuhkan kuat arus (Hamid, 2017).
Dari perhitungan di atas terlihat bahwa besarnya energi yang digunakan akan dipengaruhi oleh banyaknya anion dan kation yang terkandung dalam larutan elektrolit. Dimana larutan menyebabkan elektrolit lebih banyak menghantarkan arus listrik, maka semakin besar energi listrik yang digunakan untuk melakukan reaksi elektrolisis. Sehingga semakin banyak molekul air yang terelektrolisis dan gas yang dihasilkan berupa hidrogen dan oksigen semakin banyak (Erlinawati, 2014).
Penentuan Efisiensi Arus (𝜼)
Berdasarkan Gambar 4.2 yaitu grafik hubungan waktu percobaan (t) dengan kuat arus (I) dari percobaan yang dilakukan, terlihat hubungan keduanya, baik pada konsentrasi 20% maupun pada konsentrasi 20%. 21,6%, menunjukkan bahwa hasil datanya tidak jauh berbeda. Dari data tersebut terlihat keduanya memiliki data awal berupa penurunan nilai kuat arus terhadap waktu. Begitu pula dengan penggunaan konsentrasi 21,6%, nilai kuat arus yang konstan dicapai pada pengukuran ke-6 hingga ke-20, yaitu pada kuat arus 0,02 mA.
Penentuan nilai efisiensi arus dengan batang anoda karbon dan batang katoda karbon dapat dihitung dengan menggunakan rumus. Dalam keadaan semula, menurun lalu meningkat sedikit dan tetap konstan dari pengukuran ke-6 hingga akhir.
Penentuan Gas yang Terbentuk
Proses produksi gas klor dan H2 secara elektrolisis menggunakan sel elektrolisis dengan diafragma yang berfungsi mencegah terjadinya reaksi antara gas klor dengan H2 yang dihasilkan. Tampaknya sebagian besar logam di sebelah kiri H2O merupakan logam golongan utama (golongan A), kecuali logam Mn. Kationnya adalah Na+ yang merupakan logam aktif (sulit direduksi) sehingga reaksi katodiknya adalah reduksi air, sehingga gas yang terbentuk adalah gas H2.
Clanion tergolong anion yang mudah teroksidasi sehingga gas yang terbentuk di anoda adalah gas klor Cl2. Reaksi elektrolisis dengan elektrolit NaCl ini terjadi pada permukaan elektroda karbon, yang disebut dengan peristiwa adsorpsi atau proses penyerapan oleh padatan tertentu terhadap zat tertentu yang berlangsung pada permukaan padatan tersebut. Pada percobaan ini, banyaknya gas hidrogen yang terbentuk dapat ditentukan dengan mengukur volume larutan elektrolit di katoda.
Berkurangnya volume elektrolit dalam tabung reaksi menandakan terbentuknya gas hidrogen pada proses elektrolisis ini. Berdasarkan data yang diperoleh selama kerja praktek dengan variasi konsentrasi larutan elektrolit NaCl yaitu 20% dan 21,6. Diperoleh data jumlah hidrogen yang terbentuk pada konsentrasi 20% dan 21,6% yaitu 1,5 ml dan 2,6 ml.
Perhitungan Overpotensial Minimum
Hal ini didasarkan pada teori bahwa nilai potensial berlebih minimum dapat ditentukan dengan melihat bilangan tegangan konstan pada waktu tertentu. Sedangkan pada percobaan dengan arus 60 sampai 90 mA, tegangan tidak lagi naik atau turun dan tetap konstan pada angka 2,8 volt. Pada percobaan pertama dengan variasi konsentrasi elektrolit yaitu NaCl, nilai yang diperoleh pada percobaan umumnya mengalami peningkatan.
Hal ini dipengaruhi oleh faktor konsentrasi reaktan, semakin besar konsentrasi suatu larutan reaktan maka semakin besar pula laju reaksinya. Semakin lama proses elektrolisis air dilakukan maka tegangan yang dihasilkan cenderung mengalami perubahan yang konstan. Saran pada percobaan elektrolisis air kali ini adalah agar praktisi memahami dan melakukan percobaan dengan cermat, serta memeriksa peralatan yang akan digunakan agar tidak terjadi kesalahan dalam pengambilan data percobaan pada saat melakukan percobaan.
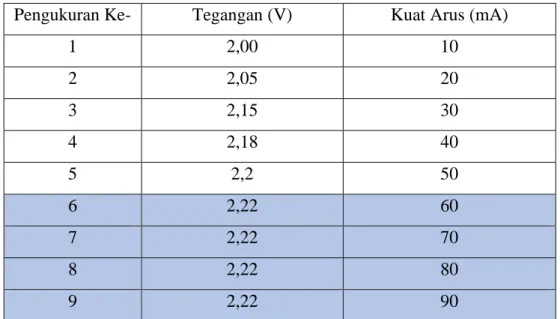
Produksi gas hidrogen menggunakan metode elektrolisis dari air dan elektrolisis air laut dengan penambahan katalis NaOH. Berdasarkan tabel diatas terlihat potensi berlebih minimum pada percobaan konsentrasi larutan elektrolit 20% adalah 2,22 V pada pengukuran keenam dengan arus 60 mA. Berdasarkan tabel diatas terlihat potensi berlebih minimum pada percobaan dengan konsentrasi larutan elektrolit 21,6% adalah 2,18 V pada pengukuran keenam dengan arus 60 mA.
4 Data Efisiensi Arus dan Konsumsi Energi percobaan kedua Waktu (Menit) Tegangan (Volt) Ampere (A) Q (Coulomb).
KESIMPULAN DAN SARAN
Kesimpulan
Saran