PENGANTAR KIMIA
UNSUR
Karakteristik Umum Unsur Golongan Utama (Unsur Blok s- dan p-)
• Unsur golongan IA (1), IIA (2), IIIA (13), IVA (14), VA (15), VIA (16), VIIA (17) dan nol (18) disebut unsur golongan utama.
• unsur-unsur golongan IA, IIA, IIIA, IVA,VA, VIA dan VIIA disebut unsur normal atau representatif dan unsur-unsur golongan nol disebut gas mulia atau gas inert.
• Berdasarkan orbital elektron valensi, unsur golongan utama dikelompokkan ke dalam kategori berikut:
(a) unsur blok-s.
Dalam atom unsur-unsur ini elektron terakhir memasuki orbital ns. Dengan demikian unsur- unsur golongan IA dan IIA adalah unsur-unsur blok-s.
(b) unsur blok-p.
Dalam atom unsur-unsur ini elektron terakhir memasuki orbital np. Golongan IIIA, IVA, VA, VIA dan VllA merupakan unsur blok-p
Karakteristik Umum dari Unsur Golongan Utama
1. Konfigurasi elektronik 2. Jari-jari atom dan ion 3. Energi Ionisasi
4. Afinitas Elektron 5. Elektronegativitas
6. Karakter elektropositif dan nonlogam (elektronegatif) 7. Kerapatan unsur dalam fasa padat
8. Volume atom dari unsur
9. Titik didih dan titik leleh
10. Potensial elektroda dari unsur
11. Sifat mengoksidasi dan mereduksi dari unsur dalam larutan berair 12. Bilangan oksidasi
13. Keenganan unsur-unsur yang lebih berat untuk ikatan phi (p-p) 14. senyawa-senyawa penting dari unsur-unsur golongan utama
Konfigurasi elektronik
• Dalam 1 periode, konfigurasi elektron dari atom-atom unsur golongan utama, dari kiri ke kanan, elektron tambahan menempati orbital yang memiliki
energi lebih tinggi, orbital diisi dengan elektron dalam urutan peningkatan energinya (prinsip Aufbau).
• Pada semua unsur blok-s (golongan IA dan IIA) dan pada unsur-unsur blok-p (IIlA, IVA, VA, VIA dan VIIA), kulit terakhir (yaitu kulit ke-n) terisi sebagian, sedangkan semua kulit bagian dalam terisi penuh.
• Dalam kasus unsur golongan nol, semua kulitnya terisi penuh.
• Jadi, konfigurasi kulit valensi umum untuk unsur blok-s dan blok-p dapat ditulis berturut-turut sebagai ns1-2 dan ns2 np1-6. Di sini n adalah jumlah kulit terakhir atau jumlah periode di mana unsur tersebut ada.
Ukuran Atom dan Ion (Jari-jari Atom dan Ion)
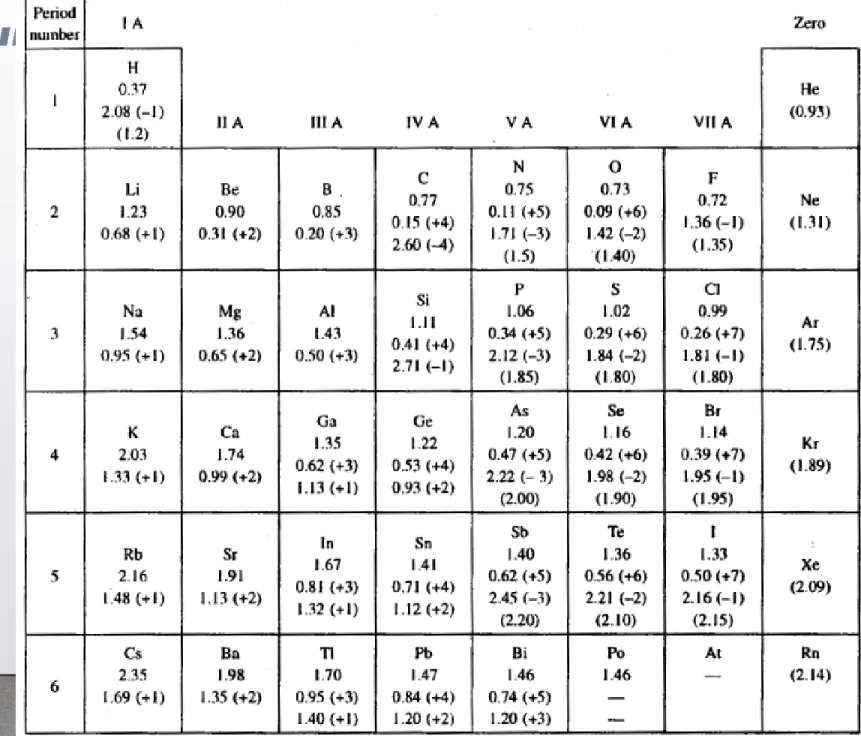
Tabel 5.1: Jari-jari kovalen
ikatan tunggal dan jari-jari ionik (Å) dari atom unsur golongan utama.
Angka yang diberikan dalam kurung adalah jari-jari van der Waals (1 Å = 1OO pm)
• Jika perbedaan elektronegatifitas (χ
A-χ
B) sangat kecil, maka jarak antar inti antara atom A dan atom B dalam molekul AB adalah
sama dengan jumlah dari jari-jari kovalen atom A dan B d
A-B= r
A+r
B(i)
• Jika perbedaan elektronegatifitas (χ
A-χ
B) sangat besar, maka jarak antar inti antara atom A dan atom B dalam molekul AB adalah
tidak sama dengan jumlah dari jari-jari kovalen atom A dan B, biasanya lebih kecil
d
A-B< r
A+r
B(ii)
Perhitungan jari-jari kovalen atom A atau B dalam
molekul AB (Molekul diatomik hetero-nuklir)
Jika dA-B dan rA diketahui, jari-jari kovalen atom B (yaitu rB) dapat dihitung dengan bantuan persamaan (i).
Contoh: Jari-jari kovalen atom C adalah 0,77 A dan jarak antar inti atom karbon dan hidrogen adalah molekul CH4 adalah 1,14 Å. Tentukan jari-jari kovalen atom-H
Penyelesaian: Dengan menggunakan persamaan (i), kita dapatkan 1,14 = 0,77 + rH
rH = 1,14 - 0,77 = 0,37 Å
Nilai ini sama dengan yang diperoleh dengan metode spektroskopi.
Misalnya pada molekul HF, HCl, HBr, HI dan (CH3)3N, nilai percobaan dA-B, pada setiap molekul, kurang dari (rA + rB), seperti yang ditunjukkan di bawah ini
• Pemendekan dA-B (panjang ikatan) disebabkan oleh adanya karakter ionik dalam ikatan A - B.
• Karakter ionik ini dihasilkan karena perbedaan elektronegativitas atom A dan B.
• Jika A lebih elektronegatif daripada B, pasangan elektron yang membentuk ikatan kovalen antara A dan B akan bergeser lebih dekat ke atom A yang lebih
elektronegatif. Jenis perpindahan elektron ini akan terakumulasi, muatan negatif pada atom A dan muatan positif yang sama (besarnya) pada atom B.
• Jenis akumulasi muatan berlawanan ini, pada dua atom yaitu, A dan B akan
membawa atom-atom ini lebih dekat satu sama lain dan karenanya jarak ikatan (dA-B) antara mereka akan diperpendek.
• Semakin besar perbedaan elektronegativitas (xA - xB), semakin besar pemendekan jarak ikatan dan semakin kecil nilai rA dan rB ·
Jari-jari kovalen ikatan ganda dan ikatan rangkap tiga
• Jika dua atom A dalam molekul A2 dihubungkan bersama oleh ikatan rangkap, A = A (misalnya, dua atom O dalam molekul O2 dihubungkan sebagai O = O), jari-jari kovalen atom A disebut jari-jari kovalen ikatan rangkap dua
• Demikian pula jika dua atom A dalam molekul A2 terikat bersama oleh ikatan rangkap tiga, A = A (misalnya, dua atom N dalam molekul N2
terikat bersama sebagai N = N), jari-jari kovalen atom A disebut jari-jari kovalen ikatan rangkap tiga.
• Dapat dilihat dari nilai di atas, bahwa jari-jari kovalen ikatan rangkap dan rangkap tiga dari atom suatu unsur lebih pendek dari jari-jari kovalen ikatan tunggalnya.
• Hal ini karena fakta bahwa dalam pembentukan ikatan kovalen tunggal, hanya orbital sigma yang tumpang tindih, sedangkan dalam bentuk ikatan rangkap atau rangkap tiga, orbital sigma dan pi tumpang tindih. Tumpang tindih
tambahan orbital pi membawa dua atom lebih dekat satu sama lain dan
karenanya panjang ikatan berkurang. Penurunan panjang ikatan mengurangi jari-jari ikatan rangkap dan kovalen ikatan rangkap tiga.
• Kita dapat menyimpulkan bahwa besarnya jari-jari kovalen suatu unsur
berkurang dengan bertambahnya kelipatan, atau jumlah ikatan antar atom,
sehingga jari-jari dari unsur tertentu ini menurun dalam urutan: jari-jari kovalen ikatan tunggal > jari-jari kovalen ikatan rangkap 2> jari-jari s kovalen ikatan rangkap tiga.
Jari-jari Atom
• Ukuran sebuah atom, dalam keadaan bebasnya, disebut jari-jari atomnya.
• Dalam banyak kasus, telah ditemukan bahwa jari-jari atom dan ukurannya yang ditentukan dari ikatan kovalen
tunggal non-polar (yaitu jari-jari kovalen) hampir sama.
• Oleh karena itu, istilah jari-jari kovalen dan jari-jari atom
telah digunakan secara sinonim oleh banyak penulis.
Faktor-faktor yang mempengaruhi besarnya jari-jari kovalen unsur
1. Muatan inti efektif (Zeff).
Dengan bertambahnya besaran Zeff yang dirasakan oleh elektron pada kulit terluar, gaya tarik antara inti dan elektron kulit terluar meningkat dan oleh karena itu awan elektron dari unsur tersebut bergerak mendekati inti.
Hal ini pada akhirnya menyebabkan jari-jari kovalen atom unsur tersebut berkurang.
Faktor ini telah digunakan untuk menjelaskan mengapa jari-jari kovalen umumnya menurun, saat kita bergerak dari kiri ke kanan, dalam periode tertentu dari unsur golongan utama (Lihat variasi jari-jari kovalen unsur golongan utama dalam suatu periode).
2. Jumlah kulit atau bilangan kuantum utama.
Bilangan kuantum utama suatu unsur mewakili jumlah total kulit yang ada dalam unsur itu.
Dengan bertambahnya jumlah kulit atau bilangan kuantum utama, elektron kulit terluar dalam atom semakin menjauh dari inti dan karenanya jari-jari kovalen meningkat.
Faktor ini telah digunakan untuk menjelaskan mengapa jari-
jari kovalen unsur meningkat, saat kita bergerak dari atas ke
bawah, dalam golongan tertentu dari unsur golongan utama
(Lihat variasi jari-jari kovalen unsur golongan utama dalam
suatu periode).
3. Multiplisitas ikatan antar atom.
Kita telah melihat bahwa besarnya jari-jari kovalen berkurang dengan meningkatnya multiplisitas ikatan antar atom.
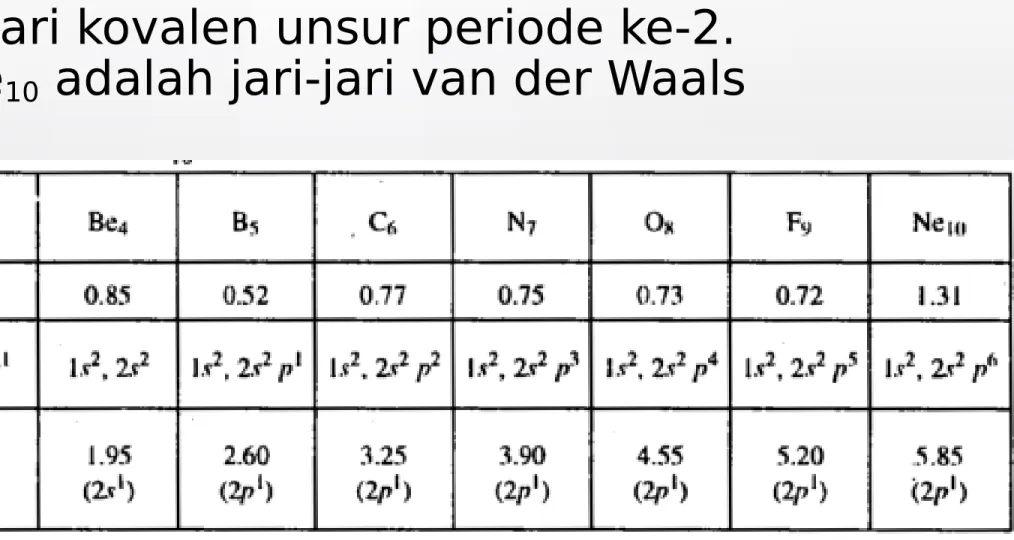
Tabel jari-jari kovalen unsur periode ke-2.
Jari-jari Ne
10adalah jari-jari van der Waals
Anomali dari ukuran atom
• Golongan III A. semakin ke bawah, jari-jari atom diharapkan meningkat, karena peningkatan jumlah kulit. Namun, saat kita berpindah dari Al ke Ga, jari-jari atom, bukannya bertambah, tapi sedikit berkurang (Al = 1,43 A, Ga = 1,35 A). Mengapa?
Penjelasan. Kita tahu bahwa konfigurasi kulit valensi Al dan Ga berturut-turut
adalah 4s2 4p1 dan 3d10 4s2 4p1. Karena orbital 3d yang ada dalam konfigurasi Ga berukuran besar, orbital ini menghalangi inti dengan tidak baik dan karenanya muatan inti efektif di Ga menjadi lebih banyak daripada di Al. Oleh karena itu, jari- jari atom Ga menjadi sedikit lebih kecil daripada Al.
Ukuran atom gas mulia
• Pada kristal gas mulia, atom-atom gas mulia tidak terikat oleh ikatan kovalen (ikatan kuat) tetapi hanya oleh gaya van der Waals (gaya tarik menarik) yang merupakan gaya lemah.
• Oleh karena itu, jari-jari atom atom gas mulia sebenarnya adalah jari-jari van der Waals dan bukan jari-jari kovalen.
• Jari-jari van der Waals mewakili jarak antara dua atom gas mulia yang berdekatan dalam keadaan padat.
• Saat kita turun dalam 1 golongan, jari-jari van der Waals meningkat karena penambahan kulit elektronik baru.
Energi Ionisasi (EI)
• didefinisikan sebagai jumlah energi yang dibutuhkan untuk melepaskan elektron dari kulit valensi atom berfase gas, untuk mengubah atom
menjadi kation dalam fase gas.
• Karena IE adalah energi yang dibutuhkan, maka ditunjukkan dengan
tanda positif, (menurut konvensi termodinamika). Pelepasan elektron dari atom gas (disebut ionisasi atom) adalah proses endotermis karena
membutuhkan energi.
• Umumnya nilai EI pertama meningkat dari kiri ke kanan (periode) dan menurun saat bergerak ke bawah dalam satu golongan.
• Energi ionisasi menurun secara teratur ketika kita bergerak ke bawah dalam 1 golongan (golongan IA dan IIA) dan meningkat melintasi
periode unsur blok-s, tetapi beberapa unsur blok-p menunjukkan
ketidakteraturan tren dalam nilai-nilai ini. Misalnya pada unsur-unsur periode ke-2 dan ke-3, nilai energi ionisasi tidak meningkat secara teratur saat kita bergerak dari kiri ke kanan pada periode tertentu.
• Variasi energi ionisasi yang tidak teratur ini telah dijelaskan pada mata kuliah SRA
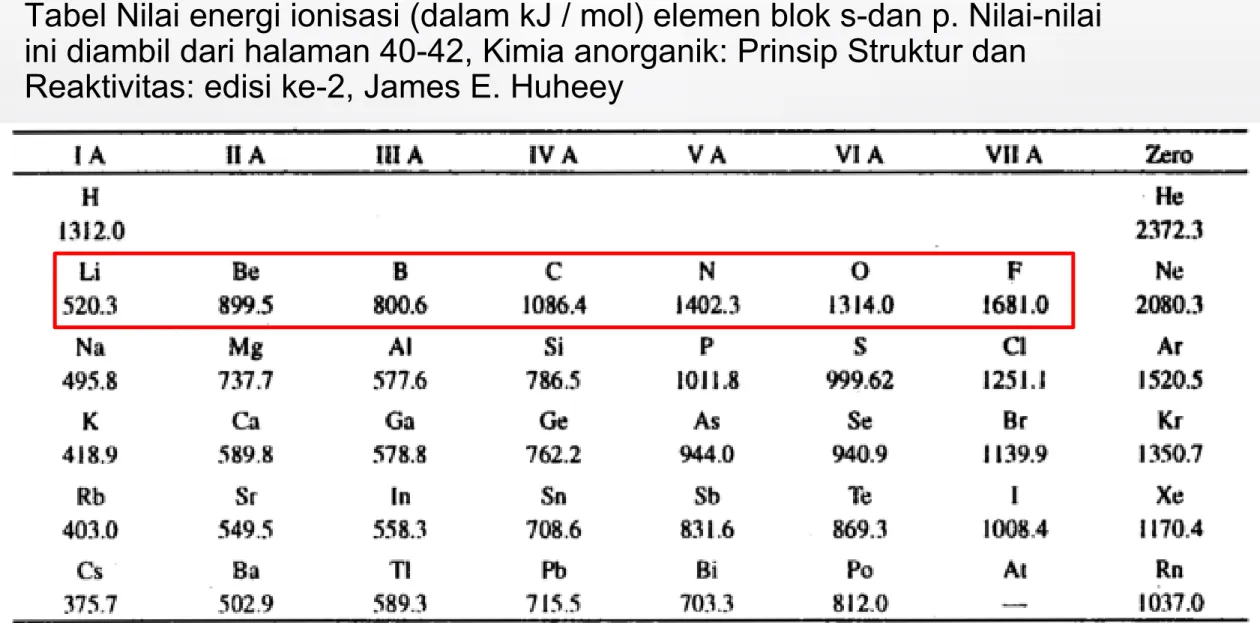
Tabel Nilai energi ionisasi (dalam kJ / mol) elemen blok s-dan p. Nilai-nilai ini diambil dari halaman 40-42, Kimia anorganik: Prinsip Struktur dan
Reaktivitas: edisi ke-2, James E. Huheey
Afinitas elektron (AE).
• Afinitas elektron (EA) suatu unsur didefinisikan sebagai jumlah energi yang dilepaskan ketika elektron ditambahkan ke kulit
valensi atom gas terisolasi dari unsur tersebut, untuk mengubah atom menjadi anion gas
• Umumnya nilai afinitas elektron meningkat saat kita bergerak
dari kiri ke kanan dalam periode tertentu (yaitu, dari logam alkali
ke halogen) dan menurun dalam satu golongan. Ingat kembali
alasan untuk variasi ini faktor-faktor yang mempengaruhi
besaran AE.
• Unsur-unsur golongan IIA memiliki nilai afinitas elektron nol atau negatif, nilai AE dari N dan P sangat rendah.
Mengapa? Cek konfigurasi e
-• Gas mulia memiliki nilai AE nol atau negatif
Elektronegativitas.
• Menurut pauling, keelektronegatifan atom suatu unsur dalam molekul adalah kecenderungan relatif (daya atau kemampuan) untuk menarik pasangan elektron bersama ke arah dirinya sendiri.
• Nilai keelektronegatifan unsur golongan utama meningkat saat bergerak dari kiri ke kanan dalam satu periode dan menurun saat
bergerak ke bawah sekelompok unsur blok-s, tetapi dalam unsur-unsur golongan IIIA dan IVA yang termasuk dalam blok-p tidak mengikuti tren ini (Lihat bab SPU) pengisian orbital d pada orbital Ge dan Sn dan d dan f pada Pb
tugas
• Carilah informasi mengenai penerapan elektronegativitas, tulis di buku catatan anda