EFEKTIVITAS EKSTRAK BIJI KAPAS (
Gossypium hirsutum
L.)
TERHADAP JUMLAH DAN KUALITAS EMBRIO
MENCIT (
Mus musculus
L.)
NOFRI ZAYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Ekstrak Biji Kapas (Gossypium hirsutum L.) terhadap Jumlah dan Kualitas Embrio Mencit (Mus musculus L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
RINGKASAN
NOFRI ZAYANI. Efektivitas Ekstrak Biji Kapas (Gossypium hirsutum L.) terhadap Jumlah dan Kualitas Embrio Mencit (Mus musculus L.). Dibimbing oleh IMAN SUPRIATNA dan MOHAMAD AGUS SETIADI.
Ekstrak biji kapas (Gossypium hirsutum L.) mengandung gosipol yang bersifat sebagai zat antifertilitas. Efeknya mampu mengurangi dan merusak folikel berkembang yang disertai dengan kerusakan oosit. Kerusakan oosit ini mengakibatkan penurunan jumlah, kualitas, viabilitas, dan hambatan perkembangan embrio. Tujuan penelitian ini adalah mengkaji efektivitas ekstrak biji kapas (Gossypium hirsutum L.) terhadap jumlah dan kualitas embrio mencit (Mus musculus L.).
Dosis ekstrak biji kapas yang digunakan terdiri atas 0 (kontrol); 1.5; 2.1; dan 2.7 g kg-1 BB peroral selama 24 hari. Ekstraksi biji kapas dilakukan dengan metode maserasi menggunakan etanol 80%. Penelitian ini menggunakan 24 ekor mencit betina strain DDY, berumur kisaran 14 sampai 15 minggu, dan bobot badan berkisar 30 sampai 35 g. Mencit kemudian dikawinkan pada hari ke-24 pemberian ekstrak biji kapas. Koleksi embrio dilakukan pada hari ke empat kebuntingan dengan metode flushing kornua uterus dan ditentukan jumlah, kualitas dan stadium perkembangannya. Embrio kemudian dikultur secara in vitro selama 48 jam dalam medium kultur modifikasi phosphate buffered saline (PBS) yang disuplementasi dengan 10% fetal bovine serum (FBS) berdasarkan stadium perkembangan untuk mengamati viabilitas embrio.
SUMMARY
NOFRI ZAYANI. Effectiveness of the Cottonseed Extract (Gossypium hirsutum L.) on the Number and Quality of Mice Embryo (Mus musculus L.). Supervised by IMAN SUPRIATNA and MOHAMAD AGUS SETIADI.
The cottonseed (Gossypium hirsutum L.) contained gossypol as antifertility agents. The effect of cottonseed extract treatment could be decrease and impaired follicles development were accompanied by oocytes damage. Damage of oocytes resulted reduction of number, quality, stadium of development, and viability of mice embryo. The objective of this study was to evaluate the effectiveness of the cottonseed extract (Gossypium hirsutum L.) on the number and quality of mice (Mus musculus L.) embryo.
Doses of the cottonseed extract were used consist of 0 (control); 1.5; 2.1; and 2.7 g kg-1 of body weight (BW) for 24 days via oral route. Extraction of the cottonseed were done by maceration method used 80% ethanol. This research used 24 animals of female DDY mice 14-15 weeks old and 30-35 g BW. Mice then were mated on days 24 of cottonseed extract treatment. Collecting embryos were done in days 4 of pregnancy by flushing method from uterine cornua and determinated the number, quality, and stage of development. Embryos then were cultured in vitro for 48 hours in modified phosphate buffered saline (PBS) supplemented with 10% fetal bovine serum (FBS) culture medium based on the stage of development to examine the viability of embryos.
The result showed that the cottonseed extract at 1.5; 2.1; and 2.7 g kg-1 BW doses produced lower number of embryos compared with the control group (P < 0.05). The cottonseed extract at 2.7 g kg-1 BW dose decreased quality of embryos (P < 0.05) like retardation, degeneration embryos, and unfertilization oocytes. The result of observation on stage of embryos showed retardation of development on days 4 of pregnancy along increasing doses. At a dose of 2.7 g kg-1 BW contained stage of embryos development with 8 cells, 4 cells, and unfertilization oocytes (P < 0.05). Data from embryos culture in vitro along 48 hours significantly reduced number of embryos (P < 0.05) that developed to the blastocysts, expanded blastocysts, and hatched blastocysts. Retardation (4-8 cells) and degeneration of embryos did not develop in culture for 24 hours. It can be concluded that the cottonseed extract which contained gossypol decreased the fertility by reduced number, quality, viability, and inhibited mice embryo development, so that it can be used as a candidate of herbal contraseption.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
EFEKTIVITAS EKSTRAK BIJI KAPAS (
Gossypium hirsutum
L.)
TERHADAP JUMLAH DAN KUALITAS EMBRIO
MENCIT (
Mus musculus
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Efektivitas Ekstrak Biji Kapas (Gossypium hirsutum L.) terhadap Jumlah dan Kualitas Embrio Mencit (Mus musculus L.)
Nama : Nofri Zayani
NRP : B352140061
Disetujui oleh Komisi Pembimbing
Prof Dr Drh Iman Supriatna Ketua
Prof Dr Drh Mohamad Agus Setiadi Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr Drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Januari sampai Mei 2016 ini adalah “Efektivitas Ekstrak Biji Kapas (Gossypium hirsutum L.) terhadap Jumlah dan Kualitas Embrio Mencit (Mus musculus L.)”. Penelitian ini diharapkan dapat memberikan sumbangan pemikiran bagi ilmu pengetahuan sekarang dan dimasa yang akan datang.
Ucapan terima kasih penulis sampaikan kepada instansi Institut Pertanian Bogor (IPB) sebagai tempat menimba ilmu pada Program Studi Biologi Reproduksi dan meraih gelar Magister Sains (M.Si). Ucapan terima kasih juga diucapkan kepada Bapak Prof Dr Drh Mohamad Agus Setiadi selaku Ketua Program Studi Biologi Reproduksi (BRP) atas segala arahannya selama penulis mengenyam pendidikan pada program studi ini. Ucapan terima kasih juga penulis sampaikan kepada semua staf dan pegawai Program Studi BRP yang telah memberikan fasilitas dan pelayanan yang menunjang perkuliahan kepada penulis. Terima kasih penulis ucapkan kepada Bapak Prof Dr Drh Iman Supriatna dan Bapak Prof Dr Drh Mohamad Agus Setiadi selaku pembimbing tesis atas segala arahan, saran, dan bimbingannya. Penulis juga mengucapkan terima kasih kepada Ibu Drh Ni Wayan Kurniani Karja, MP., PhD selalu penguji tesis yang telah banyak memberikan saran. Ungkapan terima kasih yang sebesar-besarnya penulis ucapkan kepada keluarga tercinta Ayahanda Zaidir (almarhum), Ibunda Yunibar, Kakak Zaiyu Rahman dan Zulmaneti, serta Adik Yudya Fauzan, Dila Yunita, dan Fauziah Tulhusna atas seluruh do’a, dukungan semangat, kasih sayang, serta kesabarannya dalam membantu penulis selama menempuh pendidikan di Institut Pertanian Bogor.
Ungkapan terima kasih penulis haturkan kepada sahabat tersayang Siska Adelya Ramadhani yang setia membantu dan menemani semenjak menempuh pendidikan Strata 1 sampai sekarang. Ucapan terima kasih juga penulis haturkan untuk adek kosan Baiq Hayyul Hidayati dan Euis Marlina yang sudah memotivasi, memberikan warna, dan kebersamaan yang telah tercipta selama kita di Bogor. Ucapan terima kasih juga penulis haturkan kepada Haniffudin yang selalu memberikan dorongan semangat pantang mundur dan mendengarkan keluh kesah tentang perkuliahan. Ucapan terima kasih juga penulis haturkan kepada “group IVF 2014” yang telah menemani dan membantu selama dalam masa penelitian dan juga terima kasih kepada teman-teman seperjuangan “Biologi Reproduksi 2014” yang telah mengisi hari-hari perkuliahan dengan keseriusan, canda tawa, dan keisengan. Akhir kata, penulis berharap semoga karya ilmiah ini bermanfaat bagi yang membaca pada umumnya dan penulis khususnya.
Bogor, Desember 2016
DAFTAR ISI
Viabilitas Embrio Kultur secara In Vitro Mencit (Mus musculus L.)
Pemberian Ekstrak Biji Kapas dan Pengawinan Hewan Coba Pengamatan Jumlah, Stadium Perkembangan, dan Kualitas Embrio
Pengamatan Viabilitas Embrio dalam Kultur Embrio secara In Vitro
Jumlah, Stadium Perkembangan, dan Kualitas Embrio 13 Viabilitas Embrio dalam Kultur secara In Vitro 17
5 SIMPULAN DAN SARAN 21
DAFTAR PUSTAKA 22
LAMPIRAN 27
DAFTAR TABEL
1 Stadium dan waktu perkembangan embrio mencit 6
2 Klasifikasi kualitas embrio mencit pada D4 kebuntingan 7
3 Sifat biologi mencit betina (Mus musculus L.) 9
4 Perolehan stadium perkembangan embrio mencit
pada D4 kebuntingan setelah pemberian ekstrak biji kapas 14 5 Total persentase embrio mencit yang berkembang setelah kultur
secara in vitro selama 48 jam 19
DAFTAR GAMBAR
1 Morfologi biji kapas (Gossypium hirsutum L.) 3
2 Jumlah embrio mencit (Mus musculus L.) pada D4 kebuntingan
setelah pemberian ekstrak biji kapas (Gossypium hirsutum L.) 14 3 Kualitas embrio mencit (Mus musculus L.) pada D4 kebuntingan
setelah pemberian ekstrak biji kapas(Gossypium hirsutum L.) 16 4 Persentase kualitas embrio mencit (Mus musculus L.)
setelah pemberian ekstrak biji kapas (Gossypium hirsutum L.) 17 5 Persentase embrio morula, morula kompak, blastosis awal dan
blastosis yang berkembang setelah kultur in vitro selama 48 jam 18
DAFTAR LAMPIRAN
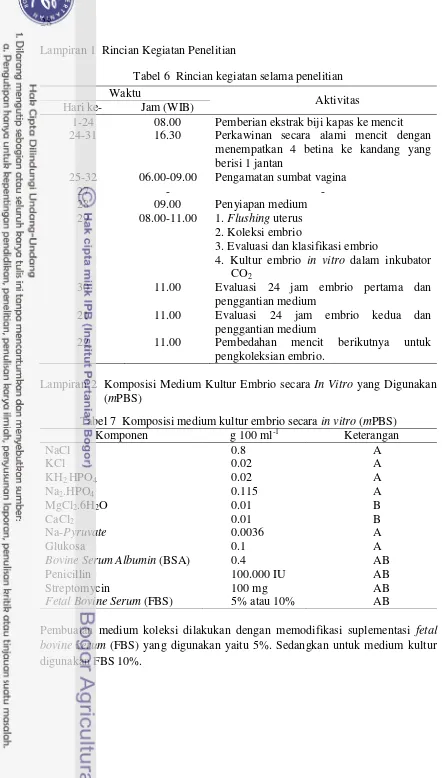
1 Rincian kegiatan penelitian 28
2 Komposisi medium kultur embrio secara in vitro 28 3 Berat badan indukan mencit sebelum dan setelah
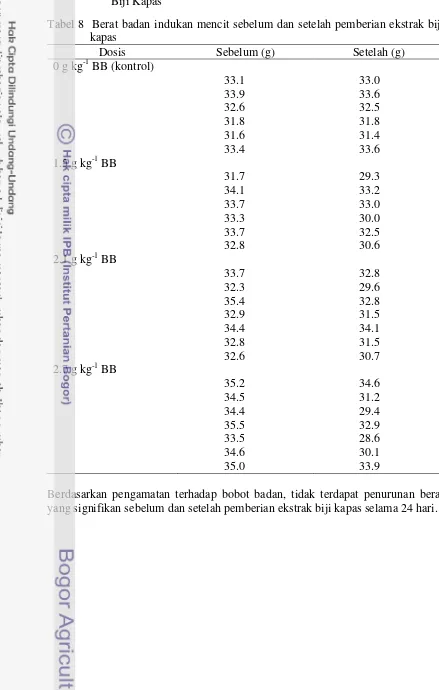
pemberian ekstrak biji kapas 29
4 Persentase kebuntingan indukan mencit 30
5 Persetujuan komisi etik atas perlakuan hewan 31
1
PENDAHULUAN
Latar Belakang
Penelitian dan pengembangan obat kontrasepsi herbal di Indonesia terus dikaji dan berkembang pesat. Obat herbal lebih banyak diminati oleh masyarakat saat ini karena bersifat reversibel, efektif, mudah didapat, dan ekonomis. Hal ini juga sesuai dengan syarat ideal untuk pemilihan bahan kontrasepsi (Akbar 2010). Selama ini, obat kontrasepsi banyak berasal dari bahan kimia termasuk hormon yang cukup membahayakan kondisi kesehatan masyarakat. Beberapa efek samping dari kontrasepsi ini di antaranya meningkatkan tekanan darah, mual, kegemukan, perdarahan di luar siklus menstruasi, dan resiko jantung koroner karena penumpukan kolesterol (Nawrot et al. 2003). Oleh karena itu, eksplorasi bahan herbal kontrasepsi sangat diharapkan agar masyarakat tetap dapat mengatur jumlah anak tanpa harus memikirkan resiko penggunaan obat.
Biji kapas (Gossypium hirsutum L.) adalah salah satu bagian tumbuhan kapas yang berpotensi sebagai bahan obat kontrasepsi herbal. Biji kapas memiliki kandungan utama gosipol, yaitu suatu zat antifertilitas yang memengaruhi kontrol hormon reproduksi dan memiliki efek sitotoksik (Gadelha et al. 2014a). Hernandez (2016) juga mengemukakan bahwa gosipol termasuk ke dalam senyawa polifenolik yang berwarna kuning. Efek antifertilitas gosipol telah diteliti mampu mengurangi jumlah folikel yang berkembang ke folikel dominan ovarium (Gadelha et al. 2014b). Mekanisme kerja gosipol langsung merusak pada sel – sel folikel ovarium (Camara et al. 2015). Pada folikel ovarium, aktivitas sitotoksik gosipol diduga memicu pembentukan oksigen reaktif spesies (O2-) yang
menghambat kerja antioksidan superoksida dismutase (SOD) sehingga menyebabkan stres oksidatif sel. Stres oksidatif mengakibatkan kerusakan komunikasi antara sel (Herve et al. 1996; Cheng et al. 2003) dan transpor ion melalui membran (Bai dan Shi 2002). Gosipol merusak transpor ion pada membran khususnya ion logam seperti kalsium (Ca2+) dan natrium (Na+) dengan menempati saluran Ca2+ tipe T. Hal ini mengakibatkan peningkatan ion kalsium intraseluler yang berbahaya untuk sel. Kerusakan oleh gosipol dapat juga menginduksi apoptosis pada sel (Zanga et al. 2003). Apoptosis merupakan kematian sel yang terprogram dengan gejala awal berpindahnya posisi asam lemak phosphatidilserin dari lapisan membran bagian dalam ke bagian luarnya sel (Bakri et al. 2016). Pada sel granulosa, peningkatan oksigen reaktif (O2-)
mengakibatkan pengurangan produksi hormon steroid karena efek antisteroidogenik gosipol menekan kerja enzim-enzim seperti sitokrom p450, aromatase, 5α reduktase, dan hidroksisteroid dehidrogenase (γ -HSD) (Gu et al. 1991; Basini et al. 2009). Penelitian Bender et al. (1988) membuktikan bahwa pemberian gosipol mengakibatkan rendahnya produksi hormon progesteron dan estrogen dibandingkan kontrol.
2
untuk proses metabolisme sel (Neganova et al. 2000). Selain itu, gosipol juga diketahui merusak pada sisterna retikulum endoplasma halus sehingga mengganggu sekresi protein dan hormon yang dibutuhkan sel. Serangkaian gangguan aktivitas seluler khususnya pada folikel ini mengakibatkan atresia yang diikuti dengan kerusakan oosit (Camara et al. 2015). Kerusakan oosit mengurangi kompetensinya untuk berkembang menjadi embrio khususnya sampai tahapan blastosis. Oleh karena itu, penelitian pemberian ekstrak biji kapas yang mengandung gosipol pada mencit telah dilakukan untuk mengamati pengaruhnya terhadap kerusakan oosit lebih lanjut yang diindikasikan dengan penurunan jumlah, kualitas, tahapan perkembangan (stadium) embrio pada D4 kebuntingan dan kemampuan perkembangan embrio yang dikultur secara in vitro selama 48 yaitu ovarium. Efek sitotoksik gosipol bekerja langsung pada ovarium dengan jalan berikatan pada molekul fosfolipid dan lipoprotein membran sehingga memicu terbentuknya radikal bebas berupa senyawa oksigen reaktif (O2-). Radikal
bebas ini dapat menyebabkan peroksidasi lipid pada membran sel serta organel sel di ovarium dan menghambat aktivitas antioksidan seluler superoksida dismutase (SOD). Hal ini mengakibatkan folikel atresia yang disertai dengan kerusakan oosit didalamnya. Oosit sebagai sel yang aktif membelah dengan mudah menyerap zat-zat yang masuk ke dalam sel sehingga menimbulkan degenerasi pada oosit. Terjadinya folikel atresia dan degenerasi pada oosit menurunkan kompetensi oosit yang diovulasikan sehingga diduga dapat mengakibatkan penurunan jumlah dan kualitas embrio. Embrio yang rendah kualitasnya mempunyai daya kemampuan perkembangan atau viabilitas yang rendah pula ke stadium lebih lanjut. Viabilitas perkembangan embrio dapat diketahui dengan melakukan kultur embrio secara in vitro.
Tujuan Penelitian
Penelitian ini bertujuan mengkaji efektivitas ekstrak biji kapas (Gossypium hirsutum L.) terhadap jumlah dan kualitas embrio secara in vivo serta viabilitas embrio mencit (Mus musculus L.) secara in vitro.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini yaitu:
1. Memberikan informasi ilmiah tentang efek ekstrak biji kapas terhadap jumlah dan kualitas embrio mencit secara in vivo dan viabilitas embrio secara in vitro. 2. Memberikan informasi kepada masyarakat tentang potensi biji kapas yang
3
2
TINJAUAN PUSTAKA
Biji Kapas (Gossypium hirsutum L.)
Jenis kapas yang banyak tersebar di wilayah Indonesia adalah Gossypium hirsutum L.. Penamaan kapas dengan Gossypium hirsutum L. melambangkan zat yang paling banyak terkandung dalam tanaman ini yaitu gossypium fenol (gosipol). Selain gosipol, kandungan kimia yang terdapat dalam tumbuhan kapas terdiri atas flafonoid dan steroid (Chandrashekar et al. 2013). Gosipol merupakan senyawa polifenolik yang dihasilkan oleh kelenjar pigmen tumbuhan genus Gossypium. Konsentrasi gosipol terbesar ditemukan dalam biji dibandingkan bagian kapas lainnya. Biji kapas mengandung 20 sampai 25% gosipol atau gosipol totalnya 14 g kg-1 (Gadelha et al. 2014a). Biji kapas yang tersebar di Indonesia berbentuk bulat telur, berwarna coklat kehitaman, panjang biji antara 6 sampai 12 mm, berat biji dalam satu buah berkisar 6 sampai 17 g (Aak 1992). Morfologi biji kapas disajikan pada Gambar 1.
Gambar 1 Morfologi biji kapas (Gossypium hirsutum L.)
Gosipol merupakan senyawa semi polar dengan rumus kimia C30H30O8
dengan struktur kimia 2.2bis(8-formil-1.5.7-trihydroxy-5-isopropil-3methyl naphthalene). Gosipol memiliki berat molekul 518.55 Dalton dan berbentuk kristal kuning. Gosipol tidak dapat larut dalam air, heksan, dan eter, namun larut dalam aseton, kloroform, metil etil keton (butanon), etanol, metanol, dan sebagian larut dalam minyak sayur mentah. Kestabilan pelarut menurun dari aseton, asetonitril, etanol, dan metanol. Dalam biji kapas terdapat gosipol bebas, gosipol terikat, dan gosipol total. Gosipol bebas terdiri dari gugus karbonil bebas dapat bereaksi dengan gugus amin dari asam amino. Sementara itu, gosipol terikat yaitu gosipol yang gugus karbonilnya langsung berikatan dengan senyawa amin dari asam amino pada protein sehingga akan kehilangan sifat bebasnya dan gosipol total merupakan jumlah antara gosipol bebas dan terikat. Gosipol terikat tidak membahayakan ternak dan manusia. Gosipol bebas dapat meracuni ternak yang masih kecil. Konsentrasi gosipol bebas dalam kapas sekitar 0.01% sampai 1.7% (Dalton 2003).
4
menyebabkan immotil spermatozoa (White et al. 1988; Udoh et al. 1992). Selain itu, gosipol juga mengakibatkan berkurangnya diameter tubulus seminiferus pada tikus dan mencit jantan (Bai et al. 2002; Amini et al. 2005; Singla dan Garg 2013). Pada betina, gosipol mengakibatkan pengurangan jumlah siklus estrus selama 30 hari tanpa menghambat proses ovulasi pada tikus, pengurangan angka kebuntingan dan jumlah embrio yang mampu bertahan sampai hari ke 13 kebuntingan (Bender et al. 1988). Efek pemberian gosipol juga menyebabkan kematian embrio yang tinggi pada embrio ayam dan tikus, resorbsi janin, namun tidak menyebabkan malformasi (Li et al. 1989). Pada hamster, pemberian gosipol dapat menghambat perkembangan embrio untuk mencapai morula (Lin et al. 1994).
Mekanisme Kerja Gosipol
Gosipol menghambat secara langsung produksi hormon gonadotropin dengan mengganggu kerja sel FSH dan LH pada hipofisis anterior (Udoh et al. 1992) serta mengganggu steroidogenesis pada ovarium. Lin et al. (1992) dan Yurekli et al. (2009) mengemukakan bahwa gosipol dapat mengganggu steroidogenesis dengan menghambat aktivitas enzim sitokrom p450, γ –hidroksisteroid dehidrogenase (γ –HSD), 5α–reduktase, dan aromatase. Enzim sitokrom p450 berfungsi mengkatalisis kolesterol menjadi pregnenolon, γ –HSD mengkatalisis pregnenolon menjadi progesteron, 5α–reduktase mengkatalisis testosteron menjadi 5–dehidrotestosteron, dan aromatase mengkatalisis testosteron menjadi estrogen (Murray et al. 2006). Hambatan pada proses kerja enzim–enzim ini menyebabkan hormon–hormon steroid yang dihasilkan dalam konsentrasi sedikit sehingga menghambat proses reproduksi. Penelitian Young et al. (1985) dan Bender et al. (1988) menemukan bahwa pemberian gosipol menyebabkan konsentrasi progesteron dan estrogen lebih rendah dibandingkan kontrol. Kekurangan progesteron pada awal kebuntingan dapat menyebabkan kematian embrio dini (Randel et al. 1996 dan Basini et al. 2009).
Gosipol juga dapat memempati reseptor hormon LH sehingga LH tidak dapat berikatan dengan reseptornya, memicu penurunan cAMP, menghambat aktivitas adenil siklase dan protein kinase. Hal ini menyebabkan terhambatnya sel luteal mensintesis enzim yang diperlukan untuk steroidogenesis (Lin et al. 1994). Zat analog yang berikatan dengan reseptor hormon tidak dapat menstimulasi reseptor tersebut (Koeman 1993). Gosipol mengakibatkan terhambatnya kerja LH untuk menstimulasi produksi cAMP. Secara normal, cAMP berfungsi untuk menstimulasi aktivitas protein kinase dan meningkatkan ketersediaan kolesterol untuk side chain cleavage dan testosteron. Gosipol mengganggu produksi cAMP juga melalui berikatannya dengan G–protein serta sub unit katalitik yang mengkonversi ATP menjadi cAMP. Gosipol yang berikatan dan berinteraksi dengan domain nukleotida sub unit katalitik mengakibatkan terganggunya sintesis protein dan enzim untuk proses reproduksi (Shaaban et al. 2007). Zhanga et al. (2003) dan Moon et al. (2011) juga menemukan bahwa gosipol mengganggu faktor trasnkripsi (p53, p50 dan p65) sehingga menghambat pembentukan enzim dan hormon yang diperlukan untuk reproduksi.
5 ovarium sapi memiliki afinitas mengikat yang paling tinggi terhadap gosipol (Lin et al. 1992). Inteaksi lipid membran dengan gosipol dapat menyebabkan peroksidasi lipid membran sehingga merusak transpor ion pada membran (Brocas et al.1997), bahkan tight junction antar sel (Villasenor et al. 2008). Peroksidasi lipid adalah proses kerusakan asam lemak penyusun membran sel dengan ditandai adanya reaksi oksidasi asam lemak tak jenuh ganda oleh radikal bebas berupa senyawa oksigen reaktif (O2-) (Setiawan et al. 2007). Senyawa O2- dapat
menghambat aktivitas antioksidan superoksida dismutase (SOD) sehingga menimbulkan stres oksidatif pada sel (Shaaban et al. 2007). Gosipol merusak transpor ion pada membran khususnya ion logam seperti Ca2+ dan Na+ (Bai dan Shi 2002). Peroksidasi lipid dan terganggunya transpor ion pada membran mengakibatkan kebocoran sel, kerusakan organel sel dan bahkan menyebabkan perembesan isi sitoplasma keluar sel. Penelitian Pan et al. (1987) menemukan bahwa gosipol pada sel granulosa menyebabkan hilangnya sisterna dari retikulum endoplasma halus.
Gosipol juga bekerja mengganggu dalam proses penghasilan energi (ATP) pada mitokondria. Penelitian Cuellar dan Ramirez (1993) menemukan bahwa mitokondria memiliki tingkat afinitas tertinggi dengan gosipol dibandingkan dengan organel sel lainnya. Gosipol selain menghambat proses metabolisme oksidatif (Gadelha et al. 2014a), juga menganggu kerja laktat dehidrogenase X (LDH-X). Laktat dehidrogenase X yaitu enzim yang berpartisipasi dalam sistem transpor ion hidrogen dari sitosol ke mitokondria. Gangguan pada penghasilan energi dapat mengakibatkan terganggunya proses perkembangan. Rendahnya persediaan ATP dan disfungsi mitokondria dalam menghasilkan ATP dapat memicu penurunan kemampuan perkembangan embrio mamalia. Penelitian Lin et al. (1994) menunjukkan bahwa pemberian gosipol pada hamster menunda stadium embrio yang berkembang mencapai morula. Penelitian Villasenor et al. (2008) pada sapi juga menunjukkan bahwa pemberian gosipol menyebabkan rendahnya embrio yang berkembang dari morula ke blastula dan tingginya persentase embrio degenerasi. Embrio degenerasi ditandai dengan adanya reduksi ukuran embrio. Berdasarkan penelitian–penelitian yang telah ada terlihat bahwa pemberian gosipol dapat menyebabkan terganggunya sistem kerja hormonal dan aktivitas seluler ovarium sehingga diperkirakan mengganggu proses pembentukan folikel dan oosit yang berdampak pada penurunan jumlah dan kualitas embrio, serta terjadi hambatan pada perkembangannya. Hal ini berarti kandungan senyawa gosipol dalam biji kapas dapat bekerja melalui efek hormonal dan sitotoksik.
Stadium Perkembangan Embrio
6
yang sudah kompak dan sulit dihitung dinamakan embrio berstadium morula kompak. Pada tahapan ini, massa embrio menempati sekitar 60-70% ruang perivitelin (Lindner et al. 1983). Hubungan komunikasi antar sel bagian dalam terjadi melalui gap junction, sedangkan sel-sel permukaan melalui tight junction. Tight junction menjadikan sel-sel pada daerah permukaan lebih permeabel dibandingkan sel-sel sebelah dalam dan merangsang akumulasi cairan dalam morula. Akumulasi cairan ini terjadi karena konsentrasi ion di bagian dalam meningkat sehingga air mudah masuk ke dalam embrio, dan mulai membentuk rongga yang disebut blastosol.
Embrio yang sudah terbentuk rongga yang berisi cairan disebut blastosis. Blastosis awal ditandai dengan terbentuknya rongga blastosol yang menempati kurang dari setengah volume embrio dan blastosis ditandai dengan telah terbentuknya rongga blastosol yang menempati setengah atau lebih volume embrio. Sel-sel bagian dalam blastosis membentuk inner cell mass (ICM), sedangkan sel-sel di bagian permukaan akan menjadi trofoblas. Trofoblas memproduksi enzim proteolitik yang berfungsi untuk menipiskan zona pelusida, sehingga zona pelusida mudah pecah. Pertambahan jumlah sel, akumulasi cairan dan melemahnya zona pelusida menyebabkan zona pelusida pecah dan embrio keluar dari zona pelusida. Proses ini disebut hatching (menetas) blastosis. Secara in vivo, stadium zigot, embrio tahapan cleavage dan morula berada dalam saluran oviduk induk mencit. Embrio kemudian berpindah ke dalam uterobal junction setelah embrio mencapai tahapan morula kompak, tahapan selanjutnya embrio sudah berada dalam uterus (Theiler 1989). Stadium perkembangan embrio mencit praimplantasi sesuai waktunya terlihat pada Tabel 1.
7 reruntuhan sel (debris). Selain itu, embrio yang dikoleksi harus sesuai dengan stadium perkembangan yang diantisipasi (Supriatna 2013). Klasifikasi kualitas embrio mencit berdasarkan morfologinya yang dimodifikasi dari Supriatna (2013) disajikan pada Tabel 2.
Tabel 2 Klasifikasi kualitas embrio mencit pada D4 kebuntingan Kualitas embrio
(Grade) Penampilan umum morfologi embrio
1 (sangat baik) Embrio hampir sempurna dengan sel blastomer sehat dan aktif lebih 98%, bentuk bundar atau spherical (simetris), zona beberapa blastomer keluar dari ikatannya, dan ukuran blastomer tidak simetris.
4 (jelek) Sel blastomer yang aktif kurang dari 25 % . 5 (retarded
perkembangan degenerasi, dan oosit tidak terfertilisasi)
Retarded hambatan perkembangan pada D4 kebuntingan mencit (4-8 sel).
Degenerasi ikatan blastomer longar sampai lepas, warna intensif/gelap (piknotik).
Oosit tidak terfertilisasi tidak terdapat sel blastomer. Sumber: modified Supriatna (2013)
Viabilitas Embrio Kultur secara In Vitro
Perkembangan embrio dapat terjadi baik secara in vivo mauppun in vitro. Perkembangan embrio secara in vitro dilakukan dengan menempatkannya pada lingkungan medium yang menyerupai kondisi alamiah dalam tubuh induk (Harding et al. 2002). Faktor yang memengaruhi perkembangan embrio secara in vitro yaitu kualitas embrio, komposisi medium kultur, dan lingkungan sistem kultur. Kualitas embrio yang jelek mengakibatkan rendahnya persentase perkembangannya ke tahapan selanjutnya. Medium yang digunakan harus sesuai dengan kebutuhan embrio (Bettger dan McKeehan 1986). Kandungan dalam medium yang paling penting adalah sumber energi, protein, dan larutan buffer. Sumber energi dapat berupa asam laktat, glukosa atau glutamin tergantung tahapan perkembangan embrio serta jenis sel yang dikultur (Gardner 2007). Protein berfungsi sebagai bahan untuk pembangun sel yang sedang membelah atau fungsi fisiologis yang lain. Larutan buffer digunakan untuk menjaga stabilitas medium kultur dari perubahan derajat keasaman (pH). Faktor lingkungan yang memengaruhi keberhasilan kultur embrio di antaranya level oksigen (O2), karbon
dioksida (CO2), pH, suhu, inkubator, cahaya, dan volume inkubasi (Freshney
8
Beberapa medium yang telah digunakan untuk perkembangan embrio mencit melalui kultur secara in vitro yaitu modified phosphate buffered saline (mPBS) yang disuplementasikan 10.0% fetal bovine serum (FBS) (Supriatna et al. 1993), HECM-6 serta KSOMaa (Rosadi et al. 2008), dan medium 16 (M16) serta human tubal fluid (HTF) (Popova et al. 2011 dan Widjiati et al. 2012). Sistem Kultur secara in vitro untuk embrio mencit sangat diperlukan medium yang mampu mendukung perkembangan embrio mencit mencapai tahapan hatched blastosis. Penggunaan medium HECM-6 dan KSOMaa kurang mendukung perkembangan embrio mencit sampai tahapan hatched blastosis karena viabilitasnya yang dihasilkan rendah yaitu hanya mencapai 32.0% dan 30.0%. Sedangkan medium M16 hanya mampu mendukung perkembangan embrio sampai hatched blastosis dengan viabilitas 63.5% (Popova et al. 2011). HTF hanya mendukung embrio sampai tahapan 4 sel (Widjiati et al. 2012). Sementara itu, penggunaan medium mPBS yang disuplementasikan 10% FBS mampu mendukung perkembangan embrio mencit sampai tahapan hatched blastosis dengan ditemukan persentase viabilitasnya mencapai 88.9%. Medium PBS dirancang dengan kisaran pH 7 sampai 7.6 dan seringnya 7.4. PBS memiliki keunggulan mempertahankan pH agar tetap konstan dan memiliki osmolaritas yang cocok (isotonis) dan tidak toksik untuk sel (Dulbecco dan Vogt 1954). Pertumbuhan sel yang dikultur secara in vitro normalnya terjadi pada pH 7.4 (Freshney 1987). Adanya penambahan FBS dalam medium mPBS mendukung dengan baik perkembangan embrio blastosis mencit karena serum ini diperoleh dari sapi pada hari ke tujuh kebuntingannya (stadium embrionya diperkirakan pada tahapan blastosis) yang memiliki unsur-unsur penting untuk perkembangan embrio sesuai dengan prinsip fetal maternal relationship (Supriatna et al. 1993).
Komponen yang terkandung dalam FBS terdiri atas serum protein (albumin, globulin, α1-antitrypsin, dan αβ-makroglobulin), protein transpor (transferrin, transcortin, α1-lipoprotein, dan 1-lipoprotein), enzim (laktat dehidrogenase, alkalin pospatase, -glutamil trasnferase, alanin aminotransferase, aspartat aminotransferase), hormon (insulin, glukagon, growth hormone, prostaglandin, paratiroid, vasopressin, kortikosteroid, tirod, dan pituitari glandotropik faktor), faktor pertumbuhan dan sitokin, asam lemak dan lemak, vitamin, karbohidrat sederhana (glukosa, galaktosa, manosa, dan fruktosa), dan nitrogen nonprotein (urea, asam amino, purin atau purimidin, dan kreatinin). Fungsi penambahaan FBS yaitu menyediakan faktor hormonal yang merangsang pertumbuhan, proliferasi, dan differensiasi sel, protein dan mineral transpor yang membawa hormon, faktor penstabil dan detoksifikasi untuk menjaga pH atau menghambat enzim protease, serta melindungi sel dari stres oksidatif (Brunner et al. 2009). Serum lainnya yang mendukung kultur embrio in vitro adalah bovine serum albumin (BSA). BSA merupakan salah satu protein yang mempunyai kandungan
protein berlimpah dalam plasma yaitu 5g 500 ml-1 dan memiliki komposisi asam
amino sebanyak 20 macam (Friedli 2006). BSA juga terbukti dapat menunjang
pertumbuhan sel secara in vitro. BSA berfungsi menyediakan sejumlah faktor
pertumbuhan, mengandung hormon serta menyediakan protein pengikat yang membawa dan mengikat unsur-unsur yang berukuran kecil, sumber
bermacam-macam lemak yang dibutuhkan sel untuk hidup dan berkembang (Summer et al.
9
Mencit (Mus musculus L.)
Mencit termasuk ke dalam Ordo Rodentia yang memiliki tipe gigi pengerat. Mencit sering digunakan sebagai hewan uji karena siklus reproduksinya pendek, jumlah anak yang dihasilkan dalam satu kali melahirkan banyak (politokus), mempunyai sifat reproduksi yang hampir mirip dengan manusia dan mamalia lainnya dan mudah dalam manajemen pemeliharaan (Smith et al. 1988). Mencit mempunyai phase estrus yang biasanya di mulai antara jam 16.00 sampai 22.00 WIB. Mencit betina mau menerima pejantan untuk kawin pada tiga jam pertama pada phase estrus. Pemberian air minum biasanya dilakukan tanpa ada pembatasan (ad libitum). Konsumsi pakan oleh mencit secara normal untuk ukuran 100 g yaitu 12 sampai 18 g (rata - rata 15 g), sedangkan konsumsi air minum sekitar 15 ml (John 2013). Sedangkan Smith et al. (1988) mengemukakan untuk mencit 20 sampai 35 g, konsumsi pakan antara 3 sampai lima g hari-1 dan air minum 4-8 ml setiap hari. Air minum harus diganti 3 kali dalam seminggu. Suhu lingkungan yang ideal untuk mencit antara 18 sampai 29 oC (65 sampai 85
o
F) dengan kelembaban relatif antara 24% sampai 2.1%. Sifat biologis mencit lebih lengkapnya dapat terlihat pada Tabel 3.
Tabel 3 Sifat biologis mencit betina (Mus musculus L.)
Kriteria Keterangan
Ovulasi Dekat akhir estrus, spontan
Fertilisasi 2 jam setelah kopulasi
Implantasi 4 – 5 hari setelah fertilisasi Teknik perkawinan 4 betina untuk 1 jantan
Lama kebuntingan 19 - 21 hari
Jumlah melahirkan 5 - 10 kali per tahun
Jumlah anak setiap kelahiran Rata-rata 6, biasanya sampai 15 ekor Jumlah puting susu 3 pasang di dada dan 2 pasang di perut
Tipe plasenta Diskoidal
Tipe uterus Dupleks
Lama kawin setelah melahirkan 1 - 24 jam
Umur sapih anak 21 hari
Umur dewasa 35 hari
Umur dikawinkan 8 minggu
Berat lahir 0.5 – 1.0 g
Berat dewasa Jantan 20 – 24 g, betina 18 - 35 g.
Kecepatan tumbuh 1 g setiap hari
Aktivitas nokturnal
10
Pemilihan strain mencit yang digunakan dalam penelitian ini yaitu DDY karena memiliki jumlah anak yang lebih banyak dibandingkan strain mencit lainnya yang ada di Indonesia dan termasuk hewan yang high ovulatory (Hogan et al. 1994). Selain itu, mencit DDY sering digunakan untuk donor atau resipien embrio pada proses transgenik hewan, dan digunakan secara luas untuk penelitian toksikologi, farmakologi serta uji keamanan suatu produk (John 2013).
3
METODE
Waktu dan Tempat Penelitian
Penelitian telah dilaksanakan dari bulan Januari sampai Mei 2016. Penelitian telah dilakukan di Laboratorium Farmasi Fakultas Kedokteran Hewan (FKH) sebagai tempat ekstraksi biji kapas, Laboratorium Teknologi Pangan Pusat Antar Universitas (PAU) sebagai tempat evaporasi ekstrak biji kapas, Rumah Sakit Hewan Pendidikan (RSHP) sebagai tempat pemeliharaan dan pemberian perlakuan ekstrak biji kapas pada mencit, dan Laboratorium Fertilisasi In Vitro Fakultas Kedokteran Hewan (FKH) Intitut Pertanian Bogor (IPB) sebagai tempat pengoleksian serta pengkulturan embrio secara in vitro.
Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah neraca Ohause, neraca analitik, sonde (jarum gavage), perangkat bedah, spuit 3 ml, spuit 5 ml berjarum tumpul, filter 0.22 µm, petri dish 35 mm (SPL dan Nunclon), mikroskop fase kontras, inkubator CO2, laminar air flow, pipet Pasteur, lumpang dan alu, tapisan,
corong, gelas beker, rotary vacuum evaporator, gelas ukur, Erlenmeyer, gelas beaker, pipet tetes, dan kamera dokumentasi. Bahan yang digunakan yaitu biji kapas, pakan mencit, air minum, sekam, kapas, aquadest, etanol 80%, carboxy methyl cellulose (CMC) 0.2%, NaCl 0.9%, medium koleksi modified phosphate buffered saline (mPBS) yang disuplementasikan 5% fetal bovine serum (FBS), medium kultur embrio mPBS yang disuplementasikan 10% FBS.
Desain Penelitian
11
Prosedur Penelitian
Pembuatan Ekstrak Biji Kapas
Biji kapas yang digunakan berasal dari Balai Penelitian Tanaman Pemanis dan Serat (Balittas) Malang, Provinsi Jawa Timur. Biji kapas yang dipilih berasal dari kapas panen berumur lima bulan. Bentuk morfologi biji kapas yang digunakan yaitu bulat lonjong utuh, berwarna coklat kehitaman dan terpisah dari seratnya. Pembuatan ekstrak biji kapas melalui dua tahapan yaitu pembuatan serbuk simplisia dan pembuatan ekstrak etanol dengan metode maserasi (perendaman). Biji kapas dicuci dengan air yang mengalir kemudian dikeringkan dengan menjemur dibawah sinar matahari selama dua hari. Biji kapas kering ditimbang sebanyak 2 kg, kemudian digerus menggunakan lumpang dan alu serta disaring dengan tapisan untuk diambil serbuk simplisianya. Selanjutnya dilakukan ekstraksi dengan metode maserasi yaitu merendam 500 g dalam 2 L pelarut etanol 80% selama 3 hari. Penggantian dan penampungan pelarut ekstrak dilakukan setiap hari sampai pelarut berwarna bening. Setiap kali penampungan dilakukan filtrasi menggunakan kapas sehingga diperoleh larutan ekstrak. Filtrat dari penyaringan dipekatkan menggunakan rotary vacuum evaporator pada suhu 68 oC hingga diperoleh serbuk ekstrak. Kemudian ekstrak ditimbang dengan menggunakan neraca analitik untuk mengetahui berat rendemen ekstrak. Ekstrak biji kapas kemudian disimpan dalam kulkas pada suhu 4 oC agar tidak rusak dan tahan lama (Chandrashekar et al. 2013). Pemberian ekstrak biji kapas pada mencit berupa suspensi yang dibuat dengan melarutkan serbuk ekstrak dengan natrium-carboxy methyl cellulose (Na-CMC) 0.2%. Larutan Na-CMC 0.2% dibuat dengan melarutkan bubuk CMC sebanyak 0.2 g dalam NaCl 0.9% hingga volumenya mencapai 100 ml dan dihomogenkan dengan batang pengaduk. Larutan Na-CMC 0.2% berfungsi sebagai pelarut ekstrak.
Persiapan Hewan Coba
12
Pemberian Ekstrak Biji Kapas dan Pengawinan Hewan Coba
Pemberian ekstrak biji kapas pada mencit dilakukan setiap hari pukul 08.00 WIB secara oral sesuai dosis perlakuan selama 24 hari. Dosis ekstrak yang diberikan pada mencit masing-masing 0; 1.5; 2.1; dan 2.7 g kg-1 BB. Setelah 24 hari pemberian ekstrak biji kapas, mencit dikawinkan secara alami. Teknik pengawinan dilakukan dengan menempatkan 4 ekor betina ke dalam suatu kandang yang berisi 1 ekor mencit jantan. Penempatan mencit betina dan jantan dilakukan pada pukul 16.30 WIB selama ± satu minggu. Terjadinya koitus (hari pertama (D1) kebuntingan) diamati melalui keberadaan sumbat vagina pada besok paginya. Mencit yang telah berhasil koitus dipelihara terpisah dari mencit yang belum koitus. Mencit yang tidak ditemukan sumbat vagina tetap dibiarkan sekandang dengan jantan sampai terjadi koitus.
Pengamatan Jumlah, Stadium Perkembangan, dan Kualitas Embrio
Pengambilan data dilakukan pada hari ke empat (D4) kebuntingan mencit dengan metode euthanasia dislokasi servikalis (AVMA Guidelines 2013). Koleksi embrio dilakukan dengan metode pembilasan (flushing) pada masing-masing kornua uterus dengan 1 ml medium koleksi mPBS yang disuplementasi dengan 5% FBS menggunakan spuit berjarum tumpul ukuran 18 G. Setiap kornua uterus dibilas dari arah bifurcatio ke apex cornua uteri. Hasil bilasan ditampung dalam petri dish yang berisi 1 ml medium koleksi dan diamati di bawah mikroskop fase kontras dengan perbesaran 400 kali. Pengamatan dilakukan terhadap jumlah, stadium perkembangan, dan kualitas embrio. Pengamatan jumlah embrio dilakukan dengan menghitung langsung embrio yang berhasil dikoleksi pada D4 kebuntingan. Pengamatan stadium perkembangan embrio mencit dilakukan dengan menghitung jumlah sel blastomer dan berdasarkan penampilan morfologi (Theiler 1989). Stadium perkembangan embrio yang terdapat pada D4 kebuntingan yaitu dari morula sampai blastosis. Stadium blastosis teramati jika blastosol yang terbentuk sudah mencapai setengah ukuran embrio, blastosis awal teramati jika blastosol yang terbentuk kurang dari setengah bagian embrio, morula teramati jika susunan blastomer sudah agak bertumpuk dan sulit menghitung jumlah blastomer (16 sampai 32 sel). Embrio degenerasi teramati jika sel blastomer tidak intak, warna intensif gelap dan piknotik. Sedangkan penentuan kualitas embrio ditentukan berdasarkan metode pemeriksaan morfologi yang dimodifikasi dari Supriatna (2013).
Pengamatan Viabilitas Embrio dalam Kultur Embrio secara In Vitro
Embrio mencit terkoleksi yang sesuai dengan stadium perkembangannya pada D4 kebuntingan yaitu morula, morula kompak, blastosis awal, dan blastosis dikultur selama 48 jam. Kultur embrio dilakukan dalam 2 ml medium mPBS yang disuplementasikan 10% FBS untuk 10 sampai 15 embrio di dalam inkubator pada suhu 37 oC dengan kondisi udara 5% CO2. Pengamatan perkembangan embrio
13
Parameter yang Diamati
Parameter yang telah diamati dalam penelitian ini adalah sebagai berikut. 1. Perkembangan embrio mencit secara in vivo
Perkembangan embrio mencit yang diamati secara in vivo meliputi jumlah, stadium perkembangan, dan kualitasnya. Jumlah embrio yang berhasil dikoleksi dengan metode flushing pada D4 kebuntingan ditentukan dengan menghitungnya langsung di bawah mikroskop. Perbesaran mikroskop yang digunakan yaitu 400 kali. Penghitungan jumlah embrio dilakukan sejalan dengan penentuan stadium perkembangan dan kualitasnya. Stadium perkembangan embrio ditentukan berdasarkan morfologinya. Pengamatan terhadap morfologi embrio dilakukan terhadap jumlah blastomer, terbentuknya blastosol, dan bentuk zona pelusida. Sementara itu, penentuan kualitas embrio mencit dilakukan dengan mengamati morfologi sel blastomer (bentuk, warna, dan kesimetrisan), bentuk zona pelusida, keberadaan vakuola, pecahan sel (debris), dan blastomer yang terlepas dari ikatannya.
2. Perkembangan embrio mencit secara in vitro Viabilitas embrio mencit yang dikultur secara in vitro selama 48 jam
Perkembangan embrio mencit secara in vitro diamati selama 48 jam kultur dengan mengamati viabilitasnya. Penentuan viabilitas embrio dilakukan dengan melihat kemampuan perkembangannya ke stadium selanjutnya. Pengkulturan dilakukan terhadap embrio berstadium morula, morula kompak, blastosis awal, dan blastosis. Viabilitas perkembangan embrio dinyatakan dalam bentuk persentase embrio yang berkembang ke stadium selanjutnya yaitu blastosis, expanded blastosis, hatching blastosis, dan hatched blastosis.
Analisis Data
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan 6 ulangan dan 4 perlakuan (dosis). Data disidik dengan analisis varian (ANOVA). Perbedaan hasil uji ANOVA dilakukan uji lanjut dengan Duncan multiple range test (DMRT) pada α = 5%. Data diolah menggunakan program SPSS Versi 16.
4
HASIL DAN PEMBAHASAN
Jumlah, Stadium Perkembangan, dan Kualitas Embrio
14
pada kelompok kontrol yaitu 12 embrio, sedangkan terendah terdapat pada kelompok dosis 2.7 g kg-1 BB yaitu 4 embrio. Pada kelompok dosis 2.7 g kg-1 BB ditemukan sekitar 25% terdiri atas oosit tidak terfertilisasi. Penurunan total jumlah embrio seiring dengan peningkatan dosis ekstrak biji kapas yang diberikan yaitu 63, 49, 41, dan 30 embrio.
Gambar 2 Jumlah embrio mencit (Mus musculus L.) pada D4 kebuntingan setelah pemberian ekstrak biji kapas (Gossypium hirsutum L.). Kontrol (0 g kg-1 BB) (a), P2 (1.5 g kg-1 BB) (b), dsdhP3 (2.1 g kg-1 BB) (b), P4 (2.7 g kg-1 BB) (c). a, b, dan c menunjukkan perbedaan nyata (P < 0.05).
Penurunan perolehan jumlah embrio diduga terjadi akibat penurunan jumlah folikel. Pemberian gosipol mengakibatkan peningkatan jumlah folikel atresia pada semua tahapan perkembangan sehingga mengurangi jumlah folikel yang berkembang pada tikus (Gadelha et al. 2014b). Kejadian serupa juga terjadi pada domba bahwa pemberian gosipol menyebabkan berkurangnya jumlah folikel yang hidup dan berkembang (Camara et al. 2015). Atresia yang terjadi pada folikel primer dan primordial berdampak terhadap pengurangan jumlah folikel beserta oosit yang diovulasikan (Gadelha et al. 2014b). Oleh karena itu, jumlah embrio dari indukan yang diberikan ekstrak biji kapas lebih rendah dibandingkan kontrol seiring dengan peningkatan dosis yang diberikan pada mencit.
Pemberian ekstrak biji kapas juga memengaruhi perkembangan embrio mencit yang diamati pada D4 kebuntingan yaitu dengan ditemukan keterlambatan perkembangannya yang mencapai tahapan blastosis. Data penelitian terhadap stadium perkembangan embrio yang terdapat pada D4 kebuntingan mencit setelah pemberian ekstrak biji kapas peroral selama 24 hari disajikan pada Tabel 4. Tabel 4 Perolehan stadium perkembangan embrio mencit pada D4 kebuntingan
setelah pemberian ekstrak biji kapas
15
Pemberian ekstrak biji kapas secara signifikan mengakibatkan peningkatan
perolehan oosit tidak terfertilisasi, embrio retarded perkembangan (4 sampai 8 sel), dan pengurangan perolehan blastosis (P < 0.05) seiring peningkatan dosis yang diberikan pada induk mencit. Namun pemberian ekstrak biji kapas tidak signifikan memengaruhi perolehan embrio stadium morula, morula kompak, dan blastosis awal (P > 0.05). Dosis 1.5 g kg-1 BB hanya signifikan mengurangi persentase embrio mencit yang mencapai stadium perkembangan blastosis (57.0%) dibandingkan dengan kelompok kontrol (73.0%) (P < 0.05). Sementara itu, dosis 2.1 g kg-1 BB sudah mulai menghambat perkembangan embrio dengan ditemukan embrio retarded (8 sel) sekitar 14.0%. Pada dosis 2.7 g kg-1 BB, terjadi hambatan parah pada perkembangan embrio dengan ditemukannya embrio yang retarded (4 sampai 8 sel), embrio degenerasi, dan juga oosit yang tidak difertilisasi. Hasil penelitian ini sejalan dengan hasil penelitian pada sapi bahwa gosipol 2 g kg-1 BB selama 70 hari mengakibatkan peningkatan embrio degenerasi, oosit tidak terfertilisasi dan penurunan persentase embrio yang berkembang ke tahapan blastosis (Villasenor et al. 2008). Dosis 1.5 dan 2.1 g kg-1 BB diduga belum efektif menghambat perkembangan embrio mencit pada hari ke empat kebuntingan karena masih ditemukan embrio yang berhasil berkembang sampai tahapan blastosis.
Hambatan perkembangan embrio oleh ekstrak biji kapas yang mengandung gosipol diduga terjadi karena oosit yang berhasil difertilisasi berasal dari folikel antral yang mengalami atresia. Atresia pada folikel antral mengakibatkan penurunan kualitas dan kompetensi oosit yang dihasilkan dengan ditandai adanya pengerutan struktur oosit, nukleus piknotik, dan kerusakan lapisan kumulus oosit (Sirard et al. 2006). Selain itu, gosipol dapat secara langsung menghambat maturasi inti oosit dengan menahan proses meiosis agar tetap berada pada tahapan diploten prophase I (Lin et al. 1994). Gosipol juga mengganggu maturasi sitoplasma oosit dengan menghambat perkembangan retikulum endoplasma halus dan meningkatkan jumlah lisosom dalam ooplasma (Pan et al. 1987). Padahal ciri oosit yang kompeten untuk berkembang adalah terjadi pemekaran kumulus, maturasi inti dan maturasi sitoplasma (Cecconi 2002). Oosit yang kompeten menentukan kemampuan perkembangan embrio ke tahapan blastosis (Lonergan et al. 2000). Pemberian ekstrak biji kapas diduga mengakibatkan kerusakan pada oosit yang berdampak pada berkurangnya kompetensi oosit sehingga sedikit yang mampu difertilisasi oleh spermatozoa dan berkembang mencapai tahapan blastosis. Oleh karena itu pada pemberian dosis 2.7 g kg-1 BB (dosis tertinggi) tidak ditemukan embrio mencit yang mencapai tahapan blastosis (0.0%). Selain itu, kerusakan oosit mengakibatkan hambatan perkembangan dengan ditemukan embrio retarded (4 sampai 8 sel) (43%) dan degenerasi (20%). Embrio degenerasi diduga karena gosipol yang diberikan menyebabkan rusaknya komunikasi antar sel sehingga mengakibatkan blastomernya menjadi tidak intak (Villasenor et al. 2008).
16
yang mencegah heat shock selama awal pembelahan (Edwards dan Hansen 1996). Oleh karena itu, data penelitian yang dihasilkan menunjukkan bahwa pada dosis tinggi (2.7 g kg-1 BB) menyebabkan tingginya persentase oosit tidak terfertilisasi (25%), sedangkan pada kelompok dosis 1.5 dan 2.1 g kg-1 BB tidak terdapat oosit tidak terfertilisasi karena dosis belum efektif dalam menghambat proses fertilisasi sehingga oosit dapat berkembang menuju zigot.
Penurunan kualitas embrio terjadi seiring dengan penghambatan perkembangan setelah pemberian estrak biji kapas. Hal ini karena salah satu aspek dalam penentuan kualitas embrio mencit adalah kesesuaian stadium perkembangan embrio dengan yang diantisipasi (Supriatna 2013). Klasifikasi embrio mencit berdasarkan kualitasnya yang diamati dari pemeriksaan morfologi pada D4 kebuntingan setelah pemberian ekstrak biji kapas disajikan pada Gambar 3.
Kualitas 1 (sangat baik)
Kualitas 2 (baik)
Kualitas 3 (cukup) Kualitas 5 (degenerasi)
Gambar 3 Kualitas embrio mencit pada D4 kebuntingan. A dan B banyak terdapat pada kelompok kontrol, C dan D terdapat pada kelompok 1.5 g kg-1 BB dan 2.1 g kg-1 BB. a dan b Sel blastomer yang terlepas. Persentase embrio berdasarkan kualitasnya yang dihasilkan pada D4 kebuntingan mencit setelah pemberian ekstrak biji kapas selama 24 hari disajikan pada Gambar 4. Pemberian ekstrak biji kapas secara signifikan menurunkan kualitas embrio (P < 0.05). Perolehan kualitas embrio kategori 1 (sangat baik) signifikan menurun yaitu 54.4% (kontrol), 7.7% (dosis 1.5 g kg-1 BB), 7.1% (dosis 2.1 g kg-1 BB), dan tidak ada (0.0%) pada dosis 2.7 g kg-1 BB seiring dengan peningkatan dosis (P < 0.05). Embrio yang berkualitas 2 (baik) pun juga signifikan menurun yaitu 40.9% (kontrol), 54.9% (dosis 1.5 g kg-1 BB), 37.6% (dosis 2.1 g kg-1 BB), dan 15.1% ( dosis 2.7 g kg-1 BB). Sementara itu, kualitas embrio kategori 3 (cukup) terlihat fluktuatif yaitu meningkat pada kelompok dosis
a
b C
A B
17 1.5 g kg-1 BB (32.9%) dan 2.1 g kg-1 BB (47.0%), namun menurun pada dosis perlakuan 2.7 g kg-1 BB (29.0%).
Gambar 4 Persentase kualitas embrio mencit (Mus musculus L.) setelah pemberian
ekstrak biji kapas (Gossypium hirsutum L.). kkualitas 1, kkualitas 2, kkualitas 3, kkualitas 4, kkualitas 5. a, b, dan c pada histogram perkembangan berupa 4 sampai 8 sel, degenerasi, dan oosit tidak terfertilisasi. Hal ini sejalan dengan penelitian pada sapi bahwa pemberian ransum yang mengandung gosipol selama 76 hari menyebabkan embrio retarded dan degenenerasi sehingga banyak tergolong embrio berkualitas 5 (Villasenor et al. 2008). Pada kelompok dosis 2.7 g kg-1 BB tidak ditemukan embrio yang berkualitas 1 (sangat baik). Pemberian ekstrak biji kapas dosis 1.5 g dan 2.1 g kg-1 BB belum efektif dalam menurunkan kualitas embrio karena masih banyak ditemukan embrio berkualitas 1, 2, dan 3. Embrio kualitas 1, 2, dan 3 merupakan embrio yang masih layak transfer dan mampu berkembang ke tahapan selanjutnya.
Viabilitas Embrio dalam Kultur Embrio secara In Vitro
Penentuan viabilitas embrio dengan kultur secara in vitro penting untuk membuktikan kemampuan perkembangan (viabiitas) embrio dari indukan yang telah diberi ekstrak biji kapas peroral selama 24 hari. Pengkulturan selama 48 jam dilakukan pada embrio stadium morula, morula kompak, blastosis awal dan blastosis. Persentase perkembangan embrio stadium morula, kompak morula, blastosis awal dan blastosis mencit yang berkembang setelah 48 jam kultur secara in vitro terlihat pada Gambar 5.
18
Pemberian ekstrak biji kapas signifikan menurunkan kemampuan perkembangan embrio yang dikultur secara in vitro selama 48 jam (P < 0.05). Hal ini terlihat dari penurunan persentase embrio yang berhasil berkembang ke tahap expanded blastosis yang dikultur selama 24 jam dan tahapan hatched blastosis yang dilanjutkan kultur sampai 48 jam dibandingkan dengan kontrol (P < 0.05). Persentase embrio yang berhasil berkembang ke tahapan expanded blastosis pada kelompok kontrol (64.3%), dosis 1.5 g kg-1 BB (35.6%), dosis 2.1 g kg-1 BB (34.0%), dan 2.7 g kg-1 BB (3.0%) setelah kultur secara in vitro selama 24 jam. Kultur lanjutan sampai 48 jam menunjukkan persentase embrio yang berhasil mencapai tahapan hatched blastosis pada kelompok kontrol (65.0%) lebih tinggi dibandingkan dosis 1.5 g kg-1 BB (27.0%), dosis 2.1 g kg-1 BB (14.3%), dan dosis 2.7 g kg-1 BB (0.0%). Hasil penelitian ini sejalan dengan penelitian Lin et al. (1989) bahwa pemberian gosipol dosis tinggi (265 ng) pada kultur embrio blastosis tikus juga mengakibatkan kegagalan perkembangannya mencapai tahapan hatched blastosis (0.0%).
Gambar 5 Persentase embrio dari morula, morula kompak, blastosis awal, dan blastosis mencit yang berkembang setelah kultur secara in vitro selama 48 jam. morula, morula kompak, blastosis awal, blablastosis, eeeexpanded blastosis, kkhatching blastosis, hatched blastosis. a dan b pada setiap histogram di antara perlakuan di atas menunjukkan perbedaan nyata (P < 0.05).
19 dish pada kultur secara in vitro. Galvao et al. (2006) mengemukanan kesesuian stadium perkembangan embrio dengan waktunya sangat mendukung keberhasilan implantasi embrio. Oleh karena itu, diduga embrio yang hanya sampai tahapan blastosis setelah kultur 48 jam ini (D6 perkembangan secara in vivo) tidak akan berhasil implantasi dan berkembang lanjut. Hal ini juga diperkuat oleh penelitian Villasenor et al. (2003) bahwa embrio sapi dari indukan yang sudah diberi pakan campuran gosipol memiliki daya perkembangan yang rendah setelah ditransferkan pada resepien normal.
Data dari hasil penelitian memperlihatkan bahwa embrio yang dapat berkembang baik selama kultur 48 jam adalah blastosis dibandingkan morula, morula kompak, dan blastosis awal. Hal ini diduga karena embrio blastosis berasal dari oosit yang masih berkualitas baik sehingga berhasil berkembang ke tahapan expanded dan hatched blastosis. Pemberian ekstrak biji kapas menyebabkan embrio tahapan morula dan kompak morula sedikit yang dapat berkembang setelah kultur 48 jam. Gordon (2003) mengemukakan bahwa perkembangan morula menuju morula kompak merupakan tahapan perkembangan penting yang mendukung pembentukan blastosis seperti terjadinya pembentukan tight junction yang penting untuk ekspansi blastosol. Pemberian ekstrak biji kapas diperkirakan dapat merusak pembentukan tight junction sehingga ikatan blastomer pada embrio morula menjadi longgar dan terjadi degenerasi. Hal ini terbukti dari hasil penelitian bahwa pada mencit yang diberi perlakukan dosis ekstrak biji kapas 2.7 g kg-1 BB menghasilkan embrio morula yang degenerasi (20.0%). Hasil pengamatan terhadap total persentase perkembangan embrio mencit yang berkembang pada kultur secara in vitro selama 48 jam disajikan pada Tabel 5. Tabel 5 Total persentase embrio mencit yang berkembang setelah kultur secara in
vitro setelah 48 jam Keterangan : Superscript yang berbeda pada kolom yang sama menyatakan perbedaan nyata (P <
0.05). n = jumlah, % = persentase embrio, dan std = standar deviasi.
20
dan retarded perkembangan gagal berkembang pada kultur 24 jam. Nasim et al. (1995) mengemukakan bahwa kematian embrio dini dapat terjadi sebelum tahapan 16 sel karena disebabkan oleh kerusakan pada oosit. Hal ini diperkuat oleh Sirard et al. (2006) dan Cecconi (2002) bahwa embrio yang berasal dari oosit yang kurang kompeten dapat mengurangi kemampuan perkembangannya ke tahapan lebih lanjut. Oleh karena itu, diperkirakan penurunan persentase embrio mencit terjadi karena pemberian ekstrak biji kapas merusak oosit sehingga tidak mampu untuk berkembang lanjut menjadi embrio.
Kultur embrio dari 24 menuju 48 jam menurunkan kemampuan embrio untuk berkembang lanjut secara tidak nyata. Berdasarkan hal ini diduga bahwa embrio yang masih berkembang baik ketika dilanjutkan kultur sampai 48 jam kemungkinan berasal dari oosit yang masih berkualitas bagus dan komposisi medium yang digunakan mampu mendukung perkembangan embrio. Nutrisi merupakan komponen penting yang mendukung perkembangan embrio preimplantasi (Said et al. 2011). Persentase embrio yang berkembang setelah 48 jam paling rendah pada kelompok dosis 2.7 g kg-1 BB karena perolehan embrio degenerasi dan retarded perkembangan paling tinggi pada kelompok ini. Hasil penelitian juga menunjukkan bahwa dosis ekstrak biji kapas 1.6 dan 2.1 g kg-1 BB belum efektif memengaruhi jumlah, kualitas, dan hambatan perkembangan embrio karena masih terlihat ada embrio yang mampu berkembang sampai tahapan hatched blastosis.
21
5
SIMPULAN DAN SARAN
22
DAFTAR PUSTAKA
Aak. 1992. Bertanam Kapas. Yogyakarta (ID): Kanisius Pr.
Akbar B. 2010. Tumbuhan dengan Kandungan Senyawa Aktif yang Berpotensi sebagai Bahan Antifertilitas. Jakatra (ID): Adabia Pr.
Amini A, Kamkar F. 2005. The effect of gossypol on spermatogenesis in NMRI mice. Ir Sci Tech. 29(1):123-134.
AVMA [American Veterinary Medical Association]. 2013. Guidelines for the Euthanasia of Animals. Schaumburg (DE): Meacham Road Pr.
Bai J, Shi Y. 2002. Inhibition of T-type Ca2+ currents in mouse spermatogenic cells by gossypol, an antifertility compound. Eur Pharmacol. 440(2):1-6. Bakri NM, Ibrahim SF, Osman NA, Hasan N, Jaffar FHF, Rahman ZA. 2016.
Embeyos apoptosis identification: oocyte grade or cleavage stage. Saudi Biol Sci. 23(6):50-55.
Basini G, Bussolati S, Baioni L, Grasselli F. 2009. Gossypol, a polyphenolic aldehyde from cotton plant interferes with swine granulosa cell function. Dom Anim Endocrinol.37(9):30-36.
Bender HS, CaceciT, Misra HP. 1988. A ultrastructural study of the effect of gossypol on the endometrium of the female Rat. Ultrastruc Mol Struc Res. 101(8):137-145.
Bettger WJ, McKeehan WL. 1986. Mechanisms of cellular nutrion. Physiol Rev. 66 (3): 1-35.
Brocas C, Rivera MR, Paula-Lopes FF, McDowell LR, Calhoun MC, Staples CR, Wilkinson NS, Boning AJ, Chenoweth PJ, Hansen PJ. 1997. Deleterious actions of gossypol on bovine spermatozoa, oocytes, and embryos. Biol Reprod. 57(7): 901-907.
Brunner D, Frank J, Appl H, Schoffl H. 2009. Serum free cell culture: The serum free media interactive. Article Altex. 27(1):1-10.
Camara ACL, Gadelha ICN, Borges PAC, Paiva SA, Melo MM, Blanco BS. 2015. Toxicity of gossypol from cottonseed cake to sheep ovarian follicles. Research article Plos One. 10(11)1-11. doi: 10.1371/journal.pone.0143 2.18.
Chandrashekar R, Kumar AK, Reddy YR, Chaitanya PJ, Bhavani NL, Pochampalli J. 2013. Isolation of gossypol and analysis of phytochemicals in seed extract of bt and non-bt varieties of cotton. Pharm Phytochem. 2(1):180-187.
Cecconi S. 2002. Growth and differentiation of small ovarian follicles in mammals: problems and future perspective. Reprod Dev. 48 (5): 431-445. Ceron H, Jousan FD, Soto P, Hansen PJ. 2005. Timing of inhibitory action of
gossypol on cultured bovine embryos. Dairy Sci. 88(20): 922-928.
Cheng JS, Lo KY, Yeh JH, Cheng HH, Liu CP, Chen WC, Jan CR. 2003. Effect of gossypol on intracellelar Ca2+ regulation in human hepatoma cells. Chin Physiol. 46: 117-122.
Cuellar A, Ramirez J. 1993. Further studies on the mechanism of action of gossypol on mitochondrial membrane. Int Biochem. 25(8):1149-1155. Dalton JC. 2003. Cottonseed product and natural service bulls. Caldwell Res
23 Dulbecco R, Vogt M. 1954. Plaque formation and isolation of pure lines with
poliomyelitis viruses. Exp Med. 99:167–182.
Edwards JL, Hansen PJ. 1996. Elevated temperature increases heat shock protein 70 synthesis in bovine two cell embryos and compromises function of maturating oocytes. Biol Reprod. 55:340-346.
Freshney RI. 1987. Culture of Animal Cells: A Manual of Basic Technique 2nd. New York (UK). Alan R Liss Inc.
Friedli, George L. 2006. Interaction Of SWP With Bovine Serum Albumin (BSA).
http://www.friedli.com/research/PhD/chapter5.html. Tanggal akses 20
September 2016.
Gadelha ICN, Fonsesa NBS, Oloris SCS, Melo MM, Blanco SB. 2014a. Gossypol toxicity from cottonseed products. Sci World. 14 (1):1-9. doi: 10.1155/2014/231635.
Gadelha ICN, deMacedo MF, Melo MM, Blanco BB. 2014b. Gossypol promotes degeneration of ovarian follicles in rats. Sci Word. 14 (2): 1-7.
Galvao KN, Santos JEP, Coscioni AC, Juchem SO, Chebel RC, Sischo WM, Villasenor M. 2006. Embryo survival from gossypol feed heifers after transfer to lactating cows treated with human chorionic gonadotropin. Dairy Sci. 23(6):123-131.
Gardner D. 2007. In Vitro Fertilization: A Practical Approach. New York (UK): Informa Healthcare Pr.
Gordon I. 2003. Laboratory Production of Cattle Embryos 2nd. Cambridge (US): CABI Publishing. Contraceptive gossypol blocks cell to cell communication in human and rat cells. Eur Pharm. 313(6): 242-255.
Hogan B, Beddington R, Costantini F, Lacy E. 1994. Manipulating the Mouse Embryos. USA (US): Cold Spring Harbor Laboratory Pr.
Hu YF, Chang CJG, Brueggemeier RW, Lin YC. 1993. Gossypol inhibits basal and estrogen stimulated and DNA synthesis in human breast carcinoma cells. Life Sci. 53(3):433-438.
John E, Harkness, Joseph E, Wagner. 2013. The biology and medicine of rabbits and rodents. [internet].[diunduh 24 mei 2015]. Tersedia pada http://www.nap.edu/readingroom/books/labrats/contents.html.
24
Kovacic P. 2003. Mechanism of drug and toxic actions of gossypol: focus on reactive oxygen species and electron transfer. Curr Medic Chem. 10(24): 2711-2718.
Li YF, Booth FG, Seegmillier RE. 1989. Evidence for embryotoxicity of gossypol in mice and chicks with no evidence of mutagenic activity in the ames test. Reprod Toxic. 3(9):59-62.
Lin YC, Rajamahendra R, Rikihisa Y, Gwazdauskas FCG. 1989. Effect of gossypol and its metabolite on in vitro early development of mouse embryos. Theriogenology. 31(4):727-740.
Lin YC, Rajamahendra R, Rikihisa Y. 1991. Inhibition of rat embryo implantation in the gossypol treated uterine horn. Theriogenology. 35(4):769-776.
Lin YC, Gu Y, Brueggemeier RW, Rikihisa Y. 1992. Binding of 3H-Gossypol in organelles of cultured bovine luteal cells. Life Sci. 50(6):443-447.
Lin YC, Sanbuissho A, Coskun S, Rikihisa Y. 1994. Inhibition of in vitro fertilization and early embryonic development in hamsters by gossypol. Life Sci. 55(14):1610-1620.
Lindner GM, Raymond W, Wright JR. 1983. Bovine embryo morphology and evaluation. Theriogenology. 20(4):407-417. doi.10.1016/0093-691X(83)902 01-7.
Lonergan P, Rizos D, Ward F, Boland MP. 2000. Factors influencing oocyte and embryo quality in cattle. Reprod Nutr Dev. 41(1):427-437.
Murray RK, Granner DK, Rodwell VW. 2006. Biokimia Harper. Pendit BU, penerjemah; Wulandari N, Dwijayathi L, Liena, Dany F, Rachman Ly, editor. Jakarta (ID): EGC. Terjemahan dari: Harper’s Ilustrated Biochemistry. Ed ke-27.
Moon DO, Choi YH, Moon SK, Kim WJ, Kim GD. 2011. Gossypol decreases tumor necrosis factor a-induced intercellular adhesion molecule-1 expression via suppression on NF-jB activity. Food Chem Toxicol.49(11):999-1008. doi.10.1016/j/fct.2011.10.006.
Nawrot TS, Hond ED, Fagard RH, Hoppenbrouwers K, Staessen JA. 2003. Blood pressure, serum total cholesterol, and contraceptive pill use in 17 year old girls. Eur Cardiovasc Pretention Rehab. 10(1):438-442.
Nasim A, Schrick FN, Butcher RL, Inskeep EK. 1995. Effect of persistent follicles on early embryonic losses in beef cows. Biol Reprod. 52(5):1129-1135.
Neganova IEGG, Sekirina, Ritter UE. 2000. Surface-expressed E-cadherin, and mitochondrial and microtubule distribution in rescue of mouse embryos from 2-cell block by aggregation. Mol Hum Reprod. 6 (2): 454-46.
Pan LC, Nadakavukaren MJ, Jensen DR. 1987. Effects of ingested gossypol on the ultrastructure of rat ovarian follicles. Cell Tissue Res. 21.5(87):215- 220. Popova E, Bader M, Krivokharchenko A. 2011. Effect of culture conditions on viability of mouse and rat embryos developed in vitro. Genes. 2(11):332-344. doi. 10.3390/genes2020332.
25 Rosadi B, Setiadi MA, Sayuthi D, Boediono A. 2008. Perkembangan embrio mencit dan hamster dalam medium KSOMaa dan HECM-6. Veteriner. 9(4):157-165.
Said S, Astirin OP, Wahyuningsih S. 2011. Tingkat fertilisasi dan perkembangan embrio mencit yang diberi ekstrak buah merah. Med Petern. 34(2): 112-116.
Shaaban WF, Taha TA, El-Nouty FD, El-Mahdy AR, Salem MH. 2007. Reproductive toxicologic effects of gossypol on male rabbits: biochemical, enzymatic, and electrolytic properties of seminal plasma. Fertil Steril. 89(3):1-11. doi.10.1016/j.fernstert.2007.06.077.
Setiawan B, Sehartono E. 2007. Peroksidasi lipid dan penyakit trekait stress oksidatif pada bayi premature. Maj Koedokt Indon. 57(1):1-8.
Singla N, Garg M. 2013. Effect of crude cottonseed oil containing gossypol on fertility of male and estrous cycle of female Bandicota bengalensis Gray and Hardwicke. Appl Anim Res. 41(2):156-165.
Sirard MA, Richard FO, Blondin P, Robert C. 2006. Contribution of the oocyte to embryo quality. Theriogenology. 65(6):126-136.
Smith JB, Mangkoewidjoyo. 1988. Pemeliharaan, Pembiakan, dan Penggunaan Hewan Coba di Daerah Tropis. Jakarta (ID): Universitas Indonesia Pr. Summer MC, McGinnis LK, Lawitts JA, Raffin M, Biggers, FD. 2000. IVF of
mouse ova in a simplex optimized medium supplemented with amino acids. Hum Reprod. 15(8):1791-1801.
Supriatna I. 2013. Transfer Embrio pada Ternak Sapi. Bogor (ID): Seameo Biotrop.
Supriatna I, Tolihere MR, Yusuf TL, Purwantara B. 1993. Pengaruh penambahan fetal serum, calf serum, dan bovine serum dalam pupukan in vitro terhadap viabilitas embrio mencit. Laporan Penelitian. Bogor (ID): Institut Pertanian Bogor. Chenoweth PJ, Martin FG, Williams Sn, Rojas LX, Calhoun MC, Wilkinson NS. 2002. Long term effect of feeding gossypol and vitamin E to dairy calves. Dairy Sci.82(1):1240-1251.
Villasenor M, Coscioni AC, Galvao KN, Juchem, Santos JEP, Puschner B. 2003. Effect of gossypol intake on plasma and uterine gossypol concentrations, on embryo development, and viability in vivo and in vitro. Dairy Sci. 86(1): 240-250.
Villasenor M, Coscioni AC, Galvao KN, Chebel RC, Santos JEP. 2008. Gossypol distrupts embryos development in Heifers. Dairy Sci. 91(8):3015-3024. doi:10.3168/jds.2007-0939.
26
White IG, Viswanath R, Swan MA, Brown-Woodman PD. 1988. Studies of the mechanism of action of gossypol as a male antifertility agent. Contraception. 37(3):123-129.
Young C, Lin M, Chitcharoenthum, Yasuko R. 1985. Effect of gossypol on thyroid hormones in young female rats. Contraception. 41(4):1-10.
Yuan YY, Shi QX. 2000. Inhibition of hamster sperm acrosomal enzyme by gossypol is closely associated with the decrease in fertilization capacity. Contraception. 62(2): 203-209.
Yurekli B, Karaca B, Cetinkalp S, Uslu R. 2009. Can gossypol be a hope for transsexual patients (male to female) before sex reassignment surgery. Med Hypoth. 73(623):1-6. doi. 10.1016/j.mehy.2009.06.042.
27