TESIS
OLEH: BETTY
PROGRAM PENDIDIKAN DOKTER SPESIALIS DEPARTEMEN PATOLOGI ANATOMI
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
TESIS
OLEH: BETTY No. Reg: 16.322
Diajukan Untuk Melengkapi Persyaratan Untuk Mencapai Keahlian Dalam Bidang Patologi Anatomi
Pada Fakultas Kedokteran Universitas Sumatera Utara
PROGRAM PENDIDIKAN DOKTER SPESIALIS DEPARTEMEN PATOLOGI ANATOMI
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
PERANAN PEMERIKSAAN IMUNOHISTOKIMIA COX-2 PADA LESI GASTRITIS, PRE-KANKER DAN KANKER LAMBUNG
T E S I S
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang
pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi,
dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah ini dan disebutkan dalam daftar pustaka.
Medan, 22 Oktober 2007
No. Register : 16.322
Program Studi : Program Pendidikan Dokter Spesialis Patologi Anantomi
TESIS INI TELAH DIPERIKSA DAN DISETUJUI OLEH :
PEMBIMBING I
[ Prof.dr.Gani W.Tambunan,SpPA(K) ]
NIP : 130 279 484
PEMBIMBING II
( dr.H.Delyuzar,SpPA )
NIP : 131 882 293
Ketua Program Pendidikan Ka. Depatermen
Dokter Spesialis Patologi Anatomi Patologi Anatomi FK - USU Medan
( dr.H.Joko S.Lukito,SpPA ) ( dr.H.Soekimin,SpPA )
Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara
Abstrak
Kanker lambung adalah jenis kanker kedua terbanyak di dunia. Walaupun
penyebabnya belum diketahui secara pasti, namun diduga merupakan kondisi akhir
dari proses yang multifaktorial, multistep dan multigenetik. Perkembangan
karsinoma lambung menurut Correa (1975) berupa gastritis kronik-gastritis
atrofi-metaplasia intestinal yang selanjutnya mengalami kelainan genomik dan fenotip
menjadi displasia serta neoplasia. Sejak 1983, Barry Marshall dan Robert Warren
(Australia) menemukan bahwa infeksi kronis Helicobacter pylori (kadang sejak
masa anak-anak) pada lambung dapat menyebabkan gastritis atrofi, metaplasia
intestinal, displasia dan karsinoma. Lesi-lesi ini juga sering ditemukan secara
ko-insiden. Pada tahun 1994, kelompok kerja IARC (International Agency for Research
on Cancer) dan WHO telah mengklasifikasikan Helicobacter pylori sebagai
karsinogenik kelompok I. Berdasarkan beberapa studi sebelumnya menyokong
bahwa Cyclooxygenase-2 (COX-2) mempunyai tampilan yang kuat pada tumor
gastrointestinal, dan beberapa jenis kanker seperti kolorektal, pankreas,
hepatoseluler, esofagus maupun lambung. Pada penelitian ini kami melihat
tampilan COX-2 pada lesi gastritis, pre-kanker dan kanker lambung dengan
melakukan pemeriksaan imunohistokimia COX-2 terhadap 48 sampel sediaan blok
parafin dari jaringan biopsi lambung. Luas tampilan COX-2 yang terbanyak adalah
persentase luas tampilan sedang (10-50% sel epitel yang tertampil positif) baik
pada sel epitel foveolar permukaan maupun pada sel epitel kelenjar. Ini terutama
Kesimpulan
Luas tampilan hasil pulasan imunohistokimia COX-2 pada sel epitel kelenjar
ditemukan berhubungan dengan derajat progresif lambung, namun tidak pada sel
epitel foveolar permukaan.
Department of Pathology of Anatomy, Faculty Medicine of North Sumatra University
Abstract
Gastric cancer is the second most common cancer in the world. Although its cause
not yet been known surely, but estimated that is the late conditions of multifactorial,
multistep and multigenetic processes. Growth of gastric cancer according to Correa
(1975) is from chronic gastritis – gastric atrophic – intestinal metaplasia, later on
experience of the disparity of genomic and fenotype become dysplasia and
neoplasia. Since 1983, Barry Marshall and Robert Warren (Australian) find that
chronic infection of Helicobacter pylori (sometime since childhood) at stomach can
leading cause of gastric atrophic, intestinal metaplasia, dysplasia and gastric
carcinoma. These lesions also often founded co-incidence. On 1994, Working team
IARC (International Agency for Research on Cancer) and WHO have classified
Helicobacter pylori as group I carcinogenic. According to some study previously
contribute that Cyclooxygenase-2 (COX-2) have the strong expression in
gastrointestinal tumours, and some cancer type of colorectal, pancreas,
hepatocellular, oesophagus and also gastric. At this research, we see the
expression of COX-2 in gastritis, gastric pre-cancer and cancer lesion by COX-2
immunohistochemistry to 48 sample paraffin block from biopsy of stomach tissue.
The most wide COX-2 expression is moderately wide percentage of expression
(10-50% epithelial cells which are positive) both in epithelial cells of foveolar surface
and also in epithelial cells of glands. There are most founded in pre-cancer lesions
especially atrophic gastritis (25,9% epithelial cells of foveolar surface and 55,0%
Conclusion
Wide expression of resulted COX-2 immunohistochemistry staining in
epithelial cells of glands found to related to the progressive degree of gastric
lesions, but not in epithelial cells of foveolar surface).
Puji syukur ke Hadirat Tuhan Yang Maha Esa, berkat Rahmat dan Kasih Nya,
saya dapat menyelesaikan penelitian dan penulisan tesis ini, yang merupakan salah
satu persyaratan untuk memperoleh keahlian dalam bidang Patologi Anatomi di
Fakultas Kedokteran Universitas Sumatera Utara Medan.
Dengan berkembangnya ilmu pengetahuan khususnya dalam bidang
kedokteran yang begitu pesat, saya menyadari sepenuhnya bahwa tesis ini masih
jauh dari sempurna, namun besar harapan saya kiranya tulisan ini dapat
disumbangkan dan dimanfaatkan dalam menambah kepustakaan, terutama dalam
bidang Patologi Anatomi serta bidang ilmu yang berkaitan dengan tulisan ini
tentang Tampilan Imunohistokimia COX-2 pada Lesi Gastritis, Pre-kanker dan
Kanker Lambung.
Dengan selesainya penelitian dan penulisan tesis ini, sebagai tugas akhir
studi saya, dalam kesempatan ini perkenankanlah saya untuk menyampaikan rasa
terima kasih dan penghargaan yang setinggi-tingginya terutama kepada Bapak
Rektor Universitas Sumatera Utara dan Bapak Dekan Fakultas Kedokteran
Universitas Sumatera Utara yang telah memberi kesempatan kepada saya untuk
mengikuti Program Pendidikan Dokter Spesialis di Bidang Patologi Anatomi
Utara/RSUP H.Adam Malik Medan, serta dr.H.Joko S.Lukito, SpPA, selaku Ketua
Program Pendidikan Dokter Spesialis Bidang Patologi Anatomi, yang telah bersedia
menerima, mendidik, membimbing serta senantiasa mengayomi saya setiap hari
dengan sabar selama menjalani pendidikan; juga kepada dr.T.Ibnu Alferaly, SpPA
selaku Sekretaris Departemen Patologi Anatomi Fakultas Kedokteran Universitas
Sumatera Utara yang telah banyak memberi masukan serta bimbingan selama
menjalani pendidikan.
Saya ucapkan terima kasih yang sedalam-dalamnya dan penghargaan
setinggi-tingginya khususnya kepada Pembimbing I saya, Guru Besar di
Departemen Patologi Anatomi Universitas Sumatera Utara, Prof.dr.Gani
W.Tambunan, SpPA(K), yang tidak bosan-bosannya membimbing, mendorong
serta memberi semangat kepada saya dalam menyelesaikan penelitian dan
penulisan tesis ini. Juga kepada dr.H.Delyuzar, SpPA, selaku Pembimbing II yang
dalam kesibukan sehari-hari masih menyempatkan diri untuk memberi bimbingan
dan dukungan dalam menyelesaikan penelitian dan penulisan tesis saya ini. Tidak
lupa saya ucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada
Prof.dr.H.M.Nadjib Dahlan Lubis, SpPA(K), selaku Guru Besar Departemen
Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara yang telah
Husodowijoyo, SpPA, walaupun telah menjalani masa purnabakti namun tetap
semangat dan aktif dalam membimbing dan mendidik saya selama ini.
Dalam kesempatan ini saya juga mengucapkan terima kasih kepada
dr.Bethy S. Hernowo, SpPA(K),PhD, selaku Kepala Laboratorium Patologi Anatomi
Sandia di Rumah Sakit Santoso Bandung yang telah banyak meluangkan waktu
untuk membimbing dan memberi kesempatan kepada saya untuk melakukan
pemeriksaan imunohistokimia di Laboratorium Sandia Rumah Sakit Santoso
Bandung dan juga kepada para staf analis di Laboratorium Sandia Bandung serta
PT.Sanbe Farma yang telah banyak membantu saya dalam hal moril maupun
material, saya ucapkan banyak terima kasih.
Saya juga ingin mengucapkan terima kasih yang sebesar-besarnya kepada
para supervisor di Depertemen Patologi Anatomi Fakultas Kedokteran Universitas
Sumatera Utara/RSUP H. Adam Malik Medan, dr.Sumondang Pardede, SpPA;
dr.Jamaluddin Pane, SpPA; dr.Lisdine, SpPA, dr.T.Intan Kemala, M.Pd dan
dr.Stephan Udjung, SpPA yang telah banyak membimbing saya selama menjalani
pendidikan. Terima kasih juga kepada dr.Arlinda Sari Wahyuni, M.Kes. yang telah
mampu melindungi dan menghantarkan saya dalam meraih cita-cita. Terima kasih
untuk suamiku tercinta atas kesabaran, pengorbanan, dorongan dan doa yang
selalu diberikan selama saya menjalani pendidikan, juga untuk putra putri yang
saya cintai dan sayangi Ericko Govardi dan Steffie Goviani, yang telah banyak
berkorban dan memberi semangat kepada mama dalam menyelesaikan pendidikan.
Dan akhirnya kepada teman sejawat para senior, PPDS, pegawai dan para
analis di Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera
Utara, saya ucapkan terima kasih atas segala bantuan dan dukungan kepada saya.
Selama saya mengikuti pendidikan tentunya saya tidak luput dari kesalahan dan
kekhilafan baik yang sengaja ataupun tidak sengaja, dalam kesempatan ini saya
menyampaikan permohonan maaf yang sebesar-besarnya. Semoga Tuhan yang
Maha Esa senantiasa memberikan Berkat dan Rahmat Nya kepada kita semua.
Medan, 22 Oktober 2007
Penulis,
ABSTRAK... i
ABSTRACT... ... iii
KATA PENGANTAR... v
DAFTAR ISI... ix
DAFTAR TABEL... xii
DAFTAR GAMBAR... xiii
BAB 1. PENDAHULUAN 1.1. Latar Belakang Masalah... 1
1.2. Identifikasi Masalah... 4
1.3. Tujuan Penelitian ... 4
1.3.1. Tujuan Umum ... 4
1.3.2. Tujuan Khusus ... ... 4
1.4. Hipotesa ... 5
1.5 Manfaat Penelitian ... 5
BAB 2. TINJAUAN PUSTAKA 2.1. Lambung Normal... 6
2.1.1. Anatomi Dan Histologi Lambung... 6
2.1.2. Fisiologi Lambung... 9
2.2. Helicobacter pylori ... 13
2.4.3. Metaplasma Intestinal ………... 42
2.4.4. Displasia Lambung... 44
2.4.5. Kanker Lambung ... 48
2.4.6. Kanker Dini Lambung ... 52
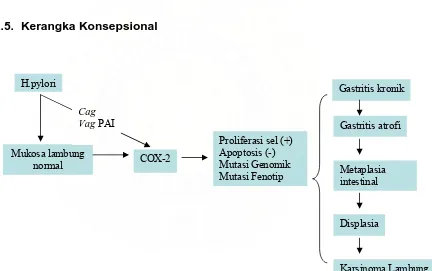
2.5. Kerangka Konsepsional ... 54
BAB 3. METODOLOGI PENELITIAN 3.1. Tempat dan Waktu Penelitian ... 55
3.1.1. Tempat Penelitian ... 55
3.1.2. Waktu Penelitian ... 55
3.2. Metode Rancangan ... 55
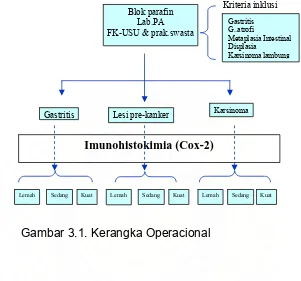
3.3. Kerangka Operasional ... 56
3.4. Populasi, Sampel dan Besar Sampel Penelitian ……… ... 56
3.4.1. Populasi ……….. ... 56
3.4.2. Sampel ……… ... 56
3.4.3. Besar Sampel Penelitian ………. .. 57
3.5. Kriteria Inklusi Dan Eksklusi ……… ... 58
3.5.1. Kriteria Inklusi……… ... 58
3.5.2. Kriteria Eksklusi ………... 58
3.6. Variabel Penelitian dan Defenisi Operasional... 58
3.6.1. Variabel Penelitian……… ... 58
3.6.2. Definisi Operasional Variabel ... 59
3.7. Prosedur Penelitian ... 62
3.7.1. Pembuatan Sediaan Mikroskopis... 62
3.9. Instrumen Penelitian ... 67
3.10. Teknik Analisa Data ... 68
BAB 4. HASIL DAN PEMBAHASAN 4.1. Hasil Penelitian ... 69
4.2. Pembahasan ... 75
BAB 5. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 78
5.1.1. Umum ... 78
5.1.2. Khusus ... 78
5.2. Saran... 79
DAFTAR PUSTAKA ... 80
LAMPIRAN-LAMPIRAN... 86
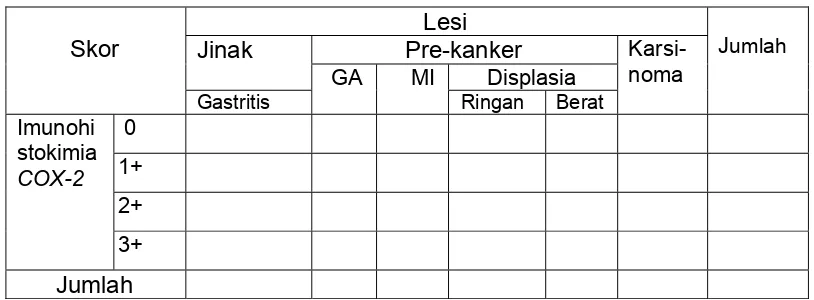
3.1. Luas tampilan imunohistokimia COX-2 pada lesi gastritis, pre-kanker
dan kanker pada lambung ………... 68
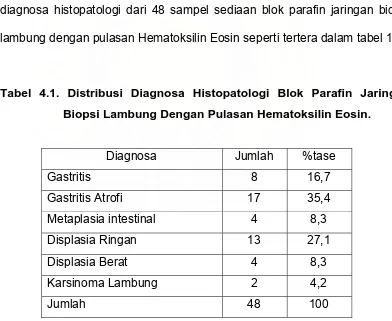
4.1. Distribusi Diagnosa Histopatologi Blok Parafin Jaringan Biopsi
Lambung Dengan Pulasan Hematoksilin Eosin... 69
4.2 Distribusi Kasus Menurut Umur ……... 70
4.3. Luas Tampilan Pulasan Imunohistokimia COX-2 Pada Sel Epitel
Foveolar Permukaan ... 70
4.4. Luas Tampilan Pulasan Imunohistokimia COX-2 Pada Sel Epitel
Kelenjar Lambung ... 71
4.5. Tampilan Pulasan Imunohistokimia COX-2 Pada Sel
Stroma ... 72
4.6. Hubungan Antara Luas Tampilan Hasil Pulasan Imunohistokimia
COX-2 Pada Sel Epitel Foveolar Permukaan Dengan Derajat Progresif Lesi
Lambung ... 73
4.7. Hubungan Antara Luas Tampilan Hasil Pulasan Imunohistokimia
COX-2 Pada Sel Epitel Kelenjar Lambung Dengan Derajat Progresif
Gambar Halaman
2.1. Anatomi lambung ... 7
2.2. Pengaliran HCO3- melalui pembuluh kapiler ………... 9
2.3. Gambaran sekresi asam oleh sel parietal ... 12
2.4. Sekresi asam lambung ... 12
2.5. Natural course of Helicobacter pylori Infection ……… 35
2.6. Skema patogenesis karsinogenesis pada lambung ………... 51
2.7. Skema Kerangka Konsepsional ... 54
BAB 1 PENDAHULUAN
1.1. Latar Belakang Penelitian
Kanker lambung adalah jenis kanker kedua terbanyak di dunia.
Sampai saat ini kanker lambung masih merupakan masalah di dunia,
walaupun insidennya telah menurun pada beberapa dekade terakhir ini
pada beberapa negara seperti AS dan Inggris. Terdapat perbedaan insiden
di antara benua dan keragaman populasi. Angka insiden yang tertinggi
terdapat di Asia (terutama negara Jepang), Eropa Barat dan Amerika
Selatan. Di AS, kanker lambung merupakan penyebab kematian terbanyak
urutan ke-7 yang disebabkan kanker.1,2,3,4
Penyebab pasti patogenesis karsinoma lambung masih belum
diketahui, namun diduga karsinoma lambung merupakan kondisi akhir dari
proses yang multifaktorial, multistep dan multigenetik. Patogenesisnya
dipengaruhi oleh berbagai faktor termasuk faktor genetik, diet, lingkungan
dan infeksi virus maupun bakteri. Insiden kanker lambung banyak
ditemukan pada umur di atas 50 tahun, jarang pada umur di bawah 30
tahun. Status sosioekonomi dan pendidikan yang rendah beresiko 2 kali
lebih tinggi terhadap karsinoma lambung dibandingkan dengan
Menurut Correa (1975), berdasarkan identifikasi gambaran
histopatologi paradigma karsinogenesis lambung yang mengawali
perkembangan karsinoma lambung berupa gastritis kronik - gastritis atrofi -
metaplasia intestinal yang selanjutnya mengalami kelainan genomik dan
fenotip menjadi displasia serta neoplasia invasif. Namun sejak
ditemukannya Helicobacter pylori oleh Barry Marshall dan Robert Warren
(Australia) pada tahun 1983, telah terjadi perkembangan ilmu yang sangat
pesat di dunia kedokteran khususnya di bidang gastroenterologi dan di
dukung oleh beberapa penelitian akhir-akhir ini, telah ditemukan bahwa
infeksi Helicobacter pylori yang berlangsung kronis (kadang infeksi telah
dimulai sejak masa anak-anak) dapat menimbulkan gastritis atrofi,
metaplasia intestinal, displasia dan karsinoma. Lesi-lesi ini juga sering
dijumpai bersama-sama. Akhir-akhir ini selain dihubungkan dengan
karsinoma lambung, infeksi H.pylori juga sering dihubungkan dengan
limfoma MALT (Mucosa-associated Lymphoid Tissue). Sejak tahun 1994,
kelompok kerja IARC (International Agency for Research on Cancer) dan
WHO telah mengklasifikasikan Helicobacter pylori sebagai karsinogenik
kelompok I.1,3,4,5
Keterlibatan infeksi Helicobacter pylori dalam karsinogenesis
lambung yaitu dengan meningkatkan kadar COX-2 akan merangsang
pelepasan prostaglandin E2 dalam lesi pre-kanker dan keganasan
lambung yang berhubungan dengan Helicobacter pylori. Beberapa studi
yang diinduksi enzim Cyclooxygenase mengubah asam arakidonat menjadi
prostanoid, mempunyai tampilan kuat pada tumor gastrointestinal.
Tampilan COX-2 telah dilaporkan pada kanker kolorektal, kanker pankreas,
karsinoma hepatoselular, kanker esofagus dan kanker lambung. Pengaruh
rangsangan isoform COX terhadap keganasan telah ditemukan
berhubungan dengan peningkatan kemampuan invasif dan metastasis
tumor. Selain itu akhir-akhir ini juga terdapat studi yang menunjukkan
tampilan COX-2 pada lesi pre-kanker. Enzim ini terlibat dalam proses awal
karsinogenesis, walaupun mekanisme pasti bagaimana COX-2
memperberat perkembangan kanker masih belum jelas, namun dari data
menyokong bahwa penghambatan COX-2 akan merangsang apoptosis,
menekan proliferasi sel, menurunkan tampilan bcl-2, meningkatkan
perkembangan sel H-ras-transformed serta merangsang tampilan GF
epidermal.4
Dalam usaha menurunkan angka mortalitas pada kanker lambung,
di Jepang dilakukan program skrining massa dengan menggunakan
endoskopi saluran cerna bagian atas, sehingga penderita kanker lambung
yang asimptomatik dapat terdeteksi dalam stadium dini dan memberikan
prognosis yang lebih baik. Diagnosa kanker dini lambung pada saat ini
sekitar 20% dari seluruh kasus kanker yang baru di negara Barat dan lebih
dari 50% di Jepang. Untuk menekan insiden karsinoma lambung saat ini
adalah dengan program eradikasi terhadap H.pylori pada mukosa
1.2. Identifikasi Masalah
Deteksi dini lesi displasia (pra-kanker) sangat penting dalam usaha
pencegahan terhadap karsinoma lambung. Namun tindakan ini sulit,
karena umumnya gejala klinis yang ditimbulkan tidak spesifik,
kadang-kadang samar-samar sehingga sering terabaikan oleh klinisi. Pasien sering
datang berobat dalam keadaan sudah stadium lanjut. Cara untuk
menemukannya adalah dengan pemeriksaan endoskopi serta melakukan
biopsi jaringan terhadap lesi yang dicurigai dan dilanjutkan dengan
pengevaluasian histopatologi terhadap jaringan biopsi tersebut. COX-2
yang merupakan salah satu enzim yang terlibat dalam proses awal
karsinogenesis tidak kalah penting untuk dievaluasi tampilannya pada
histopatologi jaringan biopsi lambung. Selain untuk menegakkan diagnosa,
tindakan ini juga dapat memberikan informasi mengenai prognosa serta
untuk memfollow-up hasil pengobatan.
1.3. Tujuan Penelitian 1.3.1. Tujuan Umum
Mengetahui peranan tampilan imunohistokimia COX-2 pada gastritis
atrofi, metaplasia intestinal, displasia dan karsinoma lambung.
1.3.2. Tujuan Khusus
Mengetahui tampilan imunohistokimia COX-2 pada displasia
1.4. Hipotesa
Hipotesa penelitian adalah :
1. Ada perbedaan luas tampilan hasil pulasan imunohistokimia COX-2
pada sel epitel foveolar permukaan dengan meningkatnya derajat
progresif lesi pada lambung.
2. Ada perbedaan luas tampilan hasil pulasan imunohistokimia COX-2
pada sel epitel kelenjar lambung dengan meningkatnya derajat
progresif lesi pada lambung.
1.5. Manfaat Penelitian
1. Pemeriksaan imunohistokimia COX-2 dapat digunakan sebagai acuan
pola penanganan displasia untuk mencegah terjadinya karsinoma.
2. Penelitian ini dapat dimanfaatkan sebagai bahan acuan untuk
BAB 2
TINJAUAN PUSTAKA
2.1. Lambung Normal
2.1.1. Anatomi Dan Histologi Lambung
Anatomi, lambung terbagi atas daerah kardia, fundus, korpus,
antrum-pilorik dan pilorus. Bagian proksimal lambung yang berbatasan
dengan esofagus disebut kardia, dan bagian distal yang beruhungan
dengan duodenum disebut pilorik. Bagian antrum-pilorik merupakan daerah
rawan terhadap infeksi H.pylori, gastritis atrofi, tukak peptik dan karsinoma.
Lengkungan kecil pada lambung dikenal sebagai kurvatura minor, daerah
ini sering dilalui oleh makanan dan minuman, adalah daerah yang rawan
untuk terjadinya ulkus. Sedangkan lengkungan besar (kurvatura mayor),
tempat melekatnya omentum. Pada daerah kurvatura minor maupun mayor
banyak dijumpai kelenjar getah bening, ini penting terutama dalam
penanganan keganasan pada lambung dalam menentukan stadium tumor.
Dinding lambung terdiri dari lapisan mukosa, sub-mukosa, muskularis
propia, lapisan sub-serosa dan serosa. Identifikasi lapisan-lapisan ini pada
sediaan reseksi lambung penting dalam menentukan kelainan patologik
pada lambung, seperti dalam menentukan dalamnya tukak lambung
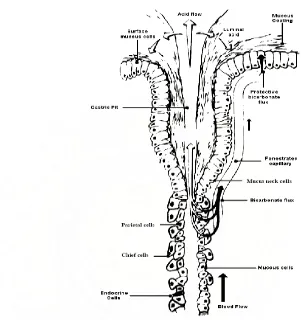
Gambar 2.1. Anatomi lambung.27
Dalam keadaan kosong, lambung membentuk lipatan-lipatan
(rugae). Seluruh dinding bagian dalam lambung terdiri dari mukosa yang
dilapisi oleh selapis epitel kolumner yang menghasilkan musin netral. Epitel
mukosa ini meluas ke bawah membentuk celah kecil (invaginasi) disebut
”gastric pits” yang berfungsi sebagai saluran sekresi. Bagian dalam pit
yang berhubungan dengan kelenjar sero-mukosa disebut ”zona generatif”,
sebagai tempat regenerasi selular. Semakin ke bawah, pit dilapisi epitel
kubus yang mengandung sedikit musin. Jadi kelenjar lambung terdiri dari
komponen foveola/sel mukosa (disebut juga sebagai kripta/pit) dan
komponen sekresi yaitu bagian leher dan kelenjar mukosa. Mukosa
lambung (bagian foveola) merupakan kelenjar bentuk tubular sederhana,
sedangkan bagian sekresi (fundus dan korpus) merupakan kelenjar
berbentuk kompleks. Ada 4 daerah lambung dengan jenis mukosa yang
berbeda dan terdapat daerah transisional diantaranya. Perbedaan
foveola dan kelenjar (bagian sekresi) serta komposisi secara
mikroskopisnya. Foveola pada kelenjar di fundus (oxyntic, acidopeptic)
hanya ¼ bagian dari ketebalan mukosa, bentuk kelenjar lurus dengan
sebaran sel ”chief” (”zymogen”), sel parietal, sel endokrin dan sel ”mucous
neck”. Kelenjar di kardia dan antrum-pilorik mempunyai gambaran histologi
yang hampir sama, dengan perbandingan bagian foveola dengan kelenjar
adalah 1 : 1. Pada kelenjar terdapat 4 jenis sel epitel yaitu sel ”chief” yang
menghasilkan pepsin; (2). Sel ”Argentaffin” yang terdapat di antara sel
”chief”; (3) Sel ”parietal”, penghasil asam lambung dan (4). Sel ”mucous
neck” terletak di antara sel ”parietal”. Sel parietal lebih banyak dijumpai
pada daerah yang lebih superfisial, sel ini menghasilkan faktor intrinsik,
bersama vitamin B12 akan diserap di ileum terminalis. Sel ”chief” terletak
lebih profunda dibandingkan sel parietal. Kelenjar pada daerah ini sebagian
besar menghasilkan musin.Pada antrum-pilorik terdapat sel G (50%) yang
menghasilkan gastrin; sel EC / enterochromaffin (30%) menghasilkan
5-HT[serotonin]) dan 15% sel D yang menghasilkan somatostatin.
Sedangkan pada fundus dan korpus tidak terdapat sel G, namun banyak
dijumpai sel ECL (EC-like). 1,5,6,8,9,13,14
Pembuluh darah lambung terdapat di sub-mukosa membentuk
pleksus venous sub-mukosa. Susunan pembuluh darah ini dapat beperan
sebagai pertahanan mukosa lambung terhadap asal di dalam lumen
lambung. Sel parietal mensekresi H+ ke kanalikulus. OH- dan CO2 akan
-selanjutnya dialirkan melalui pembuluh kapiler ke lumen permukaan
menyebar pada lapisan mukus.
Gambar 2.2. Pengaliran HCO3- melalui pembuluh kapiler.27
2.1.2. Fisiologi Lambung
Epitel lambung mempunyai 4 jenis sekresi yaitu cairan mukus, asam
lambung (HCl), enzim protease (pepsinogen) dan hormon (gastrin).27,28
Berdasarkan strukturnya hormon gastrointestinal dapat dibagi atas
carboxy-terminal pentapeptide yang sama. Hormon-hormon ini bekerja lebih aktif
pada reseptornya masing-masing. 27
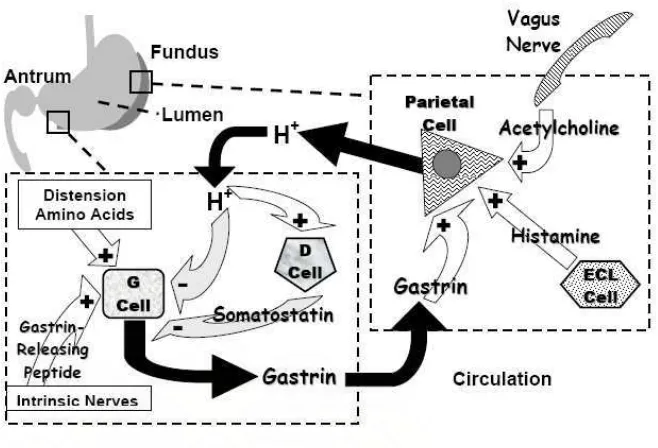
Rangsangan nervus vagus, peptida (makanan) dan asam amino
merupakan rangsangan untuk menghasilkan gastrin pada antrum,
sedangkan asam (pH<3) menghambat pelepasan gastrin. Gastrin berfungsi
untuk merangsang sekresi sel parietal untuk menghasilkan asam lambung
dan pertumbuhan epitel kelenjar fundus. Pada daerah antrum, sel D yang
mengandung somatostatin dapat mempengaruhi sel gastrin. Somatostatin
akan mengurangi sekresi gastrin melalui aksi parakrin lokal. Hormon
sekretin dan CCK dapat merangsang parakrin melepaskan prostaglandin,
sedangkan somatostatin menurunkan sekresi sel parietal.27,28
Secara biologi molekuler, sel parietal mempunyai 3 reseptor pada
membran basolateral yang berfungsi untuk merangsang sekresi asam yaitu
histamin, reseptor kholinergik dan reseptor CCK-B untuk gastrin. (1).
Reseptor Histamin, dilepaskan oleh sel yang mirip Enterochromaffin (ECL)
dan sel mast pada lamina propia. Histamin berikatan dengan reseptor
histamin (H2) pada sel epitel. (2). Reseptor Acetylcholine, dilepaskan dari
nerve endings yang akan berinteraksi dengan reseptor sel parietal,
reseptor sel ECL (yang dilepaskan histamin) serta sel D (untuk mengurangi
pelepasan peptida inhibitor, somatostatin). (3). Reseptor Gastrin, dihasilkan
oleh sel D di antrum, dipengaruhi oleh makanan (asam amino), distensi
Gastrin berikatan dengan gastrin/reseptor CCK-B pada sel parietal dan sel
ECL (yang merangsang sekresi dengan melepaskan histamin). Potensiasi
dapat terjadi bila 2 atau lebih peptida berikatan dengan reseptor sel
parietal; respons kombinasi lebih besar daripada jumlah respons tersendiri.
Ikatan terhadap reseptor pada permukaan sel parietal, akan diikuti
interseluler messenger seperti Ca+ dan cAMP active protein kinase yang
memicu sekresi asam. Jalur akhir ini menghasilkan H+ ke dalam lumen
kanalikuler dalam pertukaran terhadap K+ dengan aksi pompa proton
(H+/K+ATPase) yang berlokasi di antara membran lumen kanalikuli
sekretori sel parietal. Pemberian benzimidazoles (Omeprazol, Lansoprazol)
bertumpuk dalam rongga asam yang teraktifasi. Selanjutnya akan
berikatan dengan H+K+-ATPase, sehingga enzim tidak teraktifasi. Dalam
mengoptimalkan pengobatan, Proton Pump Inhibitiors (PPIs) diminum 30
menit sebelum makan, agar dapat terabsorbsi dan terakumulasi pada
kanalikuli sel parietal seperti H+K+-ATPase yang dirangsang oleh
Gambar 2.3. Gambaran sekresi asam oleh sel parietal.27
Gambar 2.4. Sekresi asam lambung 27
Sekretin dapat menekan sekresi asam lambung (melalui
prostaglandin). Sekretin dihasilkan oleh sel S duodenum sebagai respons
berkompetisi dengan gastrin dalam mengikat gastrin/reseptor CCK- dan
dapat merangsang sel D untuk melepaskan somatostatin.27
Pemotongan nervus vagus ke lambung akan menghilangkan
respons sel parietal terhadap gastrin. Pengangkatan sel G secara
antrektomi akan menghilangkan respons sel parietal.27
2.2. Helicobacter pylori
Helicobacter pylori merupakan kuman batang gram negatif yang
bersifat non-invasif, panjang 2-3µm, bertumbuh lambat; berbentuk kurva
(“S”), terdapat 4-6 flagela pada salah satu pole-nya; variasi bentuk
Helicobacter pylori berupa kokoid dapat dijumpai pada pasien yang telah
diberi terapi, tidak berspora, ukuran 3,5 x 0,5 m. Varian lain dari
organisme ini dikenal sebagai H.heilmannii, kuman ini lebih jarang dijumpai
(<1% dari Helicobacter yang terisolasi), bentuknya lebih spiral. H.heilmannii
dapat bereaksi silang terhadap H.pylori pada pewarnaan imunohistokimia.
H.heilmannii juga dapat menimbulkan gastritis antrum, namun biasanya
tidak seberat gastritis H.pylori.1-3,8,14,19,21,26,27
Lokalisasi Helicobacter pylori di lambung
Helicobacter pylori adalah bakteri micro-aerophile (hanya
menginvasif mukosa lambung, hanya menempati permukaan epitel pada
lapisan mukus lambung di daerah antrum. Helicobacter pylori tidak dapat
ditemukan pada lumen lambung yang ber-pH 2, namun banyak terdapat
pada lapisan mukus lambung yang berjarak 0-15µm dari sel epitel mukosa
(pH mendekati 7). Bentuknya yang spiral dan berflagela, memberi
keuntungan pada organisme ini sehingga bakteri ini dapat berenang dari
lumen ke arah permukaan sel epitel mukosa. Helicobacter pylori
menghasilkan enzim musinase berfungsi untuk melisis musin dan
mengakibatkan mukus berkurang dan viskositasnya menurun, sehingga
mempermudah bakteri tersebut untuk melewati lapisan mukus menuju ke
permukaan sel epitel mukosa .8,18,19,26,27
Sumber energi yang dibutuhkan Helicobacter pylori berasal dari
katabolisme protein dan lemak. Banyak enzim yang berperan di dalamnya
termasuk enzim catalase, superoxide, dismute, oxidase, phospholipas dan
proteases. Enzim urease yang dihasilkan Helicobacter pylori, dibutuhkan
dalam proses kolonisasi di lambung. Urease merupakan antigen yang
sering berperan dalam imunopatologi pada Helicobacter pylori. Enzim ini
terdiri dari 2 sub-unit yaitu 30 dan 60kDa, terdapat pada permukaan tubuh
bakteri. Aktifnya enzim urease ditandai dengan adanya konsentrasi urea
pada lambung dan mukosa lambung. Urea diubah oleh enzim urease
menghasilkan amonia dan karbondioksida. Aktifitas Helicobacter pylori
pemeriksaan indikator-pH berupa perubahan warna menjadi alkali.
Pemeriksaan ini mendasari pemeriksaan klinik dengan endoskopi.8,19
Mengapa sebagian penderita carrier tidak menimbulkan gejala penyakit?
Tidak semua penderita yang terdeteksi adanya Helicobacter pylori di
dalam lambung dapat menimbulkan gejala penyakit (asimptomatis).
Beberapa faktor berhubungan langsung terhadap strain Helicobacter pylori
yaitu perbedaan genetik vacA dan cag PAI (cag Pathogeneicity islands);
polimorfik host (mutasi TP53 yang mempromosi tampilan kuat IL-1b
menimbulkan radang) serta faktor lingkungan lainnya.4,8,19
Genomik. Secara genetik H.pylori adalah heterogen, terdapat <1,5juta bp genom yang mengkode 1500 gen dengan GC relatif sedikit (39%) dan
AT-nya baAT-nyak; serta baAT-nyak strain gen yang spesifik (6-7% genom). H.pylori
mempunyai jalur metabolik genom kecil yang terbatas dan tempat yang
spesifik yang mengakibatkan kuman ini hanya bisa bertahan di lambung,
sistem repair DNA terbatas karena angka mutasi gen tinggi dan protein
pengatur yang sedikit, sehingga menyebabkan H.pylori hanya bertumbuh
pada tempat yang terbatas.
terjadinya peradangan. Dalam tubuh satu host bisa dijumpai beberapa
strain Helicobacter pylori yang berbeda. Salah satu strain mungkin lebih
patogen dibandingkan strain yang lain. Strain Helicobacter pylori sering
mengalami mutasi, baik berupa point mutasi, re-arrangment kromosom,
maupun kombinasi keduanya. Sebagai contoh kasus yaitu dilakukan isolasi
terhadap 199 strain H.pylori dari seorang pasien, isolasi strain tersebut
diulang 6 tahun kemudian pada pasien yang sama. Dari hasil pemeriksaan
dijumpai 3% lokus yang berbeda diantaranya. Ini menunjukkan angka
mutasi yang tinggi. Strain jenis I menampilkan gen cagA dan vacA yang
mengkode faktor penting dari virulensi dengan patogenisitas yang tinggi.
Namun gen ini tidak ditemukan pada strain jenis ke-2.4,8,19
Faktor Virulensi untuk kolonisasi mukosa lambung
Yang termasuk faktor virulensi adalah motilitas dan daya
kemotaksis; enzim urease untuk menyelamatkan bakteri dalam lumen
lambung; perlekatan bakteri; VacA dan CagA serta sistem sekresi tipe-4
(yang disekresi secara langsung ke dalam sitosol).
Motilitas dan kemotaksis.
Motilitas merupakan faktor yang penting, karena hanya Helicobacter
pylori mutant yang dapat berkolonisasi. Pada mukosa binatang percobaan,
koloni. Aktifitas urease H.pylori merupakan faktor kolonisasi utama. Diduga
Helicobacter pylori menghasilkan enzim pada permukaan sel, namun
organisme ini tidak dapat bekerja secara optimal pada pH asam.
Pemecahan urea menjadi amonia oleh enzim urease yang dihasilkan
H.pylori biasanya terjadi di dalam lumen lambung, amonia berfungsi untuk
melindungi sekeliling sel yang alkali terhadap asam sehingga memudahkan
bakteri melewati lingkungan lambung yang asam untuk mencapai daerah
kolonisasinya. Permukaan lambung yang ditempatinya mempunyai pH
yang relatif netral dibandingkan mukus lambung, organisme ini berlanjut
menghasilkan urease dalam jumlah banyak untuk meningkatkan
pertumbuhan organisme. Bentuk heliks dan daya motilitas merupakan
seleksi dalam lingkungan mukus. Flagela penting dalam perpindahan
bakteri dalam lumen. Bila bakteri berkontak dengan mukus maka bakteri
tersebut akan “membor” masuk ke lapisan mukus menuju permukaan sel
epitel mukosa lambung. Gerakan ini difasilitasi oleh kemotaksis.
Faktor kemotaksis. Ion Arginin dan Bikarbonat yang dihasilkan
mukosa lambung dikenal oleh reseptor spesifik Helicobacter pylori
sehingga merangsang motilitas rotasi flagela untuk berenang menuju
daerah tersebut. Flagela mengandung 2 jenis protein yaitu flagelin FlaA
(merupakan filamen utama) dan FlaB. Flagelin adalah glikosilat dengan
Menghindari sistem imun bawaan. Helicobacter pylori menimbulkan
peradangan ringan dan melangsungkan hidupnya dalam jangka waktu
lama dalam tubuh host. Peradangan ringan ini terjadi karena: (1). Flagelin
merupakan perangsang lemah terhadap sel epitel lambung melalui TLR5
(Toll-like Receptor 5); dan (2). LPS bakteri merupakan toksisitas yang
sangat rendah (500 kali lebih rendah dibandingkan LPS E.coli) untuk
mengaktifkan TLR4. Keterbatasan peradangan ini sesuai dengan sifat
peradangan kronik dan infeksi persisten, sehingga perkembangan penyakit
berlansung lama.
LPS (lipopolysacharides) dan Antigen yang mirip.
Lipopolysacharides (LPS) terdiri dari O-polysaccharide dengan
karbohidrat yang identik terhadap antigen golongan darah Lewis yang
tertampil pada permukaan sel epitel lambung (terdapat kemiripan). LPS
merupakan imunogenik yang lemah. Dengan demikian sistem imun host
tidak mampu mengenalinya (Helicobacter pylori).8,19
Perlekatan Helicobacter pylori terhadap host dan Antigen golongan
darah.
Pada pemeriksaan mikroskop elekron, perlekatan Helicobacter
pylori dengan epitel lambung sangat kuat (perlekatan “pedastal”) mirip
reseptor host yang sama (sialyated glycolipids dan fucosylated
lycoproteins) Bila terjadi metaplasia intestinal atau atrofi kelenjar lambung,
tidak akan dijumpai Helicobacter pylori.
BabA2 adalah protein OM mirip porin, yang berikatan dengan
antigen Lewis-B dan antigen H1 (antigen O; antigen golongan darah)
tertampil pada sel epitel lambung (juga eritrosit). P466 adalah strain khusus
yang mengikat golongan darah O, sedangkan strain lainnya yang umum
mengikat fucosylated antigen golongan darah A, B dan O. Dengan
demikian golongan darah O lebih mudah menderita tukak lambung, karena
strain bakteri berespons terhadap tukak lambung dengan mengenali
antigen O.19
LeB (Lewis b antigen), yang berhubungan terhadap golongan darah
O, adalah difucosylated dan dibentuk dengan tambahan Fuc (branched
fucose) yang terletak di H1. Antigen ini terbatas pada fenotip golongan
darah A dan B, hubungan antigen pada sistem golongan darah Lewis
terbentuk pada bagian terminal N-acetylgalactosamine (GalNac) atau
galactose (Gal). Ini merupakan karbohidrat inti yang umum (H1) untuk
semua antigen kelompok darah, namun pada bagian terminal terdapat 2
frucose residu pada golongan darah O (Lewis b / Leb); 2 GalNAc’s pada
golongan darah A (A-Lewis b) dan 2 Gal’s untuk goglongan darah B
SabA (perlekatan afimbril lainnya), SabA menunjukan salah satu
faktor yang penting selama interaksi lanjutan (kedua) terjadinya penyakit.
Pada orang yang sehat, interaksi primer tampak diantara BabA2 dan Leb
(Lewis b antigen). Interaksi pertama ini mempengaruhi tampilan glicolipid
pada host. Glycolipid ini adalah Slex (sialyated Lewis x
glycosophingolipids) dan dikenal dengan perlekatan afimbril, SabA. Ini
mengakibatkan perlekatan yang kuat antara bakteri terhadap sel host
sehingga mengawali perkembangan penyakit.8,19
Epidemiologi Infeksi Helicobacter pylori
Helicobacter pylori merupakan bakteri patogen yang paling sering
dijumpai di dalam lambung pada hampir setengah dari penduduk di dunia.
Prevalensi infeksi beragam. Pada negara sedang berkembang terdapat
perbedaan prevalensi yang menyolok. Keragaman ini dipengaruhi oleh
keragaman etnik dan didukung oleh faktor budaya, genetik maupun faktor
lingkungan yang berhubungan dengan faktor sosioekonomi. Banyak
penelitian mendukung bahwa prevalensi yang terdapat di daerah dengan
status sosioekonomi rendah, Helicobacter pylori telah menginfeksi
penderita sejak masa anak-anak tanpa menimbulkan gejala, dan kemudian
menjadi progresif pada waktu dewasa. Infeksi dapat ditularkan secara
faecal-oral dan oral-oral. Di negara sedang berkembang, angka prevalensi
pada anak-anak sekitar 70%, dan menetap pada umur >30 tahun.21
dihubungkan dengan meningkatnya kejadian tukak dan kanker lambung.
Sebaliknya di negara maju, data yang diperoleh menunjukkan angka
prevalensi yang lebih rendah yaitu anak-anak (5-15%) dan 20-65% pada
umur >30 tahun. Peradangan hebat pada daerah antrum sering
dihubungkan dengan tukak duodenum. Pengobatan dengan menurunkan
kadar keasaman di lambung atau vagotomi selektif lebih cendrung
menimbulkan gastritis pada korpus lambung. Dari data ini, telah
menyokong perbedaan ekologi Helicobacter pylori pada negara sedang
berkembang dan negara maju. Faktor lingkungan beragam pada sebagian
populasi ini adalah asam yang dihasilkan.1,2,3,4,7,8,17,18,21
Kontaminasi peralatan endoskopi dan forsep biopsi terhadap
Helicobacter pylori dapat terjadi setelah pemeriksan endoskopi terhadap
pasien dengan Helicobacter pylori positif. Walaupun besarnya resiko belum
diketahui, Helicobacter pylori yang ditularkan melalui endoskopi telah
pernah dilaporkan oleh Jepang dan dikenal sebagai lesi mukosa lambung
akut post-endoskopi.21
Pengobatan dengan anti-Helicobacter pylori yang gagal akan
menimbulkan kekambuhan infeksi yang berulang. Keadaan ini mendukung
bahwa bakteri ini dapat tersembunyi dan terhindar dari pengobatan
anti-Helicobacter pylori. Tempat yang mungkin merupakan tempat
Diagnosa infeksi Helicobacter pylori
Diagnosa infeksi Helicobacter pylori kadang-kadang sulit. Dalam
mengidentifikasi H.pylori dikenal beberapa metode. Metode konvensional
dalam mendiagnosa Helicobacter pylori dapat menggunakan beberapa
cara, baik teknik invasif maupun non-invasif. Yang termasuk pemeriksaan
invasif yaitu pemeriksaan endoskopik, biopsi untuk pemeriksaan
histopatologi, kultur, Rapid Urease Tests, dengan metode molekuler yaitu
Polymerase Chain Reaction (PCR) / DNA, test cairan lambung, kadar urea
/ amonium dan IgA. Pemeriksaan non-invasif, yaitu Urea Breath Test
(UBT), H.pylori stool antigen (HpSA) dan serologi (IgG, IgA), PCR air liur,
Serum C-bicarbonate* dan Ekskresi urin NH4*. (* tidak digunakan dalam
klinis)
Teknik invasif
Endoskopi.
Endoskopi banyak dipergunakan untuk mengidentifikasi lesi
lambung yang spesifik seperti tukak atau neoplasma. Gambaran
makroskopis endoskopi tidak spesifik untuk mendiagnosa gastritis kronik
atau infeksi H.pylori, kecuali pada anak-anak bila dijumpai gambaran
berupa nodular pada mukosa antrum yang sangat spesifik untuk H.pylori,
H.pylori sering terdeteksi pada mukosa yang secara makroskopisnya
normal, maka dibuat kriteria endoskopi oleh “World Congress of
Gastroenterology” di Sydney dengan batasan nilai dan hubungannya
dengan penemuan histopatologi.25
Kultur.
Pemeriksaan kultur merupakan baku emas (Gold standard) untuk
berbagai penyakit infeksi, kecuali dalam diagnosa rutin infeksi H.pylori.29
Pengisolasian H.pylori untuk kultur adalah teknik diagnosa berharga;
jumlah bakteri yang sedikit dalam sediaan biopsi sudah dapat
menghasilkan kultur positif. Untuk mencapai hasil optimal dibutuhkan
ketelitian dalam persiapan dan transport sediaan (tidak boleh kering).
Media transport khusus (contoh: brain-heart infusion broth) diperlukan, dan
disimpan pada suhu 4-7oC, sediaan dipindah ke medium kultur dalam
waktu beberapa jam. Hasil kultur positif setelah 3-5 hari. Pada umumnya
pertumbuhan H.pylori di dalam media cair digunakan untuk mempelajari
fisiologi bakteri. Penyimpanan H.pylori untuk jangka lama dibutuhkan
media brain-heart infusion broth (1020% glycerol), disimpan pada suhu
-70 - (-80)oC. Walaupun kultur mempunyai spesifisitas 100%, namun hanya
didapat pada pusat laboratorium mikrobiologi. Sensitifitas teknik hampir
90% tergantung pada pemilihan isolasi, transport dan pertumbuhan bakteri.
Dalam praktek, kultur dipergunakan untuk menguji sensitifitas antibiotika.
Urease test yang merupakan diagnosa sederhana dan akurat. Kultur
bakteri hanya digunakan untuk mempelajari virulensi dan gambaran
kolonisasi dari berbagai strain H.pylori dan hubungannya dengan berbagai
kelainan gastroduodenum.25,26,29,33
Biopsi.
Biopsi jaringan lambung dilakukan pada saat gastroduodenoskopi.
Sediaan biopsi diambil dari antrum lambung. Biopsi selain untuk
menentukan ada atau tidaknya gastritis, dapat juga digunakan untuk
melihat proses peradangan yang disebabkan H.pylori. Untuk
mengidentifikasi H.pylori dari sediaan jaringan biopsi dilakukan
pemeriksaan histopatologi, kultur maupun “Rapid Urease Test”. 1,25,30,32
Persiapan biopsi. Faktor resiko yang sering terjadi pada biopsi adalah
perforasi dan perdarahan. Pengambilan sediaan biopsi dianjurkan
mencakup mukosa lambung dan bagian superfisial muskularis mukosa.
Pada atrofi, biopsi seperti ini sulit, walaupun kadang berhasil juga
dilakukan. Tindakan biopsi mukosa lambung paling sedikit dilakukan pada
2 tempat yang berbeda. H.pylori paling sering terdapat pada antrum,
namun kemungkinan besar untuk mengidentifikasi juga dibutuhkan biopsi
pada korpus. Sebab setelah diberi pengobatan, terutama dengan ”proton
pump inhibitors”, organisme dapat dibersihkan dari antrum namun mungkin
masih menetap dalam jumlah sedikit di korpus. Jadi diharuskan membiopsi
dari gastritis. Antrum dan korpus mempunyai fungsi dan abnormalitas yang
berbeda dalam mempengaruhi resiko perkembangan penyakit tukak peptik
dan keganasan. Menurut Bayerdorffer dkk., (1).Untuk mencapai
sensitifitas yang optimal, dianjurkan pengambilan biopsi paling sedikit pada
5 tempat, namun kadang biopsi yang dilakukan pada 2 daerah berbeda
sudah memberi hasil adekuat. Klasifikasi gastritis berdasarkan sistem
Sydney, dianjurkan pengambilan 2 biopsi pada antrum dan 2 biopsi dari
korpus. Pada biopsi antrum, 1 dari dinding anterior dan 1 dari dinding
posterior, dengan masing-masing jarak paling sedikit 2cm dari
pyloro-duodenal junction. Biopsi mid-korpus diambil dari dinding anterior dan
posterior. Daerah kardia dan insisura merupakan 2 tempat yang
kadang-kadang dianjurkan, namun teknik endoskopi pada daerah kardia sulit
dilaksanakan., tetapi bila berhubungan dengan kolonisasi H.pylori maka
daerah ini biasanya sering dibiopsi. (2).Orientasi biopsi agar sediaan biopsi
dapat dipotong secara tegak lurus terhadap permukaan mukosa.1,5,25,30,32
Histopatologi.
Identifikasi H.pylori pada pemeriksaan histopatologi biopsi dan
hubungannya dengan kelainan patologi mukosa lambung merupakan
penanganan yang integral bagi pasien dengan gejala gastrointestinal
bagian atas. Standard pewarnaan histologi untuk menegakkan diagnosa
biopsi lambung adalah pewarnaan Haematoxylin dan Eosin (H&E) serta
konsisten, H.pylori terwarnai biru keunguan dengan latar belakang biru
terang. Dengan alasan bahwa pemeriksaan Giemsa yang dimodifikasi
merupakan suatu metode yang cepat dan sederhana, maka teknik ini
dipilih dalam praktek klinik rutin. Warren dan Marshall menganjurkan
melakukan pemeriksaan dengan pewarnaan khusus Warthin-Starry silver
impregnation bila ditemukan H.pylori. Menurut Potter dkk., dengan
pewarnaan Giemsa dapat diidentifiksasi sebanyak 94% kultur yang positif
dibandingkan dengan pewarnaan Warthin-Starry hanya 79%. Pewarnaan
lain yang digunakan untuk mengidentifikasi H.pylori yaitu Cresyl fast violet,
pewarnaan Gimenez, acridine orange dan sebagainya. Pemeriksaan
mikroskop elektron juga dapat memperlihatkan sejumlah bentuk morfologi
H.pylori pada mukosa lambung, ini digunakan bila mempelajari
patogenesis infeksi organisme ini. Namun teknik ini tidak menambah
keakuratan diagnosa histopatologi. Teknik imunohistokimia yang
berdasarkan antibodi monoklonal meningkatkan spesifisitas histologi bila
dibandingkan dengan metode morfologi lainnya. Pemeriksaan mikroskopis
secara langsung dengan menggunakan metode pewarnaan Gram yang
dimodifikasi memberi diagnosa yang cepat bila dilakukan pada bahan
biopsi yang segar. Metode ini mempunyai sensitifitas 88-95% dan
spesifisitas hampir 100%. Pemeriksaan mikroskopi dengan zat kontras
adalah metode lainnya, yang langsung dilihat tanpa menggunakan
Rapid Urease Tests.
Prinsip pengujian ini berdasarkan aktifitas urease H.pylori dan
ekologi lokasinya di mukosa lambung, yang melindungi bakteri ini terhadap
kompetisi dengan bakteri lain. Aktifitas bakteri pada sediaan biopsi
terdeteksi dengan peningkatan pH yang dihasilkan oleh ion amonia.
Amonia merupakan hasil hidrolisis urea dengan reaksi sbb.: Urea + H2O
Amonia + CO2. Peningkatan pH menimbulkan perubahan indikator merah
phenol pada media kultur dari warna kuning menjadi merah jambu atau
merah. Metode ini berdasarkan Christensen’s 24% Urea broth namun
dijumpai beberapa keragaman. Formulasi urease test beragam
berdasarkan volume broth atau agar, konsentrasi urea dan phenol, serta
pH dan suhu inkubasi (optimum pada 45oC). Perubahan warna
mengindikasikan infeksi H.pylori sesuai dengan test yang digunakan (CLO,
Delta West; HUT, Astra) dalam 30 menit pada sebagian besar pasien
dengan H.pylori yang positif. Sebagian penulis melaporkan hasil didapat
dalam 1 menit. Sensitifitas pemeriksaan ini berkisar 86-98% dengan
spesifisitas 95-100%. Beberapa jenis obat anti-aktifitas urease memberi
hasil test negatif palsu. H.pylori tidak dapat terdeteksi bila dilakukan kurang
dari 4minggu setelah pemberian terapi. Bila pemeriksaan eradikasi dengan
menggunakan urease dan histopatologi, biopsi diambil dari daerah antrum
dan korpus lambung. Aktifitas urease dalam lambung dapat diketahui dari
sediaan aspirasi cairan lambung dengan mengukur konsentrasi
perbandingan konsentrasi urea dengan amonium. Elektoda Amonia sensitif
terhadap deteksi urease cepat, akhir-akhir ini pemeriksaan tersebut
mengindikasikan keakuratan yang tinggi.25,26,30,33
Teknik Non-invasif
Urea breath test (UBT)
UBT merupakan hidrolisis urea terlabel 13C atau 14C oleh urease
H.pylori. Urea yang terlabel didapat melalui mulut dan pada lambung
terinfeksi 13C (atau 14C) yang diubah menjadi CO2, terlarut dalam cairan
lambung, diserap dari lambung masuk ke aliran darah dan diekspirasi
melalui pernafasan. Analisa dari sejumlah CO2 yang terlabel 13C atau 14C
mengindikasikan berapa banyak urea yang terhidrolisis oleh H.pylori.
Beberapa penulis menggunakan urea terlabel 14C sebagai pengganti UBT
karena kost yang rendah dan mudah didapat; sementara 13C yang
merupakan isotop “cold” radioaktif. Akhir-akhir ini, UBT 13C merupakan
metode pilihan karena aman dan penerapannya tidak terbatas, terutama
pada anak-anak. Sedangkan UBT 14C lebih mahal. UBT 13C telah menjadi
standard dalam European working party. Sensitifitas UBT 13C 90-98%
Serologi.
Infeksi H.pylori merangsang respons imun lokal yang kuat pada
mukosa dan sistemik. Respons imun lokal mukosa lambung yang menonjol
adalah IgA, sedangkan antibodi di dalam sirkulasi adalah IgG (IgG1,
IgG2dan IgG4). Peningkatan kadar IgA dalam darah sistemik
mengindikasikan gastritis kronik aktif yang berat. Peningkatan antibodi IgA
tanpa disertai IgG jarang. Antibodi IgM dapat terdeteksi secara singkat
setelah terpapar infeksi H.pylori akut. Teknik serologi didasari
hemaglutinasi, aglutinasi bakteri, fiksasi komplemen dan imunofluoresens
tidak langsung. Metode ini sekarang jarang digunakan sejak diperkenalkan
metode ELISAs karena diagnosa lebih cepat, sederhana dan nilai akurasi
diagnosa tinggi. Test ELISA lanjutan terutama IgG melebihi teknik serologi
dalam menentukan jumlah titer antibodi. 25,26,33
Test Molekuler.
PCR (Polymerase Chain Reaction) mampu mengisolasi dan
mereplikasi DNA H.pylori dalam bahan biologi. Pemeriksaan ini
berdasarkan teknik biologi molekuler, sangat sensitif, tidak memerlukan
organisme hidup untuk mendeteksi infeksi namun hanya fragmen (bagian)
organisme. Teknik ini telah digunakan untuk meneliti berbagai genetik
strain H.pylori yang berbeda. Teknik PCR dapat diterapkan untuk biopsi
2.3. Gastritis Akut
Gastritis akut adalah peradangan akut mukosa lambung yang
bersifat sementara. Peradangan ini bisa disertai perdarahan mukosa. Pada
keadaan yang lebih berat dapat dijumpai terlepasnya permukaan epitel
mukosa (erosi). Gastritis akut dengan erosi yang berat merupakan
penyebab utama perdarahan gastrointestinal akut.1,2
Faktor Penyebab
Patogenesis gastritis akut masih belum diketahui dengan jelas
karena mekanisme normal dari proteksi mukosa lambung tidak diketahui
dengan jelas secara menyeluruh. Keadaan ini sering dihubungkan dengan
penggunaan obat-obatan seperti NSAIDs (Non-steroidal Anti-inflammatory
Drugs), peminum alkohol yang berlebihan, perokok berat, kemoterapi,
uremia, infeksi sistemik (seperti Salmonellosis), stres berat (trauma, luka
bakar, operasi), iskemik dan shok, usaha bunuh diri dengan asam dan
basa keras, trauma mekanik (intubasi nasogastrik) serta pada keadaan
paska gasterktomi distal dengan refluks cairan empedu.2
Pada gastritis akut bisa mengakibatkan gangguan pada lapisan
mukosa lambung; rangsangan sekresi asam dengan difusi balik ion
Hidrogen ke epitel permukaan penurunan produksi bufer bikarbonat oleh
langsung terhadap epitel. Bila ditemukan satu atau lebih pengaruh tersebut
di atas, maka dipikirkan untuk dilakukan tindakan operasi. Pada keadaan
infeksi akut yang disebabkan oleh H.pylori akan merangsang sel-sel
radang neutrofil pada mukosa lambung, namun peristiwa ini biasanya luput
dari perhatian pasien.1,2,5
Gambaran klinis
Gejala tergantung pada beratnya perubahan anatomi lambung.
Pada gastritis akut mungkin tidak menunjukkan gejala secara menyeluruh,
keluhan bisa berupa nyeri epigastrik dengan adanya mual dan muntah
sampai hematemesis, melena dan mampu menimbulkan kehilangan darah
secara fatal. Penyebab utama hematemesis terutama dijumpai pada
peminum alkohol. Pada pasien dengan arthritis rematoid yang
menggunakan aspirin, hampir 25% pasien kadang-kadang mengalami
serangan gastritis akut dengan perdarahan yang tampak atau tersembunyi.
Resiko perdarahan lambung yang ditimbulkan oleh penggunaan obat
NSAIDs tergantung pada dosis obat yang digunakan, dimana resiko ini
meningkatkan komplikasi pada pasien dengan penggunaan obat dalam
Histopatologi
Beratnya lesi yang dijumpai pada lambung mempunyai spektrum
yang bervariasi, bisa terlokalisir hingga difus, dari lesi peradangan
superfisial hingga mengenai keseluruhan ketebalan mukosa dengan
perdarahan dan erosi fokal. Gastritis erosiva akut dengan erosi yang
disertai perdarahan biasanya dapat dilihat secara endoskopi. Gastritis akut
ditandai dengan edema mukosa dan sebukan sel radang neutrofil dan
kemungkinan disertai sel radang kronik. Replikasi sel epitel yang
mengalami regenerasi pada gastrik pit biasanya menonjol. Jika peristiwa
yang berbahaya ini berlangsung pendek, maka gastritis akut akan hilang
dalam waktu beberapa hari dengan digantikan oleh mukosa lambung yang
normal secara keseluruhan.2
2.4. Helicobacter pylori Dan Lesi Pada Lambung
Tukak peptik terjadi bila asam dan pepsin menganggu
keseimbangan mekanisme pertahanan mukosa gastrointestinal. Tukak
peptik timbul dengan latar belakang peradangan kronik yang beragam.
Konjetzny (1924) menyatakan bahwa “tukak tidak bisa terjadi pada mukosa
Dari beberapa penelitian yang ada dinyatakan bahwa gastritis kronik
dapat menimbulkan tukak lambung, demikian juga peranan duodenitis
kronik dalam patogenesis tukak duodeni. Banyak perbedaan pendapat
mengenai patogenesis ini. Namun sejak ditemukan H.pylori oleh Barry
Marshall dan Robert Warren (1983), telah menambah suatu perubahan
dimensi yang baru dan penting dalam patogenesis tukak peptik, dulunya
dikenal “No acid, no ulcer”, namun sekarang “No bacterium, no ulcer”.
Tukak peptik mempunyai prevalensi infeksi, dan hampir semuanya
terdapat pada tukak duodenum. Sebagian besar pasien dengan tukak
lambung (70-80%) positif terhadap H.pylori.8,21,27
Adaptasi dan kolonisasi Helicobacter pylori
Helicobacter pylori yang hidup di dalam tubuh host mempunyai 2
fenomena yang penting yaitu berkolonisasi dan menyebabkan jejas pada
jaringan. Helicobacter pylori menempati lambung melalui proses adaptasi
yang lama untuk menginfeksi dan berkoloni pada mukosa permukaan
lambung. Semua penderita yang terinfeksi Helicobacter pylori mengalami
gastritis kronis aktif. Pada umumnya penderita asimptomatis walaupun
telah terjadi peradangan. Pada sebagian kasus bisa terjadi kerusakan
mukosa dan menimbulkan tukak. Bila infeksi berlanjut kronis, kelenjar
menjadi atrofi dan metaplasia intestinal hingga berlanjut menjadi kanker
lambung. Helicobacter pylori hanya terdapat pada permukaan sel epitel
lambung di luar organ lambung (metaplasia gastrik). Duodenum mengalami
metaplasia gastrik bila banyak terpapar asam lambung. Koloni jaringan ini
akan menjadi fokus duodenitis dan akan berkembang membentuk tukak
duodeni. Infeksi Helicobacter pylori juga bisa terdapat pada mukosa jenis
lambung pada divertikulum Meckel usus halus dan besar maupun
metaplasia gastrik pada Barret’s esofagus. Antrum merupakan tempat
kolonisasi yang paling disenangi Helicobacter pylori. 8,21
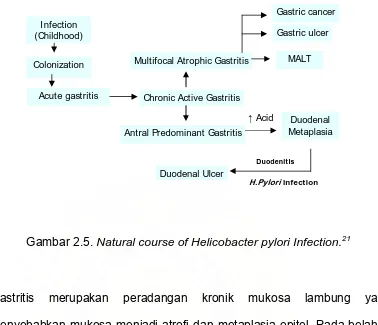
Rangkaian alami Helicobacter pylori
Rangkaian alami Helicobacter pylori pada manusia seperti yang
tertera pada gambar 1. Lebih dari 80% pasien mengalami infeksi kronik
menjadi gastritis kronik yang aktif. Sebagian besar pasien dengan gastritis
kronik tanpa gejala. Hampir 5-15% pasien berlanjut menjadi gastritis antral
yang menonjol (antral predominant gastritis) dengan menghasilkan sekresi
lambung yang berlebihan dan membentuk tukak. Sebagian kecil
berkembang menjadi sindroma gastritis atrofi yang multifokal (Multifocal
Atrophic Gastritis/MAG), yang akan berakhir menjadi tukak lambung,
I nfection (Childhood)
Colonization
Acute gastritis Chronic Active Gastritis Multifocal Atrophic Gastritis
Gambar 2.5. Natural course of Helicobacter pylori Infection.21
Gastritis merupakan peradangan kronik mukosa lambung yang
menyebabkan mukosa menjadi atrofi dan metaplasia epitel. Pada belahan
dunia yang berbeda, penyebabnya juga berbeda dengan gambaran
beragam kelainan histologi yang ditimbulkan. Di negara Barat, prevalensi
histologi berupa gastritis kronik sebagian besar (50%) dijumpai pada umur
yang lebih lanjut. Sampai saat ini, etiologi utama pada infeksi kronis
adalah disebabkan oleh Helicobacter pylori.2
2.4.1. Helicobacter pylori Dan Gastritis Kronik
Insiden dan riwayat alami gastritis kronik telah jelas diuraikan secara
sistemik sejak penggunaan endoskopik biopsi lambung. Gastritis yang
dihubungkan dengan H.pylori pertama kali dikemukakan oleh Barry
superfisial dan gastritis tipe B (sedangkan tipe A adalah gastritis autoimun).
Insiden gastritis yang dihubungkan dengan H.pylori pada anak sekitar 47%,
80% pada usia remaja dan 95% dijumpai pada orang dewasa.24 Pada
keadaan normal, lambung yang tidak terinfeksi hanya mengandung sangat
sedikit sel-sel imun maupun radang. Kolonisasi H.pylori akan menimbulkan
respons peradangan (gastritis akut), ditandai sebukan sel-sel radang
limfosit polimorfonukleus (PMN). Infeksi Helicobacter pylori menyebabkan
gejala khas sindroma gastritis akut (hipoklorhidria) yang bersifat
sementara, pasien akan sembuh setelah beberapa minggu. Bila respons
awal ini gagal menghilangkan infeksi, maka akan terjadi penimbunan
sel-sel radang neutrofil, sel-sel T, sel-sel B dan makrofag pada mukosa lambung. Jika
radang hanya terbatas pada foveola dan tidak menimbulkan atrofi, ini
disebut gastritis superfisial kronik. Beberapa minggu kemudian, sebukan
sel radang dan imun sampai ke stroma, bila semakin hebat dapat
menimbulkan gastritis kronik aktif. 1,8,21,22
Perubahan Degenerasi Sel Epitel Permukaan
Pada degenerasi sel epitel permukaan dijumpai penipisan lapisan
musin dan sel-sel terlepas (eksfoliate), yang merupakan gambaran khas
gastritis kronik yang dihubungkan dengan Helicobacter pylori aktif.
Terdapat hubungan perbandingan H.pylori yang melekat erat terhadap
plasma membran. Ini mendukung efek langsung dari bahan toksik yang
menghasilkan vakuola sitotoksin secara in vitro. Amonia yang dihasilkan
melalui aktifitas urease (enzim yang dihasilkan bakteri) juga merupakan
bahan toksik terhadap sel. Mono-N-chloramine yang terbentuk karena
interaksi amonia dengan hypochlorous acid dihasilkan oleh neutrofil yang
teraktifasi. Phospholipases yang dihasilkan oleh H.pylori dapat merusak
epitel permukaan. Phospholipases A2 dan C mengganggu phospholipid
bilayer normal membran sel epitel dan mempengaruhi integritas seluler. Di
samping itu, H.pylori juga membebaskan arachidonic acid, yang
selanjutnya diubah menjadi leucotrienes dan eicosanoids, yang akan
meningkatkan permeabilitas membran dengan melepaskan mukus dan
menimbulkan efek peradangan; serta mengurangi lapisan mukus. Mukus
yang terinfeksi H.pylori kurang hidrofobik dibandingkan mukus normal,
kemungkinan sebagian diperantarai oleh phospholipases. H.pylori
mensintesa faktor aktifasi platelet secara langsung atau menyebabkan
pelepasan sel mast untuk mengaktifkan platelet dan thrombosis, oklusi
mikrosirkulasi dan hilangnya intergritas epitel karena iskemik. Endotoksin
yang dihasilkan H.pylori menyebabkan kerusakan endotel kapiler.1,2,23,31
Aktifitas Neutrofil
Sebukan neutrofil polimorfik merupakan gambaran khas gastritis
kronik yang dihubungkan dengan H.pylori dan jika terdapat gastritis ini
menandakan suatu keadaan yang aktif. Sel radang PMN bisa dijumpai
terdapat di sekitar isthmus pit, pada kasus berat sebukan sel radang di
dalam lumen akan membentuk “abses pit”. Keadaan ini tidak dijumpai pada
metaplasia intestinal maupun gastritis atrofi, karena H.pylori akan
tereliminasi dengan sendirinya. Sel radang PMN akan menghilang setelah
diobati. Sebukan sel neutrofil PMN pada mukosa merupakan respons imun
mukosa terhadap antigen H.pylori, karena perlekatan molekul pada endotel
pembuluh darah. Kemotaksis PMN ditimbulkan oleh aktifasi komplemen
sebagai hasil antibodi spesifik, Leukotrin dan Interleukin (IL-8). Sebukan
sel radang PMN pada fase infeksi akut merupakan mekanisme non-imun
yang penting (contoh: aktifasi komplemen melalui jalur alternatif dan
pelepasan kemotaksis bakteri secara langsung).1,23,31
Peradangan kronik
Dalam keadaan normal, daerah antral mukosa lambung tidak
terdapat sel radang kronik. Pada mukosa antrum, kadang bisa terdapat
kelompokan kecil limfoid di dekat muskularis mukosa, namun tidak pada
lamina propia superfisial. Sebukan sel-sel radang kronik limfosit, sel
plasma dan sedikit sel eosinofil merupakan gambaran khas pada gastritis
kronik (kecuali gastritis stadium akhir yang disertai atrofi kelenjar dan
metaplasia intestinal dimana sebukan sel radang minimal) sebagai respons
Densitas sebukan sel radang kronik ini berhubungan dengan luas
dan tingkat kolonisasi H.pylori yang paling banyak di antrum. Adanya folikel
limfoid pada mukosa sangat erat hubungannya dengan gastritis H.pylori.
Folikel limfoid lebih menonjol pada anak-anak. H.pylori menghasilkan
antigen penting yaitu enzim urease, endotoksin LPS, heat-shock protein
62K, protein sitotoksin 87K dan 128K. Pada awalnya, antigen ini diterima
oleh monosit di lamina propria, sehingga dihasilkan TNF , IL-1 dan 6.
TNF menimbulkan perlekatan leukosit dengan sel endotel dan menarik
leukosit ke daerah infeksi. Setelah diproses, reaksi langsung dari antigen,
IL-1 dan 6 akan merangsang sel T-helper (CD4+) sehingga dihasilkan
beberapa sitokin, seperti IL-4,5,6,8 serta IFN (Interferon ). IL-8 berperan
penting untuk kemotaksis PMN (dihasilkan oleh limfosit) yang disuplai oleh
epitel sebagai respons terhadap infeksi H.pylori, IL-8 ini dapat ditingkatkan
oleh sitokin lainnya.1,23,31
IL-6 merangsang diferensiasi sel B menjadi sel plasma yang
menghasilkan antibodi spesifik. IL juga merangsang tampilan HLA-DR
kelas II pada sel epitel lambung yang kemudian menjadi APC.
Kecendrungan sel radang PMN berkumpul mengelilingi bagian proliferatif
isthmus pit menimbulkan kerusakan yang letal terhadap stem sel sehingga
2.4.2. Gastritis Atrofi
Gastritis atrofi adalah penipisan lapisan mukosa lambung yang
ditandai dengan hilangnya kelenjar karena jejas mukosa yang berulang dan
kronis. Insidens gastritis atrofi yang dihubungkan dengan H.pylori tidak
terdeteksi pada anak-anak (0%), namun pada remaja 13% dan orang
dewasa 34%.24 Atrofi paling banyak ditemukan di antrum. Gambaran awal
atrofi berupa fokus yang multipel (Multifokal Atrophic Gastritis) pada daerah
peralihan antrum dan korpus di daerah kurvatura minor. Bila berlangsung
kronis akan mengenai seluruh antrum, namun korpus hanya relatif sedikit.
Hilangnya kelenjar dapat diakibatkan oleh erosi atau tukak pada mukosa
yang disertai rusaknya lapisan kelenjar, proses radang kronik dan kerusakan
yang terjadi sedikit demi sedikit (“piecemeal”). Pada umumnya regenerasi
dapat melalui berbagai jalur diferensiasi. Pada daerah yang mengalami
regenerasi menghasilkan gambaran kelenjar metaplasia “pseudo-pilorik”
(pada korpus) dan metaplasia intestinal. Prevalensi dan beratnya atrofi pada
pasien gastritis meningkat sesuai dengan meningkatnya umur. Faktor
makanan tertentu dapat mempengaruhi keadaan ini seperti konsumsi garam
berlebihan, makanan diasap, nitrit, nitrosamin. Nitrosamin dapat dirubah
menjadi nitrit, yang membantu kolonisasi an-aerobik bakteri ini dalam
suasana hiprokhlorhidria lambung. Konsumsi sayuran dan buah-buahan
antioksidan vitamin C, E, -karoten dan selenium dapat mencegah
Diduga peralihan gastritis non-atrofi menjadi atrofi berhubungan
dengan lamanya infeksi H.pylori dengan beratnya radang. Namun, jenis
gastritis kronis lainnya (gastritis autoimun atau gastritis reaktif) tidak
mempunyai efek yang sama. Penurunan prevalensi H.pylori pada lambung
disertai peningkatan atrofi kelenjar terjadi karena alasan sebagai berikut:
(1). H.pylori hanya dapat berkoloni pada epitel lambung, (tidak pada
metaplasia intestinal yang sering menyertai gatritis atrofi, sama seperti
reseptor sel intestinal kurang spesifik untuk perlekatan H.pylori); (2).
Hipokhlorhidria akibat hilangnya sel parietal (bertentangan untuk H.pylori
karena untuk bertumbuh dibutuhkan lingkungan asam); dan (3). Asam
glikoprotein yang disekresi oleh sel epitel metaplastik merupakan lingkungan yang tidak sesuai untuk H.pylori (bila dibandingkan glikoprotein netral yang dihasilkan oleh lapisan mukus normal). Dengan
alasan tersebut di atas dapat disimpulkan bahwa bila H.pylori tidak
ditemukan pada gastritis atrofi, bukan berarti meniadakan peranan infeksi
sebagai penyebab gastritis.23
Pada penelitian yang dilakukan pada tikus di laboratorium, infeksi
H.felis dalam jangka panjang mengindikasikan peranan langsung dari
infeksi. Gastritis atrofi pada manusia yang dihubungkan dengan H.pylori
disebabkan oleh efek bakteri langsung maupun respon radang terhadap
infeksi H.pylori. Kerusakan seluler diakibatkan oleh sitotoksin, hasil amonia
atau protease, Reactive Oxygen Metabolites (ROMs) dan sel-sel radang