SKRIPSI
KAJIAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT HOMOFERMENTATIF ISOLAT ASI
Oleh:
SISKA SETIANINGSIH F24051391
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Siska Setianingsih. F24051391. Kajian Senyawa Antimikroba Bakteri Asam Laktat Homofermentatif Isolat ASI. Di bawah bimbingan Dr. Ir. Lilis Nuraida, MSc.
RINGKASAN
Bakteri Asam Laktat (BAL) termasuk mikroorganisme yang aman jika ditambahkan dalam pangan karena sifatnya tidak toksik dan tidak menghasilkan toksin, maka disebut food grade microorganism atau dikenal sebagai mikroorganisme yang Generally Recognized As Safe (GRAS) yaitu mikroorganisme yang tidak beresiko terhadap kesehatan. Bakteri asam laktat telah dikenal pemanfaatannya sejak lama yaitu sebagai biopreservatif dalam proses fermentasi berbagai produk pangan. Hal ini dimungkinkan karena BAL dapat menghasilkan produk metabolit yang bersifat antimikroba seperti asam organik, hidrogen peroksida (H2O2), karbondioksida (CO2), diasetil, dan bakteriosin.
Bakteriosin yang dihasilkan BAL, mendapat perhatian utama karena bermanfaat sebagai biopreservatif menggantikan bahan preservatif kimia. Kekhawatiran akan efek negatif bahan kimia bagi kesehatan membuat penggunaan pengawet semakin banyak beralih dari pengawet kimia ke pengawet yang lebih alami. Bakteriosin yang telah diisolasi hingga saat ini diketahui memiliki sifat sebagai protein, efek bakterisidal dengan spektrum penghambatan yang relatif terpusat pada spesies penghasil (kedekatan filogenetik), dan mempunyai reseptor spesifik pada sel sasaran. Oleh karena itu, tujuan penelitian ini adalah untuk mengkaji senyawa antimikroba yang dihasilkan BAL dan mengkaji potensinya sebagai penghasil bakteriosin.
BAL yang digunakan pada penelitian ini adalah Lactobacillus homofermentatif (A3, A36, A38, R11), Streptococcus homofermentatif (A4), Lactobacillus rhamnosus (R12, R14), Lactobacillus fermentum (R17), Lactobacillus plantarum (B6) yang diisolasi dari air susu ibu (ASI). Pada penelitian sebelumnya, isolat-isolat ini diketahui berpotensi sebagai kandidat probiotik karena memiliki ketahanan terhadap asam dan garam empedu (bile salt). Selain itu, isolat BAL tersebut juga memiliki aktivitas antimikroba terhadap beberapa bakteri patogen seperti Bacillus cereus, Staphylococcus aureus, Salmonella sp., dan Escherichia coli.
Penelitian ini terdiri dari dua tahap, yaitu (1) Pengujian aktivitas antimikroba BAL terhadap bakteri patogen (2) Pengujian aktivitas antimikroba sebagai seleksi untuk memperoleh isolat BAL yang berpotensi menghasilkan bakteriosin dan terbagi lagi menjadi empat tahap yaitu (a) Pengaruh netralisasi senyawa antimikroba terhadap bakteri uji sensitif dengan metode kontak, (b) Penentuan waktu inkubasi berdasarkan kurva pertumbuhan, (c) Pengaruh waktu inkubasi terhadap aktivitas antimikroba, (d) Konfirmasi pengujian bakteriosin
berpotensi menghasilkan bakteriosin yaitu melalui pengaruh netralisasi terhadap supernatan. Pada tahap tersebut supernatan yang dinetralisasi dari 7 isolat yaitu R12, R13, R15, R20, R32, A4, dan A38 mampu menahan kenaikan pertumbuhan bakteri uji yaitu L. monocytogenes dengan nilai yang berbeda nyata dengan kontrol berdasarkan pengujian statistik dengan ANOVA yang dilanjutkan dengan uji Duncan. Hasil tersebut menunjukkan kemungkinan terdapatnya senyawa antimikroba selain asam organik yang dapat menahan kenaikan pertumbuhan bakteri uji.
Isolat-isolat tersebut kemudian diuji lebih lanjut untuk mengkonfirmasi keberadaan bakteriosin. Waktu inkubasi yang digunakan untuk produksi bakteriosin berdasarkan waktu yang diperlukan untuk mencapai awal fase stasioner yang diperkirakan pada saat tersebut terjadi sintesis yang optimum dari bakteriosin. Isolat R13 mencapai awal fase stasioner pada jam ke-11, isolat R12, A4, dan A38 pada jam 13. Isolat R32 pada jam 15, Isolat R15 pada jam ke-19 dan R20 pada jam ke-21.
Dengan menggunakan waktu inkubasi hingga awal fase stasioner, dilakukan pengujian aktivitas antimikroba dari 7 isolat (R12, R13, R15, R20, R32, A4, dan A38) terhadap bakteri uji L. monocytogenes, B. cereus, dan S. aureus dengan metode difusi agar dan metode kontak. Hasil pengujian menunjukkan tidak adanya zona penghambatan yang kemungkinan dikarenakan kecilnya konsentrasi bakteriosin dalam 50 µl supernatan pada pengujian metode difusi agar. Pengujian metode kontak dengan menggunakan 2 isolat (A4 dan A38) yang memiliki daya penghambatan tertinggi pada tahap sebelumnya, tidak mampu menahan pertumbuhan bakteri uji L. monocytogenes. Dengan demikian hingga awal fase stasioner, sintesis bakteriosin belum maksimum sehingga aktivitas penghambatannya lebih rendah dibanding supernatan yang dinetralisasi hasil inkubasi 24 jam. Hasil tersebut juga menunjukkan bahwa setiap bakteri memiliki waktu yang berbeda dalam mensintesis bakteriosin.
KAJIAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT HOMOFERMENTATIF ISOLAT ASI
SKRIPSI
Sebagai salah satu ayarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
SISKA SETIANINGSIH F24051391
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
LEMBAR PENGESAHAN
Judul Skripsi : Kajian Senyawa Antimikroba
Bakteri Asam Laktat Homofermentatif Isolat ASI Nama Mahasiswa : Siska Setianingsih
Nomor Pokok : F24051391
Program Studi : Ilmu dan Teknologi Pangan
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. LILIS NURAIDA, MSc SITI NURJANAH, STP., MSi. NIP. 19621009 198703 2 002 NIP. 19760131 200501 2 002
Mengetahui,
Kepala Departemen Ilmu dan Teknologi Pangan
Dr. Ir. DAHRUL SYAH, MSc NIP. 19650814 199002 1 001
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal 15 Februari 1988 dari pasangan Sammy Herman dan Warnaning Sediyati. Penulis menghabiskan masa kanak-kanaknya di TK Harapan Bahagia. Penulis melanjutkan belajarnya di SDN Mekarjaya 15, kemudian di SLTPN 3 Depok, dan SMUN 1 Depok. Penulis melanjutkan pendidikannya dan diterima menjadi mahasiswi IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2005. Pada tahun 2006, penulis diterima menjadi mahasiswi departemen Ilmu dan Teknologi Pangan (ITP). Selama belajar di Departemen Ilmu dan Teknologi Pangan IPB, penulis mengikuti berbagai kegiatan, organisasi kemahasiswaan, dan lembaga informal. Diantaranya pernah menjadi panitia BAUR 2007 Departemen ITP, panitia Paskah PMK (Persekutuan Mahasiswa Kristen) 2006. Penulis juga pernah mengikuti PKM (Pekan Kreativitas Mahasiswa) yang didanai dengan judul “Pengembangan Telogurt Sinbiotik sebagai Inovasi Pangan Fungsional Indigenous Kaya Antosianin”. Penulis juga tecatat sebagai Asisten Praktikum Mikrobiologi Pangan 2009-2010. Selama kuliah, penulis merupakan penerima Beasiswa Women International Club, PT. Blue Bird Group, dan PT Gudang Garam.
KATA PENGANTAR
Puji, hormat, dan syukur penulis persembahkan kepada Tuhan Yesus atas segala berkat, kasih, serta tuntunanNya, khususnya dalam menyelesaikan penelitian dan penulisan karya ilmiah ini sehingga penulis dapat menyelesaikan tugas akhir ini untuk memenuhi segala persyaratan dalam memperoleh gelar sarjana. Dalam pelaksanaan penelitian dan penyusunan karya tulis ini, penulis banyak mendapat bantuan dan dukungan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Bapak dan Ibu di rumah atas segala doa dan kerja keras yang tiada henti demi keberhasilan studi penulis.
2. Dr. Ir. Lilis Nuraida, MSc dan dan Siti Nurjanah, STP, MSi. selaku pembimbing akademik yang telah memberikan motivasi, ilmu, dan dukungan sepenuhnya kepada penulis.
3. SEAFAST CenterIPB atas segala dukungan dana dan fasilitas yang diberikan selama penelitian oleh penulis.
4. Fitri dan Ike sebagai teman satu bimbingan, bantuan yang telah diberikan sungguh sangat berarti bagi penulis.
5. Mbak April, Mbak Hana, Mbak Dhenok dan Mbak Sofah, Mbak Desty, Mas Yeris yang telah memberi banyak sekali masukan, bantuan, dan ilmu kepada penulis.
6. Pak Rojak, Mbak Ari, Bu Entin, Pak Abah, Pak Udin, Mbak Anik atas segala bantuan yang diberikan sehingga penulis dapat dengan mudah dan lancar dalam penelitian.
7. Seluruh dosen dan staf Departemen Ilmu dan Teknologi Pangan yang telah memberikan ilmu dan mendukung kemajuan penulis.
8. Pak Muchtadin, Pak Misdi dan staf AJMP Fateta yang telah banyak membantu penulis dalam mengurus administrasi selama di Fateta.
10. Seluruh teman-teman seperjuangan ITP’42, kenangan indah selama ini tak akan pernah penulis lupakan.
11. Teman-teman Nikiters (Lena, Frahel, Mery, Leni, Dewi, Junide, Nita, Titin), keceriaan yang selama ini diberikan telah memberi warna dalam hidup penulis.
12. Serta seluruh pihak yang tidak dapat penulis sebutkan satu persatu terima kasih atas bantuan sehingga karya tulis ini dapat terselesaikan dengan baik.
Penulis menyadari masih banyak kekurangan dalam skripsi ini, oleh sebab itu masukan dan kritik yang membangun selalu penulis tunggu. Akhir kata, penulis berharap semoga karya tulis akhir ini dapat bermanfaat dan memberikan kontribusi pada perkembangan ilmu pengetahuan.
Bogor, September 2010
DAFTAR ISI
B. Senyawa Antimikroba Bakteri Asam Laktat... 8
1. Asam Laktat... 10
2. Asam Organik selain Asam Laktat ... 11
3. Hidrogen peroksida... 12
c. Mekanisme Kerja Bakteriosin... 17
C. Bakteri Patogen ... 18
III. METODOLOGI PENELITIAN... 21
A. Bahan dan Alat... 21
B. Metode Penelitian... 21
1. Pengujian Aktivitas Antimikroba BAL terhadap Bakteri Patogen... 22
2. Pengujian Aktivitas Antimikroba sebagai Seleksi untuk Memperoleh Isolat BAL yang Berpotensi Menghasilkan Bakteriosin... 23
a. Pengaruh Netralisasi Senyawa Antimikroba terhadap Bakteri Uji Sensitif dengan metode Kontak ... 23
b. Penentuan Waktu Inkubasi Berdasarkan Kurva Pertumbuhan ... 24
c. Pengaruh Waktu Inkubasi terhadap Aktivitas Antimikroba ... 24
d. Konfirmasi Pengujian Bakteriosin ... 26
IV. HASIL DAN PEMBAHASAN ... 28
B. Pengujian Aktivitas Antimikroba sebagai Seleksi untuk Memperoleh
Isolat BAL yang Berpotensi Menghasilkan Bakteriosin ... 32
1. Pengaruh Netralisasi Senyawa Antimikroba terhadap Listeria monocytogenesdengan Metode Kontak... 32
2. Penentuan Waktu Inkubasi Berdasarkan Kurva Pertumbuhan ... 38
3. Pengaruh Waktu Inkubasi terhadap Aktivitas Antimikroba ... 44
4. Konfirmasi Pengujian Bakteriosin ... 47
V. KESIMPULAN DAN SARAN... 50
A. KESIMPULAN ... 50
B. SARAN ... 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
DAFTAR GAMBAR
Gambar 1. Metabolisme homofermentatif ... 6
Gambar 2. Metabolisme heterofermentatif ... 7
Gambar 3. Struktur asam laktat ... 10
Gambar 4. Struktur asam asetat ... 11
Gambar 5. Aktivitas antimikroba 12 isolat ASI terhadap bakteri uji Gram positif dan Gram negatif ... 29
Gambar 6. Aktivitas antimikroba isolat ASI terhadap bakteri Listeria monocytogenes... 31
Gambar 7. Pengaruh supernatan bebas sel terhadap pertumbuhan bakteri uji Listeria monocytogenes... 33
Gambar 8. Nilai derajat keasaman (pH) supernatan tidak dinetralisasi dan pengaruhnya terhadap jumlah bakteri uji L. monocytogenes... 35
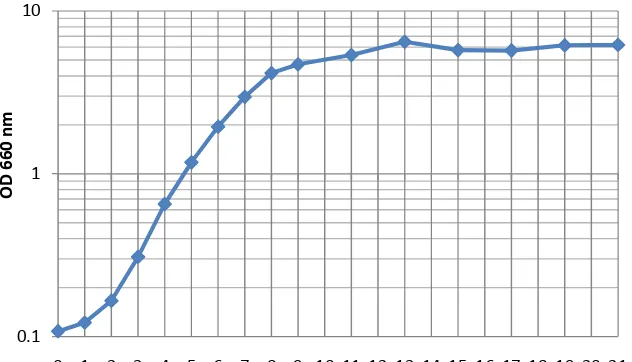
Gambar 9. Kurva pertumbuhan isolat BAL R12 ... 40
Gambar 10. Kurva pertumbuhan isolat BAL R13 ... 41
Gambar 11. Kurva pertumbuhan isolat BAL R15 ... 41
Gambar 12. Kurva pertumbuhan isolat BAL R20 ... 42
Gambar 13. Kurva pertumbuhan isolat BAL R32 ... 42
Gambar 14. Kurva pertumbuhan isolat BAL A4 ... 43
Gambar 15. Kurva pertumbuhan isolat BAL A38 ... 43
DAFTAR LAMPIRAN
Lampiran 1. Gambar hasil pengamatan mikroskop beberapa isolat ASI ... 58 Lampiran 2. Data ukuran zona hambat (mm) senyawa antimikroba beberapa
isolat ASI dengan metode difusi agar (Nuraida et al., 2007) ... 60 Lampiran 3. Data aktivitas penghambatan (mm) senyawa antimikroba
BAL isolat ASI terhadap bakteri uji Gram positif... 61 Lampiran 4. Data aktivitas penghambatan (mm) senyawa antimikroba
BAL isolat ASI terhadap bakteri uji Gram negatif ... 62 Lampiran 5. Data jumlah bakteri L. monocytogenes(cfu/ml) dalam
media supernatan bebas sel (waktu inkubasi 24 jam)
dengan metode kontak ... 63 Lampiran 6. Data statistik uji Duncan pengaruh supernatan yang dinetralisasi
terhadap pertumbuhan bakteri uji Listeria monocytogenes... 65 Lampiran 7. Data Nilai Absorbansi (Optical Density 660 nm) Tiap Jam
dari Kurva Pertumbuhan BAL Isolat ASI... 66 Lampiran 8. Gambar hasil uji aktivitas antimikroba supernatan yang
dinetralisasi dari BAL yang diinkubasi hinggá akhir fase logaritmik terhadap bakteri uji Listeria monocytogenes dan
Bacillus cereus... 68 Lampiran 9. Gambar hasil uji aktivitas antimikroba BAL terhadap S. aureus 69 Lampiran 10. Data Jumlah Bakteri Listeria monocytogenes dalam
supernatan yang dinetralisasi dari isolat BAL dengan waktu inkubasi hingga akhir fase logaritmik... 70 Lampiran 11.Data statistik uji Duncan pengaruh supernatan yang
I. PENDAHULUAN
A. LATAR BELAKANG
Bakteri Asam Laktat (BAL) telah lama dikenal peranannya dalam proses fermentasi yang menghasilkan produk pangan dengan karakteristik dan citarasa yang berbeda dibanding bahan pangan segar. Produk hasil fermentasi menggunakan kultur BAL umumnya tidak mudah mengalami kerusakan pangan dan memiliki umur simpan yang relatif lebih lama.
Sifat-sifat produk fermentasi tersebut sangat berkaitan erat dengan hasil metabolit dari BAL yang diketahui bersifat antimikroba terutama terhadap bakteri perusak pangan dan patogen. Terdapat beberapa senyawa yang dihasilkan oleh BAL dan berfungsi sebagai antimikroba terutama adalah asam organik, hidrogen peroksida, dan fraksi protein yang disebut bakteriosin (Ouwehand dan Vesterland, 2004).
Worthington dan Roberts (1993) menyatakan bahwa bakteri asam laktat sering ditemukan secara alamiah dalam bahan pangan dan diketahui juga terdapat pada air susu ibu (ASI). Di dalam ASI terdapat banyak sekali zat gizi seperti faktor bifidus, yaitu sejenis karbohidrat yang mengandung nitrogen disebut N-acetylglucosamine yang dapat menunjang pertumbuhan bakteri Lactobacillus bifidus.
termasuk dalam genus Lactobacillus dan Streptococcus untuk diteliti lebih lanjut aktivitas antimikrobanya.
Kemampuan untuk menghambat bakteri patogen menggambarkan aktivitas antimikroba yang dimiliki bakteri asam laktat isolat ASI. Oleh karena itu kajian terhadap isolat ASI yang memiliki kemampuan menghasilkan bakteriosin sebagai komponen penyusun senyawa antimikroba, sangat penting mengingat besarnya potensi bakteriosin sebagai pengawet alami atau biopreservatif. Adanya kekhawatiran akan efek negatif bahan kimia terhadap kesehatan membuat penggunaan pengawet makanan banyak beralih dari pengawet kimia ke pengawet yang lebih alami.
Bakteriosin dianggap sebagai biopreservatif karena dihasilkan oleh mikroorganisme dan sifatnya sebagai protein, membuat bakteriosin aman bagi manusia karena dapat diuraikan oleh enzim pencernaan. Beberapa jenis bakteriosin telah berhasil diisolasi dari BAL dan diketahui aktivitas penghambatannya. Salah satu diantaranya adalah nisin yang dihasilkan oleh Lactococcus lactisdan telah diakui penggunaannya secara komersial sebagai bahan tambahan pangan (food additive).
B. TUJUAN
Tujuan penelitian ini adalah untuk mengkaji aktivitas antimikroba isolat BAL dan mendapatkan isolat BAL yang berpotensi menghasilkan bakteriosin dari kultur isolat Lactobacillus homofermentatif (A3, A36, A38, R11, R13, R15, R18, R19a-2, R19b, R20, R30, R31, R32, R36, B1, B17), Streptococcus (A4), Lactobacillus rhamnosus (R12, R14), Lactobacillus fermentum(R17), dan Lactobacillus plantarum(B6) yang diperoleh dari ASI.
C. MANFAAT PENELITIAN
II. TINJAUAN PUSTAKA
A. BAKTERI ASAM LAKTAT (BAL)
Klasifikasi BAL ke dalam genus yang berbeda didasarkan pada morfologi, jenis fermentasi gula, pertumbuhan pada suhu yang berbeda, konfigurasi dari asam laktat yang dihasilkan, kemampuan untuk tumbuh pada konsentrasi garam yang tinggi. Axelsson dalam Salminen (2004) menggolongkan BAL ke dalam 12 genus yaitu Aerococcus, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus, dan Weisella. Sedangkan klasifikasi terbaru menggolongkan BAL ke dalam 17 genus yaitu Lactobacillus, Lactococcus, Carnobacterium, Enterococcus, Lactosphaera, Leuconostoc, Melissococcus, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus dan Weissella. Genus lainnya yaitu Aerococcus, Microbacterium, Propionibacterium dan Bifidobacterium (Carr et al, 2002).
Bakteri asam laktat sering ditemukan secara alamiah dalam bahan pangan dan diketahui juga terdapat pada air susu ibu (ASI). ASI adalah suatu emulsi lemak dalam larutan protein, laktosa, dan garam-garam anorganik yang disekresikan oleh kelenjar mamae ibu dan berguna sebagai makanan bagi bayinya (Siregar, 2004). ASI mengandung zat gizi berkualitas tinggi yang berguna untuk pertumbuhan dan perkembangan kecerdasan anak. Kandungan zat gizi yang terdapat dalam ASI antara lain taurin, DHA, dan AA, immunoglobulin A (IgA), laktoferin, lysosim, dan faktor bifidus di samping juga zat gizi utama yaitu laktosa, lemak, oligosakarida, dan protein (Shin et al., 2004).
al. (2004), ditemukan strain B. bifidum (yang kemudian dikenal sebagai L. bifidus) di dalam ASI, khususnya karena keberadaan N-acetylglucosamine.
Di dalam ASI juga terdapat glikoprotein yang juga dapat meningkatkan pertumbuhan BAL. Selain itu ASI juga mengandung laktoferin, yaitu protein yang berikatan dengan zat besi. Dengan mengikat zat besi, maka laktoferin dapat menunjang pertumbuhan BAL dan menghambat pertumbuhan bakteri tertentu, seperti Staphylococcus aureusdan Escherichia coli.
Penelitian oleh Nuraida et al. (2007) menyatakan bahwa isolat klinis bakteri asam laktat yang diisolasi dari Air Susu Ibu (ASI), telah teridentifikasi ciri fisioligis dan biokimianya sebagai Streptococcus heterofermentatif, Lactobacillus heterofermentatif, dan Lactobacillus homofermentatif. Isolat-isolat BAL tersebut terdiri dari 60% Isolat-isolat Lactobacillus homofermentatif, 23% isolat Lactobacillus heterofermentatif, 8% isolat Bifidobacterium, 4% isolat Streptococcus, 4% isolat Leuconostoc, dan 1% isolat Pediococcus.
1. Karakteristik Bakteri Asam Laktat
Bakteri asam laktat umumnya merupakan bakteri Gram positif, tidak membentuk spora, katalase negatif, tidak memiliki sitokrom, anaerobik fakultatif, memerlukan nutrisi yang cukup (fastidious), tahan terhadap asam (acid-tolerant), dan memiliki kemampuan untuk memfermentasi dengan asam laktat sebagai hasil utama selama proses tersebut berlangsung (Fardiaz, 1992). Stamer (1980) menyatakan bahwa BAL tidak motil atau sedikit motil, bersifat mikroaerofilik sampai anaerob, bersifat kemoorganotropik dan kompleks, serta bersifat mesofilik atau menyukai suhu 10-40oC. BAL sering dihubungkan dengan habitat yang mengandung banyak nutrisi seperti berbagai produk pangan (susu, daging, minuman, sayuran), namun beberapa diantaranya juga merupakan flora normal pada mulut dan usus mamalia.
dapat digolongkan menjadi dua kelompok yaitu Gram positif dan Gram negatif didasarkan pada perbedaan struktur dinding sel. Bakteri Gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan yang relatif tebal sedangkan Gram negatif memiliki lapisan luar berupa lipopolisakarida yaitu lapisan peptidoglikan yang lebih tipis.
2. Metabolisme Bakteri Asam Laktat
BAL tidak memiliki mekanisme transpor elektron dan sitokrom sehingga tidak dapat melakukan respirasi dan metabolismenya bergantung pada fosforilasi substrat untuk menghasilkan energi (Salminen et al., 2004). Menurut Fardiaz (1992), bakteri asam laktat secara umum dibagi menjadi dua kelompok, homofermentatif dan heterofermentatif. Kelompok homofermentatif hanya menghasilkan asam laktat selama proses fermentasi gula sedangkan heterofermentatif dapat membentuk sejumlah karbondioksida, etil alkohol, asam asetat, dan gliserol bersamaan dengan sejumlah besar asam laktat.
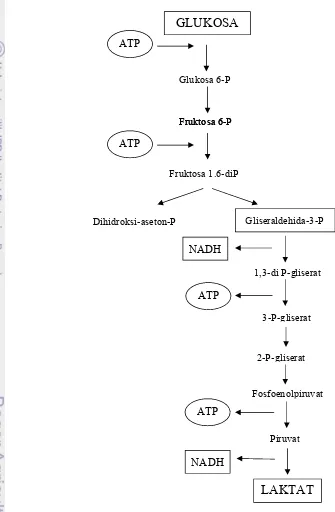
Metabolisme homofermentatif menggunakan jalur Glikolisis (Embden-Meyerhof-Parnas pathway) dan digunakan oleh seluruh BAL kecuali Leuconostoc, Lactobacilli kelompok 3, Oenococci, dan Weisellas. Jalur ini merupakan sistem metabolisme yang dicirikan dengan pembentukkan fruktosa-1,6-diphospat (FDP) yang kemudian diubah FDP aldolase menjadi dihidroksiaseton phospat (DHAP) dan gliseraldehid-3-phospat (GAP). GAP kemudian diubah menjadi piruvat melalui sekuen metabolik termasuk fosforilasi substrat. Pada kondisi normal yaitu keberadaan gula dan oksigen yang terbatas, piruvat direduksi menjadi asam laktat dan dihasilkan NADH dan ATP (Salminen et al., 2004). Metabolisme homofermentatif dapat dilihat pada Gambar 1.
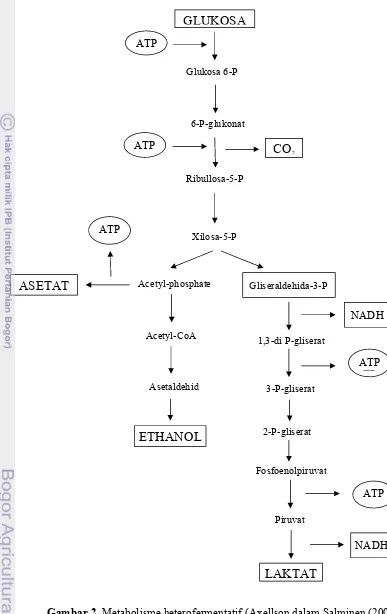
acceptor tambahan yang tersedia, asetil phospat direduksi menjadi etanol via acetyl coA dan asetaldehid. Pada metabolisme ini dihasilkan juga produk akhir lain seperti CO2, etanol (Axellson dalam Salminen (2004)).
Gambar 1. Metabolisme homofermentatif (Axellson dalam Salminen (2004))
GLUKOSA
Glukosa 6-P ATP
TP
Fruktosa 6-P Fruktosa 6-P
Fruktosa 1.6-diP ATP
TP
Dihidroksi-aseton-P Gliseraldehida-3-P
NADH
1,3-di P-gliserat ATP
TP
3-P-gliserat
2-P-gliserat
Fosfoenolpiruvat ATP
TP
Piruvat
Gambar 2. Metabolisme heterofermentatif (Axellson dalam Salminen (2004))
GLUKOSA
Glukosa 6-P ATP
6-P-glukonat
Ribullosa-5-P ATP
TP
Acetyl-phosphate Gliseraldehida-3-P
1,3-di P-gliserat
3-P-gliserat
2-P-gliserat
Fosfoenolpiruvat
Piruvat
LAKTAT
NADH
ATP TP
ATP TP
NADH Xilosa-5-P
CO2
ATP TP
ASETAT
Acetyl-CoA
Asetaldehid
3. Pertumbuhan Bakteri Asam Laktat
Pertumbuhan adalah penambahan secara teratur semua komponen sel suatu jasad. BAL seperti halnya jasad bersel tunggal lainnya mengalami mengalami pertumbuhan berupa pembelahan atau perbanyakan sel yang merupakan pertambahan jumlah individu (Pelczar dan Chan, 1986). Beberapa syarat yang menunjang pertumbuhan bakteri antara lain : (1) ada sel hidup, (2) ada sumber energi, (3) ada nutrisi dan faktor pertumbuhan, (4) tidak ada inhibitor atau toksin, serta (5) kondisi fisiko-kimia yang mendukung (Wibowo, 2010)
Pertumbuhan mikroba sangat berkaitan erat dengan senyawa metabolit yang dihasilkannya. Secara umum pertumbuhan bakteri terbagi menjadi empat tahap yaitu (1) fase lag (adaptasi), dimana sel mengalami perubahan dalam komposisi kimiawi dan senyawa intraseluler bertambah namun tidak terjadi pertambahan populasi, (2) fase logaritma dimana sel membelah dengan laju konstan, (3) fase stasioner yaitu ketika jumlah sel yang membelah sama dengan jumlah sel yang mati sehingga jumlah sel tetap akibat penumpukan produk beracun dan/atau kehabisan nutrisi, dan (4) fase kematian yaitu fase saat jumlah sel bakteri mulai menurun karena nutrisi dalam media dan cadangan energi dalam sel mulai habis (Pelczar dan Chan, 1988).
Metabolit primer yaitu senyawa yang dihasilkan pada fase lag dan fase logaritma untuk memenuhi kebutuhan bakteri dalam membentuk komponen intraseluler sedangkan metabolit sekunder adalah senyawa yang disintesa oleh suatu organisme, tidak untuk memenuhi kebutuhan primernya seperti tumbuh dan berkembang melainkan untuk mempertahankan eksistensinya dalam berinteraksi dengan lingkungan (Kusmiati dan Malik, 2002).
B. SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT
pangan yang tercemar tersebut. Pangan yang telah difermentasi tersebut umumnya lebih awet dibanding bahan mentahnya. Dengan demikian sifat ini dapat digolongkan ke dalam biopreservatif yaitu proses pengawetan yang melibatkan organisme dalam hal ini bakteri asam laktat (BAL). Hal ini sangat terkait dengan kemampuan bakteri yang terlibat dalam fermentasi tersebut untuk menghasilkan metabolit yang memiliki sifat antimikroba (Buckle et al., 1987).
Senyawa antimikroba merupakan senyawa biologis atau kimia yang dapat menghambat pertumbuhan dan aktivitas mikroba. Menurut Fardiaz (1992), senyawa antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), dan germisidal (menghambat germinasi spora bakteri). Umumnya hampir semua senyawa yang diproduksi oleh BAL mampu menghambat pertumbuhan BAL lainnya dan beberapa di antaranya memiliki efek bakterisidal terhadap bakteri lain yaitu bakteri pembusuk dan patogenik asal makanan seperti Staphylococcus aureus, Listeria monocytogenes, dan Clostridium botulinum (Gorris dan Bennik, 1994)
Bakteri asam laktat menghasilkan asam organik, hidrogen peroksida, diasetil, dan bakteriosin sebagai inhibitor yang potensial dalam menghambat organisme lain (Davidson dan Hoover dalam Salminen et al., 2004). Mekanisme aktivitas penghambatan antimikroba menurut Davidson dan Brannen (1993) dapat melalui beberapa faktor, antara lain: (1) mengganggu komponen penyusun dinding sel, (2) bereaksi dengan membran sel sehingga mengakibatkan peningkatan permeabilitas dan menyebabkan kehilangan komponen penyusun sel, (3) menginaktifkan enzim esensial yang berakibat pada terhambatnya sintesis protein dan destruksi atau kerusakan fungsi material genetik.
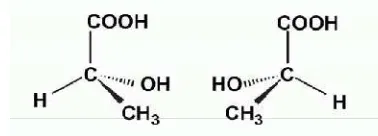
1. Asam Laktat
laktat adalah asam proton dimana proton metabolisme akan
adalah asam karboksilat dengan satu gugus (hidroksil) pada gugus karboksil (Gambar 3). Dalam air, asam ini
melepas proton (H+), membentuk ion laktat. Asam laktat alkohol dan bersifat menyerap air (higroskopik). Asam berupa D, L- atau L-asam laktat. Asam laktat diproduksi
sintesis yang dimulai dari etanol membentuk rasemik atau melalui homofermentasi (Lactobacillus delbruckii, us, L. leichmannii) karbohidrat yang biasanya membentuk L
asam laktat (pK = 3,08).
Gambar 3. Struktur asam laktat (Hart et al., 2003)
Asam akan menyebabkan penurunan pH di bawah kisaran n bakteri dimana asam-asam ini dalam bentuk tidak terdisosiasi usi secara pesat ke dalam sel mikroorganisme. Menurut
Lindgren (1990) asam tidak terdisosiasi akan terurai menjadi a dimana proton (H+) akan masuk ke dalam sel akibatnya
isme akan terganggu seperti terjadinya pengasaman sitoplasma, penghambatan transfer substrat, dan sintesis makromolekul yang
eluruhan akan menghambat pertumbuhan bakteri.
asam organik dalam produk fermentasi merupakan lemak dan juga sebagai hasil aktivitas pertumbuhan organik tersebut umumnya berupa asam organik lemah seperti
m asetat, dan asam propionat. Asam-asam organik juga sebagai asidulan (bahan pengasam) yang dapat menurunkan pertumbuhan mikroba berbahaya pada produk fermentasi
(Winarno, 1997). Selain itu, kuantitas dari asam organik berkontribusi dalam pembentukkan aroma sebagian besar dari
si (Bevilacqua dan Califano, 1989).
(hidroksil) yang asam ini terlarut Asam laktat juga (higroskopik). Asam laktat laktat diproduksi makromolekul yang secara
2. Asam Organik selain Asam Laktat
Telah dijelaskan sebelumnya bahwa asam laktat merupakan produk utama dari metabolisme homofermentif dari isolat BAL yang digunakan pada penelitian ini. Selain itu sebagai perbandingan akan dijelaskan juga asam-asam organik lain yang dihasilkan pada metabolisme heterofermentatif sebagai hasil samping dari asam laktat.
Asam asetat (Gambar 4) merupakan nama umum dari asam etanoat dan dikenal juga dengan asam cuka sedangkan asam propionat merupakan nama umum dari asam propanoat (Hart et al., 2003). Di antara asam organik yang umum dihasilkan oleh BAL, asam asetat diketahui merupakan inhibitor utama dengan spektrum penghambatan yang luas baik terhadap bakteri, khamir, maupun kapang diikuti oleh asam propionat yang memiliki spektrum penghambatan terhadap jenis kapang dan khamir tertentu.
Aktivitas antimikroba yang kuat dari asam-asam organik tersebut dijelaskan dengan nilai pKa (derajat disosiasi) asam asetat dan asam propionat yang lebih besar dibandingkan nilai pKa asam laktat. Nilai pKa asam asetat dan asam propionat berturut-turut 4.87 dan 4.75 sedangkan asam laktat 3.08. sebagai contoh pada pH 4, hanya 11 persen asam laktat yang tidak terdisosiasi sedangkan 85 persen asam asetat dan 95 persen asam proponat terdisodiasi. Asam laktat diketahui berperan sebagai agen pereduksi pH sedangkan asam asetat dan asam propionat adalah agen antimikroba yang sesungguhnya (Ouwehand dan Vesterlund dalam Salminen, 2004).
Gambar 4. Struktur asam asetat (Hart et al., 2010)
3. Hidrogen Peroksida
enzim-enzim seperti oksidase yang mengandung flavoprotein, NADH oksidase, dan superoksida dismutase untuk bekerja dan menghasilkan hidrogen peroksida. Akumulasi dari hidrogen peroksida akan sulit dihilangkan karena BAL tidak memiliki heme yang merupakan bahan dasar pembentukan katalase. Meski begitu, BAL diketahui dapat menekan akumulasi zat tersebut dikarenakan memiliki enzim peroksidase, flavoprotein, dan pseudokatalase yang dapat bertindak seperti katalase.
Efek bakterisidal dari hidrogen peroksida dikarenakan kemampuannya sebagai oxidizing agent terhadap sel bakteri. Bagian dari dinding sel seperti gugus sulfidryl dan lipid membran sel dapat dengan mudah teroksidasi (Salminen et al., 2004). Akibatnya proses metabolisme seperti glikolisis terhambat dan kerja enzim seperti hexokinase dan aldehid-3-phospat juga terganggu. Selain itu, hidrogen peroksida juga diketahui dapat mengikat oksigen (oxygen scavenger) sehingga dapat membuat lingkungan menjadi anaerob yang menghambat pertumbuhan bakteri tertentu. Umumnya hidrogen peroksida bersifat bakteriostatik terhadap bakteri Gram positif dan bersifat bakterisidal untuk bakteri Gram negatif.
4. Karbon Dioksida
Karbon dioksida (CO2) terbentuk terutama pada fermentasi BAL heterofermentatif. Karbon dioksida memiliki dua sifat sebagai antimikroba yaitu membuat lingkungan menjadi anaerob dan meningkatkan permeabilitas lipid bilayer membran (Bottazi, 1983). Pada konsentrasi rendah, CO2 dapat menstimulasi pertumbuhan beberapa organisme namun pada konsentrasi yang tinggi, zat ini dapat menghambat pertumbuhan (Ouwehand dan Vesterland dalam Salminen et al., 2004). Bakteri Gram negatif diketahui lebih sensitif terhadap CO2 dibandingkan bakteri Gram positif .
5. Diasetil
BAL spesies Lactobacillus, Leuconostoc, Pediococcus, Streptococcus, dan mungkin juga oleh spesies lain. Kadar diasetil akan meningkat dengan keberadaan sitrat karena sitrat akan diubah menjadi diasetil melalui piruvat. Menurut Davidson dan Brannen (1993), diasetil lebih efektif pada pH kurang dari 7 dan sifat antimikrobanya berlawanan dengan keberadaan glukosa, asetat, dan Tween 80. Diasetil juga diketahui lebih efektif untuk membunuh bakteri Gram negatif, khamir, dan kapang dibandingkan bakteri Gram positif.
6. Bakteriosin
Bakteriosin adalah molekul protein yang diproduksi oleh berbagai spesies bakteri yang mempunyai aktivitas bakterisidal terhadap bakteri lain yang patogen. Bagian terpenting senyawa aktif ini merupakan protein atau peptida sehingga uji sensitifitas terhadap enzim hidrolitik yang bersifat proteolitik cukup penting. Uji tersebut sangat penting dalam identifikasi susunan kimia suatu senyawa yang diduga bakteriosin. Sejumlah analisis kimia menunjukkan bahwa komposisi bakteriosin dapat berupa protein sederhana atau merupakan suatu molekul yang lebih komplek yang bersenyawa dengan asam lemak dan gula (Klaenhammer, 1988).
Banyak bakteri dengan taksonomi yang berbeda dan berada di berbagai habitat, menghasilkan antimikroba senyawa antimikroba yang aktif menghambat bakteri lain. Baik bakteri Gram negatif maupun bakteri Gram positif dapat menghasilkan bakteriosin. BAL diketahui sebagai salah satu jenis bakteri penghasil bakteriosin. Sebagian besar bakteriosin Gram positif merupakan senyawa aktif membran yang dapat meningkatkan permeabilitas dari membran sitoplasma (Jack et al., 1995). Bakteriosin Gram positif juga memiliki aktivitas bakterisidal dengan spektrum yang lebih luas dibanding colicin (bakteriosin Gram negatif yang dihasilkan oleh E. coli).
patogen yang penting. Beberapa bakteriosin yang penting di antaranya adalah nisin, diplococcin, acidophilin, bulgarican, helveticin, lactacin, dan plantaricin (Nettles dan Barefoot, 1993).
Bakteriosin yang dihasilkan BAL dapat mengalami degradasi oleh enzim proteolitik dalam pencernaan manusia dan tidak membahayakan bagi kesehatan manusia. Selain itu bakteriosin juga memiliki kestabilan terhadap pengaruh pH dan suhu. Bakteriosin tetap menunjukkan aktivitas yang stabil pada kondisi asam atau basa sehingga sangat potensial dimanfaatkan oleh industri yang dalam prosesnya melibatkan kondisi asam maupun basa. Berdasarkan pengaruh suhu, bakteriosin tetap menunjukkan aktivitas yang stabil setelah diberikan perlakuan pada suhu -20oC sampai 100oC sehingga sangat baik jika digunakan dalam proses pengolahan pangan.
a. Klasifikasi Bakteriosin
Menurut Klaenhammer (1988), bakteriosin yang dihasilkan oleh beberapa galur BAL mempunyai aktivitas hambat terhadap bakteri pembusuk dan patogen makanan yang dapat meningkatkan keamanan dan daya simpan pangan. Klaenhammer mengelompokkan bakteriosin menjadi 4 yaitu: (1) Lantibiotik yaitu bakteriosin yang mengandung cincin lantionin dalam molekulnya (<5 kDa) seperti nisin, Lacticin 481, Lacticin S, (2) bakteriosin kecil (<10 kDa), relatif tahan panas, peptida pada sisi aktifnya dan tidak mengadung lantionin, (3) bakteriosin bermolekul protein besar (>30 kDa) dengan protein tidak tahan panas, contohnya Helvetion J dan Brevicin 27, (4) bakteriosin yang mengandung protein kompleks terdiri atas komplek karbohidrat maupun lipid contohnya plantarisin S yang mengandung glikoprotein.
mempunyai reseptor spesifik pada sel sasaran, dan (5) gen determinan terdapat pada plasmid yang berperan pada produksi dan imunitas.
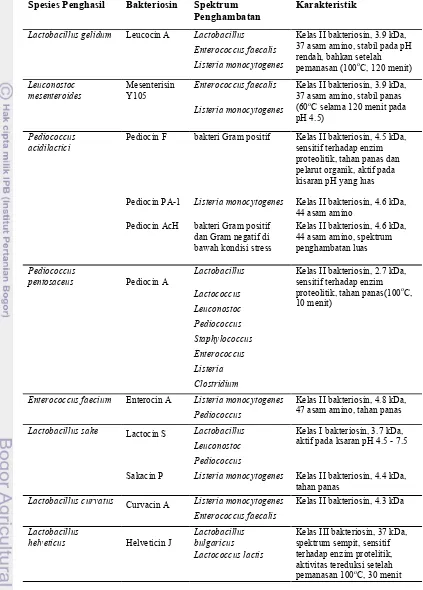
Tabel 1. Bakteriosin yang dihasilkan BAL dan karakteristiknya (Parada et al., 2007)
Spesies Penghasil Bakteriosin Spektrum Penghambatan
Karakteristik
Lactococcus lactis Nisin bakteri Gram positif Kelas I Lantibiotik, 3.5 kDa, 34 asam amino,
Lactococcin B Lactobacillus Kelas II Bakteriosin, ± 5 kDa, spektrumnya sempit
Lactobacillus acidophilus
Acidocin CH5 bakteri Gram positif kelas II bakteriosin, membentuk aggregat dengan berat molekul yang besar
Lactobacillus
Lactacin F Lactobacillus fermentum Kelas II bakteriosin, 6.3 kDa, 57 asam amino,
Lactacin B Lactobacillus delbrueckii Kelas III bakteriosin, 6.3 kDa, stabil terhadap panas, hanya dapat dideteksi pada media kultur dengan pH antara 5 - 6
Lactobin A Lactobacillus acidophilus Kelas II bakteriosin, 4.8 ka, 50 asam amino, spektrum penghambatan sempit
Lactobacillus delbrueckii
Lactobacillus casei Lactocin 705 Listeria monocytogenes kelas II bakteriosin dengan dua komponen, masing-masing 30 asam amino, 3.4 kDa
Tabel 1. Bakteriosin yang dihasilkan BAL dan karakteristiknya (lanjutan) Spesies Penghasil Bakteriosin Spektrum
Penghambatan
Karakteristik
Lactobacillus gelidum Leucocin A Lactobacillus Kelas II bakteriosin, 3.9 kDa, 37 asam amino, stabil pada pH rendah, bahkan setelah pemanasan (100oC, 120 menit)
Enterococcus faecalis
Enterococcus faecalis Kelas II bakteriosin, 3.9 kDa, 37 asam amino, stabil panas (60oC selama 120 menit pada pH 4.5)
Listeria monocytogenes
Pediococcus acidilactici
Pediocin F bakteri Gram positif Kelas II bakteriosin, 4.5 kDa, sensitif terhadap enzim proteolitik, tahan panas dan pelarut organik, aktif pada kisaran pH yang luas
Pediocin PA-1 Listeria monocytogenes Kelas II bakteriosin, 4.6 kDa, 44 asam amino
Pediocin AcH bakteri Gram positif dan Gram negatif di bawah kondisi stress
Kelas II bakteriosin, 4.6 kDa, 44 asam amino, spektrum penghambatan luas
Pediococcus
pentosaceus Pediocin A
Lactobacillus Kelas II bakteriosin, 2.7 kDa, sensitif terhadap enzim proteolitik, tahan panas(100oC, 10 menit)
Enterococcus faecium Enterocin A Listeria monocytogenes Kelas II bakteriosin, 4.8 kDa, 47 asam amino, tahan panas
Pediococcus
Lactobacillus sake Lactocin S Lactobacillus Kelas I bakteriosin, 3.7 kDa, aktif pada ksaran pH 4.5 - 7.5
Leuconostoc
Pediococcus
Sakacin P Listeria monocytogenes Kelas II bakteriosin, 4.4 kDa, tahan panas
Lactobacillus curvatus Curvacin A Listeria monocytogenes Kelas II bakteriosin, 4.3 kDa
Enterococcus faecalis
Lactobacillus
helveticus Helveticin J
Lactobacillus bulgaricus
Kelas III bakteriosin, 37 kDa, spektrum sempit, sensitif terhadap enzim protelitik, aktivitas tereduksi setelah pemanasan 100oC, 30 menit
b. Biosintesis Bakteriosin
Davidson dan Branen (1993) mengemukakan bahwa sintesis bakteriosin oleh sel galur produsen terjadi selama pertumbuhan fase eksponensial. Pada fase tersebut, pertumbuhan bakteri asam laktat akan mengalami peningkatan yang berlangsung secara logaritma. Meningkatnya jumlah bakteriosin yang dihasilkan juga akan meningkat kemudian menurun setelah mencapai fase stasioner.
Dalam penelitiannya, Kusmiati dan Malik (2002) menyatakan bahwa L mesenteroides memiliki fase stasioner yang berlangsung sampai 22 jam inkubasi kemudian mengalami fase kematian dan bakteriosin yang dihasilkan bakteri tersebut disintesa selama fase pertumbuhan eksponensial. Rattanachaikunsopon dan Phumkhachorn (2006) menyatakan bahwa bakterisiosin yang dihasilkan L. Plantarum N014 dihasilkan selama fase logaritma dan mencapai kadar tertinggi saat bakteri penghasil memasuki fase stasioner. Pertumbuhan yang melewati fase stasioner akan menurunkan aktivitas bakteriosinnya. Penurunan tersebut dapat disebabkan terbebasnya protease dari sel saat sel memasuki fase kematian.
Menurut Griffin (1991), jenis dan jumlah sumber karbon sangat mempengaruhi pertumbuhan bakteri yang secara tidak langsung mempengaruhi sintesa metabolit sekunder seperti bakteriosin. Tamime dan Robinson (1999) menyatakan bahwa jumlah glukosa 2% sebagai sumber karbon pada media tumbuh Lactococcus lactis sudah cukup untuk memproduksi bakteriosin. Dengan demikian sumber karbohidrat yang berbeda akan menghasilkan bakteriosin yang berbeda pula (Matsuaki et al., 1996).
bakteriosin akan meningkat dengan meningkatnya pH sampai pH optimum dan kemudian mengalami penurunan. Sementara faktor suhu mempunyai dua pengaruh yaitu sebelum mencapai suhu optimum akan meningkatkan produksi bakteriosin sedangkan di atas suhu optimum justru akan membunuh bakteri asam laktat penghasil bakteriosin (Klaenhammer, 1988). Berbagai genus bakteri Gram positif atau Gram negatif telah dilaporkan menghasilkan bakteriosin seperti genus Lactobacillus, Micrococcus, Staphylococcus, Pseudomonas, dan Corynebacterium(Ray, 1996).
c. Mekanisme Kerja Bakteriosin
Aktivitas penghambatan bakteriosin baik yang bersifat bakterisidal, bakteriostatik, maupun bakteriolisis umumnya ditujukan terhadap dinding dan membran sel dari mikroorganisme target. Terhadap dinding sel, bakteriosin dapat menghambat biosintesis peptidoglikan sebagai penyusun utama dinding sel. Bakteriosin juga dapat mengganggu stabilitas membran sel dengan melakukan kontak langsung. Engelke et al. (1992) menyatakan bahwa gangguan terhadap integritas dinding dan membran sel tersebut dapat menyebabkan terbentuknya lubang hingga sel mengalami kebocoran dan terjadi kehilangan Proton Motive Force(PMF).
Kebocoran mengakibatkan terjadinya difusi keluar dan masuk molekul-molekul seluler dan hilangnya PMF akan membawa pada penurunan pH gradient seluler. Efeknya menyebabkan pertumbuhan sel terhambat karena terhentinya biosintesis makromolekul seperti DNA, RNA, dan protein. Oleh karena itu proses tersebut akan menghasilkan kematian pada sel yang sensitif terhadap bakteriosin (Gonzales et al., 1996).
C. BAKTERI PATOGEN
diantara bakteri patogen tersebut dapat berada dalam pangan dan menjadi penyebab penyakit yang ditularkan melalui pangan atau foodborne disease diantaranya Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Salmonella sp (Blackburn dan McLure, 2003). Penyakit yang disebabkan oleh bakteri patogen tersebut tersebut dapat berupa infeksi yang diakibatkan tertelannya badan sel maupun intoksikasi apabila yang tertelan adalah toksin yang dihasilkan bakteri dalam makanan (Fardiaz, 1992).
Listeria monocytogenestersebar luas di alam dan terdapat secara alami pada hampir seluruh bahan pangan mentah. Bakteri ini perlu mendapat perhatian khusus terutama dalam industri pangan terutama setelah terjadi Kejadian Luar Biasa dimana bakteri ini menyebabkan infeksi yang disebut Listeriosis (Prescott et al., 2003). Galur Listeria tidak memiliki persyaratan nutrisi yang khusus. Bakteri ini tumbuh cepat baik dalam nutrientagar, serum agar maupun blood agar. Media agar yang mengandung triptosa dapat meningkatkan kecepatan pertumbuhan listeria (Ralovich, 1984)
Staphylococcus aureus merupakan bakteri Gram positif, anaerob fakultatif, nonmotil, dan biasa terdapat pada membran pernapasan dan kulit manusia (Prescott et al., 2003). Suhu optium pertumbuhan S. aureus adalah 35-37oC, suhu minimum 6.7oC dan suhu maksimum 45.5oC. bakteri ini dapat tumbuh pada pH mendekati 9.8 dengan pH optimum sekitar 7.0-7.8. Pertumbuhan pada pH mendekati 9.8 hanya mungkin bila substratnya mempunyai komponen yang baik untuk pertumbuhannya (Ralovich, 1984).
S. aureus merupakan penyebab keracunan pangan akibat intoksikasi karena menghasilkan enterotoksin yang tahan panas, di mana ketahanan panasnya melebihi sel vegetatifnya. Toksin tersebut mampu melisiskan sel darah merah dan mengkoagulasi plasma darah (Buchannan dan Gibbons, 1974). S. aureussering mengkontaminasi makanan seperti daging dan produk-produk daging, ikan, susu dan produk-produk-produk-produk susu (Fardiaz, 1989).
nitrit dan mampu menghasilkan enzim lesitin (Harmon, 1980). Bakteri ini dalam pangan dapat menyebabkan baik infeksi maupun intoksikasi. Infeksi terutama disebabkan karena spora B. cereus yang tahan panas kemudian tertelan dan menghasilkan toksin dalam usus. Toksin juga dapat dihasilkan dalam pangan terutama pada produk pangan karbohidrat seperti nasi dan pasta (Blackburn dan McLure, 2003).
Salmonella spp. adalah bakteri anaerob fakultatif, Gram negatif, berbentuk batang (0.7-1.5 x 2.0-5.0 µm), motil dengan alat gerak berupa flagela, katalase positif, dan menggunakan sitrat sebagai sumber karbon (Blackburn dan McLure, 2003). Penyakit tular makanan oleh Salmonella sp umumnya dikarenakan infeksi. Bakteri ini dengan cepat memperbanyak diri kemudian mengkolonisasi, menyebabkan peradangan dalam usus kecil (gastroenteritis). Makanan yang sering terkontaminasi oleh Salmonella adalah telur dan hasil olahannya, ikan dan hasil olahannya, daging ayam, daging sapi, susu dan hasil olahannya. Pencegahan Salmonella sp.,dapat dilakukan dengan sanitasi yang baik terhadap alat-alat pengolahan, ruang pengolahan, lingkungan, dan pekerja-pekerja. Makanan tidak boleh terlalu lama pada suhu kamar dan penyimpanan harus pada suhu rendah (Buchanan dan Gibbons, 1974).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Kultur BAL yang digunakan adalah kultur BAL isolat ASI yaitu Lactobacillushomofermentatif (A3, A36, A38, R11, R13, R15, R18, R19a-2, R19b, R20, R30, R31, R32, R36, B1, B17), Streptococcus homofermentatif (A4), Lactobacillus rhamnosus (R12, R14), Lactobacillus fermentum (R17), dan Lactobacillus plantarum (B6). Kultur bakteri uji yang digunakan adalah Bacillus cereus, Escherichia coli, Salmonella typhimurium, Staphylococcus aureus, dan Listeria monocytogenes. Kultur–kultur tersebut diperoleh dari SEAFAST Center IPB, Bogor. Bahan-bahan yang digunakan pada analisis mikrobiologi adalah Nutrient Broth (NB) (Oxoid), Nutrient Agar (NA) (Oxoid), de Mann Rogosa Sharp Broth (MRSB) (Oxoid), de Mann Rogosa Sharp Agar (MRSA) (Oxoid), akuades steril, NaOH 1N, alkohol, ammonium sulfat, dan buffer sitrat fosfat.
Alat-alat yang digunakan adalah sentrifus berpendingin, inkubator, autoklaf, hot plate, neraca analitik, neraca digital, vortex, syringe, laminar hood, refrigerator, membran filter 0.22 µm, pH meter, jangka sorong, spektrofotometer (UV-2450, UV-VIS Spektrofotometer) mikropipet, jarum ose, tip berbagai ukuran dan alat-alat laboratorium berbahan gelas
B. METODE PENELITIAN
1. Pengujian Aktivitas Antimikroba Bakteri Asam Laktat terhadap Bakteri Patogen
Pengujian aktivitas antimikroba BAL terhadap bakteri patogen dilakukan dengan metode difusi agar atau sumur (Garriga et al., 1993). Bakteri uji yang digunakan adalah bakteri Gram positif yaitu Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus, dan bakteri Gram negatif yaitu Salmonella sp dan Escherichia coli. Kultur bakteri uji yang telah disegarkan, diinokulasikan sebanyak 0.2 ml ke dalam media NA 100 ml sehingga diperoleh konsentrasi 0.2% yang telah siap dituang ke cawan petri steril. Selanjutnya 20 ml media agar NA yang telah terisi kultur bakteri uji (± 106 cfu/ml) dituangkan ke cawan dan dibiarkan menjadi padat. Setelah memadat, dibuat sumur-sumur dengan diameter 6 mm kemudian dimasukkan 30 µl kultur bakteri asam laktat yang telah disegarkan dalam MRSB selama ± 24 jam dan diinkubasi pada suhu 37oC selama 2 hari. Zona penghambatan adalah lebar areal bening yang terbentuk di sekitar sumur yang diukur dengan satuan mm. Diameter zona penghambatan (mm) diukur dengan jangka sorong sebanyak dua kali pada posisi yang berbeda dan dirata-ratakan. Semakin besar diameter zona bening yang terbentuk menunjukkan aktivitas penghambatan yang semakin tinggi. Isolat yang menunjukkan aktivitas penghambatan yang tinggi terhadap bakteri uji dilanjutkan ke tahap selanjutnya.
Zona Penghambatan = Rata-rata Diameter areal bening – Diameter sumur (Rata-rata a dan b) ( c = ± 6 mm)
Keterangan : a
b
Areal bening yang terbentuk c
2. Pengujian Aktivitas Antimikroba sebagai Seleksi untuk Memperoleh Isolat Bakteri Asam Laktat yang Berpotensi Menghasilkan Bakteriosin
a. Pengaruh Netralisasi Senyawa Antimikroba terhadap Bakteri Uji Sensitif dengan Metode Kontak (Rahayu, 2000)
Disiapkan MRSB sebanyak 60 ml dalam erlenmeyer yang telah disterilisasi. Setelah itu diinokulasikan sebanyak 3 ose dari kultur BAL yang akan diuji dan diinkubasi pada suhu 37oC selama 24 jam. Selanjutnya kultur yang diperoleh disentrifugasi pada 8000 rpm, 4oC selama 15 menit sehingga menghasilkan supernatan. Kemudian Supernatan dibagi menjadi 2 bagian, yang pertama supernatan disaring dengan milipore 0.22 µm untuk menghasilkan supernatan bebas sel. Kedua, supernatan dinetralkan pHnya hingga 6.5 dengan NaOH 1 N untuk menghilangkan pengaruh asam organik yang dihasilkan BAL. Sebelum dinetralkan, dilakukan pengukuran pH awal dari tiap supernatan isolat BAL.
pertumbuhan bakteri uji sebagai kontrol, menggunakan pengujian statistik menggunakan program SPSS yaitu ANOVA yang dilanjutkan dengan uji Duncan.
Dalam metode ini, diperlukan kontrol untuk mengukur tingkat pertumbuhan bakteri uji di dalam MRSB yang tidak ditumbuhkan BAL. Isolat yang dianggap berpotensi menghasilkan bakteriosin adalah isolat dengan supernatan netral yang mampu menekan pertumbuhan bakteri uji.
Cara perhitungan koloni berdasarkan SPC dengan aturan bahwa cawan yang dipilih dan dihitung adalah yang mengandung jumlah koloni antara 25 - 250
N = jumlah koloni pada cawan ( n1 + 0.1 n2) x d Keterangan :
n1 = jumlah cawan pada pengenceran pertama n2 = jumlah cawan pada pengenceran kedua d = pengenceran pada cawan pertama
b. Penentuan Waktu Inkubasi Berdasarkan Kurva Pertumbuhan
(Rattanachaikunsopon dan Phumkhachorn, 2006) Tahap ini bertujuan untuk mengetahui fase-fase pertumbuhan
tiap isolat khususnya akhir fase logaritmik (eksponensial) dan awal fase stasioner sebagai dasar penentuan lamanya waktu inkubasi kultur BAL. Waktu Inkubasi berpengaruh terhadap jenis dan jumlah senyawa antimikroba yang dihasilkan BAL. Isolat yang digunakan pada tahap ini adalah isolat yang lolos seleksi dari tahap pengujian dengan metode kontak.
erlenmeyer diamati pertumbuhan sel dan dilakukan pengukuran Optical Density(OD) berdasarkan nilai Absorbansi setiap 1 jam hingga jam ke-9 kemudian setiap 2 jam hingga jam ke-21. Pengukuran dilakukan hingga diperoleh nilai OD konstan menggunakan spektrofotometer UV-VIS pada panjang gelombang 660 nm. Pengenceran dilakukan jika OD mendekati 1 atau lebih dari 1 untuk menghindari penyimpangan data dikarenakan sampel yang terlalu pekat. Nilai Absorbansi (A) adalah nilai absorbansi yang terukur pada alat sedangkan Optical Density(OD) adalah Nilai Absorbansi (A) dikalikan dengan faktor pengenceran.
OD = A x FP dimana OD : Optical Density A : Nilai Absorbansi FP : Faktor Pengenceran
c. Pengaruh Waktu Inkubasi terhadap Aktivitas Antimikroba
Tahap ini dilakukan dengan metode difusi agar dan metode kontak menggunakan supernatan yang telah dinetralkan untuk mengetahui keberadaan senyawa antimikroba selain asam organik. Pada tahap ini kultur BAL yang telah diketahui kurva pertumbuhannya, diinkubasi berdasarkan waktu yang diperlukan oleh tiap isolat untuk mencapai fase yang berkaitan erat dengan sintesis senyawa antimikroba dalam fase pertumbuhannya.
Pada metode difusi agar dalam tahap ini, diperlukan proses pemisahan badan sel untuk pengujian supernatan bebas sel yang mengandung senyawa antimikroba. Isolat Bal diremajakan dalam 10 ml MRSB selama 24 jam kemudian diinokulasikan ke dalam 50 ml MRSB dan diinkubasi sesuai dengan jangka waktu yang diperlukan kultur tersebut untuk mencapai fase stasioner dari kurva pertumbuhannya. Supernatan bebas sel diperoleh dengan cara mensentrifugasi kultur cair dengan kecepatan 8000 rpm, 4oC selama 15 menit.
aktivitasnya terhadap bakteri uji dengan metode difusi agar namun pada tahap ini jumlah bakteri uji yang terkandung dalam sumur agar adalah 106 sel per ml dan supernatan yang dimasukkan ke dalam sumur sebanyak 50 µl. Bakteri uji yang digunakan hanya gram positif yaitu Listeria monocytogenes, Bacillus cereus, dan Staphylococcus aureus. Zona bening (Zona penghambatan) yang terbentuk menunjukkan adanya penghambatan terhadap pertumbuhan bakteri uji oleh supernatan. Diameter zona penghambatan (mm) diukur dengan jangka sorong sebanyak dua kali pada posisi yang berbeda dan dirata-ratakan
Pada tahap ini juga dilakukan metode kontak. Isolat BAL diremajakan dalam 10 ml media cair selama 24 jam kemudian diinokulasikan ke dalam 50 ml MRSB dan diinkubasi sesuai dengan jangka waktu yang diperlukan kultur tersebut untuk mencapai fase stasioner dari kurva pertumbuhannya. Supernatan bebas sel diperoleh dengan cara mensentrifugasi kultur cair dengan kecepatan 8000 rpm, 4oC selama 15 menit (Kim et al., 2000). Selanjutnya supernatan yang diperoleh dinetralkan dan disaring dengan milipore 0.22 µm. Filtrat yang dihasilkan diuji aktivitasnya hanya terhadap bakteri uji L. monocytogenesdengan metode kontak. Hasil metode kontak pada tahap ini juga dianalisis dengan pengujian statistik ANOVA yang dilanjutkan dengan uji Duncan menggunakan program SPSS untuk dibandingkan dengan kontrol.
d. Konfirmasi Pengujian Bakteriosin
dinetralisasi (NaOH 1 N) dan disterilisasi menggunakan membran 0.22 µm dan dilanjutkan ke tahap presipitasi dengan menambahkan ammonium sulfat (51.6 g/100 ml supernatan) dan diaduk selama 2 jam pada suhu 4oC.
IV. HASIL DAN PEMBAHASAN
A. PENGUJIAN AKTIVITAS ANTIMIKROBA BAKTERI ASAM
LAKTAT TERHADAP BAKTERI PATOGEN
BAL merupakan mikroorganisme yang bersifat anaerob fakultatif sehingga dapat melakukan metabolisme sumber energinya tanpa adanya oksigen dan sebagai hasilnya bahan baku energi ini hanya sebagian yang dipecah. BAL umumnya menghasilkan sejumlah besar asam laktat, asam asetat, dan etanol serta sejumlah kecil asam organik volatil lainnya dari fermentasi substrat energi karbohidrat (Buckle et al., 1987). Senyawa organik inilah yang diketahui merupakan senyawa antimikroba yang penting.
Tahap pengujian aktivitas antimikroba BAL bertujuan untuk menyeleksi isolat berdasarkan aktivitas senyawa antimikrobanya dan pengaruhnya terhadap beberapa bakteri uji yang patogen. Seleksi awal ini dilakukan dengan metode difusi agar dengan bakteri uji yang digunakan terdiri dari bakteri Gram positif yaitu Listeria monocytogenes, Bacillus cereus, dan Staphylococcus aureus dan bakteri Gram negatif yaitu Salmonella sp dan Escherichia coli. Bakteri ini digunakan karena umumnya mengkontaminasi makanan.
Keseluruhan isolat yang diuji pada tahap ini yaitu 21 isolat yang berasal dari Air Susu Ibu (ASI) dan bersifat homofermentatif dengan asam laktat sebagai produk utama hasil metabolismenya. Gambar hasil pengamatan mikroskop beberapa isolat ASI dapat dilihat pada Lampiran 1. Sembilan isolat di antaranya yaitu A3, A4, A36, A38, B1, B6, B17, R12, dan R14 telah diujikan sebelumnya oleh Nuraida et al. (2007) terhadap bakteri uji B. cereus, S. aureus, E. coli, dan Salmonella sp.
bakteriosin. Oleh karena itu melalui tahapan ini diharapkan, isolat dengan penghambatan yang cukup besar terhadap bakteri uji, kemungkinan juga menghasilkan senyawa antimikroba lain terutama bakteriosin.
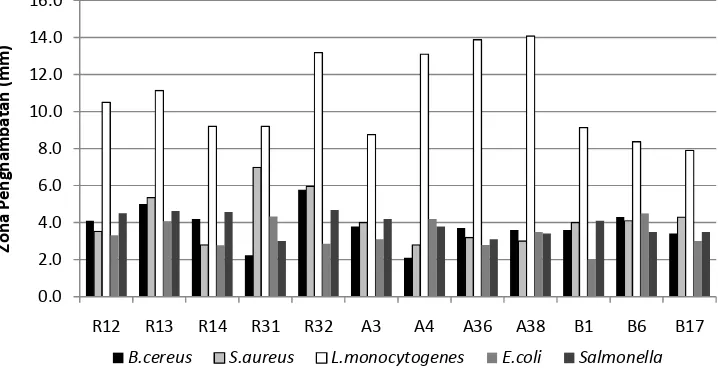
Gambar 5 memperlihatkan aktivitas antimikroba 12 isolat ASI yaitu R12, R13, R14, R31, R32, A3, A4, A36, A38, B1, B6, dan B17 terhadap bakteri patogen Gram positif dan Gram negatif. Besarnya aktivitas penghambatan dapat diketahui dari besarnya zona bening yang terbentuk. Hasil pengujian tersebut jelas memperlihatkan bahwa aktivitas antimikroba seluruh isolat menghambat lebih besar pertumbuhan bakteri uji Gram positif dengan rata-rata penghambatan sebesar 6.2 mm dibanding dengan bakteri uji Gram negatif dengan rata-rata penghambatan 3.6 mm. Penghambatan terbesar terutama terhadap L. monocytogenes dengan rata-rata 10.7 mm, kemudian terhadap S. aureus sebesar 4.2 mm, dan terhadap B. cereus sebesar 3.8 mm. Sedangkan pada bakteri uji Gram negatif, penghambatan terhadap E. coli sebesar 3.4 mm dan terhadap Salmonella spsebesar 3.9 mm.
Gambar 5.Aktivitas antimikroba 12 isolat ASI terhadap bakteri uji Gram positif dan Gram negatif
positif tersusun terutama oleh lapisan peptidoglikan yang tebal dengan kandungan asam amino yang bersifat polar dan asam teichoic. Dinding selnya mengandung lipid yang lebih rendah (1-4%) dan hanya berlapis tunggal. Sedangkan pada dinding sel bakteri Gram negatif mengandung lipid yang lebih tinggi (11-22%) dan berlapis rangkap berupa lapisan lipopolisakarida yang terdiri atas membran dan lapisan peptidoglikan yang tipis terletak pada periplasma (di antara lapisan luar dan membran sitoplasmik).
Kedua faktor inilah yang menyebabkan bakteri Gram positif lebih rentan terhadap masuknya senyawa antimikroba melalui dinding selnya dibandingkan dengan bakteri Gram negatif. Asam organik sebagai komponen utama senyawa antimikroba merupakan asam karboksilat yang tergolong polar (Hart et al., 2003). Asam organik akan melakukan penetrasi yang lebih baik pada dinding sel bakteri Gram positif yang tersusun oleh asam amino polar dibanding dengan dinding sel bakteri Gram negatif yang bersifat nonpolar dikarenakan tingginya ketebalan lapisan lipid.
Hasil penelitian Hartanti (2007) mengenai aktivitas antimikroba dari isolat ASI juga menunjukkan bahwa dari 12 isolat yang diuji yaitu R12, R14, R21, R22, R23, R24, R25, R26, R27, R28, R32, dan R34, seluruhnya mempunyai aktivitas penghambatan yang kuat terhadap bakteri Gram positif. Pada penelitian tersebut bakteri uji Gram positif yang digunakan adalah Staphlococcus aureus dan Bacillus cereus dan penghambatan tertinggi terjadi pada Bacillus cereus.
penghambatan seluruh isolat
uji Gram negatif dapat dilihat pada Lampiran 3 dan 4.
Gambar 6. Aktivitas a
Pada tahap ini, memperlihatkan peranan pemilihan isolat berdasarkan bakteri uji Gram positif, yang berpotensi untuk dari senyawa antimikroba adalah memiliki kemampuan secara filogenetik dekat 2005) sehingga sangat bakteri Gram positif a
lainnya. Selain itu bakteriosin BAL, belum diketahui
seluruh isolat baik terhadap bakteri uji Gram positif da gatif dapat dilihat pada Lampiran 3 dan 4.
. Aktivitas antimikroba isolat ASI terhadap bakteri L.monocytogenes
tahap ini, aktivitas antimikroba yang ditunjukkan oleh n peranan asam organik sebagai komponen utamanya. isolat berdasarkan semakin besarnya aktivitas antimikroba
Gram positif, dapat memperbesar kemungkinan diperolehnya berpotensi untuk menghasilkan bakteriosin. Bakteriosin sebagai
antimikroba yang dihasilkan BAL, memiliki sifat salah
lah memiliki kemampuan menghambat pertumbuhan mikroorganisme yang filogenetik dekat dengan bakteri penghasil bakteriosin (Jack
sehingga sangat mungkin bahwa bakteriosin dari BAL yang merupakan positif akan lebih mudah menghambat jenis bakteri Gram
Selain itu bakteriosin yang dihasilkan bakteri Gram positif diketahui dapat menghambat bakteri Gram negatif zat aktif yang dapat merusak membran terluar dari bakteri (Salminen et al., 2004). Oleh karena itu pada pengujian
B. PENGUJIAN AKTIVITAS ANTIMIKROBA SEBAGAI SELEKSI UNTUK MEMPEROLEH ISOLAT BAL YANG BERPOTENSI MENGHASILKAN BAKTERIOSIN
1. Pengaruh Netralisasi Senyawa Antimikroba terhadap Listeria monocytogenesdengan Metode Kontak
Pada tahap ini, dilakukan pengujian kuantitatif menggunakan metode kontak. Metode ini bertujuan untuk mengetahui perubahan jumlah bakteri uji di dalam media yang mengandung senyawa antimikroba dari BAL. perubahan tersebut dapat berupa pertumbuhan yang ditandai dengan kenaikan jumlah bakteri uji atau kematian bakteri uji berupa penurunan jumlahnya.
Kultur bakteri uji yang telah disegarkan akan mengalami kontak langsung dengan senyawa antimikroba yang dihasilkan BAL. Oleh karena itu kultur BAL berumur 24 jam harus terlebih dahulu disentrifugasi untuk memisahkan sel sehingga diperoleh supernatan yang hanya mengandung senyawa antimikroba. Supernatan yang diperoleh kemudian dibagi menjadi dua bagian yaitu supernatan bebas sel yang dinetralisasi dengan basa kuat sementara yang lain tidak dinetralisasi. Penetralan ini bertujuan untuk menghilangkan pengaruh asam organik sebagai komponen utama senyawa antimikroba dari BAL sehingga jika terjadi penghambatan oleh supernatan bebas sel yang telah dinetralisasi maka terdapat kemungkinan adanya senyawa antimikroba selain asam organik.
jam ke-0 dan jam ke-8 dinyatakan dengan nilai logaritma dan besarnya peningkatan atau penurunan jumlah bakteri uji juga dinyatakan dari perbedaan logaritma selama selang waktu tersebut.
Berdasarkan data yang diperoleh pada tahap sebelumnya, pada tahap ini akan dilakukan penentuan aktivitas antimikroba yang dipengaruhi proses penetralan, terhadap L. monocytogenes. Berdasarkan penelitian Jaya (2004), isolat BAL yang digunakannya yaitu galur M-16 menghasilkan senyawa antimikroba berupa bakteriosin yang juga memiliki daya penghambatan yang besar terhadap L. monocytogenes. Bakteri tersebut bersifat patogen yang dapat mengkontaminasi pangan dan menjadi perhatian utama pada industri pangan akibat kemampuannya menimbulkan penyakit listeriosis pada manusia (Faber dan Peterkin, 1991). Oleh karena itu, pengujian isolat penghasil bakteriosin terhadap L. monocytogenes penting dilakukan untuk mengetahui aktivitas bakteriosin yang berpotensi sebagai biopreservatif untuk pangan.
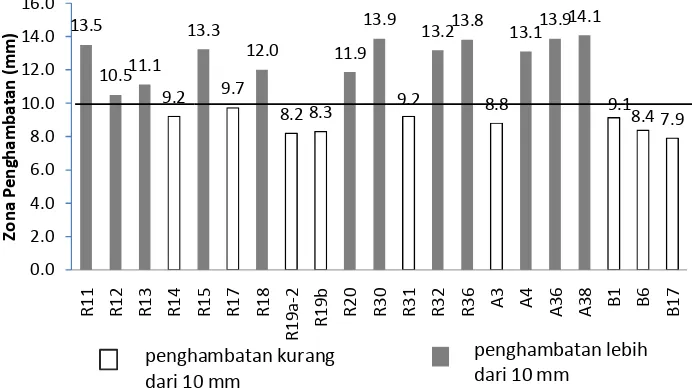
Isolat-isolat bakteri yang dilanjutkan hingga tahap ini adalah 12 isolat dengan penghambatan di atas 10 mm yaitu R11, R12, R13, R15, R18, R20, R32, R36, R30, A4, A38, dan A36 (Gambar 7). Setelah waktu kontak 8 jam, pertumbuhan bakteri uji dalam tiap supernatan menunjukkan angka
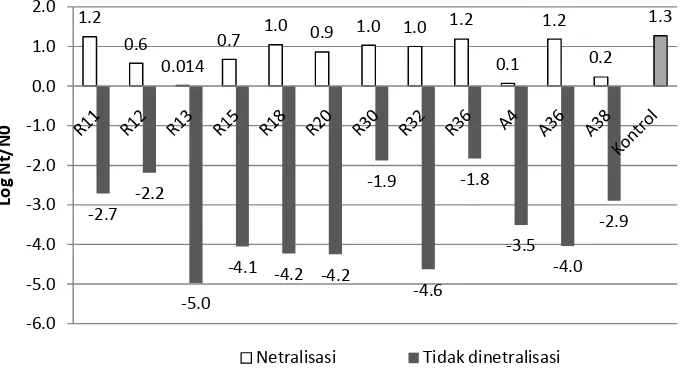
yang bervariasi. Namun jelas terlihat bahwa supernatan yang tidak dinetralisasi mampu menurunkan jumlah awal bakteri uji sedangkan pada supernatan netral terjadi sebaliknya yaitu tidak mampu menahan pertumbuhan bakteri uji (Gambar 8). Keseluruhan supernatan yang tidak dinetralisasi menurunkan jumlah awal bakteri uji, rata-rata sebanyak 3.4 log dengan penurunan terbanyak pada supernatan R13 sebesar 5.0 log dan paling sedikit pada supernatan R36 sebesar 1.8 log. Hasil selengkapnya dari pengujian dengan metode kontak antara seluruh isolat BAL dengan bakteri uji tersebut dapat dilihat pada Lampiran 5.
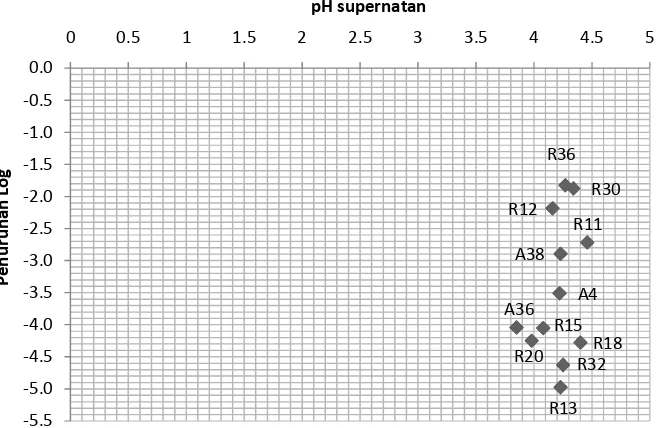
Pada Gambar 8 dapat dilihat bahwa nilai pH dari masing-masing supernatan tidak dinetralisasi tersebut berkisar antara 3.85 hingga 4.46. Hasil tersebut menjelaskan keberadaan asam organik sebagai komponen utama senyawa antimikroba. Perubahan pH disebabkan karena terbentuknya asam-asam organik oleh isolat BAL dalam media (Djaafar et al., 1996).
Menurut Davidson dan Brannen (1993), mekanisme penghambatan bakteri oleh asam organik berhubungan dengan keseimbangan asam-basa, perubahan proton dan produksi energi oleh sel. Keseimbangan asam basa pada sel mikroba ditunjukkan dengan pH yang mendekati normal. Asam akan menyebabkan penurunan pH di bawah kisaran pH pertumbuhan bakteri dimana asam-asam ini dalam bentuk tidak terdisosiasi dapat berdifusi secara pesat ke dalam sel mikroorganisme. Menurut Haller et al. (2001), hal tersebut dikarenakan pH yang rendah membuat asam organik dapat larut dalam lipid (liposolluble) yang merupakan komponen penyusun membran sel hingga mencapai sitoplasma sel.
namun memiliki kemampuan penghambatan yang lebih rendah dibanding isolat R32 dengan nilai pH supernatan 4.25. Begitu juga dengan isolat yang memiliki nilai pH supernatan yang relatif sama namun dengan aktivitas penghambatan yang berbeda seperti pada isolat R36 dan R13 dimana aktivitas penghambatan supernatan R13 lebih besar dibanding supernatan R36.
Gambar 8. Nilai derajat keasaman (pH) supernatan tidak dinetralisasi dan pengaruhnya terhadap jumlah bakteri uji L. monocytogenes
Berbeda dengan supernatan yang tidak dinetralisasi, pada supernatan yang dinetralisasi dengan NaOH 1 N terjadi kenaikan pertumbuhan bakteri uji pada semua media tersebut. Rata-rata kenaikan pertumbuhan bakteri uji adalah 0.8 log dengan kenaikan terbanyak yaitu pada supernatan R11 yaitu 1.2 log dan pada supernatan R13 kenaikan hanya 0.014 log. Sebanyak 5 isolat yaitu R30, R32, A36, R36, R11, dan R18 menyebabkan kenaikan sama atau lebih dari satu log sedangkan sisanya sebanyak 6 isolat yaitu A38, A4, R13, R12, R15, dan R20 hanya menyebabkan kenaikan kurang dari satu log. Hasil lengkap dari pengujian supernatan dengan metode kontak ini dapat dilihat pada Lampiran 5.
Dalam pengujian ini, digunakan kontrol bakteri L. monocytogenes yang ditumbuhkan dalam media MRSB steril tanpa pertumbuhan BAL. Setelah 8 jam, terjadi kenaikan pertumbuhan sebesar 1.3 log. Pengujian statistik melalui ANOVA yang dilanjutkan dengan uji Duncan terhadap nilai kenaikan log pertumbuhan bakteri uji dalam supernatan yang dinetralisasi, diperoleh hasil bahwa sebanyak 7 isolat yaitu R12, R13, R15, R20, R32, A4, dan A38 memiliki nilai lebih rendah dari kontrol dan berbeda nyata dengan kontrol dalam taraf signifikansi 0.05 atau tingkat kepercayaan 95%. Sedangkan nilai log pertumbuhan bakteri uji dalam supernatan yang dinetralisasi dari 5 isolat yang tersisa yaitu R30, A36, R36, R11, dan R18 tidak berbeda nyata dengan kontrol. Hasil uji statistik tersebut dapat dilihat pada Lampiran 6. Peningkatan jumlah bakteri uji yang lebih rendah dan berbeda nyata dengan kontrol mengindikasikan besarnya kemungkinan bahwa pada supernatan yang dinetralisasi terdapat senyawa antimikroba selain asam organik yang mampu menahan pertumbuhan bakteri uji. Senyawa ini kemungkinan adalah hidrogen peroksida, diasetil, dan bakteriosin.
Ouwehand dan Vesterlund dalam Salminen et al. (2004) menyatakan bahwa metabolisme heksosa dapat menekan pembentukan diasetil. Selain itu diperlukan sitrat sebagai substrat untuk menghasilkan diasetil dan sitrat tidak terkandung dalam media yang digunakan pada tahap ini.
Salminen et al. (2004) menyatakan keberadaan hidrogen peroksida dalam BAL diawali dari kondisi aerob yang memungkinkan enzim-enzim seperti oksidase yang mengandung flavoprotein, NADH oksidase, dan superoksida dismutase untuk bekerja dan menghasilkan hidrogen peroksida. Ouwehand dan Vesterlund (2004) menyatakan bahwa meskipun BAL tidak memiliki katalase untuk menghilangkan hidrogen peroksida, BAL memiliki enzim lain seperti peroksidase, flavoprotein, dan pseudokatalase yang dapat mencegah akumulasi hidrogen peroksida. Selain itu menurut Ray dan Daeschel (1992), hidrogen peroksida bersifat bakterisidal pada konsentrasi 20-22 µg/ml terhadap Staphylococcus aureus sedangkan produksinya pada media pepton seperti media MRS cair hanya 8-9 µg/ml setelah diinkubasi selama 2 hari pada suhu 30oC. Oleh karena itu, meskipun terdapat hidrogen peroksida, jumlahnya terlalu sedikit untuk bersifat antagonis terhadap bakteri uji sehingga keberadaan hidrogen peroksida dapat diabaikan.