a. Pohon Pepaya
Lampiran 3. Karakteristik Biji Pepaya
a. Biji pepaya
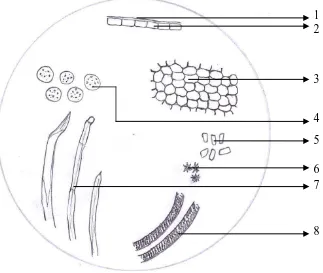
Gambar mikroskopik serbuk simplisia biji pepaya perbesaran 10x10
Keterangan: 1 = kutikula 2 = epidermis 3 = parenkim 4 = butir minyak
5 = hablur kristal oksalat bentuk prisma 6 = hablur kristal oksalat bentuk druse 7 = rambut multiselular
8 = berkas pembuluh (xylem)
1 2
3
4 5 6 7
Lampiran 5. Bagan Pembuatan, Skrining Fitokimia, dan Karakterisasi Serbuk Simplisia
Karakterisasi Simplisia: - Mikroskopik
- Makroskopik - Penetapan kadar:
•air
•sari yang larut dalam etanol
•sari yang larut dalam air
•abu total
•abu yang tidak larut dalam asam Skrining Fitokimia:
- Alkaloid - Flavonoid - Saponin - Tanin - Glikosida
- Steroid/Triterpenoida
Serbuk simplisia daun biji pepaya Simplisia
Biji Pepaya
dicuci sampai bersih
dikeringkan di lemari pengering dengan suhu ± 40oC
Ekstrak etanol biji pepaya
Karakterisasi Ekstrak: - Penetapan kadar:
• air
•sari yang larut dalam etanol
•sari yang larut dalam air
•abu total
•abu yang tidak larut dalam asam Skrining Fitokimia:
- Alkaloid - Flavonoid - Saponin - Tanin - Glikosida
- Steroid/Triterpenoida
dipekatkan dengan
rotary evaporator
dikeringkan dengan
freeze dryer
diperkolasi dengan cairan penyari etanol 96% 350 gram serbuk simplisia biji
Lampiran 7. Bagan Kerja Pengujian Ekstrak Etanol Biji Pepaya
dipuasakan selama 12-24 jam
dibersihkan ekor dengan alkohol
diambil darah tikus melalui ekor
ditampung darah dengan mikrotube sebanyak 1 ml
disentrifuge selama 15 menit dengan kecepatan 4000 rpm
terbentuk 2 lapisan
Pengukuran kadar profil lipid Tikus
Supernatan (serum) Endapan
Kolesterol Total
Trigliserida High Density Lipoprotein (HDL)
Lampiran 9. Bagan Kerja Pengukuran Kadar Kolesterol Total
dipipet sebanyak 10 µ l
dimasukkan kedalam tabung reaksi berisi larutan reagensia kolesterol 1000 µ l
dihomogenkan
diinkubasi pada suhu 37ºC dibiarkan selama 10 menit
diukur pada alat Microlab 300 dengan panjang gelombang 546 nm
dicatat hasilnya Serum tikus
dipipet sebanyak 10 µ l
dimasukkan kedalam tabung reaksi berisi larutan reagensia trigliserida 1000 µl
dihomogenkan
diinkubasi pada suhu 37ºC dibiarkan selama 10 menit
diukur pada alat Microlab 300 dengan panjang gelombang 546 nm
dicatat hasilnya Serum tikus
Lampiran 11. Bagan Kerja Pengukuran Kadar High Density Lipoprotein (HDL)
dipipet sebanyak 200 µ l
dimasukkan kedalam tabung reaksi yang berisi larutan pengendap HDL 500 µ l
dikocok dan dibiarkan selama 10 menit pada suhu 25ºC
disentrifuge selama 20 menit dengan kecepatan 4000 rpm
terdapat 2 lapisan
diambil sebanyak 10 µ l
dimasukkan kedalam tabung reaksi yang berisi larutan reagensia kolesterol sebanyak 1000 µ l
dihomogenkan
diinkubasi pada suhu 37ºC dibiarkan selama 10 menit
diukur pada alat Microlab 300 dengan panjang gelombang 546 nm
dicatat hasilnya
Serum tikus
Supernatan Endapan
Lampiran 12. (Lanjutan)
2. Perhitungan kadar abu total simplisia biji pepaya
% Kadar abu total = berat abu (g)
berat sampel (g)
x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0127 0,1752
2. 2,0023 0,1726
3. 2,0156 0,1796
a. Kadar abu total = x100% 8,70% 2,0127
0,1752 =
b. Kadar abu total = x100% 8,62% 2,0023
0,1726
=
c. Kadar abu total = x100% 8,91% 2,0156
0,1796
=
% Rata-rata kadar abu total = 8,70%+ 8,62%+8,91%
3. Perhitungan kadar abu tidak larut asam simplisia biji pepaya
% Kadar abu total = berat abu (g)
berat sampel (g) x 100% No. Berat sampel (g) Berat abu (g)
1. 2,0117 0,0212
2. 2,0235 0,0225
3. 2,0134 0,0215
a. Kadar abu total = x100% 1,05% 2,0117
0,0212 =
b. Kadar abu total = x100% 1,11% 2,0235
0.0225
=
c. Kadar abu total = x100% 1,06% 2,0134
0,0215
=
% Rata-rata kadar abu total = 1,05%+1,11%+1,06%
Lampiran 12. (Lanjutan)
4. Perhitungan kadar sari larut dalam air simplisia biji pepaya
Lampiran 13. Perhitungan Hasil Pemeriksaan Karakteristisasi Ekstrak Etanol Biji Pepaya
1. Perhitungan kadar air ekstrak etanol biji pepaya
2. Perhitungan kadar abu total ekstrak etanol biji pepaya
% Kadar abu total = berat abu (g)
berat sampel (g)
x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0054 0,0321
2. 2,0114 0,0345
3. 2,0023 0,0314
a. Kadar abu total = x100% 1,60% 2,0054
0,0321 =
b. Kadar abu total = x100% 1,71% 2,0114
0,0345
=
c. Kadar abu total = x100% 1,56% 2,0023
0,0314 =
% Rata-rata kadar abu total = 1,62% 3
1,56% 1,71%
1,60%
= +
Lampiran 13. (Lanjutan)
3. Perhitungan kadar abu tidak larut asam ekstrak etanol biji pepaya
% Kadar abu total = berat abu (g)
berat sampel (g) x 100% No. Berat sampel (g) Berat abu (g)
1. 2,0021 0,0052
2. 1,9931 0,0041
3. 2,0142 0,0063
a. Kadar abu total = x100% 0,25% 2,0021
0,0052
=
b. Kadar abu total = x100% 0,20% 1,9931
0,0041 =
c. Kadar abu total = x100% 0,31% 2,0142
0,0063
=
% Rata-rata kadar abu total = 0,25%
3
0,31% 0,20%
0,25%
= +
Lampiran 13. (Lanjutan)
5. Perhitungan kadar sari larut dalam etanol ekstrak etanol biji pepaya
% Kadar sari larut dalam etanol = berat sari (g)
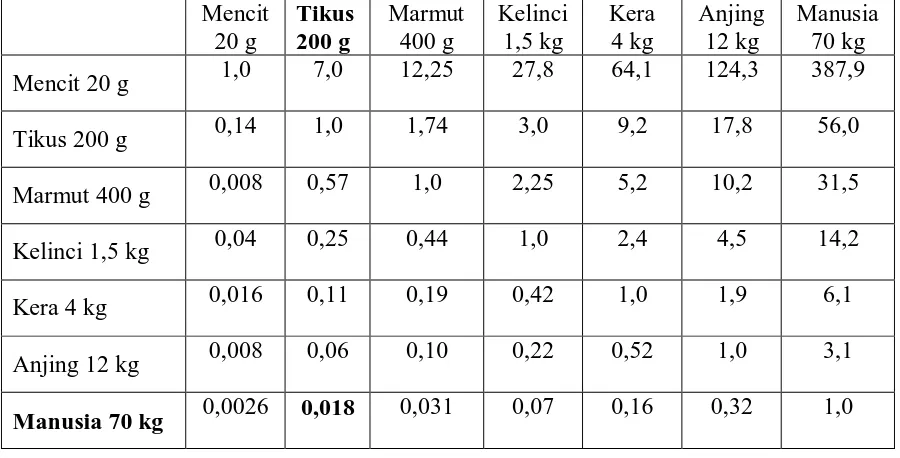
Tabel. Konversi perhitungan dosis antar jenis hewan (Laurence dan Bacharach, 1964).
a. Contoh perhitungan dosis larutan propiltiourasil 0,1% yang akan diberikan pada tikus secara per oral
1. Dosis manusia (berat 70 kg) = 100 mg
Dosis tikus (berat 200 g) = 0,018 x 100 mg = 1,8 mg = 1000/200 x 1,8 mg = 9 mg/kg bb
2. Larutan propiltiourasil 0,1% dibuat dengan cara melarutkan 100 mg serbuk propiltiourasil kedalam 100 ml akuades.
3. Berapa volume larutan propiltiourasil yang akan diberikan pada tikus? (misal berat tikus 200 g)
Jumlah propiltiourasil dosis 9 mg/kg bb = 200
Lampiran 14. (Lanjutan)
b. Contoh perhitungan dosis suspensi simvastatin 0,01% yang akan diberikan pada tikus secara per oral
1. Dosis manusia (berat 70 kg) = 10 mg
Dosis tikus (berat 200 g) = 0,018 x 10 mg = 0,18 mg = 1000/200 x 0,18 mg = 0,9 mg/kg bb 2. Cara pembuatan suspensi simvastatin 0,01%
Sebanyak 10 mg tablet simvastatin digerus di dalam lumpang, kemudian ditambahkan sedikit larutan CMC 0,5% dan digerus sampai homogen. Kemudian dituang ke dalam labu tentukur 100 ml, dicukupkan volumenya dengan larutan CMC 0,5% sampai garis tanda.
3. Berapa volume suspensi simvastatin 0,01% yang akan diberikan pada tikus? (misal berat tikus 200 g)
Jumlah simvastatin dosis 0,9 mg/kg bb = 200
1000 x 0,9 mg = 0,18 mg
Volume larutan yang diberi = 0,18 mg
0,1 mg /ml
=
1,8 mlc. Contoh perhitungan dosis suspensi ekstrak etanol biji pepaya 4% yang akan diberikan pada tikus secara per oral
1. Dosis suspensi ekstrak etanol biji pepaya (EEBP) yang diberikan adalah 200 mg/kg bb dan 400 mg/kg bb
2. Cara pembuatan suspensi ekstrak etanol biji pepaya
3. Berapa volume suspensi ekstrak etanol biji pepaya 4% yang akan diberikan pada tikus? (misal berat tikus 200 g)
Jumlah EEBP dosis 200 mg/kg bb = 200
1000 x 200 mg = 40 mg
Volume larutan yang diberi = 40 mg
40 mg /ml
=
1 mlJumlah EEBP dosis 400 mg/kg bb = 200
1000 x 400 mg = 80 mg
Volume larutan yang diberi = 80 mg
1. Pengukuran Kadar Kolesterol Total
Interval for Mean Minimum Maximum
Lampiran 16. (Lanjutan)
Post Hoc Tests
Multiple Comparisons
Dependent variable: kadar kolesterol total Tukey HSD
kel 2 + simvastatin dosis 0,9 mg/kg bb
Homogeneous subsets
kel 2 + simvastatin dosis
0,9 mg/kg bb 4 72,50
PTU dosis 9 mg/kg bb +
kuning telur 4 103,75
Sig. ,551 ,193 ,915 1,000
Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 4,000.
2. Pengukuran Kadar Trigliserida
Descriptive
N Mean
Std.
Deviation Std. Error
95% Confidence
Lampiran 16. (Lanjutan)
Post Hoc Tests
Multiple Comparisons
Dependent variable: kadar trigliserida Tukey HSD
(I) kelompok perlakuan (J) kelompok perlakuan
Mean pakan biasa + air minum PTU dosis 9 mg/kgBB
+ kuning telur 1,500 3,093 ,988 -8,05 11,05
kel 2 + simvastatin dosis 0,9 mg/kg bb
Homogeneous subsets
kel 2 + simvastatin dosis
0,9 mg/kg bb 4 71,75
Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 4,000.
3. Pengukuran Kadar HDL (High Density Lipoprotein)
Descriptive
Interval for Mean Minimum Maximum
kel 2 + simvastatin
Multiple Comparisons
Dependent variable: kadar HDL Tukey HSD
kel 2 + simvastatin dosis 0,9 mg/kg bb
Homogeneous subsets
kel 2 + simvastatin dosis
0,9 mg/kg bb 4 53,50
Sig. ,549 ,219 ,284
Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 4,000.
4. Kadar LDL (Low Density Lipoprotein)
Descriptive
Interval for Mean Minimum Maximum
kel 2 + simvastatin
Lampiran 16. (Lanjutan)
Post Hoc Tests
Multiple Comparisons
Dependent variable: kadar LDL Tukey HSD
kel 2 + simvastatin dosis 0,9 mg/kg bb
Homogeneous subsets
Kadar LDL
Tukey HSD kelompok perlakuan
N Subset for alpha = .05
1 2 1
kel 2 + simvastatin dosis
0,9 mg/kg bb 4 4,50
kel 2 + EEBP dosis 200
mg/kg bb 4 4,50
pakan biasa + air minum 4 5,25
kel 2 + EEBP dosis 400
mg/kg bb 4 5,25
PTU dosis 9 mg/kg bb +
kuning telur 4 51,00
Sig. ,999 1,000
Lampiran 17. Alat dan Bahan
a. Alat Microlab 300 (E-Merck)
c. Oral sonde + spuit
e. Komposisi reagensia trigliserida
a. Tikus jantan
b. Proses pengambilan darah pada tikus
DAFTAR PUSTAKA
Adam, J.M.F. (2009). Dislipidemia. Dalam Buku Ajar Ilmu Penyakit Dalam. Edisi Kelima. Jilid III. Editor Aru Sudoyo, Bambang Setiyohadi, Idrus Alwi, Marcellus Simadibrata, Siti Setiati. Jakarta: Interna Publishing. Halaman 1984-1992.
Adeneye, A.A., dan Olagunju, J.A. (2009). Preliminary Hypoglycemic and Hypolipidemic Activities of the Aqueous Seed Extract of Carica papaya Linn. in Wistar rats. Biology and Medicine. 1(1): 1-10.
Afoakwah, A.N., dan Owusu, W.B. (2011). The Relationship Between Dietary Intake, Body Composition and Blood Pressure in Male Adult Miners in Ghana. Asian Journal of Clinical Nutrition. 3: 1-13.
Anderson, P.O., James, E.K., dan William, G.T. (2002). Handbook of Clinical
Drug Data. Edisi 10. Amerika Serikat: McGraw-Hill Companies, Inc.
Halaman 375-376.
Anonim. (2012). Profil Lipid (Kadar lemak darah). Tanggal akses 1 september 2014. https://infolaboratoriumkesehatan.wordpress.com/tag/profil-lipid-kadar-lemak-darah.
Anwar, T.B. (2004). Dislipidemia sebagai Faktor Resiko Penyakit Jantung
Koroner. Medan: Universitas Sumatera Utara. Diakses tanggal 23 Maret
2014
Brunton, L.L., John, S.L., dan Keith, L.P. (2010). Goodman & Gilman Manual
Farmakologi dan Terapi. Penerjemah Elin Yulinah Sukandar. Jakarta:
EGC. Halaman 575.
Canaris, G.J., Neil, R.M., Gilbert, M., dan Chester, E.R. (2000). The Colorado Thyroid Disease Prevalence Study. Arch Intern Med. 160: 526-534.
Changamma, C., dan Hasim, B.S. (2013). Effect of Carica papaya (L.) Seed Extract on Lipid Metabolites in Male Albino Rats. International Journal of
Pharmacy and Pharmaceutical Sciences. 4(5): 527-529.
Cipla. (2005). Essence Series Essential Information in Brief: dyslipidemia.
Halaman 2-3. Tanggal akses 5 April 2014.
Washington DC: McGraw-Hill Companies Inc. Halaman 386, 397.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 28-29, 47.
Ditjen POM a. (1995). Farmakope Indonesia. Edisi keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 969-971, 1033.
Ditjen POM b. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 297-326, 333-340.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan I. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 10-11, 17, 31-32.
Dwiloka, B. (2003). Efek Kolesterolemik Berbagai Telur. Media Gizi &
Keluarga. 27(2): 58-65.
Elekofehinti, O.O., Adanlawo, I.G., Saliu, J.A., dan Sodehinde, S.A. (2012). Saponins from Solanum anguivi Fruits Exhibit Hypolipidemic Potential in
Rattus novergicus. Der Pharmacia Lettre. 4(3): 811-814.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. J.
Pharm. Sci. 55(3): 264.
Guyton, A.C., dan Hall, J.E. (2006). Buku Ajar Fisiologi Kedokteran. Edisi 11. Jakarta: EGC. Halaman 983.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi II. Bandung: Penerbit ITB. Halaman 152.
Heidenreich, P.A., Trogdon, J.G., Khavjou, O.A., Butler, J., Dracup, K., Ezekowitz, M.D., et al. (2011). Forecasting the Future of Cardiovascular Disease in the United States: a Policy Statement from American Heart Association. Circulation. 123: 933-944.
Kalie, M.B. (1996). Bertanam Pepaya. Edisi Revisi. Jakarta: Penebar Swadaya. Halaman 1-11.
Kelompok Kerja Ilmiah Pengembangan Obat Bahan Alam Phyto Medika. (1991).
Kothari, S., Anand, K.J., Swaroop, C.M., dan Shrinivas, D.T. (2011). Hypolipidemic Effect Of Fresh Triticum aestivum (Wheat) Grass Juice in Hypercholesterolemic Rats. Acta Poloniae Pharmaceutica-Drug Research. 2(68): 291-294.
Liscum, L. (2002). Cholesterol Biosynthesis. Dalam buku Biochemistry of Lipids, Lipoproteins, and Membrans. Edisi ke-4. Editor: D.E Vance dan J.E Vance. Washington DC: Elsevier Science B.V. Halaman 411.
Matsui, Y., Keiko, K., Hideki, M., Hideo, K., Makoto, A., Hidetoshi, K., dan Hitomi, K. (2009). Quantitative Analysis of Saponins in a Tea-Leaf Extract and Their Antihypercholesterolemic Activity. Biosci. Biotechnol.
Biochem. 73(7): 1513-1519.
Milind, P., dan Gurditta. (2011). Basketful Benefits of Papaya. International
Research Journal of Pharmacy. 2(7): 6-12.
Moffat, A.C., David O.M., dan Brian, W. (2005). Clarke’s Analysis of Drug and
Poisons. Edisi 3. London: Pharmaceutical Press. Electronic Version.
Murray, R.K., Daryl, K. G., dan Victor, W.R. (2003). Biokimia Harper. Edisi ke 27. Jakarta: EGC. Halaman 239-249.
Nidjvelt, R.J., Els, Danny, E.C., Petra, G.B., Klaske, dan Paul, A.M. (2001). Flavonoids: a Review of Probable Mechanisms of Action and Potential Applications. Am J Clin Nutr. 74: 418–425.
Oliveira, T.T., Kelly, F.S.R., Marcia, R.A., Marcelo, R.C., dan Tanus, J.M. (2007). Hypolipidemic Effect of Flavonoids and Cholestyramine in Rats.
Lat. Am. J. Pharm. 26(3): 407-410.
Pamungkas, R.A., Singgih, S.S.R., dan Samsu, W. (2013). Pengaruh Level Etanol dan Lama Maserasi Kuning Telur Puyuh Terhadap Kolesterol Total, HDL, dan LDL. Jurnal Ilmiah Peternakan. 1(3): 1136-1142.
Randox Laboratories. (2007). Lipid Profile. United Kingdom: Randox Laboratories Ltd. Halaman 6.
Rizos, C.V., Elisaf, M.S., dan Liberopuolos, E.N. (2011). Effects of Thyroid Dysfunction on Lipid Profile. The Open Cardiovascular Medicine Journal. 5: 76-84.
Kedokteran Universitas Brawijaya. Halaman 7-8.
Satyanarayana, U. (2005). Biochemistry. Edisi kedua. New Delhi: Uppala Author-Publisher Interlinks. Halaman 319.
Soeharto, I. (2004). Penyakit Jantung Koroner dan Serangan Jantung. Edisi Kedua. Jakarta: Gramedia. Halaman 66.
Suharti, K., Suherman, dan Elysabeth. (2007). Hormon Tiroid dan Antitiroid. Dalam buku Farmakologi dan Terapi. Edisi Ke-5. Editor: Sulistia Gan Gunawan. Jakarta: Fakultas Kedokteran UI. Halaman 441-442.
Sukadana, I.M., Sri, R.S., dan Juliarti, N.K. (2008). Aktivitas Antibakteri Senyawa Golongan Triterpenoid dari Biji Pepaya (Carica papaya L.).
Jurnal Kimia. 2(1): 15-18.
Suyatna, F.D. (2007). Hipolipidemik. Dalam buku Farmakologi dan Terapi. Edisi Ke-5. Editor: Sulistia Gan Gunawan. Jakarta: Fakultas Kedokteran UI. Halaman 374.
Suyono, S. (1996). Hiperlipidemia. Dalam Buku Ajar Ilmu Penyakit Dalam. Jilid I. Edisi Ketiga. Editor: H.M. Sjaifoellah Noer. Jakarta: Fakultas Kedokteran UI. Halaman 718.
Tebib, K., Pierre, B., dan Jean, M.R. (1994). Dietary Grape Seed Tannins Affect Lipoproteins, Lipoprotein Lipases and Tissue Lipids in Rats Fed Hypercholesterolemic Diets. J. Nutr. 124: 2451-2457.
Voight, R. (1995). Buku Pelajaran Teknologi Farmasi. Edisi ke-5. Yogyakarta: Media Press. Halaman 564, 568, 570, 574-577.
Wahyuningrum, M.R. (2012). Pengaruh Pemberian Buah Pepaya (Carica papaya L.) Terhadap Kadar Trigliserida Pada Tikus Sprague Dawley Dengan Hiperkolesterolemia. Artikel Penelitian. Semarang: Fakultas Kedokteran Universitas Diponegoro.
Warisno. (2003). Budidaya Pepaya. Yogyakarta: Kanisius. Halaman 16.
World Health Organization. (1998). Quality Control Methods for Medicinal Plant
Material. Switzerland: WHO. Halaman 19-25.
METODE PENELITIAN
Metode yang digunakan pada penelitian ini adalah metode eksperimental dengan post-test only control group design. Prosedur yang dilakukan meliputi penyiapan bahan tumbuhan, karakterisasi simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, pembuatan ekstrak etanol biji pepaya, tahap persiapan bahan pengujian, dan tahap pengujian terhadap profil lipid pada tikus diantaranya pengukuran kadar kolesterol total, pengukuran kadar trigliserida, pengukuran kadar HDL dan pengukuran kadar LDL dengan metode kolorimetri enzimatik. Data dianalisis dengan uji One way Anova dan dilanjutkan dengan uji post hoc
Tukey untuk melihat perbedaan nyata antar perlakuan. Analisis statistik ini
menggunakan program SPSS (Statistical Product and Service Solution) versi 15 dengan taraf kepercayaan 95%.
3.1 Alat dan Bahan Penelitian
3.1.1 Alat Penelitian
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, aluminium foil, batang pengaduk, blender, cawan penguap 250 ml,
centrifuge, kertas saring, label, lemari pengering, mikrotube, mortir, neraca
3.1.2 Bahan Penelitian
Sampel yang digunakan pada penelitian ini adalah biji pepaya. Bahan-bahan kimia yang berkualitas pro analisis produksi E-Merck: toluen, kloroform, isopropanol, benzen, n-heksan, asam nitrat pekat, asam klorida pekat, asam sulfat pekat, raksa (II) klorida, bismuth (III) nitrat, besi (III) klorida, timbal (II) asetat,
kalium iodida, iodium, α-naftol, asam asetat anhidrida, natrium hidroksida, amil alkohol, serbuk magnesium (Mg) dan kloralhidrat. Bahan kimia berkualitas teknis yang digunakan adalah etanol 96%.
Bahan lain yang digunakan adalah aquades, CMC Na, kuning telur puyuh, tablet propiltiourasil, tablet simvastatin, reagensia kolesterol, reagensia trigliserida, dan reagensia pengendap HDL-kolesterol.
3.1.3 Komposisi Reagensia Pengukuran Kadar Profil Lipid
Komposisi reagensia pengukuran kadar profil lipid serum pada tikus dapat dilihat pada Lampiran 17 halaman 104-105.
3.2 Hewan Penelitian
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan, identifikasi tumbuhan, dan pembuatan simplisia biji pepaya.
3.3.1 Pengumpulan Bahan Tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposif, yaitu tanpa membandingkan dengan daerah lain. Bagian tumbuhan yang digunakan dalam penelitian ini adalah buah pepaya matang yang diambil dari Dusun 17 Tambak Bayan Desa Saentis, Kecamatan Percut Sei Tuan, Kabupaten Deli Serdang, Provinsi Sumatera Utara. Sampel yang digunakan pada penelitian ini adalah biji pepaya yang terdapat pada buah pepaya matang.
3.3.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan pada Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia.
3.3.3 Pembuatan Simplisia Biji Pepaya
3.4 Pembuatan Pereaksi
3.4.1 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM a
3.4.2 Pereaksi Dragendorff
, 1995).
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM a
3.4.3 Pereaksi Bourchardat
, 1995).
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM a
3.4.4 Pereaksi Molisch
, 1995).
Seban yak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Ditjen POM a
3.4.5 Pereaksi Asam Klorida 2 N
, 1995).
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Ditjen POM a
3.4.7 Pereaksi Natrium Hidroksida 2 N
, 1995).
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Ditjen POM a
3.4.8 Pereaksi Timbal (II) Asetat 0,4 M
, 1995).
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM a
3.4.9 Pereaksi besi (III) klorida 1%
, 1995).
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM a
3.4.10 Pereaksi Liebermann-Burchard
, 1995).
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50 bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Ditjen POM a, 1995).
3.5 Pemeriksaan Karakteristik Simplisia dan Ekstrak
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna,
bentuk, ukuran dan tekstur dari simplisia.
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah diteteskan dengan larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di bawah mikroskop.
3.5.3 Penetapan Kadar Air
Sebanyak 5 g serbuk simplisia dan ekstrak dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (WHO, 1998; Ditjen POM b
3.5.5 Penetapan Kadar Sari Larut dalam Etanol
, 1995)
Sebanyak 5 g serbuk simplisia dan ekstrak dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (WHO, 1998; Ditjen POM b
3.5.6 Penetapan Kadar Abu Total
, 1995)
bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (WHO, 1998; Ditjen POM b
3.5.7 Penetapan Kadar Abu Tidak Larut Asam
, 1995).
Abu yang diperoleh dalam penetapan kadar abu didihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (WHO, 1998; Ditjen POM b, 1995).
3.6 Skrining Fitokimia Serbuk Simplisia dan Ekstrak
Skrining fitokimia serbuk simplisia dan ekstrak meliputi pemeriksaan senyawa golongan alkaloid, flavonoid, tanin, glikosida, saponin, dan steroid/triterpenoid.
3.6.1 Pemeriksaan Alkaloida
Sebanyak 0,5 g serbuk simplisia dan ekstrak ditimbang kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan terbentuk endapan berwarna putih atau kuning.
b. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat akan terbentuk endapan berwarna coklat-hitam.
atau tiga dari percobaan di atas (Ditjen POM b
3.6.2 Pemeriksaan Flavonoida
, 1995).
Larutan Percobaan:
Sebanyak 0,5 g serbuk simplisia dan ekstrak disari dengan 10 ml metanol lalu direfluks selama 10 menit, disaring panas-panas melalui kertas saring berlipat, filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambah 5 ml eter minyak tanah, dikocok hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40o
Cara Percobaan:
C. Sisa dilarutkan dalam 5 ml etil asetat, disaring.
a. satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1-2 ml etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 ml asam klorida 2 N, didiamkan selama satu menit. Ditambahkan 10 ml asama klorida pekat, jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya flavonoida (glikosida-3-flavonol).
b. satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1 ml etanol 96%, ditambahkan 0,1 g magnesium dan 10 ml asam klorida pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya flavonoida (Ditjen POM b
3.6.3 Pemeriksaan Tanin
, 1995).
(III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.4 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia dan ekstrak disari dengan 30 ml campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling, selanjutnya ditambahkan 10 ml HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring. Pada 30 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali dengan 20 ml campuran 3 bagian volume kloroform dan 2 bagian volume isopropanol. Diambil lapisan air kemudian ditambahkan 2 ml air dan 5 tetes pereaksi Molisch, ditambahkan hati-hati 2 ml asam sulfat pekat terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (Ditjen POM b
3.6.5 Pemeriksaan Saponin
, 1995).
Sebanyak 0,5 g simplisia dan ekstrak dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin (Ditjen POM b
3.6.6 Pemeriksaan Steroida/Triterpenoida
, 1995).
menunjukkan adanya steroida triterpenoida (Harborne, 1987).
3.7 Tahap Persiapan Penelitian
3.7.1 Pembuatan Ekstrak Etanol Biji Pepaya
Sebanyak 350 gram serbuk simplisia dimasukkan ke dalam bejana tertutup dan dibasahi dengan etanol 96%, kemudian dimaserasi selama 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan hati-hati, kemudian cairan penyari dituangkan secukupnya sampai cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator ditutup dan dibiarkan 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya dengan memasang botol cairan penyari di atas perkolator dan diatur kecepatan penetesan cairan penyari sama dengan kecepatan menetes perkolat, sehingga selalu terdapat selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika perkolat yang keluar telah jernih. Perkolat yang diperoleh dipekatkan dengan alat rotary
evaporator. Kemudian dikeringkan dengan freeze dryer selama lebih kurang 24
jam dan diperoleh ekstrak kental 25,286 gram (Ditjen POM, 1979).
3.7.2 Pembuatan Diet Kuning Telur Puyuh
3.7.3 Pembuatan Larutan Propiltiourasil 0,1%
Sebanyak 0,1 g serbuk propiltiourasil dimasukkan kedalam erlenmeyer dan dilarutkan dengan sedikit aquades. Kemudian dimasukkan kedalam labu takar 100 ml. Volumenya dicukupkan dengan aquades hingga 100 ml.
3.7.4 Pembuatan Suspensi Simvastatin 0,01%
Sebanyak 0,5 g CMC ditaburkan dalam lumpang yang berisi 10 ml aquades panas. Didiamkan 15 menit hingga diperoleh massa yang transparan dan digerus hingga terbentuk gel. Sebanyak 10 mg simvastatin digerus dan ditambahkan larutan CMC sedikit demi sedikit sambil digerus dan diencerkan dengan sedikit air. Kemudian dimasukkan ke dalam labu takar 100 ml. Volumenya dicukupkan dengan aquades hingga 100 ml.
3.7.5 Pembuatan Suspensi Ekstrak Etanol Biji Pepaya 4% b/v
Sebanyak 0,5 g CMC ditaburkan dalam lumpang yang berisi 10 ml aquades panas. Didiamkan 15 menit hingga diperoleh massa yang transparan dan digerus hingga terbentuk gel. Kemudian ekstrak etanol biji pepaya sebanyak 4 g digerus dan ditambahkan larutan CMC sedikit demi sedikit sambil terus digerus hingga terbentuk suspensi. Kemudian dimasukkan ke dalam labu takar 100 ml. Volumenya dicukupkan dengan aquades hingga 100 ml.
3.8 Tahap Pengujian
3.8.1 Pemilihan dan Penyiapan Hewan Uji
Hewan uji yang digunakan adalah tikus jantan galur wistar (Rattus
novergicus) berumur 2-3 bulan dengan bobot badan 150-200 g, diaklimatisasi
Kelompok 2 : diberikan kuning telur puyuh dosis 1% berat badan dan propiltiourasil dosis 9 mg/kg bb secara per oral (kontrol pembanding)
Kelompok 3 : diberikan kuning telur puyuh dosis 1% berat badan, propiltiourasil dosis 9 mg/kg bb, dan simvastatin dosis 0,9 mg/kg bb secara per oral (kontrol positif)
Kelompok 4 : diberikan kuning telur puyuh dosis 1% berat badan, propiltiourasil dosis 9 mg/kg bb, dan EEBP dosis 200 mg/kg bb secara per oral
Kelompok 5 : diberikan kuning telur puyuh dosis 1% berat badan, propiltiourasil dosis 9 mg/kg bb, dan EEBP dosis 400 mg/kg bb secara per oral.
3.8.2 Perlakuan Terhadap Hewan Uji
pemberian 1 jam. 2 jam setelah pemberian larutan PTU, diberikan EEBP dosis 200 mg/kg bb secara per oral. Kelompok 5 diberikan kuning telur puyuh dosis 1% berat badan, larutan PTU dosis 9 mg/kg bb dengan selang pemberian 1 jam. 2 jam setelah pemberian larutan PTU, diberikan EEBP dosis 400 mg/kg bb secara per oral. Perlakuan dilakukan selama 21 hari. Pada hari ke- 22 dilakukan pengambilan darah tikus melalui ekor dengan tikus dipuasakan selama 12-24 jam sebelumnya tetapi tetap diberikan air minum (Pokja Obat bahan Alam, 1991). Darah kemudian ditampung dengan mikrotube sebanyak 1 ml, disentrifuge selama 15 menit dengan kecepatan 4000 rpm, kemudian terbentuk 2 lapisan yaitu lapisan supernatan (serum) dan endapan. Pada lapisan supernatan dilakukan pengujian pengukuran kadar profil lipid.
3.8.3 Metode Pengukuran Profil Lipid (Kolesterol Total, Trigliserida, HDL dan LDL)
3.8.3.1 Pengukuran Kadar Kolesterol Total
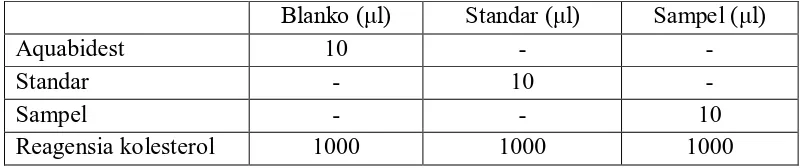
Kadar kolesterol ditetapkan dengan metode kolorimetri enzimatik (metode CHOD-PAP) dengan kolesterol esterase, kolesterol oksidase, dan peroksidase sebagai katalis indikator reaksi. Jumlah sampel, standar, dan reagensia kolesterol yang dibutuhkan dapat dilihat pada Tabel 3.1.
Prinsip:
Kolesterol ester + H2 Kolesterol + O
O kolesterol esterase kolesterol + asam lemak 2 kolesterol oksidase kolesten- 3- on + H2O
2 H
2
Blanko (μl) Standar (μl) Sampel (μl)
Aquabidest 10 - -
Standar - 10 -
Sampel - - 10
Reagensia kolesterol 1000 1000 1000
Serum darah dipipet dengan pipet mikro sebanyak 10 μl, dimasukkan kedalam tabung reaksi, kemudian ditambahkan larutan reagensia kolesterol
sebanyak 1000 μl, lalu dihomogenkan dengan menggunakan vortex, dan
diinkubasi pada suhu 37ºC selama 10 menit. Diukur serapan pada panjang gelombang 546 nm terhadap blanko dalam waktu 60 menit. Sebagai blanko
digunakan larutan reagensia kolesterol 1000 μl dan aquabidest 10 μl. Pengukuran
serapan standar sama dengan pengukuran serapan kolesterol total, tetapi serum darah diganti dengan standar kolesterol. Kadar kolesterol total diperoleh dengan menggunakan rumus:
Dimana: C = Kadar Kolesterol total (mg/dl) A = Serapan
Cst = Kadar kolesterol standar (200 mg/dl)
3.8.3.2Pengukuran Kadar Trigliserida
Kadar trigliserida ditetapkan dengan metode kolorimetri enzimatik (metode GPO-PAP) menggunakan gliserol-3-fosfat oksidase (GPO). Jumlah sampel, standar, dan reagensia trigliserida yang dibutuhkan dapat dilihat pada Tabel 3.2.
C kolesterol total =
� ������
Prinsip:
Trigliserida lipase gliserol + asam lemak Gliserol + ATP
Gliserol -3- fosfat + O
gliserol kinase gliserol -3- fosfat + ADP 2 GPO dihidroksiaseton + fosfat + H2O 2 H
2
2O2 + 4- aminoantipirin + 4- klorofenol peroksidase kuinonimin + HCl + 4 H2
Tabel 3.2 Jumlah sampel, standar dan reagensia trigliserida yang dibutuhkan
dalam pengukuran kadar trigliserida O
Blanko (μl) Standar (μl) Sampel (μl)
Standar - 10 -
Sampel - - 10
Reagensia trigliserida 1000 1000 1000
Serum darah dipipet dengan pipet mikro sebanyak 10 μl, dimasukkan kedalam tabung reaksi, kemudian ditambahkan larutan reagensia trigliserida
sebanyak 1000 μl, lalu dihomogenkan dengan menggunakan vortex, dan
diinkubasi pada suhu 37ºC selama 10 menit. Diukur serapan pada panjang gelombang 546 nm terhadap blanko dalam waktu 60 menit. Pengukuran serapan standar dilakukan dengan cara yang sama dengan pengukuran serapan sampel. Kadar trigliserida diperoleh dengan menggunakan rumus:
Dimana: C = Kadar trigliserida (mg/dl) A = Serapan
Cst = Kadar trigliserida standar (200 mg/dl) C trigliserida =
� ������
Dalam pengukuran kadar kolesterol HDL, dilakukan presipitasi HDL
dengan reagen pengendapan kolesterol HDL terlebih dahulu. Jumlah sampel, standar, dan reagensia pengendapan kolesterol HDL dapat dilihat pada Tabel 3.3.
Tabel 3.3 Prosedur presipitasi HDL
Prosedur Presipitasi
Sampel/ standar 200 μl
Reagensia pengendapan 500 μl
Serum darah dipipet dengan pipet mikro sebanyak 200 μl lalu
ditambahkan 500 μl larutan reagensia pengendap kolesterol-HDL, dikocok, dan dibiarkan selama 10 menit pada suhu 25ºC. Kemudian disentrifuge selama 20 menit dengan kecepatan 4000 rpm.
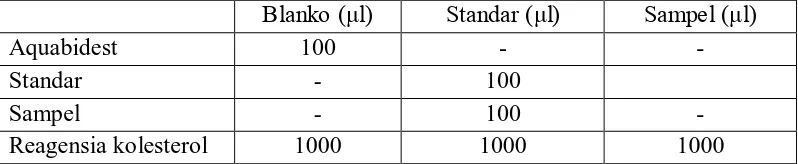
Kadar kolesterol HDL ditetapkan dengan metode kolorimetri enzimatik dengan menggunakan reagensia kolesterol. Jumlah sampel, standar, dan reagensia kolesterol yang dibutuhkan dapat dilihat pada Tabel 3.4.
Tabel 3.4 Jumlah sampel, standar, dan reagensia kolesterol yang dibutuhkan
dalam pengukuran kadar HDL
Blanko (μl) Standar (μl) Sampel (μl)
Aquabidest 100 - -
Standar - 100
Sampel - 100 -
Reagensia kolesterol 1000 1000 1000
Kadar kolesterol-HDL diperoleh dengan menggunakan rumus:
Dimana: C = Kadar Kolesterol-HDL (mg/dl) A = Serapan
Cst = Kadar kolesterol standar (200 mg/dl)
3.8.3.4Pengukuran Kadar Kolesterol LDL (Low Density Lipoprotein)
Kadar LDL dapat ditetapkan secara tidak langsung dengan menggunakan rumus Friedewald:
3.9 Analisis Data
Data hasil penelitian dianalisis dengan metode analisis variansi (ANOVA) dengan tingkat kepercayaan 95% dan dilanjutkan dengan uji post hoc Tukey untuk melihat perbedaan nyata antar perlakuan. Analisis statistik ini menggunakan program SPSS (Statistical Product and Service Solution) versi 15.
C kolesterol-HDL =
� ������
� �������x C st
LDL (mg/dl) = kolesterol total – trigliserida – kolesterol HDL
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan oleh Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia, menunjukkan bahwa tumbuhan yang digunakan adalah Pepaya (Carica papaya L.), suku Caricaceae. Hasil identifikasi dapat dilihat pada Lampiran 1 halaman 69.
4.2 Hasil Karakterisasi Simplisia dan Ekstrak
Pemeriksaan karakteristik biji pepaya secara makroskopik dilakukan untuk memperoleh identitas simplisia. Hasil pemeriksaan makroskopik simplisia biji pepaya adalah biji berwarna cokelat kehitaman dengan permukaan kasar, bergerigi, tebal, keras, berbentuk bulat lonjong, berukuran ± 5 – 8 mm. Gambar hasil pemeriksaan makroskopik biji pepaya dapat dilihat pada Lampiran 3 halaman 71.
Pemeriksaan karakteristik serbuk simplisia secara mikroskopik dilakukan untuk memperoleh identitas simplisia. Hasil pemeriksaan karakteristik serbuk simplisia secara mikroskopik terlihat adanya kutikula, jaringan epidermis, jaringan parenkim, hablur kristal oksalat bentuk prisma dan druse, berkas pembuluh (xylem), sel rambut multiselular, dan kelenjar minyak yang berisi butir-butir minyak. Gambar hasil pemeriksaan mikroskopik biji pepaya dapat dilihat pada Lampiran 4 halaman 72.
penetapan nilai untuk berbagai parameter produk. Hasil pemeriksaan karakterisasi simplisia dan ekstrak biji pepaya terlihat pada Tabel 4.1 berikut.
Tabel 4.1 Hasil Karakterisasi Simplisia dan Ekstrak Biji Pepaya
No Karakteristik Hasil Pemeriksaan (%)
Simplisia Ekstrak
1 Kadar air 7,26 9,95
2 Kadar abu total 8,74 1,62
3 Kadar abu tidak larut asam 1,07 0,25
4 Kadar sari larut dalam air 16,84 64,26
5 Kadar sari larut dalam etanol 11,01 70,85
Monografi dari simplisia biji pepaya tidak ditemukan di buku Materia Medika Indonesia (MMI), sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut. Hasil penetapan kadar air simplisia dan ekstrak etanol biji pepaya diperoleh 7,26% dan 9,95%, hal ini sesuai dengan standarisasi kadar air simplisia secara umum dengan syarat yaitu tidak lebih dari 10% (Ditjen POM b
Karakterisasi simplisia lain seperti penetapan kadar abu total, penetapan kadar abu yang tidak larut dalam asam, penetapan kadar sari yang larut dalam etanol, dan penetapan kadar sari yang larut dalam air khusus untuk simplisia biji pepaya belum ada literatur yang mencantumkannya sehingga tidak mempunyai standarisasi.
, 1995). Penetapan kadar air dilakukan untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air dalam ekstrak karena tingginya kandungan air menyebabkan ketidakstabilan sediaan obat, bakteri dan jamur cepat tumbuh dan bahan aktif yang terkandung didalamnya dapat terurai.
air. Sedangkan senyawa-senyawa yang tidak larut dalam air dan larut dalam etanol akan tersari oleh etanol.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal yang terdapat didalam simplisia yang diteliti serta senyawa organik yang tersisa selama pembakaran.
Penetapan kadar abu total dan kadar abu tidak larut asam ditetapkan untuk melihat kandungan mineral ekstrak. Zat-zat ini dapat berasal dari senyawa oksida-oksida anorganik. Kadar abu total yang tinggi menunjukkan adanya zat anorganik logam-logam (Ca, Mg, Fe, Cd dan Pb) yang sebahagian mungkin berasal dari pengotoran. Kadar logam berat yang tinggi dapat membahayakan kesehatan, oleh sebab itu perlu dilakukan penetapan kadar abu total dan kadar abu tidak larut asam untuk memberikan jaminan bahwa ekstrak tidak mengandung logam berat tertentu melebihi nilai yang ditetapkan karena berbahaya (toksik) bagi kesehatan.
4.3 Hasil Skrining Fitokimia Serbuk Simplisia dan Ekstrak
Tabel 4.2 Hasil Skrining Fitokimia Serbuk Simplisia dan Ekstrak Biji Pepaya
No Golongan Senyawa Hasil Pemeriksaan
Simplisia Ekstrak
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Hasil skrining menunjukkan bahwa simplisia dan ekstrak etanol biji pepaya mengandung senyawa golongan alkaloid, flavonoid, tanin, saponin, glikosida, dan steroid/triterpenoid.
4.4 Hasil Pengujian Ekstrak Etanol Biji Pepaya Terhadap Kadar Kolesterol Total pada Tikus
Pada penelitian ini, digunakan propiltiourasil sebagai penginduksi endogen dan kuning telur sebagai penginduksi eksogen dalam mempengaruhi nilai profil lipid pada tikus.
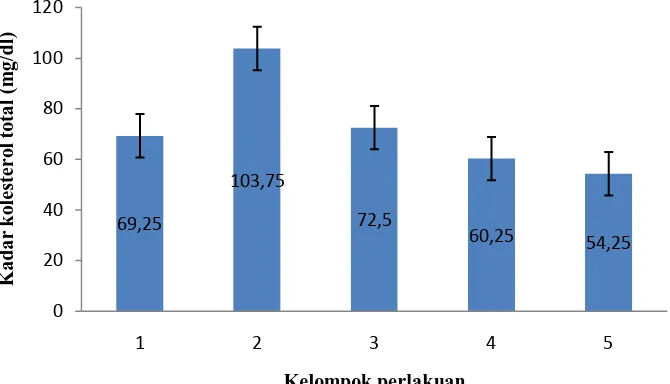
Hasil pengujian EEBP terhadap kadar kolesterol total pada tikus disajikan pada Tabel 4.3 dan grafik pada Gambar 4.1.
Tabel 4.3 Hasil rata-rata kadar kolesterol total (mg/dl) pada tikus setelah
perlakuan 21 hari
Tikus Kelompok Perlakuan
Kelompok 1 Kelompok 2 Kelompok 3 Kelompok 4 Kelompok 5
yaitu pada kelompok 2 sebesar 103,75 ± 5,7373 mg/dl, dan paling rendah pada kelompok 5 sebesar 54,25 ± 5,8523 mg/dl.
Gambar 4.1 Diagram rata-rata kadar kolesterol total (mg/dl) serum tikus setelah
perlakuan 21 hari
*Ket: Kelompok 1 : Pakan biasa + air minum
Kelompok 2 : PTU 9 mg/kg bb + kuning telur
Kelompok 3 : PTU 9 mg/kg bb + kuning telur + Simvastatin 0,9 mg/kg bb Kelompok 4 : PTU 9 mg/kg bb + kuning telur + EEBP 200 mg/kg bb Kelompok 5 : PTU 9 mg/kg bb + kuning telur + EEBP 400 mg/kg bb
Berdasarkan uji ANOVA, kadar kolesterol total pada kelompok 2 berbeda secara signifikan dibandingkan dengan kelompok 1, kelompok 3, kelompok 4, dan kelompok 5 (p < 0,05). Hal ini menunjukkan bahwa pemberian propiltiourasil dan kuning telur puyuh dapat meningkatkan kadar kolesterol total pada tikus.
Dibandingkan antara kelompok 2 dengan kelompok 3 yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa pemberian simvastatin dapat menurunkan kadar kolesterol total. Menurut
Williams (2005), simvastatin dapat menurunkan kadar kolesterol total sebesar 15-40%.
Dibandingkan antara kelompok 2 dengan kelompok 4 dan kelompok 5 yaitu terdapat perbedaan secara signifikan dengan p = 0,00 (p < 0,05). Hal ini menunjukkan bahwa EEBP dapat menurunkan kadar kolesterol total pada tikus.
Dibandingkan antara kelompok 3 dengan kelompok 4 dan kelompok 5 yaitu terdapat perbedaan secara signifikan dengan p = 0,044 dan p = 0,002 (p < 0,05). Hal ini menunjukkan bahwa terdapat perbedaan efek yang ditimbulkan antara simvastatin dengan EEBP dalam menurunkan kadar kolesterol total pada tikus. Besarnya perbedaan efek sebanding dengan peningkatan dosis pada EEBP.
Dibandingkan antara kelompok 4 dengan kelompok 5 yaitu tidak terdapat perbedaan secara signifikan dengan p = 0,551 (p > 0,05). EEBP dosis 400 mg/kg bb tetap memberikan efek penurunan terhadap kadar kolesterol total pada tikus dengan rata-rata kadar kolesterol totalnya sebesar 54,25 ± 5,8523 mg/dl.
Propiltiourasil bekerja sebagai antitiroid yang menghambat sel-sel tiroid pada tikus sehingga produksi hormon tiroid terhambat dan mengakibatkan hipotiroidisme (Febrina, dkk., 2009). Propiltiourasil menyebabkan penurunan kadar kolesterol di hati melalui inhibisi aktivitas HMG Co-A reduktase (Rizos, et al., 2011). Inhibisi aktivitas HMG Co-A reduktase menyebabkan berkurangnya sintesis kolesterol dihati. Meskipun demikian, pada hipotiroidisme terjadi peningkatan kadar kolesterol di darah. Peningkatan ini tidak diimbangi oleh tingginya aktivitas reseptor LDL karena adanya down-regulasi (penurunan jumlah) reseptor LDL akibat inhibisi SREBP-2 (Sterol Regulatoy Element
dimetabolisme di hati. Selain itu, kuning telur puyuh memiliki kandungan kolesterol yang paling tinggi dibandingkan dengan kuning telur unggas lain yaitu sebesar 2139,17 mg/100 g sehingga mampu meningkatkan kadar kolesterol (Dwiloka, 2003).
Penurunan kadar kolesterol total disebabkan kandungan senyawa berupa flavonoid, tanin, dan saponin yang ada pada EEBP. Flavonoid diketahui dapat menurunkan kadar kolesterol total karena merupakan kofaktor dari enzim kolesterol esterase. Selain itu, flavonoid dapat meningkatkan sekresi getah empedu melalui pengaktifan enzim sitokrom P-450. Enzim sitokrom P-450 mengikat beberapa komponen dalam getah empedu sehingga mengurangi kadar kolesterol didalam tubuh (Oliveira, et al., 2007). Saponin dalam EEBP membentuk kompleks tidak larut dengan kolesterol sehingga mencegah absorbsi kolesterol di usus halus. Selain itu saponin mengurangi absorbsi getah empedu dengan membentuk kompleks misel yang tidak dapat diabsorbsi karena berat molekulnya terlalu besar (Matsui, et al., 2009). Sedangkan tanin dalam EEBP dapat mengurangi absorbsi kolesterol di usus halus dan meningkatkan sekresi asam empedu dengan mekanisme yang sama seperti saponin serta dapat meningkatkan reverse cholesterol transport (Tebib, et al., 1994).
4.5 Hasil Pengujian Ekstrak Etanol Biji Pepaya Terhadap Kadar
Trigliserida pada Tikus
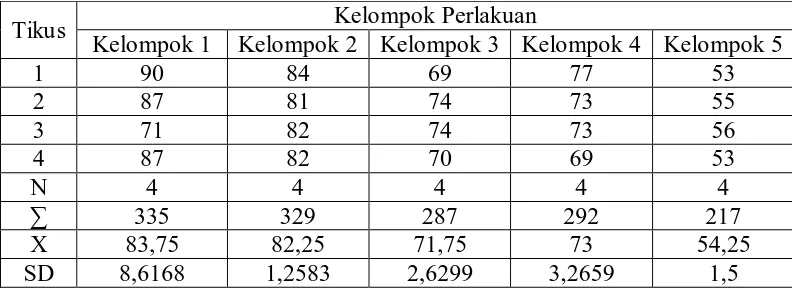
Tabel 4.4 Hasil rata-rata kadar trigliserida (mg/dl) serum tikus setelah perlakuan
21 hari
Tikus Kelompok Perlakuan
Kelompok 1 Kelompok 2 Kelompok 3 Kelompok 4 Kelompok 5
1 90 84 69 77 53
Dari Tabel 4.4 terlihat bahwa rata-rata kadar trigliserida paling tinggi yaitu pada kelompok 1, sebesar 83,75 ± 8,6168 mg/dl, dan paling rendah pada kelompok 5, sebesar 54,25 ± 1,5 mg/dl.
Gambar 4.2 Diagram rata-rata kadar trigliserida (mg/dl) serum tikus setelah
perlakuan 21 hari
*Ket: Kelompok 1 : Pakan biasa + air minum
Kelompok 2 : PTU 9 mg/kg bb + kuning telur
secara signifikan dengan kelompok 1, hal ini menunjukkan bahwa propiltiourasil dan kuning telur tidak dapat meningkatkan kadar trigliserida.
Dibandingkan antara kelompok 2 dengan kelompok 3 yaitu terdapat perbedaan secara signifikan dengan p = 0,028 (p < 0,05). Pemberian simvastatin dapat menurunkan kadar trigliserida dalam darah sebesar 10 - 30% (Anderson, et al., 2002).
Dibandingkan antara kelompok 2 dengan kelompok 4 yaitu tidak terdapat perbedaan secara signifikan terhadap kadar trigliserida pada tikus dengan p = 0,060 (p > 0,05). Dibandingkan antara kelompok 2 dengan kelompok 5 yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa EEBP dosis 400 mg/kg bb dapat menurunkan kadar trigliserida secara bermakna.
Dibandingkan antara kelompok 3 dengan kelompok 4 yaitu tidak terdapat perbedaan secara signifikan dengan p = 0,994 (p < 0,05). Dibandingkan antara kelompok 3 dengan kelompok 5 yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa EEBP dosis 400 mg/kg bb memberikan efek yang lebih besar dibandingkan dengan simvastatin dalam menurunkan kadar trigliserida pada tikus.
trigliseridanya dipengaruhi oleh asupan lemak dan karbohidrat pada makanan (Murray, dkk., 2006).
Penurunan kadar trigliserida disebabkan oleh kandungan senyawa flavonoid, tanin, dan saponin pada EEBP. Flavonoid dan tanin dapat meningkatkan aktivitas lipoprotein lipase (LPL) sehingga meningkatkan hidrolisis trigliserida menjadi asam lemak dan gliserol, sehingga kadar trigliserida dalam darah menurun (Wahyuningrum, 2012; Millind dan Gurditta; Kothari, et al., 2011). Saponin dapat menurunkan sintesis trigliserida dan absorbsi asam lemak serta meningkatkan oksidasi asam lemak (Elekofehinti, et al., 2012; Zhao, et al., 2005).
4.6 Hasil Pengujian Ekstrak Etanol Biji Pepaya Terhadap Kadar HDL pada Tikus
Hasil pengujian EEBP terhadap kadar HDL pada tikus disajikan pada Tabel 4.5 dan grafik pada Gambar 4.3.
Tabel 4.5 Hasil rata-rata kadar HDL (mg/dl) serum tikus setelah perlakuan 21
hari
Tikus Kelompok Perlakuan
Kelompok 1 Kelompok 2 Kelompok 3 Kelompok 4 Kelompok 5
1 52 38 58 42 36
2 50 35 52 40 40
3 46 39 58 38 43
4 42 34 46 44 33
N 4 4 4 4 4
∑ 190 146 214 164 152
X 47,5 36,5 53,5 41 38
pada kelompok 2 sebesar 36,5 ± 2,3804 mg/dl. Rata-rata kadar HDL paling tinggi terdapat pada kelompok 3 sebesar 53,5 ± 5,7445 mg/dl.
Gambar 4.3 Diagram rata-rata kadar HDL (mg/dl) serum tikus setelah perlakuan
21 hari
*Ket : Kelompok 1 : Pakan biasa + air minum
Kelompok 2 : PTU 9 mg/kg bb + kuning telur
Kelompok 3 : PTU 9 mg/kg bb + kuning telur + Simvastatin 0,9 mg/kg bb Kelompok 4 : PTU 9 mg/kg bb + kuning telur + EEBP 200 mg/kg bb Kelompok 5 : PTU 9 mg/kg bb + kuning telur + EEBP 400 mg/kg bb
Berdasarkan uji ANOVA, kadar HDL kelompok 2 berbeda secara signifikan dibandingkan dengan kelompok 1 dengan p = 0,013 (p < 0,05). Dibandingkan antara kelompok 2 dengan kelompok 3, terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa pemberian simvastatin dapat meningkatkan kadar HDL. Mekanisme statin meningkatkan kadar HDL yaitu dengan cara menurunkan laju katabolisme Apo AI, peningkatkan produksi Apo AI akibat inhibisi HMG-CoA reduktase, dan menginhibisi aktivitas cholesteryl ester transfer protein (CETP) (Sargowo, 2008). Simvastatin mampu meningkatkan kadar HDL sebesar 5 - 15% (Williams, 2005).
Dibandingkan antara kelompok 2 dengan kelompok 4 dan kelompok 5, yaitu tidak terdapat perbedaan secara signifikan dengan p = 0,549 dan p = 0,984 (p > 0,05). Hal ini menunjukkan bahwa pemberian EEBP dosis 200 mg/kg bb dan dosis 400 mg/kg bb tidak dapat meningkatkan kadar HDL pada tikus.
Dibandingkan antara kelompok 3 dengan kelompok 4 dan kelompok 5, terdapat perbedaan secara signifikan dengan p = 0,005 dan p = 0,001 (p < 0,05). Hal ini menunjukkan simvastatin memiliki efek yang lebih besar daripada EEBP dalam meningkatkan kadar HDL. Menurut Canaris, et al. (2000), pemberian propiltiourasil tidak memberikan efek yang bermakna dalam meningkatan kadar HDL. Menurut Dipiro (2007), Niasin (Vit B3) dapat meningkatkan kadar HDL dengan cara menurunkan aktivitas katabolisme Apo AI. Tetapi, pada biji pepaya tidak terdapat adanya kandungan niasin (Millind dan Gurditta, 2011), sehingga EEBP tidak dapat meningkatkan kadar HDL pada tikus.
4.7 Hasil Pengujian Ekstrak Etanol Biji Pepaya Terhadap Kadar LDL pada Tikus
Hasil pengujian EEBP terhadap kadar LDL pada tikus disajikan pada Tabel 4.6 dan grafik pada Gambar 4.4.
Tabel 4.6 Hasil rata-rata kadar LDL (mg/dl) serum tikus setelah perlakuan 21 hari
Tikus Kelompok Perlakuan
Kelompok 1 Kelompok 2 Kelompok 3 Kelompok 4 Kelompok 5
pada kelompok 2 sebesar 46,75 ± 9,5 mg/dl, dan paling rendah terdapat pada kelompok 4 sebesar 4,5 ± 2,0816 mg/dl.
Gambar 4.4 Diagram rata-rata kadar LDL (mg/dl) serum tikus setelah perlakuan
21 hari
*Ket : Kelompok 1 : Pakan biasa + air minum
Kelompok 2 : PTU 9 mg/kg bb + kuning telur
Kelompok 3 : PTU 9 mg/kg bb + kuning telur + Simvastatin 0,9 mg/kg bb Kelompok 4 : PTU 9 mg/kg bb + kuning telur + EEBP 200 mg/kg bb Kelompok 5 : PTU 9 mg/kg bb + kuning telur + EEBP 400 mg/kg bb
Berdasarkan uji ANOVA, kadar LDL kelompok 2 berbeda secara signifikan dengan kelompok 1 dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa pemberian propiltiourasil dan kuning telur dapat meningkatkan kadar LDL secara bermakna.
Dibandingkan antara kelompok 2 dengan kelompok 3 yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Simvastatin dapat menurunkan kadar LDL sebesar 18 - 55% (Anderson, et al., 2002).
Dibandingkan antara kelompok 2 dengan kelompok 4 dan kelompok 5 yaitu terdapat perbedaan secara signifikan dengan p = 0,000 (p < 0,05). Hal ini menunjukkan bahwa EEBP dosis 200 mg/kg bb dan 400 mg/kg bb dapat menurunkan kadar LDL pada tikus.
Dibandingkan antara kelompok 3 dengan kelompok 4 dan kelompok 5 yaitu tidak terdapat perbedaan secara signifikan dengan p = 1,000 dan p = 0,99 (p > 0,05). Hal ini menunjukkan bahwa efek penurunan kadar LDL dari simvastatin dan EEBP tidak berbeda secara bermakna.
Propiltiourasil dapat meningkatkan kadar LDL dengan cara menekan aktivitas metabolik reseptor LDL melalui inhibisi SREBP-2, yang merupakan faktor transkripsi gen dalam pembentukan reseptor LDL di hati, sehingga kadar LDL dalam darah meningkat (Rizos, et al., 2011; Guyton dan Hall, 2007). Kuning telur mampu meningkatkan kadar kolesterol, yang secara otomatis juga meningkatkan kadar LDL.
Adanya senyawa saponin dan flavonoid pada ekstrak etanol biji pepaya dapat menurunkan kadar LDL. Saponin dalam biji pepaya bekerja dengan cara mengikat asam empedu sehingga asam tersebut tetap berada di dalam usus dan proses resirkulasi ke hati (siklus enterohepatik) tidak terjadi. Akibatnya akan terjadi peningkatan penggunaan kolesterol di hati sebagai bahan baku pembuatan getah empedu sehingga cadangan kolesterol di hati menurun dengan demikian kadar LDL plasma menurun (Adeneye dan Olagunju, 2009).
menghalangi reaksi oksidasi LDL (Nijveldt, et al., 2001).
Hasil pengujian terhadap profil lipid menunjukkan bahwa dibandingkan dengan kontrol pembanding, pemberian ekstrak etanol biji pepaya dosis 200 mg/kg bb dan 400 mg/kg bb dapat menurunkan kadar kolesterol total, kadar trigliserida, dan kadar LDL secara bermakna (p < 0,05). Hanya dosis 200 mg/kgbb yang tidak memberikan perbedaan yang bermakna dengan kontrol normal. Kadar HDL tidak mengalami peningkatan pada pemberian kedua dosis ekstrak etanol biji pepaya.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian pengaruh pemberian ekstrak etanol biji pepaya
(Carica papaya L.) terhadap profil lipid pada tikus (Rattus novergicus)
dislipidemia, maka dapat disimpulkan:
a. hasil pemeriksaan karakteristik simplisia biji pepaya diperoleh kadar air 7,26%, kadar abu total 8,74%, kadar abu tidak larut asam 1,07%, kadar sari larut air 16,84%, kadar sari larut etanol 11,01%. Hasil pemeriksaan karakteristik ekstrak etanol biji pepaya diperoleh kadar air 9,95%, kadar abu total 1,62%, kadar abu tidak larut asam 0,25%, kadar sari larut air 64,26%, kadar sari larut etanol 70,85%.
b. simplisia dan ekstrak etanol biji pepaya mengandung senyawa kimia golongan alkaloid, flavonoid, tanin, saponin, glikosida, dan steroid/triterpenoid.
c. ekstrak etanol biji pepaya dapat menurunkan kadar kolesterol total dengan rata-rata 60,25 mg/dl; 54,25 mg/dl; kadar trigliserida 73 mg/dl; 54,25 mg/dl; dan kadar LDL 4,5 mg/dl; 5,25 mg/dl, tetapi tidak dapat meningkatkan kadar HDL pada tikus dislipidemia.
Dari hasil penelitian yang telah dilakukan disarankan:
a. melakukan pengujian terhadap hasil fraksionasi berdasarkan perbedaan kepolaran dan isolasi kandungan senyawa aktif biji pepaya yang berperan sebagai zat hipolipidemik.
BAB II
TINJAUAN PUSTAKA
1.1 Uraian Tumbuhan
Uraian tumbuhan meliputi sejarah tumbuhan, sistematika tumbuhan, nama daerah, morfologi tumbuhan, kandungan biji pepaya, dan manfaat tumbuhan.
2.1.1 Sejarah Tumbuhan
Pepaya merupakan tanaman yang berasal dari Amerika Tengah, yaitu daerah sekitar Meksiko bagian selatan dan Nicaragua. Negara-negara penghasil pepaya antara lain Kosta Rika, Kuba, Republik Dominika, Meksiko, Puerte Riko, dan lain-lain. Brazil, India, dan Indonesia merupakan penghasil pepaya yang cukup besar, dengan produksi mencapai 200.000 ton per tahun (Warisno, 2003).
2.1.2 Sistematika Tumbuhan
Sistematika dari tumbuhan pepaya adalah sebagai berikut Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Ordo : Cistales
Suku : Caricaceae Marga : Carica
Jenis : Carica papaya L. (Depkes RI, 2000).
2.1.3 Nama Daerah
kates (Madura). Bali: Gedang. Kalimantan: Kustela (Banjar), bua medung (Dayak Busang), buah dong (Dayak Kenya). Nusa Tenggara: Kates (Sasak), kampaya (Bima), kala jawa (Sumbawa), padu (Flores). Sulawesi: Papaya (Gorontalo), papaya (Buol), kaliki (Baree), papaya (Manado), unti jawa (Makassar), kaliki riaure (Bugis). Maluku: Papai (Buru), papaya (Halmahera), papae (Ambon), palaki (Seram), kapaya (Tidore), tapaya (Ternate). Irian: Ihwarwerah (Sarmi), siberiani (Windesi) (Depkes RI, 2000).
2.1.4 Morfologi Tumbuhan
2.1.5 Kandungan Biji Pepaya
Kandungan kimia biji pepaya antara lain benzil isotiosianat, benziltiourea, β-sitosterol, minyak pepaya (papaya oil), caricin, dan enzim mirosin (Milind dan Gurditta, 2011).
2.1.6 Manfaat Tumbuhan
Pemanfaatan tanaman pepaya cukup beragam. Daun pepaya muda, bunga, buah yang masih mentah dapat dibuat sebagai bahan berbagai ragam sayuran. Selain itu, buah pepaya, terutama yang masak mengkal, digunakan juga sebagai salah satu buah untuk rujak dan asinan. Disamping sebagai buah segar, buah pepaya dapat dibuat manisan, buah dalam sirup, saus, selai, dan sebagainya (Kalie, 1996).
Sari akar tanaman pepaya dapat digunakan sebagai obat penyakit kencing batu, penyakit saluran kencing, dan cacing kremi. Batang, daun dan buah pepaya muda mengandung getah berwarna putih. Getah ini mengandung suatu enzim pemecah protein atau enzim proteolitik yang disebut papain. Lalap daun pepaya muda yang dapat menambah nafsu makan diduga disebabkan oleh enzim ini. Sebagai enzim proteolitik, papain banyak digunakan dalam industri, diantaranya industri makanan dan minuman, farmasi, kosmetik, tekstil dan penyamak (Kalie, 1996).
antifungi (Milind dan Gurditta, 2011).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen POM, 2000).
Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan (Ditjen POM a
Berdasarkan sifatnya ekstrak dibagi menjadi:
, 1995).
a. Ekstrak encer (extractum tenue)
Ekstrak encer merupakan sediaan yang memiliki konsisten madu, dapat dituang, tetapi pada saat ini sudah tidak dipakai lagi (Voight, 1995).
b. Ekstrak kental (extractum spisscum)
Ekstrak kental merupakan sediaan yang liat dalam keadaan dingin dan tidak dapat dituang serta kandungan airnya berjumlah sampai 30% (Voight, 1995).
c. Ekstrak kering (extractum siccum)
d. Ekstrak cair (extractum fluidum)
Ekstrak cair merupakan cairan yang mengandung simplisia nabati dalam etanol sebagai bahan pelarut dan pengawet (Ditjen POM a
Ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu: , 1995).
1. Cara dingin
Ekstraksi menggunakan pelarut dengan cara dingin terdiri dari: a. Maserasi
Maserasi dapat dilakukan dengan cara mencampurkan simplisia yang telah dipotong-potong atau diserbuksarikan dengan cairan penyari dalam suatu bejana dan ditutup rapat. Simpan ditempat terlindung dari cahaya langsung selama 5 hari sambil sering dikocok. Kemudian disaring, diperas dan ampasnya dicuci dengan cairan penyari. Hasil ekstraksi disimpan ditempat sejuk selama beberapa hari, lalu cairannya dituang dan disaring (Voight, 1995).
b. Perkolasi
Perkolasi yang berarti penetesan yang dilakukan dalam wadah silindris atau kerucut (perkolator). Perkolasi dapat dilakukan dengan cara mengalirkan cairan penyari secara lambat ke dalam serbuk simplisia yang telah dibasahi. Kemudian tunggu sampai larutan ekstrak mulai menetes, lalu jalan keluar ditutup dan baru dibuka kembali jika cairan penyari berada 1-2 cm diatas simplisia (Voight, 1995).
2. Cara panas
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (kondensor) (Ditjen POM, 2000).
b. Sokletasi
Bahan yang diekstraksi berada dalam kantung ekstraksi didalam sebuah alat soklet yang bekerja kontinu, yang diletakkan diantara labu suling dan suatu pendinginan aliran balik (kondensor) dan dihubungkan melalui pipet (sippon). Labu yang berisi bahan pelarut akan terkondensasi dan menetes ke atas bahan yang terekstraksi dan menarik keluar bahan yang diekstraksi. Kemudian hasil ekstraksi akan ditampung didalam labu (Voight, 1995).
c. Digesti
Digesti merupakan proses ekstraksi simplisia dengan cara merendam serbuk simplisia dengan pelarut pada suhu 40-50 °C sambil dilakukan dalam selang waktu tertentu. Selanjutnya cairan disaring bila perlu diuapkan untuk memperoleh ekstrak kental (Voight, 1995).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur (96-98o
e. Dekokta
C) selama waktu tertentu (15-20 menit) (Voight, 1995).
2.3 Propiltiourasil
Menurut Moffat, et al., (2005), sifat fisiko kimia propiltiourasil adalah sebagai berikut.
Rumus struktur :
Gambar 2.1 Struktur Propiltiourasil
Nama kimia : 2,3-Dihydro–6–propyl–2–thioxo–4(1H) pyrimidinone Rumus kimia : C7H10N2
Berat molekul : 170,2 OS
Pemerian : Serbuk kristal putih, agak krem, atau tak berwarna, tidak berbau, rasa pahit.
Kelarutan : Larut dalam air (1:900), dalam etanol (1:60), dan dalam aseton (1:60); sedikit larut dalam klorofom dan eter; larut dalam larutan alkali hidroksida
Titik lebur : 219-221ºC.
dilihat pada Gambar 2.2.
Gambar 2.2 Efek Hormon Tiroid pada Metabolisme Lipid (Rizos, et
al., 2011)
Propiltiourasil menghambat 3-hidroksi-3-metilglutaril koenzim A (HMG-CoA) reduktase
Propiltiourasil dapat mempengaruhi metabolisme HDL melalui penurunan aktivitas cholesteryl ester transfer protein (CETP), yang menukar kolesterol ester
, yang merupakan tahap pertama pada biosintesis kolesterol.
Selain itu, propiltiourasil menghambat aktivitas sterol regulatory element-binding
protein-2 (SREBP-2) yang meregulasi ekspresi gen reseptor LDL, sehingga
dari HDL2 ke VLDL yang akhirnya akan dibawa menuju hati. Sebagai tambahan, propiltiourasil juga menghambat aktivitas lipoprotein lipase (LPL), yang mengkatabolisme lipoprotein kaya trigliserida, dan hepatic lipase (HL), yang menghidrolisis HDL2 menjadi HDL3 dan berkontribusi dalam mengkonversi IDL menjadi LDL (Rizos, et al., 2011).
2.4 Simvastatin
Menurut Moffat, et al., (2005), sifat fisiko kimia simvastatin adalah sebagai berikut.
Rumus struktur :
Gambar 2.3 Struktur Simvastatin
Nama kimia : 2,2-Dimethylbutanoic acid (1S,3R,7S,8S,8aR) 1,2,3,7,8,8a hexahydro–3,7–dimethyl–8-[2-[(2R,4R)-tetrahydro–4–hydroxy– 6–oxo–2H-pyran–2–yl]ethyl]-1–naphthalenyl ester
Rumus kimia : C25H38O Berat molekul :
5 418,6