PENGGUNAAN POLIESTER AMIDA PADA BIOPLASTIK
PROTEIN KEDELAI DARI LIMBAH PADAT
INDUSTRI TAHU DENGAN GLISEROL
SEBAGAI BAHAN PEMLASTIS
TESIS
OLEH
RENA NOVAYANTY
097022004/TK
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGGUNAAN POLIESTER AMIDA PADA BIOPLASTIK
PROTEIN KEDELAI DARI LIMBAH PADAT INDUSTRI TAHU DENGAN GLISEROL
SEBAGAI BAHAN PEMLASTIS
TESIS
Untuk memperoleh Gelar Magister Teknik Dalam Program Studi Magister Teknik Kimia Pada Sekolah Pascasarjana Universitas Sumatera Utara
OLEH
RENA NOVAYANTY 097022004/TK
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Hamidah Harahap, M.Sc
Anggota : Prof. Dr. Ir. Muhammad Turmuzi, MS
Dr. Ir. Taslim, M.Si
Dr. Halimatuddahliana, ST., M. Sc
RIWAYAT HIDUP
Nama : Rena Novayanty
Tempat/Tgl. Lahir : Medan, 29 Nopember 1982
Alamat : Jln. Nusa Indah VI LK. XX No. 75 Blok 13 Helvetia – Medan
Pendidikan
1. Tamatan SD Swasta ST. Thomas 1 Medan Tahun 1989-1995
2. Tamatan SMP Swasta ST. Thomas 1 Medan Tahun 1995-1998
3. Tamatan SMU Negeri 1 Surabaya Tahun 1998-2001
4. Tamat Sarjana pada Fakultas Teknik Jurusan Teknik Kimia, Universitas
Sumatera Utara (USU) Medan Tahun 2002-2007
Penulis menikah pada tahun 2012 dengan Junius Frans Kennedy Tampubolon, ST
ABSTRAK
Penelitian ini bertujuan untuk mengetahui karakter film bioplastik protein kedelai – gliserol dan film bioplastik protein kedelai - gliserol - poliester amida, serta perbandingan yang optimum antara protein kedelai - gliserol - poliester amida yang digunakan pada film bioplastik dari limbah padat industri tahu. Penelitian meliputi proses ekstraksi protein kedelai dari ampas tahu, pembentukan film bioplastik menggunakan metode solution casting dengan variasi gliserol dan poliester amida sebesar 10%, 15%, 30% dan 10%, 30%, 50% dari protein kedelai, kemudian dilakukan analisis dan karakterisasi. Konsentrasi gliserol optimum yang digunakan pada pembuatan film bioplastik protein kedelai – gliserol – poliester amida adalah pada presentase gliserol 15% dari protein kedelai. Hasil pengujian sifat mekanik seperti uji kekuatan tarik dan % kemuluran film bioplastik optimum pada film bioplastik protein kedelai – gliserol – poliester amida 30%, sebesar 8,886 MPa dan 170,588%. Hal ini disebabkan karena molekul komponen penyusun film bioplastik berada pada titik kesetimbangan. Perbandingan komposisi ester dan amida pada polister amida mempengaruhi kadar protein film bioplastik. Hasil uji kadar protein film bioplastik menunjukkan bahwa kadar protein film bioplastik nilainya semakin kecil dengan penambahan konsentrasi poliester amida. Hasil pengujian daya tahan panas film bioplastik protein kedelai – gliserol – poliester amida menggunakan Thermogravimetric Analysis (TGA) menunjukkan bahwa masih tersisa residu film bioplastik sebesar 24,31%. Nilai tersebut mengindikasikan bahwa film bioplastik protein kedelai – gliserol – poliester amida memiliki sifat termal dan ketahanan panas yang baik. Derajat kristalisasi poliester amida yang lebih kecil dibanding dengan derajat kristalisasi protein kedelai menyebabkan hasil uji biodegradasi film bioplastik dengan laju biodegradai tercepat terdapat pada film bioplastik protein kedelai – gliserol – poliester amida 50%. Hasil analisis permukaan dengan mikroskop pemindai elektron (SEM) menunjukkan bahwa morfologi permukaan protein kedelai memiliki struktur globular. Hasil analisis spektroskopi infra merah (FTIR) menunjukkan bahwa terdapat interaksi fisik (blending) yang dipengaruhi oleh adanya ikatan hidrogen (O-H) dari komponen protein kedelai – gliserol – poliester amida sehingga tidak ada ditemukan gugus fungsi yang baru pada film bioplastik.
ABSTRACT
The objective of the research was to find out the characteristics bio-plastic film of soy protein – glycerol and bio-plastic film of soy protein– glycerol - polyester amide, and optimum comparison of soy protein – glycerol and polyester amide which are used in bio-plastic film from solid waste of tofu industry. The research includes the process of extraction of soy protein from tofu waste, the formation of bio-plastic film by using solution casting method with the variation of glycerol and polyester amide of 10%, 15%, 30% and 10%, 30%, 50% from soy protein and they were analyzed and characterized. Optimum of glycerol concentration used in making bio-plastic film of soy protein – glycerol – polyester amide is in the glycerol percentage of 15% from soy protein. The optimum result of its mechanical characteristic testing such as tensile strength and the percentage of elongation of soy protein – glycerol – polyester amide of 30% is 8.886 MPa and 170.588%. This is because the molecule component of bio-plastic film composer is on the balance point. The comparison of ester composition and amide in polyester amide influences bio-plastic film of protein content. The testing result of bio-plastic film of protein content indicates that the value of bio-plastic of protein content is decreasing by the addition of polyester amide concentration. The testing result of thermal property of bio-plastic film of soy protein – glycerol – polyester amide, using Thermogravimetric Analysis (TGA) indicates that there is still the residue of bio-plastic film of 24.31%. This value indicates that bio-plastic film of soy protein – glycerol – polyester amide has good thermal property and heat resistance. The crystallization degree of the smaller polyester amide than the crystallization degree of soy protein has caused the biodegradation testing result of bio-plastic film with the fastest rate of biodegradation to be found in bio-plastic film of soy protein – glycerol – polyester amide of 50%. The surface result with Scan Electronic Microscope (SEM) indicates that the morphology of soy protein surface has globular structure. The Fourier Transform Infrared Spectroscopy (FTIR) analysis indicates that there is physical interaction (blending) which is influenced hydrogen bond (O-H) from component soy protein – glycerol – polyester amide so that the new functional cluster is not found in bio-plastic film.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa yang
selalu melimpahkan karunia dan rahmat-Nya sehingga penulis dapat menyelesaikan
penulisan tesis ini yang berjudul “ Penggunaan Poliester Amida Pada Bioplastik Protein Kedelai Dari Limbah Padat Industri Tahu dengan Gliserol sebagai Bahan Pemlastis “.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih yang
sebesar-besarnya kepada Ibu Dr. Ir. Hamidah Harahap, M.Sc selaku Ketua Komisi
Pembimbing dan Bapak Prof. Dr. Ir. Muhammad Turmuzi, MS selaku Anggota
Komisi Pembimbing yang telah memberikan bimbingan dan arahan dalam
penyusunan tesis ini sebagai salah satu syarat untuk menyelesaikan studi di Program
Magister Teknik Kimia Fakultas Teknik Universitas Sumatera Utara.
Penulis juga mengucapkan terima kasih kepada Bapak Dr. Ir. Taslim, M.Si
selaku Ketua Program Studi Magister Teknik Kimia, seluruh staff pengajar dan
pegawai administrasi Magister Teknik Kimia Fakultas Teknik Universitas Sumatera
Utara. Begitu pula ucapan terima kasih kepada kedua Orang tua, Mertua, Suami,
anakku Gadita, seluruh keluarga dan teman-teman di Magister Teknik Kimia, serta
semua pihak yang telah berjasa dalam kehidupan saya yang tidak dapat saya sebutkan
satu per satu. Semoga Tuhan Yang Maha Esa melimpahkan rahmat dan kasih-Nya
Akhirnya penulis mengharapkan saran dari berbagai pihak yang membaca
tesis ini sehingga dapat memberikan hasil yang baik dan maksimal dalam perbaikan
isi tesis pada masa yang akan datang.
Medan, Januari 2015
Penulis,
DAFTAR ISI
Halaman
ABSTRAK/ABSTRACT ………. i
KATA PENGANTAR ..……….. ii
DAFTAR ISI ...……….. iv
DAFTAR GAMBAR …...……… viii
DAFTAR TABEL ………... x
BAB I. PENDAHULUAN 1.1. Latar Belakang ………. 1
1.2. Perumusan Masalah ……….. 6
1.3. Tujuan Penelitian ……….... 6
1.4. Manfaat Penelitian ……….... 6
1.5. Lingkup Penelitian ……….... 7
BAB II. TINJAUAN PUSTAKA 2.1. Kedelai ...……….. 9
2.2. Protein Kedelai ...………. 10
2.3. Limbah Industri Tahu ……….………… 11
2.4.Bioplastik ………...………... 14
2.5. Metode Pembuatan Bioplastik ……….………... 18
2.7. Gliserol ………... 21
2.8. Poliester amida ……….... 23
2.9. Analisis dan Karakterisasi Bahan Polimer ……….. 25
2.9.1. Spektroskopi Infra merah Fourier-Transform (FTIR) ………….. 25
2.9.2. Pengujian Sifat Mekanis ………... 26
2.9.3. Mikroskop Pemindai Elektron (SEM) ……….. 27
2.10 Penelitian Pendahuluan Yang Pernah Dicapai ………... 27
BAB III. METODOLOGI PENELITIAN 3.1. Tempat dan Waktu ………. 30
3.2. Alat dan Bahan ………... 30
3.3. Prosedur Penelitian ………. 31
3.3.1. Penyiapan Ampas Tahu ……… 31
3.3.2. Proses Isolasi Protein Kedelai dari Ampas Tahu .……….... 31
3.3.3. Pembentukan Film Bioplastik ……….. 32
3.3.3.1. Pembentukan Film Bioplastik Protein Kedelai – Gliserol ………... 32
3.3.3.2. Pembentukan Film Bioplastik Protein Kedelai – Gliserol - Poliester Amida ……….………. 34
3.4. Diagram Alir Prosedur Penelitian ...……….. 35
3.4.1. Diagram Alir Proses Isolasi Protein Kedelai dari Ampas Tahu ... 35
3.4.2.1. Pembentukan Film Bioplastik Protein Kedelai – Gliserol
………... 36
3.4.2.2. Pembentukan Film Bioplastik Protein Kedelai – Gliserol
- Poliester Amida ………. 37
3.5. Analisis dan Karakterisasi Film Bioplastik ……….... 38
3.5.1. Pengujian Sifat Mekanik dengan Uji Kekuatan Tarik …………. 38
3.5.2. Pengujian Kadar Protein ……….. 39
3.5.3. Pengujian Daya Tahan Panas (TGA) ………... 41
3.5.4. Pengujian Biodegradasi (Masa Urai) ………... 41
3.5.5. Analisis Permukaan dengan Mikroskop Pemindai Elektron (SEM)
……….... 42
3.5.6. Analisis Spektroskopi Infra Merah (FTIR) ……….. 44
BAB IV. HASIL DAN PEMBAHASAN
4.1. Pembuatan Protein Kedelai dari Limbah Padat Industri Tahu ………… 47
4.2. Karakterisasi Serbuk Protein Kedelai ………... 47
4.2.1. Analisis FTIR ………... 47
4.2.2 Analisis Permukaan dengan Mikroskop Pemindai Elektron (SEM)
………. 49
4.3. Pembuatan Film Bioplastik Protein Kedelai – Gliserol dan Film
Bioplastik Protein Kedelai – Gliserol – Poliester Amida ……….. 50
4.3.2 Pembuatan Film Bioplastik Protein Kedelai – Gliserol – Poliester
Amida ………... 53
4.4 Karakterisasi Film Bioplastik Protein Kedelai – Gliserol – Poliester Amida ………. 54
4.4.1 Pengujian Sifat Mekanik (Uji Kekuatan Tarik) ……….. 54
4.4.2 Pengujian Kadar Protein ………. 58
4.4.3 Pengujian Daya Tahan Panas (TGA) ..………... 59
4.4.4 Pengujian Biodegradasi (Masa Urai) ……….. 62
4.4.5 Analisis Permukaan dengan Mikroskop Pemindai Elektron (SEM) ………. 65
4.4.6 Analisis Spektroskopi Infra Merah (FTIR) ……… 67
BAB V. KESIMPULAN DAN SARAN 5.1. Kesimpulan ………. 72
5.2. Saran ………... 74
DAFTAR PUSTAKA ………. 75
LAMPIRAN 1: Penentuan dan Perhitungan Kadar Protein Film Bioplastik ……… 78
LAMPIRAN 2: Perhitungan Hasil Uji Biodegradasi Film Bioplastik ……….. 81
LAMPIRAN 3: Spektra Hasil Analisis Gugus Fungsi Film Bioplastik ... 84
DAFTAR GAMBAR
Nomor Judul Halaman
2.1 Struktur Kimia Asam Amino Protein Kedelai ………... 10
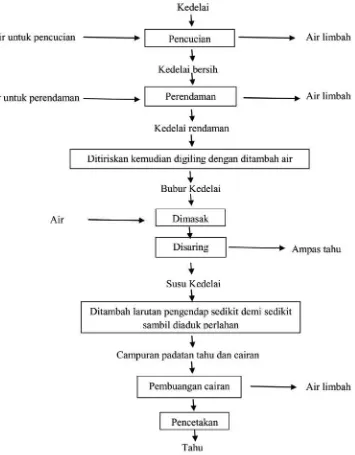
2.2 Diagram Alir Proses Pembuatan Tahu ………... 13
2.3 Rumus Struktur Gliserol ……...………. 23
2.4 Rumus Struktur Poliester amida ……… 24
3.1 Diagram Alir Proses Isolasi Protein Kedelai dari Ampas Tahu …… 35
3.2 Diagram Alir Pembentukan Film Bioplastik Protein Kedelai – Gliserol ………. 36
3.3 Diagram Alir Pembentukan Film Bioplastik Protein Kedelai – Gliserol – Poliester Amida ………... 37
3.4 Spesimen Film untuk Uji Tarik ……….. 38
3.5 Mikroskop Pemindai Elektron (SEM) Model JSM 6260 LE JOEL .. 44
3.6 Spektra FTIR Model Perkin Elmer ………... 46
4.1 Serbuk Protein Kedelai Hasil Limbah Padat Industri Tahu ………... 47
4.2 Spektra Hasil Analisis Gugus Fungsi Serbuk Protein Kedelai dari Limbah Padat Industri Tahu dengan FTIR ……..………... 48
4.3 Foto SEM Protein Kedelai dari Limbah Padat Industri Tahu …….... 49
4.4 Foto Film Bioplastik Protein Kedelai – Gliserol ………... 51
4.6 Grafik Nilai Kekuatan Tarik Film Bioplastik Protein Kedelai –
Gliserol – Poliester Amida ………. 55
4.7 Grafik Nilai % Kemuluran Film Bioplastik Protein Kedelai – Gliserol
– Poliester Amida ………... 55
4.8 Hasil Analisis TGA Film Bioplastik Protein Kedelai – Gliserol –
Poliester Amida ……….. 60
4.9 Grafik Persentase Berat Sisa Film Bioplastik selama Penguburan di
dalam Tanah ………... 64
4.10 Foto SEM Film Bioplastik dengan (a) Protein Kedelai – Gliserol 15%
(kontrol), (b) Film Bioplastik Protein Kedelai – Gliserol – Poliester
Amida 30% …………... 65
4.11 Spektra Hasil Analisis Gugus Fungsi Film Bioplastik Protein Kedelai –
Gliserol 15% (kontrol) ... 67
4.12 Spektra Hasil Analisis Gugus Fungsi Film Bioplastik dengan (a)
Protein Kedelai – Gliserol – Poliester Amida 10%, (b) Protein Kedelai
– Gliserol – Poliester Amida 30%, (c) Protein Kedelai – Gliserol –
DAFTAR TABEL
Nomor Judul Halaman
2.1 Komposisi Gizi Tiap 100 gram Berat Kedelai ………... 10
2.2 Kandungan Nilai GIzi Ampas Tahu ……….. 14
2.3 Sifat-sifat Poliester Amida ………. 24
4.1 Data Hasil Analisis FTIR Serbuk Protein Kedelai dari Ampas Tahu..48
4.2 Hasil Pengujian Sifat Mekanik Film Bioplastik Protein Kedelai –
Gliserol – Poliester Amida ………. 54
4.3 Hasil Uji Kadar Protein Film Bioplastik Protein Kedelai – Gliserol –
Poliester Amida ……….. 58
4.4 Persentase Berat Sisa Film Bioplastik Selama Penguburan di dalam
Tanah ……….. 63
4.5 Data Hasil Analisis Gugus Fungsi Film Bioplastik Protein Kedelai –
ABSTRAK
Penelitian ini bertujuan untuk mengetahui karakter film bioplastik protein kedelai – gliserol dan film bioplastik protein kedelai - gliserol - poliester amida, serta perbandingan yang optimum antara protein kedelai - gliserol - poliester amida yang digunakan pada film bioplastik dari limbah padat industri tahu. Penelitian meliputi proses ekstraksi protein kedelai dari ampas tahu, pembentukan film bioplastik menggunakan metode solution casting dengan variasi gliserol dan poliester amida sebesar 10%, 15%, 30% dan 10%, 30%, 50% dari protein kedelai, kemudian dilakukan analisis dan karakterisasi. Konsentrasi gliserol optimum yang digunakan pada pembuatan film bioplastik protein kedelai – gliserol – poliester amida adalah pada presentase gliserol 15% dari protein kedelai. Hasil pengujian sifat mekanik seperti uji kekuatan tarik dan % kemuluran film bioplastik optimum pada film bioplastik protein kedelai – gliserol – poliester amida 30%, sebesar 8,886 MPa dan 170,588%. Hal ini disebabkan karena molekul komponen penyusun film bioplastik berada pada titik kesetimbangan. Perbandingan komposisi ester dan amida pada polister amida mempengaruhi kadar protein film bioplastik. Hasil uji kadar protein film bioplastik menunjukkan bahwa kadar protein film bioplastik nilainya semakin kecil dengan penambahan konsentrasi poliester amida. Hasil pengujian daya tahan panas film bioplastik protein kedelai – gliserol – poliester amida menggunakan Thermogravimetric Analysis (TGA) menunjukkan bahwa masih tersisa residu film bioplastik sebesar 24,31%. Nilai tersebut mengindikasikan bahwa film bioplastik protein kedelai – gliserol – poliester amida memiliki sifat termal dan ketahanan panas yang baik. Derajat kristalisasi poliester amida yang lebih kecil dibanding dengan derajat kristalisasi protein kedelai menyebabkan hasil uji biodegradasi film bioplastik dengan laju biodegradai tercepat terdapat pada film bioplastik protein kedelai – gliserol – poliester amida 50%. Hasil analisis permukaan dengan mikroskop pemindai elektron (SEM) menunjukkan bahwa morfologi permukaan protein kedelai memiliki struktur globular. Hasil analisis spektroskopi infra merah (FTIR) menunjukkan bahwa terdapat interaksi fisik (blending) yang dipengaruhi oleh adanya ikatan hidrogen (O-H) dari komponen protein kedelai – gliserol – poliester amida sehingga tidak ada ditemukan gugus fungsi yang baru pada film bioplastik.
ABSTRACT
The objective of the research was to find out the characteristics bio-plastic film of soy protein – glycerol and bio-plastic film of soy protein– glycerol - polyester amide, and optimum comparison of soy protein – glycerol and polyester amide which are used in bio-plastic film from solid waste of tofu industry. The research includes the process of extraction of soy protein from tofu waste, the formation of bio-plastic film by using solution casting method with the variation of glycerol and polyester amide of 10%, 15%, 30% and 10%, 30%, 50% from soy protein and they were analyzed and characterized. Optimum of glycerol concentration used in making bio-plastic film of soy protein – glycerol – polyester amide is in the glycerol percentage of 15% from soy protein. The optimum result of its mechanical characteristic testing such as tensile strength and the percentage of elongation of soy protein – glycerol – polyester amide of 30% is 8.886 MPa and 170.588%. This is because the molecule component of bio-plastic film composer is on the balance point. The comparison of ester composition and amide in polyester amide influences bio-plastic film of protein content. The testing result of bio-plastic film of protein content indicates that the value of bio-plastic of protein content is decreasing by the addition of polyester amide concentration. The testing result of thermal property of bio-plastic film of soy protein – glycerol – polyester amide, using Thermogravimetric Analysis (TGA) indicates that there is still the residue of bio-plastic film of 24.31%. This value indicates that bio-plastic film of soy protein – glycerol – polyester amide has good thermal property and heat resistance. The crystallization degree of the smaller polyester amide than the crystallization degree of soy protein has caused the biodegradation testing result of bio-plastic film with the fastest rate of biodegradation to be found in bio-plastic film of soy protein – glycerol – polyester amide of 50%. The surface result with Scan Electronic Microscope (SEM) indicates that the morphology of soy protein surface has globular structure. The Fourier Transform Infrared Spectroscopy (FTIR) analysis indicates that there is physical interaction (blending) which is influenced hydrogen bond (O-H) from component soy protein – glycerol – polyester amide so that the new functional cluster is not found in bio-plastic film.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Salah satu masalah lingkungan yang menjadi ancaman serius bagi masa depan
namun sering terabaikan adalah masalah sampah plastik. Plastik yang biasa
digunakan merupakan polimer sintetis dengan minyak bumi sebagai bahan baku
ditambah bahan-bahan tambahan yang umumnya merupakan logam-logam berat
(kadnium, timbal, nikel) atau bahan beracun lainnya seperti klor. Racun dari plastik
ini dapat terlepas pada saat terurai atau terbakar (Sutasurya, 2006). Minyak bumi
sebagai bahan baku plastik sintetis merupakan sumber daya tak terbaharukan. Plastik
sintetis juga tidak ramah lingkungan karena tidak mudah diuraikan oleh alam baik
oleh curah hujan, panas matahari, maupun mikroba tanah. Selain itu, karena
keterbatasan bahan bakar, cadangan produk-produk hasil minyak bumi (seperti
plastik dan bahan bakar) juga menjadi terancam (Ullsten et al., 2010).
Saat ini, industri-industri material di dunia sedang mengarah pada pergantian
penggunaan material-material berbahan petrokimia menuju material-material yang
ramah lingkungan. Penggunaan plastik berbahan baku sumber daya terbaharukan dan
bersifat dapat diuraikan diperlukan untuk mengatasi masalah lingkungan yang timbul
dari penggunaan plastik sintetis (Bai et al., 2010). Bioplastik adalah plastik yang
oleh aktivitas mikroorganisme menjadi hasil akhir berupa air dan gas karbondioksida
setelah habis terpakai dan dibuang ke lingkungan tanpa meninggalkan sisa yang
beracun. Karena sifatnya yang dapat kembali ke alam, bioplastik merupakan bahan
plastik yang ramah terhadap lingkungan (Pranamuda, 2009). Salah satu bahan
bioplastik dapat bersumber dari bahan yang mengandung protein kedelai, seperti
limbah industri tahu.
Limbah industri tahu dapat menimbulkan pencemaran yang cukup berat
karena mengandung polutan organik yang cukup tinggi. Dari beberapa hasil
penelitian, konsentrasi COD (Chemical Oxygen Demand) di dalam air limbah industri
tahu cukup tinggi yakni berkisar antara 7.000 – 10.000 ppm, serta mempunyai
keasaman yang rendah yakni pH 4 - 5 (Said, 2006). Jika limbah tahu cair tidak
ditangani dengan baik, dapat mengganggu ekosistem air seperti sungai, danau, dan
laut. Selain limbah cair, industri tahu juga menghasilkan limbah padat berupa ampas
tahu. Ampas tahu merupakan limbah padat dari pengolahan kedelai menjadi tahu
yang telah dipisahkan dari bubur kedelai. Selama ini limbah padat industri tahu ini
dimanfaatkan masyarakat untuk pakan ternak, bahan baku kerupuk, dan sebagai nata
de soya. Bila ditinjau dari segi gizinya, sesungguhnya limbah padat ini merupakan
bahan yang kaya akan nutrisi, seperti protein (23,55%), lemak (5,54%), karbohidrat
(26,92%), abu (17,03%), serat kasar (16,53%), dan air (10,43%) (Kaswinarni, 2007).
Ampas tahu merupakan produk dari kedelai yang sifat proteinnya hampir
perlakuan-perlakuan tertentu selama pembuatan tahu
Protein kedelai terdiri suatu campuran dari albumin dan globulin, dimana 90%
protein yang tersimpan adalah dalam bentuk globular (Sebastian, 2012). Protein
kedelai dari ampas tahu diperoleh dengan cara melakukan suatu isolasi protein.
Menurut Sebastian (2012),
seperti pemanasan (Mahmud et
al, 1990).
isolasi protein pada prinsipnya terdiri dari tahap-tahap
seperti ekstraksi protein dalam medium pengekstrak, penghilangan bahan tidak larut
dengan sentrifuse, filtrasi, atau kombinasinya, pengendapan, pencucian, dan
pengeringan isolat.
Kinsella (1979) menambahkan kemampuan ekstraksi protein dipengaruhi oleh
beberapa faktor, antara lain ukuran partikel tepung, umur tepung, perlakuan panas
sebelumnya, rasio pelarutan, serta suhu, pH, dan kekuatan ion medium pengekstrak.
Prinsip yang digunakan untuk mengisolasi protein total adalah pengendapan seluruh
protein kacang pada titik isoelektriknya yaitu pH dimana seluruh protein
menggumpal. Pada titik isoelektriknya, muatan total masing-masing asam amino
dalam protein sama dengan not, artinya jumlah antara gugus bermuatan positif sama
dengan gugus bermuatan negatif. Interaksi elektrostatik antar asam amino akan
maksimum karena muatan yang tidak sejenis cenderung untuk tarik-menarik,
fenomena ini diamati dengan terjadinya penggumpalan protein.
Saat ini, protein kedelai telah dipertimbangkan sebagai suatu alternatif
daripada polimer sintetis turunan minyak bumi dalam pembuatan plastik. Hal ini
diinginkan, seperti ketersediaannya dari sumber pertanian yang dapat diperbaharui
dan memiliki sifat biodegradasi yang baik. Namun, plastik berbasis protein kedelai
murni juga memiliki beberapa sifat yang tidak diinginkan sebagai bahan baku
bioplastik, seperti sifat mekanik yang rendah, rapuh, dan sensitivitas plastik terhadap
air (Kurose, 2007).
Pembuatan bioplastik memerlukan campuran bahan aditif untuk mendapatkan
sifat mekanik yang lunak, ulet dan kuat. Untuk itu perlu ditambahkan suatu zat
cair/padat agar meningkatkan sifat plastisitasnya. Proses ini dikenal sebagai plastisasi,
sedang zat yang ditambahkan disebut pemlastis. Selain dapat meningkatkan elastisitas
bahan, zat pemlastis juga membuat plastik menjadi
Adapun bahan pemlastis yang digunakan adalah gliserol, karena gliserol
merupakan bahan yang murah, sumbernya mudah diperoleh, dapat diperbaharui dan
juga ramah lingkungan karena mudah terdegradasi di alam.
tahan beku dan menurunkan suhu alir,
sehingga pemlastis kadang-kadang disebut juga dengan ekastikator antibeku atau pelembut. Jelaslah
bahwa pemlastis akan mempengaruhi semua sifat fisik dan mekanik film seperti kekuatan tarik,
elastisitas, kekerasan, sifat listrik, suhu alir, suhu transisi kaca dan sebagainya.
Juliyarsi et al, (2011) melalui penelitiannya tentang pengaruh penambahan
gliserol sebagai pemlastis terhadap kualitas film berbahan whey milk. Hasilnya ada
kecenderungan penurunan aktivitas air dari film whey milk yang sebanding dengan
penambahan gliserol sebagai pemlastis yang diakibatkan oleh karakteristik hidrofilik
dari gliserol sehingga gliserol mampu terikat dengan air (Juliyarsi et al, 2011).
kopolikondensasi poliamida dan asam adipik. Poliester yang menunjukkan komponen
polar tertinggi ini memiliki kekompakan yang baik dengan produk polar lainnya,
seperti senyawa karbohidrat dan protein. Selain itu, poliester golongan ini juga
menunjukkan permeabilitas air yang paling tinggi. Ikatan rantai ester pada rantai
poliester amida menampilkan sifat biodegradasi dan ikatan rantai amida menampilkan
sifat termal dan sifat mekanik yang baik pada rantai poliester amida (Zuo, 2011).
Poliester amida banyak digunakan sebagai bahan dalam dunia biomedis, seperti
sebagai bahan pembungkus obat-obatan dan alat-alat bedah.
Pembuatan bioplastik berbasis protein kedelai dengan poliester amida sebagai
bahan pengisi belum pernah dilakukan. Oleh karena itu berdasarkan uraian di atas,
maka penulis tertarik untuk memanfaatkan limbah padat industri tahu menjadi
sumber matriks bioplastik berbasis protein, poliester amida sebagai bahan pengisi,
dan gliserol sebagai bahan pemlastis untuk mengurangi pencemaran lingkungan dan
meningkatkan nilai tambah bagi limbah padat industri tahu tersebut.
Penggunaan poliester amida sebagai pengisi bioplastik memiliki keuntungan
tersendiri karena selain sifatnya yang ramah lingkungan, poliester amida juga
memiliki sifat proses yang baik, dan aman dimetabolisme oleh tubuh manusia, serta
1.2 Perumusan Masalah
Poliester amida adalah biodegradable polyester yang sesuai untuk digunakan
dalam pembuatan bioplastik dari protein kedelai. Selain karena sifatnya yang ramah
lingkungan, biodegradable polyester ini juga memiliki kompatibilitas yang baik
antara gugus amida dan plastik protein kedelai. Hal demikian perlu diketahui
perbedaan karakter film bioplastik protein kedelai – gliserol dan film bioplastik
protein kedelai - gliserol - poliester amida serta perbandingan yang optimum antara
protein kedelai - gliserol - poliester amida yang digunakan pada film bioplastik dari
limbah padat industri tahu.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui karakter film bioplastik
protein kedelai – gliserol dan film bioplastik protein kedelai - gliserol - poliester
amida, serta perbandingan yang optimum antara protein kedelai - gliserol - poliester
amida yang digunakan pada film bioplastik dari limbah padat industri tahu.
1.4 Manfaat Penelitian
Adapun manfaat yang diperoleh dari penelitian ini bagi industri dan
masyarakat adalah:
1. Memberikan informasi untuk mengoptimalkan pemanfaatan limbah industri tahu
2. Mendorong terciptanya usaha-usaha pengendalian pencemaran dengan cara
memanfaatkan produk yang ramah lingkungan.
3. Menjadi suatu acuan dan perbandingan terhadap penelitian yang sejenis.
1.5 Lingkup Penelitian
Lingkup dari penelitian ini, iputi:
1. Bahan-bahan yang digunakan adalah:
a. Isolat protein kedelai dari limbah industri tahu sebagai bahan bioplastik
b. Larutan NaOH sebagai pengekstrak protein
c. Larutan HCl untuk mengasamkan filtrat limbah tahu
d. Gliserol sebagai bahan pemlastis
e. Poliester amida sebagai pengisi bioplastik
2. Penelitian ini dilakukan terlebih dahulu dengan proses ekstraksi protein ampas
tahu (limbah padat dari industri tahu), kemudian proses pembentukan bioplastik
dengan cara solution casting.
3. Temperatur yang digunakan pada proses isolasi protein kedelai dari ampas tahu
adalah 10 0C dan 50 0C dengan sentrifusi 4000 rpm sedangkan temperatur untuk
proses pembentukan dan pengeringn film bioplastik adalah 80 0C dan 50 0
4. Variabel penelitian adalah:
C.
a. Variabel tetap adalah protein kedelai (10 gram atau 100%)
b. Variabel tidak tetap, antara lain:
Poliester amida (10%, 30%, dan 50% dari protein kedelai)
5. Analisis dan karakterisasi film bioplastik yang dilakukan adalah:
a.
b.
Pengujian sifat mekanik dengan uji kekuatan tarik
c.
Pengujian kadar protein
Pengujian daya tahan panas dengan Thermogravimetric analysis
d.
(TGA)
e.
Pengujian biodegradasi (masa urai)
f.
Analisis permukaan dengan mikroskop pemindai elektron (SEM)
BAB II
TINJAUAN PUSTAKA
2.1 Kedelai
Kedelai adalah tanaman pangan berupa semak yang tumbuh tegak dan
termasuk Famili Leguminosa (kacang-kacangan). Berdasarkan jenisnya tanaman
kedelai terdiri atas kedelai putih/kuning, hitam, cokelat, dan hijau. Hubeis (1984)
dalam Sutanto (1998), menyatakan bahwa berdasarkan umurnya kedelai terbagi atas
kedelai berumur pendek (60-80 hari), berumur sedang (90-100 hari), dan berumur
dalam (110-120 hari). Pada tanaman kedelai biasanya yang diambil adalah bijinya.
Struktur biji kedelai terdiri atas tiga bagian utama, yaitu keping biji/kotiledon (90%),
kulit biji (8%), dan embrio/hipokotil (2%).
Nilai gizi kedelai cukup tinggi terutama kandungan proteinnya. Selain protein,
kedelai juga mempunyai kandungan lemak yang cukup tinggi, yang terdiri atas 86%
asam lemak tidak jenuh dan 40% asam lemak jenuh. Komposisi zat gizi secara
lengkap dapat dilihat pada Tabel 2.1.
Biji kedelai berkeping dan terbungkus kulit biji, dan tidak mengandung
jaringan endosperma. Embrio terletak diantara keping biji. Warna kulit biji kuning,
hitam, hijau, atau cokelat. Pusat biji adalah jaringan bekas biji yang melekat pada
Tabel 2.1 Komposisi Gizi Tiap 100 g Berat Kedelai
Protein adalah struktur makromolekul yang terdiri atas asam-asam amino
yang saling berhubungan melalui ikatan peptida. Protein kedelai terdapat dalam
jaringan kotiledon biji kedelai. Pada tingkat subseluler, protein kedelai terdistribusi di
dalam bagian-bagian sel yang disebut protein tubuh dan di sekitar sitoplasma. Sekitar
90% protein kedelai adalah globulin yang terdapat sebagai protein cadangan, sisanya
merupakan enzim-enzim intraseluler (lipoksigenase, amilase) hemaglutinin, protein
inhibitor dan lipoprotein membran (Kinsella dalam Sutanto, 1998).
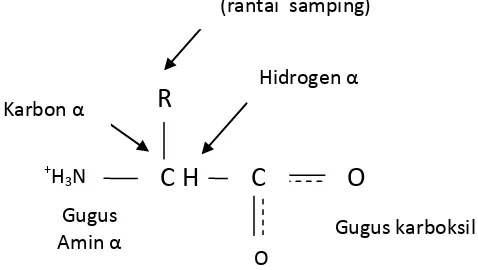
Gambar 2.1 Sruktur Kimia Asam Amino Protein Kedelai (Sutanto, 1998)
Sifat fungsional protein adalah sifat fisik dan kimia yang memungkinkan
protein menyumbang karakteristik yang diinginkan pada makanan. Sifat-sifat
fungsional protein yang dapat diklasifikasikan ke dalam tiga kelompok utama, yaitu
(1) sifat hidrasi (berhubungan dengan interaksi protein-air) seperti daya ikat air,
kebasahan, swelling, daya lekat, kekentalan, kelarutan; (2) sifat yang berhubungan
dengan interaksi protein-protein seperti pembentukan gel, dan (3) sifat-sifat
permukaan seperti emulsifikasi (Cheftel et al., 1985 dalam Sutanto, 1998). Sifat
fungsional protein ini dipengaruhi oleh faktor intrinstik, faktor lingkungan, dan
perlakuan selama proses.
Protein kedelai menjadi pilihan yang baik sebagai bahan baku film plastik
karena polimer asam amino ini berisi 20 asam amino yang pada rantai samping, rantai
akhir, atau rantai utamanya dapat menampung gugus fungsi. Gugus fungsi seperti
amida, hidroksil, dan karboksil dapat berinteraksi dengan berbagai bahan pemlastis.
2.3 Limbah Industri Tahu
Industri tahu pada umumnya dibagi menjadi dua bentuk limbah, yaitu limbah
padat dan limbah cair. Limbah padat ini berupa kotoran hasil pembersihan kedelai
(batu, tanah, kedelai, dan benda padat lain yang menempel pada kedelai) dan sisa
saringan bubur kedelai yang disebut dengan ampas tahu.
Ampas tahu merupakan hasil ikutan dari proses pembuatan tahu. Limbah
padat industri tahu meliputi ampas tahu yang diperoleh dari hasil pemisahan bubur
bisa dimanfaatkan sebagai bahan pakan ternak dan ikan. Akan tetapi kandungan air
ampas tahu yang masih tinggi merupakan penghambat sebagai pakan ternak. Salah
satu sifat dari ampas tahu ini adalah mudah tengik (basi dan tidak tahan lama) dan
menimbulkan bau busuk kalau tidak cepat dikelola. Pengeringan merupakan salah
satu jalan untuk mengatasinya. Pengeringan juga mengakibatkan berkurangnya asam
lemak bebas dan ketengikan sehingga memperpanjang umur simpan (Kaswinarni,
2007).
Ampas tahu yang terbentuk besarannya berkisar antara 25-35% dari produk
tahu yang dihasilkan. Oleh karena itu untuk menghasilkan ampas tahu tidak terlepas
dari proses pembuatan tahu (Subowo, 2001).
Dasar pembuatan tahu adalah melarutkan protein yang terkandung dalam
kedelai dengan menggunakan air sebagai pelarutnya. Setelah protein tersebut larut,
diendapkan kembali dengan penambahan bahan pengendap sampai terbentuk
gumpalan-gumpalan protein yang akan menjadi tahu. Salah satu cara pembuatan tahu
ialah dengan menyaring bubur kedelai sebelum dimasak, sehingga cairan tahu sudah
terpisah dari ampasnya (Kastyanto, 1994).
Diagram alir proses pembuatan tahu secara umum dapat dilihat pada Gambar
Komposisi limbah kedelai mengandung protein 35% bahkan pada varietas unggul
kadar proteinnya dapat mencapai 40-43%. Dibandingkan dengan beras, jagung, tepung
singkong, kacang hijau, daging, ikan segar, dan telur ayam, kedelai mempunyai kandungan
protein yang lebih tinggi, hampir menyamai kadar protein susu skim kering (Radiaty, 1992).
Kandungan nilai gizi yang masih terdapat dalam 100 gram ampas tahu secara rinci dapat
dilihat pada Tabel 2.2 di bawah ini.
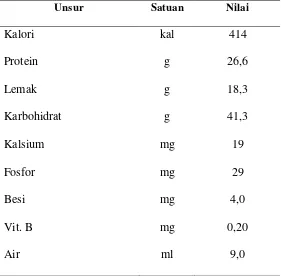
Tabel 2.2 Kandungan Nilai Gizi Ampas Tahu
Unsur Satuan Nilai
Kalori kal 414
Protein g 26,6
Lemak g 18,3
Karbohidrat g 41,3
Kalsium mg 19
Fosfor mg 29
Besi mg 4,0
Vit. B mg 0,20
Air ml 9,0
(Sumber: Kaswinarni, 2007 )
2.4 Bioplastik
Bioplastik adalah suatu bentuk plastik yang berasal atau bersumber dari
tumbuhan, misalnya berasal dari minyak rami, minyak kacang kedelai, atau pati.
Plastik ini mempunyai sifat biodegradable (Wikipedia, 2006). Menurut Pranamuda
(2009), bioplastik adalah plastik yang dapat digunakan layaknya seperti plastik
konvensional, namun akan hancur terurai oleh aktivitas mikroorganisme menjadi
lingkungan tanpa meninggalkan sisa yang beracun.
Menurut Adam dan Clark (2009), bioplastik adalah polimer yang dapat berubah
menjadi biomassa, H2O, CO2 dan atau CH4 melalui tahapan depolimerisasi dan mineralisasi. Depolimerisasi terjadi karena kerja enzim ekstraseluler (terdiri dari endoenzim dan
eksoenzim). Endoenzim memutuskan ikatan internal pada rantai utama polimer secara acak,
dan eksoenzim memutuskan unit monomer pada rantai utama secara berurutan.
Bagian-bagian polimer yang terbentuk ini dipindahkan ke dalam sel dan mengalami mineralisasi.
Proses mineralisasi membentuk CO2, CH4, N2
Berdasarkan bahan baku yang dipakai, bioplastik dikelompokkan menjadi dua
kelompok, yaitu kelompok dengan bahan baku petrokimia (non-renewable resources) dengan
bahan aditif dari senyawa bio-aktif yang bersifat biodegradabel, dan kelompok kedua adalah
dengan keseluruhan bahan baku dari sumber daya alam terbarukan (renewable resources)
seperti dari bahan tanaman pati dan selulosa serta hewan seperti cangkang atau dari
mikroorganisme yang dimanfaatkan untuk mengakumulasi plastik yang berasal dari sumber
tertentu seperti lumpur aktif atau limbah cair yang kaya akan bahan- bahan organik sebagai
sumber makanan bagi mikroorganisme tersebut (Adam dan Clark, 2009).
, air, garam-garam, mineral, dan biomassa.
Definisi polimer bioplastik dan hasil akhir yang terbentuk dapat beragam tergantung pada
polimer, organisme, dan lingkungan.
Polimer bioplastik dapat dikategorikan ke dalam tiga jenis (Evans, 2010)
a.
, yaitu:
Chemically synthesised polymers, misalnya polyglycolic acid, polylactic acid,
poly (caprolactone), polyvinyl alcohol, polyethylene oxide. Jenis ini sangat rentan
terhadap serangan enzim atau mikroba sehingga tidak dapat digunakan secara
b.
c.
Starch-based bioplastic polymers. Pada jenis ini, pati (tepung halus dari
singkong/kentang/ubi) ditambahkan sebagai bahan untuk produksi campuran
plastik, misalnya starch-polyethylene. Tujuannya agar mikroba dalam tanah dapat
mendegradasi pati dengan mudah sehingga dapat menguraikan plastik ini secara
signifikan dalam waktu yang relatif cepat. Akan tetapi, beberapa jenis plastik
lainnya dapat terdegradasi sebagian (tergantung kondisi tanah). Beberapa fragmen
yang tertinggal setelah penghilangan pati tertinggal di lingkungan dalam waktu
yang lama.
Polyhydroxyalkanoates (PHAs), yaitu polimer terdiri atas 2 sampai 6 hydroxy
acids, yang diproduksi sebagai granula intraselular oleh banyak jenis bakteri. Ini
sangat berpotensi sebagai plastik terbaharukan dan seratus persen bioplastik.
Polimer ini dapat digunakan secara komersial untuk menggantikan penggunaan
plastik konvensional.
Averous (2008) dalam Fibhumika (2009), mengelompokkan polimer
bioplastik ke dalam dua kelompok dan empat keluarga berbeda. Kelompok utama
adalah: (1) agro-polimer yang terdiri dari polisakarida, protein dan sebagainya; dan
(2) biopoliester (bioplastik poliester) seperti poli asam laktat (PLA),
polyhydroxyalkanoate (PHA), aromatik and alifatik kopoliester. Biopolimer yang
tergolong agro-polimer adalah produk-produk biomassa yang diperoleh dari
bahan-bahan pertanian.
Kelompok lain biopoliester yang diperoleh dari aplikasi bioteknologi, yaitu
Contoh polilaktida adalah poli asam laktat (PLA). Kelompok terakhir biopoliester
yang lain juga ada yang diperoleh dengan sintesis secara konvensional dari
monomer-monomernya. Kelompok ini terdiri dari polycaprolactones (PCL), polyesteramides
(PEA), aliphatic co-polyesters dan aromatic co-polyesters.
Menurut laporan Pranamuda (2009) dalam penelitiannya, menyatakan bahwa saat ini
polimer bioplastik yang telah diproduksi adalah kebanyakan dari polimer jenis poliester
alifatik. Bioplastik yang sudah diproduksi skala industri, antara lain:
a. Poli (ε-kaprolakton) (PCL) : PCL adalah polimer hasil sintesa kimia menggunakan
bahan baku minyak bumi. PCL mempunyai sifat biodegradabilitas yang tinggi, dapat
dihidrolisa oleh enzim lipase dan esterase yang tersebar luas pada tanaman, hewan
dan mikroorganisme. Namun titik lelehnya yang rendah, Tm = 60 0
b. Poli (ß-hidroksi butirat) (PHB) : PHB adalah poliester yang diproduksi sebagai
cadangan makanan oleh mikroorganisme seperti Alcaligenes (Ralstonia) eutrophus,
Bacillus megaterium dsb. PHB mempunyai titik leleh yang tinggi (Tm = 180 C, menyebabkan
bidang aplikasi PCL menjadi terbatas (Awaliyyah RF, 2008; Pranamuda, 2009).
0
c. Poli (butilena suksinat) (PBS): PBS mempunyai titik leleh yang setara dengan plastik
konvensional polietilen, yaitu Tm = 113
C),
tetapi karena kristalinitasnya yang tinggi menyebabkan sifat mekanik dari PHB
kurang baik (Ping, 2006).
0
d. Poli asam laktat (PLA) : PLA merupakan poliester yang dapat diproduksi
menggunakan bahan baku sumber daya alam terbarui seperti pati dan selulosa
0C, dan dapat dibuat menjadi lembaran film yang transparan (Kurniawan RA, 2010;
Pranamuda, 2009).
2.5 Metode Pembuatan Bioplastik
Kemampuan suatu bahan dasar dalam pembuatan film plastik dapat
diterangkan melalui fenomena fase transisi gelas. Pada fase tertentu di antar fase cair
dengan padat, massa dapat dicetak atau dibentuk menjadi suatu bentuk tertentu pada
suhu dan kondisi lingkungan tertentu. Fase transisi gelas biasanya terjadi pada bahan
polimer. Sedangkan suhu dimana fase transisi gelas terjadi disebut sebagai titik fase
gelas (glassy point). Pada suhu tersebut bahan padat dapat dicetak menjadi suatu
bentuk yang dikehendaki, misalnya bentuk lembaran tipis (film) kemasan.
Istilah plastik meliputi produk hasil proses polimerisasi baik yang sintesis
maupun semisintesis. Plastik dapat dibentuk menjadi suatu objek, film, ataupun serat
(Anonim, 2006). Menurut Allcock dan Lampe (1981), film plastik dapat dibuat
melalui dua teknik dasar yang berbeda, yaitu solution casting atau molten polymer.
Pada pembuatan film plastik dengan teknik solution casting, bahan polimer dilarutkan
ke dalam pelarut yang cocok untuk menghasilkan larutan yang viskos. Larutan yang
dihasilkan dituang pada suatu permukaan yang rata (cetakan) yang bersifat non-adesif
dan pelarut dibiarkan menguap sampai habit. Film plastik yang sudah kering
kemudian diangkat dari cetakannya. Teknik molten polymer dilakukan dengan cara
pemanasan polimer sampai di atas titik lelehnya (Allcock dan Lampe, 1981).
pilihan yang cepat dan mudah untuk dilakukan pada skala laboratorium. Pemilihan
jenis pelarut yang cocok dengan bahan polimer menjadi faktor penting yang perlu
diperhatikan.
Teknik solution casting dilakukan dengan membuat larutan polimer 20% (b/v)
untuk menghasilkan larutan dengan viskositas yang sesuai. Pengadukan diperlukan
untuk mempercepat kelarutan, misalnya pengadukan dengan strirrer (Allcock dan
Lampe, 1981). Allcock dan Lampe (1981) menambahkan bahwa apabila larutan
polimer perlu disaring sebelum proses casting, maka dapat dilakukan penyaringan
vakum karena larutan terlalu viskos. Pada skala laboratorium, proses solution casting
dapat dilakukan pada plat kaca atau cawan gelas.
2.6
Menurut Wu dan Bates (1972) dalam Sutanto (1998), mekanisme
pembentukan film protein terjadi karena polimerisasi endotermik dan denaturasi
protein akibat pemanasan yang diikuti dehidrasi permukaan. Mekanisme polimerisasi
melibatkan molekul disulfida dan ikatan hidrofobik. Pemanasan menyebabkan
struktur tiga dimensi protein antara sulfhidril dan rantai sisi hidrofobik sehingga
rantai protein yang tidak melipat akan saling mendekat satu dengan yang lainnya dan
saling berhubungan lewat ikatan disulfida dan hidrofobik (Fukushima dan Van
Burren, 1970 dalam Sutanto, 1998).
Mekanisme Pembentukan Film
Menurut (Cheflet et al, 1985 dalam Sutanto, 1998) denaturasi protein adalah
peptida yang ada pada struktur primernya. Selama denaturasi rantai protein akan
terbuka sehingga memungkinkan pembentukan jaringan matriks baru yang lebih
kompak dan dapat berinteraksi dengan komponen lain. Pada saat larutan dipastikan
telah homogen, poliester amida ditambahkan yang berfungsi untuk mengatasi sifat
rapuh film. Dengan adanya penambahan poliester amida, maka gugus hidrogen dari
poliester amida akan berikatan dengan gugus amida dari protein sehingga kekuatan
intermolekuler antar rantai protein akan berkurang dan mobilitas polimer akan
meningkat sehingga fleksibilitas akan meningkat pula (Sutanto, 1998).
Struktur film merupakan matriks protein yang dibentuk oleh
interaksi-interaksi protein yang dikatalisis oleh panas dengan ikatan disulfida, hidrogen, dan
hidrofobik sebagai kekuatan asosiasi dalam jaringan film (Famum et al, 1976 dalam
Sutanto, 1998). Ikatan disulfida terbentuk melalui pertukaran ion disulfida dan reaksi
oksidasi ion yang diindikasi oleh adanya panas. Ikatan ini akan membentuk struktur
tiga dimensi. lkatan hidrogen berperan dalam peningkatan viskositas dan stabilisasi
struktur gel, sedangkan ikatan hidrofobik berperan dalam pengerasan struktur gel dan
2.7 Gliserol
Billmeyer (1994) dalam Sutanto (1998) menambahkan bahwa jika suatu
polimer semikristalin mendapat tambahan
Menurut Hammer (1978) dalam Sutanto (1998), bahan pemlastis adalah bahan
kimia yang dapat digunakan untuk mengurangi kekakuan resin termoplastik. Prinsip
kerja bahan pemlastis adalah dengan membentuk interaksi molekuler rantai polimer
untuk meningkatkan kecepatan respon viskoelastis pada polimer. Hal ini akan
meningkatkan mobilitas molekuler rantai polimer dan akibatnya dapat menurunkan
substransisi kaca (Tg).
bahan pemlastis maka akan terjadi
penurunan titik lebur (Tm) dan derajat bahan pemlastis akan lebih banyak berinteraksi
dengan fase amorf dan sangat sedikit yang berinteraksi dengan fase kristalin.
Efektivitas penambahan bahan pemlastis dapat dilihat melalui beberapa parameter
semi empiris, seperti penurunan suhu transisi kaca dan titik leleh, karakteristik
mekanik, serta kondisi molekuler.
Menurut Syarief (1989), untuk memperbaiki sifat plastik maka ditambahkan
berbagai jenis tambahan atau aditif. Bahan tambahan ini sengaja ditambahkan dan
berupa komponen bukan plastik yang diantaranya berfungsi sebagai bahan pemlastis,
penstabil pangan, pewama, penyerap UV, dan lain-lain. Bahan itu dapat berupa
senyawa organik maupun anorganik yang biasanya mempunyai berat molekul rendah.
Bahan pemlastis merupakan bahan tambahan yang diberikan pada waktu
proses untuk meningkatkan beberapa sifat dari polimer, misalnya ketahanan terhadap
pemlastis adalah bahan non-volatil dengan titik didih tinggi yang apabila
ditambahkan ke dalam bahan lain akan merubah sifat fisik dan atau sifat mekanik dari
bahan tersebut (Krochta, et.a1, 1994). Bahan pemlastis ditambahkan untuk
mengurangi gaya intermolekul antar partikel penyusun pati yang menyebabkan
terbentuknya tekstur edible film yang mudah patah (getas). Bahan pemlastis juga
meningkatkan gaya intermolekuler dan meningkatkan mobilitas ikatan polimer
sehingga memperbaiki fleksibilitas dan extensibilitas film.
Sedangkan bahan pemlastis yang umum digunakan dalam pembuatan plastik
bioplastik adalah gliserol karena ketersediaan gliserol melimpah di alam dan sifatnya
yang tidak merusak alam. Gliserol atau biasa disebut gliserin merupakan suatu larutan
kental tidak berwama dan mempunyai rasa yang manis. Jika direaksikan dengan air
dan alkohol menyebabkan rasa dingin pada kulit. Gliserol dapat dihasilkan dari
minyak sawit (CPO, BPO, dan RPDPO), minyak inti sawit (PKO), dan minyak
kelapa (CNO). Dalam pengolahan minyak (trigliserida) selain menghasilkan gliserol
juga akan menghasilkan asam lemak yang juga dapat diolah menjadi beberapa macam
produk seperti asam laurat, asam kaprat, dan asam stearat (Guerrero, dkk., 2010).
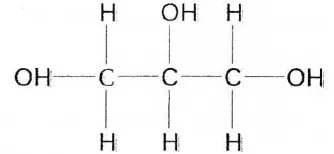
Gliserol merupakan suatu trihidroksi alkohol yang terdiri atas tiga atom
karbon. Jadi, tiap atom karbon mempunyai gugus -OH. Gliserol merupakan suatu
molekul bidrofilik yang relative kecil dan mudah di sisipkan diantara rantai protein
dan membentuk ikatan hidrogen dengan gugus dan protein gluten. Hal ini berakibat
pada penurunan interaksi langsung dan kedekatan antara rantai protein. Selain itu,
seiring dengan peningkatan kadar gliserol dalam film akibat dari penurunan kerapatan
jenis protein (Gontard, 2009).
Gliserol efektif digunakan sebagai bahan pemlastis pada film hidrofilik,
seperti pektin, pati, gel dan modifikasi pati, maupun pembuatan edible film berbasis
protein (Juliyarsi et al, 2011).
Gambar 2.3 Rumus Struktur Gliserol
2.8 Poliester Amida
Sejumlah besar biodegradable polyester yang berasal dari minyak bumi
diperoleh secara kimiawi dari monomer-monomer sintesisnya. Biodegradable
polyester ini dapat dibedakan berdasarkan struktur kimianya, seperti
policaprolactones, poliester amida, kopoliester alifatis maupun kopoliester aromatis.
Semua poliester ini lembut pada temperatur kamar.
Poliester amida diperoleh secara industri dari monomer-monomer
kopolikondensasi poliamida dan asam adipic. Poliester yang menunjukkan komponen
polar tertinggi memiliki kekompakan yang baik dengan produk polar lainnya, seperti
senyawa-senyawa karbohidrat. Selain itu, poliester golongan ini juga menunjukkan
permeabilitas air yang paling tinggi.
kompatibilitasnya yang baik antara gugus amida dan plastik protein kedelai.
Pencampuran protein kedelai dengan biodegradable polyester bertujuan untuk
meningkatkan kekuatan plastik bioplastik dari kedelai.
R
C 1 C NH R2 NH C R1 C O R3
O
Dan, beberapa sifat fisika dan mekanik dari poliester amida dapat dilihat pada
Tabel 2.3 di bawah ini :
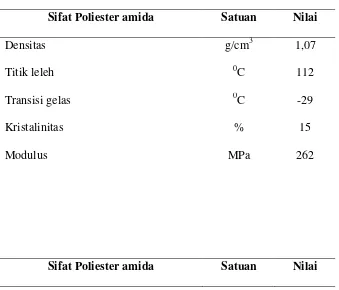
Sifat Poliester amida Satuan Nilai
Densitas g/cm3 1,07
Titik leleh 0C 112
Transisi gelas 0C -29
Kristalinitas % 15
Modulus MPa 262
Sifat Poliester amida Satuan Nilai
O O
O O
Elongation at break % 420
Kekuatan tarik MPa 17
Biodegradasi/mineralisasi * % 100
Permeabilitas air pada 250C g/m2/hari 680
Tegangan permukaan mN/m 59
(*) Selama 60 hari dalam pengkontrolan berdasarkan ASTM 5336
2.9 Analisis dan Karakterisasi Bahan Polimer
2.9.1 Spektroskopi Infra merah Fourier-Transform (FTIR)
Serapan radiasi infra merah oleh suatu molekul terjadi karena interaksi vibrasi
ikatan kimia yang menyebabkan perubahan polarisabilitas dengan medan listrik
gelombang elektromagnetik. Ada dua jenis vibrasi ikatan kimia yang dapat menyerap
radiasi infra merah, yakni vibrasi longitudinal dan vibrasi sudut.
Molekul polimer dikenal dengan karakteristik rantai yang terdiri dari sejumlah
satuan-ulangan (sampai 102 - 105 unit per rantai). Secara teori spektrum inframerah
bahan polimer akan tergantung dari karakteristik spektrum dan struktur kimia satuan
ulangannya. Akan tetapi, berbeda dengan senyawa bobot molekul rendah yang murni,
struktur satuan-ulangan dalam rantai polimer tidak selamanya identik. Ditambah lagi
perubahan susunan geometris, perubahan orientasi ikatan dan bentuk kristal akan
mempengaruhi serapan inframerah oleh kimia satuan-ulangan. Karena itu dapat
diduga bahwa polimer dengan bobot molekul tinggi yang terdiri dari 103-106 atom
per molekul akan memberikan sejumlah besar pita serapan.
Pada dasarnya, teknik FTIR adalah sama dengan spektroskopi inframerah
biasa, kecuali dilengkapi dengan cara penghitungan Fourier Transform dan
pengolahan data untuk mendapatkan resolusi dan kepekaan yang lebih tinggi.
2.9.2 Pengujian Sifat Mekanis
Penggunaan bahan polimer sebagai bahan teknik misalnya dalam industri
suku cadang mesin, konstruksi bangunan dan transportasi, tergantung sifat
mekanisnya, yaitu gabungan antara kekuatan yang tinggi dan elastisitas yang baik.
Sifat mekanis yang khas ini disebabkan oleh adanya dua macam ikatan dalam bahan
polimer, yakni ikatan kimia yang kuat antara atom dan interaksi antara rantai polimer
yang lebih lemah.
Sifat mekanis biasanya dipelajari dengan mengamati sifat kekuatan tarik (σ)
menggunakan alat pengukur tensometer atau dinamometer, bila terhadap bahan
diberikan tegangan. Secara praktis, kekuatan-tarik diartikan sebagai besarnya beban
maksimum (Fmaks) yang dibutuhkan untuk memutuskan spesimen bahan, dibagi
dengan luas penampang bahan. Karena selama di bawah pengaruh tegangan,
spesimen mengaiami perubahan bentuk (deformasi) maka definisi kekuatan tarik
dinyatakan dengan luas penampang semula (A0 ). Kekuatan tarik suatu bahan dapat
0
/A Fmaks
t =
σ
SEM berbeda dengan mikroskopi elektron transmisi (TEM), dalam hal ini suatu
berkas insiden elektron yang sangat halus di-scan menyilangi permukaan sampel dalam
sinkronisasi dengan berkas tersebut dalam tabung sinar katoda. Elektron-elektron yang
terhambur digunakan untuk memproduksi sinyal yang memodulasi berkas dalam tabung sinar
katoda, yang memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan
yang hampir tiga dimensi.
2.9.3 Mikroskop Pemindai Elektron (SEM)
Dalam penelitian morfologi permukaan SEM terbatas pemakaiannya, tetapi
memberikan informasi yang bermanfaat mengenai topologi permukaan dengan resolusi
sekitar 100 A. Aplikasi-aplikasi yang khas mencakup penelitian dispersidispersi pigmen
dalam cat, pelepuhan atau peretakan koting, batas-batas fasa dalam polipaduan yang tak dapat
campur, struktur sel busa-busa polimer, dan kerusakan pada bahan perekat. SEM teristimewa
berharga dalam mengevaluasi betapa penanaman (implant) bedah polimerik bereaksi baik
2.10 Penelitian Pendahuluan Yang Pernah Dicapai
Penelitian yang menyangkut penggunaan protein kedelai sebagai bahan dasar
bioplastik yang pernah dilakukan diantaranya, Sutanto (1998) melakukan
pencampuran antara protein bungkil kedelai dengan karboksi metil selulosa (CMC),
metil selulosa (MC), lilin lebah dan bahan pemlastis polietilen glikol (PEG).
Penambahan lilin lebah adalah untuk meningkatkan barrier uap air dari film berbasis
polisakarida dan protein, sedangkan penambahan bahan pemlastis adalah untuk
mengatasi sifat rapuh film. Bungkil kedelai diambil ekstrak proteinnya dengan
beberapa tahap, yaitu penggilingan dan perendaman pada suhu 65 0C selama satu jam, dilanjutkan dengan penirisan selama 20 menit, penghancuran dengan blender,
pemasakan dengan suhu 90-95 0
Kristanoko (1996) juga melakukan penelitian terhadap pengaruh penambahan
CMC dan sorbitol terhadap karakteristik fisik edible film dari ekstraksi bungkil
kedelai. Konsentrasi CMC yang diteliti 0,75; 100; dan 1,25 g/ 45 ml ekstrak protein
bungkil kedelai. Sedangkan sorbitol yang ditambahkan 2 dan 3 ml/ 45 ml ekstrak C selama 10 menit, penyaringan, lalu sentrifusi. Dari
hasil penelitian tersebut disimpulkan bahwa dengan peningkatan konsentrasi PEG,
maka kuat tarik akan menurun, sedangkan permeabilitas uap air, permeabilitas
oksigen, persen pemanjangan, dan ketebalan akan meningkat. Dengan peningkatan
konsentrasi lilin lebah, maka kuat tarik, permeabilitas uap air, dan oksigen akan
menurun sedangkan ketebalan dan persen pemanjangan akan meningkat. Dari segi
penampakan, semakin tinggi jumlah lilin lebah, maka film akan semakin kurang
protein bungkil kedelai. Konsentrasi ekstrak protein bungkil kedelai adalah 3%.
Film yang dihasilkan untuk beberapa karakteristik fisik tertentu sangat
dipengaruhi oleh konsentrasi CMC dan sorbitol yang ditambahkan. CMC
meningkatkan kadar air, ketebalan, kuat tarik, persen pemanjangan, laju transmisi uap
air (WVTR). Sedangkan kadar protein film menjadi turun. Sorbitol memberikan
pengaruh yang berbeda. Sorbitol meningkatkan kadar air, kadar protein, ketebalan,
persen pemanjangan, dan laju transmisi uap air, tetapi kuat tarik film semakin
menurun.
Bai et al. (2010) melakukan penelitian tentang efek dari salicylic acid
terhadap sifat mekanis dan ketahanan air dari film isolat protein kedelai. Film
komposit protein kedelai (SF) disiapkan dengan menggunakan isolat protein kedelai
(SPI), salicylic acid (SA), dan gliserol sebagai bahan pemlastisnya. Sedangkan untuk
menyiapkan film komposit protein kedelai tahan air (SF-B), maka digunakan 2,
2-diphenyl-2-hydroxyethanoic acid (DPHEAc). Sejumlah SA yang berbeda (0,25; 0,5;
0,75 w/w) dicampur hingga merata dengan tepung SPI dan gliserol (30% dari berat
SPI) menggunakan mixer selama 15 menit, kemudian dipress menggunakan hot press
pada suhu 140 0C dan tekanan 20 MPa selama 10 menit. Hasil penelitian tersebut menunjukkan bahwa film SF-B dengan 0,5% (wt) SA memiliki kekuatan tarik dan
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian ini secara keseluruhan dilakukan di Laboratorium Kimia Polimer,
Laboratorium Kimia Organik, Laboratorium Biokimia, dan Laboratorium Terpadu yang
berlokasi di Fakultas Matematika dan Ilmu Pengetahuan Alam, serta di Laboratorium Polimer
Teknik Kimia, Universitas Sumatera Utara.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini, adalah erlenmeyer, beaker glass,
gelas ukur, batang pengaduk kaca, neraca analitik, oven, hot plate, kain saring, kertas
saring, penyaring vakum, corong kaca, tabung sentrifusi, labu alas, desikator,
magnetic styrer, seperangkat alat Kjeldahl, termometer, alumunium foil, ayakan 40
mesh, Universal Testing Machine (UTM) GOTECH Al-7000M Grid Tensile, dan
spektra FTIR model Perkin Elmer.
Adapun bahan yang digunakan dalam pembuatan plastik bioplastik ini adalah
limbah ampas tahu, aquades, NaOH 2N, HCl 2 N, gliserol, poliester amida (PEA),
H2SO4 (pekat), selenium, H3BO3, HCl 0,1 N, cairan indikator Tashiro, dan kertas
3.3 Prosedur Penelitian
Ampas tahu diperoleh dari industri pembuatan tahu berupa butiran halus yang
masih mengandung kadar air yang tinggi. Menurut Bian et al, (2003), ampas tahu
basah sangat mudah rusak bila dibiarkan terlalu lama di udara terbuka. Oleh sebab itu
ampas tahu yang digunakan pada penelitian ini adalah ampas tahu kering.
3.3.1 Penyiapan Ampas Tahu
Ampas tahu kemudian diperas, dikeringkan di dalam oven pada suhu 50 0
C
selama 24 jam, dan dihaluskan menggunakan ayakan 40 mesh agar tahan lebih lama
dan juga terpisah dari kotoran dan kontaminan lainnya (Bian et al, 2003).
Isolasi protein ini dilakukan dengan menggunakan metode Koswara (1992).
Ampas tahu yang telah disaring dengan ayakan 40 mesh dimasukkan ke dalam beaker
glass kemudian ditambahkan aquades dengan perbandingan ampas tahu dan aquades
sebesar 1 : 2. Pada penelitian ini setiap percobaan isolasi protein sampel (ampas tahu)
diambil sebanyak 500 gram. Setelah itu dilakukan ekstraksi protein dengan
menggunakan larutan NaOH 2 N dan pH 10 selama satu jam. Kemudian hasil
ekstraksi tersebut disaring dengan menggunakan penyaringan vakum sebanyak dua
kali proses penyaringan. Penyaringan I dilakukan dengan menggunakan kain saring
yang pori-porinya lebih besar. Kemudian penyaringan II dilakukan dengan
menggunakan kertas saring.
Dari hasil penyaringan, diperoleh residu dan protein terekstrak. Residu yang
diperoleh berupa kotoran (abu) maupun senyawa-senyawa lain yang tidak diinginkan
(seperti lemak dan karbohidrat). Selanjutnya, protein yang terekstrak tersebut
diendapkan dengan menggunakan larutan HCl 2 N sampai diperoleh larutan pH
protein terekstrak sebesar pH 4,5 dan disimpan di dalam lemari pendingin pada suhu
10 0C selama 15 jam. Selajutnya larutan protein terekstrak tersebut disentrifuse
dengan kecepatan 4000 rpm selama 10 menit. Dari proses entrifuse tersebut diperoleh
endapan protein dan whey. Endapan protein tersebut kemudian dicuci dengan
aquades. Setelah itu, endapan protein yang bercampur aquades disentrifuse lagi
dengan kecepatan 4000 rpm selama 10 menit. Dari hasil sentrifusi yang kedua ini
diperoleh endapan protein yang sudah tercuci dan selanjutnya endapan protein
tersebut dikeringkan di dalam oven pada suhu 50 0C selama 24 jam. Hasil proses
isolasi protein dari ampas tahu ini disebut dengan kosentrat protein.
3.3.3 Pembentukan Film Bioplastik
3.3.3.1. Pembentukan Film Bioplastik Protein Kedelai – Gliserol (Sebastian, 2012)
Pada dasarnya, ada dua teknologi pembuatan film bioplastik berbasis protein
(Cuq et al, 1998) yaitu: proses basah (wet process) dan proses kering (dry process).
Suatu proses basah (wet process) yang lebih dikenal dengan solution casting
merupakan suatu teknologi pembuatan film bioplastik berdasarkan penyebaran atau
merupakan teknologi pembuatan film bioplastik berdasarkan pada sifat-sifat
termoplastik protein, yang sering lebih dikenal dengan teknik ekstrusi (hot pressing
atau compression moulding). Pada penelitian ini, film bioplastik dibuat dengan proses
basah (solutioncasting).
Film bioplastik protein kedelai – gliserol dibuat dengan menambahkan 10
gram protein kedelai ke dalam 100 mL aquades dimana pH diatur sampai 10 dengan
penambahan NaOH 2,0 N. Lalu secara perlahan dimasukkan 1,0 gram gliserol (10 %
dari bahan baku protein kedelai) ke dalam larutan protein kedelai tersebut. Kemudian
campuran dipanaskan sambil diaduk hingga suhu 80 0
Film protein kedelai – gliserol yang telah terbentuk disimpan di dalam
desikator pada suhu kamar. Selanjutnya film protein kedelai - gliserol yang telah
kering dilepas dari permukaan cetakan secara perlahan-lahan untuk dilakukan
pengujian sifat dan karakterisasinya. Langkah-langkah percobaan di atas diulang
untuk variasi berat gliserol sebanyak 1,5 g dan 3 g.
C selama 30 menit hingga
campuran merata dan mengental. Lalu hasilnya dicetak di atas plat kaca berukuran 30
x 30 cm yang telah dilapisi kertas aluminium foil, kemudian dikeringkan di dalam
oven pada suhu 50 °C selama 24 jam.
Pada penelitian ini, film bioplastik protein kedelai – gliserol yang dipakai
sebagai kontrol untuk pembentukan film bioplastik – gliserol – poliester amida adalah
film bioplastik protein – kedelai dengan variasi gliserol yang optimum dari
3.3.3.2. Pembentukan Film Bioplastik Protein Kedelai - Gliserol - Poliester Amida (Sebastian, 2012)
Film bioplastik protein kedelai – gliserol – poliester amida (PEA) disiapkan
dengan menambahkan 10 gram protein kedelai ke dalam 100 ml aquades dimana pH
diatur sampai 10 dengan penambahan NaOH 2,0 N. Setelah itu, secara perlahan-lahan
ditambahkan gliserol sebanyak 1 gram (10% dari bahan baku protein kedelai) dan
poliester amida sebanyak 1 gram (10% dari SPI). Lalu, campuran dipanaskan pada
suhu 80 °C selama 30 menit sambil diaduk dengan magnetic styrer sampai campuran
merata dan mengental. Setelah mengental, campuran tersebut dituang di atas kaca
berukuran 30 x 30 cm yang dilapisi aluminum foil untuk membentuk film yang
seragam. Dan selanjutnya, film bioplastik protein kedelai – gliserol – poliester amida
(PEA) kemudian dikeringkan pada suhu 50 °C selama 24 jam di dalam oven.
Film bioplastik protein kedelai – gliserol – poliester amida (PEA) yang telah
terbentuk disimpan di dalam desikator pada suhu kamar. Selanjutnya film bioplastik
protein kedelai – gliserol – poliester amida (PEA) yang telah kering dilepas dari
permukaan cetakan secara perlahan-lahan untuk dilakukan pengujian sifat dan
karakterisasinya. Langkah-langkah percobaan di atas diulang untuk variasi berat
poliester amida sebanyak 3 g dan 5 g atau sebanyak 10%, 30%, dan 50% dari protein
kedelai. Sehingga dari hasil pengujian dan karakterisasi film bioplastik protein
kedelai dengan menggunakan perbandingan gliserol sebagai bahan pemlastis dan
pengisi poliester amida yang optimum, diperoleh film bioplastik protein kedelai –
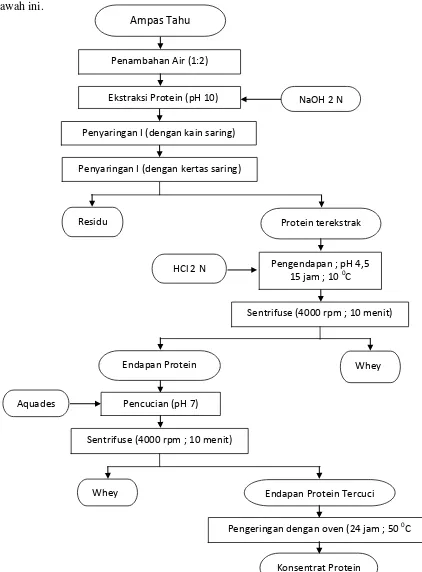
3.4.1 Diagram Alir Proses Isolasi Protein Kedelai dari Ampas Tahu 3.4 Diagram Alir Prosedur Penelitian
Proses isolasi protein kedelai dari ampas tahu dapat dilihat pada Gambar 3.1
di bawah ini.
Pengendapan ; pH 4,5 15 jam ; 10 0C
Sentrifuse (4000 rpm ; 10 menit)
Pencucian (pH 7) Ampas Tahu
Penyaringan I (dengan kain saring) Ekstraksi Protein (pH 10)
Penambahan Air (1:2)
NaOH 2 N
Penyaringan I (dengan kertas saring)
Protein terekstrak Residu
HCl 2 N
Endapan Protein Whey
Aquades
Sentrifuse (4000 rpm ; 10 menit)
Endapan Protein Tercuci Whey
3.4.2 Diagram Alir Pembentukan Film Bioplastik
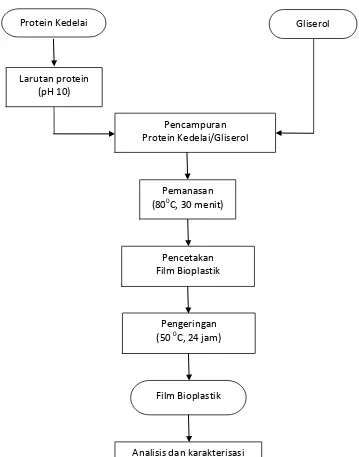
3.4.2.1. Pembentukan Film Bioplastik Protein Kedelai – Gliserol
Pada tahap berikutnya setelah proses isolasi protein kedelai dari ampas tahu
adalah pembentukan film bioplastik. Gambar 3.2 di bawah ini menjelaskan
bagaimana proses pembentukan film bioplastik protein kedelai – gliserol.
Gliserol
Pencampuran Protein Kedelai/Gliserol
Pencetakan Film Bioplastik
Pengeringan (50 0C, 24 jam)
Film Bioplastik Pemanasan (800C, 30 menit) Larutan protein
(pH 10) Protein Kedelai
3.4.2.2 Pembentukan Film Bioplastik Protein Kedelai – Gliserol – Poliester Amida
Proses pembentukan film bioplastik protein kedelai – gliserol – poliester
amida dijelaskan pada Gambar 3.3 di bawah ini.
Gambar 3.3 Diagram Alir Pembentukan Film Bioplastik Protein Kedelai – Gliserol – Poliester Amida
Pencampuran
Protein Kedelai/Gliserol/Poliester Amida
Pencetakan Film Bioplastik
Pengeringan (50 0C, 24 jam)
Film Bioplastik Larutan protein
(pH 10)
Protein Kedelai Gliserol
Poliester Amida
Pemanasan Campuran (800C, 30 menit, pH 10)
3.5 Analisis dan Karakterisasi Film Bioplastik
g.
Analisis dan karakterisasi film bioplastik dilakukan untuk mengetahui apakah
plastik yang dihasilkan telah memenuhi syarat yang ditentukan untuk suatu
penggunaan tertentu, jenis pengujian yang dilakukan adalah :
h.
Pengujian sifat mekanik dengan uji kekuatan tarik
i.
Pengujian kadar protein
j.
Pengujian daya tahan panas (TGA)
k.
Pengujian biodegradasi (masa urai)
l.
Analisis permukaan dengan mikroskop elektron payaran (SEM)
Analisis spektroskopi infra merah (FTIR)
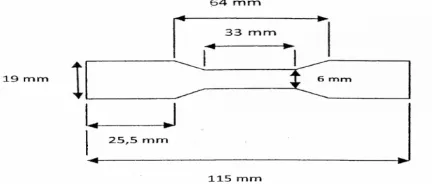
Pengujian sifat mekanis dalam penelitian ini menggunakan alat Universal
Testing Machine Gotech Al-7000M Grid Tensile dengan beban 2000 kgf dan
kecepatan 25 mm/menit. Spesimen film bioplastik dipotong dengan ketebalan di
bawah 1 mm (0,1 – 0,2 mm) sesuai dengan standar ASTM D 882-91, yaitu standar
untuk uji kemuluran dan kekuatan tarik plastik pelapis tipis dan film bioplastik.
Gambar 3.4 menampilkan ukuran spesimen film untuk uji tarik pada penelitian ini.