STUDI PERBANYAKAN
IN VITRO
TANAMAN
NENAS (
Ananas comosus
L. Merr.) DAN ANALISIS
KESTABILAN GENETIK BERDASARKAN
KARAKTER MORFOLOGI, ISOZIM DAN RAPD
FATIMAH NURSANDI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
STUDI PERBANYAKAN
IN VITRO
TANAMAN
NENAS (
Ananas comosus
L. Merr.) DAN ANALISIS
KESTABILAN GENETIK BERDASARKAN
KARAKTER MORFOLOGI, ISOZIM DAN RAPD
FATIMAH NURSANDI
DISERTASI
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Departemen Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
© Hak cipta milik Fatimah Nursandi, tahun 2006 Hak cipta dilindungi
ABSTRAK
FATIMAH NURSANDI. Studi Perbanyakan In Vitro Tanaman Nenas (Ananas
comosus L. Merr.) dan Analisis Kestabilan Genetik Berdasarkan Karakter
Morfologi, Isozim dan RAPD. Dibimbing oleh ROEDHY POERWANTO, SOBIR, SRIANI SUJIPRIHATI, AGUS PURWITO.
Upaya perbanyakan in vitro pada tanaman nenas dilakukan untuk
mendapatkan bibit dalam jumlah banyak, seragam, dan cepat serta untuk mendukung program pemuliaan tanaman karena perbanyakan alami sangat lambat dan hanya menghasilkan sedikit bibit. Variasi somaklonal sering muncul pada
perbanyakan in vitro tanaman pisang dan kelapa sawit. Evaluasi variasi
somaklonal dengan mengkombinasikan beberapa karakter perlu dilakukan untuk menilai protokol regenerasi in vitro dan kestabilan genetik tanaman regeneran. Tujuan penelitian adalah: (1) mempelajari dan menganalisis pengaruh TDZ, IAA dan NAA terhadap multiplikasi, dan keseragaman keragaan di lapangan pada nenas kultivar Queen, (2) mempelajari dan menganalisis pengaruh BAP dan frekuensi subkultur terhadap multiplikasi, kualitas buah dan kestabilan genetik pada nenas kultivar Queen dan (3) mempelajari dan menganalisis pengaruh BAP dan TDZ serta teknik etiolasi terhadap multiplikasi pada nenas kultivar Smooth Cayenne.
Hasil penelitia n menunjukkan TDZ dapat menginduksi kalus nodul, tunas dan kalus, tunas dan akar nenas kultivar Queen bergantung pada konsentrasi yang digunakan. Penambahan 0,23-0,46 µM TDZ menghasilkan 56-65 tunas/eksplan selama 31 minggu. Tanaman regeneran di lapangan menunjukkan tinggi tanaman, diameter tajuk, panjang dan lebar daun tidak berbeda. Variasi yang muncul di lapangan adalah tanaman roset (1,59%), variegata (0,36%) dan
tanaman kecil dan kaku (2,16%). Penambahan BAP 8,88 µM pada SK 1
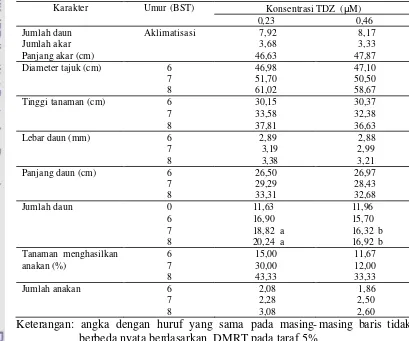
menghasilkan 26,3 tunas/eksplan selama 11 minggu. Tanaman regeneran hasil perlakuan 4,44 µM BAP menunjukkan pertumbuhan vegetatif dan kualitas buah yang lebih baik serta varian yang muncul rendah (1,53%) walaupun tingkat multiplikasi lebih rendah dibandingkan perlakuan 8,88 µM BAP. Pertumbuhan vegetatif dan kualitas buah kecuali bobot mahkota buah seragam untuk masing-masing perlakuan BAP. Tanaman regeneran normal yang berasal dari perlakuan BAP 2,22-17,76 µM secara genetik stabil berdasarkan analisis isozim: PER, EST, ADH dan MDH dan analisis RAPD dengan primer OPE 7 dan OPG 2. Tanaman variegata yang berbeda secara morfologi dengan tanaman normal menghasilkan pita monomorfik berdasarkan analisis RAPD dengan primer OPG 2 tetapi dengan primer OPE 7 me nghasilkan 33 % pita polimorfik.
ABSTRACT
FATIMAH NURSANDI. Study on In Vitro Propagation of Pineapple (Ananas
comosus L. Merr.)and Genetic Stability Analysis Based on Morphological,
Isozyme, and RAPD Markers. Supervised by ROEDHY POERWANTO, SOBIR, SRIANI SUJIPRIHATI, AGUS PURWITO.
An In vitro propagation experiment in pineapple was carried out to obtain uniform, large planting materials and support the plant breeding program where the conventional propagations have limitation in terms of small number propagules produced and take long time. In vitro propagation in several fruit plants generally produced somaclonal variations. The evaluation of somaclonal variations in pineapple using a combination of several markers is needed to esthablish an in vitro regeneration protocol and assess the genetic stability of the resulted regenerants. The objectives of the research are to 1) determine the effect of TDZ, IAA and NAA on multiplication rate and field performance in pineapple cv. Queen, 2) elaborate the effect of BAP and subculture frequency on multiplication rate, fruit quality, and genetic stability in cv. Queen, 3) study the effect of BAP, TDZ, and etiolation technique on multiplication rate in cv. Smooth Cayenne.
Results revealed that TDZ significantly induced shoots, nodule calli or roots of the explants depent on its concentration. Shoot explants grown on MS media supplemented with 0.23-0.46 µM TDZ produced 56 to 65 shoots per explant within 31 weeks period. Field evaluation of the TDZ-treated regenerants showed no difference in plant hight, width and length of the leaves. TDZ treatments generated three different variants: variegated (0.36%), rosset (1.59%), and dwarf (2.16%) plants. Supplemented with 4.44 µM BAP produced 26.3 shoots per explant within 11 weeks period. The explants treated with 4.44 µM BAP produced vigorous regenerants and good quality of fruit as well as lower level of variance (1.53%). The Bartlett test indicated that the variance of the vegetatif growth and fruit quality of the regenerants was not significantly different. Normal plants produced on media with 2.22- 17.76 µM BAP in the field showed genetic stability as verified using PER, EST, ADH and MDH isozymes analysis and RAPD technique on dan OPG 2 primers. The leaves of the resulted variegated plants showed a different level of chimeras. RAPD analysis with OPG 2 primer in variegated plants produced monomorphic bands, whereas with OPE 7 resulted in approximately 33% polimorphic bands.
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Studi Perbanyakan
in Vitro Tanaman Nenas (Ananas comosus L. Merr.) dan Analisis Kestabilan
Genetik Berdasarkan Karakter Morfologi, Isozim dan RAPD adalah karya
saya sendiri, dengan pembimbingan para Komisi Pembimbing dan belum diajukan
dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di
bagian akhir disertasi ini.
Bogor, Januari 2006
Judul Disertasi : Studi Perbanyakan In Vitro Tanaman Nenas (Ananas comosus L. Merr.) dan Analisis Kestabilan Genetik Berdasarkan
Karakter Morfologi, Isozim dan RAPD Nama : Fatimah Nursandi
NRP : P 03600013 Departemen : Agronomi
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Roedhy Poerwanto, M.Sc. Dr. Ir. Sobir, M.S.
Ketua Anggota
Dr. Ir. Sriani Sujiprihati, M.S. Dr. Ir. Agus Purwito, M.Sc.
Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak bulan Juli 2002 sampai Maret 2005 adalah
perbanyakan in vitro dengan judul Studi Perbanyakan in vitro Tanaman Nenas
(Ananas comosus L. Merr.) dan Analisis Kestabilan Genetik Berdasarkan
Karakter Morfologi, Isozim dan RAPD.
Sebagian dari isi Disertasi ini telah dipublikasikan pada Tropika (2005),
diseminarkan pada Simposium Nasional dan Kongres Peragi VIII pada tanggal
8-10 Juli 2003 di Universitas Bandar Lampung. Juga telah diseminarkan pada
Simposium Nasional dan Kongres PERIPI pada tanggal 25-26 Agustus 2005 di
Universitas Jenderal Soedirman.
Penulis menyampaikan ucapan terima kasih dan penghargaan kepada
Prof. Dr. Ir. Roedhy Poerwanto, M.Sc., Dr. Ir. Sobir, M.S., Dr. Ir. Sriani
Sujiprihati, M.S., Dr. Ir. Agus Purwito, M.Sc., selaku komisi pembimbing yang
telah memberikan kepercayaan dan bimbingan selama penelitian sampai
penyusunan disertasi. Penulis juga mengucapkan terima kasih kepada
Dr. Ir. Nurul Humaida, M.S., Prof. Dr. Ir. Nurhayati Ansori Mattjik, M.S., Dr. Ir.
Ahmad Dimyati, M.S. dan Dr. Ir. Darda Efendi, M.Sc. selaku penguji luar
komisi atas masukan dan sumbangan literatur yang diberikan demi
kesempurnaan disertasi ini. Penulis juga mengucapkan terima kepada Dr. Ir.
Satriyas Ilyas, M.S. selaku ketua program studi agronomi dan seluruh dosen
PS Agronomi yang selalu memberikan pelayanan yang baik dan menyenangkan
serta dukungan. Prof. Dr. Ir. Bambang S. Purwoko, M.S. dan Prof. Dr. Ir.
Sudarsono, M.Sc. yang telah memberikan saran selama penyusunan disertasi.
Penelitian ini didukung oleh dana Riset Unggulan Strategis Nasional
(Rusnas) Pusat Kajian Buah-buahan Tropika (PKBT). Untuk itu penulis
mengucapkan terima kasih kepada Kementerian Negara Riset dan Teknologi dan
PKBT yang telah memberikan dana dan fasilitas laboratorium selama penelitian.
Penulis juga mengucapkan terima kasih dan penghargaan kepada Rektor
Universitas Muhammadiyah Malang yang telah memberikan kesempatan untuk
Penulis mengucapkan banyak terima kasih kepada Ibu Kasutjianingati,
Teti Herawati, Eries, Siska, Yuni, Bapak Noto, Bapak Ilyas Marzuki, yang banyak
membantu penulis selama penelitian. Juga kepada Mbak Eri, Ike, Riris, Mas
Kusuma, Bapak Ibram, Bapak Sulaeman, Ibu Yuyun, Miranti, Murtini, Galuh, Cut
Nyak atas semua bantuan yang diberikan.
Ucapan terima kasih penulis sampaikan kepada Bapak dan Ibu serta Ibu
Mertua (almarhumah) yang senantiasa berdoa untuk kelancaran studi penulis, Dik
Mida, Dik Diah sekeluarga, Mas Teguh sekeluarga, Dik Imam sekeluarga yang
selalu memberikan dorongan semangat dan doa. Kepada suami tercinta
Drs. Untung Santoso, M.Si., saya mengucapkan banyak terima kasih karena telah
memberikan kesempatan, kepercayaan, dorongan, doa, perhatian serta kasih
sayang sampai disertasi ini terselesaikan. Hidup adalah perjuangan, nikmatilah
pilihan kita dengan ikhlas dan niat ibadah. Kepada ananda Hanief Ariefman Sani
(12 tahun), Afif Mahardika Sani (8 tahun), Dinda Fajria Sani (5 tahun) dan
Andika Rahman Sani (4 tahun), mama mengucapkan terima kasih karena kalian
adalah penyemangat mama untuk menyelesaikan studi ini. Penulis juga
mengucapkan terima kasih kepada semua pihak yang telah membantu dengan
tulus, semoga Allah SWT membalas dengan pahala yang dilipatgandakan.
Akhir kata, mudah- mudahan Disertasi ini bermanfaat bagi pihak yang
memerlukan dan pengembangan ilmu pengetahuan, dan semoga Allah SWT
senantiasa melimpahkan Rahmat dan hidayah-Nya kepada kita semua. Amin.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Banyuwangi pada tanggal 29 Januari 1966 sebagai
anak sulung dari pasangan H. Abdul Rachman dan H. Maslaha. Penulis menikah
dengan Drs. Untung Santoso, M.Si dan dikaruniai 4 anak (Hanief Ariefman
Sani, Afif Mahardika Sani, Dinda Fajria Sani dan Andika Rahman Sani).
Pendidikan sarjana ditempuh di Program Studi Ilmu dan Teknologi Benih,
Fakultas Pertanian IPB, lulus tahun 1990. Pada tahun 1994, penulis diterima di
Program Studi Agronomi pada Program Pascasarjana IPB dan menamatkannya
pada tahun 1997. Kesempatan untuk melanjutkan ke Program Doktor pada
program studi dan perguruan tinggi yang sama diperoleh pada tahun 2001.
Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan
Nasional Republik Indonesia.
Penulis bekerja sebagai staf pengajar di Fakultas Pertanian universitas
Muhammadiyah Malang sejak 1991 sampai sekarang. Pada tahun 1998-2001
penulis menjadi kepala Pusat Bioteknologi Pertanian Universitas muhammadiyah
Malang.
Selama mengikuti program S3, penulis menyajikan karya ilmiah berjudul
(1) Perbanyakan In Vitro Nenas (Ananas comosus L. Merr) dengan
Menggunakan BAP dan TDZ pada Simposium Nasional dan Kongres PERAGI
VIII di Lampung pada bulan Juli 2003, (Lampiran 1) (2) Studi Pertumbuhan
Tanaman Nenas (Ananas comosus L. Merr) Kultivar Queen Hasil In Vitro
dan Analisis Kestabilan Genetik Berdasarkan Karakter Morfologi dan
RAPD pada Simposium Nasional dan Kongres PERIPI di Purwokerto pada
bulan Agustus 2005 (Lampiran 2). Sebuah artikel telah diterbitkan dengan judul
Perbanyakan Tanaman Nenas (Ananas comosus (L) Merr) cv. Smooth
Cayenne dengan Teknik Etiolasi Secara In Vitro pada jurnal Tropika (2005)
Universitas Muhammadiyah Malang (Lampiran 3). Karya-karya ilmiah tersebut
DAFTAR ISI
Halaman
DAFTAR TABEL ……… xiii
DAFTAR GAMBAR ………. xv
DAFTAR LAMPIRAN ………. xvii
DAFTAR SINGKATAN ……….. xviii
1 PENDAHULUAN Latar Belakang ……….. 1
Perumusan Masalah ……….. 4
Tujuan Penelitian ……….. 8
Manfaat Penelitian ……… 8
2 TINJAUAN PUSTAKA Tanaman Nenas ………. 9
Kultivar Nenas ………. 10
Perbanyakan Nenas ……….. 12
Perbanyakan In Vitro ……… 14
Zat Pengatur Tumbuh ………... 16
Kestabilan Genetik dalam Perbanyakan In Vitro ………. 17
Deteksi Variasi Somaklonal ……… 19
3 PENGARUH TDZ, IAA DAN NAA TERHADAP MULTIPLIKASI DAN KESERAGAMAN KERAGAAN TANAMAN NENAS KULTIVAR QUEEN DI LAPANGAN Pendahuluan ………...……… 22
Bahan dan Metode ………. 24
Hasil dan Pembahasan ………... 28
Hasil ……… 28
Pembahasan ……….. 40
Kesimpulan Dan Saran ………...………... 43
4 PENGARUH BAP DAN FREKUENSI SUBKULTUR TERHADAP MULTIPLIKASI, KUALITAS BUAH DAN KESTABILAN GENETIK TANAMAN NENAS KULTIVAR QUEEN Pendahuluan ………...……… 44
Bahan dan Metode ………. 46
Hasil dan Pembahasan ………... 55
Hasil ……… 55
Pembahasan ……….. 73
5 PENGARUH BAP DAN TDZ SERTA TEKNIK ETIOLASI DALAM
PERBANYAKAN IN VITRO TANAMAN NENAS KULTIVAR
SMOOTH CAYENNE
Pendahuluan ………...…….. 80
Bahan dan Metode ………... 82
Hasil dan Pembahasan ………. 85
Hasil ……….. 85
Pembahasan ……… 93
Kesimpulan Dan Saran ………..………. 98
6 PEMBAHASAN UMUM ………... 99
Peran Sitokinin dalam Perbanyakan In Vitro ……….. 99
Variasi Somaklonal pada Perbanyakan In Vitro ……….. 103
7 KESIMPULAN ………... 106
DAFTAR PUSTAKA ………... 108
DAFTAR TABEL
Halaman
1 Karakter fenotipe 5 kultivar nenas (Leal dan Soule, 1977 dalam
Nakasone dan Paull, 1999) ………. 11
2 Pengaruh TDZ terhadap bobot kalus nodular, eksplan bertunas dan jumlah tunas/eksplan nenas kultivar Queen umur 16 MST ……….. 30
3 Pengaruh TDZ terhadap jumlah tunas nenas dalam media MS0 dan media akar ………... 31
4 Pengaruh TDZ terhadap peubah pada saat aklimatisasi dan di
lapangan ……… 32
5 Variasi tanaman di lapangan pada umur 8 bulan hasil perbanyakan
in vitro denga n TDZ ……… 34
6 Pengaruh interaksi TDZ, IAA dan NAA terhadap eksplan berakar
(%) pada tahap induksi ………... 37
7 Pengaruh interaksi TDZ, IAA dan NAA terhadap jumlah akar pada tahap induksi umur 15 MST …………..……… 37
8 Pengaruh interaksi TDZ dan auksin terhadap bobot kalus nodular dan jumlah tunas pada tahap multiplikasi dalam media MS0 …..……. 40
9 Bahan-bahan kimia larutan penyangga dalam analisis isozim ………. 51
10 Jumlah tunas dalam media BAP SK 1 dan media akar ….………….. 57
11 Pengaruh BAP SK 1 terhadap jumlah daun , jumlah akar, panjang
akar dan tunas berakar ………..……. 58
12 Pengaruh BAP SK 1 terhadap tanaman menghasilkan anakan dan
jumlah anakan per tanaman ………… ……….. 59
13 Variasi tanaman nenas asal perbanyakan in vitro SK 1 pada 33 MST
di lapangan ………. 61
14 Pengaruh BAP terhadap beberapa karakter pada fase generatif tanaman nenas umur 15 bulan ……… 62
15 Rekapitulasi nilai karakter morfologi dan kualitas buah tanaman hasil
perbanyakan in vitro SK 1 ……… 62
17 Pengaruh BAP SK 2 pada media akar terhadap jumlah tunas umur
10 MST ………..………... 68
18 Pengaruh BAP pada SK 2 terhadap peubah vegetatif di lapangan .. 70
19 Variasi pada tanaman SK 2 di lapangan umur 27 MST ………..….. 70
20 Pengaruh BAP pada SK 3 terhadap jumlah tunas dan bobot kalus
nodular pada umur 16 MST ………..………. 71
21 Pengaruh BAP pada SK 3 terhadap jumlah tunas dalam media akar
umur 0 dan 14 MST ……… 71
22 Pengaruh BAP pada SK 3 terhadap jumlah anakan per tanaman … 73
23 Variasi pada tanaman regeneran SK 3 di lapangan umur 25 MST …. 73
24 Pengaruh BAP terhadap jumlah tunas dan kalus nodular saat SK tanaman nenas kultivar Smooth Cayenne klon Subang …….……… 86
25 Pengaruh BAP terhadap jumlah tunas pada saat aklimatisasi dari media pengakaran ………. 86
26 Pengaruh TDZ SK 1 terhadap jumlah tunas dan bobot kalus nodular
tanaman nenas kultivar Smooth Cayenne klon Subang …….……… 87
27 Pengaruh TDZ SK 2 terhadap jumlah tunas dan bobot kalus nodular
tanaman nenas kultivar Smooth Cayenne klon Subang ………. 87
28 Pengaruh TDZ SK 2 dalam media MS0 terhadap jumlah tunas dan
bobot kalus nodular kultivar Smooth Cayenne klon Subang ……… 87
29 Pengaruh TDZ + NAA SK 1 terhadap jumlah tunas dan bobot kalus nodular tanaman nenas kultivar Smooth Cayenne klon Subang …… 88
30 Pengaruh TDZ + NAA SK 2 terhadap jumlah tunas dan bobot kalus nodular tanaman nenas kultivar Smooth Cayenne klon Subang …… 88
31 Pengaruh TDZ+NAA SK 2 dalam media MS0 II terhadap jumlah tunas dan bobot kalus nodular kultivar Smooth Cayenne klon Subang 88
32 Pengaruh NAA dan GA3 terhadap eksplan bertunas tidak berakar dan bertunas berakar pada umur 7 MST ... 91
33 Pengaruh NAA terhadap diameter batang pada umur 7 MST ... 91
DAFTAR GAMBAR
Halaman
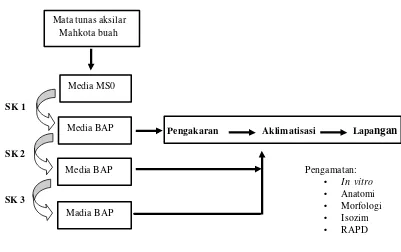
1 Kerangka studi perbanyakan in vitro tanaman nenas dan analisis
kestabilan genetik ……… 5
2 Alur pelaksanaan penelitian ……….…….. 7
3 Bagian vegetatif tanaman nenas yang dipergunakan sebagai bahan perbanyakan tanaman ………….……… 13
4 Bahan tanam mahkota buah nenas (A) dan tunas dalam media MS0 umur 4 MST (B) ……….……… 25
5 Alur kegiatan multiplikasi dengan TDZ ……….. 26
6 Alur kegiatan multiplikasi dengan TDZ, IAA dan NAA …….……… 28
7 Eksplan membentuk kalus nodular dalam media TDZ (µM) umur 14 MST ……….……… 29
8 Jaringan meristematik yang terbent uk dengan perlakuan TDZ …..… 30
9 Eksplan mengalami nekrosis dalam media MS0 I (A), regenerasi tunas dalam media MS0 II ………... 31
10 Variasi tanaman regeneran di lapangan ………..….. 33
11 Perkembangan eksplan pada tahap induksi dalam media TDZ …….. 35
12 Pengaruh TDZ terhadap eksplan bertunas (A) dan jumlah tunas (B) dalam media induksi ……… 35
13 Pengaruh TDZ terhadap eksplan berkalus nodular (A) dan bobot kalus nodular (B) pada tahap induksi ……… 36
14 Pengaruh TDZ terhadap tunas aksilar (A) dan tunas total (B) pada tahap multiplikasi dalam media MS0 ……… 38
15 Pengaruh TDZ pada tahap multiplikasi eksplan tunas dalam media MS0 ………. 39
16 Pengaruh TDZ pada tahap multiplikasi dengan eksplan kalus nodular pada MS0 ………. 39
17 Alur kegiatan perbanyakan in vitro nenas kultivar Queen ………….. 47 18 Daun tanaman normal (A) dan daun tanaman variegata (B) untuk
19 Tunas yang tumbuh dalam media BAP SK 1 ……… 56
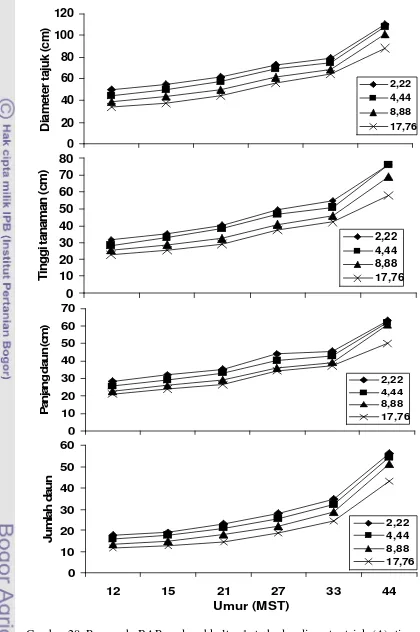
20 Pengaruh BAP subkultur 1 terhadap diameter tajuk (A), tinggi
tanaman (B), panjang daun (C) dan jumlah daun (D) di lapangan … 60
21 Tanaman variegata fase generatif (A), anakan yang dihasilkan tanaman variegata ………. 61
22 Buah berukuran tidak normal (A,B,C) dan buah berukuran normal (D) 63
23 Berbagai bentuk mahkota buah tidak normal ……… 63
24 Pola pita isozim ADH, EST, PER, MDH ……….. 65
25 Pola pita berdasarkan RAPD dengan primer OPE 7 dan OPG 2 ….. 66
26 Pengaruh BAP terhadap eksplan berkalus nodular pada SK 2 umur 12 MST ……….. 67
27 Pengaruh BAP SK 2 terhadap jumlah daun (A), jumlah akar (B) dan panjang akar (C) saat aklimatisasi ……….…….… 69
28 Pengaruh BAP subkultur 3 terhadap diameter tajuk (A), tinggi
tanaman (B), panjang daun (C) dan lebar daun (D) di lapangan …… 72
29 Alur kegiatan penelitian nenas kultivar Smooth Cayenne ………… 82
30 Induksi tunas etiola si nenas klon Subang pada 0, 4, 8 MST ……….. 89
31 Pengaruh NAA (A) dan GA3 (B) terhadap eksplan bertunas ... 90
32 Pengaruh NAA (A) dan GA (B) terhadap jumlah buku ... 90
33 Pertumbuhan dan perkembangan tunas etiolasi dalam media BAP ... 92
DAFTAR LAMPIRAN
Halaman
1 Makalah yang disampaikan pada Simposium Nasional dan
Kongres PERAGI VIII di Lampung pada bulan Juli 2003 ………….. 118
2 Makalah yang disampaikan pada Simposium Nasional dan Kongres
PERIPI di Purwokerto pada bulan Agustus 2005 ……….. 127
3 Artikel yang diterbitkan di jurnal Tropika 2005 Universitas
Muhammadiyah Malang ……….. 136
DAFTAR SINGKATAN
AAT : enzim aspartat amino transferase ACP : enzim acid phosphatase
ADH : enzim alcohol dehydrogenase
Aklimatisasi : penyesuaian fisiologi suatu organisme hidup terhadap perubahan keadaan lingkungan
Amplifikasi : proses penggandaan molekul DNA
Aneuploid : tanaman yang mempunyai jumlah kromosom yang bukan kelipatan dari kromosom dasarnya
BAP : benzyl amino purine, sitokinin turunan purin BSA : bulan setelah aklimatisasi
BST : bulan setelah tanam
Buffer ekstrak : buffer yang digunakan dalam analisis isozim, membantu menghancurkan sel
Buffer elektroda : buffer yang digunakan merendam kaki cetakan tray pada proses elektroforesis isozim
Buffer gel : buffer yang digunakan untuk melarutkan pati kentang dalam analisis isozim
Buku : bagian pada batang yang mengeluarkan satu atau lebih daun
CBP : cytokinin-binding protein adalah reseptor sitokinin CDK : cytokinin dependent-kinase, enzim yang terlibat dalam
siklus sel
CTAB : cetyl triethylammonium bromide
Denaturasi : proses pemisahan DNA dari ikatan ganda menjadi ikatan tunggal
DNA : deoxyribonucleic acid, merupakan bahan genetik dNTP : deoxynucleotide triphosphates (umumnya dalam bentuk
campuran dATP, dCTP, dTTP, dGTP) EDTA : ethylene diaminetetracetic acid
Elektroforesis : teknik pemisahan molekul berdasarkan gerakan yang berbeda pada medan listrik
Epigenetik : segala sesuatu yang berhubungan dengan interaksi faktor-faktor genetik
EST : enzim esterase
EtBr : ethidium bromide
Etiolasi : keadaan yang tidak normal dari semai atau tanaman yang kekurangan sinar matahari.
GA : giberelic acid
Gap : salah satu tahap dalam siklus sel G1/S : tahap transisi antara gap 1 dan sintesis G2/M : tahap transisi antara gap 2 dan mitosis
Gel pati : pati kentang khusus yang digunakan dalam analisis isozim HST : hari setelah tanam
IAA : indol acetic acid
Isozim : kelompok enzim yang mempunyai bentuk molekul atau struktur berbeda tetapi mempunyai efek katalitik yang sama
Loading dye : pemberat dan pada saat elektroforesis
Mata tunas : suatu titik tumbuh pada batang/cabang yang akan menjadi tunas
MDH : malate dehydrogenase
Media : suatu bahan yang mengandung zat makanan dengan komposisi tertentu sebagai tempat tumbuh kultur jaringan tanaman/jasad renik, bakteri, jamur
Meristem : jaringan yang sel-selnya belum berfungsi khusus dan masih aktif membelah untuk membentuk sel baru; jaringan tanaman yang terdiri dari sel-sel hidup dan berdinding tipis yang mampu membelah berulang-ulang Mitosis : proses pembelahan sel somatik
Monomorfik : hanya satu bentuk genotip MS : Murashige and Skoog
MS0 : Media MS tanpa zat pengatur tumbuh MSS : minggu setelah subkultur
MST : minggu setelah tanam NAA : naphthalene acetate acid
Nekrosis : gejala matinya beberapa sel/bagian/organ tanaman yang berhubungan dengan kehilangan klorofil
Organogenesis : pembentukan dan perkembangan organ dalam pembentukan embrio
PCR : polymerase chain reaction (proses polimerasi DNA secara in vitro)
PER : enzim peroksidae
Plantlet : tumbuhan kecil yang telah sempurna dihasilkan dari biji atau biakan in vitro
PLB : protocorm like body, biji yang sangat kecil dan tidak dapat dibedakan bakal akar atau batang bila
berkecambah, misal pada anggrek
Polimorfik : bentuk pola pita DNA yang berbeda antar individu Primer : rantai nukleotida pendek, berfungsi sebagai pemula
sintesis DNA dalam reaksi polimerisasi
Propagul : bagian organisme yang dapat digunakan dalam perbanyakan
RAPD : random amplified polymorphic DNA (teknik analisis DNA berdasarkan panjang fragmen DNA hasil amplifikasi oleh enzim polymerase dengan primer tertentu
rpm : rotation per minutes
Self incompatibility : bunga yang tidak dapat membentuk buah bila terjadi penyerbukan sendiri atau baru dapat membentuk buah bila terjadi penyerbukan silang
Tanaman roset : tanaman dengan susunan daun rapat karena ruas batang amat pendek
TDZ : thidiazuron, sitokinin turunan fenilurea Tris : tris (hydroxymethy)-aminomethane
Tunas aksilar : tunas yang muncul dari ketiak daun batang utama suatu tumbuhan
I. PENDAHULUAN
1.1. Latar Belakang
Nenas merupakan buah tropika ketiga setelah pisang dan mangga yang
diperdagangkan secara global (Petty et al. 2002) dalam bentuk nenas segar dan
produk olahan. Hampir seluruh bagian tanaman nenas dapat dimanfaatkan,
limbah dari buah untuk pakan ternak dan produksi asam organik (seperti asam
sitrat, asam askorbat, asam malat), serat daun untuk bahan tekstil, dan bromelin
untuk industri makanan, kosmetik, obat-obatan (Wee dan Thongtham, 1997;
Nakasone dan Paull, 1999). Pada tahun 2000 Indonesia adalah produsen nenas
terbesar ke-9 namun peran Indonesia dalam mengisi ekspor buah nenas dunia
masih rendah yaitu 0,003% untuk nenas segar dan 12,34% nenas kaleng
(Poerwanto, 2003). Produksi nenas Indonesia pada tahun 2000 hanya 2% dari
produksi dunia, padahal pada tahun 1995 produksi nenas Indonesia mencapai 6%
dari produksi dunia (Anonim, 2001). Produksi nenas dapat ditingkatkan dengan
beberapa cara diantaranya: membuka kebun baru, meremajakan
kebun-kebun yang tua, memperkenalkan kultivar baru dan menyediakan bibit unggul.
Usaha tersebut harus didukung dengan teknik perbanyakan yang cepat dan bibit
yang dihasilkan seragam, yaitu teknik perbanyakan in vitro.
Teknik perbanyakan in vitro tanaman nenas perlu dikembangkan karena
teknik perbanyakan tradisional dan modifikasinya tidak efisien. Teknik
perbanyakan tradisional dengan menggunakan bagian vegetatif tanaman seperti
crown (mahkota buah ), slip, shoot (tunas samping) dan sucker (anakan)
memerlukan waktu lama, jumlah bibit ya ng dihasilkan sedikit dan tidak seragam.
Tanaman nenas kultivar Smooth Cayenne menghasilkan 2 propagul/tanaman per
tahun sehingga perlu waktu 30 tahun untuk menghasilkan bahan tanaman yang
cukup untuk satu hektar yang dimulai dari satu tanaman (Purseglove, 1972).
Untuk meningkatkan jumlah bibit dapat dilakukan dengan memodifikasi teknik
tradisional yaitu (1) metode pemotongan mata tunas pada ketiak daun dari crown,
slip, dan sucker, (2) metode pemotongan memanjang dari slip dan sucker (teknik
kuarter), dan (3) metode pemotongan batang (Selamat, 1996). Bibit yang
dihasilkan dengan metode tersebut sebanyak 15-256 bibit/sucker/tahun (Selamat,
yang perlu bibit ratusan ribu bahkan jutaan bibit per tahun. Selain itu,
perbanyakan in vitro untuk perbanyakan bahan tanaman yang terbatas jumlahnya
(misal klon introduksi), klon unggul hasil seleksi atau hibrid hasil persilangan.
Keberhasilan dalam perbanyakan secara in vitro ditentukan oleh banyak
faktor, diantaranya kultivar tanaman, komposisi media, metode kultur, jenis dan
konsentrasi zat pengatur tumbuh (ZPT) serta umur kultur. Klon nenas yang
berbeda menghasilkan multiplikasi berbeda (DeWald et al. 1988). Metode
regenerasi yang berbeda juga menghasilkan multiplikasi berbeda. Kiss et al.
(1995) dengan metode etiolasi dapat menghasilkan 80 000 plantlet/tanaman
per tahun, sedangkan Teng (1997) dengan metode kultur nodul dapat
menghasilkan 80 000-100 000 plantlet/tana man per tahun.
Teknik perbanyakan in vitro pada beberapa jenis tanaman terbukti efisien,
namun pada tanaman nenas belum digunakan secara komersial karena
kemungkinan terjadi variasi somaklonal (Bartholomew dan Criley, 1988). Variasi
yang muncul selama proses kultur in vitro disebut variasi somaklonal (Larkin dan
Scowcorft, 1981). Penyebab munculnya variasi somaklonal ada dua yaitu variasi
genetik yang memang sudah ada dalam eksplan dan variasi induksi atau variasi
epigenetik yang muncul selama fase kultur in vitro. Variasi genetik bersifat stabil
baik melalui perbanyakan seksual dan aseksual, sedangkan variasi epigenetik
tidak stabil dan berpotensi dapat balik (reversible) (Evans et al. 1984; Kaeppler
et al. 2000). Epigenetik adalah variasi dalam ekspresi gen yang secara potensial
dapat balik tetapi sekuen DNA tidak mengalami perubahan (Kaeppler et al.
2000). Oono (1985 dalam Kaeppler et al. 2000) melaporkan, padi kerdil hasil
perbanyakan in vitro tetap terbawa me lalui perbanyakan generatif. Padi kerdil
kembali menjadi tanaman normal setelah diperlakukan dengan 5-deoxyazacytidine
yaitu senyawa anti metilasi DNA. Sifat kerdil yang muncul pada padi tersebut
merupakan variasi epigenetik.
Variasi somaklonal yang terjadi pada teknik perbanyakan in vitro nenas
dan tanaman lainnya dipengaruhi oleh banyak faktor dan mekanisme penyebabnya
masih menjadi perdebatan. Menurut Kaeppler et al (2000), penyebab terjadinya
variasi somaklonal adalah perubahan kromosom (penggandaan kromosom, delesi,
transposon. Besarnya variasi tergantung pada klon atau kultivar tanaman, macam
dan konsentrasi zat pengatur tumbuh, kecepatan multiplikasi, umur kultur, sumber
eksplan, penggunaan agen mutagenik dan tekanan seleksi (seperti kadar garam,
herbisida, produk sampingan dari mikroorganisme), jumlah kromosom dan tipe
regenerasi (Skirvin, 1978; Skirvin et al. 1994).
Kultivar berbeda dalam satu spesies tanaman pisang menunjukkan tingkat
variasi yang berbeda. Variasi pada kultur pisang rata-rata 3% tetapi pada kultivar
Cavendish mencapai 20% (Hwang dan Ko, 1986). Penggunaan zat pengatur
tumbuh (ZPT) konsentrasi tinggi, umur kultur dan frekuensi subkultur yang
berlebihan dapat menginduksi variasi (Skirvin et al. 1994). Eksplan yang
mempunyai mata tunas kemungkinan terjadinya variasi lebih kecil dibandingkan
eksplan yang tidak mempunyai meristem calon tunas (Skirvin et al. 1994).
Regenerasi melalui perbanyakan tunas aksilar dapat mengurangi munculnya
variasi somaklonal dibandingkan regenerasi melalui tunas adventif dan
embriogenesis (Karp, 1989). Variasi somaklonal yang masih bisa diterima adalah
tidak lebih dari 3-5% (Cote et al. 1993). Oleh karena itu perlu dilakukan
penelitian untuk mendapatkan metode perbanyakan in vitro nenas yang efisien
dengan variasi somakonal yang rendah melalui pengaturan ZPT, regenerasi
langsung dan frekuensi subkultur.
Variasi somaklonal perlu dievaluasi sedini mungkin. Evaluasi bisa
dilakukan pada plantlet dala m botol, saat aklimatisasi di rumah kaca atau di
lapangan pada fase vegetatif dan generatif. Dalam melakukan evaluasi variasi
somaklonal perlu digunakan kombinasi beberapa penanda misalnya karakter
morfologi, biokimia (isozim), sitologi, dan molekuler. Masing- masing penanda
mempunyai kelemahan dan kelebihan sehingga dengan mengkombinasikan
beberapa penanda dapat diperoleh hasil evaluasi yang dapat dipercaya.
Identifikasi dengan menggunakan karakter morfologi mudah dilakukan dan
biayanya murah, namun sering dipengaruhi oleh lingkungan dan tahap
perkembangan tanaman. Jika pengaruh lingkungan sangat besar terhadap induksi
keragaman maka penilaian keragaman berdasarkan data karakter morfologi tidak
mencerminkan tingkat keragaman genetik yang sebenarnya (Yee et al. 1999).
Ford-lloyd, 1993), tidak dipengaruhi lingkungan dan mampu membedakan antar
tanaman yang secara morfologi dan sitologi tidak dapat dibedakan. Penanda
RAPD adalah hasil amplifikasi sebagian DNA dari genom dengan menggunakan
satu buah primer oligonukleotida yang terdiri atas 10 nukleotida (William et al.
1990). Analisis isozim mempunyai beberapa kelemahan dibandingkan penanda
RAPD yaitu jumlah isozim yang bisa dianalisis terbatas, polimorfik yang
dihasilkan lebih rendah dan perubahan sekuen DNA atau nukleotida yang tidak
merubah sekuen asam amino polipeptida tidak dapat dideteksi dengan isozim
(Roose, 1988). RAPD mempunyai beberapa kelebihan diantaranya perbedaan
primer pada satu nukleotida tunggal akan menghasilkan profil yang berbeda. Jadi
teknik ini dapat mendeteksi perubahan basa tunggal dalam DNA genom jika
cukup banyak primer yang digunakan (Deng et al. 1995).
1.2. Perumusan Masalah
Teknik perbanyakan tanaman nenas secara alami dan modifikasinya tidak
efisien, oleh karena itu perlu dilakukan teknik perbanyakan in vitro. Teknik
in vitro yang efisien harus mampu menghasilkan kecepatan multiplikasi yang
tinggi sehingga dapat dihasilkan bibit dalam jumlah banyak dan cepat.
Multiplikasi tinggi dapat dicapai dengan menggunakan ZPT sitokinin dan auksin
konsentrasi tinggi, subkultur berulang dan regenerasi langsung atau tidak
langsung. Namun kecepatan multiplikasi yang tinggi dapat menginduksi
munculnya variasi somaklonal (Gambar 1). Penyebab terjadinya variasi
somaklonal adalah perubahan kromosom (penggandaan kromosom, delesi,
inversi, translokasi), perubahan sekuen DNA, metilasi dan aktifasi elemen
transposon (Kaeppler et al 2000).
Stabilitas klonal adalah faktor yang sangat penting dalam perbanyakan
mikro secara komersial. Pada beberapa kasus variasi somaklonal yang terdeteksi
saat in vitro, ketika di lapangan menjadi normal (berdasarkan karakter morfologi).
Evaluasi variasi somaklonal hasil perbanyakan in vitro tanaman nenas telah
dilakukan pada plantlet dalam botol dan aklimatisasi di lapangan umur 6 minggu
(Mhatre et al. 2002; Smith et al. 2002) tetapi evaluasi variasi somaklonal pada
dilakukan evaluasi variasi somaklonal tanaman nenas hasil kultur in vitro
sampai fase generatif dan kualitas buah dengan menggunakan kombinasi beberapa
penanda (morfologi, isozim dan RAPD) agar diperoleh hasil yang dapat dipercaya
(Gambar 1). Perlu dicari metode perbanyakan yang dapat meningkatkan
kecepatan multiplikasi setinggi mungkin dengan resiko munculnya variasi
somaklonal serendah mungkin. Untuk itu dalam penelitian ini dilakukan studi
perbanyakan in vitro tanaman nenas melalui pendekatan penggunaan ZPT (BAP,
TDZ, IAA, NAA, GA3), metode regenerasi (organogenesis, teknik etiolasi) dan
frekuensi sub kultur pada dua kultivar nenas (kultivar Queen dan Smooth
Cayenne).
Pada awalnya, penelitia n dirancang untuk membandingkan respon kultivar
Queen dan Smooth Cayenne terhadap BAP dan TDZ dengan pendekatan
konsentrasi yang sama dan teknik regenerasi yang sama melalui organogenesis.
Namun dalam pelaksanaannya, kultivar Queen dan Smooth Cayenne
menunjukkan respon yang sangat berbeda dalam media media induksi (MS0)
sehingga dilakukan penelitian yang terpisah untuk kedua kultivar (Gambar 2).
BAP dan TDZ pada kultivar Queen menunjukkan efek yang sangat berbeda
sehingga memerlukan pendekatan metode perbanyakan yang berbeda, oleh karena
itu dilakukan penelitian 1 dan 2 yang saling terpisah. Perbanyakan in vitro nenas
kultivar Smooth Cayenne kurang efisien melalui organogenesis langsung
menggunakan TDZ dan BAP sehingga dilakukan percobaan dengan teknik etiolasi
(Gambar 2) Permasalahan di atas dipelajari dengan melakukan 3 penelitian yang
terpisah yaitu:
1 Pengaruh TDZ, IAA dan NAA terhadap multiplikasi dan keseragaman
keragaan tanaman nenas kultivar Queen di lapangan
2 Pengaruh BAP dan frekuensi subkultur terhadap multiplikasi, kualitas
buah dan kestabilan genetik tanaman nenas kultivar Queen.
3 Pengaruh TDZ dan BAP serta teknik etiolasi dalam perbanyakan in vitro
1.3. Tujuan Penelitian
Tujuan umum penelitian adalah mendapatkan sistem perbanyakan in vitro
tanaman nenas melalui organogenesis dengan variasi somaklonal sekecil
mungkin.
Tujuan spesifik adalah:
1 Mempelajari dan menganalisis pengaruh TDZ, IAA dan NAA terhadap
multiplikasi, pengakaran dan keseragaman keragaan tanaman nenas kultivar
Queen di lapangan
2 Mempelajari dan menganalisis pengaruh BAP terhadap multiplikasi,
pengakaran, dan kualitas buah serta kestabilan genetik tanaman nenas
kultivar Queen.
3 Mempelajari dan menganalisis pengaruh BAP dan TDZ serta teknik etiolasi
terhadap multiplikasi dan pengakaran tanaman nenas kultivar Smooth
Cayenne.
1.4. Manfaat penelitian
1 Mendapatkan konsentrasi optimum dari TDZ dan BAP untuk menginduksi
multiplikasi tunas yang tinggi dengan variasi somaklonal ya ng rendah,
sehingga diperoleh tanaman regeneran dalam jumlah banyak, seragam, dan
stabil.
2 Mendapatkan metode standar dalam perbanyakan in vitro tanaman nenas
kultivar Queen dan Smooth Cayenne sehingga dapat membantu perusahaan
nenas dalam penyediaan bibit bermutu.
3 Mendapatkan metode untuk mendeteksi variasi somaklonal pada waktu
sedini mungkin terhadap tanaman nenas hasil perbanyakan in vitro
II. TINJAUAN PUSTAKA
2.1. Tanaman Nenas
Nenas merupakan anggota famili Bromeliaceae atau bromeliad. Famili ini
terdiri atas 45 genus dan 2000 spesies (Nakasone dan Paull, 1999) yang semuanya
berasal dari Amerika Selatan kecuali satu spesies Pitcairnia felicana berasal dari
Afrika Barat (Collins, 1968). Tanaman nenas ditemukan oleh Columbus tahun
1493 (Petty et al. 2001), diduga masuk ke Indonesia pada abad ke-16 dibawa oleh
orang Spanyol (Collins, 1968) dan masuk ke pulau Jawa tahun 1599 (Purseglove,
1972).
Ananas comosus L. Merr. adalah nenas budidaya yang merupakan
tanaman herba tahunan (perenial), sukulen, dan serofit, steril bila menyerbuk
sendiri, monokotil, epifit atau terestrial (Purseglove, 1972; Wee dan Thongtham,
1997; Paull, 1997; Nakasone dan Paull, 1999; Petty et al. 2001). Tanaman nenas
mempunyai tinggi 50-100 cm, tinggi batang tanaman dewasa 30-35 cm, diameter
6,5-7,5 cm dengan ruas pendek 1-10 mm (Nakasone dan Paull, 1999). Akar
tanaman nenas ada 3 macam yaitu akar tanah, akar aksilar dan akar adventif
(Collins, 1968). Akar tanah adalah akar yang berada di bawah permukaan tanah,
akar aksilar adalah akar pada pangkal batang dan berada di atas permukaan tanah,
sedangkan akar adventif adalah akar yang muncul di aksilar daun batang. Akar
aksilar dan akar adventif berfungsi untuk menyerap air dan nutrisi. Akar baru
terus terbentuk dan menyebar dan terhenti saat terjadi inisiasi pembungaan. Daun
nenas berbentuk pedang dengan panjang 1 m atau lebih, lebar 5-8 cm, pinggiran
berduri atau hampir rata, berujung lancip. Daun menempel secara spiral pada
batang dengan jarak yang rapat sehingga membentuk roset. Daun nenas
mengandung serat 2-3% yang dapat digunakan untuk tekstil (Purseglove, 1972).
Secara alami inisiasi inflorescence dipercepat dengan adanya suhu rendah
pada malam hari dan pengurangan jam penyinaran, namun inisiasi dapat diinduksi
secara buatan dengan menggunakan gas etilen (Paull, 1997; Wee dan Thongtham,
1997). Fase generatif terbagi dalam 5 tahap yaitu (1) awal induksi, yaitu
inflorescence tersembunyi membentuk roset daun, (2) red heart yaitu tahap antara
pematangan buah (Coppens d’Eeckenbrugge et al. 2001). Inflorescence kompak
mengandung 100-200 bunga hermaprodit. Antesis terjadi 2-4 minggu, dan setiap
bunga mekar selama 1-2 hari (Ploetz et al. 1996). Buah nenas merupakan buah
multiple partenokarpi atau sinkarp ya ng terbentuk dari penebalan poros bunga
dan peleburan masing- masing bunga (Purseglove, 1972; Wee dan Thongtham,
1997). Perkembangan fruitlet telah lengkap bersamaan dengan munculnya
mahkota buah, selanjutnya buah dan mahkota terus berkembang sampai buah
matang. Buah matang sekitar 4 bulan sejak munculnya mahkota atau 6-7 bulan
dari inisiasi bunga (Nakasone dan Paull, 1999). Bakal biji dan serbuk sari
berfungsi normal tetapi tidak kompatibel menyerbuk sendiri (self incompatible)
sehingga tidak menghasilkan biji atau biji yang terbentuk tidak normal (Nakasone
dan Paull, 1999). Self incompatible ini disebabkan oleh terhambatnya
pertumbuhan tabung serbuk sari pada 1/3 bagian atas dari tangkai putik
(Brewbaker dan Go rrez, 1967 dalam Nakasone dan Paull, 1999).
Kandungan nutrisi buah dipengaruhi oleh lingkungan. Nenas yang
ditanam di dataran rendah ukurannya lebih besar, lebih manis dan lebih berair
(Wee dan Thongtham, 1997). Rasio gula:asam sangat bervariasi tergantung pada
kultivar, kondisi pertumbuhan tanaman dan umur panen (Nakasone dan Paull,
1999). Wee dan Thongtham (1997) menyatakan rasio gula:asam = 16:1 adalah
ideal untuk proses pengalengan.
2.2. Kultivar Nenas
Kultivar yang dibudidayakan mungkin merupakan tanaman diploid,
triploid atau tetraploid dengan 2n = 50, 75 atau 100 kromosom. Tanaman nenas
diploid dan tetraploid merupakan tanaman fertil tetapi self incompatible,
sedangkan nenas triploid adalah steril (IBPGR, 1986). Kultivar komersial
Cabezona adalah tanaman triploid alami dengan 75 kromosom (Collins, 1933
dalam Collins, 1968). Persilangan antara 2 kultivar diploid dapat menghasilkan
beberapa tanaman triploid, tetraploid dengan persentase sangat kecil dibandingkan
tanaman diploid. Tanaman triploid berasal dari sel telur yang tidak tereduksi
(gamet diploid) dibuahi sel serbuk sari haploid. Tanaman tetraploid berasal dari
menghasilkan 90% serbuk sari fertil sedangkan tanaman triploid menghasilkan
90-95% serbuk sari steril (Collins, 1968).
Kultivar-kultivar nenas berbeda dalam ukuran tanaman dan buah, warna
dan rasa daging buah, pinggiran daun berduri atau rata. Kultivar tersebar pada
berbagai negara sehingga sering mempunyai nama berbeda-beda (Coppens
d’Eeckenbrugge et al. 2001). Tanaman nenas dikelompokkan dalam 5 kelompok
fenotipe berdasarkan karakter buah dan daun (Tabel 1). Pengelompokan
berdasarkan karakter fenotipe tidak persis sama dengan pengelompokan
berdasarkan variasi isozim (Aradhaya et al. 1994).
Tabel 1 Karakter fenotipe 5 kultivar nenas (Leal dan Soule, 1977 dalam Nakasone dan Paull, 1999).
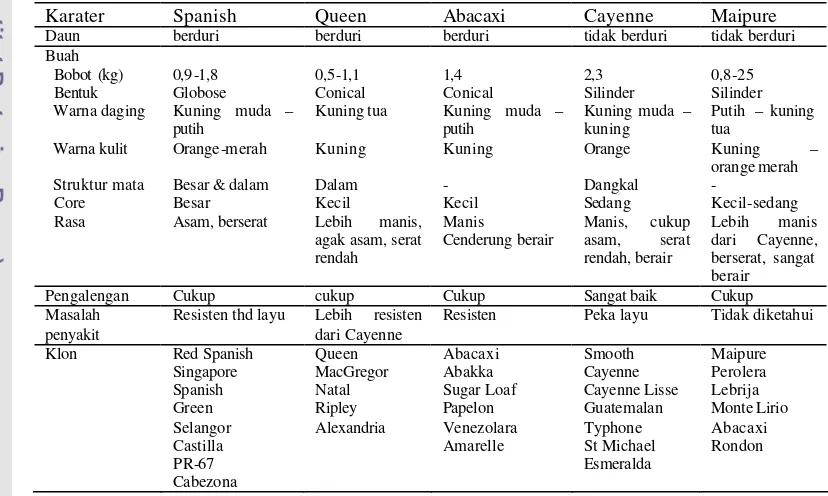
Karater Spanish Queen Abacaxi Cayenne Maipure
Daun berduri berduri berduri tidak berduri tidak berduri
Buah Bobot (kg) Bentuk Warna daging Warna kulit Struktur mata Core Rasa 0,9-1,8 Globose Kuning muda – putih
Orange-merah
Besar & dalam Besar Asam, berserat 0,5-1,1 Conical Kuning tua Kuning Dalam Kecil Lebih manis, agak asam, serat rendah
1,4 Conical
Kuning muda – putih Kuning - Kecil Manis Cenderung berair 2,3 Silinder Kuning muda – kuning Orange Dangkal Sedang Manis, cukup asam, serat rendah, berair 0,8-25 Silinder Putih – kuning tua
Kuning – orange merah - Kecil-sedang Lebih manis dari Cayenne, berserat, sangat berair
Pengalengan Cukup cukup Cukup Sangat baik Cukup
Masalah penyakit
Resisten thd layu Lebih resisten dari Cayenne
Resisten Peka layu Tidak diketahui
Klon Red Spanish
Singapore Spanish Green Selangor Castilla PR-67 Cabezona Queen MacGregor Natal Ripley Alexandria Abacaxi Abakka Sugar Loaf Papelon Venezolara Amarelle Smooth Cayenne Cayenne Lisse Guatemalan Typhone St Michael Esmeralda Maipure Perolera Lebrija Monte Lirio Abacaxi Rondon
Penjelasan singkat dari lima kelompok fenotipe nenas sebagai berikut: (1)
Kultivar Cayenne banyak ditanam untuk produksi komersial selama hampir 150
tahun. Kultivar Smooth Cayenne awalnya satu genotipe tunggal karena
diperbanyak secara aseksual dan terjadi mutasi somatik maka muncul sejumlah
klon-klon yang berbeda dalam kultivar tersebut (Broertjes dan Van Harten, 1988).
Menurut Collins dan Kerns (1938) dalam Broertjes dan Van Harten (1988) ada
30 tipe mutan dari kultivar Cayenne. Kultivar Cayenne menghasilkan sedikit
[image:31.596.96.510.325.573.2]et al. 2001). (2) Kultivar Queen lebih banyak diperdagangkan sebagai buah segar,
mempunyai ukuran tanaman dan buah lebih kecil dan daun lebih pendek
dibandingkan dengan kultivar Cayenne. Daun kultivar Queen berduri, rasa dan
aroma buah lebih disukai. Kultivar Queen menghasilkan 3-12 sucker (Apriyani,
2005) (3). Kultivar Spanish berukuran kecil sampai sedang, daun berduri, sering
terjadi multiple mahkota dan menghasilkan banyak sucker. Buah tidak cocok
untuk produk kalengan karena mata terlalu dalam dan warna daging buah pucat.
(4). Kultivar Abacaxi banyak ditanam di Amerika Latin dan daerah Karibia.
Kultivar ini disebut juga Pernambuco (Petty et al. 2002). Buah tidak cocok untuk
produk kalengan atau buah segar, banyak dipasarkan dalam bentuk juice dengan
rasa yang sesuai untuk konsumen Amerika Latin dan Karibia. (5). Kultivar
Maipure banyak dibudidayakan di Amerika Tengah dan Selatan sebagai buah
segar untuk pasar lokal. Nama lain dari kultivar ini adalah Perolera (Petty et al.
2002), sering menghasilkan mahkota buah berukuran kecil pada bagian dasar
mahkota dan menghasilkan banyak slip sampai 6. Mutan Perolera menghasilkan
buah berwarna merah (Coppens d’Eeckenbrugge et al. 2001).
2.3. Perbanyakan Nenas
Tanaman nenas umumnya diperbanyak secara vegetatif dengan
menggunakan tunas vegetatif dari berbagai bagian batang tana man dan mahkota
buah. Berbagai bahan perbanyakan menurut Collins (1968) dan Rangan (1984),
(Gambar 3) antara lain:
1. Crown (mahkota buah) adalah bagian tanaman yang ada di atas buah
2. Slip (tunas tangkai buah) adalah tunas yang muncul di bawah dasar buah
3. Hapas adalah tunas yang muncul pada daerah antara ujung batang dan dasar
buah tangkai buah
4. Shoot (tunas ketiak daun atau tunas samping) adalah tunas yang muncul dari
aksilar daun
5. Sucker (anakan) adalah tunas yang muncul dari bagian batang di bawah
permukaan tanah.
Wee dan Thongtham (1997) membagi bahan tanam nenas menjadi tiga yaitu
Dari ketiga bagian tersebut yang paling sering digunakan sebagai bahan
perbanyakan adalah tunas batang sedangkan mahkota jarang digunakan karena
ukurannya tidak seragam.
1 2 3 4
Gambar 3 Bagian vegetatif tana man nenas yang dipergunakan sebagai bahan perbanyakan tanaman 1. Crown, 2. Slip, 3. Shoot, 4. Sucker
Jumlah anakan dan tunas samping berkorelasi negatif dengan kepadatan
populasi tanaman (Petty e t al. 2002), selain itu juga tergantung pada kultivar
nenas. Kultivar Smooth Cayenne menghasilkan tunas batang sedikit yaitu kurang
dari tiga sehingga untuk perbanyakan lebih sering digunakan tunas ketiak daun
(Nakasone dan Paull, 1999). Kultivar Queen banyak menghasilkan anakan dan
tunas samping (8-12) (Sari, 2002). Shoot diambil dari tanaman induk 1 bulan
setelah panen, slip diambil 2-3 bulan setelah panen, sedangkan mahkota diambil
bersamaan dengan saat panen. Tunas samping terus berkembang sampai buah
dipanen sehingga ukurannya lebih besar dibanding slip (Nakasone dan Paull,
1999). Perbanyakan bibit dengan mengandalkan produksi dari tanaman secara
alami hasilnya sedikit dan memerlukan waktu yang lama serta ukurannya
bervariasi. Oleh karena itu, perlu dicari teknik perbanyakan yang dapat
meningkatkan kecepatan dan jumlah bibit yang dihasilkan. Beberapa teknik
perbanyakan telah dilakukan diantaranya: (1) menyemprotkan bahan kimia
(seperti morphactin, klorflurenol, flurenol, diklorflurenol) ke tanaman untuk
menginduksi pembentukan plantlet (Nickell, 1988), (2) memodifikasi metode
perbanyakan tradisional yaitu metode pemotongan mata tunas, metode
Selamat, 1996) dan (3) perbanyakan in vitro (Wakasa, 1979; Zepeda dan Sagawa,
1981; Kiss et al. 1995; Teng, 1997; Prahardini et al. 1995; Imelda dan Erlyandari,
2000).
2.4. Perbanyakan In Vitro
Teknik perbanyakan in vitro adalah cara perbanyakan dengan
menggunakan media buatan di bawah kondisi aseptik (Rice et al. 1992). Teknik
perbanyakan in vitro disebut juga perbanyakan mikro atau kultur jaringan
tanaman. Menurut Ahloowalia et al. (2004) kultur jaringan tanaman adalah
menumbuhkan dan memperbanyak sel, jaringan dan organ dalam media padat
atau cair di bawah kondisi aseptik dan terkendali. Teknik perbanyakan in vitro
mempunyai beberapa kelebihan dibandingkan perbanyakan konvensional yaitu:
(1) membutuhkan bahan tanam atau eksplan sedikit, (2) menghasilkan tanaman
bebas patogen dalam waktu cepat dan ruangan relatif sempit, (3) menghasilkan
tanaman secara klonal tanpa dipengaruhi musim atau lingkungan dan (4)
kecepatan produksi dapat diatur sesuai permintaan pasar (Fiorino dan Loreti,
1987). Teknik perbanyakan in vitro umumnya dilakukan melalui lima tahapan
(Werbrouck dan Debergh, 1994):
Tahap 0 : Persiapan dan perlakuan tanaman (sumber eksplan)
Tahap 1 : Inisiasi eskplan
Tahap 2 : Multiplikasi tunas
Tahap 3 : Pemanjangan, induksi akar dan perkembangan akar
Tahap 4 : Aklimatisasi dan penanaman di lapangan
Tahap 0 dilakukan untuk mendapatkan bahan tanam (eksplan) yang sehat dan
kondisi fisiologisnya bagus. Pada tahap ini, tanaman sebagai sumber eksplan
perlu dirawat dengan baik dan kadang-kadang perlu perlakuan khusus seperti
pemangkasan, penyemprotan zat pengatur tumbuh sehingga kond isi fisiologinya
lebih baik. Pada tahap inisiasi, kegiatan yang dilakukan adalah memilih bagian
tanaman yang akan dijadikan eksplan, mencari prosedur sterilisasi yang efektif
namun tidak mematikan eksplan, dan memilih komposisi media yang tepat.
Tahap multiplikasi merupakan tahap yang penting dalam perbanyakan in vitro.
sitokinin dalam media dan atau mensubkultur plantlet pada media yang sama atau
media yang berbeda. Pada beberapa kasus, penggunaan sitokinin cukup optimal
untuk multiplikasi tunas (Werbrouck dan Debergh, 1994). Tahap pengakaran
kadang-kadang bisa dilewati karena pada akhir tahap multiplikasi beberapa
plantlet dapat menghasilkan akar sehingga bisa segera diaklimatisasi. Apabila
sitokinin yang digunakan pada tahap 2 relatif tinggi, kadang-kadang tunas yang
dihasilkan pendek dan sulit berakar. Agar dihasilkan tunas yang panjang dan
berakar, plantlet ditransfer ke media yang berbeda. Pada tahap aklimatisasi yang
perlu diperhatikan adalah pemilihan media dan kondisi lingkungan rumah kaca.
Pada dasarnya ada 3 macam teknik perbanyakan mikro yaitu: (1)
perbanyakan meristem adventif (organogenesis), (2) embriogenesis somatik dan
(3) perbanyakan tunas aksilar (tunas yang sudah ada di meristem) (Fiorino dan
Loreti, 1987; Rice et al. 1992). Pada permulaan kultur, metode perbanyakan tunas
aksilar kurang efisien dibanding organogenesis atau embriogenesis, namun
setelah beberapa kali subkultur maka kecepatan multiplikasi dari tunas aksilar
akan meningkat pesat (Fiorino dan Loreti, 1987).
Metode lain yang merupakan modifikasi dari perbanyakan meristem
adventif adalah teknik kultur kalus nodular. Nodular adalah kumpulan sel yang
menunjukkan pola diferensiasi jaringan dan sel internal yang konsisten (Teng,
1997). Nodular umumnya mempunyai kapasitas yang tinggi untuk regenerasi
menjadi tanaman atau organ melalui organogenesis. Nodular juga dapat
berproliferasi membentuk kalus nodular yang lebih banyak, dapat dipertahankan
dalam waktu yang lama dan proses regenerasi dapat disinkronisasi sesuai
kebutuhan. Nodular dapat diinduksi dari kalus atau secara langsung dari eksplan.
Nodular nenas mempunyai karakter yang sama dengan kalus yaitu dapat
berproliferasi membentuk nodular baru dan regenerasi menjadi tunas. Nodular
baru terbentuk dari bagian nodular yang tua dan 70% dari nodular yang baru dapat
membentuk tunas. Kultur nodular mempunyai potensi untuk menghasilkan
plantlet yang tinggi. Kalus nodular seberat 0,4 g dapat menghasilkan lebih dari
50 tanaman dalam waktu 1 bulan sehingga dalam setahun diperkirakan dapat
dihasilkan 8-10 x 104 plantlet dari nodular yang diinduksi dari satu tanaman.
potongan buku yang mengalami etiolasi didapatkan 13-15 plantlet/eksplan buku
dan diperkirakan dalam setahun dihasilkan 8 x 104 plantlet dari satu tanaman.
Perbanyakan nenas Bogor pada media MS + 1 mg/l BAP menghasilkan 9 tunas
pada umur 2 bulan dan bila konsentrasi BAP ditingkatkan menjadi 2 mg/l jumlah
tunas menjadi 2 (Imelda dan Erlyandari, 2000). Prahardini et al. (1995) dengan
menambahkan IAA, BA dan GA3 pada media MS mendapatkan 9 tunas in vitro
nenas Queen klon Blitar pada umur 5 bulan.
2.5. Zat Pengatur Tumbuh
Manipulasi sel, jaringan dan organ tanaman dalam kultur in vitro untuk
tujuan perbanyakan dan modifikasi tanaman sangat bergantung pada penggunaan
zat pengatur tumbuh. Zat pengatur tumbuh sitokinin sering digunakan dalam
perbanyakan in vitro untuk mendapatkan multiplikasi yang tinggi. Aktifitas
berbagai hormon tanaman bergantung pada interaksinya dengan hormon tanaman
lainnya. Sitokinin bersinergis dengan auksin dalam menstimulasi pembelahan sel
secara kontinue dalam kultur jaringan pith tembakau, tetapi bersifat antagonis
dengan auksin dalam mengontrol inisiasi tunas dan akar dalam kultur jaringan dan
dalam proses dominansi apikal (Binns, 1994).
Berdasarkan struktur kimia ada 2 kelompok sitokinin yaitu turunan adenin
(BAP, kinetin, zeatin) dan turunan fenilurea (TDZ). TDZ dan BAP mempunyai
respon fisiologi yang sama yaitu berperan dalam regulasi pembelahan sel,
diferensiasi dan pertumbuhan jaringan dan organ serta biosintesis klorofil (Murthy
et al. 1996). Efektifitas antara BAP dan TDZ dalam menginduksi multiplikasi
tunas berbeda-beda bergantung pada jenis tanamannya. Pada tanaman anggrek
Phalaenopsis konsentrasi optimal untuk menginduksi tunas adventif adalah
5-10 µM TDZ dan bila menggunakan BAP 40 µM (Chen dan Piluek, 1995). Pada tanaman ubi kayu perlakuan 10 mg/l BAP menghasilkan jumlah tunas per
eksplan lebih banyak dibandingkan perlakuan 10 mg/l TDZ tetapi persentase
eksplan membentuk tunas pada perlakuan TDZ lebih tinggi dibandingkan
perlakuan BAP (Konan et al. 1997)
Pengaruh penggunaan TDZ dalam perbanyakan in vitro diantaranya adalah
menginduksi embrio somatik tanpa dikombinasi dengan zat pengatur tumbuh
lainnya (Murthy et al. 1995), merangsang proliferasi tunas dan regenerasi organ
adventif tanaman berkayu (Huetteman dan Preece, 1993), meningkatkan
kecepatan proliferasi protocorm-like body (PLB), menginduksi pembentukan PLB
(Ernst, 1994). Selain itu TDZ dapat menginduksi absisi daun kapas melalui
peningkatan etilen endogen (Suttle, 1985). Penggunaan sitokinin dengan
konsentrasi tinggi akan berpengaruh negatif yaitu menghambat perpanjangan
tunas dan inisiasi akar Cymbidium sinense Willd (Chang dan Chang, 2000),
menghasilkan tunas hiperhid rik pada tanaman ubi kayu (Konan et al. 1997),
menyebabkan vitrifikasi yaitu suatu kondisi fisiologi in vitro yang menyebabkan
disorganisasi seluler (Ziv, 1991). Pengaruh negatif lainnya adalah menyebabkan
munculnya kalus pada bagian dasar eksplan (Lakshmanan et al. 1997),
pembengkakan akar dan pertumbuhan akar terhenti (Fratini dan Ruiz, 2002,
produksi etilen meningkat (Kevers dan Gasper, 1985).
2.6. Kestabilan Genetik dalam Perbanyakan In Vitro
Stabilitas klonal merupakan faktor yang sangat penting dalam
perbanyakan mikro secara komersial (George dan Sherrington, 1984). Stabilitas
genetik eksplan dalam kultur in vitro tergantung pada derajat struktur, organisasi
dan pengaruh lingkungan aseptik yang menyertai ekspresi potensi variabilitas
(Rice et al. 1992). Stabilitas genetik eksplan seringkali tidak dapat dipertahankan
selama atau setelah melalui proses in vitro sehingga muncul variasi yang disebut
variasi somaklonal.
Penyebab munculnya variasi somaklonal ada dua kemungkinan yaitu
variasi genetik (genetic variation) yang memang sudah ada dalam eksplan dan
variasi induksi (induce variation) atau variasi epigenetik yang muncul selama fase
kultur jaringan. Variasi genetik bersifat stabil baik melalui perbanyakan seksual
dan aseksual, sedangkan variasi epigenetik tidak stabil walaupun melalui
perbanyakan aseksual (Evans et al. 1984). Variasi genetik yang ada dalam
eksplan (pre-existing variation) dapat berasal dari eksplan multiseluler dan
tanaman kimera. Eksplan biji atau kecambah terdiri atas beberapa tipe sel dapat
induksi dapat disebabkan oleh zat pengatur tumbuh, tipe regenerasi, kultivar atau
klon tanaman, jumlah kromosom (level ploidi), sumber eksplan, umur kultur dan
frekuensi subkultur, kecepatan proliferasi, agen mutagenik serta lingkungan kultur
(kondisi kultur) ( Cote et al. 1993; Skirvin et al. 1994). Variasi somaklonal dapat
terjadi pada gen tunggal atau multi gen yang disebabkan adanya perubahan
basa-basa DNA, gen, kromosom atau genom (Orton, 1984)).
Eksplan yang berasal dari bagian tanaman yang mempunyai mata tunas
seperti mata tunas aksilar, apeks dan meristem, kemungkinan terjadinya variasi
lebih kecil dibandingkan eksplan yang tidak mempunyai meristem calon tunas
seperti daun, akar, dan protoplas (Skirvin et al. 1994). Variasi yang muncul pada
meristem tunas atau mata tunas aksilar dapat ditekan karena derajat stabilitasnya
tinggi dan lebih plastis (Rice et al. 1992).
Penggunaan sitokinin dan zat pengatur tumbuh lainnya dalam konsentrasi
tinggi meningkatkan frekuensi tanaman regeneran tumbuh abnormal. Pada
strawberi penggunaan adenin sulfat tanpa sitokinin dapat meningkatkan
kemantapan dan mengurangi munculnya off-type. Off-type mungkin disebabkan
oleh kecepatan multiplikasi yang tinggi pada media yang mengandung BAP (Rice
et al. 1992). Brand dan Kiyomoto (1997) menyarankan dalam kultur jaringan
Rhododendron sebaiknya digunakan sitokinin konsentrasi rendah agar diperoleh
tunas yang vigor dan variasi minimum.
Tipe regenerasi melalui perbanyakan tunas aksilar dapat mengurangi
kemungkinan munculnya variasi somaklonal dibandingkan tipe regenerasi melalui
tunas adventif dan embriogenesis (Karp, 1989). Variasi yang muncul dari mata
tunas aksilar mungkin disebabkan oleh variasi yang sudah ada (pre-existing) atau
induksi sela ma pembentukan kalus. Pada setiap tahap dalam perbanyakan in vitro
sebaiknya dihindari kemungkinan terbentuknya kalus karena kalus sering
berasosiasi dengan variasi somaklonal, dan hubungan antara keduanya sangat
kuat. Munculnya kalus akan merangsang munculnya enzim penginduksi stress
dan produk sampingan khusus (McClintock,1984 dalam Skirvin et al. 1994)
Beberapa kultivar dalam satu spesies tanaman menunjukkan tingkat variasi
yang berbeda. Terdapat kultivar yang menunjukkan variasi yang berlebihan,
kultur pisang rata-rata 3% tetapi pada kultivar Cavendish mencapai 20%. Variasi
yang muncul pada kultur in vitro pisang berupa ukuran tanaman, kelainan bentuk,
ukuran dan tebal daun. Kelainan yang paling sering muncul pada pisang
Cavendish adalah kekerdilan bisa mencapai 70% disusul bentuk dan ukuran buah
(Marie, 1992 dalam Cote et al. 1993). Kelainan yang masih dapat ditoleransi
pada tanaman pisang 3-5% (Cote et al. 1993), sedangkan pada nenas 5% (Smith
dan Drew, 1990).
Subkultur dilakukan untuk meningkatkan kecepatan multiplikasi,
sedangkan umur kultur adalah berapa lama suatu plantlet berada dalam in vitro.
Umur kultur dan frekuensi subkultur yang berlebihan dapat menginduksi variasi
(Skirvin et al. 1994). Fiorino dan Loreti (1987) menyatakan jumlah mata tunas
baru yang terbentuk dari 1 eksplan meningkat sampai subkultur ketiga atau
keempat kemudian stabil. Secara teori subkultur dapat dilakukan terus menerus
tetapi dengan bertambahnya umur kultur maka subkultur menjadi kurang
responsif dan muncul ketidakstabilan genetik. Oleh karena itu untuk
mempertahankan tanaman true to type jumlah subkultur harus dibatasi. Pada
pisang subkultur maksimal 10 kali (Cote et al. 1993).
Mekanisme molekuler penyebab perubahan fenotipe adalah patahnya
kromosom, perubahan basa tunggal, perubahan jumlah sekuen berulang dan
perubahan dalam pola metilasi DNA (Scowcroft dan Larkin, 1988). Amplifikasi
sekuen DNA berulang lebih tinggi dalam kultur sel Nicotiana glauca (Durante
et al. 1983), meningkatnya metilasi DNA dan menurunnya kandungan DNA pada
tanaman regeneran Pisum sativum L. (Cecchini et al. 1991). Perubaha n
kromosom yang umum dijumpai pada variasi somaklonal adalah poliploidi,
aneuploid dan putusnya daerah heterokromatin (Al Zahim et al. 1999).
2.7. Deteksi Variasi Somaklonal
Untuk mengevaluasi variasi somaklonal dengan baik diperlukan beberapa
pendekatan yaitu melalui pengamatan karakter morfologi, sitologi dan molekuler,
karena penggunaan marker molekuler saja tidak efisien. Penilaian keragaman
genetik suatu spesies tanaman secara konvensional berdasarkan perbedaan
dipengaruhi faktor lingkungan. Jika pengaruh lingkungan sangat besar terhadap
induksi keragaman dibandingkan keragaman genetik maka penilaian keragaman
berdasarkan data morfologi tidak mencerminkan tingkat keragaman genetik
diantara aksesi (Yee et al. 1999).
Banyak teknik molekuler telah dikembangkan untuk menilai keragaman
genetik diantaranya analisis isozim dan RAPD. Isozim adalah enzim yang
merupakan produk langsung dari gen, terdiri atas berbagai molekul aktif dengan
struktur kimia berbeda tetapi mengkatalisis reaksi kimia yang sama (Adam, 1983).
Perbedaan suatu sistem enzim dapat dilihat melalui pola pita dengan metode
elektroforesis gel sesudah diwarnai. Perbedaan pola pita tersebut berkaitan
langsung dengan perbedaan bobot dan muatan listrik asam amino penyusun enzim
yang dianalisis. Susunan asam amino yang membentuk macam- macam protein
ini disandikan oleh susunan basa nukleotida dalam DNA yang khas untuk setiap
jenis enzim (Ghesquiere, 1984). Isozim mempunyai kelebihan dibandingkan
pengamatan karakter morfologi yaitu tidak dipengaruhi lingkungan, bersifat
kodominan, membutuhkan sampel sedikit. Kelemahan isozim adalah yang dapat
dideteksi terbatas, tidak dapat mendeteksi perubahan sekuen DNA, dan tidak
merubah sekuen asam amino polipeptida (Roose, 1988).
Random amplified polymorphic DNA (RAPD) adalah amplifikasi fragmen
(potongan) DNA melalui PCR menggunakan primer pendek (Williams et al.
1990). Polimorfisme antar genotipe dapat terdeteksi jika ada mutasi titik atau
inversi pada tempat melekatnya primer dan adanya penyisipan atau delesi dalam
satu fragmen amplifikasi (Debener, 2002). Kelebihan RAPD adalah tidak
dipengaruhi lingkungan, membut uhkan sedikit DNA dengan kemurnian tidak
tinggi, prosedur sederhana, tanpa radioaktif, dapat mendeteksi perubahan basa
tunggal dalam DNA genom jika cukup banyak primer yang digunakan (Deng
et al. 1995). Sementara kelemahan RAPD adalah bersifat dominan sehingga ada
beberapa informasi yang hilang, jumlah polimorfik dan reproduksibilitasnya lebih
rendah (Williams et al. 1990; Koch dan Jung, 1997).
Roose (1988) tidak dapat menggunakan isozim untuk membedakan antar
kultivar citrus sedangkan Deng et al. (1995) dengan menggunakan RAPD dapat
(1995) juga menguji reproduksibilitas RAPD dengan menggunakan DNA yang
berasal dari 3 bahan yaitu kalus embrionik, tanaman di rumah kaca dan di
lapangan, ternyata dari ketiganya didapatkan pola RAPD yang sama. RAPD
dapat digunakan untuk membedakan tanaman Phalaenopsis varian dan tanaman
normal hasil perbanyakan in vitro. Isozim AAT juga dapat digunakan untuk
membedakan tanaman varian dan tanaman mutan sedangkan PGM menghasilkan
pola pita yang sama (Chen et al. 1998).
Analisis RAPD dengan 5 primer terhadap 120 tanaman regeneran dari
tunas adventif in vitro dari eksplan daun genotipe tunggal bit gula didapatkan
0,05% varian, sedangkan terhadap 30 regeneran sekunder terdeteksi 0,01%
varian (Munthali et al. 1996). Shoyama et al. (1997) menyimpulkan bahwa
embriogenesis somatik dapat digunakan untuk perbanyakan klonal tanaman
ginseng berdasarkan analisis terhadap plantlet yang berasal dari embriogenesis
somatik yang diinduksi dari jaringan kalus kuncup bunga ginseng tidak
menunjukkan variasi setelah dianalisis dengan menggunakan 21 primer RAPD.
Mhatre et al. (2002) menganalisis 10 tanaman nenas berduri (normal) dan
10 tanaman tidak berduri dari 900 tanaman regeneran berumur 4-6 minggu dengan
58 primer RAPD. Primer RAPD OPA 02, 03, 04, 06, dan 08 memproduksi pita
polimorfik pada fenotipe berduri sebaliknya OPA 01, 03, 04, 07, 08, dan 09
polimorfik pada fenotipe tidak berduri. Tanaman berduri menghasilkan 1 pita
sedangkan tanaman tidak berduri menghasilkan 2 pita dengan primer OPA 04.
III. PENGARUH TDZ, IAA DAN NAA TERHADAP MULTIPLIKASI DAN KESERAGAMAN KERAGAAN TANAMAN NENAS
KULTIVAR QUEE