ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN
JINTAN HITAM (Nigella sativa L.) SERTA KARAKTERISASI
ISOLAT SECARA SPEKTROFOTOMETRI SINAR
ULTRAVIOLET DAN INFRAMERAH
SKRIPSI
OLEH:
LENI EPITA RAHAYU
NIM 111524036
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN
JINTAN HITAM (Nigella sativa L.) SERTA KARAKTERISASI
ISOLAT SECARA SPEKTROFOTOMETRI SINAR
ULTRAVIOLET DAN INFRAMERAH
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara
OLEH:
LENI EPITA RAHAYU
NIM 111524036
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN
SKRIPSI
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN
JINTAN HITAM (Nigella sativa L.) SERTA KARAKTERISASI
ISOLAT SECARA SPEKTROFOTOMETRI SINAR
ULTRAVIOLET DAN INFRAMERAH
OLEH:
LENI EPITA RAHAYU
NIM 111524036
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 22 Agustus 2013
Pembimbing I, Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. Dr. M. Pandapotan Nasution, M.P.S., Apt. NIP 195709091985112001 NIP 194908111976031001
Pembimbing II, Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra. Aswita Hafni Lubis, M.Si., Apt. Drs. Panal Sitorus, M.Si., Apt. NIP 195304031983032001 NIP 1953103011980031002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, September 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat, hidayah dan anugerah-Nya, sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi ini. Adapun tujuan penelitian ini adalah untuk mengisolasi senyawa alkaloida dari biji tumbuhan jintan hitam (Nigella sativa L.) serta melakukan karakterisasi secara spektrofotometri sinar ultraviolet dan inframerah, yang merupakan salah satu syarat memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Apt., Drs. Panal Sitorus, M.Si., Apt., Drs. Suryadi Achmad, M.Sc., Apt., Ibu Dr. Marline Nainggolan, M.S., Apt., dan ibu Dra. Aswita Hafni Lubis, M.Si., Apt., selaku dosen penguji yang memberikan masukan, kritik, arahan dan saran dalam menyusun skripsi ini. Penulis juga mengucapkan terima kasih kepada teman-teman yang tidak dapat disebutkan namanya satu per satu atas semua motivasinya.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak guna memperbaiki skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khusus bidang farmasi.
Medan, Agustus 2013 Penulis
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN JINTAN HITAM (Nigella sativa L.) SERTA KARAKTERISASI ISOLAT SECARA SPEKTROFOTOMETRI SINAR ULTRAVIOLET DAN INFRAMERAH
ABSTRAK
Jintan hitam (Nigella sativa L.) termasuk suku Ranunculaceae, merupakan salah satu tumbuhan yang mengandung senyawa alkaloida yang digunakan sebagai obat karena mempunyai efek fisiologis yang kuat terutama pada susunan syaraf. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia, skrining fitokimia dan isolasi senyawa alkaloida dari biji jintan hitam. Isolate yang diperoleh dikarakterisasi secara spektrofotometer ultraviolet (UV) dan inframerah (IR).
Ekstraksi dilakukan secara maserasi sebagai pelarut digunakan metanol dan senyawa alkaloida diisolasi dari ekstrak kasar dengan metode pengocokan asam basa, selanjutnya dilakukan pemisahan alkaloida secara KLT preparatif dengan fase gerak kloroform-metanol-amonia (85:15:1). Isolat yang diperoleh akan dikarakterisasi dengan spektrofotometer ultraviolet dan spektrofotometer inframerah. Skrining fitokimia dilakukan terhadap senyawa golongan alkaloida, flavonoida, glikosida, glikosida antrakinon, saponin, tannin dan triterpenoida/steroida.
Hasil karakterisasi simplisia biji jintan hitam adalah kadar air 4,6%, kadar sari yang larut dalam air 22,7%, kadar sari yang larut dalam etanol 23,2%, kadar abu total 4,2%, kadar abu yang tidak larut dalam asam 0,7%. Hasil skrining fitokimia biji jintan hitam mengandung senyawa golongan alkaloida, flavonoida, steroida/triterpenoida, glikosida, tanin dan saponin. Pemisahan dengan KLT preparatif menghasilkan isolat yang mempunyai harga Rf 0,6 memberikan absorbansi maksimum ultraviolet pada panjang gelombang 203 nm. Hasil spektrofotometri IR dari isolat menunjukkan adanya gugus -OH, CH, -CH2, -CH3, C=O, C=C dan C-N.
THE ISOLATION OF ALKALOID COMPOUNDS FROM THE SEEDS OF BLACK CUMIN (Nigella sativa L.) AND CHARACTERIZATION
OF ISOLATE BY ULTRAVIOLET AND INFRARED SPECTROPHOTOMETRIES
ABSTRACT
Black cumin (Nigella sativa L.) belongs to the family Ranunculaceae, it is one of alkaloid containing plant used as a drug due to its strong physiological effects, especially on the nervous system. The purpose of this research was to isolate alkaloidal compound from black cumin seed.
The extraction of seeds was accomplished by maceration with methanol as solvent and alkaloidal compounds were isolated by acid-base shake up method. Separation of alkaloidal compounds into its components were carried out by preparative TLC with chloroform-methanol-ammonium hydroxide (85:15:1) as mobile phase. The isolate was characterized by ultraviolet and infrared spectrophotometries. Phytochemical screening were carried out for the presence of alkaloid, flavonoid, glycoside, anthraquinone glycoside, saponin, tannin and triterpenoi/steroid.
The results of simplex characterization gave water content 4.6%, water soluble extract 22.7%, ethanol soluble extract 23.2%, total ash 4.2% and acid insoluble ash 0.7%. The result of phytochemical screening of black cumin seed gave positive results for the presence of alkaloidal, flavonoid, steroid/triterpenoid, glycoside, tannin, and saponin. The separation of alkaloid by preparative TLC gave an isolate (Rf 0.6). Isolate exhibited an ultraviolet maximum absorption at 203 nm and infrared spectrophotometric measurement indicated the presence of -OH, CH, -CH2, -CH3, C=O, C=C and C-N functional groups.
DAFTAR ISI
Halaman
JUDUL ... i
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xv
DAFTAR TABEL ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Habitat ... 5
2.1.2 Morfologi ... 5
2.1.3 Sistematika tumbuhan ... 6
2.2 Uraian Kimia ... 7
2.2.1 Alkaloida ... 7
2.2.2 Glikosida ... 18
2.2.3 Saponin ... 20
2.2.4 Triterpenoida/steroida ... 21
2.2.5 Flavonoida ... 22
2.2.6 Tanin ... 26
2.3 Ekstraksi ... 27
2.4 Kromatografi ... 29
2.4.1 Kromatografi Lapis Tipis ... 32
2.5 Spektrofotometri Ultraviolet ... 33
2.6 Spektrofotometri Inframerah ... 35
BAB III METODE PENELITIAN ... 39
3.1 Alat ... 39
3.2 Bahan ... 39
3.3 Pembuatan Larutan Pereaksi ... 40
3.3.1 Pereaksi Meyer ... 40
3.3.2 Pereaksi Bouchardat ... 40
3.3.3 Pereaksi Dragendorff ... 40
3.3.4 Pereaksi Liebermann-Burchard ... 41
3.3.5 Pereaksi asam klorida 2 N ... 41
3.3.6 Pereaksi natrium hidroksida 2 N ... 41
3.3.8 Pereaksi Molish ... 41
3.3.9 Pereaksi besi (III) klorida 1% ... 41
3.3.10 Pereaksi timbal (II) asetat 0,4 M ... 41
3.3.11 Pereaksi kloralhidrat ... 41
3.4 Pengambilan dan Pengolahan Simplisia ... 42
3.4.1 Pengambilan dan Pengolahan sampel ... 42
3.4.2 Identifikasi tumbuhan ... 42
3.4.3 Pembuatan simplisia ... 42
3.5 Karakterisasi Simplisia ... 42
3.5.1 Pemeriksaan makroskopik ... 43
3.5.2 Pemeriksaan mikroskopik ... 43
3.5.3 Penetapan kadar abu ... 43
3.5.4 Penetapan kadar abu tidak larut dalam asam ... 43
3.5.5 Penetapan kadar sari yang larut dalam air ... 43
3.5.6 Penetapan kadar sari yang larut dalam etanol ... 44
3.5.7 Penetapan kadar air ... 44
3.6 Skrining Fitokimia ... 45
3.6.1 Pemeriksaan alkaloida ... 45
3.6.2 Pemeriksaan flavonoida ... 45
3.6.3 Pemeriksaan glikosida ... 46
3.6.4 Pemeriksaan glikosida antrakinon ... 47
3.6.5 Pemeriksaan tanin ... 47
3.6.7 Pemeriksaan saponin ... 48
3.7 Pembuatan Ekstrak ... 48
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Metanol dengan Metode Asam Basa ... 49
3.9 Analisis Senyawa Alkaloida Hasil Isolasi Secara KLT ... 50
3.10 Isolasi Senyawa Alkaloida Secara KLT Preparatif ... 50
3.11 Uji Kemurnian Isolat Dengan KLT Dua Arah ... 51
3.12 Karakterisasi Isolat ... 52
3.12.1 Karakterisasi isolat dengan spektrofotometri ultraviolet ... 52
3.12.2 Karakterisasi isolat dengan spektrofotometri inframerah ... 52
BAB IV HASIL DAN PEMBAHASAN ... 53
BAB V KESIMPULAN DAN SARAN ... 59
5.1 Kesimpulan ... 59
5.2 Saran ... 59
DAFTAR PUSTAKA ... 60
DAFTAR GAMBAR
Gambar Halaman
1 Gambar struktur alkaloida vinkristina ... 8
2 Gambar struktur alkaloida reserpina ... 8
3 Gambar struktur alkaloida kolkisina ... 9
4 Gambar struktur alkaloida meskalina ... 9
5 Gambar struktur alkaloida efedrin ... 9
6 Gambar struktur alkaloida golongan purin ... 10
7 Gambar struktur alkaloida kafeina ... 10
8 Gambar struktur alkaloida golongan pirol ... 11
9 Gambar struktur alkaloida golongan pirolidin ... 11
10 Gambar struktur alkaloida higrina ... 11
11 Gambar struktur alkaloida golongan pirolizidina ... 11
12 Gambar struktur alkaloida retronesina ... 11
13 Gambar struktur alkaloida golongan piridina ... 12
14 Gambar struktur alkaloida nikotina ... 12
15 Gambar struktur alkaloida golongan piperidina ... 12
16 Gambar struktur alkaloida koniin ... 12
17 Gambar struktur alkaloida tropan ... 13
18 Gambar struktur alkaloida atropin ... 13
19 Gambar struktur alkaloida golongan isokuinolina ... 13
21 Gambar struktur alkaloida golongan kuinolizidina ... 14
22 Gambar struktur alkaloida sitisina ... 14
23 Gambar struktur alkaloida golongan kuinolina ... 14
24 Gambar struktur alkaloida kuinina ... 14
25 Gambar struktur alkaloida golongan indol ... 15
26 Gambar struktur alkaloida reserpina ... 15
27 Gambar struktur alkaloida golongan aporfina ... 15
28 Gambar struktur alkaloida golongan imidazol ... 16
29 Gambar struktur alkaloida pilokarpina ... 16
30 Gambar struktur alkaloida golongan purina ... 16
31 Gambar struktur alkaloida kafeina ... 16
32 Gambar struktur alkaloida golongan steroida ... 17
33 Gambar struktur alkaloida solanidina ... 17
34 Gambar struktur salisin ... 19
35 Gambar struktur sinigrin ... 19
36 Gambar struktur krotonosida ... 20
37 Gambar struktur barbaloin ... 20
38 Gambar struktur sapogenin steroida ... 21
39 Gambar struktur sapogenin triterpenoida ... 21
40 Gambar struktur squalena ... 22
41 Gambar struktur inti steroida ... 22
42 Gambar struktur flavonoida golongan flavon ... 23
44 Gambar struktur flavonoida golongan isoflavon ... 24
45 Gambar struktur flavonoida golongan flavonon ... 24
46 Gambar struktur flavonoida golongan flavononol ... 24
47 Gambar struktur flavonoida golongan auron ... 25
48 Gambar struktur flavonoida golongan khalkon ... 25
49 Gambar struktur flavonoida golongan katekin ... 25
50 Gambar struktur flavonoida golongan leukoantosianidin ... 25
DAFTAR LAMPIRAN
Lampiran Halaman 1 Hasil Identifikasi tumbuhan jintan hitam ... 64 2 Gambar tumbuhan jintan hitam (Nigella sativa L.) ... 65 3 Gambar makroskopik simplisia biji jintan hitam (Nigellae sativae
semen) ... 66 4 Gambar mikroskopik serbuk simplisia biji jintan hitam (Nigellae
sativae semen) ... 67 5 Perhitungan pemeriksaan karakterisasi serbuk simplisia biji jintan
hitam (Nigellae sativae semen) ... 68 6 Bagan ekstraksi serbuk simplisia biji jintan hitam (Nigellae
sativae semen) secara maserasi ... 73 7 Bagan isolasi alkaloida dari ekstrak metanol dengan metode
pengocokan asam basa ... 74 8 Gambar kromatogram ekstrak kloroform biji jintan hitam
(Nigellae sativae semen) dengan beberapa perbandingan fase gerak kromatografi ... 75 9 Gambar kromatogram isolasi senyawa alkaloida secara KLT
preparatif ... 76 10 Gambar kromatogram KLT satu arah dari isolat dengan fase gerak
yang berbeda ... 77 11 Gambar kromatogram KLT satu arah dari isolat dengan fase gerak
DAFTAR TABEL
Tabel Halaman 1 Hasil pemeriksaan karakterisasi serbuk simplisia biji jintan
hitam ... 40 2 Hasil skrining fitokimia serbuk simplisia dan ekstrak metanol
biji jintan hitam ... 41 3 Data hasil KLT ekstrak alkaloida kasar dari biji jintan hitam .... 43
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN JINTAN HITAM (Nigella sativa L.) SERTA KARAKTERISASI ISOLAT SECARA SPEKTROFOTOMETRI SINAR ULTRAVIOLET DAN INFRAMERAH
ABSTRAK
Jintan hitam (Nigella sativa L.) termasuk suku Ranunculaceae, merupakan salah satu tumbuhan yang mengandung senyawa alkaloida yang digunakan sebagai obat karena mempunyai efek fisiologis yang kuat terutama pada susunan syaraf. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia, skrining fitokimia dan isolasi senyawa alkaloida dari biji jintan hitam. Isolate yang diperoleh dikarakterisasi secara spektrofotometer ultraviolet (UV) dan inframerah (IR).
Ekstraksi dilakukan secara maserasi sebagai pelarut digunakan metanol dan senyawa alkaloida diisolasi dari ekstrak kasar dengan metode pengocokan asam basa, selanjutnya dilakukan pemisahan alkaloida secara KLT preparatif dengan fase gerak kloroform-metanol-amonia (85:15:1). Isolat yang diperoleh akan dikarakterisasi dengan spektrofotometer ultraviolet dan spektrofotometer inframerah. Skrining fitokimia dilakukan terhadap senyawa golongan alkaloida, flavonoida, glikosida, glikosida antrakinon, saponin, tannin dan triterpenoida/steroida.
Hasil karakterisasi simplisia biji jintan hitam adalah kadar air 4,6%, kadar sari yang larut dalam air 22,7%, kadar sari yang larut dalam etanol 23,2%, kadar abu total 4,2%, kadar abu yang tidak larut dalam asam 0,7%. Hasil skrining fitokimia biji jintan hitam mengandung senyawa golongan alkaloida, flavonoida, steroida/triterpenoida, glikosida, tanin dan saponin. Pemisahan dengan KLT preparatif menghasilkan isolat yang mempunyai harga Rf 0,6 memberikan absorbansi maksimum ultraviolet pada panjang gelombang 203 nm. Hasil spektrofotometri IR dari isolat menunjukkan adanya gugus -OH, CH, -CH2, -CH3, C=O, C=C dan C-N.
THE ISOLATION OF ALKALOID COMPOUNDS FROM THE SEEDS OF BLACK CUMIN (Nigella sativa L.) AND CHARACTERIZATION
OF ISOLATE BY ULTRAVIOLET AND INFRARED SPECTROPHOTOMETRIES
ABSTRACT
Black cumin (Nigella sativa L.) belongs to the family Ranunculaceae, it is one of alkaloid containing plant used as a drug due to its strong physiological effects, especially on the nervous system. The purpose of this research was to isolate alkaloidal compound from black cumin seed.
The extraction of seeds was accomplished by maceration with methanol as solvent and alkaloidal compounds were isolated by acid-base shake up method. Separation of alkaloidal compounds into its components were carried out by preparative TLC with chloroform-methanol-ammonium hydroxide (85:15:1) as mobile phase. The isolate was characterized by ultraviolet and infrared spectrophotometries. Phytochemical screening were carried out for the presence of alkaloid, flavonoid, glycoside, anthraquinone glycoside, saponin, tannin and triterpenoi/steroid.
The results of simplex characterization gave water content 4.6%, water soluble extract 22.7%, ethanol soluble extract 23.2%, total ash 4.2% and acid insoluble ash 0.7%. The result of phytochemical screening of black cumin seed gave positive results for the presence of alkaloidal, flavonoid, steroid/triterpenoid, glycoside, tannin, and saponin. The separation of alkaloid by preparative TLC gave an isolate (Rf 0.6). Isolate exhibited an ultraviolet maximum absorption at 203 nm and infrared spectrophotometric measurement indicated the presence of -OH, CH, -CH2, -CH3, C=O, C=C and C-N functional groups.
BAB I
PENDAHULUAN
1.1Latar Belakang
Tumbuhan berkhasiat obat telah banyak diteliti untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada. Penelitian tersebut dilakukan dengan berbagai pendekatan seperti cara empiris, etnobotani dan etnofarmakologi (Suhirman, 2011). Selanjutnya dilakukan upaya untuk pengisolasian senyawa murni dan turunannya sebagai bahan dasar obat modern (Hernani, 2004).
Salah satu tumbuhan berkhasiat yang digunakan sebagai obat adalah jintan hitam (Nigella sativa L.), suku Ranunculaceae. Tumbuhan ini termasuk gulma semusim dan tumbuh di daerah Levant, kawasan Mediterania Timur (Rahmi, 2011). Bagian yang digunakan adalah biji dari jintan hitam yang dapat bermanfaat sebagai antibakteri (Landa, et al., 2009), antihipertensi (Fallah, et al., 2013), antioksidan (El-Dakhakhny, et al., 2002), melancarkan peredaran darah, melegakan pernafasan (Mahendra, 2008), menghambat kanker serviks (Elkady, 2012), menghambat pertumbuhan sel kanker payudara (Ahmad, et al., 2012), meningkatkan daya tahan tubuh (Salem, 2005), meredakan bronkitis dan batuk (El-Tahir dan Ashour, 1993), serta untuk terapi hiperlipidemia (Bahram, et al., 2009).
golongan alkaloida yang berkhasiat obat, efek fisiologis yang kuat terutama pada susunan syaraf pusat (Hasibuan, 2007) menyebabkan senyawa alkaloida sangat bermanfaat dalam pengobatan (Lenny, 2010). Beberapa suku tumbuhan yang terkenal kaya mengandung alkaloida diantaranya adalah Apocynaceae, Leguminosae, Lauraceae, Ranunculaceae, Rutaceae, Papaveraceae, Rubiaceae (Evans, 2009).
Senyawa alkaloida merupakan senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen yang terletak dalam sistem siklik. Menurut Harborne (1987), sebagai basa, alkaloida biasanya diekstraksi dari tumbuhan dengan pelarut alkohol yang bersifat asam lemah kemudian diendapkan dengan amonia pekat. Isolasi dilakukan dengan metode asam basa untuk mendapatkan senyawa alkaloida dari biji jintan hitam. Pemisahan senyawa alkaloida dapat dilakukan dengan kromatografi kolom atau kromatografi lapis tipis perparatif yang dipantau dengan kromatografi lapis tipis menggunakan fase diam dan fase gerak (Gritter dkk, 1991).
1.2Rumusan Masalah
1. Apakah hasil karakterisasi yang diperoleh dari simplisia biji jintan hitam
memenuhi persyaratan Materia Medika Indonesia Jilid III?
2. Apakah senyawa alkaloida pada biji jintan hitam dapat terpisah dengan
sempurna menggunakan metode asam basa dan pemisahannya dilanjutkan
dengan KLT preparatif?
3. Apakah senyawa alkaloida hasil isolasi dapat dikarakterisasi secara
spektrofotometri sinar ultraviolet (UV) dan inframerah (IR)?
1.3Hipotesis
1. Hasil karakterisasi yang diperoleh dari simplisia biji jintan hitam memenuhi
persyaratan Materia Medika Indonesia Jilid III.
2. Senyawa alkaloida yang terdapat pada biji jintan hitam dapat terpisah dengan
sempurna menggunakan metode asam basa dan KLT preparatif.
3. Senyawa alkaloida hasil isolasi dapat dikarakterisasi secara spektrofotometri
sinar UV dan IR?
1.4 Tujuan Penelitian
1. Melakukan karakterisasi simplisia dari biji jintan hitam.
2. Mengetahui golongan senyawa kimia yang terdapat pada biji jintan hitam.
3. Mengisolasi senyawa alkaloida dari biji jintan hitam serta melakukan
karakterisasi senyawa alkaloida hasil isolasi dari biji jintan hitam secara
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Habitat
Tumbuhan jintan hitam (Nigella sativa L.) merupakan salah satu spesies dari genus Nigella yang memiliki kurang lebih 14 spesies tanaman yang termasuk dalam famili Ranunculaceae (Widyaningrum, 2012). Jintan hitam juga dikenal dengan nama daerah jinten hitam pahit, sedangkan nama asingnya black cumin (Inggris), habbatussauda (Arab), kalonji (India) (Mahendra, 2008).
2.1.2 Morfologi
Tanaman jintan hitam merupakan tanaman semak belukar dengan ketinggian 50 cm. Tanaman ini memiliki batang tegak dan berusuk, daunnya berbentuk lanset dan bergaris dengan panjang 1,5 sampai 2 mm. Ujungnya runcing serta memiliki tiga tulang daun yang berbulu (Rahmi, 2011). Bunga jintan hitam memiliki lima buah kelopak bunga yang berbentuk bulat telur, pangkalnya mengecil membentuk sudut yang pendek (Widyaningrum, 2012), ujungnya agak runcing sampai agak tumpul serta memiliki benang sari yang tergolong banyak (Depkes, 1979).
hitam kecoklatan, hitam kelabu sampai hitam, kasar dan berkerut (Widyaningrum, 2012; Depkes, 1979).
2.1.3 Sistematika tumbuhan
Menurut Widyaningrum (2012) tanaman jintan hitam (Nigella sativa L.) diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisio : Magnoliophyta Kelas : Magnoliopsida Ordo : Ranunculales Famili : Ranunculaceae Genus : Nigella
Spesies : Nigella sativa L.
2.1.3 Kandungan kimia
Kandungan kimia biji Nigella sativa L. adalah saponin, polifenol (Hutapea, 1994), alkaloida, steroida dan flavonoida (Liu, et al., 2011). Kandungan kimia lainnya adalah protein, karbohidrat dan asam lemak esensial. Disamping itu terdiri dari asam linoleat, asam oleat, kalsium, kalium, besi, seng, magnesium, selenium, natrium, vitamin A, vitamin B1, vitamin B2,
2.2 Uraian Kimia
2.2.1 Alkaloida
Alkaloida adalah suatu golongan senyawa organik yang terbanyak ditemukan dialam. Hampir seluruh senyawa alkaloida berasal dari tumbuh-tumbuhan yang tersebar luas dalam berbagai jenis tumbuh-tumbuhan. Semua alkaloida mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa dan pada sebagian besar alkaloid atom nitrogen ini merupakan bagian dari cincin heterosiklik (Lenny, 2006). Menurut Harborne, alkaloida adalah senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen yang terletak dalam sistem siklik. Disamping itu alkaloida dapat didefinisikan sebagai suatu senyawa yang mengandung nitrogen, bersifat basa, terdapat pada tanaman dalam jumlah yang relatif kecil dan mempunyai aktivitas farmakologi. Pengertian ini terlalu luas, karena tidak semua senyawa yang mengandung nitrogen merupakan alkaloida. Protein, klorofil, asam amino misalnya bukanlah alkaloida walaupun mengandung nitrogen. Hegnauer memberikan batasan bahwa alkaloida adalah senyawa bersifat toksik yang bekerja terhadap sistem syaraf pusat, bersifat basa, mengandung nitrogen heterosiklik, disintesa dalam tumbuhan dari asam amino atau turunannya dan umumnya tersebar pada tumbuh-tumbuhan (Farnsworth, 1966).
1. Alkaloida Sejati
Alkaloida ini dibentuk atau berasal dari asam amino yang umumnya mempunyai unsur nitrogen yang terikat pada cincin heterosiklik dan kebanyakan bersifat basa seperti vinkristina dan reserpina, kecuali kolkisina yang tidak mempunyai cincin heterosiklik dan tidak bersifat basa.
N O O O O N O O O HN N OH
Gambar 2.1 Struktur alkaloida vinkristina
N H
N
O H3CO
OCH3 OCH3 OCH3 H COOCH3 H H OCH3 O
O
O
O
O N
C
CH3
H3C
H3C
O
H3C
H3C
Gambar 2.3 Struktur alkaloida kolkisina 2. Protoalkaloida
Alkaloida ini dibentuk dari asam amino, tetapi unsur nitrogennya tidak terikat pada cincin heterosiklik dan bersifat basa. Contohnya meskalina dan efedrin.
O
CH3
O CH3
NH2
O
CH3
Gambar 2.4 Struktur alkaloida meskalina
CH3 OH
HN
CH3
3. Pseudoalkaloida
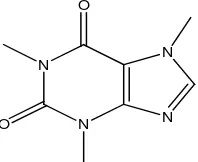
Alkaloid ini merupakan alkaloida bukan turunan asam amino, pada umumnya mempunyai unsur nitrogen yang terikat pada cincin heterosiklik dan biasanya bersifat basa. Alkaloida yang penting dari golongan ini adalah alkaloida golongan purina seperti kafeina.
N
N
N H N
Gambar 2.6 Struktur alkaloida golongan purin
N
N N
N O
O
Gambar 2.7 Struktur alkaloida kafeina
Menurut Evans (2009), pembagian alkaloida berdasarkan letak atom nitrogen adalah:
A. Non heterosiklik atau atipikal alkaloida, disebut juga protoalkaloida atau amin biologis misalnya efedrina yang terdapat dalam Ephedra distachya.
B. Heterosiklik atau tipikal alkaloida yang dibagi kedalam 12 grup berdasarkan struktur cincinnya, yaitu:
H N
Gambar 2.8 Struktur alkaloida golongan pirol
H N
Gambar 2.9 Struktur alkaloida golongan pirolidin
N CH3
H2
C C CH3
O
Gambar 2.10 Struktur alkaloida higrina
2. Alkaloida golongan pirolizidina, contohnya retronesina pada Crotalaria retusa.
N
Gambar 2.11 Struktur alkaloida golongan pirolizidina
N HO
OH
H
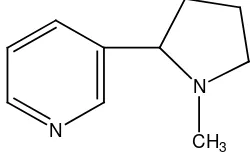
3. Alkaloida golongan piridina dan piperidina, contohnya nikotin pada tumbuhan Nicotiana tabaccum dan koniin pada tumbuhan Conium maculatum.
N
Gambar 2.13 Struktur alkaloida golongan piridina
N
N
[image:30.595.197.322.295.371.2]CH3
Gambar 2.14 Struktur alkaloida nikotina
H N
Gambar 2.15 Struktur alkaloida golongan piperidina
N
H CH2
H2
C
CH3
Gambar 2.16 Struktur alkaloida koniin
Gambar 2.17 Struktur alkaloida tropan
CH3 N OCCH H3C
HO
O
Gambar 2.18 Struktur alkaloida atropin
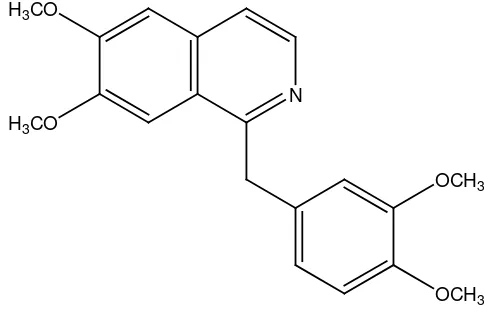
5. Alkaloida isokuinolina, contohnya papaverina pada tumbuhan Papaver somniferum.
[image:31.595.182.429.518.676.2]N
Gambar 2.19 Struktur alkaloida golongan isokuinolina
N
H3CO
H3CO
OCH3
OCH3
6. Alkaloida golongan kuinolizidina, contohnya sitisina pada tumbuhan Cytisus scoparius.
N
Gambar 2.21 Struktur alkaloida golongan kuinolizidina
N H
H NH
[image:32.595.189.322.263.380.2]O
Gambar 2.22 Struktur alkaloida sitisina
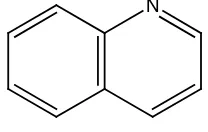
7. Alkaloida golongan kuinolina, contohnya kuinina pada tumbuhan Cinchona ledgeriana.
N
Gambar 2.23 Struktur alkaloida golongan kuinolina
CH HO
N
CH
OH3C
CH2
[image:32.595.215.319.480.546.2]8. Alkaloida golongan indol, contohnya reserpina pada tumbuhan Rauwolfia serpentina.
[image:33.595.209.343.508.657.2]H N
Gambar 2.25 Struktur alkaloida golongan indol
N H
N
O H3CO
OCH3
OCH3
OCH3 H
COOCH3 H
H
OCH3 O
Gambar 2.26 Struktur alkaloida reserpina
9. Alkaloida golongan aporfina, contohnya morfina pada tumbuhan Papaver somniferum.
N
10.Alkaloida golongan imidazol, contohnya pilokarpina pada tumbuhan Pilocarpus jaborandi.
H N
N
Gambar 2.28 Struktur alkaloida golongan imidazol
N N
O
O
CH3
CH3
Gambar 2.29 Struktur alkaloida pilokarpina
11.Alkaloida golongan purina, contohnya kafeina pada tumbuhan Coffea arabica.
N
N
[image:34.595.215.312.494.558.2]N H N
Gambar 2.30 Struktur alkaloida golongan purina
N
N N
N O
O
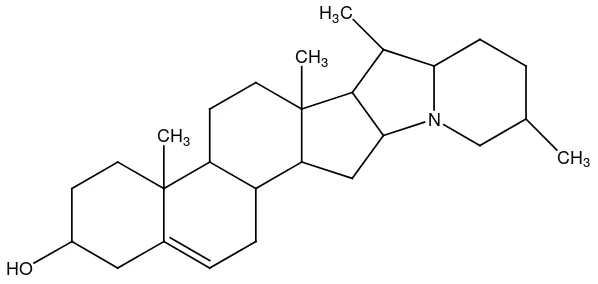
[image:34.595.206.305.613.694.2]12.Alkaloida golongan steroida, contohnya solanidina pada tumbuhan Solanum tuberosum.
Gambar 2.32 Struktur alkaloida golongan steroida
N
HO
CH3
CH3 H3C
CH3
Gambar 2.33 Struktur alkaloida solanidina
[image:35.595.166.465.317.459.2]Alkaloida yang telah diisolasi berbentuk kristal dengan titik lebur tertentu. Beberapa diantaranya berbentuk amorf dan sebagian kecil berbentuk cair seperti nikotina dan koniina. Kebanyakan alkaloida tidak berwarna, tetapi alkaloida yang berstruktur kompleks dan mempunyai ikatan rangkap terkonjugasi kebanyakan berwarna, misalnya: berberina berwarna kuning, betanina berwarna merah. Alkaloida dalam bentuk basa bebas umumnya larut dalam pelarut organik (Cordell, 1981).
Sifat alkaloida yang paling umum adalah basa lemah, kebasaan dari alkaloida ini bergantung pada ketersediaan pasangan elektron sunyi dari nitrogen (Cordell, 1981). Bila gugus fungsi yang berdekatan dengan nitrogen bersifat sebagai penolak elektron, seperti gugus alkali, maka ketersediaan elektron disekitar nitrogen akan bertambah, mengakibatkan alkaloida bersifat lebih basa. Sebaliknya bila gugus fungsi yang melekat pada nitrogen bersifat sebagai penarik elektron, seperti gugus karbonil maka ketersediaan elektron disekitar nitrogen akan berkurang, mengakibatkan alkaloida bersifat netral bahkan sedikit bersifat asam (Lenny, 2006).
2.2.2 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis menghasilkan satu atau lebih gula yang disebut glikon dan bagian bukan gula yang disebut aglikon. Gula yang paling sering dijumpai dalam glikosida adalah glukosa. Glikosida dihidrolisis dengan cara pendidihan dalam asam encer. Secara kimia dan fisiologi, glikosida alam cendrung dibedakan berdasarkan bagian aglikonnya (Robinson, 1995).
Berdasarkan hubungan ikatan antara glikon dan aglikonnya, glikosida dapat dibagi menjadi empat (Farnsworth, 1966) yaitu:
1. O-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom O, contohnya: salisin
CH2OH
O
C6H11O5
Gambar 2.34 Struktur salisin
2. S-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom S, contohnya: sinigrin
CHCH2C
CH
2NOSO
3K
C
6H
11O
5S
3. N-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom N, contohnya: krotonosida
N N
N N NH2
OH
[image:38.595.165.312.162.264.2]C5H9O4
Gambar 2.36 Struktur kronotosida
4. C-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom C, contohnya: barbaloin
OH
H C6H11O5
CH2OH
OH O
Gambar 2.37 Struktur barbaloin
2.2.3 Saponin
[image:38.595.153.320.384.481.2]berdasarkan kemampuannya menghemolisis sel darah dan memberikan reaksi warna yang karakteristik pada uji Liebermann-Burchard (Farnsworth, 1966).
Berdasarkan bagian glikonnya dikenal dua jenis saponin, yaitu saponin steroida dan saponin triterpenoida (Farnsworth, 1966).
O O
HO
CH3
CH3
H3C
[image:39.595.116.434.210.358.2]CH3
Gambar 2.38 Struktur sapogenin steroida
HO
COOH
Gambar 2.39 Struktur sapogenin triterpenoida 2.2.4 Triterpenoida/steroida
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam satuan isopren dan secara biosintesis dibuat dari senyawa
[image:39.595.141.359.393.574.2]Gambar 2.40 Struktur skualena
Steroida merupakan triterpen yang mempunyai inti siklopentano perhidrofenantren (Harborne, 1987). Inti steroida dasar sama dengan inti kolesterol, tetapi pada posisi 10 dan 13 terdapat gugus metal yang terikat pada sistem cincin. Pada umumnya steroida tumbuhan berupa alkohol dengan gugus hidroksil pada C3 sehingga steroida sering juga disebut sterol (Robinson,
1995).
2
3
4 5
1
6 7 8 9
10 11
12
13
14 15
16 17
18 20
19
21 22
23
24
25 26
27
[image:40.595.133.400.455.620.2]2.2.5 Flavonoida
Flavonoida merupakan salah satu metabolit sekunder. Keberadaannya dalam daun kemungkinan dipengaruhi oleh adanya proses fotosintesis sehingga daun muda belum terlalu banyak mengandung flavonoida (Markham, 1988). Senyawa flavonoida mempunyai struktur C6-C3-C6. Tiap bagian C6 merupakan cincin benzena yang dihubungkan oleh atom C3 yang merupakan rantai alifatik (Sastrohamidjojo, 1996; Markham, 1988).
Flavonoida umumnya terdapat dalam tumbuhan terikat pada gula sebagai glikosida. Flavonoida terdapat dalam bentuk bebas maupun terikat sebagai glikosida. Glikosidanya larut dalam air dan etanol tapi tidak larut dalam pelarut organik, sedangkan geninnya (aglikon) tidak larut dalam air tetapi larut dalam pelarut-pelarut organik.
Klasifikasi flavonoida dalam tumbuhan berdasarkan sifat kelarutannya dan reaksi-reaksi warnanya, kemudian dilanjutkan dengan kromatografi kertas satu dimensi dari ekstrak terhidrolisis dan dua dimensi dari ekstrak alkohol langsung. Kerangka dan skema pemberian nomor dan tipe-tipe flavonoiida adalah sebagai berikut:
[image:41.595.151.357.569.695.2]O 1 2 3 4 5 6 7 8 2 3 4 5 6 O
O
O
[image:42.595.151.339.96.203.2]OH
Gambar 2.43 Struktur flavonoida golongan flavonol
O
[image:42.595.151.339.246.341.2]O
Gambar 2.44 Struktur flavonoida golongan isoflavon
O
O
Gambar 2.45 Struktur flavonoida golongan flavonon
O
O
OH
[image:42.595.150.332.386.505.2] [image:42.595.152.336.553.653.2]O
O
[image:43.595.151.368.96.186.2]CH
Gambar 2.47 Struktur flavonoida golongan auron
[image:43.595.151.339.229.334.2]O
Gambar 2.48 Struktur flavonoida golongan khalkon
O
OH OH
OH
OH HO
Gambar 2.49 Struktur flavonoida golongan katekin
O
HO OH
OH
[image:43.595.152.385.376.540.2] [image:43.595.150.328.593.677.2]O+
[image:44.595.115.296.97.170.2]OH
Gambar 2.51 Struktur flavonoida golongan antosianidin
2.2.6 Tanin
Tanin terdapat luas pada tumbuhan berpembuluh, dalam Angiospermae terdapat khusus di jaringan kayu. Tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tidak larut dalam air. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang mentah menjadi kulit siap pakai karena kemampuannya menyambung silang protein (Harbone, 1987).
Secara kimia terdapat dua jenis utama tanin (Harborne, 1987) yaitu : 1. Tanin terkondensasi
Tanin terkondensasi terbentuk dengan cara kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan oligomer yang lebih tinggi. Ikatan karbon-karbon menghubungkan satu satuan flavon dengan satuan berikutnya melalui ikatan 4-8 atau 6-8. Kebanyakan flavolan mempunyai 2-20 satuan flavon. Tanin terkondensasi disebut juga dengan proantosianidin karena bila direaksikan dengan asam panas, beberapa ikatan karbon-karbon penghubung satuan terputus dan dibebaskanlah monomer antosianidin.
2. Tanin terhidrolisis
a. Depsida galoil glukosa
Pada senyawa ini, inti yang berupa glukosa dikelilingi oleh lima gugus ester galoil atau lebih.
b. Dimer asam galat
Inti molekul berupa senyawa dimer asam galat, yaitu asam heksahidroksidifenat yang berikatan dengan glukosa. Tanin terhidrolisis disebut juga elagitanin yang pada hidrolisis menghasilkan asam galat.
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkann ke dalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Depkes, 2000).
Metode ekstraksi dengan menggunakan pelarut ada beberapa cara, yaitu (Depkes, 2000):
1. Cara dingin a. Maserasi
adanya perbedaan konsentrasi antara larutan zat aktif di dalam dan diluar sel maka larutan terpekat didesak keluar. Proses ini berulang sehingga terjadi keseimbangan konsentrasi antara larutan di dalam dan di luar sel.
Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air, etanol, metanol, etanol-air atau pelarut lainnya. Maserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna pada suhu kamar. Proses perkolasi terdiri tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya, terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur yang mencapai titik didihnya, selama waktu tertentu dan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
b. Sokletasi
ekstraksi berulang-ulang dan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi dengan pengadukan yang berulang-ulang pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50°C.
d. Infundasi
Infundasi adalah ekstraksi dengan pelarut air, dilakukan pada suhu 96-98°C selama 15 - 20 menit.
e. Dekoktasi
Dekoktasi adalah infus pada waktu yang lebih lama dan temperatur sampai titik didih air.
2.4 Kromatografi
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari fase diam, yang dapat berupa zat padat atau zat cair. Jika fase diam berupa zat padat disebut kromatografi serapan; jika berupa zat cair disebut kromatografi partisi. Karena fase gerak dapat berupa zat cair atau gas maka terdapat empat macam sistem kromatografi, yaitu:
1. Fase gerak cair-fase diam padat (kromatografi serapan):
− kromatografi lapis tipis
− kromatografi kolom
2. Fase gerak gas-fase diam padat:
− kromatografi gas padat
3. Fase gerak cair-fase diam cair (kromatografi partisi):
− kromatografi kertas
4. Fase gerak gas –fase diam cair:
− kromatografi gas-cair
Pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1991).
2.4.1 Kromatografi lapis tipis
Kromatografi lapis tipis dapat dipakai untuk dua tujuan (Gritter, dkk., 1991) yaitu:
1. Sebagai metode untuk mencapai hasil kualitatif (analitik) dan kuantitatif (preparatif).
2. Untuk mencari sistem pelarut yang akan dipakai dalam kromatografi kolom. Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri atas bahan padat yang dilapiskan pada permukaan penyangga datar yang terbuat dari kaca atau logam. Lapisan melekat pada permukaan dengan bantuan bahan pengikat. Beberapa contoh fase diam yang digunakan untuk pemisahan dalam kromatografi lapis tipis yaitu silika gel, alumina, kieselguhr dan selulosa (Gritter, dkk., 1991).
Pada kromatografi lapis tipis lapisan fase diam harus sesedikit mungkin mengandung air, karena air akan menempati semua titik penyerapan sehingga tidak akan ada senyawa yang melekat. Oleh karena itu, sebelum digunakan plat kromatografi lapis tipis perlu diaktifkan dengan pemanasan pada 1100C selama 30 menit (Gritter, dkk., 1991; Stahl, 1985)
masing-Rf = jarak titik pusat bercak dari titik awal
jarak garis depan fase gerak dari titik awal
masing pelarut sehingga dengan demikian akan diperoleh sistem pengembang yang cocok (Stahl, 1985).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan harga Rf (Stahl, 1985).
Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Harga Rf berada antara 0,00 – 1,00. Harga Rf ini sangat berguna untuk mengindentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut (Sastrohamidjojo, 1991):
1. Struktur kimia senyawa yang dipisahkan 2. Sifat penyerap
3. Tebal dan kerataan lapisan penyerap 4. Pelarut dan derajat kemurniannya
5. Derajat kejenuhan uap pengembang dalam bejana 6. Teknik percobaan
7. Jumlah cuplikan yang digunakan 8. Suhu
2.4.2 KLT Preparatif
pemakaian hanya dalam jumlah milligram. Ukuran pelat yang biasa digunakan yaitu 20 x 20 cm atau 20 x 40 cm. Penjerap yang paling umum ialah silika gel dan dipakai untuk pemisahan senyawa lipofil maupun campuran senyawa hidrofil. Cuplikan sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan pada pelat KLTP dimana konsentrasinya sekitar 5-10%. Penotolan dapat dilakukan dengan tangan (pipet) ataupun dengan penotol otomatis (Hostettmann, 1995).
Pilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai KLT analitik. Karena ukuran partikel penjerap kira-kira sama, pelarut yang dipakai pada KLT analitik dapat dipakai langsung pada KLTP. Kebanyakan penjerap KLTP mengandung indikator fluoresensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Untuk senyawa yang tidak menyerap sinar UV, ada beberapa pilihan :
a. Menyemprot dengan air (misalnya saponin)
b. Menutup pelat dengan sepotong kaca kemudian menyemprot salah satu sisi dengan pereaksi semprot
c. Menambahkan senyawa pembanding (Hostettmann, 1995).
2.5 Spektrofotometri Sinar Ultraviolet
Spektrofotometer UV pada umumnya digunakan untuk:
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa.
3. Mampu menganalisis senyawa organic secara kuantitatif dengan menggunakan hokum Lambert-Beer (Dachriyanus, 2004).
Serapan molekul di dalam daerah ultraviolet bergantung pada struktur elektronik dari molekul. Apabila suatu molekul menyerap radiasi ultraviolet, di dalam molekul tersebut terjadi perpindahan tingkat energi elektron-elektron ikatan pada orbital molekul paling luar dari tingkat energi yang lebih rendah ke tingkat energi yang paling tinggi (Noerdin, 1985).
Spektrum ultraviolet dari suatu senyawa biasanya diperoleh dengan melewatkan cahaya dengan panjang gelombang tertentu (cahaya monokromati) melalui larutan encer senyawa tersebut. Sistem (gugus atom) yang menyebabkan terjadinya absorpsi cahaya disebut kromofor. Kromofor yang
menyebabkan terjadinya transisi σ→σ* ialah senyawa yang mempunyai
elektron pada orbital molekul σ, yaitu molekul organik jenuh yang tidak mempunyai atom dengan pasangan elektron sunyi. Senyawa yang mempunyai
transisi σ→σ* mengabsorpsi cahaya pada panjang gelombang sekitar 150 nm
(Creswell, et al., 1982).
Kromofor yang menyebabkan terjadinya transisi n→σ* ialah senyawa
yang hanya mempunyai orbital molekul n dan σ, yaitu molekul organik jenuh
yang mempunyai satu atau lebih atom dengan pasangan elektron sunyi.
Kromofor yang menyebabkan terjadinya transisi π→π* ialah senyawa yang
transisi n→σ* dan π→π* mengabsorpsi cahaya pada panjang gelombang sekitar 20 nm (Creswell, et al., 1982).
Kromofor yang menyebabkan transisi n→π* ialah senyawa yang mempunyai orbital molekul n maupun π yaitu senyawa yang mengandung atom
yang mempunyai pasangan elektron sunyi dan orbital π. Senyawa yang
mempunyai transisi n→π* mengabsorpsi cahaya yang panjang gelombang 200 -400 nm (Creswell, et al., 1982).
Istilah-istilah yang sering digunakan di dalam membicarakan spektra elektronik yaitu:
Kromofor : Suatu gugus kovalen tidak jenuh yang bertanggung jawab untuk serapan elektronik.
Auksokrom : Suatu gugus jenuh dengan elektron tidak terikat dimana bila menempel kepada suatu kromofor dapat mengubah panjang gelombang dan intensitas serapan.
Pergeseran batokromik : Pergeseran serapan ke panjang gelombang yang lebih panjang karena sisipan atau pengaruh pelarut (geseran merah).
Pergeseran hipsokromik : Pergeseran serapan ke panjang gelombang yang lebih pendek disebabkan substitusi atau pengaruh pelarut (geseran biru).
Efek hiperkromik : Kenaikan dalam intensitas serapan.
Efek hipokromik : Penurunan dalam intensitas serapan (Silverstein, 1986).
2.6 Spektrofotometri Sinar Inframerah
1. Menentukan gugus fungsi suatu senyawa organik
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya.
Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2,5-50 μm atau bilangan gelombang 4000-200 cmˉ1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorbsi inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi. Metoda ini sangat berguna untuk mengidentifikasi senyawa organik dan organometalik.
Jika suatu frekuensi tertentu dari radiasi inframerah dilewatkan pada sampel suatu senyawa organik maka akan terjadi penyerapan frekuensi oleh senyawa tersebut. Detektor yang ditempatkan pada sisi lain dar senyawa akan mendeteksi frekuensi yang dilewatkan pada sampel yang tidak diserap oleh senyawa. Banyaknya frekkuensi yang melewati senyawa (yang tidak diserap) akan diukur sebagai persen transmitan (Dachriyanus, 2004).
Penafsiran spektrum inframerah dari suatu senyawa yang belum diketahui haruslah ditujukan pada penentuan ada atau tidaknya beberapa gugus fungsional utama seperti C=O, O-H, N-H, C-O, C=C, C≡C, C=N, C≡N, dan NO2. Langkah-langkah yang umum dilakukan untuk memeriksa pita-pita yang
penting pada hasil spektrum inframerah (Pavia, et al., 1988): 1. Gugus karbonil
Gugus C=O memberikan puncak yang kuat pada daerah 1820-1660 cm-1. 2. Bila gugus C=O ada, periksalah gugus-gugus berikut (jika C=O tidak ada
langsung ke nomor 3).
Asam : periksalah gugus O-H, merupakan serapan melebar di daerah 3300-2500 cm-1
Amida : periksalah gugus N-H, merupakan serapan medium didaerah 3500 cm-1, kadang-kadang dengan puncak rangkap.
Ester : periksalah gugus C-O, merupakan serapan medium didaerah 1300-1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1.
Aldehida : periksalah gugus C-H, merupakan dua serapan lemah didaerah 2850 dan 2750 cm-1 yaitu disebelah kanan serapan C-H.
Alkohol atau fenol : periksalah gugus O-H, merupakan serapan melebar di daerah 3600-3300 cm-1 yang diikuti adanya serapan C-O di daerah 1300-1000 cm-1.
Amina : periksalah gugus N-H, yaitu serapan medium di daerah 3500 cm-1.
Eter : periksalah gugus C-O (dan tidak adanya O-H), yaitu serapan medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua atau cincin aromatik
− Serapan lemah C=C di daerah 1650 cm-1.
− Serapan medium sampai kuat pada daerah 1650-1450 cm-1sering
menunjukkan adanya cincin aromatik.
− Buktikan kemungkinan di atas dengan memperhatikan serapan pada
daerah C-H aromatik di sebelah kiri 3000 cm-1, sedangkan C-H alifatis terjadi di sebelah kanan daerah tersebut.
5. Ikatan rangkap tiga
− Serapan medium dan tajam dari C≡N di daerah 2250 cm-1.
− Serapan medium dan tajam dari C≡C di daerah 2150 cm-1.
6. Gugus nitro
− Dua serapan yang kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1.
7. Hidrokarbon
− Apabila keenam serapan di atas tidak ada.
− Serapan yang sangat sederhana di daerah 1450 cm-1 (CH2) dan 1375
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental meliputi pengumpulan dan pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis ekstrak dengan kromatografi lapis tipis, isolasi alkaloida dengan metode asam basa, uji kemurnian isolat dan karakterisasi isolat dengan spektrofotometri ultraviolet serta spektrofotometri inframerah.
3.1. Alat-alat Yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas (Iwaki Pyrex), blender (Philips), eksikator, mikroskop (Olympus), neraca analitik (Vibra AJ), neraca kasar (Homeline), oven listrik (Memmert), penangas air, penguap vakum putar (Stuart), seperangkat alat kromatografi lapis tipis, seperangkat alat penentu kadar air (Pyrex), spektrofotometer ultraviolet (Shimadzu), spektrofotometer inframerah (Shimadzu) dan tanur (Nabertherm).
3.2. Bahan-bahan Yang Digunakan
besi (III) klorida, bismuth (III) nitrat, etanol, etilasetat, iodium, isopropanol, kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, n-heksan,
α-naftol, plat pra lapis silika gel 60 F254, raksa (II) klorida, serbuk magnesium,
timbal (II) asetat dan toluena. Selain itu juga digunakan air suling.
3.3 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi asam klorida 2 N, asam sulfat 2 N, Bouchardat, kloralhidrat, Mayer, Molish, natrium hidroksida 2 N, timbal (II) asetat 0,4 M, (Depkes, 1995), besi (III) klorida 10% (Depkes, 1979), Liebermann-Burchard dan Dragendorff (Harborne, 1987).
3.3.1 Pereaksi Mayer
Sebanyak 1,359 gram raksa (II) klorida ditimbang, dilarutkan dalam air suling hingga 60 ml. Pada wadah lain kalium iodida ditimbang sebanyak 5 gram, dilarutkan dalam 10 ml air suling, kemudian keduanya dicampurkan dan ditambahkan air suling hingga 100 ml.
3.3.2 Pereaksi Bouchardat
Sebanyak 4 gram kalium iodida ditimbang, dilarutkan dalam air suling dan sebanyak 2 gram iodium ditimbang, dilarutkan dalam larutan kalium iodida dan dicukupkan dengan air suling hingga 100 ml.
3.3.3 Pereaksi Dragendorff
dilarutkan 6 gram kalium iodida dalam 10 ml air suling. Kemudian kedua larutan dicampurkan dengan 7 ml asam klorida pekat dan 15 ml air suling.
3.3.4 Pereaksi Liebermann-Burchard
Dua puluh bagian asam asetat anhidrida dicampurkan dengan satu bagian asam sulfat pekat.
3.3.5 Pereaksi asam klorida 2 N
Sebanyak 7,293 ml asam klorida pekat ditambahkan air suling hingga 100 ml.
3.3.6 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 gram kristal natrium hidroksida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml.
3.3.7 Pereaksi asam sulfat 2 N
Sebanyak 9,808 ml asam sulfat pekat diencerkan dengan air suling secukupnya hingga volume 100 ml.
3.3.8 Pereaksi Molish
Sebanyak 3 gram α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml.
3.3.9 Pereaksi besi (III) klorida 1%
3.3.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat ditimbang, dilarutkan dalam air suling bebas karbondioksida sehingga diperoleh larutan 100 ml.
3.3.11 Pereaksi kloralhidrat 70%
Sebanyak 18 gram kloralhidrat ditimbang, dilarutkan dalam campuran 20 ml air suling.
3.4 Pengambilan dan Pengolahan Sampel
3.4.1 Pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah biji jintan hitam yang dibeli dari Pasar tradisional Pajak Sore Padang Bulan Kecamatan Medan Baru Medan. Pengambilan sampel dilakukan secara purposif tanpa membandingkan dengan sampel yang sama dari daerah lain.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi LIPI Bogor (hasil identifikasi tumbuhan dapat dilihat pada Lampiran I).
3.4.3 Pembuatan simplisia
3.5 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik simplisia, mikroskopik serbuk simplisia, penetapan kadar abu, penetapan kadar abu tidak larut dalam asam, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol (Depkes, 1995) dan penetapan kadar air (WHO, 1998).
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati bentuk, warna, ukuran dan bau simplisia biji jintan hitam (Nigellae sativae semen). 3.5.2 Pemeriksaan mikroskopik
Pemeriksaan dilakukan terhadap serbuk simplisia. Pada kaca objek diletakkan preparat lalu ditetesi dengan larutan kloralhidrat 70%, ditutup dengan kaca penutup diamati di bawah mikroskop.
3.5.3 Penetapan kadar abu
Sebanyak 2 gram serbuk yang telah digerus ditimbang seksama, dimasukkan ke dalam krus porselen yang telah terlebih dahulu dipijar dan ditara, kemudian diratakan. Lalu krus dipijarkan perlahan-lahan sampai bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara. 3.5.4 Penetapan kadar abu yang tidak larut dalam asam
tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara.
3.5.5 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasarkan rata yang telah ditara. Sisa dipanaskan sampai kering pada suhu 105°C hingga bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.5.6 Penetapan kadar sari larut dalam etanol
Sebanyak 5 gram serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml etanol (95%) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring dengan cepat untuk menghindarkan penguapan dari etanol, sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan sampai kering pada suhu 105oC hingga bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.5.7 Penetapan kadar air
volume air dalam tabung penampung dari alat penentuan kadar air dibaca dengan ketelitian 0,05 ml. Selanjutnya ke dalam labu dimasukkan 5 gram bahan sampel yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluena mulai mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik. Setelah sebagian besar air terdestilasi, kecepatan tetesan dipercepat menjadi 4 tetes untuk tiap detik (dengan cara menaikkan suhu). Setelah volume air tidak bertambah lagi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Volume air dibaca setelah air dan toluena memisah sempurna. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat di dalam bahan yang diperiksa. Kadar air dihitung dalam persen terhadap berat sampel yang telah dikeringkan.
3.6 Skrining Fitokimia
Skrining fitokimia dilakukan berdasarkan Depkes (1995) alkaloida, flavonoida, glikosida, glikosida antrakinon, saponin; Farnsworth (1966) tanin; dan Harborne (1987) triterpenoida/steroida.
3.6.1 Pemeriksaan alkaloida
Sebanyak 0,5 gram serbuk simplisia ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut :
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan di atas.
3.6.2 Pemeriksaan flavonoida
Sebanyak 0,5 gram serbuk simplisia ditimbang, ditambahkan 10 ml metanol, kemudian direfluks selama 10 menit dan disaring panas-panas melalui kertas saring, filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambahkan n-heksan, dikocok hati-hati lalu didiamkan sebentar. Lapisan metanol diambil lalu diuapkan pada temperatur 40°C, sisanya dilarutkan dalam 5 ml etil asetat dan disaring. Filtrat digunakan untuk uji flavonoida dengan cara sebagai berikut:
− Filtrat sebanyak 1 ml diuapkan sampai kering, sisanya dilarutkan dalam 1
ml sampai 2 ml etanol 95% lalu ditambah 0,5 gram serbuk seng dan 2 ml asam klorida 2 N, didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida pekat, jika dalam waktu 2 sampai 5 menit terjadi warna merah intensif menunjukkan adanya flavonoida.
− Filtrat sebanyak 1 ml diuapkan sampai kering, sisanya dilarutkan dalam
3.6.3 Pemeriksaan glikosida
Sebanyak 3 gram serbuk simplisia ditimbang, disari dengan 30 ml campuran dari 7 bagian etanol 95% dan 3 bagian air suling, ditambahkan dengan asam klorida 2 N hingga pH larutan 2, direfluks selama 10 menit, dinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok dan didiamkam selama 5 menit, lalu disaring. Filtrat diekstraksi dengan 20 ml campuran 3 bagian kloroform dan 2 bagian isopropanol, ini dilakukan sebanyak tiga kali. Kumpulan sari diuapkan pada temperatur tidak lebih dari 50°C. sisanya dilarutkan dalam 2 ml metanol. Larutan ini digunakan untuk percobaan berikut: larutan sisa dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisanya ditambahkan 2 ml air dan 5 tetes pereaksi Molish kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung. Jika terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya gula.
3.6.4 Pemeriksaan glikosida antrakinon
3.6.5 Pemeriksaan tanin
Sebanyak 0,5 gram serbuk simplisia ditimbang, disari dengan 10 ml air suling selama 15 menit lalu disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes larutan pereaksi besi (III) klorida 1 %. Apabila terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin.
3.6.6 Pemeriksaan triterpenoida/steroida
Sebanyak 1 gram serbuk simplisia ditimbang, direndam dengan 20 ml n-heksana selama 2 jam kemudian disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisanya ditambahkan pereaksi asam asetat anhidrida 3 tetes dan 3 tetes asam sulfat pekat ( Liebermann-Burchard). Timbulnya warna ungu atau merah yang kemudian berubah menjadi hijau biru menunjukkan adanya triterpenoida/steroida.
3.6.7 Pemeriksaan saponin
Sebanyak 0,5 gram serbuk simplisia ditimbang, dimasukkan dalam tabung reaksi lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, jika terbentuk buih yang stabil selama tidak kurang dari 10 menit setinggi 1-10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih tidak hilang menunjukkan adanya saponin.
3.7 Pembuatan Ekstrak
Cara kerja:
Serbuk simplisia sebanyak 1 kg dimasukkan ke dalam wadah kaca berwarna, lalu ditambahkan pelarut metanol secukupnya sampai serbuk simplisia basah, didiamkan beberapa jam. Setelah itu ditambahkan pelarut metanol sampai bahan tumbuhan terendam sempurna. Maserasi dilakukan selama tiga hari sambil sekali-kali diaduk, kemudian dipisahkan sehingga diperoleh maserat. Ampas bahan tumbuhan ditambahkan pelarut metanol sampai bahan tumbuhan terendam sempurna. Proses maserasi dilakukan tiga kali masing-masing selama tiga hari sambil sekali-kali diaduk. Semua maserat yang diperoleh digabung, kemudian pelarutnya diuapkan dengan bantuan alat rotary evaporator suhu tidak lebih dari 40°C, selanjutnya di Freeze dryer,
hasilnya diperoleh ekstrak kental (Adams, et al., 1970).
Terhadap ekstrak metanol dilakukan skrining fitokimia senyawa alkaloida, flavonoida, glikosida, glikosida antrakinon, tanin, saponin dan steroida/triterpenoida.
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Metanol dengan Metode Asam Basa
Senyawa alkaloida yang terdapat dalam ekstrak metanol diisolasi dengan menggunakan metode pengocokan asam basa sampai diperoleh alkaloida kasar.
Cara kerja:
Kemudian filtrat ini dikocok dengan 100 ml kloroform dalam corong pisah, lapisan air dan lapisan kloroform dipisahkan. Perlakuan dilakukan sebanyak tiga kali. Lapisan kloroform yang diperoleh dikumpulkan dan disaring. Volume kloroform yang diperoleh diuapkan menjadi sepertiganya dengan penguap vakum putar pada suhu tidak lebih dari 40°C. Terhadap fraksi kloroform ditambahkan HCl 2 N sama banyak, dikocok dalam corong pisah, lalu lapisan asam dan lapisan kloroform dipisahkan. Perlakuan dilakukan sebanyak tiga kali. Larutan asam dikumpulkan dan disaring, kemudian dibasakan dengan NH4OH pekat hingga pH 9-10, dikocok dengan 100 ml
kloroform kemudian kedua lapisan dipisahkan. Perlakuan ini dilakukan sebanyak tiga kali, lapisan kloroform dikumpulkan dan diuapkan dengan alat rotary evaporator pada temperatur tidak lebih dari 40°C, hasilnya diperoleh ekstrak kloroform kental (ekstrak alkaloida kasar) (Fergusson, 1956).
3.9 Analisis Senyawa Alkaloida Hasil Isolasi Secara KLT.
Terhadap ekstrak kloroform hasil isolasi dari ekstrak metanol yang diperoleh dilakukan analisa senyawa alkaloida menggunakan KLT dengan fase diam plat pra lapis silika gel 60 F254 dan fase gerak kloroform - metanol-
amonia perbandingan (95 : 5 : 1), (90 : 10 : 1), (85 : 15 : 1), (80 : 20 : 1). (70 : 30 : 1) dan (60 : 40 : 1). Penampak bercak digunakan pereaksi Dragendorff. Cara kerja:
Ekstrak alkaloida kasar ditotolkan pada plat pra lapis silika gel 60 F254
kromatografi yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah elusi selesai plat dikeluarkan dari chamber dan dikeringkan di udara, kemudian plat disemprot dengan larutan penampak bercak Dragendorff. Warna bercak yang terjadi diamati dan dihitung harga Rf-nya (hasil kromatogram ekstrak kasar alkaloida dapat dilihat pada Lampiran 8).
3.10 Isolasi Senyawa Alkaloida Secara KLT Preparatif
Isolasi senyawa alkaloida dilakukan secara KLT preparatif, sebagai fase gerak digunakan kloroform-metanol-amonia (85:15:1) dan sebagai penampak bercak digunakan pereaksi Dragendorff.
Cara kerja:
Ekstrak diencerkan dengan metanol dan ditotolkan pada jarak 2 cm dari tepi bawah plat pra lapis silika gel 60 F254 berukuran 20 x 20 cm yang
3.11 Uji Kemurnian Isolat Dengan KLT Dua Arah
Terhadap isolat hasil isolasi dilakukan uji kemurnian dengan KLT untuk melihat alkaloida menggunakan fase diam plat pra lapis silika gel 60 F254
dengan fase gerak pertama kloroform-metanol-amonia (85:15:1) dan fase gerak kedua kloroform-metanol-amonia (70:30:1). Sebagai penampak bercak digunakan pereaksi Dragendorff.
Cara kerja:
Isolat hasil isolasi ditotolkan pada plat pra lapis silika gel 60 F254 yang
sebelumnya telah diaktifkan, kemudian dimasukkan ke dalam bejana kromatografi dengan fase gerak pertama yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah elusi selesai plat dikeluarkan dari bejana kromatografi, lalu diputar 90° dimasukkan ke dalam bejana kromatografi dengan fase gerak kedua yang telah jenuh dengan uap pengembang, ditutup rapat dan dikeringkan di udara, kemudian plat disemprot dengan larutan penampak bercak Dragendorff. Warna bercak yang terjadi diamati dan dihitung harga Rf-nya.
3.12 Karakterisasi Isolat
Karakterisasi senyawa alkaloida hasil isolasi dilakukan dengan spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
3.12.1 Karakterisasi isolat dengan spektrofotometri ultraviolet
3.12.2 Karakterisasi isolat dengan spektrofotometri inframerah
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi LIPI Bogor, terhadap bahan yang diteliti adalah biji tumbuhan jintan hitam Nigella sativa L. suku Ranunculaceae. Hasilnya dapat dilihat pada Lampiran 1.
[image:73.595.114.499.391.561.2]Hasil pemeriksaan karakterisasi serbuk simplisia yang meliputi kadar abu total, kadar abu yang tidak larut dalam asam, kadar sari larut dalam air, kadar sari larut dalam etanol, kadar air dapat dilihat pada Tabel 1.
Tabel 1. Hasil pemeriksaan karakterisasi serbuk simplisia biji jintan hitam.
No. Pemeriksaan Hasil (%) Persyaratan MMI (%)
1 Kadar abu total 4,2 < 8
2 Kadar abu tidak larut dalam asam 0,7 < 1,3 3 Kadar sari larut dalam air 22,7 > 22 4 Kadar sari larut dalam etanol 23,2 > 18
5 Kadar air 4,6 < 8
dalam air atau etanol. Penetapan kadar air dilakukan berhubungan dengan mutu simplisia agar tidak mudah ditumbuhi mikroorganisme (Ditjen POM, 1995).
Hasil karakterisasi simplisia secara makroskopik yaitu biji berwarna hitam, berbentuk seperti limas ganda dengan ujung meruncing bersudut 3 sampai 4, panjang 1,5-3 mm, lebar lebih kurang 1 mm, kasar, bau khas aromatik, rasa pahit sedikit pedas. Secara mikroskopik terhadap serbuk simplisia biji jintan hitam dijumpai adanya kulit biji berwarna hitam yaitu lapisan penutup pada permukaan biji, epidermis dalam terlihat tangensial, endosperm penuh berisi butir aleuron dan tetes-tetes minyak, berguna sebagai tempat menyimpan cadangan makanan (Depkes, 2008) dan sel parenkim di bawah palisade yang terlihat secara tangensial, hasil ini sesuai dengan yang tertera pada Materia Medika Indonesia Jilid III (1979). Hasilnya dapat dilihat pada Lampiran 4.
Serbuk simplisia biji jintan hitam diekstraksi dengan cara maserasi menggunakan pelarut metanol sehingga diharapkan kandungan senyawa kimia yang terdapat pada biji jintan hitam dapat tersari sempurna. Hasil dari 1 kg serbuk simplisia setelah diuapkan dengan alat rotary evaporator dan di Freeze dryer diperoleh ekstrak metanol (223,5 gram).
Hasil skrining fitokimia serbuk simplisia dan ekstrak metanol biji jintan hitam (Nigellae sativae L.) dapat dilihat pada Tabel 2:
Tabel 2. Hasil skrining fitokimia serbuk simplisia dan ekstrak metanol biji jintan hitam.
No. Pemeriksaan
Hasil
Serbuk simplisia Ekstrak metanol
1 Alkaloida + +
2 Flavonoida + +
3 Glikosida + +
4 Glikosida antrakinon - -
5 Tanin + +
6 Steroida/Triterpenoida + +
7 Saponin + +
Keterangan: + = mengandung golongan senyawa = tidak mengandung golongan senyawa
Menurut Harborne (1987) bahwa penambahan asam pada ekstrak metanol biji jintan hitam dimaksudkan untuk membentuk senyawa alkaloida dalam bentuk garam yang mudah larut dalam air, sedangkan penambahan basa adalah untuk membebaskan kembali alkaloida dari bentuk garam sehingga dengan mudah dapat diekstraksi menggunakan pelarut organik yang sesuai.
bercak larutan Dragendorff. Hasil analisis KLT diperoleh tiga bercak (noda) dengan semua fase gerak, hasilnya dapat dilihat pada Lampiran 8, dan memberikan satu bercak yang positif terhadap alkaloida untuk semua perbandingan fase gerak setelah dilakukan penyemprotan dengan pereaksi Dragendorff (harga Rf dari masing-masing perbandingan fase gerak dapat dilihat pada Tabel 3 dan pola kromatogram dapat dilihat pada Lampiran 8. Tabel 3. Data hasil KLT ekstrak alkaloida kasar dari biji jintan hitam.
No. Perbandingan fase gerak kloroform - metanol - amonia
Harga Rf
Penampak noda Dragendorff
1 60:40:1
70:30:1 80:20