PENDUGAAN KUALITAS EKOSISTEM TERUMBU
KARANG DI KEPULAUAN SERIBU DENGAN
MENGGUNAKAN PROPORSI FORAMINIFERA
BENTIK SEBAGAI BIOINDIKATOR
LUMBAN NAULI LUMBAN TORUAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Pendugaan Kualitas Ekosistem Terumbu Karang di Kepulauan Seribu Dengan Menggunakan Proporsi Foraminifera Bentik Sebagai Bioindikator” adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 12 Desember 2011
ABSTRACT
LUMBAN NAULI LUMBAN TORUAN. The Approximation of Coral Reef Ecosystem Quality in The Seribu Islands Using Benthic Foraminifera Proportion as Bioindicator. Under direction of DEDI SOEDHARMA and KRESNA TRI DEWI.
!" # $
% & '
( ' ) # *
!" # $ + #, # -'./0'1'
#
+ # , 2'1/3'1
#
! * ' !"
# $ #
4 ' ' ' !"
RINGKASAN
LUMBAN NAULI LUMBAN TORUAN. Pendugaan Kualitas Ekosistem Terumbu Karang Di Kepulauan Seribu Dengan Menggunakan Proporsi Foraminifera Bentik sebagai Bioindikator. Dibimbing oleh DEDI SOEDHARMA dan KRESNA TRI DEWI.
Foraminifera bentik merupakan salah satu kelompok organisme yang memiliki asosiasi yang erat dengan terumbu karang, sehingga dapat digunakan sebagai bioindikator untuk menduga kualitas ekosistem terumbu karang. Beberapa penelitian mengenai foraminifera bentik di ekosistem terumbu karang telah dilakukan di Kepulauan Seribu, namun kajian yang secara langsung menghubungkan keberadaan foraminifera bentik dengan eksistensi terumbu karang belum pernah dilakukan di Indonesia. Oleh karena itu penelitian ini dilakukan dengan tujuan 1) mengetahui komposisi dan sebaran foraminifera bentik di ekosistem terumbu karang, 2) menentukan kelompok taksonomi foraminifera sebagai indikator ekosistem terumbu karang, 3) mengkaji hubungan antara FORAM Index (FI) terhadap kondisi ekosistem terumbu karang di sebagian Kepulauan Seribu, 4) membuktikan bahwa aplikasi FORAM Index di wilayah tropis khususnya Kepulauan Seribu dapat digunakan sebagai indikator ekologi dalam menilai kualitas lingkungan ekosistem terumbu karang.
Pulau Karang Bongkok, Pulau Pramuka, dan Pulau Onrust di Kepulauan Seribu dipilih sebagai kajian untuk mencapai tujuan yang dimaksud. Pengukuran suhu air, kecerahan, salinitas, oksigen terlarut, pH, dan kecepatan arus dilakukan secara / . Pengukuran klorofil8a, klorofil8b, klorofil8c, fosfat, nitrat, amonia, dan silikat, serta parameter sedimen yaitu N total, C8organik, dan ukuran butiran dilaksanakan di laboratorium. Contoh air diambil di kolom dekat dasar perairan kecuali pengukuran kecepatan arus dilakukan di kolom permukaan perairan.
Persentase penutupan karang dilakukan dengan menggunakan metode Transek Garis Menyinggung yang dilakukan secara acak pada kedalaman tujuh meter di bawah permukaan laut. Sampel foraminifera diperoleh dengan mengambil sedimen pada dasar perairan dengan kedalaman dari permukaan sedimen sampai 2 cm di bawah permukaan sedimen. Pengambilan sedimen menggunakan sekop dan dimasukkan dalam plastik contoh yang telah diberi label. Peralatan SCUBA digunakan saat melakukan pengukuran persen penutupan substrat dan untuk membantu menyelam saat mengambil contoh air dan sedimen.
Sampel foraminifera dicuci dengan air yang mengalir dalam saringan 0,063 mm, setelah itu dikeringkan menggunakan oven pada suhu 500C selama dua jam. Kemudian foraminifera pada masing8masing sampel dipisahkan dari sedimen pada cawan di bawah mikroskop binokuler. Selanjutnya diambil sebanyak 300 spesimen pada setiap sampel dan diletakkan pada untuk proses identifikasi menggunakan mikroskop binokuler dengan perbesaran 40 kali. Hasil identifikasi foraminifera kemudian diklasifikasikan berdasarkan kelompok fungsional dan dimasukkan ke dalam formula FORAM Index.
mengetahui nilai kesamaan antar stasiun pengamatan berdasarkan variabel penutupan karang keras dan kelimpahan foraminifera bentik.
Kisaran nilai suhu, salinitas, pH, dan DO pada kolom perairan di Pulau Karang Bongkok, Pulau Pramuka, dan Pulau Onrust masih dalam kisaran Baku Mutu Air Laut berdasarkan Kep.Men.LH No.51 Tahun 2004. Nilai turbiditas, kecerahan, nutrien, klorofil, dan C organik serta N total menunjukkan perairan di Pulau Onrust telah tercemar. Hal ini terjadi karena proses sedimentasi dan beban polusi yang tinggi akibat dekatnya area ini dengan Teluk Jakarta yang telah tercemar. Analisis Komponen Utama menunjukkan bahwa Pulau Onrust sangat dipengaruhi konsentrasi klorofil dan hara yang tinggi, substrat berlumpur dan berlempung, serta nilai turbiditas yang tinggi dan tingkat kecerahan yang rendah.
Persentase penutupan karang tertinggi terdapat pada Pulau Karang Bongkok (16,07824,68%) diikuti Pulau Pramuka (2,97814,07%) kemudian Pulau Onrust (0%). Degradasi persentase penutupan karang berkorelasi positif dengan letak pulau kajian terhadap pencemaran akibat tekanan ekologis yang kuat dari Teluk Jakarta, proses sedimentasi, dan tingkat aktivitas manusia.
Foraminifera bentik besar memiliki asosiasi yang kuat terhadap ekosistem terumbu karang. Pada ekosistem terumbu karang yang memiliki persentase penutupan karang yang lebih tinggi akan memiliki jumlah taksa foraminifera yang lebih tinggi dibandingkan ekosistem yang telah mengalami tekanan ekologis. Selain itu ekosistem terumbu karang yang baik pada wilayah oligotrofik akan didominasi oleh kelompok foraminifera yang bersimbiosis dengan mikro alga. Hasil penelitian menunjukkan penurunan jumlah taksa foraminifera dari Pulau Karang Bongkok ke Pulau Pramuka lalu ke Pulau Onrust yang berhadapan dengan Teluk Jakarta. Pulau Onrust yang tidak memiliki terumbu karang didominasi oleh foraminifera jenis oportunis sebagai indikator tingginya konsentrasi nutrien.
Keragaman foraminifera pada Pulau Karang Bongkok (3,8984,17) lebih tinggi dibandingkan pada Pulau Pramuka (3,6484,12), sedangkan keragaman terendah terletak pada Pulau Onrust (3,0183,82). Wilayah yang berdekatan dengan aktivitas daratan dan mengalami tekanan akibat kadar nutrien yang tinggi cenderung menyebabkan nilai keragaman foraminifera menjadi lebih rendah.
Tingginya jumlah individu genus dan ! pada
wilayah dengan persentase penutupan karang keras yang tinggi merupakan indikator kualitas ekosistem terumbu karang yang masih baik. Pada perairan yang tercemar, foraminifera bentik kelompok oportunis akan melimpah sebagai respon terhadap meningkatnya konsentrasi nutrien, sedangkan kelompok simbion alga akan menurun jumlahnya. Modifikasi FI dengan memasukkan jenis
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang8Undang
5
( '
' ' '
6 7 6
#( 5
PENDUGAAN KUALITAS EKOSISTEM TERUMBU
KARANG DI KEPULAUAN SERIBU DENGAN
MENGGUNAKAN PROPORSI FORAMINIFERA
BENTIK SEBAGAI BIOINDIKATOR
LUMBAN NAULI LUMBAN TORUAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pendugaan Kualitas Ekosistem Terumbu Karang Di Kepulauan Seribu Dengan Menggunakan Proporsi Foraminifera Bentik Sebagai Bioindikator
Nama : Lumban Nauli Lumban Toruan
NIM : C551090051
Disetujui
Komisi Pembimbing
Prof.Dr.Ir. Dedi Soedharma, DEA Dra. Kresna Tri Dewi, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Kelautan
Dekan Sekolah Pascasarjana
Dr.Ir. Neviaty P. Zamani, M.Sc Dr.Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Terimakasih kepada Tuhan karena Firman8Nya di Mazmur 104:25 8
“ ' ' '
' / ”8 memberikan inspirasi
kepada penulis untuk berusaha mengeksplorasi sebagian kecil dari binatang renik yang ada di dalam lautan. Atas rahmat8Nya juga penulisan tesis ini dapat diselesaikan. Tema yang telah diajukan sejak Desember 2010 ini berkaitan dengan bioindikator di lingkungan ekosistem terumbu karang, yang pertama kali dipresentasikan dalam Sidang Komisi I tanggal 2 Februari 2011 dan proposalnya disahkan pada tanggal 24 Februari 2011. Pelaksanaan penelitian baik di lapangan maupun di laboratorium dilaksanakan sejak Bulan Maret8September 2011, sedangkan proses penulisan dan perbaikannya dilakukan di sela8sela penelitian sampai setelah ujian tesis. Setelah melalui beberapa konsultasi dan perbaikan penulisan, maka hasil penelitian ini dipresentasikan kembali pada saat Sidang Komisi II dan seminar hasil pada tanggal 17 Oktober 2011 serta pada saat ujian tesis.
Semoga karya ilmiah yang tidak sempurna ini dapat dikritik, diuji kembali baik teori maupun aplikasinya di lapangan, dan bermanfaat.
Bogor, 12 Desember 2011
UCAPAN TERIMAKASIH
Penelitian ini tidak dapat terlaksana dengan baik tanpa bantuan berbagai pihak, oleh karena itu penulis sangat berterimakasih kepada:
1. Bapa, mama, kakak, dan adik8adikku (Lasmaulitua, Bernauli, Daud Yusup, dan Ishak Khatulistiwa: Lumban Toruan) atas segala restu, doa, semangat, dan dukungannya selama penulis melaksanakan studi di IPB.
2. Ketua komisi pembimbing: Prof.Dr.Ir. Dedi Soedharma, DEA yang telah mendukung dan membimbing penulis dengan kehangatan seorang bapak sekaligus pendidik, sehingga penulis mendapatkan banyak ilmu dan dapat menyampaikannya dalam suatu tulisan.
3. Anggota komisi pembimbing: Dra. Kresna Tri Dewi, M.Sc untuk nasehat, teguran, diskusi hangat, dan argumentasinya sehingga tesis ini menjadi lebih berisi melampaui perkiraan penulis pada saat pertama kali topik ini diajukan. 4. Dr. Ir. Neviaty Putri Zamani, M.Sc sebagai penguji tamu pada ujian akhir
tesis, sekaligus sebagai Ketua Program Studi Ilmu Kelautan yang telah memberikan masukan berharga terutama pada kesimpulan dan saran serta semangat, baik pada saat melakukan penelitian maupun pada saat ujian tesis. 5. Dr. Etty Riani, MS sebagai moderator dan penilai saat seminar hasil penelitian
membantu persiapan seminar dengan konsumsinya, Pak Aen yang mau disibukkan membuka pintu Lab. Petrologi dan Mikropaleontologi P3GL8 Bandung dan mau menunggu sampai lewat jam kantor, Prof. Pamela Hallock Muller, Ph.D atas literatur dan komunikasi pribadinya yang mencerahkan, dan Reza, Yayan, Hidayah Hamzah, serta Yuliana Fitri atas bantuan literaturnya. 7. Teman8teman IKL 2009: Achmad Zamroni, Kaharuddin, Khoirol Imam Fatoni
Mardiansyah, Muliari, Anna Ida Sunaryo, Dian Respati Widianari, Emmy Syafitri, Maria Ulfah, dan Yuliana Fitri Syamsuni terutama atas kehadirannya saat seminar hasil penelitian hari Senin tanggal 17 Oktober 2011 pukul 11812 WIB, Reza Cordova, Wahyu A’idin Hidayat yang memonitor dari jarak jauh, Citra Satrya Utama Dewi dan Heidi Retnoningtyas ditengah kesibukannya mengurus bayi, dan Yulianto Sutedja. Terimakasih atas dukungan, semangat, bantuan, canda, SMS, telepon, kerjasama, konflik, dan kebersamaannya. 8. Dikti yang memberikan Beasiswa Pendidikan Pascasarjana (BPPS), Undana
serta Yayasan Toyota dan Astra atas bantuan penelitiannya, dan Program Mitra Bahari8COREMAP II yang memberikan bantuan penulisan tesis.
9. Rekan8rekan Persekutuan Oikumene IPB untuk segala doa dan dukungannya, terutama kepada Yuliana Radja Riwu, Emy Kiha, dan Bu Tirsa yang memberi semangat saat seminar. Teman8teman Tim Pendamping Mahasiswa Katolik IPB untuk doa dan semangatnya, terutama kepada Silvana Fofid (THP’46) sebagai koordinator yang mendukung dari sebelum sampai sesudah seminar. 10. Keluarga Bria di Kupang, NTT: Ibu Maria Ani Safitri, Maria Dolorosa (Oca),
Maria Archancella (Ella), Maria Theresia Avila (Thessa), Johanes Donbosco (Don), dan Maria Demetria (Thya) yang memberi semangat serta doanya sehingga penulis bisa menyelesaikan studi di IPB.
11. Martha Dara Ayuningtyas (Jeng Kenes Skolastika) dan keluarga di Puspa8 Cibinong atas doa, penghiburan, pengertian, pendampingan, dan motivasinya sehingga beban penelitian dan penulisan tesis ini menjadi lebih ringan.
# ' 9
RIWAYAT HIDUP
Penulis yang dilahirkan di Bandung, 10 Februari 1978, merupakan anak kedua dari lima bersaudara dari ayah Drs. L.G.L Toruan dan ibu Dra. Lamria br. Hutauruk. Penulis menyelesaikan pendidikan dari TK Kristen BPPK tahun 1984, SD Kristen BPPK sampai tahun 1988 dan dilanjutkan di SD Katolik Pandu sampai tahun 1990, SMPN 5 tahun 1993, dan SMAN 2 tahun 1996. Seluruh proses pendidikan tersebut dilaksanakan di Bandung. Pada tahun 1997 penulis diterima sebagai mahasiswa di Institut Pertanian Bogor (IPB) pada Jurusan Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan (FPIK). Tahun 2009 penulis melanjutkan studi di Sekolah Pascasarjana pada mayor Ilmu Kelautan di IPB8Jawa Barat yang didanai oleh Dikti melalui BPPS. Selama kuliah sejak S1 dan S2, penulis pernah menjadi asisten mata kuliah Oseanografi Kimia, Planktonologi, Agama Katolik, dan Ekologi Perairan baik untuk mahasiswa program S1 maupun program D3 IPB.
Setelah lulus S1, penulis bekerja di PT. Vena Internet sebagai manajer pemasaran pada tahun 200382004. Pada Bulan Maret tahun 2004 mengikuti
" ) yang diadakan oleh DAAD Jerman dan FPIK8
IPB selama tiga bulan dan mendapatkan dana untuk melakukan penelitian dengan
judul “% 8
" & ( ( ' : ” selama satu tahun. Pada saat yang
bersamaan, penulis bekerja selama satu tahun di FPIK8IPB sampai tahun 2005. Pada tahun 2005, penulis bekerja sebagai dosen pada Sekolah Tinggi Ilmu dan Teknologi Kelautan Nusantara Kupang, NTT. Tahun 2006 sampai sekarang penulis bekerja sebagai dosen di Program Studi Budidaya Perairan, Jurusan Perikanan dan Ilmu Kelautan, Fakultas Pertanian8Universitas Nusa Cendana, Kupang, Nusa Tenggara Timur. Karya ilmiah penulis berjudul “)
8 & ' * ”
telah dipublikasikan pada Jurnal Akuatika Vol.IV No.2 Tahun 2006. Pada tahun 2008 penulis mendapatkan dana Penelitian Dosen Muda (PDM) untuk melakukan penelitian berjudul “& 8
& ' * ”.
Penulis dapat dihubungi pada alamat surat elektronik ( ):
dan serta Lumban
Halaman
1.5 Manfaat Penelitian ... 6
1.6 Kerangka Pemikiran ... 7
2 TINJAUAN PUSTAKA ... 8
2.1 Foraminifera ... 8
2.2 Faktor Lingkungan Yang Mempengaruhi Keberadaan Foraminifera ... 9
2.2.1 Suhu ... 9
2.2.2 Kekeruhan dan Kecerahan ... 10
2.2.3 Kedalaman ... 10
2.2.4 Arus ... 11
2.2.5 Substrat ... 11
2.2.6 Salinitas ... 12
2.2.7 Oksigen Terlarut ... 12
2.2.8 pH ... 13
2.2.9 Nutrien ... 14
2.3 Makanan dan Predator... 14
2.4 Simbiosis Foraminifera Dengan Alga Simbion ... 15
2.5 Asosiasi Foraminifera Dengan Terumbu Karang ... 17
2.6 Aplikasi Foraminifera Sebagai Indikator Lingkungan ... 18
2.7 Konsep Bioindikator Pada Ekosistem Terumbu Karang ... 19
2.8 Indeks FORAM ... 20
3 METODE PENELITIAN ... 22
3.1 Tempat dan Waktu ... 22
3.2 Pengambilan Sampel ... 23
3.2.1 Pengambilan Contoh Air dan Sedimen Untuk Sampel Foraminifera ... 23
3.2.2 Pengukuran dan Analisa Persentase Substrat Perairan ... 23
3.2.3 Pengambilan dan Pengukuran Parameter Perairan ... 23
3.2.4 Penjentikan Foraminifera Bentik... 24
4 HASIL DAN PEMBAHASAN... 27
4.1 Parameter Fisika Kimia Perairan ... 27
4.2 Kondisi Terumbu Karang ... 32
4.3 Sebaran dan Kelimpahan Foraminifera Bentik ... 38
4.3.1 Kelompok Simbion Alga ... 41
4.3.2 Kelompok Oportunis ... 47
4.3.3 Kelompok Heterotrofik ... 49
4.4 Analisa Kesamaan Bray Curtis Pada Foraminifera ... 53
4.5 Keragaman Foraminifera Bentik ... 54
4.6 Aplikasi FORAM Index Pada Ekosistem Terumbu Karang ... 57
5 SIMPULAN DAN SARAN... 67
5.1 SIMPULAN ... 67
5.2 SARAN... 67
DAFTAR PUSTAKA... 68
DAFTAR TABEL
Halaman
1 Penggolongan tingkat trofik berdasarkan keping (meter) ... 10
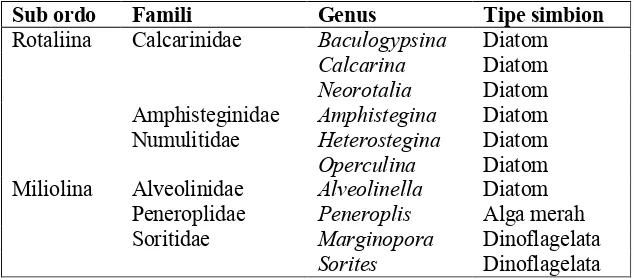
2 Taksa foraminifera dengan tipe simbion (Utchike dan Nobes, 2008) ... 16
3 Parameter perairan yang diukur ... 24
DAFTAR GAMBAR
Halaman 1 Kerangka pemikiran ... 7 2 Lokasi penelitian ...22 3a Parameter lingkungan perairan ...28 3b Parameter lingkungan perairan...29 3c Parameter lingkungan perairan ...30 4 Pengelompokan stasiun berdasarkan parameter fisika8kimia perairan ...31 5 Nilai AKU dari sebaran parameter fisika8kimia terhadap lokasi
penelitian ...31 6 Perbandingan persen penutupan dan jumlah genus karang keras ...33 7 Komposisi penutupan substrat...34 8 Pengelompokan stasiun berdasarkan penutupan karang keras ...35 9. Jumlah taksa foraminifera bentik ...39 10 Komposisi relatif kelompok fungsional foraminifera bentik...40 11 Komposisi relatif foraminifera bentik predominan ...40 12 Jumlah individu taksa foraminifera bentik predominan ...42 13 Pengelompokan stasiun berdasarkan kelimpahan relatif 13 taksa
predominan foraminifera bentik...53 14 Indeks keragaman (H’) foraminifera bentik...55 15 Sebaran persentase terumbu karang (%TK), jumlah taksa terumbu
karang (Taksa TK), FI, dan keragaman foraminifera bentik (H’) ...58 16 Sebaran spesies pada Famili Calcarinidae pada setiap stasiun ...60 17 Sebaran FI modifikasi (FIm), FI, keragaman foraminifera bentik (H’),
dan persentase terumbu karang (%TK) ...62 18 Hubungan antara a) persentase penutupan terumbu karang (%TK) dan
FI, dan b) FI dan keragaman foraminifera bentik (H’)...64 19 Hubungan antara a) persentase penutupan terumbu karang (%TK) dan
DAFTAR LAMPIRAN
Halaman 1 Lokasi penelitian... 79 2 Perhitungan yang digunakan dalam penelitian ... 79 3 Parameter lingkungan perairan... 83 4 Persentase penutupan terumbu karang dan biota serta substrat ... 84 5 Daftar spesies karang yang ditemukan di Teluk Jakarta pada tahun
1920, namun tidak ditemukan pada tahun 2005 baik di Teluk Jakarta
1.1 Latar Belakang
Ekosistem terumbu karang merupakan salah satu ekosistem pesisir dengan biodiversitas yang tinggi. Keunikan ekosistem serta keragaman organismenya menjadikan ekosistem terumbu karang memiliki nilai ekonomi, ekologi, bahkan sosial yang tinggi. Beragam kegiatan dari pariwisata, olahraga selam, aktivitas perikanan, perhubungan, industri, sampai pendidikan dan penelitian sering dilakukan pada ekosistem terumbu karang. Secara ekologis, keberadaan ekosistem ini merupakan salah satu tempat pemijahan, pembesaran, serta penyedia pakan bagi organisme laut. Ekosistem ini juga dapat menjaga stabilitas pantai dari terpaan gelombang.
Meski ekosistem terumbu karang memiliki beragam fungsi, namun rentan terhadap degradasi lingkungan akibat dampak antropogenik. Dampak ini terjadi akibat eksploitasi manusia terhadap sumberdaya tanpa memperhitungkan daya dukung lingkungannya. Sukmara . (2001) mengemukakan bahwa jenis ancaman terhadap terumbu karang akibat aktivitas manusia melebihi ancaman karena pengaruh alami.
Ekosistem terumbu karang di wilayah Kepulauan Seribu memiliki sumberdaya alam yang sangat menarik bagi beragam aktivitas perairan. Kepulauan Seribu umumnya memiliki tiga ekosistem pesisir tropis yang lengkap sebagai ciri khas ekosistem pesisir tropis, sehingga keragaman organisme pada ekosistem terumbu karang menjadi tinggi dan akhirnya memiliki potensi yang tinggi pula baik secara ekonomi, ekologi, maupun sebagai kajian penelitian.
selatan yang berdekatan dengan Teluk Jakarta. Degradasi lingkungan pada wilayah ini akan berpengaruh terhadap eksistensi berbagai ekosistem lain beserta organisme yang berasosiasi. Kondisi tersebut akan mempengaruhi kehidupan manusia itu sendiri seperti abrasi yang terjadi di beberapa wilayah utara Jakarta dan Banten, intrusi air laut, serta berkurangnya ikan sebagai salah satu bahan pangan.
Untuk menjembatani kepentingan ekologi dan ekonomi tersebut, maka telah banyak dibuat peraturan yang salah satu diantaranya berkaitan dengan hasil pemantauan lingkungan yang berkesinambungan. Pemantauan lingkungan perairan merupakan salah satu upaya untuk mendeteksi secara dini terjadinya kerusakan ekosistem perairan seperti terumbu karang, yang merupakan hal penting dalam strategi pengelolaan lingkungan pesisir (Setiapermana ., 1994). Dari sisi ekologi, degradasi ekosistem dapat diduga dengan melihat tekanan pada komunitas biologi yang terkandung di dalamnya (Cervetto ., 2002). Fluktuasi kelimpahan organisme tertentu yang tajam, invasi spesies asing, dan keragaman jenis yang rendah dapat menunjukkan kualitas perairan yang memburuk. Kesimpulan yang sah bisa diperoleh dengan mengkorelasikan faktor biologis dan beberapa faktor fisika8kimia kunci sebagai pendukung.
Beberapa organisme perairan dapat dijadikan sebagai indikator kualitas ekosistem terumbu karang, sehingga dapat disebut sebagai bioindikator. Beberapa bioindikator yang digunakan di ekosistem terumbu karang pada wilayah Indonesia adalah komposisi dan kelimpahan ikan karang serta luasan tutupan karang. Organisme renik seperti foraminifera bentik selama ini telah dijadikan sebagai bagian dari pemantauan ekosistem terumbu karang di mancanegara.
salah satu bagian dari pemantauan kondisi terumbu karang ( ( "
" ( ) sejak tahun 2008 (Schaffelke ., 2008). Penggunaan
foraminifera seperti tersebut di atas belum dilakukan di Indonesia, namun sudah diterapkan oleh Dewi . (2010), Natsir (2010, 2011), dan (Natsir dan Subkhan, 2011) untuk mendapatkan nilai indeks foraminifera. Hal ini disebabkan karena para ahli foraminifera lebih fokus bergelut pada penelitian yang berkaitan dengan taksonomi, (paleo)ekologi, (paleo)klimatologi, dan lain8lain sesuai dengan tugas dan fungsinya di instansi masing8masing.
Foraminifera merupakan salah satu kelompok organisme yang bersimbiosis dan memiliki asosiasi yang sangat erat dengan terumbu karang. Nybakken dan Bertness (2006) menyatakan keberadaan foraminifera bentik dapat meningkatkan proses kalsifikasi terumbu karang antara 20 sampai 40 kali dibandingkan dengan yang tidak berasosiasi dengan foraminifera bentik tersebut. Oleh karena asosiasinya yang kuat, maka foraminifera bentik dapat dijadikan sebagai indikator kualitas ekosistem terumbu karang.
Berkaitan dengan siklus hidupnya yang singkat serta pola adaptasinya, fauna renik seperti foraminifera bentik dapat segera merespon perubahan lingkungan (Day ., 1989), oleh karena itu organisme ini sangat meyakinkan dalam penggunaannya untuk menilai kondisi lingkungan perairan. Perubahan yang mencolok dari eksistensi foraminifera dapat digunakan sebagai indikator ekologi untuk menduga kualitas ekosistem terumbu karang.
! " # $(FORAM Index/FI)
yang sehat. Penggunaan foraminifera bentik sebagai bioindikator ekosistem terumbu karang direkomendasikan dengan prioritas yang tinggi dalam kerangka program monitoring jangka panjang dan monitoring jangka pendek seperti analisa dampak lingkungan (Cooper ., 2009).
1.2 Permasalahan
Ekosistem terumbu karang merupakan salah satu ekosistem yang terancam akibat pemanfaatan yang tidak mempertimbangkan keseimbangan ekologis. Dalam rangka pengelolaan yang bertanggung jawab, pemantauan yang berkesinambungan merupakan langkah awal untuk mendeteksi perubahan ekosistem tersebut. Beragam metoda telah dikembangkan untuk memantau kondisi kualitas ekosistem terumbu karang baik melibatkan analisa fisika8kimia perairan, organisme makro, maupun organisme mikro. Pemantauan juga dilakukan dari tingkat genetik, populasi, sampai komunitas. Selama ini penggunaan organisme makro yang didukung dengan analisa fisika8kimia perairan merupakan metoda yang sering digunakan karena dianggap cukup mudah, murah, dan ramah lingkungan.
Dewi (2010) menuliskan beberapa metoda yang menggunakan bioindikator sebagai bagian dari pemantauan terumbu karang antara lain indeks penutupan karang, indeks kematian karang, indeks keanekaragaman ikan dan biota indikator yang berasosiasi dengan terumbu karang seperti ikan kepe8kepe ( ). Metoda tersebut melibatkan organisme makro sebagai objek pemantauan karena organisme makro umumnya mudah untuk diamati dengan jumlah individu yang lebih sedikit dibandingkan organisme renik. Pada organisme mikro, perubahan lingkungan akan segera mempengaruhi pola kehidupannya dibandingkan organisme makro, namun pengaruh lingkungan tersebut lebih lama mempengaruhi eksistensi organisme renik tersebut dibandingkan parameter fisika dan kimia. Oleh karena itu keberadaan organisme renik dapat dijadikan alternatif sebagai indikator awal atas degradasi lingkungan, contohnya adalah foraminfera.
sampling yang tidak terlalu mahal dan mudah digunakan dibandingkan parameter fisika – kimia (Gibson ., 1997 Porto Neto, 2003), c). alat dan bahan yang tidak terlalu banyak serta cukup mudah diperoleh.
Penelitian tentang foraminifera bentik sebagai bioindikator ekosistem terumbu karang di manca negara telah dilakukan jauh sebelum tahun 2003 sampai tahun 2011 (Hallock ., 2003, Velásquez ., 2011). Meski demikian, Hallock (2003) menyarankan agar keberhasilan menjadikan foraminifera sebagai bioindikator ekosistem terumbu karang yang telah dilakukan di wilayah Karibia dan beberapa lokasi lain perlu diverifikasi di wilayah lainnya terutama di wilayah Indo8Pasifik. Korelasi antara kuantifikasi foraminifera bentik dan parameter fisika8kimia perairan yang dibandingkan dengan kondisi terumbu karang belum pernah dilakukan secara bersamaan di Indonesia. Berdasarkan uraian tersebut maka permasalahan yang akan dijawab dalam penelitian ini adalah 1. bagaimana hubungan antara kondisi terumbu karang serta parameter fisika8
kimia terhadap proporsi kelimpahan foraminifera bentik?
2. apakah kuantifikasi foraminifera bentik yang dirumuskan dalam FORAM Index dapat digunakan sebagai bioindikator ekosistem terumbu karang di Kepulauan Seribu?
1.3 Hipotesis
Hipotesis penelitian ini adalah jumlah taksa foraminifera bentik, kelimpahan relatif foraminifera yang bersimbiosis dengan alga, dan nilai FORAM Index akan meningkat seiring tingginya persentase penutupan terumbu karang hidup. Kondisi ini merupakan cerminan dari kualitas abiotik perairan yang mendukung pertumbuhan terumbu karang.
1.4 Tujuan
Tujuan dari penelitian ini adalah:
1. mengetahui komposisi dan sebaran foraminifera bentik di ekosistem terumbu karang
3. mengkaji hubungan antara FORAM Index terhadap kondisi ekosistem terumbu karang di beberapa pulau di Kepulauan Seribu.
4. membuktikan bahwa aplikasi FORAM Index di wilayah tropis khususnya Kepulauan Seribu dapat digunakan sebagai indikator ekologi dalam menilai kualitas lingkungan ekosistem terumbu karang.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah:
a. memberikan dan menambah pengetahuan dinamika foraminifera di wilayah tropis, khususnya di Kepulauan Seribu,
b. sebagai dasar untuk penelitian foraminifera yang lebih kompleks di masa datang,
c. foraminifera sebagai indikator ekologi dapat digunakan untuk penilaian cepat ( ), murah, dan sebagai pelengkap dari penelitian lain yang berkaitan terhadap perubahan awal lingkungan perairan, sehingga dapat mengurangi penggunaan parameter fisika dan kimia,
d. aplikasi pengamatan foraminifera dapat digunakan bila terdapat keterbatasan alat dan bahan untuk analisa parameter fisika dan kimia untuk menduga tekanan terhadap lingkungan ekosistem terumbu karang,
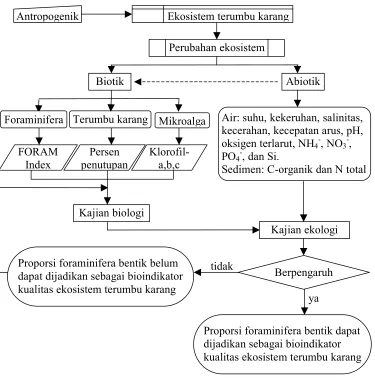
1.6 Kerangka Pemikiran
Gambar 1 memberikan skema kerangka pemikiran yang mendasari penelitian.
Gambar 1 Kerangka pemikiran. Ekosistem terumbu karang Antropogenik
Perubahan ekosistem
Biotik Abiotik
Kajian biologi
Kajian ekologi
Berpengaruh
Proporsi foraminifera bentik dapat dijadikan sebagai bioindikator kualitas ekosistem terumbu karang Proporsi foraminifera bentik belum
dapat dijadikan sebagai bioindikator kualitas ekosistem terumbu karang
tidak
ya Mikroalga
Terumbu karang
Foraminifera Air: suhu, kekeruhan, salinitas,
kecerahan, kecepatan arus, pH, oksigen terlarut, NH48, NO38,
PO48, dan Si.
Sedimen: C8organik dan N total Persen
penutupan FORAM
Index
2.1 Foraminifera
Foraminifera adalah organisme bersel tunggal (uniseluler) yang hidup secara akuatik, memiliki satu atau lebih kamar yang terpisah satu sama lain oleh sekat (septa) yang ditembusi oleh banyak lubang halus (foramen) (Pringgoprawiro dan Kapid, 2000). Nybakken dan Bertness (2006) menambahkan bahwa organisme ini merupakan fauna renik laut yang memproduksi cangkang yang mengandung kalsium karbonat.
Foraminifera merupakan fauna mikroskopis yang telah ada sejak jaman Kambrium (5008570 juta tahun lalu) (Boudagher8Fadel, 2008). Meskipun diduga memiliki sekitar 27.000 spesies dan lebih dari 100 famili (Haq dan Boersma, 1998), namun foraminifera modern hanya memiliki sekitar 10.000 spesies dalam 26 famili, dimana jumlah foraminifera plankton sekitar 40850 jenis (Sen Gupta, 2003a). Identifikasi dan klasifikasi foraminifera didasarkan pada ciri8ciri cangkang seperti struktur dan komposisi, bentuk dan susunan kamar, apertur, dan ornamentasi (Brasier, 1980). Berdasarkan hasil kompilasi, maka klasifikasi foraminifera modern menurut Sen Gupta (2003b) adalah sebagai berikut:
Kingdom: Protoctista
Filum : Granuloreticulosea Kelas: Foraminifera
Ordo: terdiri dari 16 ordo antara lain Miliolida dan Rotaliida beranggotakan beberapa genera yang hidup di sekitar lingkungan terumbu karang. Foraminifera umumnya berukuran mikroskopik dengan ukuran antara sekitar 30 Nm – 1 mm (Chester, 1990). Alat gerak yang digunakan umumnya adalah pseudopodia. Cangkang pada foraminifera cukup keras dan umumnya terdiri dari CaCO3 ( /gampingan) atau butiran pasir
( /agglutinin) yang melekat pada tubuhnya (Boltovskoy dan Wright, 1976).
pembelahan aseksual yang dilakukan jenis bentonik. Reproduksi pada foraminifera besar umumnya aseksual (Murray, 2006).
Hanya sebagian kecil dari foraminifera yang bersifat planktonik, sebagian besar bersifat bentik yang tinggal di dasar perairan (Boltovskoy dan Wright, 1976). Beberapa jenis dapat berpenetrasi ke bagian bawah sedimen sampai sejauh 60 cm, meskipun pada umumnya penetrasi hanya sampai beberapa sentimeter di bawah permukaan sedimen dimana jumlah tertinggi ditemukan pada kedalaman 1 cm di bawah permukaan sedimen (Murray, 2006). Foraminifera bentik memiliki ukuran yang lebih besar dan duri yang lebih keras dibandingkan jenis planktonik. Secara taksonomi, keragaman foraminifera bentik lebih tinggi dibandingkan jenis planktonik, namun jumlah individu per jenis lebih kecil (Boltovskoy dan Wright, 1976). Jenis bentik dapat dibagi dalam dua kelompok yaitu kelompok yang bergerak bebas di substrat dan yang menempel pada sedimen atau vegetasi dasar.
Foraminifera besar yang umumnya memiliki diameter cangkang yang lebih besar dari 2 mm, banyak terdistribusi pada perairan tropis yang dangkal dan mengandung endosimbion. Secara distribusi mikro, pola distribusi pada foraminifera bentik biasanya mengelompok, bukan acak maupun seragam. Hal ini terjadi karena efek dari kondisi lingkungan secara skala mikro seperti kompetisi interspesifik dan proses reproduksinya. Pada skala global, suhu perairan, kandungan nutrien, intensitas cahaya, dan energi hidrodinamik mempengaruhi penyebaran foraminifera. Daerah Indo8Pasifik seperti Indonesia memiliki kandungan dan keragaman foraminifera yang tinggi (Murray, 2006).
2.2 Faktor Lingkungan Yang Mempengaruhi Keberadaan Foraminifera
2.2.1 Suhu
2.2.2 Kekeruhan dan Kecerahan
Kekeruhan yang tinggi menyebabkan fitoplankton yang berada dalam kolom perairan yang lebih dalam tidak dapat melakukan fotosintesis dengan efektif, sehingga pasokan makanan untuk foraminifera menjadi berkurang (Boltovskoy dan Wright, 1976). Kekeruhan yang berlebihan memberikan dampak yang merugikan bagi foraminifera karena jumlahnya akan berkurang baik karena mati atau tidak terjadi regenerasi (Pringgoprawiro dan Kapid, 2000). Hasil penelitian Adisaputra dan Rostyati (2009) di Delta Mahakam, Kalimantan Timur menunjukkan pada perairan yang jernih, foraminifera bentik yang dominan adalah
! . Pada wilayah tersebut jenis ini umumnya berasosiasi dengan terumbu karang yang turbulensi arusnya rendah.
Aktivitas fotosintetik dari kolom permukaan sampai suatu kedalaman ekuivalen dengan dua setengah kali kedalaman dimana keping tidak lagi terlihat (Boltovskoy dan Wright, 1976). Henderson (1987) dalam Garno (2000) menggolongkan tingkat trofik berdasarkan kedalaman keping sebagai fungsi dari visibilitas perairan sebagaimana yang tertera pada Tabel 1.
Tabel 1 Penggolongan tingkat trofik berdasarkan keping (meter) No Trofik Rata – rata keping Maksimal tahunan keping
1. Ultra oligotrofik ≥12 ≥6,0
2. Oligotrofik ≥6,0 3,0 – 6,0
3. Mesotrofik 3,0 – 6,0 1,5 – 3,0
4. Eutrofik 1,5 – 3,0 0,7 – 1,5
5. Hipereutrofik < 1,5 <0,7
2.2.3 Kedalaman
Kedalaman mempengaruhi variasi spesies dan besarnya cangkang. Pada laut yang dangkal umumnya variasi jumlah spesies dan individunya lebih besar dibanding perairan dalam. Jenis8jenis cangkang gampingan akan semakin banyak dan cangkang aglutinin tidak terlalu melimpah pada zona perairan dangkal ini (Pringgoprawiro dan Kapid, 2000).
oksigen, dan karbon dioksida dapat membatasi pertumbuhan dan perkembangan foraminifera (Funnel Murray, 1973 Rositasari, 1989 dan Renema, 2008 ).
2.2.4 Arus
Keberadaan arus memiliki sisi yang menguntungkan dan merugikan bagi foraminifera. Faktor yang menguntungkan dari keberadaan arus akan menyebabkan sebaran suhu dan salinitas menjadi merata dalam suatu lokasi, membawa makanan dan mentranspor oksigen terlarut yang dibutuhkan oleh foraminifera, serta sebaran jenis8jenis foraminifera juga akan lebih luas. Sebaliknya arus turbulen pada zona perairan yang dangkal dapat menyebabkan kekeruhan yang merugikan foraminifera (Pringgoprawiro dan Kapid, 2000). Pada wilayah terumbu karang, pengaruh arus dan gelombang dapat memindahkan komunitas foraminifera besar. Foraminifera tersebut akan mengikatkan dirinya ke substrat menggunakan pseudopodia atau perluasan protoplasmik untuk mencegah perpindahan tubuhnya (Murray, 2006).
2.2.5 Substrat
Semua foraminifera bentik besar merupakan epifauna yang tinggal pada substrat keras seperti patahan karang dan beberapa adalah epifit pada lamun dan alga berkapur. Sedimen yang lembut menyediakan ruang tiga dimensi bagi kehidupan foraminifera epifauna dan infauna (Murray, 2006). Pada saat hidup, pseudopodia foraminifera cenderung akan menancapkan cangkang ke dalam sedimen sehingga mencegah terjadinya erosi pada substrat (Boltovskoy dan Wright, 1976).
Tekstur dan kandungan kimia substrat mempengaruhi distribusi dan morfologi foraminifera bentik. Foraminifera dengan bentuk agglutinin memiliki kertekaitan yang lebih kuat dengan kondisi substrat dasar karena banyak material cangkang agglutinin berasal dari dasar dibandingkan jenis gampingan yang mensekresikan cangkangnya secara kimia (Boltovskoy dan Wright, 1976).
(0,12580,250 mm) yang mengandung moluska dan detritus alga ditemukan populasi foraminifera litoral yang tinggi, namun populasi yang lebih kaya terdapat pada zona alga berkapur yang masih hidup. Pada zona yang dipengaruhi pasir kasar (0,581 mm) didominasi oleh jenis gampingan. Pada sedimen tipe pasir kasar umumnya didominasi foraminifera yang berdinding tebal sedangkan yang berdinding tipis terdapat pada zona sedimen yang bertipe butiran halus (Boltovskoy dan Wright, 1976).
2.2.6 Salinitas
Foraminifera dapat hidup pada perairan dengan kisaran salinitas 0870 tergantung jenisnya, namun jumlah dan keragaman tertinggi ditemukan pada kisaran salinitas 32837, sedangkan pada salinitas 10812, sel foraminifera tidak dapat berfungsi dengan baik (Murray, 2006) bahkan dapat menyebabkan kematian (Pringgoprawiro dan Kapid, 2000). Umumnya foraminifera bentik merupakan fauna stenohalin (Rositasari, 1989) meskipun kisarannya masih lebih lebar dibandingkan foraminifera planktonik (Boltovskoy dan Wright, 1976), namun beberapa jenis lainnya seperti ! memiliki toleransi salinitas yang tinggi yaitu dari 2 8 41.
Pada perairan yang bersalinitas rendah, keragaman foraminifera akan rendah, ukuran cangkang yang mengecil dan menipis, terjadi transformasi dari cangkang berkapur menjadi berkhitin, hilangnya ornamentasi cangkang, pola ornamentasi cangkang berubah, dan komunitas foraminifera didominasi oleh tipe agglutinin. Hal ini terjadi akibat adanya penurunan sekresi kalsium karbonat (CaCO3) dari dalam protoplasma. Proses tersebut terjadi karena solubilitas CaCO3
akan menurun dengan menurunnya salinitas, sehingga tidak akan terdapat CaCO3
yang mencukupi untuk membentuk cangkang foraminifera pada area yang bersalinitas rendah (Boltovskoy dan Wright, 1976, Rositasari, 1989).
2.2.7 Oksigen Terlarut
sebentar lalu akan mencari zona yang mengandung oksigen terlarut yang tinggi bila tidak ingin menghadapi kondisi yang fatal seperti kematian (Murray, 2006). Rendahnya kandungan oksigen akan mengurangi kemampuan foraminifera untuk mensekresi kalsium karbonat, terutama pada kondisi perairan yang bersifat asam, akibatnya akan mereduksi jumlah spesies foraminifera bentik, meningkatkan kelimpahan beberapa jenis tertentu, merubah morfologi spesies, dan membatasi distribusinya (Boltovskoy dan Wright, 1976). Jenis yang melimpah di daerah tercemar telah beradaptasi dengan lingkungan anoksik (Rositasari, 1989). Rositasari (1997) menyatakan pada populasi anaerobik dicirikan dengan cangkang gampingan, tipis dan berukuran kecil, dan tidak berornamen.
Phleger dan Soutar in Braddier (1980) Rositasari (1997) menduga bahwa kebutuhan oksigen pada foraminifera sangat kecil, namun demikian Boltovskoy dan Wright (1976) menuliskan pada beberapa genus bentik (% ' ' ' * ' ) membutuhkan pasokan oksigen yang relatif besar. Suplai kebutuhan oksigen pada foraminifera bentik tersebut dicukupi oleh simbiotik alga yang ada pada protoplasma foraminifera.
2.2.8 pH
Rendahnya nilai pH terjadi karena adanya dekomposisi material organik. Selain itu rendahnya nilai pH bisa juga terjadi karena adanya masukan H2SO4dari
2.2.9 Nutrien
Kadar nitrat nitrogen pada perairan alami hampir tidak pernah lebih dari 0,1 ppm. Kadar yang lebih dari 0,2 ppm dapat mengakibatkan eutrofikasi perairan, sedangkan bila lebih dari 5 ppm menggambarkan terjadinya pencemaran antropogenik (Effendi, 2003). Dalam air laut, rata – rata kadar fosfat adalah 0,06 ppm. Kadar ini semakin meningkat dengan masuknya limbah domestik dari deterjen, limbah industri, dan limbah pertanian/perkebunan akibat pemakaian pupuk yang banyak mengandung fosfat. Berdasarkan kadar ortofosfat, perairan diklasifikasikan menjadi tiga yaitu perairan oligotrofik antara 0,003 – 0,01 ppm, mesotrofik antara 0,011 – 0,05 ppm, dan eutrofik antara 0,031 – 0,1 ppm (Volenweider, 1969 Effendi, 2003). Boltovskoy dan Wright (1976) menuliskan pada konsentrasi pospat yang tinggi (mencapai 10 kali konsentrasi normal) akan terjadi peningkatan produksi fitoplankton dan foraminifera planktonik. Keragaman foraminifera bentik menurun pada daerah tercemar dan beberapa spesies akan mendominasi.
Perairan tropis yang umumnya oligotrofik merupakan tempat yang sesuai untuk perkembangan foraminifera besar (Murray, 2006). Lingkungan terumbu karang yang konsentrasi nutriennya rendah akan didominasi oleh foraminifera bentik besar, sedangkan pada wilayah yang memiliki kandungan nutrien yang tinggi akan didominasi oleh foraminifera detrivor dan herbivor yang berukuran kecil (Hallock , 2003). Pertumbuhan foraminifera bentik yang terdapat pada ekosistem terumbu karang yang berdekatan dengan daratan umumnya tereduksi karena tingginya nutrien di zona tersebut, akibatnya tingkat reproduksi menjadi menurun dan akhirnya jumlah individunya akan menurun juga (Uthicke dan Altenrath, 2010). Hal tersebut terjadi karena endosimbion menyimpan hasil fotosintesis untuk pertumbuhan dan reproduksi endosimbion sehingga secara fisiologi menekan foraminifera (Osawa ., 2010).
2.3 Makanan dan predator
foraminifera dengan menggunakan pseudopodia yaitu jaringan kaki semu yang dibentuk dari juluran protoplasma yang keluar melalui lubang cangkang (Boltovskoy dan Wright, 1976). Murray (2006) mengelompokkan jenis foraminifera berdasarkan cara makan dalam delapan kelompok:
a. baktivor: jenis ini merupakan jenis yang paling primitif, antara lain
Allogromiids,! , $ , dan; .
b. herbivor: jenis ini terbatas pada zona eufotik; seperti ! , ,
% , , .
karnivor: jenis yang bergerak cepat dan kanibal; contohnya adalah
! ,! 8 ,% , ,( , dan(
d. detrivor: jenis ini berada pada sedimen di bawah zona eufotik; contohnya
antara lain% ' ' .
e. omnivor: umumnya bentik foraminifera yang oportunis; contohnya antara lain
! dan! 8 .
f. pasif pemakan suspensi: jenis ini termasuk epifauna dan sesil; antara lain
! 8 ' ' " ' ( 'dan
g. materi organik terlarut: seperti! dan* .
h. parasit: terdapat jenis ektoparasit seperti dalam ,< dalam bivalvia serta terumbu karang perairan
dalam, dan( sebagai endoparasit! .
Proses predasi terhadap foraminifera mengontrol dan membatasi jumlah individu namun tidak membatasi distribusi foraminifera. Predator foraminifera antara lain gastropoda, bivalvia, nematoda, udang, krustasea ( ), poliket
( ), , , , , ,
, , , , dan ikan (Murray, 2006).
2.4 Simbiosis Foraminifera Dengan Alga Simbion
Simbion tersebut umumnya berada pada foraminifera yang terletak pada perairan dangkal dengan intensitas cahaya yang tinggi dan memiliki dinding cangkang yang transparan (Boltovskoy dan Wright, 1976). Foraminifera mendapatkan simbion dengan menangkapnya menggunakan reticulopodia. Penyebaran simbion terjadi selama proses reproduksi aseksual pada foraminifera besar (Murray, 2006)
Masing8masing kelompok foraminifera bentik memiliki tipe endosimbion yang berbeda yang menempati sel pada foraminifera besar. Beberapa taxa dengan tipe simbion yang berbeda ditampilkan pada Tabel 2 (Utchike dan Nobes, 2008).
Tabel 2 Taksa foraminifera dengan tipe simbion (Utchike dan Nobes, 2008)
Sub ordo Famili Genus Tipe simbion
Rotaliina Calcarinidae Diatom
mikroalga tersebut. Proses ini serupa dengan kemampuan zooxanthella mensuplai kebutuhan oksigen bagi terumbu karang bahkan pada saat kondisi intensitas cahaya yang rendah. Keberadaan simbion tersebut menyebabkan kondisi foraminifera yang memiliki simbion menjadi lebih baik dibandingkan foraminifera jenis yang sama tanpa simbion (Boltovskoy dan Wright, 1976) karena foraminifera besar dapat bertahan sampai beberapa tahun dan dapat secara perlahan menyiapkan cadangan makanan untuk keperluan reproduksi (Murray, 1991a).
2.5 Asosiasi Foraminifera Dengan Terumbu Karang
Sebagian besar foraminifera bentik besar yang hidup di wilayah tropis dan subtropis berasosiasi dengan terumbu karang (Uthicke dan Altenrath, 2010). Foraminifera besar dengan endosimbionnya memberikan kontribusi yang lebih besar dibandingkan fitoplankton pada perairan dangkal di ekosistem terumbu karang. Produksi karbonat oleh foraminifera besar memberikan kontribusi 708 80% dari seluruh karbonat foraminifera terumbu karang dengan produksi tahunan 44 juta ton yang mewakili 0,76% produksi karbonat lautan modern (Murray, 2006). Tiga puluh persen dari hamparan sedimen pasir8karang pada Terumbu Pulau Green di Great Barrier Reef, Australia merupakan hasil kontribusi dari foraminifera bentik meskipun produksi CaCO3 organisme tersebut lebih kecil
dibandingkan organisme pembentuk terumbu lainnya. Foraminifera yang mendominasi sedimen tersebut adalah ! ,
, dan (Yamano ., 2000)
Cangkang foraminifera bentik memiliki kontribusi yang penting sebagai material gampingan pada terumbu karang (Castro dan Huber, 2007). Cangkang karbonat foraminifera biasanya merupakan hasil endosimbiotik dengan beberapa jenis alga seperti zooxanthella. Dengan cara simbiosa seperti itulah dimungkinkan beberapa fosil foraminifera dapat mencapai bentuk 'raksasa', karena alga menyediakan senyawa hara dari hasil fotosintesa sehingga tersedia kalsium karbonat (CaCO3) yang maksimal (Rositasari, 1997). Peran tersebut menunjukkan
dengan spesies < (Leutenegger, 1984 Rositasari dan Sidabutar, 1993).
Foraminifera yang terdapat di lingkungan terumbu karang umumnya sebagai biota penempel seperti < dan " 'dan sebagai epifauna yang hidup dalam kerangka terumbu seperti ' ! dan
" Marga8marga yang beradaptasi dengan baik di lingkungan karang
ini misalnya ' ! ' " ' ( ' '
! ' ' 'dan (Rositasari, 1997) Ekosistem
terumbu karang yang sehat, akan mendukung kebutuhan berbagai organisme seperti foraminifera termasuk habitat untuk memijah, mencari makan, dan menetap (Bradley, 2010).
2.6 Aplikasi Foraminifera Sebagai Indikator Lingkungan
Foraminifera sering dipakai sebagai indikator dalam berbagai bidang lingkungan perairan. Jenis* yang sensitif terhadap perubahan suhu digunakan sebagai indikator paleoklimat dan paleooseanografi. (http://www.ucmp.berkeley.edu/fosrec/Olson2.html). Beberapa aplikasi lain penggunaan foraminifera sebagai indikator lingkungan modern adalah:
a. Pada perairan yang tercemar didominasi oleh beberapa jenis foraminifera yang mampu beradaptasi, terjadi deformasi bentuk cangkang, dan diversitas yang rendah (Rositasari, 1989), hal ini terjadi karena pencemaran dapat mengganggu metabolismenya sehingga dapat mempengaruhi fisiologi dan ekologinya secara keseluruhan (Kennish, 1992).
b. Rasio infauna/epifauna: rasio yang tinggi menunjukkan perairan yang produktif (Gooday, 2003).
c. Rasio jumlah Hidup/Mati {Live/Dead (L/D)}: rasio yang rendah menunjukkan lambatnya proses pendepositan sedimen (Majewski, 2005).
tengah paparan, 50870% diluar paparan, dan >70% berada di atas zona (Pezelj , 2007).
e. Rasio jumlah Pasiran/Gampingan {Agglutinated/Calcareous (A/C)} yang tinggi menunjukkan kondisi lingkungan yang terbatas bagi perkembangan foraminifera karena kadar hara yang tinggi dan salinitas yang rendah (Rositasari, 2006).
f. FORAM ( ! " ) Index (FI)
merupakan indeks yang digunakan untuk memantau kesehatan ekosistem terumbu karang. Makin tinggi nilai FI menunjukkan kondisi ekosistem terumbu karang yang makin baik untuk mendukung pertumbuhan dan perkembangan terumbu karang (Hallock , 2003).
2.7 Konsep Bioindikator Pada Ekosistem Terumbu Karang
Indikator merupakan tanda untuk menyampaikan pesan yang kompleks yang berasal dari berbagai sumber dengan cara yang disederhanakan serta berguna dan pesan tersebut terutama digunakan untuk memberikan karakteristik status pada saat tertentu serta untuk memprediksi perubahan penting. Bioindikator ( ) merupakan respon adanya masukan antropogenik maupun alamiah terhadap parameter biomolekul, biokimia, atau fisiologi yang berkaitan dengan dampak biologi pada suatu tingkatan organisme, populasi, komunitas, atau ekosistem (Fichez ., 2005).
Penetapan bioindikator sebagai biokriteria di ekosistem terumbu karang dianggap penting untuk membantu menentukan kelayakan pemanfaatan suatu ekosistem sesuai dengan yang diharapkan (Bradley, 2010). Cooper dan Fabricius (2007) mengemukakan lima kriteria yang digunakan untuk menggolongkan bioindikator yang digunakan dalam mengkaji perubahan kualitas air di ekosistem terumbu karang:
a. ) : merupakan respon biologis yang spesifik terhadap tekanan tertentu yaitu kepada penyebabnya, bukan pada penyebab lainnya.
c. " : tingkat besarnya perubahan pada bioindikator setara terhadap intensitas dan durasi perubahan kualitas air sebagai bukti adanya keterkaitan konsentrasi polutan terhadap respon biota.
d. ( : kemudahan untuk mendeteksi perubahan pada bioindikator, dalam hal ini misalnya dengan biaya yang murah, mudah untuk dikuantifikasi, tidak merusak, ketidak tergantungan antar peneliti, dan tingkat keahlian yang dibutuhkan pada saat pengkajian.
e. : mengacu pada relevansi ekologi dan relevansinya pada kepentingan masyarakat sehingga hasil dari bioindikator dapat membantu menjelaskan hasilnya untuk kepentingan yang lebih luas.
Cooper . (2009) meninjau 21 metode bioindikator yang pernah digunakan untuk memantau terumbu karang, dari tingkat genetik dan koloni, populasi, dan komunitas. Dua bioindikator dengan prioritas tertinggi adalah penggunaan mikro/meiobentik dan kedalaman maksimum pertumbuhan terumbu karang. Penggunaan mikro/meiobentik disarankan digunakan untuk monitoring jangka panjang dan jangka pendek. Hal yang mendasari keputusan tersebut karena
penggunaan mikro/meiobentik memiliki , , ,
dan yang tinggi, serta yang rendah.
Beragam mikro/meiobentik dapat digunakan sebagai bioindikator di ekosistem terumbu karang. Beberapa contohnya adalah kandungan organik, kelimpahan dan komposisi bakteri, mikrofitobentik di sedimen, ampipoda, stomatopoda, dan foraminifera (Cooper ., 2009).
2.8 Indeks FORAM
FORAM ( ! " ) Index (FI)
kalsifikasi. Kesimpulan yang dapat ditarik dari nilai FI adalah kondisi foraminifera yang memiliki simbion dan terumbu karang akan baik pada lingkungan oligotrofik dengan pakan yang terbatas (Hallock ., 2003).
FI dapat digunakan untuk menilai kelayakan kualitas air dalam mendukung pemulihan terumbu bahkan setelah ekosistem tersebut mengalami kerusakan parah akibat topan, pemutihan, atau aktifitas antropogenik lainnya. Pemilihan foraminifera sebagai bioindikator dalam menilai kualitas lingkungan karena a) terumbu, zooxanthella, dan foraminifera yang memiliki alga simbion memiliki kesamaan kualitas perairan untuk tumbuh dan berkembang, b) rentang waktu hidup foraminifera cukup pendek dibandingkan koloni karang sehingga perubahan lingkungan akan segera mempengaruhi foraminifera, c) foraminifera berukuran relatif kecil, jumlahnya melimpah, mudah dan cepat dikoleksi dengan biaya yang relatif murah, jumlahnya dapat diolah secara statistik, dan ideal sebaga komponen dari program pemantauan yang komprehensif, d) pengambilan foraminifera tidak merusak ekosistem terumbu karang (Hallock ., 2003).
3.1 Tempat dan Waktu
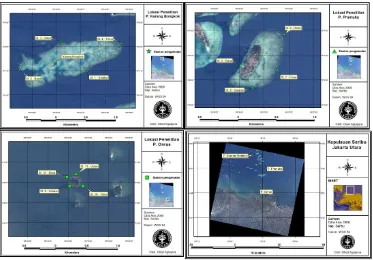
Pengambilan data dilakukan pada tiga pulau di Kepulauan Seribu, yaitu Pulau: Onrust yang berdekatan dengan Teluk Jakarta, Pramuka, dan Karang Bongkok yang berada di utara Pulau Pramuka (Gambar 2). Pemilihan ketiga pulau tersebut berdasarkan pada kategori persen penutupan karang keras dari Gomez dan Yap (1988) Fadila dan Idris (2009). Persen penutupan karang di Pulau Onrust pada tahun 2007 adalah 0,0% dengan kategori buruk, Pulau Pramuka sebesar 34,6% dengan kategori sedang, dan Pulau Karang Bongkok sebesar 63,7% dengan kategori baik. Pada setiap pulau, parameter contoh diambil pada empat stasiun yaitu di sebelah utara, timur, selatan, dan barat pulau, kecuali pada pada Pulau Onrust bagian timur, sehingga secara keseluruhan terdapat 11 stasiun. GPS Armin 60i digunakan untuk merekam lokasi penelitian (Lampiran 1).
Gambar 2. Lokasi penelitian.
Laboratorium Tanah, Balai Besar Sumberdaya Lahan Pertanian8Balai Penelitian Tanah Bogor. Identifikasi foraminifera dilakukan di Laboratorium Hidrobiologi Ilmu Kelautan IPB dan Pusat Penelitian dan Pengembangan Geologi Kelautan (P3GL), Bandung. Pengambilan sampel di lapangan dilakukan pada tanggal 15818 Maret 2011. Identifikasi foraminifera dilakukan pada Bulan April – Juli 2011.
3.2 Pengambilan Sampel
3.2.1 Pengambilan Contoh Air dan Sedimen Untuk Sampel Foraminifera
Contoh air diambil di kolom dekat dasar perairan kecuali pengukuran kecepatan arus dilakukan di kolom permukaan perairan. Sampel foraminifera diperoleh dengan mengambil sedimen permukaan pada dasar perairan dengan kedalaman dari permukaan sampai 2 cm di bawah permukaan sedimen (Hallock
., 2003). Peralatan SCUBA digunakan saat melakukan pengukuran persen penutupan substrat dan untuk membantu menyelam saat mengambil contoh air serta sedimen di ekosistem terumbu karang. Pengambilan sedimen menggunakan sekop dan dimasukkan dalam plastik contoh yang telah diberi label.
3.2.2 Pengukuran dan Analisa Persentase Substrat Perairan
Analisa persentase penutupan substrat perairan digunakan untuk membandingkan nilainya dengan nilai FORAM Index. Pengukuran persentase penutupan substrat berdasarkan kategori substrat dilakukan menggunakan metode Transek Garis Menyinggung/TGM ( # Transect/LIT) (English ., 1994) (Lampiran 2). Pengukuran dilakukan secara acak dengan kedalaman yang tetap pada setiap titik (Hodgson ., 2006). Pada penelitian ini kedalaman yang digunakan yaitu tujuh meter di bawah permukaan laut. Hasil persentase penutupan karang keras selanjutnya dibandingkan dengan nilai FORAM Index.
3.2.3 Pengambilan dan Pengukuran Parameter Perairan
organik; dan ukuran butiran sedimen dilaksanakan di laboratorium. Klasifikasi butiran sedimen menggunakan skala Wentworth (Tabel 4) (Stoddart, 1978).
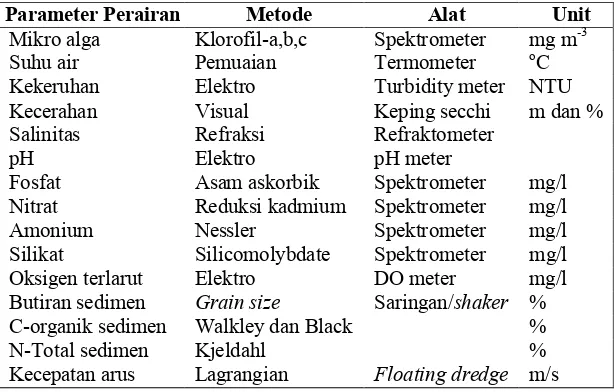
Tabel 3 Parameter perairan yang diukur
Parameter Perairan Metode Alat Unit
Mikro alga Klorofil8a,b,c Spektrometer mg m83 Suhu air Pemuaian Termometer oC Kekeruhan Elektro Turbidity meter NTU Kecerahan Visual Keping secchi m dan % Salinitas Refraksi Refraktometer
pH Elektro pH meter
Fosfat Asam askorbik Spektrometer mg/l Nitrat Reduksi kadmium Spektrometer mg/l Amonium Nessler Spektrometer mg/l Silikat Silicomolybdate Spektrometer mg/l Oksigen terlarut Elektro DO meter mg/l Butiran sedimen > 8 Saringan/ % C8organik sedimen Walkley dan Black % N8Total sedimen Kjeldahl % Kecepatan arus Lagrangian m/s
Tabel 4 Skala ukuran butiran sedimen (Stoddart, 1978)
Milimeter i Mikron iPhi (Φ) i Kelas Wentworth
2 81
0,0156 15,6 6 Medium silt
0,0078 7,8 7
)
0,0039 3,9 8 =
3.2.4 Penjentikan Foraminifera Bentik
dicuci dengan air yang mengalir dalam saringan 0,063 mm, setelah itu dikeringkan menggunakan oven pada suhu 500C selama dua jam. Kemudian foraminifera pada masing8masing sampel dipisahkan dari sedimen pada cawan di bawah mikroskop binokuler. Selanjutnya diambil sebanyak 300 spesimen pada setiap sampel dan diletakkan pada untuk proses identifikasi sampai tingkat genus menggunakan mikroskop binokuler dengan perbesaran 40 kali dengan memperhatikan struktur dinding cangkang, bentuk dan jumlah kamar dari tampak dorsal dan ventral, serta penampakan apertura (Dewi , 2010, Natsir, 2010). Pengambilan 300 spesimen ini sesuai dengan kondisi biota bentik lautan tropis (Sanders, 1968, Hallock ., 2003, Pezelj ., 2007)
Literatur identifikasi yang digunakan mengacu pada Adisaputra . (2010), Albani dan Yassini (1993), Barker (1960),Loeblich dan Tappan (1994), Nobes dan Uthicke (2008), Renema . (2001), Renema (2003, 2008), serta Yassini dan Jones (1995). Setelah dipisahkan berdasarkan genusnya, lalu spesimen tersebut dihitung jumlah individunya pada setiap genus, kemudian dilakukan analisa FORAM Index (FI) (Hallock ., 2003) (Lampiran 2).
3.4 Analisa Statistik dan Ekologi
Keseluruh parameter yang telah diukur dianalisa secara statistik dan ekologi. Kelimpahan relatif foraminifera ditransformasi menggunakan transformasi akar empat (4x ) untuk memperkecil pengaruh dari jenis yang dominan dan memperbesar pengaruh dari spesies yang jarang (Barbosa ., 2009, Narayan dan Pandolfi, 2010, Uthicke ., 2010). Pengolahan transformasi akar empat menggunakan perangkat lunak Excel 2000.
Indeks keragaman Shannon8Wiener digunakan untuk mengkaji pola distribusi contoh (Buzas ., 2007, Barbosa ., 2009). Bila nilai indeks makin tinggi, berarti komunitas biota di perairan makin beragam (Romimohtarto dan Juwana, 1999) (Lampiran 2).
Analisis indeks jarak Euclidean yang ditampilkan dalam bentuk dendogram digunakan untuk mengetahui nilai kesamaan antar stasiun pengamatan berdasarkan variabel fisika8kimia perairan (Legendre dan Legendre, 1998) (Lampiran 2). Indeks ini tidak dibatasi oleh nilai antara 0 sampai 1. Bila kesamaan antar stasiun makin tinggi, maka nilai indeks jarak Euclidean akan makin rendah.
Analisis lainnya yaitu Indeks Bray8Curtis yang ditampilkan dalam bentuk dendogram digunakan untuk mengetahui nilai kesamaan antar stasiun pengamatan berdasarkan variabel biologi perairan (Brower , 1990) (Lampiran 2), yaitu untuk variabel penutupan karang keras dan kelimpahan relatif foraminifera. Nilai indeks ini dari 0 (ketika kedua komunitas sangat berbeda) hingga 1 (ketika kedua komunitas identik baik dalam komposisi spesies dan kelimpahan).
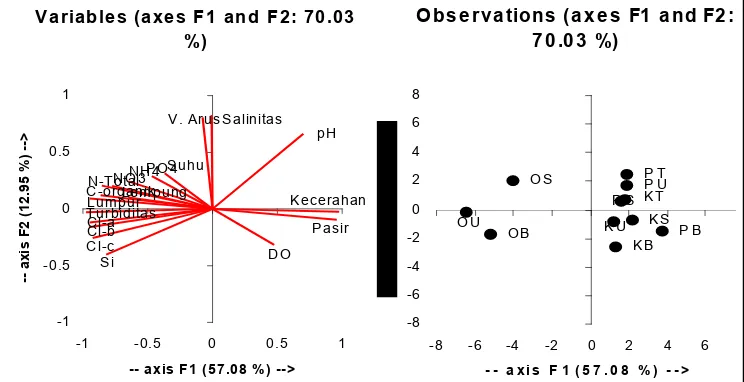
Pengaruh variabel lingkungan terhadap FI dikaji melalui analisis komponen utama (AKU) (Schueth dan Frank, 2008). AKU merupakan metode pereduksian data menjadi matriks data untuk menarik kesimpulan dari jumlah variabel yang banyak sehingga kumpulan data menjadi lebih mudah diinterpretasikan. Tabel data tersebut terdiri dari n individu (baris) dan p variabel (kolom). Variabel harus dalam bentuk matrik (Bengen, 2000). AKU tidak dapat dilakukan bila ada data yang hilang, selain itu data dalam AKU tidak perlu dinormalisasikan karena AKU bukan merupakan alat yang digunakan untuk menguji suatu hipotesis (Zuur ., 2007). AKU dapat diaplikasikan bila komponen pertama dapat menjelaskan minimal 50% dari total variasi contoh (van Marle, 1988).
4.1 Parameter Fisika Kimia Perairan
Wilayah administrasi Kabupaten Kepulauan Seribu merupakan bagian dari Provinsi DKI Jakarta yang terletak di sebelah utara Teluk Jakarta dan Laut Jawa pada posisi 1060 20’8106057’ BT dan 5010’85057’ LS. Dari rangkaian 105 pulau yang terbentang dari Teluk Jakarta sampai Pulau Sebira (sekitar 150 km dari pantai Jakarta Utara), total luas daratan mencapai 897,71 ha dan luas perairannya mencapai 6.997,50 km2(Tim Pusat Sumberdaya Alam Laut BAKORSUTANAL, 2009). Sebagai wilayah kepulauan, wilayah ini sangat rentan terhadap kenaikan muka laut dan polusi perairan dari Teluk Jakarta. Data tahun 2008 menunjukkan Indeks Kerentanan wilayah ini merupakan yang tertinggi (41,76) diantara enam wilayah administrasi di DKI Jakarta (Firman ., 2011). Polusi tersebut berasal dari 13 sungai yang bermuara ke Teluk Jakarta (Hosono ., 2011). Kontribusi polusi terbesar berasal dari Sungai Cisadane yang berada di bagian barat di luar teluk, Sungai Angke di bagian selatan di dalam teluk, dan Sungai Citarum dengan delta yang besar di bagian timur tanjung (van der Meij ., 2010).
menyebabkan tingginya proses dekomposisi sehingga terjadi pemanfaatan oksigen terlarut dan menyebabkan kondisi perairan menjadi lebih asam.
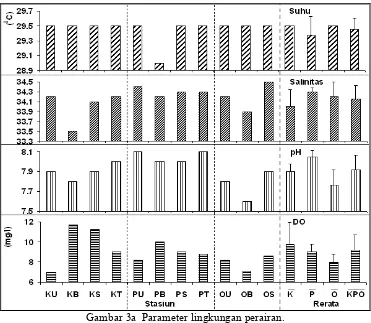
Gambar 3a Parameter lingkungan perairan. Catatan: K = Karang Bongkok, P = Pramuka, O = Onrust,
U = Utara, B = Barat, S = Selatan, T = Timur
Kep.Men.LH No.51 Tahun 2004 (MENLH, 2004). Penggolongan tingkat trofik berdasarkan kecerahan perairan menempatkan Pulau Onrust berada dalam golongan eutrofik dengan kedalaman penetrasi antara 1,583,0 meter, sedangkan Pulau Karang Bongkok serta Pulau Pramuka berada dalam golongan oligotrofik dengan kedalaman penetrasi lebih besar dari 6 meter (Garno, 2000).
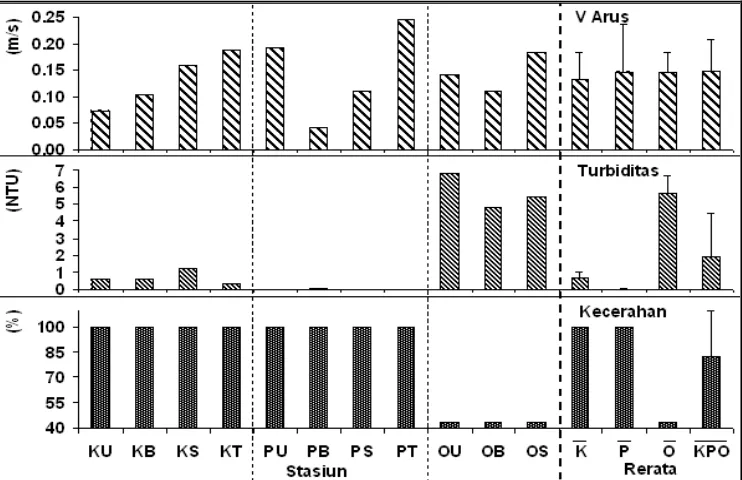
Gambar 3b Parameter lingkungan perairan.
Rendahnya tingkat kecerahan di Pulau Onrust karena kandungan partikel padatan dan terlarut yang lebih tinggi dibandingkan kedua pulau lain. Hal ini ditunjukkan dengan tingginya nilai klorofil dan nutrien perairan serta C8organik dan N8total sedimen (Gambar 3c, Lampiran 3). Dugaan ini didukung dengan adanya perbedaan antara Pulau Karang Bongkok dan Pramuka terhadap Pulau Onrust berdasarkan hasil ANOVA satu arah (α = 0,05) terhadap parameter perairan yaitu nutrien dan klorofil, serta sedimen yaitu C8organik dan N8total.
makin rendahnya aktivitas manusia yang memicu serta memacu pencemaran lingkungan perairan. Selain itu proses siltasi yang sangat dominan di Teluk Jakarta menjadi berkurang saat mencapai pulau8pulau di Kepulauan Seribu. Warna sedimen pada Pulau Onrust yang lebih cokelat dan lebih gelap dibandingkan kedua pulau lainnya menunjukkan tingginya proses dekomposisi dan pengaruh dari daratan utama, yaitu Jakarta.
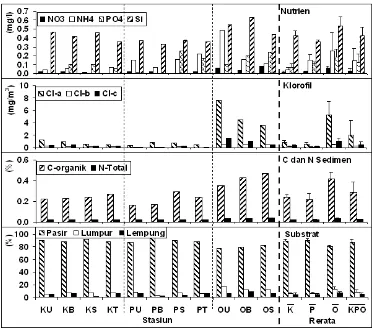
Gambar 3c Parameter lingkungan perairan.
konsentrasi nitrat, fosfat, silikat, serta klorofil menyebabkan kandungan C8organik sedimen menjadi tinggi (r = 0,6480,83). Nilai NO3dan NH4di Pulau Onrust lebih
tinggi daripada kedua pulau lainnya dan memberikan kontribusi yang signifikan terhadap tingginya konsentrasi klorofil (α = 0,05). Sebaran parameter nutrien, klorofil, N8total, C8organik, dan kekeruhan yang tinggi pada Pulau Onrust merupakan akibat dari dekatnya jarak pulau tersebut dengan Teluk Jakarta yang telah tercemar. Hasil kajian di bagian barat Teluk Jakarta menunjukkan degradasi kualitas perairan memiliki korelasi positif dengan meningkatnya limbah rumah tangga (van der Meij ., 2010).
Gambar 4 Pengelompokan stasiun berdasarkan parameter fisika8kimia perairan.
Kelompok kedua merupakan gabungan stasiun yang berada pada Pulau Pramuka dan Pulau Karang Bongkok yang dicirikan dengan tingginya nilai pH, visibilitas, dan kandungan oksigen terlarut, serta kondisi substrat berpasir. Substrat berpasir merupakan indikasi dari cukup jernihnya perairan dan pengaruh arus serta gelombang yang cukup tinggi, hal ini terjadi karena masa jenis substrat berpasir lebih berat dibandingkan substrat berlumpur dan lempung sehingga turbulensi masa air tidak mudah mengakibatkan resuspensi pada pasir dibandingkan lumpur dan lempung. Sebaran nutrien umumnya menunjukkan konsentrasi yang makin rendah pada lokasi penelitian yang makin jauh dari Teluk Jakarta. Hasil penelitian Paonganan (2008) pada Pulau Bokor, Pulau Pari, dan Pulau Payung menunjukkan pola yang serupa yaitu adanya korelasi positif dari parameter nutrien dan laju sedimentasi dengan Pulau Bokor yang berdekatan dengan Teluk Jakarta, sedangkan pada Pulau Payung yang paling jauh dari Teluk Jakarta memiliki karakteristik dengan kandungan nutrien yang rendah serta nilai pH dan intensitas cahaya yang tinggi.
4.2 Kondisi Terumbu Karang
Terumbu karang merupakan ekosistem khas tropis yang dapat berkembang pada kondisi nutrien dan kekeruhan yang rendah serta tingkat kecerahan yang tinggi. Asosiasi hewan karang dengan zooxanthella menyebabkan pemanfaatan nutrien cukup efektif, sehingga bila terjadi penambahan nutrien yang berlebih pada ekosistem terumbu karang akan membahayakan hewan karang karena akan terjadi ledakan alga. Peristiwa ini akan menyebabkan kekeruhan yang tinggi sehingga menghalangi penetrasi cahaya matahari ke bagian dasar perairan sebagai habitat hewan karang.
Selain faktor yang telah diuraikan tersebut, aktifitas fisik manusia juga ikut memberikan kontribusi terhadap degradasi ekosistem terumbu karang. Aktifitas tersebut antara lain kegiatan pariwisata, penangkapan ikan yang destruktif, dan adanya kegiatan pelabuhan.
LANDSAT, sekitar 60% rusak parah, 25% baik, dan 15% sangat baik. Kondisi tutupan karang keras pada pulau8pulau yang berdekatan dengan Jakarta umumnya kurang dari 5% akibat dampak dari aktivitas manusia seperti penangkapan ikan, pembuangan sampah, penambangan pasir dan karang, serta penebangan mangrove (Tim Pusat Sumberdaya Alam Laut BAKORSUTANAL, 2009). Estradivari . (2009) menemukan 60 jenis karang keras pada tahun 2007.
Pada stasiun yang terletak di Pulau Karang Bongkok dan Pulau Pramuka, pengambilan data penutupan susbstrat pada kedalaman tujuh meter umumnya berada pada lereng ( ) terumbu karang. Pada Pulau Onrust, kedalaman pengambilan data penutupan substrat berada pada area yang cukup landai (rataan).
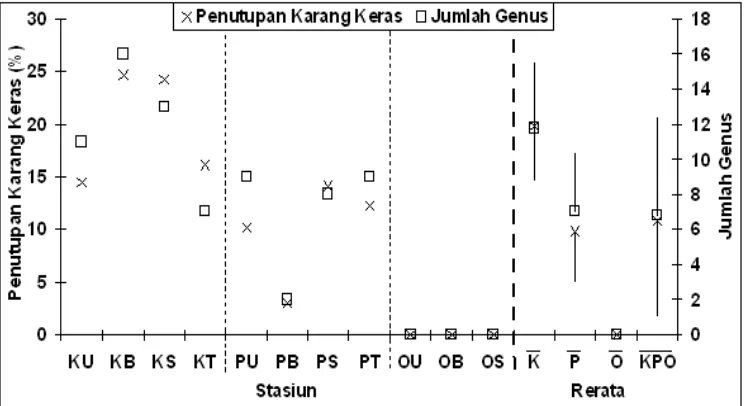
Gambar 6 Perbandingan persen penutupan dan jumlah genus karang keras.
seperti Pulau Opak Kecil dengan aktivitas manusia yang rendah. Selain itu dampak pencemaran dari Teluk Jakarta masih rendah karena letaknya yang cukup jauh dari Pulau Karang Bongkok (~50 km), hal ini didukung dengan konsentrasi nutrien yang masih rendah terutama bila dibandingkan dengan Pulau Onrust.
Kondisi yang berbeda terjadi pada Pulau Pramuka yang merupakan daerah pemukiman dan pusat pemerintahan. Pada Pulau Pramuka, rerata penutupan karang menjadi lebih rendah karena pulau ini merupakan daerah pemukiman dengan beragam kegiatan pariwisata, pelabuhan, perikanan, budidaya, dan lain sebagainya. Beragam aktivitas tersebut memberikan kontribusi terhadap degradasi ekosistem terumbu karang meskipun pulau ini jaraknya masih jauh dari Teluk Jakarta (~41 km). Berdasarkan komposisi penutupan substrat yang dilakukan dengan metode Transek Garis Menyinggung, perairan pada Pulau Pramuka lebih didominasi oleh pecahan karang ( ?R) dan pasir () /S) bila dibandingkan dengan Pulau Karang Bongkok (Gambar 7, Lampiran 4). Pecahan karang yang banyak menunjukkan tingginya pengaruh aktifitas manusia terhadap dasar perairan, seperti saat melemparkan jangkar perahu.
Gambar 7 Komposisi penutupan substrat.
Catatan: S =) , R = , OT = , SP =) ,
MA =" a , HA =< , DCA =5 ! ,
Hasil pengelompokan stasiun berdasarkan penutupan karang keras menunjukkan adanya pengelompokan yang terpisah pada stasiun di Pulau Karang Bongkok dan Pulau Pramuka, dan antara kedua pulau tersebut dengan Pulau Onrust (Gambar 8, Lampiran 10). Tiga stasiun pada Pulau Onrust membentuk satu kelompok karena tidak memiliki terumbu karang pada saat ini. Pada Pulau Karang Bongkok bagian utara, barat, selatan, dan timur serta Pulau Pramuka bagian timur (KB8UBST dan PT) membentuk satu kelompok karena memiliki persentase penutupan karang yang cenderung seragam (12,20824,68%); Pulau Pramuka bagian utara, barat, dan selatan (P8UBS) membentuk satu kelompok (persen penutupan karang keras sebesar 2,97814,06%). Tumpang tindih persentase penutupan karang pada pengelompokan antara KB8UBST dan PT serta P8UBS terjadi karena pada kelompok KB8UBST dan PT memiliki 7816 genera karang keras, sedangkan pada P8UBS hanya memiliki 289 genera karang keras, dimana meskipun jumlah genus pada kelompok P8UBS ada yang memiliki lebih dari tujuh genera, namun persentase penutupan pada P8UBS tetap lebih rendah dibanding KB8UBST dan PT.
Gambar 8 Pengelompokan stasiun berdasarkan penutupan karang keras.
dengan Teluk Jakarta yang telah tercemar, khususnya dari limbah yang berasal dari Sungai Angke. Selain itu Pulau Onrust merupakan lokasi pariwisata dan berada diantara pulau lain yang dijadikan sebagai kawasan pariwisata seperti Pulau Bidadari, Pulau Kelor, dan Pulau Cipir. Tekstur butiran pasir yang cenderung berlumpur dan berwarna lebih gelap dibandingkan kedua pulau kajian lain menandakan perairan di Pulau Onrust sangat keruh sehingga tidak dapat mendukung pertumbuhan karang.
Estradivari . (2009) mengemukakan pada tahun 1985 di Pulau Onrust masih ditemukan 4% tutupan karang hidup, sedangkan pada tahun 1993 menurun menjadi 2%, dan pada tahun 2005 tidak ditemukan lagi tutupan karang hidup. Pada tahun 2007 hanya ditemukan 8 koloni karang keras berukuran kecil dari jenis " . Kekayaan jenisnya juga sudah sangat berkurang, dari 96 jenis pada tahun 1926 menjadi 21 jenis pada tahun 1993. van der Meij . (2010) menyatakan bahwa pada tahun 1920 di Pulau Onrust terdapat 57 spesies karang, namun pada tahun 1994 menurun secara drastis sehingga menjadi lima spesies
( ' ' ( ' ( ' dan
), dan pada tahun 2005 ditemukan tujuh spesies (
' ( ' ( ' ( ' ( ' (
' dan ( ). Area rataan karang hilang sama sekali pada pulau ini, hanya sejumlah koloni kecil yang ditemukan. Degradasi karang di Pulau Onrust menandakan hampir tidak terjadi pemulihan ekosistem terumbu karang akibat kuatnya tekanan antropogenik dari Teluk Jakarta.
Sta. PB merupakan daerah sekitar pelabuhan dan alur pelayaran, sehingga aktivitas tersebut mempengaruhi eksistensi ekosistem terumbu karang. Sta. PU dan Sta. PS berada di sekitar pemukiman dengan aktivitas masyarakat yang cukup tinggi.
terumbu karang. Kecepatan arus dan gelombang yang cukup besar sampai pada taraf yang dapat ditoleransi oleh hewan karang berguna untuk membersihkan polip hewan karang dari partikel yang menempel dan memberikan pasokan makanan untuk menjaga kehidupan hewan karang tersebut (Walker dan Wood, 2005).
1985 = 0,9 m81dan tahun 1995 = 2,6 m81). Letak ketiga pulau tersebut berdekatan dengan Pulau Pramuka dan Pulau Karang Bongkok. Penambahan limbah tersebut berkaitan erat dengan kegiatan manusia seperti kegiatan pariwisata, perikanan, alur pelayaran, dan pembuangan limbah domestik lainnya.
Data historis menunjukkan degradasi karang yang berkesinambungan dan makin rendahnya kedalaman pertumbuhan karang sejak tahun 1920 sangat berkaitan dengan aktivitas manusia dan bertambahnya kandungan hara yang menyebabkan kondisi perairan menjadi semakin eutrofik. Selain itu berdasarkan hasil penelusuran beragam artikel ilmiah, maka dari 190 spesies karang yang telah dikumpulkan sejak tahun 192082005 telah mengalami penurunan jumlah spesies sebanyak 60 spesies pada tahun 2005 saja (Lampiran 5). Selain punahnya beberapa spesies, terjadi juga pergerakan distribusi karang yang menjauhi Teluk Jakarta dan pulau8pulau yang berdekatan dengan teluk tersebut ke arah utara dimana kondisi perairannya masih baik (van der Meij ., 2010).
4.3 Sebaran dan Kelimpahan Foraminifera Bentik
Sebanyak enam ordo foraminifera bentik teridentifikasi dalam 179 spesies dari 53 genera berdasarkan dua kali pengulangan proses identifikasi (Lampiran 6, 12, dan 13). Keenam ordo tersebut adalah Astrorhizida, Buliminida, Lagenida, Miliolida, Rotaliida, dan Textulariida. Beberapa spesies yang tidak diketahui diberi tanda angka setelah penulisan genus untuk membedakan antar spesies dalam satu genus. Untuk perhitungan analisis pengelompokan digunakan genus yang memberikan kontribusi kelimpahan relatif minimal 1% dari seluruh individu foraminifera hasil identifikasi dari seluruh stasiun.
yang telah dilakukan van der Meij . (2009) tentang moluska dan van der Meij . (2010) mengenai terumbu karang. Penurunan jumlah taksa pada foraminifera, moluska, dan terumbu karang terjadi pada wilayah yang berdekatan dengan area yang mengalami tekanan akibat aktivitas manusia. Fauna karang di Teluk Jakarta pada tahun 2005 telah berkurang sebesar 45% bila dibandingkan dengan tahun 1920, sedangkan penurunan kekayaan spesies pada moluska lebih tajam lagi yaitu sebesar 66% bila dibandingkan dengan kekayaan spesies pada tahun 1937/1938. Pemulihan fauna karang dan organisme yang berasosiasi tersebut menjadi lebih lambat akibat dampak antropogenik dibandingkan dengan peristiwa alamiah seperti penaikan/penurunan muka laut secara ekstrim, proses predasi, dan pemanasan global. Hal ini menunjukkan besarnya pengaruh manusia dalam jangka panjang terhadap eksistensi fauna di ekosistem terumbu karang.
Gambar 9 Jumlah taksa foraminifera bentik.
pada tipe ini berada di Sta. OU (11,33%). Perbedaan komposisi foraminifera tipe simbion alga dan heterotrofik tidak nyata pada ketiga pulau, namun pada tipe oportunis perbedaan tersebut sangat nyata antara Pulau Karang Bongkok dan Pulau Onrust serta antara Pulau Pramuka dan Pulau Onrust (uji t, α = 0,01). Tipe oportunis merupakan tipe yang mendominasi area yang kaya akan zat hara dimana kompetisi akan sumberdaya makanan menjadi minimal. Area yang kaya akan nutrien tersebut terletak pada wilayah yang mendapat masukan dari daratan yang cukup tinggi akibat aktivitas manusia. Pada wilayah yang tertekan secara ekologi tersebut, tipe ini dapat beradaptasi pada kondisi eutrofik dan berkembang biak dengan baik (Hallock ., 2003).
Gambar 10 Komposisi relatif kelompok fungsional foraminifera bentik.
Penggunaan komposisi kelimpahan relatif yang memberikan kontribusi minimal 1% menyebabkan tereduksinya kelimpahan relatif, sehingga komposisi kelimpahan tertinggi terdapat di Sta. OB (96,83%) dan terendah di Sta. PB (75,67%) (Gambar 11). Jumlah genus mengalami penurunan menjadi 13 genera (Gambar 12). merupakan tipe simbion alga yang umumnya mendominasi seluruh stasiun (0,67844,50%, x = 25,08%, StD = 15,16).