(HEMIPTERA: ALEYRODIDAE), SERTA PENGUJIAN
KETAHANAN GENOTIPE TOMAT TERHADAP
STRAIN BEGOMOVIRUS
NOOR AIDAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa disertasi berjudul Keanekaragaman Begomovirus pada Tomat dan Serangga Vektornya, Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae), serta Pengujian Ketahanan Genotipe Tomat terhadap Strain Begomovirus adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir setiap topik disertasi ini.
Bogor , September 2006
KEANEKARAGAMAN BEGOMOVIRUS PADA TOMAT DAN
SERANGGA VEKTORNYA, Bemisia tabaci GENNADIUS
(HEMIPTERA: ALEYRODIDAE), SERTA PENGUJIAN
KETAHANAN GENOTIPE TOMAT TERHADAP
STRAIN BEGOMOVIRUS
NOOR AIDAWATI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Vektornya , Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae), serta Pengujian Ketahanan Genotipe Tomat terhadap Strain Begomovirus. Dibimbing oleh SRI HENDRASTUTI HIDAYAT, PURNAMA HIDAYAT, RUSMILAH SUSENO, dan SRIANI SUJIPRIHATI
Begomovirus, yang termasuk famili Geminiviridae, dilaporkan merupakan salah satu virus yang berperan menyebabkan penurunan produksi yang sangat besar dibanyak daerah tropis dan subtropis. Spesies dan keanekaragaman begomovirus yang menginfeksi tanaman tomat sangat tinggi dan penyebarannya di lapangan sangat ditentukan oleh aktivitas serangga vektor kutukebul, B. tabaci.
Tujuan penelitian adalah: 1)Mendapatkan informasi keanekaragaman begomovirus yang menginfeksi tanaman tomat berdasarkan teknik PCR-RFLP. 2) Mendapatkan informasi keanekaragaman kutukebul yang ada pada beberapa tanaman berdasarkan teknik molekuler. 3)Mempelajari efisiensi penularan begomovirus oleh populasi kutukebul yang berbeda. 4) Mengguna kan teknik hibridisasi dot -blot sebagai metode deteksi virus dalam pengujian ketahanan beberapa genotipe tomat.
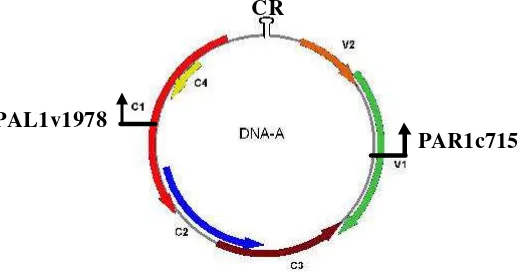
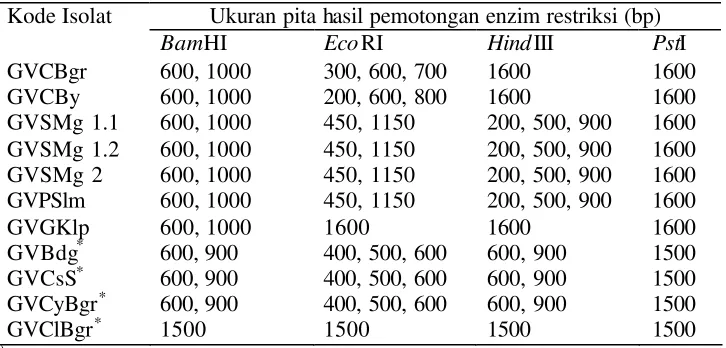
Sampel tanaman tomat terinfeksi begomovirus dikumpulkan dari D.I. Yogyakarta, Jawa Tengah dan Jawa Barat. Deteksi dan identifikasi dilakukan dengan teknik PCR menggunakan primer universal begomovirus yaitu PAL 1v 1978 dan PAR 1c 715 dan selanjutnya fragmen DNA dipotong dengan enzim restriksi (BamHI, EcoRI, HindIII dan PstI). Analisis keanekaragaman B. tabaci dilakukan melalui pengujian kemampuan serangga tersebut dalam menginduksi daun tanaman labu (Cucurbita pepo) menjadi keperak-perakan (induksi silverleaf), melalui penggunaan teknik molekuler yaitu teknik PCR-RAPD dan analisis sekuen gen cytochrome oxidase I (COI) yang ada pada mitokondria. Kutukebul dikumpulkan dari tanaman brokoli, cabai, mentimun, kedelai, edamame, tomat yang ada di Jawa Barat dan terong yang ada di Jawa Timur. Untuk mempelajari interaksi antara biotipe B. tabaci dengan strain begomovirus telah dilakukan penelitian penularan tiga strain begomovirus yang berbeda (Kaliurang, Boyolali dan Bogor) menggunakan tiga populasi B. tabaci yang berbeda, yaitu satu B. tabaci biotipe B (BtBsBJB) dan dua B. tabaci biotipe non B (BtCkBJB dan BtKKJT). Pengujian ketahanan tanaman tomat terhadap begomovirus dilakukan dengan menginokulasi tiga strain begomovirus, yang berasal dari Kaliurang, Boyolali dan Bogor kemasing-masing genotipe tanaman uji (14 genotipe) secara terpisah menggunakan penularan dengan serangga vektor, B. tabaci Genn. Infeks i begomovirus pada tanaman uji dideteksi menggunakan teknik hibridisasi dot-blot. Sebagai pelacak DNA digunakan klon DNA tobacco leaf curl virus yang dilabel dengan dioksigenin (DIG).
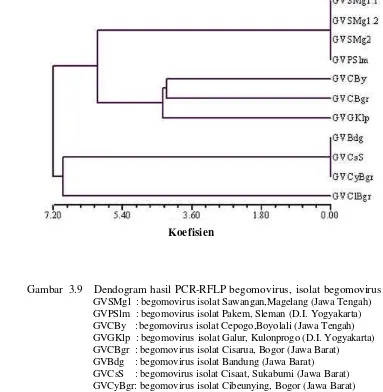
berbeda. Berdasarkan dendogram hasil analisis pemotongan fragmen DNA menggunakan program NTSYS PC 2.02 diketahui bahwa isolat begomovirus yang menginfeksi tanaman tomat di daerah Jawa terbagi menjadi dua kelompok. Kelompok pertama terdiri dari 4 strain begomovirus yang berbeda dan kelompok kedua terdiri dari 2 strain begomovirus yang berbeda.
Hasil penelitian keanekaragaman genetik serangga vektor B. tabaci menunjukkan B. tabaci asal brokoli mampu menginduksi daun labu menjadi keperak-perakan (silverleaf), sedang B. tabaci yang lainnya tidak menginduksi daun labu menjadi keperak-perakan. Analisis genetik berdasarkan PCR-RAPD dan sekuen gen COI dari mitokondria menunjukkan bahwa terdapat 2 tipe genetik di Indonesia, yaitu B. tabaci biotipe B (B. tabaci asal brokoli) dan B. tabaci non B (B. tabaci asal cabai, mentimun, terong, tomat, kedelai dan edamame ). B. tabaci biotipe B dari Indonesia menunjukkan perbedaan dengan B. tabaci biotipe B yang berasal dari daerah geografi lain. Empat populasi B. tabaci non B (B. tabaci asal cabai, mentimun, terong dan kedelai) memiliki kedekatan genetik dengan B. tabaci non B dari Cina, Turki, Pakistan, Malaysia, Singapura dan Thailand, sedangkan populasi B. tabaci non B asal edamame memiliki perbedaan dengan populasi B. tabaci non B lainnya.
Pengujian periode makan akuisisi (PMA), periode makan inokulasi (PMI), dan jumlah serangga menunjukkan bahwa masing-masing biotipe B. tabaci dapat menularkan ke tiga strain begomovirus dengan PMA selama 15 menit, PMI selama 15 menit, dan satu ekor serangga setiap tanaman. Walaupun demikian, efisiensi penularan sangat beragam antar biotipe B. tabaci dan strain begomovirus. Strain begomovirus asal Kaliurang lebih efisien ditularkan oleh ketiga populasi B. tabaci dengan jumlah serangga 10-20 ekor tiap tanaman dibandingkan dengan dua strain begomovirus lainnya. Strain begomovirus asal Boyolali paling ef isien ditularkan oleh B. tabaci biotipe non B asal Jawa Timur, sedangkan strain begomovirus asal Bogor lebih efisien ditularkan oleh kedua B. tabaci biotipe non B dibandingkan oleh B. tabaci biotipe B.
NOOR AIDAWATI. Diversity of Begomovirus Infecting Tomato and Its Insect Vector, Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae), and Screening of Tomato Genotypes for Resistance to Begomovirus Strains. Supervised by SRI HENDRASTUTI HIDAYAT, PURNAMA HIDAYAT, RUSMILAH SUSENO, and SRIANI SUJIPRIHATI.
Begomovirus, is an important virus that has been reported to cause significant yield reduction in many tropical and subtropical region. Genetic diversity of tomato-infecting begomovirus is very high and the distribution of the virus depends on the activity of its insect vector, B. tabaci.
The aims of this research are: 1) to develop an identification method to differentiate isolates of begomovirus based on PCR-RFLP technique; 2) to build a basic information regarding genetic diversity of B. tabaci in Indonesia, based on its molecular characters; 3) to study transmission efficiency of begomovirus by different population of B. tabaci; 4) to initiate screening protocol for tomato genotypes for their response to begomovirus infection.
Samples of tomato leaves infected by begomovirus was collected come from D.I. Yogyakarta, Central Java and West Java. Detection and identification of begomovirus was conducted with PCR technique using universal primers of begomovirus i.e PAL 1v 1978 and PAR 1c 715. The amplified viral DNA was digested w ith restriction enzymes (BamHI, EcoRI, HindIII, and PstI). Whiteflies population collected from different crops, i.e. tomato, brocolli, chillipepper, eggplant, cucumber, soybean and edamame was evaluated using silverleaf-induction test, PCR-RAPD, and COI gene analysis. Transmission efficiency was evaluated for three different strains of begomovirus -infecting tomato i.e strain of Kaliurang, Boyolali and Bogor, by three different population of B. tabaci, i.e one B. tabaci biotype B (BtBsBJB) and two B. tabaci biotype non B (BtCkBJB and BtKKJT). Evaluation of 14 tomato genotypes for their response to begomovirus infection was assisted by dot -blot hybridization technique. PCR-amplified product of DNA clone of tobacco leaf curl virus-Indonesia was labelled by digoxigenin for DNA probe .
Using universal primers, PAL1v 1978 and PAR 1c 715, DNA of begomovirus was successfully amplified from samples from Central Java (Magelang and Boyolali), D.I.Yogyakarta (Kaliurang and Kulonprogo) and West Java (Barusireum). Amplified viral DNA with the size of ≈ 1.600 bp was then subjected to restriction enzyme (BamHI, EcoRI, HindIII,and PstI) digest. Based on the restriction pattern, begomovirus isolates from Java can be compared. Strains of begomovirus from Magelang were similar with those from Kaliurang. Both strains were different from those of Boyolali, Kulonprogo and Barusireum, whereas the last three strains were different from each other. It can be concluded using NTSYS PC 2.1 that the begomovirus infecting tomato in Java can be differentiated into two groups. The first group consist of 4 different begomovirus strain s and the second group consist of 2 different begomovirus strains.
from Indonesia showed genetic differences compared to other B. tabaci biotype B from other geographic location. Four population of B. tabaci biotype non B (B. tabaci from chillipepper, cucumber, eggplant and soybean) share closed genetic similarity with those from China, Pakistan, Turkey, Malaysia, Singapore, and Thailand. On the other hand, B. tabaci biotype non B from eda mame showed genetic differences wit h other B. tabaci biotype non B.
Transmission study employing different acquisition feeding period, inoculation feeding period, and number of insect showed that each population of B. tabaci was able to transmit three different strains of begomovirus with 15 min. acquisition feeding period, 15 min. inoculation feeding period, and single insect per plant. However, transmission efficiency varies among B. tabaci biotypes and begomovirus strains. Begomovirus strain from Kaliurang was transmitted more effective ly by all three B. tabaci populations using 10-20 insect per plant compared to the other two begomovirus strains. Begomovirus strain from Boyolali was transmitted most effectively by B. tabaci biotype non B from East Java, whereas begomovirus strain from Bogor was transmitted more effectively by B. tabaci biotype non B than those of B. tabaci biotype B.
Judul Disertasi : KEANEKARAGAMAN BEGOMOVIRUS PADA TOMAT DAN SERANGGA VEKTORNYA, Bemisia tabaci GENNADIUS (HEMIPTERA:ALEYRODIDAE), SERTA PENGUJIAN
KETAHANAN GENOTIPE TOMAT TERHADAP STRAIN
BEGOMOVIRUS
Nama : Noor Aidawati NIM : A426010061
Disetujui Komisi Pembimbing
Dr. Ir. Sri Hendrastuti Hidayat , M.Sc. Dr. Ir. Purnama Hidayat, M.Sc. Ketua Anggota
Prof. Dr. Ir. Rusmilah Suseno , M.Sc. Dr. Ir. Sriani Sujiprihati, M.S. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi dan Fitopatologi Institut Pertanian Bogor
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Dr. Ir. Khairil Anwar Notodiputro ,M.S.
RIWAYAT HIDUP
Penulis dilahirkan di Banjarmasin, 25 Juli 1966. Penulis merupakan anak ketiga
di antara lima bersaudara dari pasangan H. Achmad Sayudi dan Hj. Khalimatussa’diah
Penulis menyelesaikan pendidikan dasar di Sekolah Dasar Negeri Lambung
Mangkurat pada tahun 1980, serta pendidikan menengah di Sekolah Menengah Pertama
Negeri 2 Banjarmasin pada tahun 1983 dan Sekolah Menengah Atas Negeri 1
Banjarmasin pada tahun 1986. Gelar Sarjana Strata 1 penulis raih dari Jurusan Hama
dan Penyakit Tumbuhan, Fakultas Pertanian, Universita s Lambung Mangkurat pada
tahun 1992 dan Sarjana Strata 2 dari Program Entomologi dan Fitopatologi, Program
Pascasarjana, Institut Pertanian Bogor pada tahun 2000. Sejak tahun 2001 penulis
terdaftar sebagai mahasiswa program doktor (Strata 3) pada Program Entomologi dan
Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Sejak tahun 1993 penulis diangkat sebagai staf pengajar tetap pada Jurusan
Hama dan penyakit Tumbuhan, Fakultas Pertanian, Universitas Lambung Mangkurat,
Banjarmasin.
Satu artikel dari disertasi ini telah dipublikasikan dengan judul: Identifikasi
Begomovirus yang Menginfeksi Tomat Berdasarkan Teknik Polymerase Chain
Reaction -Restriction Fragment Length Polymorphism pada Jurnal Mikrobiologi
Indonesia 10 (1): 29-32, 2005. Diterbitkan oleh Perhimpunan Mikrobiologi Indonesia.
Sekuen gen COI Bemisia tabaci telah didaftarkan pada GeneBank dengan nomor
asesi AB248260 (B. tabaci asal kedelai), AB248261 (B. tabaci asal cabai), AB248262
(B.tabaci asal terong), AB248263 (B.tabaci asal edamame), AB248264 (B. tabaci asal
PRAKATA
Penulis mengucapkan syukur kehadirat Allah Rabbul Alamin karena berkat
rahmat-Nya sehingga penelitian yang berjudul Pengkajian Keanekaragaman
Begomovirus pada Tomat dan Serangga Vektornya, Bemisia tabaci Gennadius
(Hemiptera:Aleyrodidae), serta Pengujian Ketahanan Genotipe Tomat terhadap Strain
Begomovirus ini dapat diselesaikan dengan baik.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada Dr. Ir. Sri
Hendrastuti Hidayat, M.Sc., Dr. Ir. Purnama Hidayat, M.Sc., Prof. Dr. Ir. Rusmilah
Suseno, M.Sc., dan Dr. Ir. Sriani Sujiprihati, M.S. atas segala kesabaran dan bimbingan,
kritik, saran, serta dukungan moril yang sangat besar peranannya dalam
terselesaikannya disertasi ini.
Terima kasih saya sampaikan kepada Bapak Dr. Ir. Kikin Hamzah Mutaqin,
MSi, Bapak Prof. Dr. Ir. Aunu Rauf, MSc dan Bapak Dr. Ir. Sukamto, M.Agr.Sc. yang
bersedia menjadi penguji luar komisi pada sidang tertutup dan terbuka. Terima kasih
atas saran yang diberikan untuk perbaikan disertasi ini.
Ucapan terima kasih juga disampaikan kepada Rektor Universitas Lambung
Mangkurat, Banjarmasin, Dekan Fakultas Pertanian dan Ketua Jurusan Hama dan
penyakit Tumbuhan, Faperta, Universitas Lambung Mangkurat, atas ijin yang diberikan
kepada penulis untuk mengikuti program doktor (S3) di program studi Entomologi dan
Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Ucapan yang sama
disampaikan kepada Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana, IPB,
Ketua dan seluruh staf pengajar program studi Entomologi dan Fitopatologi, Ketua dan
seluruh staf pengajar dan administrasi Departemen Proteksi Tanaman, Faperta, IPB.
Ucapan terima kasih disampaikan juga pada tim manajemen Beasisw a Program
Pascasarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan
Nasional yang telah memberikan dana untuk mengikuti program doktor.
Penulis juga menyampaikan rasa terima kasih dan penghargaan kepada
teman-teman Laboratorium Virologi, Eliza S. Rusli, Tuti Legiastuti, Dedek Heriyadi, Reno,
Arta, Latifah, Pak Rai, adik-adik mahasiswa S1, Pak Edi, M. Taufik, Ummu Salamah,
Supriyanti, Dwi Subekti, Firdaus, Irwan, serta Lisnawita, Hiasinta J. Motulo, dan Andi
Khairuni Ramlan. Hal yang sama juga disampaikan pada seluruh rekan-rekan
sempat disebutkan satu per satu. Terima kasih kepada Ibu Dr. Ir. Sri Sulandari, MP
sekeluarga atas bantuannya selama survei di pertanaman tomat di Daerah Istimewa
Yogyakarta dan Jawa Tengah. Ucapan terima kasih juga penulis sampaikan kepada Ir.
Ifa Manzila, MSi atas bantuannya dalam mendeteksi begomovirus dengan dot-blot
hibridisasi. Kepada saudara Saefudin (Mput) terima kasih atas bantuannya selama
penulis melaksanakan penelitian di rumah kaca.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua
tercinta, ibunda Hj. Chalimatussa’diah dan ayahnda H. Achmad Sayudi (Alm.) atas doa
restu, dan kasih sayang serta bantuan baik moril maupun materiil selama penulis
melanjutkan pendidikan S3. Terima kasih penulis sampaikan kepada Kakak Noor Laila
Hajati, Noor Chalifah, adik Taufiqurrachman, Noor Rahmawati serta kakak dan adik
ipar atas doa dan bantuannya . Terima kasih juga penulis sampaikan kepada Dr.
Muhammad Rizal atas doa dan bantuannya selama ini. Penulis juga mengucapkan
terima kasih kepada seluruh keluarga di Jakarta atas perhatian dan bantuannya selama
penulis melanjutkan pendidikan.
Akhirnya penulis berharap bahwa apa yang telah dihasilkan ini dapat bermanfaat
bagi pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, September 2006
DAFTAR ISI
Serangga Vektor Begomovirus: Bemisia tabaci Genn. (Hemiptera: Aleyrodidae)... 13
Ketahanan Tanama n Terhadap Begomovir us... 22
Daftar Pustaka ... 25
V. PENULARAN BEBERAPA STRAIN BEGOMOVIRUS YANG MENGINFEKSI TOMAT MELALUI Bemisia tabaci
BIOTIPE B DAN BIOTIPE NON B... 102
Abstrak ... 102
Abstract ... 103
Pendahuluan ... 104
Bahan dan Metode ... 106
Hasil ... 109
Pembahasan ... 114
Simpulan dan Saran ... 119
Daftar Pustaka ... 120
VI. PENGGUNAAN PELACAK DNA SEBAGAI DASAR UJI KETAHANAN GENOTIPE TANAMAN TOMAT TERHADAP INFEKSI BEGOMOVIRUS... 124
Abstrak ... 124
Abstract ... 125
Pendahuluan ... 126
Bahan dan Metode ... 130
Hasil ... 134
Pemba hasan ... 139
Simpulan dan Saran ... 144
Daftar Pustaka ... 145
VII. PEMBAHASAN UMUM ... 149
VIII. KESIMPULAN UMUM ... 155
DAFTAR PUSTAKA... 156
DAFTAR TABEL
Halaman
3.1 Gejala infeksi begomovirus pada tanaman tomat di lapangan dan hasil deteksi begomovirus menggunakan primer universal
begomovirus PAL1v 1978 dan PAR 1c 715... 50
3. 2 Ukuran pita hasil pemotongan fragmen DNA isolat begomovirus
dengan menggunakan enzim restriksi ... 54
3. 3 Matrik tingkat perbedaan 9 isolat begomovirus berdasarkan
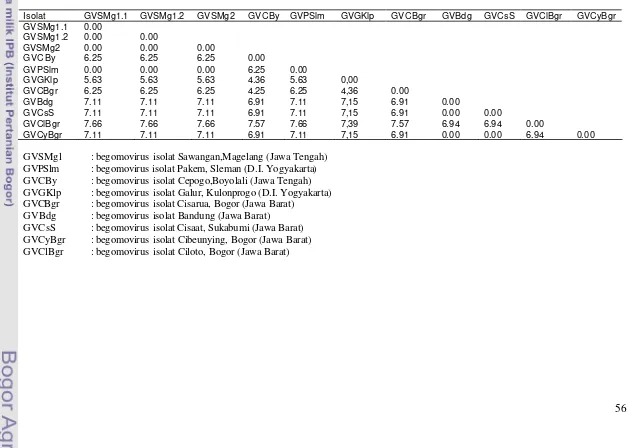
pola pita PCR-RFLP menggunakan program NTSYS versi 2.1 ... 56
4.1 Primer random yang digunakan untuk seleksi primer PCR-RAPD ... 74
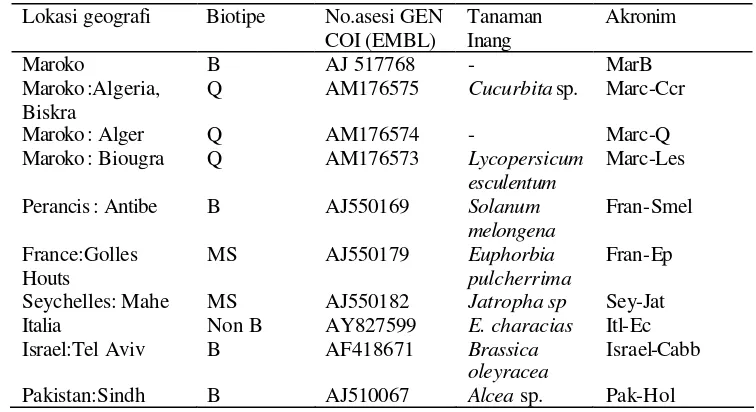
4.2 Lokasi, geografi, biotipe, nomor asesi sekuen gen COI pada
GeneBank dan tanaman inang B. tabaci ... 75
4.3 Hasil koleksi dan identifikasi kutukebul dari berbagai daerah dan
tanaman inang ... 80
4.4 Matrik jarak perbedaan 9 populasi B. tabaci berdasarkan
karakter molekuler ... 85
5.1 Biotipe B. tabaci yang digunakan dalam uji penularan tiga
strain begomovirus ... 106
5.2 Pengaruh periode makan akuisisi serangga vektor BtBsBJB ,
BtCkBJB, dan BtKKJT terhadap penularan tiga strain begomovirus dan masa inkubasi virus pada tanaman tomat dengan periode makan inokulasi 48 jam dan jumlah serangga sepuluh ekor
setiap tanaman... 110
5.3 Pengaruh periode makan inokulasi serangga vektor BtBsBJB, BtCkBJB, dan BtKKJT terhadap penularan tiga strain begomovirus dan masa inkubasi virus pada tanaman tomat dengan periode makan akuisisi 24 jam dan jumlah serangga sepuluh ekor
setiap tanaman... 112
5.4. Pengaruh jumlah serangga vektor BtBsBJB, BtCkBJB, dan BtKKJT terhadap penularan tiga strain begomovirus dan masa inkubasi virus pada tanaman tomat dengan periode makan akuisisi 24 jam
dan periode makan inokulasi 48 jam... 113
6.1 Pengelompokan tingkat respon tanaman tomat terhadap infeksi begomovirus 131
6.3 Ketahanan 14 genotipe tomat terhadap infeksi begomovirus
asal Kaliurang (GVPSlm) ... 135
6.4 Ketahanan 14 genotipe tomat terhadap infeksi begomovirus
asal Boyolali (GVCBy) ... 136
6.5 Ketahanan 14 genotipe tomat terhadap infeksi begomovirus
asal Bogor (GVCBgr) ... 136
6.6 Hasil deteksi genotipe tanaman tomat terhadap infeksi begomovirus
DAFTAR GAMBAR
Halaman
1.1 Bagan Penelitian... 5
3.1 Posisi penempelan primer PAL1v 1978 dan PAR1c 715 pada genom begomovirus ... 46
3. 2 Keanekaragaman gejala begomovirus yang ditemukan di lapangan selama survei ... 48
3. 3 Gejala infeksi begomovirus pada tanaman tomat varietas Arthaloka hasil penularan dengan serangga vektor ... 49
3.4 Hasil amplifikasi DNA begomovirus dari tanaman tomat dengan teknik PCR menggunakan pasangan primer PAL1v 1978 dan PAR1c 715 ... 51
3.5 Pola pemotongan fragmen DNA isolat begomovirus Magelang (GVSMg) dan Kaliurang (GVPSlm) dengan be berapa enzim restriksi ... 51
3.6 Pola pemotongan fragmen DNA isolat begomovirus Kulonprogo (GVGKlp) dengan beberapa enzim restriksi... 53
3.7 Pola pemotongan fragmen DNA isolat begomovirus Boyolali (GVCBy) dengan beberapa enzim restriksi... 52
3. 8 Pola pemotongan fragmen DNA isolat begomovirus Bogor (GVCBgr) dengan beberapa enzim restriksi ... 53
3.9 Dendogram hasil PCR-RFLP begomovirus isolat begomovirus... 55
4.1 P uparium B. tabaci ... 78
4.2 P uparium T. vaporariorum... 79
4.3 Tanaman labu (C. pepo): A. Diinfestasi dengan populasi B. tabaci asal cabai, B. Diinfestasi dengan populasi B. tabaci asal brokoli dan menyebabkan gejala keperak-perakan (silverleaf)... 81
4.4 Perkembangan perubahan warna daun tanaman labu yang terinduksi menjadi keperak-perakan oleh populasi B. tabaci asal brokoli ... 81
4.5 Hasil seleksi primer terhadap B. tabaci biotipe B dan B. tabaci biotipe Q ... 82
4.7 Dendogram B. tabaci biotipe B, B. tabaci biotipe Q dan populasi
B. tabaci dari beberapa tanaman berdasarkan karakter molekuler ... 84
4.8 Hasil amplifikasi fragmen DNA gen COI B. tabaci menggunakan primer
C1-J-2195 dan L2-N-3014... 86
4.9 Perbandingan hasil sekuensing gen COI yang berasal dari
6 populasi B. tabaci... 88
4.10 Filogenetik kekerabatan 6 populasi B. tabaci dari Indonesia terhadap populasi B. tabaci dari lokasi geografi lain yang ada
pada GeneBank... 90
6.1 Hasil deteksi genotipe tanaman tomat yang terinfeksi begomovirus asal Kaliurang (GVPSlm) dengan teknik hibridisasi menggunakan
DAFTAR LAMPIRAN
Halaman
1 Matrik data karakter molekuler (PCR-RAPD) Bemisia tabaci biotipe B, B. tabaci biotipe Q, populasi B. tabaci brokoli (BtBsBJB), populasi B. tabaci cabai (BtCkBJB), populasi B. tabaci mentimun (BtBPBJB), populasi B. tabaci tomat (BtCb1BJB), populasi B. tabaci terong (BtKKJT) populasi B. tabaci edamame (BtBbBJB), populasi B. tabaci kedelai
(BtCb2BJB) ... 161
2 Matrik jarak genetik populasi B. tabaci dari geografi yang berbeda
berdasarkan analisis UPGMA ... 162
3 Tingkat kesamaan populasi B. tabaci yang berasal dari geografi
©Hak cipta milik Institut Pertanian Bogo r, tahun 2006 Hak cipta dilindungi
Latar Belakang
Tomat (Lycopersicon esculentum L.) merupakan salah satu komoditi
sayuran unggulan di Indonesia karena nilai ekonomi dan kandungan gizinya
(Hasanudin 2006). Permintaan tomat di beberapa negara terus meningkat dari
waktu ke waktu sejalan dengan meningkatnya rata-rata konsumsi tomat dan
meningkatnya jumlah penduduk. Pada tahun 2004 luas pertanaman tomat di
Indonesia mencapai 52.719 ha dengan produktivitas 118,9 ku/ha dan produksi
626.872 ton. Hasil ini lebih rendah dibandingkan dengan produksi pada tahun
2003 yaitu sebesar 657.459 ton dan produktivitas 173,3 ku/ha, sedangkan luas
pertanaman tomat hanya 47.884 ha (Direktorat Jenderal Bina Produksi
Holtikultura 2005). Salah satu kendala yang menyebabkan produksi tomat
menurun adalah terdapatnya serangan patogen. Salah satu patogen yang sangat
merugikan pada pertanaman tomat adalah virus, diantaranya Tomato mosaic virus
(ToMV), Cucumber mosaic virus (CMV) (Semangun 1991), dan Begomovirus
(Sudiono et al. 2004). Data serangan organisme pengganggu tanaman dari
Direktorat Je nderal Perlindungan Tanaman Hortikultura menunjukkan bahwa
serangan virus pada tanaman tomat dari tahun 2000 – 2004 terus meningkat.
Tingginya serangan virus ini tampaknya berkorelasi dengan penurunan
produktivitas tanaman tomat.
Begomovirus dilaporkan sebagai salah satu virus yang berperan
menyebabkan penurunan produksi yang sangat besar di banyak daerah tropis dan
subtropis (Czosnek et al. 1988; Idris & Brown 1998). Hasil pe nelitian Polston
dan Anderson (1997) menunjukkan bahwa kerusakan akibat infeksi begomovirus
yang ditularkan oleh B. tabaci mengakibatkan hancurnya industri tomat di
Meksiko, Venezuela, Brazil, Florida, Amerika Tengah serta Karibia. Di Israel,
serangan tomato yellow leaf curl begomovirus (TYLCV) pada tanaman tomat
mengakibatkan kehilangan hasil sebesar 100% (Pico et al. 1996). Di Indonesia,
beberapa hasil penelitian menunjukkan bahwa serangan begomovirus pada
tanaman tomat di daerah Bogor dan sekitarnya dapat mencapai kurang lebih
pengetahuan tentang begomovirus dan penyakit yang ditimbulkannya, khususnya
pada tanaman tomat di Indonesia masih sangat terbatas. Hal tersebut karena
deteksi begomovirus dengan metode konvensional seringkali tidak mungkin
dilakukan, karena tidak semua begomovirus dapat ditularkan secara mekanis
dengan cairan perasan tanaman terinfeksi. Dengan demikian penggunaan bioasai
untuk identifikasi dan evaluasi kisaran inang menjadi sulit untuk dilakukan.
Penggunaan metode serologi juga tidak efektif untuk mendeteksi begomovirus,
karena keanekaragaman begomovirus yang cukup tinggi dan kesulitan untuk
pembuatan antisera (Robert et al. 1984).
Metode deteksi yang didasarkan pada analisis asam nukleat virus banyak
digunakan untuk mendeteksi dan mengidentifikasi begomovirus. Sebagai contoh
teknik hibridisasi asam nukleat (Polston et al. 1989; Gilbertson et al. 1991;
Hidayat et al. 1993; Bendahmane et al. 1995) dan teknik p olymerase chain
reaction (PCR) dengan menggunakan primer universal dapat digunakan untuk
mendeteksi dan mengidentifikasi begomovirus dari tanaman yang berbeda dan
tempat yang berbeda (Chiemsombat et al. 1990 ; Rojas et al. 1993 ; Wyatt &
Brown 1996 ; Roye et al. 1997; Hidayat et al. 1999; Sudiono et al. 2004).
Deteksi begomovirus dengan menggunakan teknik PCR yang dilanjutkan dengan
restriction fragment length polymorphism (PCR-RFLP) dapat menentukan adanya
strain begomovirus yang berbeda. Berdasarkan PCR-RFLP Sudiono et al. (2004)
melaporkan adanya dua strain begomovirus yang menginfeksi tanaman tomat di
Jawa Barat. Berdasarkan perbandingan sekuen genom begomovirus dan analisis
filogenetik Sukamto et al. (2005) menunjukan terdapat tiga kelompok
begomovirus yang menginfeksi tanaman tomat di daerah Bandung, Purwokerto,
Magelang dan Malang. Begomovirus tersebut memiliki kedekatan genetik dengan
tomato leaf curl Java virus (ToLCJAV) (Kon et al. 2003), p epper yellow leaf curl
Indonesia virus (PepYLCIDV) (Ikegami, belum dipublikasikan), ageratum yellow
vein virus (AYVV) ya ng berasal dari Indonesia, Cina dan Taiwan.
Keanekaragaman begomovirus tidak dapat dipungkiri sangatlah tinggi. Oleh
karena itu penelitian mengenai keanekaragaman begomovirus yang ditemukan di
Hasil penelitian Mehta et al. (1994b), Aidawati et al. (2002) dan Fitriyanti,
dan Aidawati (2002) menunjukkan bahwa persentase serangan begomovirus
meningkat dengan meningkatnya jumlah serangga vektornya, yaitu B. tabaci atau
di Indonesia dikenal dengan nama kutukebul. Tingginya serangan begomovirus
selain dipengaruhi oleh populasi kutukebul di lapang, juga dipengaruhi oleh
keanekaragaman kutukebul tersebut (Costa & Brown 1991; Brown 1994; Brown
et al. 1995b). Menurut Bedford et al. (1992, 1994) dan Burban et al. (1992)
populasi kutukebul yang berasal dari wilayah geografi yang berbeda menunjukkan
perbedaan dalam kemampuan makan, reproduksi dan kemampuan dalam
menularkan begomovirus. Populasi kutukebul tersebut secara morfologi tidak
dapat dibedakan secara jelas, tetapi menunjukkan beberapa perbedaan dalam
bertahan dan berkembang khususnya pada tanaman inang. Keberadaan
B. tabaci telah diketahui di Indonesia, tetapi informasi mengenai
keanekaragamannya masih sangat terbatas. Yuliani (2002) melaporkan serangan
B. tabaci pada tanaman tomat, cabai dan kedelai di daerah Bogor, Cianjur dan
Sukabumi, sedangkan keanekaragaman kutukebul tersebut dan kemampuannya
dalam menularkan begomovirus belum pernah dilaporkan. Oleh karena itu
penelitian mengenai keanekaragaman kutukebul dan kemampuannya dalam
menularkan begomovirus dari isolat yang berbeda sangat penting dilakukan.
Usaha pengendalian begomovirus yang selama ini dilakukan adalah
dengan cara menekan populasi serangga vektor menggunakan insektisida
(Denholm et al. 1998; Palumbo et al. 2001). Sayangnya, pengendalian dengan
menggunakan insektisida ini kurang efektif, karena satu ekor serangga vektor
virulifer sudah mampu menularkan begomovirus. Di samping itu kutukebul
mempunyai kisaran inang yang banyak, pergerakannya cepat, dan kemampuan
kutukebul menjadi resisten terhadap insektisida sangat cepat (Nakhla & Maxwell
1998). Penggunaan insektisida yang intensif dapat mengakibatkan kontaminasi
buah tomat yang dihasilkan, matinya musuh alami kutukebul serta pencemaran
lingkungan (Trabolsi 1994). Salah satu pengendalian begomovirus yang aman
adalah dengan menggabungkan pengendalian menggunakan musuh alami (parasit,
predator dan cendawan) atau dengan varietas tanaman tomat yang tahan terhadap
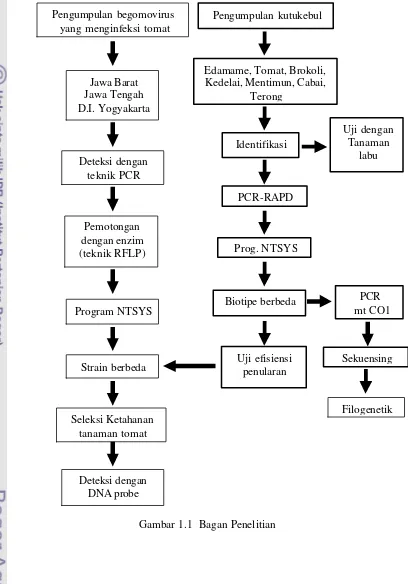
5 Gambar 1.1 Bagan Penelitian
Uji efisiensi penularan
Penggunaan pelacak DNA
Pengumpulan isolat begomovirus
dari Jawa Barat, Jawa Tengah dan D.I.Yogyakarta
Deteksi begomovirus dengan PCR dan PCR-RFLP
Analisis keanekaragaman isolat-isolat begomovirus
Penentuan strain
Penentuan Biotipe B.tabaci Pengumpulan kutukebuldari
beberapa tanaman
Identifikasi
B. tabaci
Uji induksi daun keperak- perakan
pada tanaman labu PCR-RAPD
Analisis keanekaragaman
B. tabaci dengan Prog. NTSYS
Amplifikasi gen CO1
Sekuensing gen COI
Analisis kekerabatan B.tabaci
(2003) melaporkan bahwa parasitoid kutukebul yang ada di Indonesia adalah
Encarcia adrianae (Hymenoptera: Aphelinidae), dan telah dikembangkan di Balai
Penelitian Tanaman Sayuran, Lembang, tetapi kultivar tomat yang tahan terhadap
begomovirus di Indonesia belum banyak dilaporkan dan diteliti. Oleh karena itu
seleksi ketahanan kultivar tomat terhadap begomovirus ini sangat penting
dilakukan dalam usaha mengendalikan serangan begomovirus pada tanaman
tomat.
Tujuan Penelitian
Penelitian dilakukan sesuai alur penelitian yang telah disusun (Gambar 1.1).
Tujuan yang ingin dicapai dari penelitian ini yaitu:
1. Mendapatkan informasi keanekaragaman begomovirus yang menginfeksi
tanaman tomat berdasarkan teknik PCR-RFLP.
2. Mendapatkan informasi keanekaragaman kutukebul yang ada pada beberapa
tanaman berdasarkan teknik molekuler.
3. Mempelajari efisiensi penularan begomovirus oleh populasi kutukebul yang
berbeda.
4. Mengunakan teknik hibridisasi dot-blot sebagai metode deteksi virus dalam
menguji ketahanan beberapa genotipe tomat.
Hipotesis
1. Terdapat beberapa strain begomovirus yang menginfeksi tanaman tomat di
Indonesia.
2. Terdapat beberapa biotipe B. tabaci yang ditemukan pada beberapa tanaman
inangnya.
3. Kemampuan biotipe B. tabaci dalam menularkan strain begomovirus
berbeda-beda dan kemampuan biotipe tersebut menularkan strain begomovirus
berkaitan dengan lamanya periode makan akuisisi virus dan periode makan
inokulasi oleh ve ktor serta banyaknya vektor pada waktu inokulasi.
4. Terdapat beberapa genotipe tanaman tomat yang memiliki respon toleran dan
Gambar 1.1 Bagan Penelitian Pengumpulan begomovirus
yang menginfeksi tomat
Deteksi dengan teknik PCR
Pemotongan dengan enzim (teknik RFLP)
Program NTSYS
Strain berbeda
Seleksi Ketahanan tanaman tomat
Jawa Barat Jawa Tengah D.I. Yogyakarta
Pengumpulan kutukebul
Edamame, Tomat, Brokoli, Kedelai, Mentimun, Cabai,
Terong
Identifikasi
PCR-RAPD
Prog. NTSYS
Biotipe berbeda
Uji efisiensi penularan
Deteksi dengan DNA probe
Uji dengan Tanaman
labu
PCR mt CO1
Sekuensing
II. TINJAUAN PUSTAKA
Karakter Molekuler BegomovirusBegomovirus merupakan salah satu genus dari famili geminivirus.
Geminivirus merupakan golongan virus tumbuhan dengan morfologi partikel yang
berbeda dengan golongan virus tumbuhan lainnya yang telah umum dikenal.
Nama geminivirus berasal dari karakteristik partikel virus yang isometrik ganda,
yang dalam keadaan tunggal umumnya mempunyai diameter berkisar 18 – 20 nm
dan sebagian besar senantiasa terdapat dalam keadaan berpasangan dengan ukuran
20 nm x 30 nm (Bock 1982). Kelompok geminivirus merupakan golongan virus
yang mempunyai asam nukleat deoksiribonukleat dalam bentuk utas tunggal
(single stranded (ss) DNA). Di dalam tanaman virus berada dalam jaringan floem
dan terakumulasi di dalam inti sel jaringan floem yang terinfeksi.
Berdasarkan struktur genom, serangga vektor dan tanaman inang,
geminivirus terbagi menjadi empat genus yaitu Mastrevirus, Curtovirus,
Begomovirus dan Topocuvirus (van Regenmortel et al. 2000, Hull 2002).
Mastrevirus adalah geminivirus dengan tanaman inang dari kelompok monokotil,
ditularkan oleh vektor wereng daun dan memiliki genom monopartit. Genus ini
memiliki lebih dari 10 jenis virus yang sudah diketahui, dengan tanaman inang
dari famili Graminea, di antaranya adalah chlorosis striate mosaic virus (CSMV),
digitaria streak virus (DSV), maize streak virus (MSV) dan wheat dwarf virus
(WDV). Curtovirus adalah geminivirus dengan tanaman inang dikotil, ditularkan
oleh vektor wereng daun, dan genomnya monopartit. Anggota genus ini di
antaranya adala h beet curly top virus (BCTV) dengan vektor Circulifer tenellus
(Hemiptera: Cicadellidae), dan tobacco yellow dwarf virus (TYDV) dengan
vektor Orosius argentatus (Hemiptera: Cicadellidae). Begomovirus adalah
geminivirus dengan tanaman inang dikotil, ditula rkan oleh vektor kutukebul
memiliki genom bipartit atau monopartit. Berdasarkan daerah asal genus tersebut
anggota begomovirus terbagi menjadi dua kelompok yaitu kelompok yang
berasal dari Old World (benua Eropa, Asia dan Afrika) dan kelompok New World
(Benua Amerika). Begomovirus memiliki anggota yang paling banyak bila
dibanding genus-genus lainnya. Anggota begomovirus yang memiliki genom
(ACMV), bean dwarf mosaic virus (BDMV), bean golden mosaic virus (BGMV),
cotton leaf crumple virus (CLCV), euphorbia mosaic virus (EuMV), indian
cassava mosaic virus (ICMV), mungbean yellow mosaic virus (MYMV), potato
yellow mosaic virus (PYMV), tomato golden mosaic virus (TGMV) dan squash
leaf curl virus (SqLCV), sedangkan yang memiliki genom monopartit contohnya
tomato leaf curl virus dari Australia (ToYLV-Aus) dan tomato yellow leaf curl
virus dari Israel (TYLCV-Is) (Navot et al. 1991; Dhar & Singh 1996;
Navas-Castillo et al. 1999) . Topocuvirus adalah genus pada geminivirus yang
merupakan bagian dari genus curtovirus. Topocuvirus mempunyai genom yang
mirip dengan curtovirus tetapi ditularkan melalui wereng pohon Micrutalis
malleifera. Anggota genus tersebut adalah tomato pseudocu rly top virus.
Gejala Infeksi Begomovirus pada Tanaman Tomat
Gejala yang timbul karena infeksi begomovirus pada tanaman tomat
sangat bervariasi, tergantung pada strain virus, kultivar, umur tanaman pada waktu
terinfeksi dan lingkungan. Umumnya gejala ya ng ditimbulkannya pada tanaman
tomat merupakan kombinasi mosaik kuning, belang-belang klorotik, klorotik pada
ujung daun, daun berkerut, daun mengecil, tanaman menjadi kerdil dan bunga
cepat rontok (Polston & Anderson 1997).
Tomato golden mosaic virus yang menginfeksi tanaman tomat
menunjukkan gejala mosaik kuning (Costa 1969; Hamilton et al. 1981). Lastra &
Uzcateque (1978 ) melaporkan bahwa mosaico amarillo del tomate (MAT)/
tomato yellow mosaic virus yang menginfeksi tanaman tomat di Venezuela
menunjukkan gejala mosaik kuning, keriting dan tanaman menjadi kerdil.
Butter & Rataul (1977) melaporkan bahwa tanaman tomat yang terinfeksi
ToLCV menunjukkan gejala daun keriting, daun menggulung (rolling), perubahan
bentuk daun, daun berkerut (puckering) dan terdapat enasi pada permukaan bawah
daun. Gejala strain ToLCV-Aus berupa daun keriting, kuning, daun menggulung
ke atas. Tanaman yang terinfeksi pada umur muda tidak berbuah dan kerdil
(Conde & Connelly 1994). Chiang et al. (1997) melaporkan adanya strain
ToLCV yang menginfeksi tanaman tomat di Makutupora, Tanzania
(ToLCV-Tan). ToLCV-Tan ini menim bulkan gejala berupa belang-belang kuning, daun
menginfeksi tanaman tomat di Pakistan menunjukkan gejala berupa tepi daun
yang melengkung ke atas atau ke bawah, tulang daun menjadi tebal dan tanaman
kerdil (Mansoor et al. 1997).
Tanaman tomat di Culiacan Valley yang terinfeksi tomato leaf crumple
begomovirus (TLCrV) menunjukkan gejala daun kisut, berkerut, epinastis,
bergelombang (purpling), keriting dan belang-belang (Paplomatas 1994).
Polston et al. (1993 & 1995) melaporkan tomato mottle virus (ToMoV)
menginfeksi tanaman tomat sejak tahun 1989 di Florida dan California Selatan.
Gejala yang ditimbulkan oleh infeksi virus tersebut berupa belang-belang klorotik,
daun melengkung ke atas dan kerdil. Infeksi ToMoV pada tanaman tomat di
Yucatan, Meksiko menunjukkan gejala pertumbuhan terhambat, daun
belang-belang dan deformasi (Garr ido-Ramirez & Gilbertson 1998).
Infeksi TYLCV pada tanaman tomat menyebabkan daun menjadi kecil,
keriting, keras, dan klorotik; bunga jatuh prematur; tunas kaku, internoda pendek
dan tanaman menjadi kerdil (Cohen & Nitzany 1966). Jones et al. (1991),
menjelaskan bahwa tanaman yang terinfeksi TYLCV mengakibatkan bunga
rontok dan kualitas buah rendah serta cepat masak. Muniyappa et al.(1991)
melaporkan adanya strain TYLCV yang menginfeksi tanaman tomat di India.
Gejala yang ditimbulkan oleh TYLCV-India berupa mosaik kuning, keriting, daun
menjadi seperti mangkok dan tanaman kerdil. Di Jepang, TYLCV yang
menginfeksi tanaman tomat di daerah Shizuoka dan Aichi mirip dengan
TYLCV-Is-M. Gejala yang ditimbulkan berupa daun menguning mulai dari ujung hingga
ke bawah, daun yang baru muncul menjadi kecil dan keriting (Kato et al. 1998).
Sinaloa tomato leaf curl virus (STLCV) yang menginfeksi tanaman tomat
di Sinaloa, Meksiko menunjukkan gejala berupa daun menjadi klorosis,
bergelombang, keriting, internoda menjadi pendek (Brown et al. 1993; Idris et al.
1999).
Di Indonesia, infeksi begomovirus pada tomat menimbulkan geja la berupa
penebalan tulang daun, lamina daun berkerut-kerut, menguning, tepi daun
melengkung ke atas, daun menjadi keriting dan tanama n menjadi kerdil
Penularan Begomovirus
Begomovirus pada umumnya dapat ditularkan dengan berbagai cara, ba ik
melalui serangga vektor kutukebul maupun wereng daun, melalui penyambungan
dan secara mekanik dengan cairan perasan tanaman sakit. Walaupun demikian
penularan dan pemencaran virus tersebut di lapangan terutama ditentukan oleh
aktifitas serangga vektor.
Hasil penelitian Uzcategui & Lastra (1978) menunjukkan bahwa periode
makan akuisisi (PMA) minimum B. tabaci menularkan MAT adalah 2 jam
dengan periode laten 20 jam. Efisiensi penularan B. tabaci yang dipelihara pada
suhu 30-34°C adalah 93%, sedangkan yang dipelihara pada suhu 20-30°C hanya
75%. Serangga vektor mampu menularkan MAT maksimum 7 hari. Serangga
betina lebih efisien menularkan MAT dibandingkan yang jantan.
Cohen & Nitzany (1966) menunjukkan bahwa periode akuisisi B. tabaci
untuk dapat menularkan TYLCV-Is adalah 15 menit dengan periode makan
inokulasi (PMI) 48 jam. Penularan tidak terajadi apabila PMA di bawah 15
menit. Penularan semakin meningkat setelah PMA 4 jam. PMI minimun
serangga vektor ini menularkan TYLCV-Is adalah 30 menit, dengan PMI 15
menit virus tidak dapat ditularkan. Penularan semakin meningkat setelah PMI
lebih dari 1 jam. Periode laten virus di dalam tubuh serangga 21 jam. Periode
retensi TYLCV-Is di dalam tubuh serangga selama 10-15 hari. Nimfa mampu
mengakuisisi virus dan imago yang dihasilkan virulifer. TYLCV-Is tidak
ditularkan secara transovarial
Hasil penelitian Butt er & Rataul (1977) menunjukkan bahwa PMA
minimum B. tabaci untuk dapat menularkan ToLCV adalah 31 menit dengan PMI
selama 24 jam. Semakin lama PMA penularan semakin meningkat. PMI
minimum kutukebul tersebut untuk dapat menularkan ToLCV adalah 32 menit
dengan PMA selama 24 jam. B. tabaci mampu mengakuisisi virus dari kotiledon
tanaman tomat yang terinfeksi, tetapi infeksi tidak terjadi ketika serangga virulifer
tersebut dipindahkan ke kotiledon tanaman yang sehat. Bemisia tabaci mampu
menularkanToLCV dengan efesiensi tertinggi apabila PMA dan PMI dilakukan
pada daun muda. Kutukebul mampu menularkan ToLCV sebesar 38% apabila
yang dilakukan pada sumber inokulum yang berumur 11 bulan hanya
menyebabkan infeksi sebesar 8%. Kutukebul betina yang virulifer mempunyai
efisiensi penularan 53 hari, sedang yang jantan hanya 8 hari. Nimfa mampu
mengakuisisi ToLCV dan menularkannya. ToLCV tidak ditularkan secara
transovarial.
Brown & Nelson (1988) menunjukkan bahwa satu ekor B. tabaci yang
telah diberi perlakuan PMA selama 48 jam dan PMI selama 3 hari, mampu
menularkan chino del tomato virus (CdTV) dengan jumlah tanaman terinfeksi
15%. Penularan semakin meningkat dengan bertambahnya jumlah serangga.
PMA minimum B. tabaci untuk dapat menularkan CdTV apabila diberi PMI
selama 3 hari adalah 1 jam, sedang PMI minimum 2 jam dengan PMA 24 jam.
Apabila PMA ditingkatkan hingga 48 jam, penularan terjadi setelah PMI 10
menit.. Periode laten CdTV dalam tubuh serangga 17-22 jam. Periode retensi
virus dalam tubuh kutukebul selama 4,5 hari setelah PMA 24 jam dan 7,3 hari
setelah PMA 72 jam.
Hasil penelitian Mehta et al. (1994b) menunjukkan bahwa satu ekor B.
tabaci biotipe B mampu menularkan TYLCV-Mesir , dan efisiensi penularan
meningkat 4 kali jika jumlah serangga ditingkatkan hingga 5 ekor per tanaman.
PMA serangga vektor untuk dapat menularkan virus adalah 15 menit. Penularan
semakin meningkat dengan semakin lamanya PMA dan mencapai maksimum
setelah 24 jam. PMI minimum adalah 15 menit. Penularan semakin meningkat
dengan meningkatnya PMI dan mencapai maksimum setelah 12 jam PMI. Imago
B. tabaci yang berasal dari nimfa yang dibiakan pada tanaman tomat terinfeksi
TYLCV mampu menularkan virus tersebut setelah PMI 2 jam. Penularan
semakin meningkat dengan meningkatnya PMI.
Idris & Brown (1998) menunjukkan bahwa B. tabaci biotipe A yang telah
diberi PMA 0,5 jam tidak mampu menularkan STLCV. Penularan terja di setelah
1 jam dengan PMI 24 jam. Semakin lama PMA kemampuan serangga vektor
menularkan STLCV semakin meningkat. B. tabaci yang diberi perlakuan PMA
24 jam tidak mampu menularkan STLCV setelah PMI 0,5 jam, tetapi penularan
terjadi setelah PMI 1 jam. Penularan meningkat dengan semakin lamanya PMI.
penularan secara berseri menunjukkan bahwa penularan STLCV oleh B. tabaci
biotipe A ini bersifat intermittent. Virus ini tidak ditularkan secara transovarial.
Hasil penelitian Sanchez-Campos et al. (1999) menunjukkan bahwa B.
tabaci biotipe B dan Q mempunyai kemampuan menularkan TYLCV-Sar dan
TYLCV-Is. Biotipe Q lebih efisien menularkan kedua virus dibandingkan biotipe
B. Kedua biotipe lebih efisien menularkan TYLCV-Is. Satu ekor B. tabaci
biotipe B lebih rendah menularkan TYLCV-Sar dibandingkan biotipe Q, hal yang
sama terjadi pada TYLCV-Is. Perbedaan penularan ini tidak membedakan
kemampuan biotipe B atau Q dalam mengakuisisi TYLCV-Sar atau TYLCV-Is
dari sumber virus.
Hasil penelitian Ghanim et al. (1998) menunjukkan bahwa TYLCV-Is
mampu ditularkan secara transovarial oleh B. tabaci selama dua generasi dan
melalui kopulasi antar individu (Ghanim & Czosnek 2000). Hasil penelitian ini
juga menunjukkan bahwa TYLCV dapat berperan sebagai patogen pada B. tabaci,
karena sangat mempengaruhi siklus hidupnya dan fekunditinya. Diduga TYLCV
berreplikasi di dalam tubuh B. tabaci, tetapi cara replikasinya belum diketahui.
McGrath & Harrison (1995) menunjukkan bahwa penularan tomato leaf
curl begomovirus oleh B. tabaci dipengaruhi oleh isolat begomovirus dan biotipe
serangga vektor yang menularkannya. Hal ini diduga karena adanya perbedaan
protein selubung begomovirus . Protein selubung tersebut berpengaruh terhadap
kemampuan serangga vektor dalam menularkan virus.
Deteksi Begomovirus
Deteksi begomovirus dengan metode konvensional seringkali tidak
mungkin dilakukan, karena tidak semua begomovirus dapat ditularkan secara
mekanik dengan cairan perasan tanaman terinfeksi. Beberapa begomovirus yang
dapat ditularkan secara mekanik yaitu BDMV (Morales et al. 1990), MYMV
(Honda et al. 1983) dan TYMV (Uzcategui & Lastra 1978). Dengan demikian
penggunaan bioasai untuk identifikasi dan evaluasi kisaran inang menjadi sulit
untuk dilakukan.
Metode serologi dilaporkan dapat digunakan untuk mendeteksi
begomovirus. Penggunaan metode ini telah dilakukan untuk mendeteksi virus
(Thomas & Bowyer 1980), TGMV (Stein et al. 1983), labu leaf curl virus
(SLCV) (Cohen et al. 1983), ACMV dan BGMV (Sequeira & Harrison 1982),
honeysuckle yellow vein mosaic (HYVM) dan tobacco leaf curl viruses (TLCV)
(Osaki et al. 1979). Akan tetapi untuk saat ini penggunaan metode serologi
tersebut tidak efektif untuk mendeteksi begomovirus , karena keanekaragaman
begomovirus yang cukup tinggi dan kesulitan untuk pembuatan antisera yang
disebabkan oleh sifat fisik dan kimia partikel virus yang me mbuatnya sulit untuk
dimurnikan dalam bentuk yang stabil ; sifat imunogenik dari virion yang lemah;
protein selubung, terutama untuk virus-virus yang ditularkan oleh B. tabaci tidak
dapat dibedakan melalui antisera poliklonal maupun monoklonal (Roberts et al.
1984).
Sekarang ini metode deteksi yang didasarkan pada analisis asam nukleat
virus telah banyak digunakan untuk mendeteksi dan mengidentifikasi
begomovirus. Sebagai contoh teknik hibridisasi asam nukleat (Polston et al.
1989; Gilbertson et al. 1991; Hidayat et al. 1993; Bendahmane et al. 1995) dan
teknik Polymerase chain reaction (PCR) dengan menggunakan primer universal
(Chiemsombat et al. 1990; Rojas et al. 1993 ; Wyatt & Brown 1996 ; Roye et
al. 1997; Hidayat et al. 1999; Aidawati et al. 2001; Aidawati & Hidayat 2002;
Sudiono et al. 2004; Sulandari et al 2001,2006), telah terbukti dapat digunakan
untuk mendeteksi dan mengidentifikasi begomovirus dari tanaman yang berbeda
dan tempat yang berbeda. Kedua teknik ini tidak hanya dapat mendeteksi asam
nukleat genimivirus pada jaringan tanaman terinfeksi tetapi juga berhasil
mendeteksi asam nukleat begomovirus dalam tubuh serangga vektor B. tabaci
(Navot et al. 1989 ; Polston et al. 1990 ; Chiemsombat et al. 1990; Mehta et al.
1994a ; Aidawati & Hidayat 1999).
Selain melalui analisis sekuen DNA, keanekaragaman begomovirus dapat
dilihat dari pola pita PCR-RFLP. Hasil analisis pola enzim restriksi (Restriction
Fragment Length Polymorphism (RFLP)) dari fragmen DNA hasil amplifikasi
dengan PCR menunjukkan kemungkinan adanya strain begomovirus yang
berbeda. Rojas et al. (1993) menunjukkan adanya perbedaan strain begomovirus
yang menginfeksi tanaman tomat dari Costa Rica dan Meksiko. Behjatnia et al.
strain tersebut berbeda dengan ToLCV-Aus. Pola PCR-RFLP fragmen DNA-A
dan DNA-B isolat dari Guadeloupe, Martinique dan Puerto Rico adalah sama,
sehingga diduga tanaman tomat tersebut terinfeksi oleh virus yang sama (Polston
et al. 1997). Momol et al. (1999) menunjukkan bahwa fragmen DNA
begomovirus yang menginfeksi tanaman tomat di daerah Georgia Selatan dan
Florida Utara setelah dipotong dengan enzim EcoRI dan ClaI polanya sama
dengan TYLCV yang menginfeksi tanaman tomat, tetapi berbeda dengan tomato
mottle virus (ToMoV). Hasil penelitian Hidayat et al. (1999) menunjukkan
bahwa pola enzim restriksi virus Cugenang berbeda dengan virus
cabai-Segunung tetapi sama dengan virus cabai-Baranangsiang. Dengan metode yang
sama, Sudiono et al. (2004) berhasil menganalisis pola enzim restriksi dari
fragmen DNA hasil amplifikasi dengan PCR dan menunjukkan adanya strain
begomovirus yang berbeda pada tanaman tomat yaitu isolat begomovirus dari
Bandung, Cisaat dan Cibeunying ada lah sama, tetapi berbeda dengan isolat
begomovirus dari Ciloto.
Pada saat ini hasil sekuensing genom begomovirus yang menginfeksi
tomat, cabai dan tembakau telah dilaporkan dan dimasukkan ke GeneBank (Shih
et al. 1999; Kon et al. 2003; Sukamto et al. 2005; Hidayat et al 2006ab; Tsai et al.
2006a,b; Ikegami, belum dipublikasikan).
Serangga Vektor Begomovirus : Bemisia tabaci Genn. (Hemiptera: Aleyrodidae)
Persebaran B. tabaci
B. tabaci ditemukan pertama kali pada tahun 1889. Serangga tersebut
menyerang tanaman tembakau di Greeca dan dinamakan kutukebul tembakau
(Aleyrodes tabaci) (Gennadius 1889). Kemudian pada tahun 1897 B. tabaci
kembali ditemukan pada tanaman ubi jalar yaitu di daerah Amerika Serikat.
Kutukebul tersebut dinamakan A. inconspicua Quaintance dengan nama umum
kutukebul ubi jalar (sweetpotato whitefly) (Quaintance 1900). Nama spesies
tersebut kemudian berubah menjadi genus baru yaitu Bemisia dan pada tahun
1914 disebut B. inconspicua (Quaintance & Baker 1914). Pada awalnya
Quaintance & Baker (1914) tidak dapat menempatkan A. tabaci ke dalam genus
tahun, pada tahun 1964 telah ditemukan 19 spesies kutukebul yang sama dengan
B. tabaci. Kutukebul tersebut dideskripsi dari 14 negara lain pada
bermacam-macam tanaman inang. Berdasarkan daftar spesies yang ada Takahashi (1936)
menempatkan A. tabaci ke dalam genus Bemisia, sehingga menghasilkan nama B.
tabaci hingga saat ini.
Di Brazil, pada tahun 1928 kutukebul ditemukan pertama kali pada
tanaman Euphorbia hirtella dan dinamakan B. costalimai Bondar. Di Taiwan,
kutukebul ditemukan tahun 1933 dinamakan B. hibisci (Mound & Halsey 1978).
Selanjutnya kutukebul menyebar ke daerah-daerah tropik dan subtropik te rmasuk
daerah iklim sedang. Sekarang kutukebul tersebar secara luas dan ditemukan
pada semua kontinental kecuali antartika (Martin 1999; Martin et al. 2000).
Menurut Campbell et al. (1996) berdasarkan hubungan evolusioner secara
taksonomi Bemisia termasuk famili Aleyrodidae dan diduga berasal da ri daerah
tropik yaitu Afrika. Selanjutnya serangga tersebut terbawa hingga ke neotropik
dan Amerika bagian Timur serta Utara. Brown et al. (1995b) menduga bahwa B.
tabaci berasal dari India atau Pakistan. Hal tersebut ditunjukkan dengan
ditemukannya keanekaragaman parasitoid kutukebul yang sangat tinggi. Kriteria
tersebut menunjukkan bahwa daerah tersebut merupakan pusat genus kutukebul.
Populasi B. tabaci mulai meledak sejak tahun 1980-a n di berbagai tempat.
Populasi B. tabaci di lembah Imperial California meningkat 300 kali pada
pertengahan tahun 1980-an dan 1600 kali pada pertengahan 1970-a n hingga
pertengahan 1990-an (Wisler et al. 1998). Serangga tersebut merupakan faktor
pembatas produksi tanaman makanan dan umbi-umbian di seluruh dunia karena
B. tabaci secara langsung menyebabkan kerusakan pada tanaman dan secara tidak
langsung merupakan vektor virus tanaman (Brown 1994).
Menurut Cock (1986) B. tabaci merupakan hama utama tanaman hias di
rumah kaca, walaupun tanaman utama yang diproduksi di rumah kaca seperti
tomat, cabai, buncis, terong dan mentimun juga terserang. Price et al. (1986)
melaporkan pertama kali bahwa B. tabaci menyebabkan kerusakan pada tanaman
hias di rumah kaca di Amerika Serikat. Serangga tersebut sangat cepat
penyebarannya dan sangat sulit untuk dikendalikan. Akibat adanya kutukebul
sehingga menyebabkan fitotoksik. Disamping itu embun madu yang dihasilkan
kutukebul merupakan substrat bagi pertumbuhan cendawan embun jelaga pada
daun tanaman yang terinfestasi sehingga mengakibatkan penurunan kualitas
estetika tanaman hias.
Biologi B. tabaci
Perkembangan B. tabaci dimulai dari telur, nimfa, pupa dan kemudian
imago. Telur berbentuk bulat panjang (0.2–0.3 mm) dengan tangkai yang pendek
pada salah satu ujungnya. Telur diletakkan satu per satu dengan posisi tangkai
tegak lurus pada permukaan bawah daun (Gameel 1977). Menurut Badri (1983)
telur yang baru diletakkan berwarna kekuning-kuningan dan tertutup oleh tepung
lilin, setelah 24 jam warnanya berubah menjadi coklat dan dalam waktu dua hari
telah terbentuk dua bintik merah kecoklat – coklatan yaitu mata faset embrio.
Masa inkubasi telur tergantung pada keadaan lingkungan, terutama suhu.
Pada suhu antara 26°-32°C masa inkubasi berlangsung selama 4-6 hari, sedangkan
pada suhu 18°-22°C meningkat menjadi 10-16 hari dan perkembangan embrio
terhenti pada suhu 16°C (Gameel 1977). Menurut Badri (1983) masa inkubasi
telur B. tabaci yang berasal dari tanaman kedelai 5.78 ± 0.21 hari pada suhu 28°
-30°C.
B. tabaci mempunyai tiga instar nimfa yang perkembangannya secara
keseluruhan berlangsung selama 12-15 hari pada suhu 28°-32°C, dan 28-32 hari
pada suhu 20°-24°C. Pada suhu tinggi yaitu 30°-34°C periode perkembangan
tersebut lebih cepat, dan menjadi lebih lama apabila suhu mencapai 18°-22°C
(Gameel 1977). Nimfa instar pertama yang baru keluar dari telur aktif bergerak
dan mengisap cairan makanan pada permuka an bawah daun selama 1-2 hari, dan
setelah mendapatkan tempat yang sesuai akan menetap dan tidak bergerak lagi.
Menurut Badri (1983) nimfa instar pertama B. tabaci lamanya 3.14±0.24 hari,
berbentuk bulat panjang, berwarna hijau cerah dan pada bagian pinggir tubuh
nimfa terdapat bulu-bulu halus dengan lapisan lilin tipis. Nimfa instar dua
lamanya 3.21±0.16 hari dan nimfa instar tiga lamanya 3.14±0.16 hari. Nimfa
instar dua dan tiga ini tidak bergerak dan berwarna hijau. Panjang tubuh nimfa
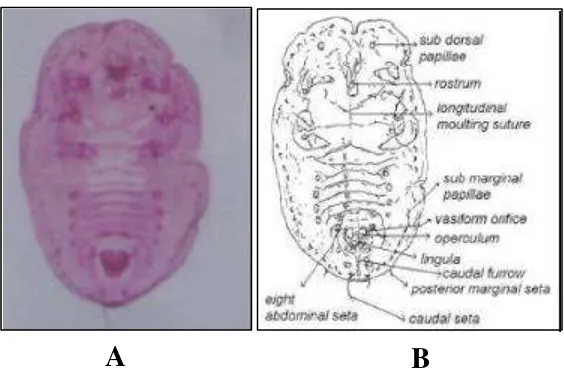
Pupa B. tabaci berbentuk bulat panjang dengan torak agak melebar dan
cembung, berwarna kuning dan ruas abdomen tampak jelas. Lamanya stadium
pupa adalah 2.51±0.21 hari (Badri 1983). Bagian pinggir pupa tidak rata dan
ter dapat tujuh pasang seta pada bagian dorsal dan satu pasang pada ujung anal.
Vasiform orifice berbentuk segitiga dan memanjang, serta operkulum menutupi
hampir separuh bagian dari vasiform orifice.
Tubuh imago B. tabaci berwarna kuning, panjang 1.0-1. 5 mm dan
sayapnya tertutup oleh tepung berwarna putih (Kalshoven 1981). Menurut
Gameel (1977), imago berwarna putih kekuning – kuningan, tubuh imago ditutupi
oleh sekresi seperti tepung. Imago jantan berukuran lebih kecil daripada betina,
sayap depan berwarna putih, mempunyai antena tujuh ruas dengan ruas ketiga
lebih panjang daripada ruas yang lain, sedangkan ruas terakhir meruncing dan
ditutupi oleh rambut-rambut. Imago B. tabaci yang baru menjadi dewasa akan
mengembangkan sayapnya selama lebih kurang 8-15 menit dan kemudian tubuh
serangga mulai tertutupi tepung lilin. Lama hidup imago bervariasi tergantung
pada keadaan lingkungan dan faktor-faktor lain. Menurut Kalshoven (1981) lama
hidup imago B. tabaci di Indonesia berkisar enam hari, sedangkan Gamel (1977)
melaporkan B. tabaci di Sudan lama hidup serangga jantan umumnya lebih
pendek dibandingkan dengan serangga betina yaitu 9.54-17.20 hari, sedangkan
yang betina dapat mencapai 37.75-74.20 hari.
Kisaran Inang B. tabaci
B. tabaci mempunyai kisaran inang lebih dari 600 spesies tanaman
(Greathead 1986) yang berasal dari 63 famili tanaman (Mound & Halsey 1978).
Serangga tersebut mempunyai sifat polifagus (Costa & Brown 1990, 1991) dan
sejumlah besar spesies tanaman tahunan dan setahun yang telah dibudidayakan
maupun yang belum dibudidayakan sesuai untuk makan dan/atau inang
reproduksi (Bedford et al. 1992, 1994; Brown et al. 1992, 1995b). Mound &
Halsey (1978) menunjukkan bahwa sebanyak 50% spesies tanaman yang
merupakan inang kutukebul berasal dari famili Fabaceae, Asteraceae, Malvaceae,
Solanaceae dan Euphorbiaceae. Di antara famili tersebut 99% spesies tanaman
Hubungan inang B. tabaci yang kompleks terjadi di Puerto Rico yaitu
biotipe Sida bersifat polifagus dan biotipe Jatropha bersifat monofagus berada
pada daerah geografi yang sama, tetapi relung ekologinya berbeda (Brown et al.
1995b).
Menurut Lima et al. (2000) dan Oliveira et al. (2000) di Brazil kutukebul
telah menginfestasi tanaman baru dan gulma sebagai inang. Gulma yang menjadi
inang kutukebul tersebut adalah: Cleome espinosa (Cleomaceae), Senna
obtusifolia (Fabaceae), Herisanthia hemoralis (Malvaceae), Richardia
grandiflora, Borreria verticilliata (Rubiaceae), Waltheria indica, W. Rotundifolia
(Sterculicaceae), dan Stachytarpheta sanguinea (Verbenaceae). Simmon et al.
(2000) melaporkan bahwa inang baru kutukebul di Amerika Serikat: Hyperium
perfolatum (Hypericaceae), Valeriana officinalis (Valerianaceae), Tanacetaum
parthenium, Echinaceae pallida, E. Purpurea (Asteraceae).
Kerusakan yang Disebabkan B. tabaci
B. tabaci merupakan hama penting pada banyak tanaman. Menurut
Berlinger (1986) ada 3 tipe kerusakan yang disebabkan oleh B. tabaci :
(1) Kerusakan secara langsung. Kerusakan tersebut disebabkan oleh bekas
tusukan stiletnya sewaktu mengambil sap dari daun tanaman. Akibat aktivitas
makan tersebut menyebabkan tanaman menjadi lemah dan layu, menurunkan
pertumbuhan tanaman dan hasil. Disamping itu B. tabaci menyebabkan daun
klorosis, kering, jatuh sebelum waktunya dan tanaman menjadi mati. Infestasi
nimfa menyebabkan terjadinya irregular ripening pada buah tomat dan warna
daun tanaman labu menjadi seperti keperak-perakan (silverleaf (SSL)). Johnson
et al. (1992) menunjukkan bahwa semakin meningkat populasi kutukebul yang
ada pada tanaman selada di Hawai, mengakibatkan bongkol selada menjadi kerdil,
menguning dan tanaman mati. Beberapa tanaman sayuran yang terinfestasi
kutukebul menjadi kerdil, menguning, belang-belang dan batang menjadi putih
dengan meningkatnya populasi kutukebul. (2) Kerusakan secara tidak langsung.
Kerusakan secara tidak langsung disebabkan oleh akumulasi embun madu yang
dihasilkan kutukebul. Embun madu merupakan substrat untuk pertumbuhan
cendawan embun jelaga pada daun dan buah. Adanya cendawan ini menyebabkan
Kerusakan karena kemampuannya sebagai vektor virus tanaman. Menurut Cohen
& Berlinger (1986) populasi kutukebul yang kecil sudah dapat menyebabkan
kerusakan tanaman. Hal tersebut karena kutukebul merupakan vektor virus
tanaman. Virus tanaman yang ditularkan oleh kutukebul menyebabkan lebih dari
40 penyakit tanaman sayuran dan umbi di seluruh dunia. Ada 1.100 spesies
kutukebul yang diketahui di dunia, tetapi hanya tiga spesies yang dapat berperan
sebagai vektor virus tanaman. Kutukebul ubi jalar umum ditemukan dan
merupakan vektor virus tanaman di dunia. Kutukebul tersebut diketahui sebagai
vektor kelompok begomovirus.
Biotipe B. tabaci
Menurut Bedford et al. (1992, 1994) dan Burban et al. (1992) populasi
kutukebul yang berasal dari geografi yang berbeda menunjukkan perbedaan dalam
kemampuan makan, reproduksi dan kemampuan dalam menularkan begomovirus.
Populasi kutukebul tersebut secara morfologi tidak dapat dibedakan secara jelas,
tetapi menunjukkan beberapa perbedaan dalam bertahan dan berkembang
khususnya terhadap inang. Menurut Claridge et al. (1997) suatu populasi
serangga yang secara morfologi kurang dapat dibedakan, tetapi mempunyai
karakteristik lain yang berbeda dengan populasi lainnya disebut biotipe. Biotipe
kutukebul biasanya ditandai oleh adanya reaksi fitotoksik spesifik (Yokomi et al.
1990; Brown et al. 1992; Byrne et al. 1995a). Sampai saat ini diketahui ada
sekitar 20 biotipe kutukebul dengan tingkat karakter yang berbeda. Beberapa
biotipe tersebut mempunyai kisaran inang dan distribusi geografis yang terbatas,
tetapi yang lainnya terutama biotipe B, memiliki kisaran inang dan sebaran
geografis yang luas (Bedfort et al. 1994).
Perring et al. (1993) menggunakan PCR-RAPD untuk menunjukkan
perbedaan hasil amplifikasi antara biotipe A dan B. Hasil pengujian tersebut
menunjukkan bahwa 90% ukuran pita mirip di dalam populasi setiap biotipe dan
hanya 10% ukuran pita mirip antar biotipe. Dengan teknik yang sama Gawel &
Bartlett (1993) melaporkan hasil yang mirip dan berhasil menunjukkan perbedaan
B. tabaci biotipe A dan biotipe B dengan mudah. Hasil penelitian Moya et al.
(2001) berhasil mendeterminasi keanekaragaman genetik populasi B. tabaci yang
merupakan biotipe Q, satu populasi biotipe B dan yang lainnya merupakan
campuran kedua biotipe tersebut.
Hubungan genetik antar biotipe B. tabaci juga dapat dideteksi dengan
marker molekuler yang lain yaitu melalui teknik amplified fragment length
polymorphism (AFLP). Berdasarkan marker AFLP Cervera et al. (2000)
membagi biotipe B. tabaci menjadi 4 kelompok, (1) biotipe dari bagian selatan
dan subkontinental India; (2) biotipe B dan Q serta populasi Nigerian dari kacang
panjang; (3) biotipe A dari dunia baru; dan (4) biotipe S dan populasi Nigerian
dari ubi kayu. Hasil ini konsisten dengan penelitian Guirao et al. (1997) yaitu
pengelompokkan biotipe yang didasarkan analisis PCR-RAPD.
Perbedaan Kelompok dalam Kompleks Spesies B. tabaci
Populasi B. tabaci telah dipelajari melalui berbagai macam teknik
sehingga dapat dikelompokkan dalam kompleks spesies. P engujian dengan
berbagai macam teknik tersebut menunjukkan hasil yang konsisten, sehingga
menempatkan biotipe khusus dalam suatu kelompok. Beberapa peneliti yang
menunjukkan hasil perbandingan pada sederetan populasi: diantaranya Bedford et
a l. (1994) melalui perkawinan, Rosell et al. (1997) melalui karakter morfologi,
Frohlich et al. (1999) melalui analisis gen 16S mitokondria dan COI, Brown et al.
(2000) melalui analisis allozyme, dan De Barro et al. (2000) melalui analisis
ribosomal ITS1. Hasil studi tersebut menunjukkan beberapa informasi yang dapat
digunakan untuk mengelompokkan populasi dan membedakannya dengan
populasi B. tabaci yang lain. Dengan menggunakan informasi tersebut terdapat 7
kelompok dalam kompleks spesies B. tabaci, yaitu:
Kelompok 1: Dunia lama(biotipe A, C, N, R)
Populasi B. tabaci yang ditemukan di baratdaya Amerika Serikat dan
Meksiko merupakan esterase biotipe A. Pada daerah geografi tersebut umumnya
ditemukan biotipe A hingga pertengahan tahun 1980-an terbawa biotipe B.
Populasi B. tabaci yang telah melalui evaluasi tipe kawin dikumpulkan dari
Sinaloa, Meksiko (Brown et al. 2000) dan Baratdaya Amerika Serikat (Liu et al.
ditemukan adanya anterior sub-marginal setae nomor 4 (ASMS4), sedangkan pada
kutukebul yang lainnya tidak ditemukan adanya ASMS4 (Rosell et al. 1997).
Hasil pengujian dengan ribosomal ITS1, biotipe A dari Baratdaya Amerika
Serikat satu kelompok dengan kutukebul dari Costa Rica yaitu esterase biotipe C.
Kutukebul dari Columbia yang merupakan esterase biotipe R ternyata
menunjukkan hubungan dengan biotipe A dan C, walaupun terbentuknya
hubungan tersebut masih berbeda subkelompok dalam kelompok (De Barro et al.
2000). Frohlich et al. (1999) menggunakan gen 16S dan gen CO1 yang berasal
dari mitokondria menempatkan kutukebul dari Puerto Rico yang berasal dari
tanaman Jatropha gossypifolia dan merupakan esterase biotipe N termasuk
kelompok New World. Hasil penelitian Rosell et al. (1997) menunjukkan bahwa
morfologi biotipe N mempunyai ASMS4 yang mirip dengan biotipe A.
Kelompok 2: Kosmopolitan (biotipe B (= B. argentifolii), B2)
Salah satu karakteristik yang membedakan biotipe B dan B2 dengan
biotipe yang lain adalah kerusakan fisiologi pada tanaman yang terinfestasi.
Kerusakan yang disebabkan oleh biotipe tersebut adalah warna daun tanaman labu
berubah menjadi keperak-perakan (SSL) dan pematangan buah tomat tidak teratur
(irregular ripening). Kedua gejala tersebut dapat digunaka n untuk menentukan
adanya biotipe B. Bermacam-macam metode pengujian seperti esterase, RAPD
dan biologi telah dilakukan untuk membandingkan biotipe B dengan biotipe yang
lainnya (Brown et al. 1995b; De Barro 1995; Perring 1996). Hasil pengujian
biologi dan genetik yang dilakukan oleh Perring et al. (1993) menunjukkan bahwa
biotipe A berasal dari Kalifornia, Amerika Serikat dan membuktikan bahwa
biotipe B cukup berbeda pada tingkat spesies. Bellows et al. (1994)
mendeskripsikan biotipe B sebagai B. argentifolii Bellows and Pering dengan
nama umum kutukebul daun perak.
Hasil evaluasi pengujian kawin menunjukkan bahwa populasi dari
Australia (De Barro & Hart 2000), Cyprus (bedford et al. 1994), Israel (Bedford
et al. 1994, Byrne et al. 1995b), Amerika Ser ikat bagian Selatan (Liu et al.
1992, Costa et al. 1993, Perring et al. 1993, Bedford et al. 1994) dan Yaman
(Bedford et al. 1994) berhasil terjadi perkawinan. Menurut Brown et al.