POTENSI TERAPI HORMON TESTOSTERON
TERHADAP EKSPRESI β AMYLOID PADA MARMUT
SEBAGAI MODEL PENYAKIT ALZHEIMER
YULI PURWANDARI KRISTIANINGRUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Potensi Terapi Hormon Testosteron terhadap Ekspresi β Amyloid pada Marmut sebagai Model Penyakit Alzheimer adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
YULI PURWANDARI KRISTIANINGRUM. Potensi Terapi Hormon Testosteron terhadap Ekspresi β Amyloid pada Marmut sebagai Model Penyakit Alzheimer. Dibimbing oleh DONDIN SAJUTHI, EKOWATI HANDHARYANI dan ERNI SULISTIAWATI
Sejalan dengan peningkatan umur mengakibatkan terjadinya penurunan kadar hormon testosteron yang signifikan pada laki-laki. Penurunan kadar hormon testosteron ini berhubungan dengan gangguan fungsi pada organ-organ tubuh yang responsif terhadap androgen seperti otak, tulang, otot dan jantung. Penurunan kadar androgen pada otak dari aksi sel neuron selama proses penuaan menyebabkan peningkatan disfungsi dan resiko penyakit neurodegeneratif antara lain penyakit Alzheimer. Selain hormon testosteron berperan penting dalam perkembangan organ reproduksi dan tingkah laku pada laki-laki, hormon testosteron dapat menurunkan pembentukan plak β amyloid pada proses amyloid prekursor protein. Deplesi testosteron yang dilakukan dengan kastrasi dapat meningkatkan kadar β amyloid dalam plasma darah dan cairan serebrospinal serta menurunkan kadar testosteron dalam plasma darah. Salah satu cara pendekatan yang dilakukan untuk mengatasi kejadian penyakit Alzheimer adalah menggunakan terapi hormon testosteron. Pemberian hormon testosteron dapat menurunkan pembentukan plak β amyloid pada organ otak.
Penelitian ini bertujuan untuk mendapatkan informasi perubahan tingkat seluler dari β amyloid pada otak marmut sebagai hewan model penyakit Alzheimer dengan kondisi deplesi testosteron dan potensi terapi hormon testosteron yang berhubungan dengan patogenesis penyakit Alzheimer. Tahap pertama penelitian adalah penentuan kondisi hewan model marmut yang berhubungan dengan patogenesis pembentukan plak β amyloid, kadar testosteron, kadar β amyloid pada plasma darah dan cairan serebrospinal. Tahap kedua penelitian bertujuan untuk mengetahui potensi pemberian terapi hormon testosteron terhadap hewan model marmut yang berhubungan dengan perubahan patologi otak, kadar testosteron, kadar β amyloid pada plasma darah dan cairan serebrospinal.
Hasil penelitian menunjukkan bahwa perlakuan deplesi hormon testosteron dengan cara kastrasi dapat menurunkan kadar testosteron yang signifikan dalam sirkulasi darah. Selain itu juga terjadi peningkatan pada kadar β amyloid pada cairan serebrospinal dan plasma darah. Berdasarkan pengamatan secara histologi dengan pewarnaan Hematoxillin & Eosin (HE), penurunan kadar testosteron ini menyebabkan peningkatan tingkat kematian sel otak (nekrosis) dan disertai dengan peningkatan aktivitas sel-sel glia. Pada pewarnaan secara immunohistokimia menunjukkan adanya pembentukan plak β amyloid pada otak setelah tiga bulan pasca kastrasi. Marmut tua yang dikastrasi minimal selama tiga bulan dapat digunakan sebagai hewan model penyakit Alzheimer yang berhubungan dengan pembentukan plak β amyloid.
cairan serebrospinal dan plasma darah. Perubahan secara histopatologi dengan pewarnaan HE dapat diamati antara lain adanya penurunan kerusakan sel otak (nekrosis), sedangkan dengan pewarnaan immunohistokimia terlihat adanya penurunan plak β amyloid pada jaringan otak dan pembuluh darah otak. Dengan demikian dapat disimpulkan bahwa pemberian injeksi hormon testosteron dapat berfungsi untuk memperbaiki kerusakan otak akibat deplesi hormon testosteron.
SUMMARY
YULI PURWANDARI KRISTIANINGRUM. Potency of Testosterone Hormone Therapy to amyloid β Expression in the Guinea pig as Alzheimer’s disease Model. Dibimbing oleh DONDIN SAJUTHI, EKOWATI HANDHARYANI dan ERNI SULISTIAWATI
A consequence of aging is a decline in circulating and brain level of the steroid hormone. Testosterone depletion leads functional organs impairment that are responsive to androgens such as bone, muscle, brain and heart. Decreased levels of androgens on brain neuronal cells during the aging process causes the dysfunction and an increased risk of neurodegenerative diseases include Alzheimer's disease. The hormone testosterone plays an important role in the development of reproductive organs and behavior in males. Testosterone can
reduce amyloid plaque formation in the process of amyloid β precursor protein.
Testosterone depletion by castration performed can increase the levels of β
amyloid in the blood plasma and cerebrospinal fluid as well as lower testosterone levels in the blood plasma. One of the ways the approach taken to address the incidence of Alzheimer's disease is the use of testosterone therapy. Giving
testosterone can reduce the formation of amyloid β plaques in the brain organ. This study aimed to gain insight into changes in cellular levels of β amyloid
in the brains of guinea pigs as an animal model of Alzheimer's disease with the condition of depletion of testosterone and testosterone therapeutic potential associated with the pathogenesis of Alzheimer's disease. The first phase of the study is to determine the condition of an animal model of guinea pigs is associated
with the pathogenesis of β amyloid plaque formation, testosterone levels, amyloid β levels in blood plasma and cerebrospinal fluid. The second phase of the study
aimed to determine the potential of testosterone therapy on an animal model of guinea pigs is associated with pathological changes in the brain, testosterone
levels, amyloid β levels in blood plasma and cerebrospinal fluid.
The results showed that treatment with testosterone depletion castration method can significantly reduce levels of testosterone in the blood circulation.
There was also an increase in the levels of β amyloid in cerebrospinal fluid and
blood plasma. Based on the histological observation Hematoxillin & Eosin (HE) staining, the decline in testosterone levels cause increased levels of brain cell death (necrosis) and is accompanied by an increase in the activity of glial cells.
On the basis immunohistochemical staining showed the presence of β amyloid
plaque formation in the brain after three months post castration. Old guinea pigs were castrated at least three months can be used as an animal model of Alzheimer's disease-related amyloid β plaque formation.
Testosterone injections can significantly increase testosterone levels in the blood circulation, especially in the high-dose testosterone injection group. Increased levels of testosterone affect picture pathological changes in the brain
and decreased levels of β amyloid in cerebrospinal fluid and blood plasma.
testosterone injections can repair brain damage caused by testosterone hormone depletion.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Biomedis Hewan
POTENSI TERAPI HORMON TESTOSTERON
TERHADAP EKSPRESI β AMYLOID PADA MARMUT
SEBAGAI MODEL PENYAKIT ALZHEIMER
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup: 1. Prof drh Kurniasih, MVSc PhD 2. Prof Dr drh Maria Bintang, MS
Judul Disertasi : Potensi Terapi Hormon Testosteron terhadap Ekspresi β Amyloid pada Marmut sebagai Model Penyakit Alzheimer
Nama : Yuli Purwandari Kristianingrum
NIM : B361100011
Disetujui oleh Komisi Pembimbing
Prof drh Dondin Sajuthi, MST PhD Ketua
Prof drh Ekowati Handharyani, MSi PhD Anggota
Dr drh Erni Sulistiawati, SP1 Anggota
Diketahui oleh
Ketua Program Studi Ilmu Biomedis Hewan
Drh Agus Setiyono, MS PhD
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2012 sampai Januari 2014 ini ialah hewan model penyakit Alzheimer, dengan judul Potensi Terapi Hormon Testosteron terhadap Ekspresi β Amyloid pada Marmut sebagai Model Penyakit Alzheimer.
Terima kasih penulis ucapkan kepada Bapak Prof drh Dondin Sajuthi, MST PhD, Ibu Prof drh Ekowati Handharyani, MSi PhD dan Ibu Dr drh Erni Sulistiawati, SP1 selaku Komisi Pembimbing, yang telah banyak memberikan bimbingan, pengarahan dan memberikan kemudahan fasilitas selama pelaksanaan penelitian. Terima kasih penulis ucapkan kepada Ibu Prof drh Kurniasih, MVSc PhD dan Ibu Prof Dr drh Maria Bintang, MS selaku penguji luar komisi pada ujian sidang tertutup dan Bapak drh Agus Setiyono, MS PhD sebagai pimpinan sidang ujian tertutup. Terima kasih juga penulis ucapkan kepada Bapak Prof Dr dr Eka Julianta Wahjoepramono, SpBS PhD dan Bapak drh Adi Winarto, PhD atas kesediaannya menjadi penguji luar komisi pada sidang ujian terbuka dan Bapak Prof drh Srihadi Agungpriyono, PhD sebagai pimpinan sidang ujian terbuka.
Di samping itu, penghargaan penulis sampaikan kepada Ketua program Studi Ilmu Biomedis Hewan Bapak drh Agus Setiyono, MS Ph.D dan semua staf pengajar Program Studi Ilmu Biomedis Hewan, Bapak Kasnadi, Bapak Sholeh dan Bapak Endang dari Laboratorium Patologi, FKH IPB, serta Ibu drh. Imelda L. Winoto beserta staf karyawan Fasilitas Hewan Laboratorium PT. Indoanilab atas segala bantuan tenaga dan fasilitas selama pelaksanaan penelitian. Terima kasih juga penulis sampaikan kepada Staf Laboratorium Patologi dan Mikrobiologi, Pusat Studi Satwa Primata, IPB yang telah banyak membantu selama penelitian. Selain itu terima kasih banyak kepada Bapak drh. Huda S. Darusman, MSi dan Bapak Ghalib, MSi atas kerjasama dan bantuannya selama penelitian. Selain itu juga terima kasih pada rekan-rekan mahasiswa IBH, BRP dan rekan sejawat di Fakultas Kedokteran Hewan, Universitas Gadjah Mada yang telah banyak memberikan dorongan kepada penulis untuk menyelesaikan tugas belajar ini serta semua pihak yang telah banyak membantu penulis.
Ungkapan terima kasih sedalam-dalamnya juga disampaikan kepada suami tercinta Edy Purwanto dan anak-anak penulis Thalia Mutiara Fikri dan Thalik Abraham serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Saran 72
DAFTAR PUSTAKA 73
DAFTAR TABEL
1 Rataan berat badan marmut masing-masing kelompok 20 2 Rata-rata perbedaan level testosteron pada plasma darah dari
kelompok perlakuan (ng/ml) 22
3 Rerataan perbedaan level β amyloid pada plasma darah dan CSF dari
kelompok perlakuan (pg/ml) 24
4 Rataan berat badan marmut masing-masing kelompok 46 5 Rerataan berat otak masing-masing kelompok perlakuan 48 6 Rataan kadar testosteron marmut masing-masing kelompok (ng/ml) 50 7 Rerataan hasil pengukuran kadar β amyloid pada cairan serebrospinal
marmut dari kelompok perlakuan (pg/ml) 53
8 Rerataan hasil pengukuran kadar β amyloid pada plasma darah marmut
dari kelompok perlakuan (pg/ml) 53
DAFTAR GAMBAR
1 Bagan alur kerangka pemikiran 5
2 Proses amyloid prekursor protein 6
3 Androgen mengaktifkan jalur neuroprotektif yang mengurangi
kejadian Alzheimer’s disease 11 4 Grafik pertumbuhan berat badan kelompok perlakuan 21 5 Rerataan kadar testosteron dalam plasma darah marmut pre dan post
kastrasi dari masing-masing kelompok 22
6 Rerataan kadar β amyloid pada cairan serebrospinal dan plasma darah 24 7 Pemeriksaan makroskopik otak marmut usia dan potongan melintang
1/3 belakang 26
8 Grafik rerataan hasil penimbangan otak marmut dari masing-masing
kelompok perlakuan 26
9 Histopatologi otak marmut usia tua kastrasi tiga bulan pada daerah
hipokampus 27
10 Histopatologi otak marmut usia tua kastrasi tiga bulan pada daerah
korteks 28
11 Grafik perhitungan jumlah sel neuron yang mengalami kematian sel
(nekrosis) pada masing-masing bagian otak 28
12 Histopatologi otak marmut usia tua dengan kastrasi tiga bulan dengan
pewarnaan Congo red 30
13 Histopatologi otak marmut usis tua dengan kastrasi tiga bulan dengan
pewarnaan Congo red 30
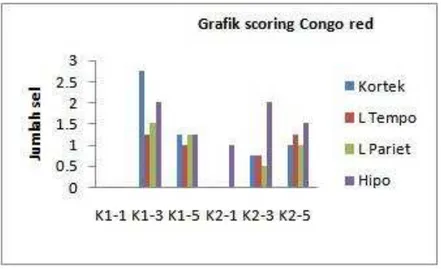
14 Grafik perhitungan congo[hilic angiopathy dan jumlah sel neuron ysng
beraksi positif dengan pewarnaan Congo red 31
15 Immunohistokimia otak marmut usia tua kastrasi tiga bulan pada bagian
korteks 32
16 Immunohistokima otak marmut usia tua kastrasi tiga bulan bagian lobus
17 Grafik perhitungan atau scoring jumlah sel neuron, parenkim dan pembuluh darah yang bereaksi positif terhadap βA 33 18 Grafik tren penurunan dan peningkatan berat badan dari masing-masing
kelompok perlakuan 47
19 Berat otak dari masing-masing kelompok marmut 49 20 Grafik kadar testosteron dari masing-masing kelompok perlakuan 51 21 Kadar β amyloid dalam cairan serebrospinal dan plasma darah 53 22 Organ otak marmut yang terlihat normal dan tidak menunjukkan
perubahan patologi yang spesifik 55
23 Grafik rerataan hasil penimbangan berat otak marmut dari
masing-masing kelompok perlakuan 55
24 Histopatologi otak marmut kelompok kastrasi lima bulan dengan
pewarnaan HE 56
25 Histopatologi otak marmut kelompok kastrasi lima bulan dengan injeksi
testosteron dosis tinggi 57
26 Grafik perhitungan atau scoring lesi histopatologi dengan pewarnaan
HE 58
27 Histopatologi otak marmut kastrasi lima bulan dengan pewarnaan
Congo red 59
28 Histopatologi hipokampus otak marmut kelompok kastrasi lima bulan
dengan pewarnaan Congo red 60
29 Grafik perhitungan atau scoring jumlah sel neuron yang bereaksi positif
terhadap pewarnaan Congo red 61
30 Histopatologi otak bagian korteks dari marmut kelompok kastrasi lima
bulan kontrol 62
31 Histopatologi otak bagian korteks dari marmut kastrasi lima bulan
dengan injeksi testosteron dosis tinggi 63
32 Histopatologi otak bagian korteks dari marmut kastrasi lima bulan
dengan injeksi testosteron dosis rendah 63
33 Grafik perhitungan akumulasi plak β amyloid pada jaringan otak dari
Penyakit Alzheimer (AD) merupakan suatu penyakit yang bersifat irreversible, dan ditandai dengan kehilangan memori serta kognitif yang bersifat progresif. Penyakit ini dibagi menjadi 2 subtipe berdasarkan waktu ketuaan yaitu early-onset AD (EOAD) dan late-onset AD (LOAD). Early-onset AD berjumlah sekitar 1% sampai 6% dari total kasus dan berkisar umur 30 tahun sampai 60 atau 65 tahun. Namun demikian, LOAD merupakan bentuk paling banyak dari AD yang menyerang manusia umur 60 dan 65 tahun. Baik EOAD maupun LOAD kemungkinan besar terjadi pada orang dengan riwayat keluarga menderita penyakit Alzheimer. Sebanyak 60% kasus EOAD adalah dari keluarga yang memiliki riwayat penyakit Alzheimer (Brickell et al. 2006).
Hormon steroid merupakan hormon yang mengatur potensi hidup sel syaraf pada sistem syaraf pusat (CNS) dari perkembangan normal sampai kerusakan syaraf. Hal ini sangat memungkinkan bahwa terapi hormon steroid merupakan langkah strategis dalam mengatasi gangguan neurodegeneratif seperti penyakit Alzheimer (Akiyama et al. 2000; LaFerla and Oddo 2005). Testosteron dan metabolit aktifnya dihydrotestosteron (DHT) mempunyai aksi penting pada otak. Aksi androgen ini dimediasi melalui pengaktifan reseptor androgen (AR) pada otak yang merupakan daerah penting untuk kecerdasan dan memori seperti hipokampus dan amigdala (Kerr et al. 1995; Simerly et al. 1990; Tohgi et al. 1995). Aksi penting androgen pada otak meliputi stimulasi diferensiasi neuron, mempertahankan bentuk neuron dan mendukung densitas sinaps (Leranth et al. 2004). Studi yang dilakukan pada hipokampus tikus jantan menunjukkan adanya penurunan signifikan pada densitas sinaps setelah dilakukan kastrasi. Efek sebaliknya terjadi pada pemberian terapi testosteron atau DHT (Kovacs et al. 2003; Leranth et al. 2003). Selain itu aksi androgen pada neuron dapat mengatur penurunan kejadian astrogliosis ( Day et al. 1998).
Penurunan konsentrasi testosteron terjadi mulai dekade ketiga dan berlanjut rata-rata 0.2% - 1% dari total testosteron (Gray et al. 1991; Muller et al. 2003). Sebanyak 30% - 70% laki-laki yang berumur 70 tahun dan lebih mengalami hypogonad, kurang lebih 5 juta laki-laki tua di Amerika Serikat menderita akibat andropouse dan hanya sebagian kecil yang telah menerima pengobatan hormon (Morley and Perry 2003).
Aksi neuron lain dari androgen adalah mengatur viabilitas neuron selama perkembangan apoptosis (Lund etal. 2000), sedangkan pada otak dewasa berfungsi untuk melindungi terhadap agen toksik. Pada studi sel kultur neuronal menunjukkan bahwa terlihat adanya efek neuroprotektif dari androgen melawan penghilangan serum (Hammond et al. 2001), toksisitas β amyloid (βA) (Pike 2001, Zhang et al. 2004, Nguyen et al. 2005) dan stress oksidatif (Ahlbom et al.2001). Penelitian pada hewan model, menunjukkan bahwa pemberian testosteron dan DHT dapat meningkatkan regenerasi syaraf kranial (Yu 1982) dan menurunkan hilangnya neuron motorik akibat axotomy (Yu 1989). Hal yang sama juga terjadi pada hamster jantan yang mengalami kerusakan syaraf facialis, bahwa pemberian testosteron dapat meningkatkan pertumbuhan axon dan kembalinya fungsi sel syaraf (Kujawa et al 1991).
Peningkatan kadar phosphorilasi dan total protein tau pada cairan cerebrospinal berkorelasi dengan penurunan penilaian kognitif. Peningkatan stress oksidatif, fungsi ikatan protein dari retikulum endoplasmik yang tidak seimbang, defisiensi proteasom dan pembersihan dari protein yang rusak, berhubungan dengan proses penuaan yang dapat mempercepat akumulasi protein tau pada penyakit Alzheimer (Hoozemans et al. 2005). Plak dan tangles juga dapat ditemukan pada hewan yang tua tanpa menunjukkan terjadinya gangguan kognitif. Jumlah plak dan tangles berperan penting dalam penurunan kecerdasan pada penyakit Alzheimer yang ditemukan pada daerah neokorteks, hipokampus dan amigdala. Hipokampus sangat berperan penting dalam proses penerimaan informasi, penyimpanan memori baru dan pengungkapan memori lama (Kumar et al. 2005).
Mekanisme androgen dalam mengatur β amyloid belum diketahui dengan pasti. Hormon testosteron mempunyai efek seluler melalui tiga jalur yaitu: 1) Aksi langsung melalui aktivasi androgen reseptor dependent pathways, 2) Secara tidak langsung melalui jalur estrogen dengan diaromatisasi menjadi estradiol, dan 3) Aksi secara tidak langsung melalui jalur gonadotropin dengan memodulasi testosteron dari axis gonad hypothalamic-pituitary. Penelitian sebelumnya membuktikan bahwa pengaturan androgen terhadap β amyloid melibatkan salah satu atau ketiga alur tersebut (Ramsden et al.2003). Metabolisme dari amyloid prekursor protein (APP) yang diperantarai oleh estrogen secara tidak langsung dapat menurunkan kadar β amyloid terlarut (Goodenough et al. 2000).
Penelitian ini bertujuan untuk mendapatkan informasi tentang perubahan tingkat seluler beta amyloid pada otak marmut dengan kondisi deplesi hormon testosteron dan potensi terapi hormon testosteron yang berhubungan dengan salah satu patogenesis penyakit Alzheimer. Kondisi tersebut menyerupai keadaan laki-laki yang tua dengan penurunan hormon testosteron pada sirkulasi darah dan otak sebagai salah satu predisposisi penyakit Alzheimer.
Perumusan masalah
hormon testosteron dalam perbaikan plak β amyloid pada marmut yang belum pernah ada laporan atau publikasinya.
Marmut tua berpotensi sebagai hewan model penyakit Alzheimer dengan perubahan tingkat seluler pada otak dan pemberian terapi hormon testosteron berpotensi dalam memperbaiki kondisi penyakit Alzheimer. Sejauh ini penelitian penyakit Alzheimer yang dilakukan pada hewan model marmut tua belum diperoleh gambaran tentang perubahan tingkat seluler pada otak marmut yang berhubungan dengan pembentukan plak β amyloid. Hal ini kemungkinan besar sangat dipengaruhi oleh penentuan umur marmut sebagai hewan model penyakit Alzheimer.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan hewan model yang tepat untuk penyakit Alzheimer yang berhubungan dengan proses pembentukan plak β amyloid dan mendapatkan informasi terhadap peran terapi hormon testosteron dalam penyakit Alzheimer. Adapun tujuan khusus dari penelitian ini adalah:
1. Penentuan umur hewan model marmut untuk penyakit Alzheimer dengan mengamati perubahan tingkat seluler plak β amyloid pada otak marmut, kadar testosteron dan β amyloid dengan kondisi deplesi hormon testosteron.
2. Mengetahui potensi terapi hormon testosteron untuk perbaikan kondisi penyakit Alzheimer dengan menggunakan parameter perbaikan tingkat seluler otak, kadar testosteron dan β amyloid.
Manfaat Penelitian
Keseluruhan data yang diperoleh dari hasil penelitian ini diharapkan dapat: 1. Memberikan gambaran tentang pembentukan plak β amyloid pada hewan
model marmut (Cavia porcellus) dengan deplesi hormon testosteron sebagai model penyakit Alzheimer.
2. Data ini dapat digunakan untuk penerapan dan pengembangan ilmu pengetahuan dalam bidang Kedokteran dan Farmasi terutama dalam terapi penyakit Alzheimer.
Kebaruan (Novelty)
Ruang Lingkup Penelitian
Hormon testosteron berperan penting dalam perkembangan organ reproduksi dan tingkah laku pada laki-laki. Selain itu juga, beberapa penelitian menunjukkan bahwa penurunan hormon testosteron berperan aktif dalam perkembangan penyakit Alzheimer (AD). Hormon testosteron dapat menurunkan pembentukan β amyloid dari amyloid prekursor protein. Deplesi hormon testosteron yang dilakukan dengan cara kastrasi dapat meningkatkan kadar β amyloid dalam plasma darah dan cairan serebrospinal serta menurunkan kadar hormon testosteron dalam plasma darah. Hormon testosteron dapat mencegah hiperfosforilasi τ (tau) yang diinduksi oleh aktivasi glikogen sintesa kinase 3β dengan menurunkan sintesis peptida β amyloid dan mencegah toksisitas neuron yang diperantari β amyloid. Kadar hormon testosteron akan mengalami penurunan sejalan dengan penambahan umur. Kondisi tersebut dikenal dengan andropouse. Penurunan tersebut dapat disebabkan oleh menurunnya jumlah sel leydig pada testis karena proses penuaan.
Peptida β amyloid berperan penting dalam proses perkembangan penyakit Alzheimer, sehingga penurunan produksi β amyloid dan peningkatan klirens β amyloid adalah target terapi (pengobatan) yang perlu dikembangkan. Terapi hormon testosteron merupakan salah satu terapi yang berpotensi untuk dikembangkan pada penderita penyakit Alzheimer. Berdasarkan penelitian terdahulu yang menggunakan hormon testosteron pada marmut, belum menunjukkan hasil yang positif terhadap peran hormon testosteron dalam menurunkan proses pembentukan plak β amyloid pada organ otak dan ginjal. Dengan demikian, perlu dilakukan penelitian untuk mengetahui efek atau pengaruh terapi hormon testosteron terhadap pembentukan plak β amyloid pada hewan coba marmut. Hal ini kemungkinan disebabkan karena waktu penelitian yang relatif singkat dan faktor umur hewan coba yang masih muda. Sehingga muncul pemikiran adanya perlakuan waktu yang lebih lama dalam mengamati pengaruh pemberian terapi hormon testosteron terhadap pembentukan plak β amyloid pada otak maupun pada cairan serebrospinal. Dari hasil penelitian ini diharapkan dapat diterapkan pada manusia dalam uji klinis untuk pengobatan penyakit Alzheimer pada laki-laki yang mengalami andropouse dan gangguan kognitif ringan. Masing-masing penelitian dilakukan dengan metode spesifik yang hasil dan pembahasannya disampaikan pada bagian tersendiri dari disertasi ini, dengan judul :
1. Ekspresi seluler β amyloid pada otak marmut (Cavia porcellus) sebagai
model penyakit Alzheimer dengan deplesi hormon testosteron
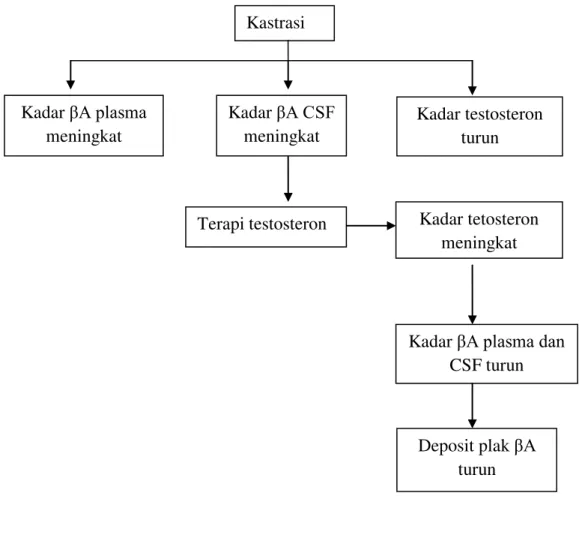
Gambar 1 Bagan alur kerangka pemikiran Kastrasi
Kadar βA CSF meningkat Kadar βA plasma
meningkat
Kadar testosteron turun
Terapi testosteron Kadar tetosteron meningkat
Kadar βA plasma dan CSF turun
2 TINJAUAN PUSTAKA
β amyloid
β amyloid (βA) merupakan produk proteolisis dari metabolisme amyloid
prekursor protein yang berperan dalam transport axon dan transkripsi gen (Turner et al. 2003) serta merupakan peptida dari asam amino 40 sampai 42 yang terakumulasi sebagai plak amyloid ekstraseluler pada otak yang menyebabkan kerusakan serabut syaraf dan dapat memicu kejadian penyakit neurodegeneratif. Pembentukan plak β amyloid berperan utama dalam proses neuropatologi penyakit Alzheimer (Checler 1995; Yanker 1996). Namun demikian, βA42 lebih dominan ditemukan pada plak amyloid pada otak penderita penyakit Alzheimer. Hal ini merupakan tahap awal pembentukan plak amyloid yaitu suatu protein amyloidogenik yang tidak larut dalam air. Konsekuensi dari ekspresi amyloid prekursor protein, β amyloid secara normal ditemukan sebagai protein terlarut dengan level rendah pada cairan dan jaringan tubuh. Secara teori, perubahan pada produksi dan pembuangan β amyloid akan meningkatkan level neuron yang akan memicu perkembangan dari penyakit Alzheimer (Hardy and Higgins 1992). Akumulasi β amyloid yang tinggi dalam bentuk ikatan oligomer yang tidak normal akan merubah struktur neuron dan dapat memicu ke arah penyakit neurodegeneratif (Haass and Selkoe 2007).
Gambar 2 Proses amyloid precursor protein (Querfurth and LaFerla 2010). Berdasarkan gambar di atas menunjukkan bahwa β amyloid berasal dari proteolisis amyloid precursor protein karena aktivitas enzimatik dari beta-site amyloid precursor protein-cleaving enzim 1 (BACE-1) yaitu β-secretase dan ϓ -secretase yang merupakan suatu protein komplek dengan presenilin 1 (Haass and Selkoe 2007) (Gambar 2). Adanya ketidakseimbangan antara produksi dan klirens kumpulan peptida β amyloid menyebabkan terjadinya akumulasi. Hal ini merupakan salah satu faktor pendukung terjadinya penyakit Alzheimer.
dilaporkan sebagai enzim yang paling umum pada otak (Iwata et al. 2001; Shirotany et al.2001). Enzim ini mengalami penurunan pada daerah otak yang terakumulasi β amyloid (Iwata et al. 2002). Neprilysin protease dan insulin degrading enzime (IDE) berfungsi dalam pengaturan level dari β amyloid. Neprilysin merupakan suatu membran zink endopeptidase yang mendegradasi monomer dan oligomer β amyloid. Penurunan neprilysin menyebabkan terjadinya akumulasi β amyloid pada otak (Iwata et al. 2001). Neprilysin adalah suatu enzim pengubah angiotensin dan enzim pemecah insulin yang memecah β amyloid ke dalam β amyloid yang mengalir melalui ruang ekstraseluler pada substansia grisea otak dan sepanjang jalur perivaskuler (Love et al. 2009). Neprilysin dihasilkan oleh neuron pyramidal dan sel otot polos pada dinding arteri. Penurunan neprilysin pada dinding arteri dan enzim lain pada arteri cerebralis berhubungan dengan penyakit Alzheimer (Miners et al. 2006). Beberapa NEP adalah protein membran tipe II dan berhubungan dengan ekstraseluler β amyloid dan mempunyai afinitas yang tinggi terhadap βA dibandingkan dengan neuropeptida lain (Shirotani et al.2001; Iwata et al. 2005). Peningkatan aktivitas NEP pada otak akan melindungi akumulasi β amyloid, melindungi neuron dari toksisitas β amyloid dan mengubah perkembangan penyakit Alzheimer (Salim et al. 2007). Sedangkan enzim pemecah insulin merupakan suatu thiol metalloendopeptidase yang memecah peptide-peptida kecil seperti insulin dan monomer β amyloid. Pada hewan mencit penghilangan enzim pemecah insulin dapat menurunkan pemecahan β amyloid lebih dari 50%. Sebaliknya peningkatan neprilysin atau enzim pemecah insulin dapat mencegah terjadinya pembentukan plak β amyloid (Leissring et al. 2003).
Serebrum
Bagian otak ini merupakan bagian terbesar dan paling berkembang sebesar 80% dari berat total otak. Bagian ini merupakan pusat kegiatan dan gerakan sadar serta beberapa gerakan refleks. Permukaan serebrum ditandai dengan adanya penonjolan yang disebut sulkus dan lekukan yang disebut girus. Serebrum terbagi menjadi dua bagian, yaitu hemisfer kanan dan kiri. Masing-masing hemisfer dibedakan menjadi empat lobus, yaitu lobus frontalis, lobus temporalis, lobus parietalis dan lobus oksipitalis. Setiap hemisfer terdiri dari lapisan luar tipis yang disebut kortek yang menutupi medulla yaitu bagian tengah yang lebih tebal dan berwarna putih.
Penurunan androgen pada laki-laki yang mengalami penuaan
Sejalan dengan peningkatan umur mengakibatkan terjadinya penurunan yang signifikan terhadap kadar hormon testosteron pada laki-laki (Swerdloff and Wang 1993). Penurunan total kadar hormon testosteron ini berlangsung mulai umur 30 tahun dan berlanjut rata-rata 0.2%-1% (Feldman et al.2002; Gray et al. 1991). Penurunan level testosteron yang berhubungan dengan umur secara normal berhubungan dengan gangguan fungsi pada organ-organ yang responsif terhadap androgen seperti tulang, otot dan jantung (Baumgartner et al.1999; Burger et al. 1998; Ferrando et al. 2002; Jones et al. 2003). Beberapa studi telah melaporkan bahwa terjadi perubahan pada mood, libido dan kognitif karena penurunan kadar hormon androgen (Gooren 2003; Kaufman and Vermeulen 2005; Morley 2001). Penurunan kadar hormon androgen pada otak terhadap aksi neuronal selama penuaan akan menyebabkan peningkatan disfungsi dan resiko penyakit neurodegeneratif termasuk penyakit Alzheimer.
Androgen dan Penyakit Alzheimer
Salah satu aksi penting dari hormon androgen yang berperan dalam menurunkan resiko penyakit Alzheimer adalah sebagai neuroproteksi. Hormon androgen berperan sebagai promotor viabilitas neuron selama perkembangan neuron pada otak dewasa terhadap kerusakan mekanik dan penyakit yang berhubungan dengan toksisitas (Jones et al. 2001). Selain itu juga mendukung survival neuron pada daerah otak yang mudah rusak karena penyakit neurodegeneratif seperti penyakit Alzheimer. Pada daerah otak seperti hipokampus dan kortek merupakan daerah yang peka terhadap penyakit Alzheimer dan kaya akan reseptor androgen (Simerly 1990). Pada penelitian yang dilakukan oleh Frye and Reed (1998); Frye and Seliga (2001) menunjukkan bahwa testosteron dapat menurunkan hilangnya neuron melalui penghambatan aktivitas kejang. Beberapa studi telah menemukan bahwa adanya proteksi dihydrostestosteron (DHT) terhadap 5α-androstane-3α, 17α-diol, yang merupakan androgen, dapat bertindak sebagai reseptor gamma amino butiric acid (GABA). Aktivitas GABA dapat menurunkan signaling eksitatori dalam meminimalkan kerusakan lesi otak (Edinger and Frye 2005).
Hormon androgen mempunyai fungsi kognitif yang berhubungan dengan tingkah laku (Gouchie and Kimura 1991) dan kelancaran verbal (Alexander et al. 1998). Pada beberapa studi menunjukkan bahwa kadar hormon androgen yang rendah berhubungan dengan gangguan fungsi kognitif (Haren et al. 2005; Moffat et al. 2004), penurunan visual memori, visuomotorik, memori verbal dan proses visuospatial (Moffat et al. 2004). Pada laki-laki dengan kadar hormon testosteron yang rendah dengan terapi hormon androgen dapat memperbaiki beberapa tingkah laku kognitif (Alexander et al. 1998).
penyakit Alzheimer (Rosario et al. 2004). Hilangnya hormon androgen dapat meningkatkan level β amyloid pada kasus penyakit Alzheimer (Hardy and Selkoe 2002).
Deplesi hormon androgen dapat terjadi selama 6 minggu pada tikus jantan dewasa yang mengalami gonadectomy. Peningkatan secara signifikan terjadi pada level β amyloid terlarut dibandingkan dengan tikus yang tidak mengalami gonadectomy. Selain itu pemberian terapi pada tikus yang digonadectomy selama 4 minggu dengan non-aromatized androgen DHT dapat mencegah peningkatan level β amyloid pada otak (Ramsden et al. 2003). Hal ini juga dapat diamati bahwa akumulasi β amyloid pada subiculum, hipokampus dan amigdala terjadi peningkatan signifikan akibat dari deplesi hormon androgen karena gonadectomy (Rosario et al. 2006).
Mekanisme androgen dalam pengaturan β amyloid
Hormon androgen dapat melindungi otak dari kejadian penyakit Alzheimer melalui pengaturan akumulasi β amyloid. Penelitian banyak dilakukan untuk mengetahui hubungan antara terapi anti-androgen pada laki-laki dan penyakit Alzheimer terhadap kejadian kanker prostat. Gandy et al. (2001) telah melakukan inisiasi terapi anti androgen dengan leuprolide dan flutamide. Pengamatan dalam beberapa minggu menunjukkan bahwa level testosteron dan estradiol dalam sirkulasi sangat menurun sedangkan level β amyloid meningkat secara signifikan. Penurunan hormon androgen dan peningkatan level β amyloid terjadi pada jantan yang menerima terapi anti androgen untuk pengobatan kanker prostat (Almeida and Flicker 2003 ) dan pada orang yang tua mengalami kehilangan memori atau demensia (Gillet et al. 2003).
Penelitian pada laki-laki tua menunjukkan hasil yang selaras dengan penelitian pada rodensia. Hal ini mengindikasikan bahwa hormon androgen berfungsi sebagai pengatur endogenous dari kadar β amyloid. Pada studi awal menunjukkan bahwa androgen mengurangi kadar β amyloid terlarut pada tikus jantan. Selanjutnya pemberian terapi DHT pada tikus orchiectomy (ORX) dapat menyebabkan penurunan yang signifikan kadar β amyloid pada otak (Ramsden et al. 2003). Perubahan yang sama terlihat pada hubungan antara kadar hormon androgen dan akumulasi β amyloid pada mencit model 3xTgAD yang dideplesi hormon androgen melalui ORX pada umur 3 bulan dan terjadi perkembangan patologi penyakit Alzheimer yang signifikan (Oddo et al. 2003). Mencit yang diberikan terapi DHT selama 4 bulan secara terus menerus, pada saat observasi menunjukkan bahwa terlihat akumulasi intraseluler yang signifikan β amyloid tidak terlarut pada gonad, sedangkan pada mencit umur 7 bulan pada CA1 hipokampus, subiculum dan amigdala (Rosario et al. 2006). Penelitian terbaru melaporkan bahwa level β amyloid dalam plasma dan cairan cerebrospinal secara signifikan meningkat pada marmut ORX, sedangkan efek perlindungan dari pemberian testosteron terjadi 1 minggu setelah ORX (Wahjoepramono et al. 2008).
testosteron secara tidak langsung melalui estrogen mediated regulation dari pembentukan APP. Pada studi awal untuk mengamati pengaturan testosteron dari APP dan β amyloid pada kultur ditemukan bahwa terapi testosteron yang lama dihubungkan dengan peningkatan α-secretase cleavage APP dan menurunkan β amyloid (Gouras et al. 2000). Pada penelitian berikutnya pada kultur sel menunjukkan bahwa testosteron mendukung proteolisis APP oleh α-secretase, namun demikian efeknya diblok oleh aromatase inhibitor estrogen dependent (Goodenough et al. 2000). Penelitian pada tikus jantan, ditemukan bahwa androgen mengatur kadar β amyloid pada otak, tetapi tidak ada perbedaan pada
panjang APP atau APPα kelompok terapi androgen. Hal ini mengindikasikan
bahwa perubahan pada pembentukan APP tidak hanya disebabkan oleh mekanisme yang mempengaruhi androgen terhadap level β amyloid (Ramsden et al. 2005).
Pengaturan β amyloid melalui proteolisis APP, hormon androgen juga menurunkan kadar β amyloid melalui jalur promosi endogenous clearance. Hormon androgen menurunkan kadar β amyloid sebagai konsekuensi ekspresi pengaturan enzim katabolisme β amyloid yaitu neprilysin, yang merupakan enzim homeostasis β amyloid pada otak (Wahjoepramono et al. 2008). Hormon testosteron diubah menjadi DHT oleh aksi 5α-reductase yaitu suatu enzim lokal pada target organ spesifik seperti prostat. Pertumbuhan prostat tergantung juga pada besarnya DHT (Wilson et al. 2007).
Aksi yang menguntungkan dari hormon androgen seperti viabilitas syaraf dan memodulasi kadar β amyloid dapat mendukung hipotesis bahwa penurunan hormon androgen yang berhubungan dengan umur dapat meningkatkan resiko perkembangan dari penyakit Alzheimer. Mekanisme pengaturan androgen terhadap β amyloid tidak diketahui, tetapi dapat diasumsikan melibatkan satu atau lebih dari ketiga jalur umum yaitu aksi langsung melalui jalur dependent androgen reseptor (AR), secara tidak langsung melalui jalur estrogen melalui aromatisasi estradiol, dan aksi secara tidak langsung melalui jalur gonadotropin dengan modulasi testosteron dari axis gonad hypothalamic-pituitary.
Hampir sama dengan hormon androgen, hormon estrogen juga ditemukan sebagai regulator endogenous dari β amyloid. Pada model sel kultur, 17B-estradiol dapat menurunkan kadar β amyloid secara langsung melalui β amyloid terlarut dan secara tidak langsung meningkatkan kadar soluble APPα (sAPPα) yang merupakan produk proteolitik dari non amyloidogenik dari metabolisme APP (Xu et al. 1998). Pada mencit transgenik AD, terapi selama 3 bulan dengan leuprolide asetat dapat menurunkan akumulasi β amyloid dan penurunan gangguan kognitif (Casadesus et al.2006). Selanjutnya terapi leutinizing hormone (LH) pada sel line neuroblastoma dapat meningkatkan kadar sekresi β amyloid dan menurunkan kadar sAPPα. Hal ini disebabkan karena LH mendukung proses amyloidogenik dari APP (Bowen et al. 2004). Gonadotropin juga berperan dalam pengaturan kadar β amyloid melalui pengubahan ekspresi dari presinilin sebagai mediator penting dalam produksi β amyloid (Barron et al. 2006).
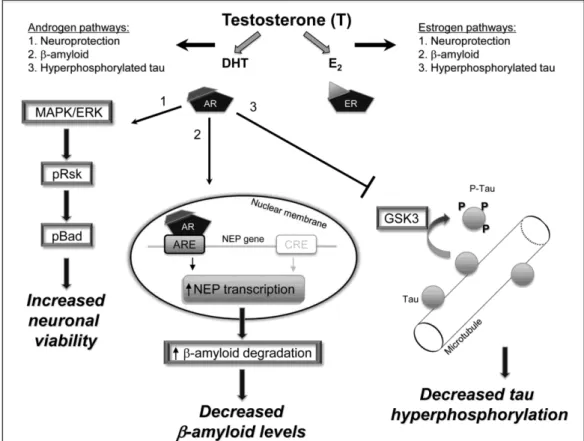
apoptosis pada neuronal melalui suatu non-genomik signaling kaskade yang melibatkan aktifasi dari MAPK/ERK, diikuti oleh aktifasi phosphorylation (p) dari Rsk, dan inaktifasi phosphorylation dari pro-apoptotic protein Bad. Selain itu, androgen menurunkan levels AD-related protein βA oleh mekanisme klasik genomik yang melibatkan aktifasi interaksi AR interaksi dengan androgen response elements (ARE) pada gen neprilysin, yang mengakibatkan peningkatan ekspresi dari enzim katabolisme βA.
Gambar 3 Mekanisme Androgen mengaktifkan jalur neuroprotektif yang mengurangi kejadian penyakit Alzheimer (Caroll and Rosario 2012) Ada beberapa resiko yang berhubungan dengan terapi hormon androgen, antara lain kanker prostat, atherosklerosis, kanker payudara dan hipertensi (Kaufman and Vermeulen 2005).
Diagnosis klinis penyakit Alzheimer
amyloid pada otak yang mengalami penyakit Alzheimer adalah β amyloid (βA) (Iwatsuko et al. 1994). Bentuk paling umum β amyloid pada manusia adalah asam amino dengan panjang 40 yang disebut βA40. Asam amino dengan panjang fragmen 42 (Aβ42), lebih sedikit dibandingkan dengan βA 40 dan hanya berbeda 2 asam amino tambahan pada C-terminus. Fragmen βA 42 fragment dihubungkan dengan AD (Bentahir et al. 2006). β amyloid berasal dari amyloid precursor protein (APP) setelah dipecah oleh secretase. Pertama, α-secretase (pemecah nonneurotoksik “normal”) atau β-secretase (pemecah potensial
neurotoxic “abnormal”) memecah APP, dan pemecah kedua dari produk β
-secretase oleh --secretase, memecah APP yang menghasilkan β amyloid (Haass et al. 1992; Shoji et al. 1995).
Marmut sebagai Hewan Model
Etika dalam penelitian ilmiah mengharuskan untuk mengurangi penggunaan hewan laboratorium dan jika dimungkinkan untuk diminimumkan. Namun demikian, penelitian pada hewan model masih diperlukan untuk mengetahui mekanisme penyakit-penyakit pada manusia dan percobaan strategi pengobatan baru. Dalam hal ini, penelitian dengan menggunakan hewan harus selalu disetujui oleh komite etik dan dilakukan sesuai dengan norma-norma yang ditentukan. Hewan tikus dan mencit merupakan hewan yang biasa digunakan untk hewan model penelitian penyakit-penyakit pada manusia. Hewan ini mempunyai siklus reproduksi yang pendek, angka kelahiran tinggi, berukuran kecil sehingga mudah dalam penanganan dan pemeliharaan (Sarasa and Pesini 2009). Namun demikian, hewan ini mempunyai struktur peptida β amyloid berbeda dengan manusia pada tiga asam amino dan gambaran lengkap β amyloid yang dihasilkan oleh proses amyloid prekursor protein juga berbeda dengan manusia. Peptida β amyloid pada mencit dan tikus berbeda dengan manusia dan marmut. Perbedaan tersebut pada asam amino ke-5 (arginin- glisin, ke-10 (lisin-fenilalanin), dan ke-13 (histidin- arginin) (Du et al. 2007).
3 EKSPRESI SELULER β AMYLOID PADA OTAK MARMUT (Cavia
porcellus) SEBAGAI MODEL PENYAKIT ALZHEIMER DENGAN
DEPLESI HORMON TESTOSTERON
ABSTRAK
Penuaan merupakan faktor yang paling signifikan dalam perkembangan beberapa penyakit neurodegeneratif seperti penyakit Alzheimer’s (AD). Dampak alami pada laki-laki normal dari penuaan adalah penurunan kadar hormon steroid pada sirkulasi dan otak. Penurunan testosteron memicu kerusakan fungsi organ termasuk otak. Penelitian ini bertujuan untuk mengamati ekspresi β amyloid pada otak marmut sebagai model penyakit Alzheimer dengan deplesi hormon testosteron dengan cara kastrasi. Sebanyak dua belas ekor marmut jantan (Cavia cobaya) yang dibagi dalam dua kelompok berdasarkan umur, enam ekor marmut berumur 16-32 bulan (kelompok I) dan enam ekor berumur 32-48 bulan (kelompok II). Kedua kelompok dikastrasi untuk menurunkan kadar hormon testosteron. Dua ekor marmut dari setiap kelompok dieutanasi atau nekropsi untuk mengamati perubahan pada organ otak pada satu, tiga dan lima bulan setelah kastrasi. Sampling darah untuk analisa kadar testosteron dilakukan dua kali yaitu sebelum dan setelah kastrasi bersamaan dengan waktu nekropsi dari masing- masing kelompok perlakuan. Cairan serebrospinal untuk analisa kadar β amyloid diambil pada sisterna magna sebelum waktu nekropsi. Kadar testosteron dari plasma darah dan β amyloid dianalisa dengan metode ELISA. Sampel otak diamati secara makroskopik dan mikroskopik dengan metode pewarnaan Hematoxylin & Eosin (HE), Congo red dan immunohistokimia terhadap antibodi β amyloid. Hasil penelitian menunjukkan bahwa terlihat ekspresi plak β amyloid pada otak pada kelompok kastrasi tiga dan lima bulan pada kedua kelompok umur. Pada kelompok marmut kastrasi satu bulan ekspresi plak β amyloid tidak begitu jelas. Gambaran umum yang tampak meliputi akumulasi plak β amyloid pada parenkim otak dan pembuluh darah. Sehingga diperoleh kesimpulan bahwa marmut tua merupakan hewan model yang potensial untuk mempelajari pembentukan plak β amyloid berhubungan dengan patogenesis penyakit Alzheimer.
CELLULER EXPRESSION OF AMYLOID ΒIN THE BRAIN GUINEA PIG
(Cavia porcellus) AS A MODEL ALZHEIMER’S DISEASE WITH
TESTOSTERONE HORMONE DEPLETION
ABSTRACT
Advancing age is the most significant factor for developing of several degenerative diseases such as Alzheimer’s Disease (AD). In normal men, a consequence of aging is a decline in circulating and brain level of the steroid hormone. Testosterone depletion leads functional organ impairment and high risk of degenerative diseases involving brain. This study aimed to characterize beta amyloid expression on the brain guinea pig as model Alzheimer’s Disease. That was conducted on guinea pigs which had testosterone depletion. Twelve male of guinea pigs (Cavia cobaya) were devided into two groups based on age, six animals on 16-32 months (group I) and six animals on 32-48 months (group II). Both of groups had testosterone depletion as a result of castration. Two animals of each group underwent necropsy to collect the brain for cellular evaluation on first, third and fifth month after castration. Blood collection for testosterone evaluation were taken pre and postcastration on the same month necropsy. Cerebrospinal fluid was collected on magna cisterna. Testosterone level of blood plasma and amyloid β level were analyzed by ELISA. Brain samples were done by macroscopic and microscopic evaluation through Hematoxylin & Eosin (HE), Congo red staining and immunohistochemistry with amyloid β (Aβ). The result showed that cellular expression of amyloid β plaque on the brain of three months and five months castration had obvious finding compared to one month castration. Common features which appeared include Aβ plaque deposition in the brain parencym and blood vessels. Therefore, old guinea pigs are potentials animal model to study Aβ formation in relation to the pathogenecity of AD.
PENDAHULUAN
Penyakit Alzheimer merupakan penyakit neurodegeneratif yang bersifat irreversible, dan ditandai dengan kehilangan memori serta gangguan memori yang bersifat progresif (Hirtz et al. 2007). Sebanyak 50% sampai 70% dari total kasus berdasarkan autopsi dan gejala klinis, sedangkan 13% sampai 17% berdasarkan penyakit pada pembuluh darah otak (Querfurth and LaFerla 2010). Penyakit ini menyerang pada lebih dari 35 juta penduduk di dunia dan 5.5 juta penduduk di Amerika serta merupakan penyebab kematian terbesar ke-4 di United States. Resiko terjadinya penyakit Alzheimer (AD) meningkat sejalan dengan pertambahan umur dan prevalensinya meningkat dua kali setiap pertambahan umur 5 tahun pada umur diatas 65 tahun. Sebanyak 1.275 kasus baru terdiagnosis pada setiap 100.000 orang yang berumur lebih dari 65 tahun per tahun (Hirtz et al. 2007).
Gambaran perubahan patologi yang terpenting dari penyakit Alzheimer adalah adanya plak serebral dari β amyloid, neurofibrillary tangles dan neurophil yang mengandung hyperphosporilated tau protein. Akumulasi plak β amyloid pada daerah neokortek otak disebut senile plak (SP). Senile Plak berasal dari akumulasi fibril β amyloid yang merupakan derivat dari amyloid prekursor protein (APP). Mutan dari APP merupakan salah satu penyebab Familial Alzheimer’s Disease (FAD) dan mutasi dari APP meningkatkan akumulasi β amyloid pada otak. β amyloid (βA) berasal dari proteolysis amyloid prekursor protein karena aktivitas enzimatik dari beta-site amyloid precursor protein-cleaving enzim 1 (BACE-1) yaitu beta-secretase dan gamma-secretase yang merupakan suatu protein komplek dengan presenilin1 (Haass and Selkoe 2007).
Peningkatan level phosphorylated dan tau total pada cairan cerebrospinal berkorelasi dengan penurunan skor kognitif. Peningkatan stress oksidatif, fungsi ikatan protein dari retikulum endoplasmik yang tidak seimbang, defisiensi proteasome dan pembersihan autophagi dari protein yang rusak, berhubungan dengan proses penuaan yang akan mempercepat akumulasi protein tau pada penyakit Alzheimer. Plak dan tangles juga dapat ditemukan pada hewan yang tua tanpa menunjukkan gangguan kognitif. Jumlah plak dan tangles berperan dalam penurunan intelektual pada penyakit Alzheimer yang ditemukan pada daerah neokortek, hipokampus dan amigdala (Hoozemans et al. 2005).
Hormon testosteron merupakan salah satu hormon yang penting dalam pengaturan organ reproduksi dan tingkah laku pada laki-laki. Kadar total hormon testosteron dan testosteron bebas dapat mencerminkan konsentrasi hormon bioaktif bagi laki-laki yang sudah tua (Van den Beld et al. 2000). Penurunan kadar hormon testosteron berkaitan dengan peningkatan usia. Hal ini juga berhubungan dengan gangguan fungsi pada organ-organ yang responsif terhadap hormon androgen seperti tulang, otot dan jantung (Ferrando et al, 2002; Jones et al. 2003). Beberapa studi telah melaporkan bahwa terjadi perubahan pada keinginan libido dan fungsi kognitif akibat penurunan kadar hormon androgen (Gooren 2003; Kaufman and Vermeulen 2005). Penurunan kadar hormon androgen pada otak terhadap aksi neuronal selama penuaan akan mengakibatkan peningkatan disfungsi dan resiko penyakit termasuk penyakit Alzheimer.
Kondisi tersebut menyerupai keadaan laki-laki yang tua dengan penurunan hormon testosteron pada sirkulasi darah dan otak sebagai salah satu predisposisi penyakit Alzheimer.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di 1) Fasilitas Hewan Laboratorium PT. Indoanilab, Taman Kencana, Bogor untuk prosedur penelitian, perlakuan dan observasi hewan percobaan, 2) Laboratorium Patologi dan Laboratorium Mikrobiologi, Pusat Studi Satwa Primata, Institut Pertanian Bogor untuk nekropsi hewan dan analisis sampel, 3) Laboratorium Patologi, Departemen Klinik, Reproduksi, dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) untuk prosedur pembuatan preparat dan pembacaan histopatologi, 4) Laboratorium Patologi, Fakultas Kedokteran Hewan, Universitas Gadjah Mada (UGM) untuk analisis histopatologi dan pengambilan gambar. Kegiatan penelitian ini dilakukan pada bulan April 2012 sampai dengan Juni 2013.
Bahan dan Alat
Bahan penelitian yang digunakan antara lain kit Testosteron DRG EIA 1559, kit β amyloid KHB344, antibodi primer monoklonal antibodi rabbit anti-Human Amyloid A4 (USBiological, Cat. No. A2275-58T, USA), Antibodi sekunder serta kromogen 3-3,diaminobenzidine (DAB) (Dako LSAB+System-HRP, USA), buffer neutral formalin 10%, ethanol absolut, xylol. Alat yang digunakan adalah seperangkat alat operasi dan nekropsi, timbangan digital, mesin proses jaringan, mikrotom, inkubator, mikropipet, sentrifuse, ELISA reader, mikroskop dan kamera olympus binokuler.
Metode Penelitian
hewan dipuasakan 2-4 jam sebelum pembedahan, air minum tetap disediakan. Selama proses pembedahan, hewan dalam keadaan teranastesi. Anastesi menggunakan kombinasi ketamin (50 mg/kg BB IP) dan xylazine (5 mg/kg BB IP), serta lidocaine 0.05 ml subkutan pada setiap sisi sayatan. Analgetika yang digunakan adalah ketoprofen (4 mg/kg BB IM). Hewan diposisikan terlentang, daerah skrotum dibersihkan dan diberikan desinfektan dengan povidone iodine. Testis dikeluarkan dari ruang peritoneum melalui cincin inguinal dan dipegang erat dengan scrotumnya. Penyayatan dilakukan pada kulit scrotum sepanjang 2-3 cm tergantung pada ukuran testis dan sejajar dengan axis panjang tubuh. Testis dikeluarkan melalui daerah sayatan, kemudian selaput pembungkus testis disayat untuk mengeluarkan penggantungnya (cord). Penggantung (cord) dijepit dengan hemostat dan diligasi dengan cat gut 2/0 atau 3/0 dengan arah proksimal. Cord dipotong sebelah distal dari ligasi untuk menghindari bukaan ke ruang peritoneum. Daerah incisi pada ruang scrotum ditutup dengan jahitan horizontal dengan menggunakan catgut chromic 2/0 atau 3/0. Setelah proses pembedahan selesai, hewan diberikan cairan ringer laktat (10 ml/kg BB SC). Penelitian ini dilakukan atas persetujuan dan pengawasan komisi etik hewan Animal Care and Use Committee (ACUC) No. 12-IA-ACUC-001, PT. Indoanilab, Taman Kencana, Bogor.
Pengambilan darah dilakukan dua kali yaitu sebelum dilakukan kastrasi dan saat eutanasi pada bulan ke-1, ke-3 dan ke-5 setelah perlakuan dari masing-masing kelompok sebanyak dua ekor. Sampel darah diambil dari sudut mata bagian belakang sebanyak 1-2 ml menggunakan mikrohematokrit dan ditampung pada tabung yang mengandung EDTA. Selanjutnya darah disentrifugasi dengan kecepatan 2000 rpm selama 15 menit sehingga diperoleh plasma darah. Plasma darah digunakan untuk analisis kadar hormon testosteron dan kadar β amyloid.
Pengambilan sampel cairan serebrospinal (CSF) dilakukan pada saat yang sama dengan waktu eutanasi masing-masing kelompok. Lokasi pengambilan CSF pada area sisterna magna dengan menggunakan spine needle 25G. Marmut diposisikan duduk dengan kepala ditarik ke bawah agar ruang sisterna magna terbuka. CSF ditampung di dalam tabung eppendorf dan digunakan untuk analisis kadar β amyloid.
Setelah marmut dieutanasi, kemudian dilakukan nekropsi untuk mengambil sampel otak dan organ paru, hati, jantung, limpa, ginjal, pankreas, kelenjar adrenal. Semua organ ditimbang berat basahnya dan dimasukkan dalam larutan buffer netral formalin (BNF) 10% selama 24 jam. Organ otak dipotong melintang pada 1/3 bagian belakang setebal 3-5 mm sehingga diperoleh bagian korteks, lobus parietalis, lobus temporalis dan hipokampus untuk analisis histopatologi dengan pewarnaan Hematoxilin & Eosin (HE), Congo red dan immunohistokimia dengan antibodi β amyloid.
Analisis sampel
menggunakan tips yang berbeda-beda. Sebanyak 200 µl konjugat enzim dimasukkan kedalam setiap sumuran, dilakukan dengan benar pada tahap pencampuran ini selama 10 detik untuk mendapatkan campuran yang tepat. Selanjutnya diinkubasi selama 60 menit pada suhu ruang tanpa diberi penutup. Inkubasi tersebut bertujuan agar sampel dan konjugat saling berikatan. Sumuran dibilas sebanyak 3 kali dengan larutan pencuci (400 µl/sumuran) dan langsung dikeringkan dengan cara membalikkan sumuran. Selanjutnya ditambahkan 200 µl larutan substrat atau kromogen pada setiap sumuran. Substrat rentan terhadap cahaya, maka larutan di dalam ruangan bebas cahaya. Inkubasi dilakukan selama 15 menit pad suhu ruang. Reaksi enzimatik dihentikan dengan menambahkan 100 µl dengan menggunakan stop solution. Selanjutnya, microtitterplate dimasukkan ke dalam ELISA reader dengan pembacaan panjang gelombang 450+10 nm. Pembacaan dilakukan dalam waktu 10 menit setelah penambahan stop solution.
Sampel CSF dianalisis kadar β amyloid dengan metode ELISA
(Invitrogen™ human beta amyloid peptide 42 (catalog number KHB3441,
Invitrogen™, Camarillo, CA, USA). Level βA42 minimum dapat dideteksi pada
10 pg/ml dan assay tidak mempunyai crossreaktif dengan βA spesies lain (βA12,
βA20, βA28, βA35, βA40) atau marker penyakit neurodegeneratif lain, seperti α
-synuclein dan amyloid precursor protein (APP). Seluruh sampel dianalisa secara duplo dan variasi koefisien intra-assay yaitu 8.6%. microtitterplate diukur dengan dalam ELISA reader dengan pembacaan panjang gelombang 450 nm dengan koreksi panjang gelombang 540 dan 570 nm.
Sampel otak yang telah dipotong melintang pada 1/3 bagian belakang otak besar setebal 3-5 mm, dilakukan dehidrasi jaringan dengan dimasukkan ke dalam larutan alkohol secara bertingkat (70%, 80%, 90%, 95% dan absolut) dan clearing atau penjernihan dalam larutan xylol dengan tiga kali ulangan. Infiltrasi di dalam parafin cair dengan tiga kali ulangan dan dilanjutkan dengan penanaman jaringan (embedding) dalam parafin. Sediaan yang telah dicetak dipotong setebal 4 µm dengan mikrotom, dan ditaruh pada gelas obyek dan dimasukkan dalam inkubator selama 24 jam untuk pewarnaan jaringan dengan Hematoksilin & Eosin (HE), Congo red dan immunohistokimia dengan antibodi β amyloid. Gelas obyek yang digunakan untuk pewarnaan immunohistokimia terlebih dahulu dicoating dengan silane agar jaringan tidak lepas pada saat proses pewarnaan.
Proses pewarnaan jaringan dengan metode HE dengan tahapan sebagai berikut : jaringan dalam gelas obyek dilakukan deparafinisasi dengan larutan xylene selama 5 menit dengan tiga kali ulangan, selanjutnya dilakukan proses rehidrasi pada larutan alkohol bertingkat (absolut selama 3 menit dengan dua kali ulangan, 95% selama 3 menit dengan dua kali ulangan, 70% selama 3 menit), dimasukkan larutan hematoksilin selama 2 menit, kemudian dibilas dengan air mengalir selama 2 menit, dicelupkan acid alkohol 3-10 kali, dibilas dengan air mengalir selama 5 menit. Preparat dimasukkan dalam larutan eosin 5 menit, dibilas dengan air mengalir selama 5 menit, dilanjutkan dengan proses dehidrasi pada alkohol bertingkat (70%, 80%, 95%, absolut masing-masing 3 kali celupan ), selanjutnya proses clearing dalam xylol dengan ulangan tiga masing-masing 3 menit kemudian ditutup dengan entellan dan diamati dengan mikroskop binokuler (Olympus DP12).
tiga kali masing-masing 3 menit, selanjutnya dilakukan proses rehidrasi pada larutan alkohol bertingkat (absolut selama 3 menit dengan dua kali ulangan, 95% selama 3 menit dengan dua kali ulangan, 70% selama 3 menit), dicuci dengan air mengalir selama 1 menit dan dimasukkan dalam larutan Congo red selama 15-20 menit, dicuci dengan air mengalir selama 1 menit, diferensiasi cepat 5 – 10 celup di dalam alkohol alkalin, dicuci dengan air mengalir selama 1 menit. Counterstain dengan larutan hematoksilin 10 celup dan dicuci dengan air mengalir selama 2 menit, dilanjutkan dengan proses dehidrasi pada alkohol bertingkat (70%, 80%, 95%, absolut masing-masing 3 kali celupan ), selanjutnya proses clearing dalam xylol dengan ulangan tiga masing-masing 3 menit kemudian ditutup dengan entellan dan diamati dengan mikroskop binokuler (Olympus DP12).
Prosedur kerja immunohistokimia dengan monoklonal antibodi rabbit anti-Human Amyloid A4 (Amyloid beta) (USBiological, Cat. No. A2275-58T, USA), Antibodi sekunder serta kromogen 3-3,diaminobenzidine (DAB) (Dako LSAB+System-HRP, USA) sebagai berikut: slide jaringan pada gelas obyek dilakukan deparafinisasi dalam larutan xylol dengan ulangan tiga kali masing-masing 3 menit, selanjutnya dilakukan proses rehidrasi pada larutan alkohol bertingkat (absolut selama 3 menit dengan dua kali ulangan, 95% selama 3 menit dengan dua kali ulangan, 80% selama 3 menit, 70% selama 3 menit), dicuci dengan phosfat buffer saline (PBS) dengan tiga kali ulangan masing-masing 5 menit. Selanjutnya proses antigen retrieval methode dengan merendam slide jaringan ke dalam buffer sitrat suhu 90-950C selama 30 menit, dicuci dengan PBS dengan tiga kali ulangan masing-masing 5 menit. Blocking endogenous activity pada 0.3% H202 dalam metanol selama 20 menit, dan dicuci dengan PBS dengan
tiga kali ulangan masing-masing 5 menit. Setelah itu dilakukan inkubasi pada serum normal Fetal Bovine Serum (FBS) 1% selama 30 menit, dan diinkubasi dalam antibodi primer β amyloid (1:500) selama 24 jam atau overnight, dicuci dengan PBS dengan tiga kali ulangan masing-masing 5 menit. Selanjutnya diberi antibodi sekunder (Dako LSAB+System-HRP, USA) selama 30 menit, dan dicuci dengan PBS dengan tiga kali ulangan masing-masing 5 menit. Streptavidin Horse Radish Peroxidase (HRP) diberikan selama 30 menit, dan dicuci dengan PBS dengan tiga kali ulangan masing-masing 5 menit. Substrat atau kromogen 3-3,diaminobenzidine (DAB) diberikan selama 2-5 menit kemudian dicuci pada aquades, dan counterstain dengan larutan hematoksilin 10-15 celup, dicuci dengan air mengalir selama 2 menit, dilanjutkan dengan proses dehidrasi pada alkohol bertingkat (70%, 80%, 95%, absolut masing-masing 3 kali celupan), selanjutnya proses clearing dalam xylol dengan ulangan tiga masing-masing 3 menit kemudian ditutup dengan entellan dan diamati dengan mikroskop binokuler (Olympus DP12).
Parameter yang Diamati
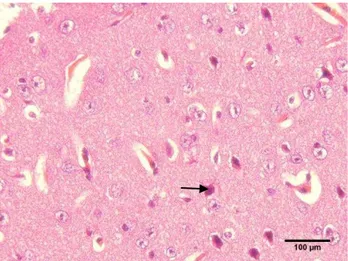
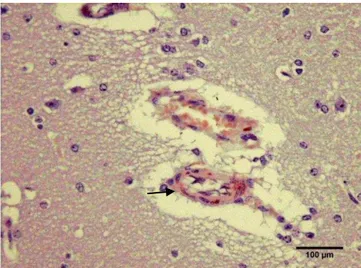
Eosin (HE) untuk melihat, Congo red dan immunohistokimia. Pewarnaan HE dilakukan untuk melihat perubahan struktur sel neuron otak dan aktivitas sel-sel glia. Pewarnaan Congo red bertujuan untuk melihat akumulasi amyloid pada otak, sedangkan pewarnaan immunohistokimia untuk melihat aktivitas dan penegasan imunoreaktivitas ikatan antigen dan antibodi β amyloid pada parenkim otak, sel neuron dan pembuluh darah.
Analisis data
Hasil pemeriksaan kadar βAdari cairan serebrospinal, plasma darah dan
level testosteron dianalisa secara deskriptif dari masing-masing kelompok. Perbedaan rerata diantara kelompok perlakuan diuji dengan analysis of variance (ANOVA) dan uji non-parametrik Mann-Whitney U. Hasil pemeriksaan terhadap perubahan patologi otak baik secara makroskopis dan mikroskopis dengan menggunakan teknik pewarnaan HE, Congo red dan immunohistokimia dianalisa secara deskriptif semi kuantitatif dengan program Image J.
HASIL DAN PEMBAHASAN
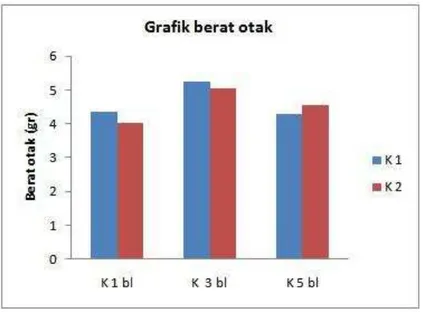
Berat badan
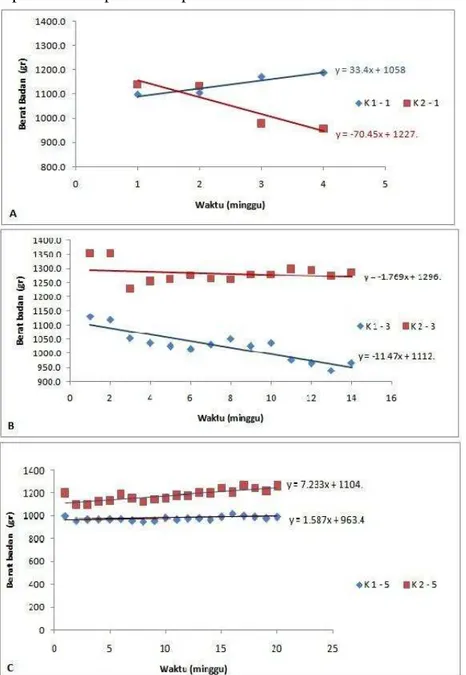
Pengamatan terhadap pertumbuhan berat badan marmut pada masing-masing kelompok perlakuan dilakukan pada setiap minggu selama perlakuan. Rerataan berat badan marmut dari setiap kelompok perlakuan menunjukkan adanya pertumbuhan yang bervariasi. Hasil analisa statistik menunjukkan adanya penurunan berat badan yang nyata (P<0.05) pada kelompok K2-1 dan K1-3. Rataan berat badan masing-masing kelompok dapat dilihat pada Tabel 1.
Tabel 1 Rataan berat badan marmut masing-masing kelompok
Kelompok Periode perlakuan
BB awal 1 bulan 3 bulan 5 bulan
K1-1 1100+0a 1189+0.09 - -
K2-1 1139.5+0.07a 956+0.15b - - K1-3 1129.5+0.03a 1035.5+0.03 966+0.12b - K2-3 1354.5+0.02 1255+0.02 1285+0.02 -
K1-5 1000+0.05a 972.5+0.05 980+0.03 994.5+0.02b K2-5 1201+0.07 1124.5+0.01 1177.5+0.08 1263.5+0.06
Sedangkan trend perkembangan berat badan dari masing-masing kelompok perlakuan dapat dilihat pada Gambar 4.
Gambar 4 Grafik pertumbuhan berat badan kelompok perlakuan, A. K1-1= Marmut dewasa kastrasi 1 bulan, K2-1= Marmut tua kastrasi 1 bulan B. K1-3= Marmut dewasa kastrasi 3 bulan, K2-3= Marmut tua kastrasi 3 bulan dan C. K1-5= Marmut dewasa kastrasi 5 bulan, K2-5= Marmut tua kastrasi 5 bulan
lebih tahan dan kuat terhadap stress dan rasa sakit, sehingga tindakan kastrasi tidak berpengaruh terhadap nafsu makan. Kelompok perlakuan kastrasi 3 bulan menunjukkan adanya trend penurunan berat badan baik pada umur tua maupun paruh baya. Namun demikian, terlihat pada kelompok perlakuan 5 bulan berat badan relatif stabil pada kedua kelompok umur. Hal ini menunjukkan bahwa hewan sudah tidak terpengaruh oleh stress dan rasa sakit akibat tindakan kastrasi karena marmut sudah sembuh dari luka akibat kastrasi dan sudah beradaptasi dengan perubahan hormon testosteron. Penurunan level testosteron yang berkaitan dengan umur secara normal berhubungan dengan gangguan fungsi pada organ-organ yang responsif terhadap androgen seperti tulang, otot dan jantung (Baumgartner et al.1999; Burger et al. 1998; Ferrando et al, 2002; Jones et al. 2003).
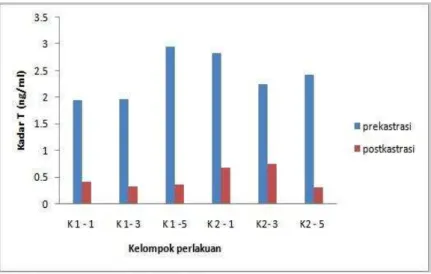
Kadar Testosteron
Rerataan hasil pengukuran kadar testosteron pada semua kelompok perlakuan menunjukkan adanya penurunan yang signifikan antara kondisi sebelum dikastrasi dan setelah dikastrasi. Hal ini dapat diamati pada Tabel 2 dan Grafik 2.
Tabel 2 Rata-rata perbedaan level testosteron pada plasma darah dari kelompok perlakuan (ng/ml)
Kelompok Periode
1 bulan 3 bulan 5 bulan
prekastrasi Postkastrasi prekastrasi post kastrasi pre kastrasi postkastrasi
K1 1.95+0.91 0.4+0.28 1.96+0.91 0.31+0.08 2.95+0.14 0.35+0.23 K2 2.83+0.38 0.68+0.17 2.24+0.76 0.74+0.09 2.42+1.62 0.3+0.21
Keterangan: K1= Kelompok hewan paruh baya (16-32 bl), K2 = Kelompok hewan tua (32-48 bl)
Berdasarkan tabel dan grafik diatas menunjukkan bahwa tindakan kastrasi terhadap marmut dapat menyebabkan terjadinya penurunan kadar hormon testosteron dalam plasma darah secara signifikan. Kastrasi dapat menurunkan level testosteron dalam plasma darah dari 70% sampai 80% dari kedua kelompok perlakuan pada satu, tiga dan lima bulan setelah kastrasi. Penurunan level testosteron ini terjadi pada kedua kelompok perlakuan, baik pada kelompok paruh baya maupun tua. Penurunan sangat jelas terlihat pada kelompok umur 5 bulan. Hal ini membuktikan bahwa waktu kastrasi sangat berpengaruh terhadap kadar testosteron dalam plasma darah. Tindakan kastrasi pada marmut ini diharapkan menghasilkan kondisi yang mirip pada laki-laki yang sudah tua. Hal ini akan berpengaruh terhadap pembentukan plak β amyloid pada otak pada proses perkembangan penyakit Alzheimer. Kadar testosteron yang rendah akibat kastrasi akan menyebabkan terjadinya peningkatan kadar β amyloid dalam cairan serebrospinal dan plasma darah. Pada penelitian in vivo menunjukkan bahwa penurunan kadar testosteron baik yang disebabkan oleh orkidektomi maupun terapi anti androgen menyebabkan peningkatan kadar β amyloid pada plasma darah (Almeida et al. 2004) dan otak (Ramsden et al. 2003; Rosario et al. 2006). Kadar testosteron yang rendah karena kastrasi akan menyebabkan hilangnya umpan balik negatif testosteron terhadap gonadotropin leutinizing hormone (LH) sehingga menyebabkan peningkatan kadar LH dan secara in vitro menyebabkan peningkatan produksi β amyloid melalui jalur amiloidogenik (Bowen et al. 2004).
Testosteron merupakan hormon androgen utama dalam sirkulasi. Hormon ini dihasilkan 95% oleh sel Leydig di dalam testis. Selain itu juga dihasilkan oleh kortek adrenal dari kelenjar adrenal. Testosteron diubah menjadi estradiol oleh enzim aromatase melalui proses aromatisasi (Norman and Litwack 1987). Testosteron juga berpengaruh terhadap sistem syaraf pusat. Aksi neuronal dari androgen adalah mengatur viabilitas neuron selama perkembangan apoptosis (Lund et al.2000). Selain itu juga androgen mempunyai aksi penting pada otak sebagai neuroproteksi terhadap penyakit Alzheimer (Pike 2001) dan menghilangkan hiperfosforilasi dari tau (Papasozomenos 1997). Gejala klinis level testosteron rendah pada manusia tidak spesifik. Perubahan yang tampak adalah penurunan kekuatan fisik, mood rendah, iritabilitas, konsentrasi menurun, panas dan berkeringat, penurunan libido dan ereksi serta gangguan tidur. Laki-laki dengan kadar testosteron yang rendah juga mengalami kehilangan motivasi, inisiatif dan kepercayaan diri (Christiansen 2004). Selain itu juga terjadi kerontokan rambut, kehilangan berat badan, penurunan densitas tulang, rapuh, mudah patah, anemia dan peningkatan lemak tubuh (. Wheeler and Barnes 2008). Namun demikian, penurunan level testosteron dapat juga disebabkan oleh tindakan medis (pemberian opioid, steroid) (Rajagopal et al. 2004) atau penyakit akut dan kronis (diabetes, gagal jantung, gagal ginjal, rheumatoid arthritis) (Kalyani et al. 2007).
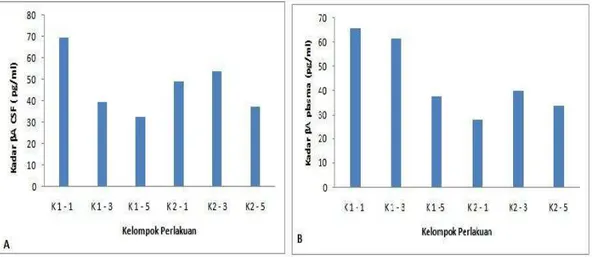
Kadar β amyloid pada plasma darah dan cairan serebrospinal
Pengukuran kadar β amyloid dilakukan dengan menggunakan sampel