Lampiran A. Hasil Karakterisasi Edible Film
Keterangan: σ : Kuat tarik Edible Film (KgF/mm2) ԑ : Kemuluran (%)
No. Variabel Tebal (mm)
Lebar (mm)
Lo
(mm) Ao
(mm2)
Load (KgF)
Stroke (mm/menit)
σ
Lampiran B. Gambar Penelitian
Lampiran B.1 Edible film dengan komposisi 6 g tepung tapioca, kitosan 2%, 10 g ekstrak buah naga merah, dan 2 g gliserin.
Lampiran B.3 Edible film dengan komposisi 6 g tepung tapioca, kitosan 2%, 30 g ekstrak buah naga merah, dan 2 g gliserin.
Lampiran B.5 Edible film saat dilepas dari plat akrilik
Lampiran C.2.Hasil Analisa Gugus Fungsi FT-IR Edible Film dengan variasi 20 ml ekstrak buah naga merah, 6 g tepung tapioca, 12 ml kitosan 2%, 1 ml gliserin
Lampiran C.3.Hasil Analisa Gugus Fungsi FT-IR Edible Film dengan variasi 30 ml ekstrak buah naga merah, 6 g tepung tapioca, 12 ml kitosan 2%, 1 ml gliserin
Lampiran C.4.Hasil Analisa Gugus Fungsi FT-IR Edible Film dengan variasi 40 ml ekstrak buah naga merah, 6 g tepung tapioca, 12 ml kitosan 2%, 1 ml gliserin
Lampiran D. 1.1 Jumlah pertumbuhan koloni bakteri dalam waktu 1 hari terhadap sampel 1 sosis yang dibungkus dengan Edible
Film
Lampiran D. 3 Jumlah pertumbuhan koloni bakteri dalam waktu 5 hari terhadap sampel 1 sosis yang dibungkus dengan Edible Film
Lampiran D. 2.1 Jumlah pertumbuhan koloni bakteri dalam waktu 1 hari terhadap sampel 2 sosis yang dibungkus dengan Edible
Lampiran D. 2.2 Jumlah pertumbuhan koloni bakteri dalam waktu 3 hari terhadap sampel 2 sosis yang dibungkus dengan Edible
Film
Lampiran D. 2.3 Jumlah pertumbuhan koloni bakteri dalam waktu 5 hari terhadap sampel 2 sosis yang dibungkus dengan Edible
Lampiran D. 3.1 Jumlah pertumbuhan koloni bakteri dalam waktu 1 hari terhadap sampel 3 sosis yang dibungkus dengan Edible
Film
Lampiran D. 3.2 Jumlah pertumbuhan koloni bakteri dalam waktu 3 hari terhadap sampel 3 sosis yang dibungkus dengan Edible
Lampiran D. 3.3 Jumlah pertumbuhan koloni bakteri dalam waktu 5 hari terhadap sampel 3 sosis yang dibungkus dengan Edible
Film
Lampiran E.1. Grafik Plot Permukaan Ketebalan edible film dari ekstrak buah naga merah dengan campuran tepung tapioca, kitosan, dan gliserin
0 50 100 150 200 250
10 ml buah naga merah
20 ml buah naga merah
30 ml buah naga merah
40 ml buah naga merah
50 ml buah naga merah
Ketebalan
Column2
Lampiran E.2. Grafik Plot Permukaan Kuat Tarik edible film dari ekstrak buah naga merah dengan campuran tepung tapioca, kitosan, dan gliserin
Lampiran E.3. Grafik Plot Permukaan Kemuluran edible film dari ekstrak buah naga merah dengan campuran tepung tapioca, kitosan, dan gliserin
0 100 200 300 400 500 600
10 ml Buah Naga Merah
20 ml Buah Naga Merah
30 ml Buah Naga Merah
40 ml Buah Naga Merah
50 ml Buah Naga Merah Column2 Column1 Kuat Tarik 0 2 4 6 8 10 12 14 16
10 ml Buah Naga Merah
20 ml Buah Naga Merah
30 ml Buah Naga Merah
40 ml Buah Naga Merah
50 ml Buah Naga Merah
Column1
Column2
Lampiran F. Struktur Bahan Campuran Dalam Pembuatan Edible Film
Interaksi Kitosan dengan Gliserin
Interaksi struktur kitosan dengan struktur antioksidan buah naga merah
Lampiran G. 1 Penentuan Ketebalan
Penentuan ketebalan pada edible film dengan penambahan tepung tapioca, kitosan, ekstrak buah naga merah, aquadest dan gliserin dapat dihitung dengan menggunakan jangka sorong. Penetuan dilakukan pada lima sisi yang berbeda.
1.1 Penentuan Ketebalan Edible Film Perbandingan Buah naga merah 10 ml
Adapun perhitungan ketebalan rata-rata edible film: Uji ketebalan (X1) = 0,23 mm
Uji ketebalan (X2) = 0,23 mm
Uji ketebalan (X3) = 0,23 mm
Uji ketebalan (X4) = 0,23 mm
Uji ketebalan (X5) = 0,24 mm
Uji ketebalan rata-rata = 0,23 mm + 0,23 mm + 0,23 mm + 0,23 mm + 0,24 mm 5
= 0, 232 mm
1.2 Penentuan Ketebalan Edible Film Perbandingan Buah naga merah 20 ml
Adapun perhitungan ketebalan rata-rata edible film: Uji ketebalan (X1) = 0,11 mm
Uji ketebalan (X2) = 0,11 mm
Uji ketebalan (X3) = 0,11 mm
Uji ketebalan (X5) = 0,10 mm
Uji ketebalan rata-rata = 0,11 mm + 0,11 mm + 0,11 mm + 0,11 mm + 0,10 mm 5
= 0, 108 mm
1.3 Penentuan Ketebalan Edible Film Perbandingan Buah naga merah 30 ml
Adapun perhitungan ketebalan rata-rata edible film: Uji ketebalan (X1) = 0,20 mm
Uji ketebalan (X2) = 0,20 mm
Uji ketebalan (X3) = 0,20 mm
Uji ketebalan (X4) = 0,20 mm
Uji ketebalan (X5) = 0,18 mm
Uji ketebalan rata-rata = 0,20 mm + 0,20 mm + 0,20 mm + 0,20 mm + 0,18 mm
Uji ketebalan (X4) = 0,24 mm
5 = 0, 196 mm
1.4 Penentuan Ketebalan Edible Film Perbandingan Buah naga merah 40 ml
Adapun perhitungan ketebalan rata-rata edible film: Uji ketebalan (X1) = 0,24 mm
Uji ketebalan (X2) = 0,24 mm
Uji ketebalan (X5) = 0,22 mm
Uji ketebalan rata-rata = 0,24 mm + 0,24 mm + 0,24 mm + 0,24 mm + 0,22 mm 5
= 0, 236 mm
1.5 Penentuan Ketebalan Edible Film Perbandingan Buah naga merah 50 ml
Adapun perhitungan ketebalan rata-rata edible film: Uji ketebalan (X1) = 0,16 mm
Uji ketebalan (X2) = 0,16 mm
Uji ketebalan (X3) = 0,16 mm
Uji ketebalan (X4) = 0,16 mm
Uji ketebalan (X5) = 0,15 mm
Uji ketebalan rata-rata = 0,16 mm + 0,16 mm + 0,16 mm + 0,16 mm + 0,15 mm 5
= 0, 158 mm
Lampiran G.2 Perhitungan Kuat Tarik
2.1 Perhitungan Kuat Tarik Edible Film Perbandingan buah naga merah 10 ml
Adapun perhitungan kuat tarik edible film :
Load : 0,17 KgF
Lebar specimen : 31 mm Tebal specimen : 0,11 mm
A0 = Lebar specimen x Tebal specimen
= 31 mm x 0,11 mm = 3,41 mm2
Kekuatan Tarik (σ) = ���� �� = 0,17 ���
3,41 ��2 = 0,498 KgF/mm2
2.2 Perhitungan Kuat Tarik Edible Film Perbandingan buah naga merah 20 ml
Adapun perhitungan kuat tarik edible film :
Load : 0,13 KgF
Lebar specimen : 31 mm Tebal specimen : 0,20 mm
A0 = Lebar specimen x Tebal specimen
Kekuatan Tarik (σ) = ������
= 0,13 ��� 6,2 ��2
= 0,209 KgF/mm2
2.3 Perhitungan Kuat Tarik Edible Film Perbandingan buah naga merah 30 ml
Adapun perhitungan kuat tarik edible film :
Load : 0,07 KgF
Lebar specimen : 31 mm Tebal specimen : 0,16 mm
A0 = Lebar specimen x Tebal specimen
= 31 mm x 0,16 mm = 4,96 mm2
Kekuatan Tarik (σ) = ������
= 0,07 ��� 4,96 ��2
= 0,141 KgF/mm2
2.4 Perhitungan Kuat Tarik Edible Film Perbandingan buah naga merah 40 ml
Adapun perhitungan kuat tarik edible film :
Load : 0,11 KgF
Tebal specimen : 0,24 mm
A0 = Lebar specimen x Tebal specimen
= 31 mm x 024 mm = 7,44 mm2
Kekuatan Tarik (σ) = ������
= 0,11 ��� 7,44 ��2
= 0,147 KgF/mm2
2.5 Perhitungan Kuat Tarik Edible Film Perbandingan buah naga merah 50 ml
Adapun perhitungan kuat tarik edible film :
Load : 0,09 KgF
Lebar specimen : 31 mm Tebal specimen : 0,23 mm
A0 = Lebar specimen x Tebal specimen
= 31 mm x 0,23 mm = 7,13 mm2
Kekuatan Tarik (σ) = ���� �� = 0,09 ���
7,13 ��2
Lampiran G.3 Perhitungan Kemuluran
Perhitungan kemuluran pada edible film dengan penambahan tepung tapioca, kitosan, gliserin, dengan variasi ekstrak buah naga merah dan aquadest dapat dihitung dengan menggunakan perhitungan regangan terhadap panjang mula-mula (I0).
3.1 Perhitungan Kemuluran Edible Film Perbandingan ekstrak buah naga merah 10 ml
Adapun perhitungan kemuluran edible film:
Stroke : 16,0 mm/menit
Panjang specimen mula – mula (I0) : 110 mm
Kemuluran (ԑ) =Stroke
I0 x 100%
=��,���
�����x 100% = 14,54 %
3.2 Perhitungan Kemuluran Edible Film Perbandingan ekstrak buah naga merah 20 ml
Adapun perhitungan kemuluran edible film:
Stroke : 11,4 mm/menit
Panjang specimen mula – mula (I0) : 110 mm
Kemuluran (ԑ) =Stroke
I0 x 100%
=��,���
3.3 Perhitungan Kemuluran Edible Film Perbandingan ekstrak buah naga merah 30 ml
Adapun perhitungan kemuluran edible film:
Stroke : 10,7 mm/menit
Panjang specimen mula – mula (I0) : 110 mm
Kemuluran (ԑ) =Stroke
I0 x 100%
=��,���
�����x 100% = 9.72 %
3.4 Perhitungan Kemuluran Edible Film Perbandingan ekstrak buah naga merah 40 ml
Adapun perhitungan kemuluran edible film:
Stroke : 8,7 mm/menit
Panjang specimen mula – mula (I0) : 110 mm
Kemuluran (ԑ) =Stroke
I0 x 100%
=�,���
3.5 Perhitungan Kemuluran Edible Film Perbandingan ekstrak buah naga merah 50 ml
Adapun perhitungan kemuluran edible film:
Stroke : 7,2 mm/menit
Panjang specimen mula – mula (I0) : 110 mm
Kemuluran (ԑ) =Stroke
I0 x 100%
=�,���
DAFTAR PUSTAKA
Abugoch, L. E,. Tapia, C., Villaman, M. C., Pedram, M. Y., Dosque, M. D. 2011. Characterization of quinoa protein-chitosan blend edible films. Food Hydrocolloids. 25, 879-886.
Alves, V. D., Ferreira, A. R., Costa, N., Freitas, F., Reis, M. A. M., Coelhoso, I. M. 2011. Characterization of biodegradable films from the extracellular polysaccharide produced by Pseudomonas oleovorans grown on glycerol by product. Carbohydrate Polymers. 83, 1582-590.
Aulia, A. 2012. PembuatanEdible Film dari Ekstark Buah Pepaya (Carica papaya L.) dengan Campuran Tepung Tapioka, Tepung Terigu dan Gliserin. Skripsi. Medan: Departemen Kimia Universitas Sumatera Utara. Bourtoom, T. 2007. Plasticizer effect on the properties of biodegradable blend
film from rice starch-chitosan. Songklanakarin Journal of Science and Technology. 30, 149-155.
Buckle, K.A. 1985. Ilmu Pangan. Jakarta: UI Press.
Cerqueira, M. A., Souza, B. W. S., Teixeira, J. A., Vicente, A. A. 2012. Effect of interaction between the constituent of Chitosan-Edible Films on Their Physical Properties. Food Bioprocess Technology 5,3181-3192.
Embuscado, M. E. 2009. Edible Films and Coating for Food Application. London: springer.
Fessenden, R. J. 1986. Kimia Organik. Edisi Ketiga.Jilid kedua. Jakarta: Erlangga. Flores, S., Fama, L., Rojas, A. M., Goyannes, S., gerschenson, L. 2006. Physical properties of tapioca-starch films: Influence of filmmaking and potassium sorbate. Food Research Internasional 40,257-265.
Gontard, N., Guilbert,S., dan cuq, J. L. 1993. Water and Glycerol as Plasticizer Affect Mechanical and Water Barrier Properties at an Edible Wheat Gluten Film. USU: J. Food Science.
Gunawan., Budi. dan Azhari, Citra Dewi. 2010. Karakterisasi Spektrofometri IR dan Scanning Electron Microscopy (SEM) Sensor Gas dari Bahan Polimer Poly Ethelyn Glycol (PEG). ISSN : 1979-6870 : 1-17
tanggal 2 januari 2016.
Http://susyanairi.blogspot.com/gliserin/html. Diakses pada tanggal 5 januari 2016. http://www.iptek.net.id/ind/warintek/?mnu=6&ttg=6&doc=6b30. Diakses tanggal
20 desember 2015.
Jawetz, E. Menick, J,L., dan Adelberg, E. A. 2001. Mikrobiologi Kedokteran. Ahli bahasa: Eddy Mudihardi. Jakarta. Penerbit Salemba Medika.
Ketaren, S. Minyak dan Lemak Pangan. Jakarta. UI-Press. 128-133.
Jimmy. 2013. Karakterisasi Edible Film dari Campuran Tepung tapioca, Kitosan, Gliserin, dan Ekstrak mangga (Mangifera indica L.). Medan: USU.
Julianti,E. dan Nurminah,M.2007. Buku Ajar Teknologi Pengemasan. 2016.
Kristanto,D. 2009. Buah Naga Pembudidayaan di Pot dan Kebun. Bogor: Penebar Swadaya.
Kumar, M.N.V.R. 2000. A Review of Chitin and Chitosan Application. Reactive & functional Polymers 46(1): hal 1-27.
Lehninger, A. L. 1982. Dasar-Dasar Biokimia. Penterjemah: M. Thenawijaya. Jakarta: Erlangga.
Mashithah, Z. 2012. Karakterisasi Edible film dari Campuran Ekstrak Wortel (Daucus carota L.) dengan Tepung Tapioka dan Gliserin. Skripsi. Medan: Departemen Kimia Universitas sumatera Utara.
Mulja, M. 1995. Analisis Intrumental. Airlangga Press. Surabaya.
Poedjiadi, A. 1994. Dasar-Dasar Biokimia. Jakarta: Penerbit Universitas Indonesia.
Sadani, M. 2014. Karakterisasi Edible film dari Campuran Tepung Tapioka, Kitosan, dan Ekstrak Jambu Biji (Psidium guajava L.) dengan Pemlastis Gliserin. Skripsi. Medan: Departemen Kimia Universitas Sumatera Utara. Sinaga, L. 2013. Karakterisasi Edible Film Dari Ekstrak Kacang Kedelai Dengan
Penambahan Tepung Tapioka Dan Gliserol Sebagai Bahan Pengemas
Makanan. Jurnal Teknik Kimia: Departemen Teknik Kimia, Fakultas
Sugita, P., Wukirsari, T., Sjahriza A., Wahyono, D. 2009. Kitosan: Sumber Biomaterial Masa Depan. Bogor: IPB Press.
Sulistiani, E. 2011. Pembuatan Edible Film dari Campuran Kanji, Dengan Ekstrak wortel (Daucus Carota L.) dan Gliserin Sebagai Bahan Pengemas. Skripsi. Medan: Departemen Kimia Universitas Sumatera Utara.
Sudarmadji, S. 1984. Analisa Bahan Makanan dan Pertanian.Yogyakarta: Liberti. Wafiroh, S., Ardiarto, T., Agustin, E. T. 2010. Pembuatan danKarakterisasi Edible Film dari Komposit Kitosan-Pati garut (Maranta Arundinaceae) Dengan pemlastis Asam Laurat. Surabaya: Universitas Erlangga.
Wahyu, M. K. 2008. Pemanfaatan Pati Singkong Sebagai Bahan Baku Edible Film. Bandung: Indonesia.
Whistler, R. L. 1984. Starch Chemistry and Technology. Second Edition. New York: Academic Press, Inc. Ltd.
Wirjosentono, B. 1996. Analisis dan Karakterisasi Polimer. Medan: USU Press. Zhong, Q. P., Xia, W.S. 2008. Physicochemical properties of edible and
BAB 3
METODE PENELITIAN
3.1 Alat-Alat - Hotplate - Oven
- Neraca analisis - Gelas beaker - Gelas ukur - Labu takar - Alat torse - Termometer
- Spektrofotometer FT-IR
- SEM (Scanning Electron Microscope) - Jangka Sorong
- Plat Akrilik - Spatula - Pipet Tetes - Blender - Botol Reagen - Botol Aquades - Magnetik Stirer
- Erlenmeyer pyrex
- Saringan - Hotplate - Corong
- Spektrofotometer UV-Visible Spectronic 300 - Jangka Sorong
- Labu Takar Permacolor
- Pipet volume Pyrex - Plastik
3.2 Bahan
- Buah Naga Merah
- Kitosan % DD 90,2%
- Tepung Tapioka Dua koki anggur
- Gliserin PT.SOCI
- sCH3COOH(aq) 1%
- Akuades
3.3 Prosedur Penelitian
3.3.1 Pengambilan Sampel
Sampel berupa buah naga merah yang diperoleh dari pasar buah medan. Buah naga merah memiliki nama latin
3.3.2 Pembuatan Larutan Pereaksi
3.3.2.1. Pembuatan Larutan CH3COOH 1% (w/v)
Dipipet 1 ml larutan CH3COOH(aq) kemudian dimasukkan kedalam labu takar 100
ml. Diencerkan dengan akuades hingga garis batas.
3.3.2.2. Pembuatan Larutan Kitosan2% (w/v)
Ditimbang 1 g kitosan kemudian dimasukkan ke dalam gelas beaker. Ditambahkan 50 ml larutan CH3COOH 1% (V/V). Didiamkan selama ± 1 jam
3.3.3 Cara Kerja
3.3.3.1. Preparasi Sampel
Buah naga merah dikupas kemudian dipotong tipis-tipis,kemudian dimasukkan didalam blender. Setelah halus dan didapatkan ekstrak mangga.
3.3.3.2. Pembuatan Edible Film
Sebanyak 6 g tepung tapioca dimasukkan kedalam gelas beaker yang telah diisi dengan 81 ml akuades. Diaduk hingga homogen. Dipanaskan di atas hotplate pada suhu± 650C hingga mengental. Ditambahkan kitosan 2% (w/v). Ditambahkan 10 g
ekstark buah naga merah sambil diaduk hingga homogeny. Kemudian ditambahkan 2 g gliserin. Diaduk hingga homogen dan dibiarkan mengental. Campuran dituang di plat akrilik dan diratakan. Dikeringkan didalam oven pada suhu ± 300C selama ± 2 hari. Dilakukan prosedur yang sama untuk sampel buah naga merah dengan variasi 20 g, 30 g, 40 g, 50 g dan akuades dengan variasi 71 ml, 61 ml, 51 ml, 41 ml.
3.3.4. Pengukuran Ketebalan Edible Film
Edible film yang diperoleh dipotong dengan ukuran 10 cm x 10 cm, kemudian dilakukan pengukuran dengan menggunakan jangka sorong sebanyak dari lima sisi, yaitu sudut sisi kiri atas, sudut sisi kanan atas, sudut sisi kiri bawah, sudut sisi kanan bawah dan tengah. Kemudian, dicari rata-rata dari ketebalan tersebut.
3.3.5. Pengukuran Kuat Tarik dan Kemuluran
Kekuatan tarik adalah salah satu sifat dasar dari bahan polimer yang terpenting dan sering digunakan untuk karakteristik suatu bahan polimer. Kekuatan tarik suatu bahan didefinisikan sebagai besarnya beban maksimum (Fmax) yang
Perhitungan Uji Kuat Tarik :
Kekuatan tarik(σ) = Fmaks
�� =
���� ��
Keterangan : Load = Tegangan (KgF) Ao = Luas specimen (mm2)
σ = Kekuatan tarik bahan (KgF/mm2)
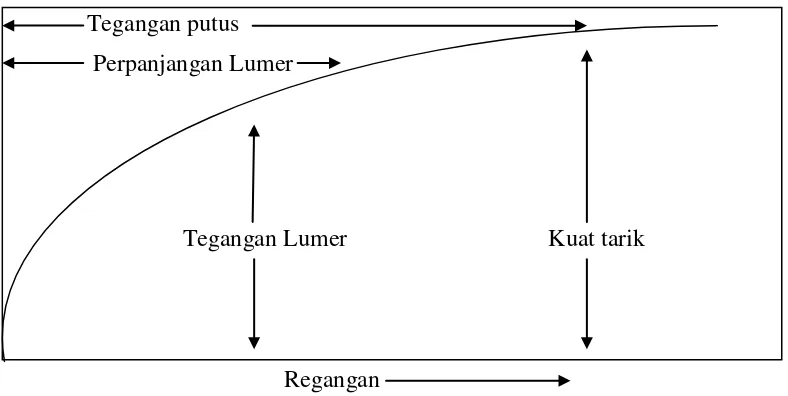
Bila suatu bahan dikenakan beban tarik yang disebut tegangan, maka bahan akan mengalami regangan. Kurva tegangan terhadap regangan merupakan karakteristik dari sifat mekanik suatu bahan. Untuk bahan polimer bentuk kurva tegangan regangan terlihat pada gambar 3.1
[image:31.595.115.509.375.573.2]
Regangan
Gambar 3.1 Kurva Tegangan dan Regangan Bahan Polimer
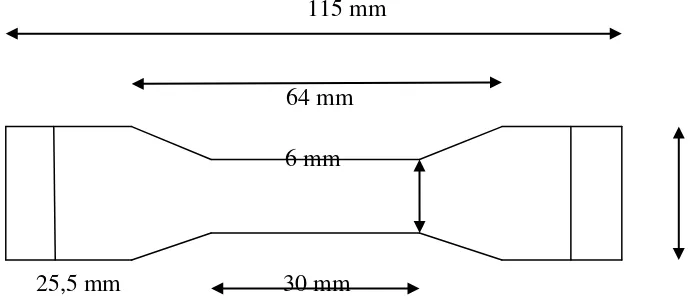
Spesimen yang digunakan untuk uji kekuatan tarik berdasarkan ASTM D 638 seperti terlihat pada gambar 3.2. rangkaian alat uji tarik diset sesuai dengan yang diperlukan. Kecepatan tarik 100 mm/menit dan beban maksimum 100 kgf. Sampel yang sudah berbentuk dumbbell dijepitkan pada alat uji tarik, kemudian alat dijalankan dan didata yang dihasilkan diamati pada monitor.
Tegangan putus Perpanjangan Lumer
115 mm
64 mm 6 mm
[image:32.595.138.485.89.243.2]25,5 mm 30 mm
Gambar 3.2 Bentuk Spesimen Untuk Analisis Kuat Tarik dan Kemuluran ASTM D-638-72 Tipe IV
Disamping uji sifat mekanik kekuatan tarik (σ), juga diamati kemuluran (ԑ) yang didefinisikan sebagai perubahan panjang specimen (I0) dengan perubahan
panjang specimen setelah diberi beban (It) maupun terhadap regangan (stroke).
Perhitungan Kemuluran :
Kemuluran(ԑ) = �� −�0
�0 x 100%
Kemuluran(ԑ) =�������0 x 100%
Keterangan:
ԑ = kemuluran (%)
Stoke = Regangan (mm/menit)
I0= Panjang specimen mula-mula (mm)
It = Panjang specimen setelah diberi beban (mm)
3.3.6 Analisa SEM ( Scanning Electron Microscope)
Analisa SEM (Scanning Electron Microscope) merupakan pemeriksaan dan analisa permukaan serta mempelajari sifat morfologi sampel. Dalam hal ini, dilihat dari permukaan edible filmhasil campuran tepung tapioca dengan kitosan, ekstrak buah naga merah, dan gliserin berdasarkan sifat mekanik edible film yang optimal.
3.3.7 Analisa FT-IR (Fourier Transform Infra Red)
Analisa FT-IR (Fourier Transform Infra Red) merupakan analisa terhadap interaksi senyawa-senyawa yang terkandung dalam edible film berupa uluran atau lekukan gugus fungsi yang ditampilkan dalam bentuk spectrum gelombang. Dalam hal ini, dilihat dari spectrum interaksi gugus fungsi dari edible film hasil campuran tepung tapioca dengan kitosan, ekstrak buah naga merah, dan gliserin berdasarkan sifat mekanik edible film yang optimal.
3.4 Uji Aktivitas Antibakteri
3.4.1 Uji Aktivitas dengan Metode Kirby Bauer
Dituang media MHA (Mueller Hinton Agar) steril kedalam cawan petri secara aseptis dan biarkan hingga memadat. Dibuat suspensi bakteri uji dengan cara mengambil biakkan bakteri tersebut untuk selanjutnya dihomogenkan kedalam 10 mL garam fisiologis (0,9 %). Konsentrasi bakteri uji selanjutnya disamakan dengan konsentrasi larutan McFarland (108 CFU/mL). Suspensi bakteri uji tersebut selanjutnya diinokulasikan dengan cara menggoresnya menggunakan
cotton bud steril hingga merata pada media MHA yang telah memadat.
3.4.2 Uji Aktivitas dengan Metode Total Plate Count
Disiapkan 5 buah tabung reaksi yang masing-masing berisi 9 mL akuades steril. Selanjutnya ditimbang sebanyak 1 g sampel uji untuk dimasukkan kedalam tabung reaksi pertama. Dari hasil homogenisasi antara 9 mL akuadest steril dengan 1 g sampel uji diperoleh faktor pengenceran dengan konsetrasi 10-1. Dari hasil pengenceran 10-1 diambil sebanyak 1 mL untuk dimasukkan kedalam tabung ke 2. Hasill homogenisasi pada tabung ke dua akan memperoleh faktor pengenceran dengan konsentrasi 10-2 begitu seterusnya hingga diperoleh faktor pengenceran 10-5. Diambil masing-masing sebanyak 0,1 mL dari pengenceran 10-4 dan 10-5 untuk diinokulasikan kedalam 2 cawan petri yang berbeda. Dituangkan media PCA (Plate Count Agar) pada kisaran suhu ±36 oC kedalam cawan petri yang telah berisi 0,1 mL larutan dari hasil faktor pengenceran 10-4 dan 10-5. Diinkubasi hasil TPC dengan metode cawan tuang tersebut pada suhu 34 oC selama 1 x 24 jam. Dihitung jumlah koloni yang tumbuh setelah masa inkubasi.
3.5 Bagan Penelitian 3.5.1. Preparasi Sampel
Dikupas
Dibersihkan
Diiris tipis-tipis
Dihaluskan dengan blender
Disaring
Buah Naga Merah
3.5.2. Pembuatan Edible Film
Ditimbang sebanyak 6 g
Dimasukkan ke dalam gelas beaker Ditambahkan 81 ml akuades
Dipanaskan diatas hotplate (± 65oC) Ditambahkan larutan kitosan 2% Ditambahkan 10 gr ekstrak buah naga merah
Ditambahkan 1 ml gliserin
Diaduk hingga homogen dan mengental
Dituang di plat akrilik dan diratakan Dikeringkan didalam oven (± 30oC) selama 2 hari
Dilakukan perlakuan yang sama untuk volume buah naga merah 20 gr, 30 gr, 40 gr, 50 gr.
Tepung Tapioka
Tabel 3.1 Perbandingan berat sampel dalam pembuatan Edible Film
Buah Naga Merah Kitosan Tepung Tapioka Gliserin
10 gr 12 gr 6 gr 1 gr
20 gr 12 gr 6 gr 1 gr
30 gr 12 gr 6 gr 1 gr
40 gr 12 gr 6 gr 1 gr
50 gr 12 gr 6 gr 1 gr
3.5.3 Karakterisasi dan Pengujian Edible Film
Edible Film
Pengukuran
Ketebalan
Kuat Tarik
dan
Kemuluran
Uji
SEM
Uji
3.5.4. Pengujian Aktivitas Antibakteri Edible Film
3.5.4.1 Uji Aktivitas Edible Film dengan Metode Kirby Bauer
Biakan bakteri Escherichia coli dan Staphyloccus aureus
disuspensi dalam akuades steril dihomogenkan dengan vortex dibandingkan dengan kekeruhan Suspensi bakteri
diencerkan dengan akuades
Steril sampai kekeruhan Media MHA
106 CFU/ml di inkubasi di
Suspensi Bakteri atas media MHA
di inkubasi di atas media MHA
Media MHA Cakram
Edible Film
diletakkan cakram edible film diatas media MHA di inkubasi secara terbaik dalam inkubator pada suhu 32-34ºC selama 24 jam
di ukur diameter zona antibakteri
3.5.4.2 Uji Aktivitas Edible Film dengan Metode Standart Plate Count (SPC) pada Sosis
Sosis
dibungkus dengan edible film diletakkan pada suhu kamar dipotong seberat 1 g
dihaluskan dan dimasukkan dalam tabung reaksi ditambah akuades steril sebanyak 9 ml
Kultur awal pengenceran 10-1
diencerkan hingga 10-5
dimasukkan 0,1 ml ke dalam media PCA padat didalam cawan petri
diratakan dengan hockey stick Media PCA dan kultur
diinkubasi pada suhu 32-34ºC selama 24 jam dihitung isolate bakteri
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
[image:39.595.112.478.373.500.2]Dari hasil penelitian edible film dari campuran ekstrak buah naga merah dengan tepung tapioca, kitosan, dan gliserin yang telah dilakukan diperoleh karakterisasi edible film sebagai berikut:
Table 4.1 Hasil Karakterisasi Edible film dari 6 g Tepung tapioca, 2% Kitosan, 10 g Ekstrak buah naga merah, 1 ml gliserin.
No. Parameter Hasil 1. Ketebalan 0,232 mm 2. Kuat Tarik 0,498 KgF/mm2 3. Kemuluran 14,54 %
Table 4.2 Hasil Karakterisasi Edible film dari 6 g Tepung tapioca, 2% Kitosan, 20 g Ekstrak buah naga merah, 1 ml gliserin.
[image:39.595.111.486.582.707.2]Table 4.3 Hasil Karakterisasi Edible film dari 6 g Tepung tapioca, 2% Kitosan, 30 g Ekstrak buah naga merah, 1 ml gliserin.
[image:40.595.107.486.599.726.2]Table 4.4 Hasil Karakterisasi Edible film dari 6 g Tepung tapioca, 2% Kitosan, 40 g Ekstrak buah naga merah, 1 ml gliserin.
Table 4.5 Hasil Karakterisasi Edible film dari 6 g Tepung tapioca, 2% Kitosan, 50 ml Ekstrak buah naga merah, 1 ml gliserin.
No. Parameter Hasil 1. Ketebalan 0,196 mm 2. Kuat Tarik 0,141 KgF/mm2 3. Kemuluran 9,72 %
No. Parameter Hasil 1. Ketebalan 0,236 mm 2. Kuat Tarik 0,147 KgF/mm2 3. Kemuluran 7,91 %
4.1.2 Hasil Analisis Spectroscopy Fourier Transform Infra Red (FT-IR)
Edible Film
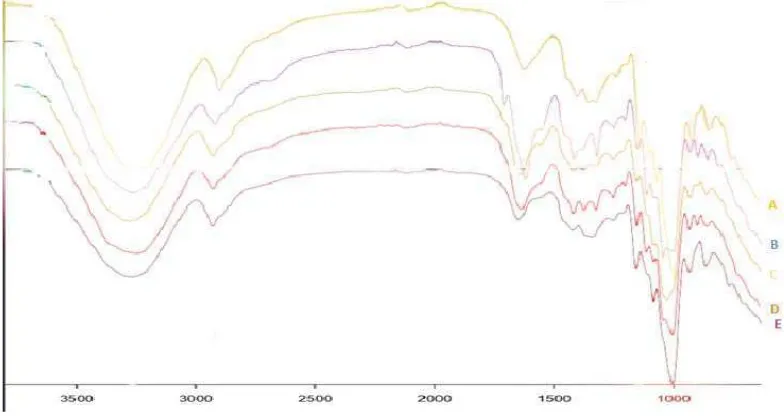
[image:41.595.114.506.221.430.2]Analisis karakterisasi FT-IR edible film dilakukan dengan mengidentifikasi gugus-gugus fungsi dan analisa kuantitatif derajat deasetilasi dari edible film yang telah dihasilkan dari penelitian ini. Hasil Karakterisasi gugus fungsi berupa spektrogram FTIR yang ditunjukan pada Gambar 4.1
Gambar 4.1 Spektrum Senyawa Hasil Penelitian dengan FT-IR
Table 4.6 Interpretasi Gugus Fungsi Senyawa Hasil Analisis FT-IR
GGugus Fungsi Frekuensi (cm-1) Hasil Frekuensi (cm-1) Teori
CH 2925,59 cm
-1
2841-2967 cm-1 2924,50 cm-1
2925,25 cm-1 2923,08 cm-1
OH
3264,88 cm-1
2500-3333 cm-1 3273,96 cm-1
3274,55 cm-1 3269,17 cm-1 3241,15 cm-1
[image:41.595.116.508.534.731.2]4.1.3 Hasil Uji Aktivitas Antibakteri Edible Film
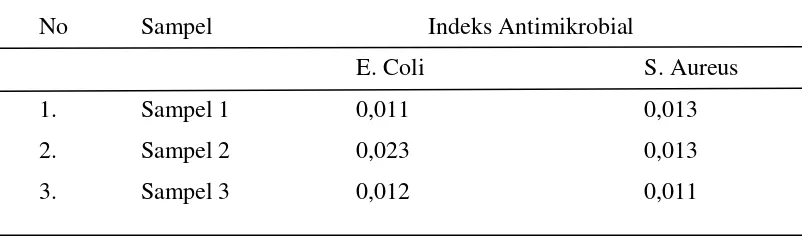
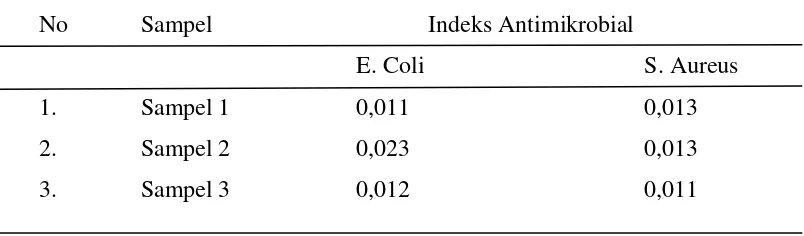
[image:42.595.115.516.266.386.2]Pada edible film dilakukan uji aktivitas antibakteri dengan menggunakan Metode Kirby Bauer. Aktivitas antibakteri edible film menunjukkan indeks antimikrobial pada pertumbuhan bakteri patogen yaitu Staphylococcus aureus dan Eschericia coli dengan perhitungan zona hambat.
Tabel 4.7 Hasil perhitungan diameter zona hambat beberapa kultur bakteri oleh edible film
No Sampel Indeks Antimikrobial
E. Coli S. Aureus
1. Sampel 1 0,011 0,013
2. Sampel 2 0,023 0,013
3. Sampel 3 0,012 0,011
4.2 Pembahasan Penelitian
4.2.1 Kuat Tarik
Kuat tarik dan persen elongasi merupakan sifat mekanik yang berhubungan dengan sifat kimia film. Kuat tarik merupakan gaya maksimum yang dapat ditahan oleh sebuah alat hingga terputus. Parameter ini merupakan salah satu sifat mekanis yang penting dari edible film. Kuat tarik yang terlalu kecil mengindikasikan bahwa film tidak dapat dijadikan kemasan, karena karakter fisiknya kurang kuat dan mudah patah (Ulpa,2011).
Dari hal ini menunjukkan bahwa data dari kuat tarik dan kemuluran dengan variasi penambahan buah naga merah menjelaskan bahwa semakin sedikit volume buah naga merah yang ditambahkan maka kekuatan tarik dan kemuluran dari Edible Film akan semakin kuat disertai dengan penambahan gliserin karena adanya gugus OH dari gliserin dengan gugus CH dari buah naga merah mengakibatkan terjadinya interaksi sehingga molekul-molekul akan terdispersi dan berinteraksi dengan struktur rantai polimer dan menyebabkan rantai polimer sukar bergerak. Hal ini yang menyebabkan kekuatan tarik meningkat karena adanya gaya intermolekuler diantara rantai struktur. Efek pengaruh penambahan ekstrak buah naga merah terhadap edible film yang dihasilkan adalah memberikan penampilan, warna, aroma, dan tingkat kemanisan pada edible film.
4.2.2 Ketebalan
Pengukuran ketebalaan film dilakukan pada lima titik yang diukur secara acak dengan menggunakan mikrometer sekrup. Hasil dari pengukuran ketebalan edible film pada variasi 40 ml buah naga merah, 6 g tepung tapioka, 12 ml kitosan 2% dan 1 ml gliserin yaitu 0,236 mm lebih tinggi dibandingkan dengan variasi lainnya. Hal ini dikarenakan dengan adanya perbedaan variasi pada penambahan buah naga merah sehingga pencampuran sampel buah naga merah dengan volume 40 ml yang terdapat dalam film mempengaruhi komposisi film sehingga semakin banyak sampel buah naga merah yang ditambahkan sebagai bahan pengisi mempengaruhi ketebalan film.
4.2.3 Kemuluran
dalam edible film. Berdasarkan hasil uji kemuluran edible film dengan variasi 10 ml buah naga merah, 6 g tepung tapioka, 12 ml kitosan 2% dan 1 ml gliserin dihasilkan persen keregangan 14,54% sedangkan variasi 20 ml buah naga merah, 6 g tepung tapioka, 12 ml kitosan2% dan 1 ml gliserin dihasilkan persen keregangan 14,90%. Hal ini dapat disimpulkan semakin kuat suatu film maka semakin kuat juga persen keregangan karena film yang kuat tidak mudah putus ketika terjadi tarikan.
4.2.4 Analisa FT-IR
Spektroskopi FT-IR dilakukan untuk interaksi spektrum gugus fungsi karakterisasi secara mikrostruktural diantara kitosan, tepung tapioka dan gliserin. Pada tepung tapioca yang digunakan dalam penelitian, dilakukan analisa secara FT-IR menunjukkan adanya regangan gugus –OH pada panjang gelombang 3241 cm-1 – 3274 cm-1, regangan gugus C-H pada panjang gelombang 2923 cm-1 – 2925 cm-1, regangan gugus amina NH pada panjang gelombang 1630 cm-1 – 1706 cm-1 dan deformasi gugus C-H pada panjang gelombang 851 cm-1 – 858 cm-1 dimana menggambarkan struktur dari tepung tapioka secara keseluruhan.
Pada kitosan yang digunakan dalam penelitian dilakukan analisa secara FT-IR menunjukkan adanya regangan gugus –OH pada panjang gelombang 3241 cm-1 – 3274 cm-1, regangan gugus amina NH pada panjang gelombang 1634 cm-1 1643 cm-1 dan regangan gugus C-H pada panjang gelombang 2923 cm-1 – 2925 cm-1 dan deformasi gugus –CH pada panjang gelombang 890 cm-1 – 927 cm-1 dimana menggambarkan struktur dari kitosan secara keseluruhan.
Pada gliserin yang digunakan dalam penelitian, dilakukan analisa secara FT-IR menunjukkan adanya regangan gugus –OH pada panjang gelombang 3241 cm-1 – 3273 cm-1, regangan gugus C-H pada panjang gelombang 1412 cm-1 – 1415cm-1 dan deformasi gugus –CH pada panjang gelombang 927 cm-1 – 1016 cm-1 dimana menggambarkan struktur gliserin secara keseluruhan.
– 3273 cm-1 dan vibrasi gugus C-N pada panjang gelombang 1316 cm-1 – 1371 cm-1. Hal ini menunjukkan adanya interaksi antara tepung tapioka, kitosan, dan gliserin pada edible film yang dibuat dengan demikian,edible film yang telah dibuat memiliki karakteristik yang memenuhi syarat umum dalam pembuatan edible film.
4.2.5 Analisa SEM
Analisa ini dilakukan dengan alat yang biasa disebut dengan mikroskopi kamera. Analisa ini bertujuan untuk melihat permukaan penampang, untuk melihat permukaan melintang dan membujur suatu spesimen secara mikroskopis dengan pembesaran tertentu. Analisa ini juga dapat mengevaluasi homogenitas film. Struktur lapisan, halus maupun kasarnya permukaan sehingga topografi, tonjolan, lekukan dan pori-pori pada permukaan dapat terlihat. Pada prinsipnya bila terjadi perubahan pada suatu bahan misalnya patahan, lekukan dan perubahan struktur dari permukaan suatu bahan, maka bahan tersebut cenderung mengalami perubahan energy (Ulpa, 2011).
4.2.6. Uji Aktivitas Antibakteri Edible Film
4.2.6.1 Uji Aktivitas Antibakteri dengan Metode Kirby Bauer
[image:46.595.115.517.256.374.2]Pengujian aktivitas antibakteri dari edible film dapat dilihat pada tabel 4.3 terhadap bakteri Staphylococcus aureus dan Eschercia coli menunjukkan hasil yang negatif, ini ditandai dengan tidak adanya terbentuk larutan bening pada sekitar edible film.
Tabel 4.7 Hasil Uji Edible Film Terhadap E. Coli dan S. Aureus
No Sampel Indeks Antimikrobial
E. Coli S. Aureus
1. Sampel 1 0,011 0,013
2. Sampel 2 0,023 0,013
3. Sampel 3 0,012 0,011
filmnya. Sehingga film ini walaupun tidak memiliki zona hambat cocok untuk sebagai bahan pembungkus makanan.
4.2.6.2 Pertumbuhan Koloni Bakteri pada Sosis yang di Bungkus Edible
Film, dengan Metode Standart Plate Count
Dengan menggunakan metode Standard Plate Count (SPC) pada media plate count agar (PCA), jumlah koloni yang tumbuh pada sosis yang dibungkus dengan
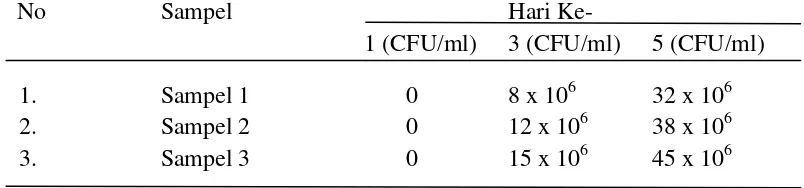
edible film dapat dihitung. Perhitungan jumlah koloni dilakukan dengan
menggunakan counter pada jangka waktu 5 hari. Sebagai kontrol jumlah koloni juga dilakukan terhadap sosis yang dibungkus dengan plastik biasa. Berikut hasil perhitungan jumlah koloni yang tumbuh pada media PCA.
Tabel 4.8 Hasil Pengamatan Pertumbuhan Koloni pada Sosis yang di Bungkus Edible Film Dengan Perbandingan Waktu Hari 1, Hari 3, Hari 5.
No Sampel Hari Ke-
1 (CFU/ml) 3 (CFU/ml) 5 (CFU/ml) 1. Sampel 1 0 8 x 106 32 x 106 2. Sampel 2 0 12 x 106 38 x 106 3. Sampel 3 0 15 x 106 45 x 106
[image:47.595.111.513.437.531.2]pertumbuhan coloni dibandingkan dengan sampel 2 dan sampel 3. Ini disebabkan karena komposisi edible film pada sampel 1 dengan penambahan ekstrak buah naga merah 10 ml (Hylocereus Costaricencis), tepung tapioca, kitosan 2%, dan gliserin sebagai plasticizer lebih baik digunakan sebagai pengemasan sosis sapi dibandingkan dengan sampel 2 dengan penambahan ekstrak buah naga merah 20 ml (Hylocereus Costaricencis), tepung tapioca, kitosan 2%, dan gliserin dan sampel 3 dengan penambahan ekstrak buah naga merah 30 ml (Hylocereus Costaricencis), tepung tapioca, kitosan 2%, dan gliserin pertumbuhan jumlah koloni lebih banyak dibandingkan dengan sampel 1. Dari hasil data dapat disimpulkan bahwa semakin sedikit penambahan ekstrak buah naga merah maka pertumbuhan coloni semakin sedikit sehingga dapat digunakan sebagai pengemasan sosis.
Tabel 4.9 Hasil Pengamatan Pertumbuhan Koloni pada Sosis yang di Bungkus Edible Film, diCelup dengan Edible Film Liquid, dan di Bungkus dengan Plastik Biasa
No Sampel Jumlah Koloni
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Karakteristik terbaik dari edible film yang dihasilkan, diperoleh edible dengan ketebalan 0,232 mm, kuat tarik sebesar 0,498 KgF/mm2, kemuluran 14,54 %. Dari hasil SEM terlihat permukaan film yang rata, rapat, dan berpori kecil. Dari hasil FT-IR menunjukkan panjang gelombang 3241 cm-1 – 3274 cm-1 menunjukkan adanya regangan gugus – OH, dan pada panjang gelombang 1316 cm-1 – 1371 cm-1 merupakan vibrasi gugus C-N.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Klasifikasi Buah Naga Merah
Buah naga merah (Hylocereus costaricencis) adalah tanaman yang buahnya berwarna merah menyala dan bersisik hijau. Buah naga termasuk tanaman kaktus atau famili Cactaceae dan subfamili Hylocereanea. Dalam subfamili ini terdapat beberapa genus, sedangkan buah naga termasuk dalam genus Hylocereus. Genus ini pun tediri dari sekitar 16 spesies. Dua diantaranya memiliki buah yang komersial, yaitu Hylocereus undatus ( berdaging putih) dan Hylocereus costaricensis ( daging merah).
Gambar 2.1 Buah Naga Merah (Hylocereus costaricencis) Adapun klasifikasi buah naga tersebut sebagai berikut:
Divisi :Spermatophyta (tumbuhan berbiji) Subdivisi :Angiospermae(berbiji tertutup)
Kelas :Dicotyledonae (berkeping dua) Ordo :Cactales
Famili :Cactaceae Subfamili :Hylocereanea Genus :Hylocereus
Tanaman yang berasal dari meksiko, Amerika Tengah, dan Amerika Selatan bagian utara ini sudah lama dimanfaatkan buahnya untuk konsumsi segar. Namun, selama itu tidak satu pun media massa dunia yang memberitakannya. Tanamannya merupakan jenis tanaman memanjat. Saat ditemukan di alam aslinya, tanaman ini memanjat batang tanaman lain dihutan yang teduh, walaupun perakarannya di tanah dicabut, tanaman ini masih tetap hidup sebagai tanaman epifit karena kebutuhan makanannya diperoleh melalui akar udara pada batangnya. Secara morfologis, tanaman ini termasuk tanaman tidak lengkap karena tidak memiliki daun.
Buah naga merah (Hylocereus costaricencis) sepintas mirp buah
Hylocereus polyrhizus. Namun, warna daging buahnya lebih merah, itulah
sebabnya tanamn ini disebut buah naga berdaging super merah. Batangnya bersosok lebih besar disbanding Hylocereus polyrhyzus. Batang dan cabangnya akan berwarna loreng saat berumur tua. Berat buahnya sekitar 400-500 g. Rasanya manis dengan kadar kemanisan mencapai 13-15 briks. Tanamannya sangat menyukai daerah yang panas dengan ketinggian rendah sampai sedang.
2.1.1 Khasiat Buah Naga Merah
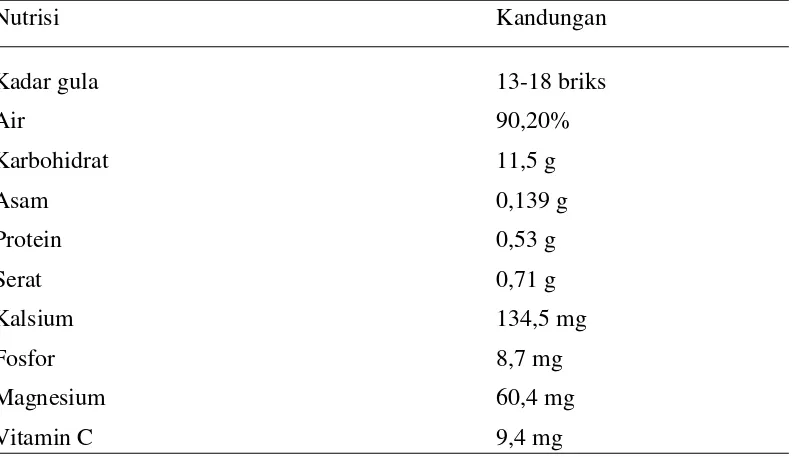
Dari beberapa media massa disebutkan bahwa buah naga merah memiliki khasiat untuk kesehatan manusia, diantaranya ialah sebagai penyeimbang kadar gula darah, pencegah kanker usus, pelindung kesehatan mulut, serta pengurangan kolesterol, pencegah pendarahan, dan obat keluhan keputihan. Adanya khasiat-khasiat tersebut disebabkan oleh kandungan nutrisi dalam buahnya yang sangat mendukung kesehatan tubuh manusia. Table 1 memberikan gambaran tentang kandungan nutrisi dalam buah naga merah.
TABEL 2.1. KANDUNGAN NUTRISI BUAH NAGA MERAH
Nutrisi Kandungan
Kadar gula 13-18 briks
Air 90,20%
Karbohidrat 11,5 g
Asam 0,139 g
Protein 0,53 g
Serat 0,71 g
Kalsium 134,5 mg
Fosfor 8,7 mg
Magnesium 60,4 mg
Vitamin C 9,4 mg
(Kristanto,2009)
2.1.2 Jenis Buah Naga
Ada empat jenis buah naga yang diusahakan dan memiliki prospek baik. Keempat jenis tersebut sebagai berikut.
2.1.2.1 Hylocereus Undatus
Hylocereus undatus yang lebih popular dengan sebutan white pitaya
2.1.2.2 Hylocereus polyrhizus
Hylocereus polyrhizus yang lebih banyak dikembangkan di Cina dan
Australia ini memiliki buah dengan kulit berwarna merah dan daging berwarna merah keunguan. Kulitnya terdapat sisik atau jumbai hijau. Rasa buah lebih manis disbanding Hylocereus undatus, kadar kemanisan mencapai 13-15 briks. Tanaman lebih kekar dibanding Hylocereus undatus. Dari pada batang dan cabang berjarak lebih rapat. Tanaman ini tergolong jenis yang sangat rajin bunga, bahkan cenderung berbunga sepanjang tahun.
2.1.2.3 Hylocereus costaricencis
Buah Hylocereus costaricencis adalah buah yang warna dagingnya lebih merah dan tanaman ini disebut dengan buah naga berdaging super merah. Batangnya bersosok lebih besar dibanding jenis buah naga Hylocereus polyrhizus. Batang dan cabangnya akan berwarna loreng saat berumur tua. Berat buah nya sekitar 400-500 g, rasanya manis dengan kadar kemanisan mencapai 13-15 briks.
2.1.2.4 Selenicereus megalanthus
Jenis buah ini berpenampilan berbeda disbanding jenis anggota genus Hylocereus. Kulit buahnya berwarna kuning tanpa sisik sehingga cenderung lebih halus. Walaupun tanpa sisik, kulit buahnya masih menampilkan tonjolan-tonjolan dan rasa buahnya jauh lebih manis dibanding buah naga lainnya karena memiliki kadar kemanisan mencapai 15-18 briks. Sayangnya buah yang dijuluki yellow pitaya ini kurang popular dibanding jenis lainnya. (Hardjadinata.S,2009)
2.2 Edible Film
Edible film diaplikasikan pada makanan dengan cara pembungkus, pencelupan, penyikatan atau penyemprotan. Bahan hidrokoloid dan lemak atau campuran keduanya dapat digunakan untuk membuat edible film. Hidrokoloid yang dapat digunakan untuk membuat edible filmadalah protein (gelatin, kasein, protein kedelai, protein jagung dan gluten gandum) dan karbohidrat (pati, alginate, pectin, gum arab, dan modifikasi karbohidrat lainnya), sedangkan lipid yang digunakan adalah lilin/wax, gliserol dan asam lemak. Adapun ketebalan edible film adalah tidak lebih dari 0,3 mm (Embuscado, 2009).
Kelebihan edible film yang dibuat dari hidrokoloid diantaranyamemiliki kemampuan yang baik untuk melindungi produk terhadap oksigen, karbondioksida dan lipid serta memiliki sifat mekanis yang diinginkan dan meningkatkan kesatuan struktural produk. Kelemahannya, film dari karbohidrat kurang bagus digunakan untuk mengatur migrasi uap air sementara film dari protein sangat dipengaruhi oleh pengaruh pH. Kelebihan edible film dari lipid adalah memiliki kemampuan yang baik untuk melindungi produk dari penguapan air atau sebagai bahan pelapis untuk mengoles produk makanan (Krochta, 1997). Metode pembuatan edible film yang sering digunakan yaitu metode casting, yaitudengan mendispersikan bahan baku edible film, pengaturan pH larutan, pemanasan larutan, pencetakan, pengeringan, dan pelepasan dari cetakan. Tidak ada metode standart dalam pembuatan edible film sehingga dapat dihasilkan film dengan fungsi dan karakteristik fisikokimia yang diinginkan akan berbeda. Namun pada umumnya dilakukan penambahan hidrokoloid untuk membentuk struktur film yang tidak mudah hancur dan plasticizer untuk meningkatkan elastisitas (Wahyu, 2008).
2.2.1 Sifat-sifat Edible Film
kemampuan film melindungi produk yang dikemas dengan menggunakan film tersebut.
Beberapa sifat film meliputi kekuatan renggang putus, ketebalan, pemanjangan, laju tranmisi uap air dan kelarutan film.
1. Ketebalan edible film
Ketebalan film merupakan sifat fisik yang dipengaruhi oleh konsentrasi padatan terlarut dalam larutan film. Ketebalan film akan mempengaruhi laju transmisi uap air, gas dan senyawa volatile.
2. Perpanjangan edible film atau elongasi
Perpanjangan edible film atau elongasi merupakan kemampuan perpanjangan bahan saatdiberikan gaya tarik. Nilai elongasi edible film menunjukkan kemampuan rentangnya.
3. Peregangan edible film atau tensile strength
Peregangan edible film merupakan kemampuan bahan dalam menahan tekanan yang diberikan saat bahan tersebut berada dalam regangan maksimumnya. Kekuatan peregangan menggambarkan tekanan maksimum yang dapat diterima oleh bahan atau sampel.
4. Kelarutan film
Persen kelarutan edible film adalah persen berat kering dari film yang terlarut setelah dicelupkan didalam air selama 24 jam.
5. Laju transmisi uap air
2.2.2 Aplikasi Edible film
Komponen penyusun edible film mempengaruhi secara langsung bentuk morfologi maupun karakteristik pengemas yang dihasilkan. Komponen penyusun edible film dikelompokkan menjadi tiga, yaitu hidrokoloid, lipida, dan komposit. Bahan-bahan tambahan yang sering dijumpai dalam pembuatan edible film adalah antimikroba, antioksidan, flavor,dan pewarna.
Komponen yang cukup besar dalam pembuatan edible film adalah plasticizer, yang berfungsi untuk meningkatkan fleksibilitas, menghindari film dari keretakan, meningkatkan permeabilitas terhadap gas, uap air, zat terlarut, dan meningkatkan elastisitas film. Beberapa jenis plasticizer yang dapat digunakan dalam pembuatan edible film adalah gliserol, polivinil alcohol, dan sorbitol.
Aplikasi dari edible film dapat dikelompokkan atas :
1. Sebagai kemasan primer dari produk pangan
Contoh dari penggunaan edible film sebagai kemasan primer adalah pada permen, sayur-sayuran, dan buah-buahhan segar, sosis, daging dan produk hasil laut.
2. Sebagai barrier
Penggunaan edible film sebagai barrier dapat dilihat dari contoh-contoh berikut: Gellan gum yang direaksikan dengan garam mono atau bivalen yang membentuk film, diperdagangkan dengan nama dagang Kelcoge, yang merupakan barrier yang baik untuk adsorpsi minyak pada bahan pangan yang digoreng, sehingga menghasilkan bahan dengan kandungan minyak yang rendah.
3. Sebagai pengikat
melekat pada produk. Pelapisan ini berguna untuk mengurangi lemak pada bahan yang digoreng dengan penambahan bumbu.
4. Pelapis
Edible film dapat bersifat sebagai pelapis untuk meningkatkan penampilan dari produk-produk bakery, yaitu untuk menggantikan pelapisan dengan telur. Keuntungan dari pelapisan dengan edible film adalah dapat menghindari masuknya mikroba yang dapat terjadi jika dilapisi dengan telur (Julianti E. dan Nurminah M, 2007).
2.3 Gliserin
Gliserin adalah senyawa netral, dengan rasa yang manis, tidak berwarna, cairan kental dan sangat higroskopis. Gliserin dapat menjadi berbentuk pasta bila berada mendekati titik beku. Gliserin dapat larut sempurna dalam air dan alcohol, tapi tidak larut dengan minyak, sebaliknya banyak zat lebih mudah larut dalam gliserol dibanding dalam air maupun alcohol. Oleh karena itu gliserin merupakan sebuah pelarut yang baik. Gliserin yang merupakan produk samping dari industry oleokimia yang memiliki sifat higroskopis, larut dalam air dan alcohol, tidak berwarna, tidak berbau dan memiliki rasa manis. Gliserin banyak digunakan untuk farmasi, bahan makanan, kosmetik, emulsifier dan minyak pelumas. Adapun kegunaan gliserin adalah sebagai berikut:
1. Bidang Farmasi
2. Bahan makanan
Gliserin digunakan sebagai pelarut ekstrak buah seperti vanili, kopi, koumarin. Gliserin juga digunakan untuk minuman berkarbonat, pembuatan keju, permen jeli.
3. Kosmetik
Gliserin yang memiliki sifat tidak beracun, tidak iritasi dan tidak berwarna digunakan untuk pelembut dan pelembab kulit, krem kulit, sabun, pembersih wajah. Gliserin juga digunakan sebagai pelarut parfum, pewarna dan pembersih kendaraan (Minner, 1953).
Gliserin dengan rantai HO-CH2-CH-(OH)-CH2-OH adalah produk
samping dari reaksi hidrolisis antara minyak nabati dengan air untuk menghasilkan asam lemak. Senyawa ini bisa menurunkan titik beku pelarutnya dengan mengganggu pembentukan Kristal es pelarut.
Gliserin juga dapat meningkatkan titik didih pelarutnya dengan menghalangi molekul-molekul pelarut saling bertumbukan, dengan demikian mengurangi tekanan uap pelarutnya. Gliserin berbentuk cairan jernih, tidak berbau dan memiliki rasa manis.
CH2 OH
CH OH
[image:59.595.287.351.494.621.2]CH2 OH
Gambar 2.2 Struktur Gliserin
air/pelembab sehingga cream selalu basah dan tidak cepat mongering di udara bebas.
Gliserin mudah dicerna dan tidak beracun dan bermetabolisme bersama karbohidrat, meskipun berada dalam bentuk kombinasi pada sayuran dan lemak binatang. Untuk produk makanan dan pembungkus makanan yang kontak langsung dengan konsumen, syarat utamanya adalah tidak beracun. Kegunaannya didalam produk makanan dan minuman antara lain sebagai:
- Pelarut untuk pemberi rasa - Pengental dalam sirup
- Bahan pengisi dalam makan rendah lemah (biskuit) - Pencegah kristalisasi gula pada permen dan es (http:susyanairi.blogspot.com/gliserin/html)
2.3 Kitosan
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan rotasi spesifik [α]D11 -3 hingga -10o (pada konsentrasi asam asetat 2%). Kitosan larut
pada kebanyakan asam organic pada pH sekitar 4,0 tetapi tidak larut pada pH lebih besar dari 6,5 dan juga tidak larut dalam pelarut air, alcohol, dan aseton (Sugita, 2009).
Kitosan diturunkan dari kitin dengan melakukan deasetilasi oleh pengaruh alkali. Kitosan dapat diketahui dari derajat deasetilasi dan berat molecular rata-rata yang terkandung disamping kegunaannya sebagai antimikroba dengan sifat-sifat kationik yang dimiliki.
Gambar 2.3 Struktur polimer kitosan
2.3 Tepung Tapioka
Tepung tapioca yang dibuat dari ubi kayu mempunyai banyak kegunaan, antara lain sebagai bahan pembantu dalam berbagai industry. Dibandingkan dengan tepung jagung, kentang, dan gandum atau terigu, komposisi zat gizi tepung tapioca cukup baik sehingga mengurangi kerusakan tenun, juga digunakan sebagai bahan bantu berwarna putih.
Tepung tapioca diolah menjadi sirup glukosa dan dekstrin sangat diperlukan oleh berbagai industry. Tapioca juga banyak digunakan sebagai bahan pengental, bahan pengisi, bahan pengikat dalam industry makanan. Ampas tapioca banyak dipakai sebagai campuran makanan ternak. Pada umumnya masyarakat kita mengenal dua jenis tapioca, yaitu tapioca kasar dan tapioca halus. Kualitas tepung tapioca ditentukan oleh beberapa factor, misalnya warna, kandungan air, banyak kotoran, dan tingkat kekentalan
Table 2.2 Daftar komposisi nutrisi tepung tapioka
No Kandungan zat Kadar zat
1 Air 9 gram
2 Kalori 363 kal
3 Protein 1,1 gram
4 Lemak 0,5 gram
5 Karbohidrat 88.2 gram
6 Kalsium 84 mg
7 Phospor 125 mg
8 Besi 1.0 mg
9 Vitamin B1 0.4 mg
[image:61.595.123.467.576.736.2]a. Pati
Amilum atau dalam kehidupan sehari-hari disebut pati terdapat pada umbi, daun, batang dan biji-bijian. Amilum terdiri atas dua macam polisakarida yang kedua-duanya adalah polimer dari glukosa, yaitu amilosa dan sisanya amilopektin. Amilosa terdiri atas 250-300 unit D-glukosa yang terikat dengan ikatan α 1,4-glikosidik, jadi molekulnya merupakan rantai terbuka. Amilopektin juga terdiri atas molekul D-glukosa yang sebagian besar mempunyai ikatan 1,4-glikosidik dan sebagian lagi ikatan 1,6-1,4-glikosidik. Adanya ikatan 1,6-1,4-glikosidik ini menyebabkan terjadinya cabang, sehingga molekul amilopektin berbentuk rantai terbuka dan bercabang (Poedjiadi, 1994).
Pati dapat dipisahkan menjadi dua fraksi utama berdasarkan kelarutan bila ditambahkan dengan air panas: sekitar 20% pati adalah amilosa (larut) dan 80% sisanya ialah amilopektin (tidak larut). Struktur amilosa merupakan struktur lurus dengan ikatan α- (1,4)-D-glukosa. Amilopektin terdiri dari struktur bercabang dengan ikatan α- (1,4)-D-glukosa dan titik percabangan amilopektin merupakan ikatan α- (1,6). Berat molekul amilosa dari beberapa ribu hingga 500.000, begitu pula dengan amilopektin (Lehninger, 1982).
Gambar 2.4 Struktur amilopektin
Suatu polisakarida yang jauh lebih besar daripada amilosa, mengandung 1000 satuan glukosa atau lebih per molekul. Seperti rantai dalam amilosa, rantai utama dai amilopektin mengandung 1,4-α-D-glukosa. Tidak seperti amilosa, amilopektin bercabang sehingga terdapat satu glukosa ujung kira-kira tiap 25 satuan glukosa. Ikatan pada titik percabangan ialah ikatan 1,6-α-glikosida (Fessenden, 1986).
Gambar 2.5 Struktur Amilosa
[image:63.595.163.458.459.568.2]b. Karakterisasi Edible Film
2.5.1 Fourier Transform Infrared (FTIR)
Spektroskopi adalah ilmu yang mempelajari segala sesuatu tentang interaksi antara materi dengan radiasi elektromagnetik (REM). Interaksi yang terjadi dalam spektroskopi inframerah ini merupakan interaksi dengan REM melalui absorbansi radiasi. Pancaran inframerah pada umumnya mengacu pada bagian spektrum elektromagnetik yang terletak diantara daerah tampak dan gelombang mikro. Molekul menyerap radiasi elektromagnetik dengan panjang gelombang yang khusus. Absorbansi cahaya ultraviolet mengakibatkan pindahnya sebuah elektron ke orbital dengan energi yang lebih tinggi. Radiasi inframerah tidak cukup mengandung energi untuk melakukan eksitasi tersebut, absorbsinya hanya mengakibatkan membesarnya amflitudo getaran atom-atom yang terikat satu sama lain (Sudarmadji, 1989).
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah vibrasi molekul yang dideteksi dan dapat diukur pada spektrofotometer infra merah. Spektra didaerah infra merah dapat digunakan untuk mempelajari sifat-sifat bahan, perubahan struktur yang sedikit saja dapat memberikan perubahan yang dapat diamati pada spectrogram panjang gelombang versus transmitasi. Menurut Sastrohamidjojo (1992), panjang gelombang yang diserap oleh berbagai tipe ikatan tergantung pada jenis vibrasi ikatan tersebut. Oleh karena itu berbagai jenis ikatan mengabsorbsi radiasi inframerah pada panjang gelombang yang berbeda.Perubahan ini sangat spesifik dan merupakan sidik jari suatu molekul dengan membandingkan spektogram yang dihasilkan oleh bahan yang diuji terhadap bahan yang sudah diketahui secara kualitatif. Penerapan secara kualitatif dapat dilakukan dengan membandingkan fungsi puncak pada panjang gelombang terkait yang dihasilkan oleh zat-zat yang diujikan dan zat standart. Spectra inframerah ditujukan terutama untuk senyawa organik yaitu analisis gugus fungsi yang dimiliki oleh senyawa tersebut (Mulja, M. 1995).
suatu senyawa menyerap radiasi pada suatu panjang gelombang tertentu, intensitas radiasi yang diteruskan oleh contoh akan berkurang. Ini menyebabkan suatu penurunan %T dan terlihat didalam spektrum sebagai suatu sumur, yang disebut sebagai puncak absorpsi atau pita absorpsi. Bagian spektrum dimana %T menunjukkan angka 100 (atau hampir 100) disebut garis dasar (baase line), yang didalam spektrum inframerah direkam pada bagian atas (Fessenden, 1992).
2.5.2. Scanning Electron Microscope (SEM)
Scanning Electron Microscope (SEM) dikembangkan untuk mempelajari secara langsung struktur permukaan, mikrostruktur, dan morfologi bahan. Alat SEM yang digunakan pada penelitian ini dilengkapi dengan EDS (Energy Dispersive Spectroscopy). EDS dihasilkan dari Sinar-X karakteristik, yaitu dengan menembakkan sinar-X pada posisi yang ingin kita ketahui komposisinya. Maka setelah ditembakkan pada posisi yang diinginkan maka akan muncul puncak – puncak tertentu yang mewakili suatu unsur yang terkandung.
Scanning Electron Microscope (SEM) merupakan sejenis mikroskop
yangmenggunakan elektron sebagai pengganti cahaya untuk melihat benda dengan resoles itinggi. Analisa SEM bermanfaat untuk mengetahui mikrostruktur (termasuk porositasdan bentuk retakan) benda padat. Berkas sinar elektron dihasilkan dari filamen yang dipanaskan, disebut elektron gun. Cara kerja SEM adalah gelombang elektron yang dipancarkan elektron gun terkondensasi dilensa kondensor dan terfokus sebagai titik yang jelas oleh lensa objekstif. Scanning coil yang diberi energi menyediakan medan magnetik bagi sinar elektron. Berkas sinar elektron yang mengenai cuplikan menghasilkan elektron sekunder dan kemudian dikumpulkan oleh detektor sekunder atau detektor backscatter. Gambar yang dihasilkan terdiri dari ribuan titik berbagai intensitas dipermukaan Cathoda Ray Tube (CRT) sebagai topografi gambar. Pada sistem ini berkas elektron dikonsentrasikan pada spesimen, bayangannya diperbesar dengan lensa objektif dan diproyeksikan pada layar.
1. Plat dipotong dengan menggunakan gergaji intan. Seluruh kandungan air, larutan dan semua benda yang dapat menguap apabila divakum, dibersihkan.
2. Cuplikan dikeringkan pada suhu 60°C minimal selama 1 jam.Cuplikan non logam harus dilapisi dengan emas tipis atau logam lainnya, seperti Pt. 3. Cuplikan logam dapat langsung dimasukkan dalam ruang cuplikan.
Sistem penyinaran dan lensa pada SEM sama dengan mikroskop cahaya biasa. Pada pengamatan yang menggunakan SEM lapisan cuplikan harus bersifat konduktif agar dapat memantulkan berkas elektron dan mengalirkannya ke ground.
Bila lapisan cuplikan tidak bersifat konduktif maka perlu dilapisi dengan emas atau Pt. Pada pembentukan lapisan konduktif, spesimen yang akan dilapisi diletakkan pada tempat sampel disekeliling anoda. Ruang dalam tabung kaca dibuat memliki suhu rendah dengan memasang tutup kaca rapat dan gas yang ada didalam tabung dipompa keluar. Antara katoda dan anoda dipasang tegangan 1,2 kV sehingga terjadi ionisasi udara yang bertekanan rendah. Elektron bergerak menuju anoda dan ion positif dengan energi yang tinggi bergerak menumbuk katoda emas. Hal ini menyebabkan partikel emas menghambur dan mengendap dipermukaan spesimen. (Gunawan dan Azhari, 2010).
2.5.3 Uji Tarik
Kekuatan tarik adalah salah satu sifat dasar dari bahan polimer yang terpenting dan sering digunakan untuk karakteristik suatu bahan polimer. Kekuatan tarik suatu bahan didefenisikan sebagai besarnya beban maksimum (Emaks) yang
digunakan untuk memutuskan specimen bahan dibagi dengan luas penampang awal (Ao).
2.6 Mikrobiologi Pangan
Sejumlah besar penelitian memperlihatkan bahwa makanan tambahan yang dioalah dalam kondisi yang tidak higenis kerapkali terkontaminasi berat dengan agens patogen dan merupakan faktor resiko utama dalam penularan penyakit, khususnya penyakit diare. Dalam kemasan edible film dapat ditambahkan bahan baku seperti antimikroba. Kemasan antimikroba adalah sistem kemasan yang mampu mengendalikan, mengurangi, menghambat atau memperlambat pertumbuhan mikroorganisme patogen dan mengurangi kontaminasi permukaan makanan. Penelitian yang dilakukan oleh black dkk, di Bangladesh menunjukkan bahwa 41% sampel makanan yang diberikan kepada anak-anak usia penyapihan mengandung kuman. Bakteri pada umumnya adalah heterotrof namun ada bakteri yang autotrof seperti bakteri kemosintetik. Bakteri ini mendapat energi melalui reaksi kombinasi oksigen dengan molekul anorganik, seperti sulfur, nitrit atau amonia.
1. Escherichia Coli
Escherichia coli merupakan bakteri gram negatif, berbentuk batang dengan panjang sekitar 2 mikrometer dan diameter 0,5 mikrometer, bersifat anaerob fakulatif, biasanya dapat bergerak dan tidak membenruk spora. Bakteri ini umumnya hidup pada rentang 20-40ºC, optimum pada 37ºC. Escherichia coli merupakan bakteri yang secara normal terdapat di dalam usus dan berperan dalam proses pembusukan sisa-sisa makanan. Keberadaan bekteri ini merupakan parameter ada tidaknya materi fekal di dalam suatu habitat khusunya air, Escherichia coli adalah salah satu jenis bakteri yang ada dalam tinja manusia dan dapat mengakibatkan gangguan pencernaan seperti diare.
2. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, aerob atau
Bakteri ini tumbuh cepat pada suhu 37ºC tetapi paling baik membentuk pigmen pada suhu 20-25ºC. koloni pada pembenihan padat berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen. Bakteri ini terdapat pada kulit, selaput lender, bisul dan luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan.
Usaha untuk menjaga agar mikroorganisme perusak tidak mencemari bahan makanan dapat mengurangi kerusakan makanan, memudahkan pengawetan pangan dan memperkecil kemungkinan adanya patogen. Pengepakan (kemasan) makanan, pengalengan makanan yang telah diolah dan pelaksanaan metode yang memenuhi syarat kebersihan dalam menangani bahan makanan merupakan contoh penanganan aseptik (Jawetz,2001).
2.7 Sosis
BAB I PENDAHULUAN
1.1. Latar Belakang
Pengemasan merupakan suatu cara dalam memberikan kondisi sekeliling yang tepat bagi bahan pangan dan dengan demikian membutuhkan pemikiran dan perhatian yang lebih besar untuk mengembangkan kemasan yang ramah lingkungan. Semua bahan pangan mudah rusak dan itu berarti bahwa setelah jangka waktu penyimpanan tertentu, ada kemungkinan untuk membedakan antara bahan pangan segar dengan bahan pangan yang telah disimpan dalam jangka waktu tertentu. Perubahan demikian dinamakan sebagai kerusakan bahan pangan. Kerusakan yang terjadi mungkin saja bersifat spontan, namun ini lebih sering disebabkan keadaan di luar dan kebanyakan pengemasan digunakan hanya untuk membatasi antara bahan pangan dan keadaan normal di sekelilingnya untuk menunda terjadinya proses kerusakan dalam jangka waktu yang di inginkan. Ini merupakan waktu dimana bahan pangan harus dikonsumsi atau harus dijual. Ini disebut sebagai daya awet bahan pangan. Penggunaan bahan pengemas yang banyak pada saat ini memiliki banyak kekurangan terhadap bahan pangan (Buckle, 1985).
Edible film, telah digunakan sejak beberapa abad sebelumnya untuk
Kitosan merupakan produk yang dihasilkan dari kulit hewan Crustaceae yang didapatkan dengan deasetilasi kitin. Kitosan merupakan polisakarida kationik dengan masa molekuler yang besar, kemampuan membentuk lapisan film yang baik serta aktivitas anti mikroba (Zhong,2008). Kitosan merupakan kopolimer β-(1,4)-2-asetamido D-glukosa. Kitosan mampu membentuk pelapis (coating) semipermeabel yang tahan terhadap pertukaran atmosfer, menunda pemasakan dan mengurangi laju transpirasi didalam buah dan makanan (Bourtoom,2008). Pada masa sekarang, polimer dengan bahan-bahan sintetik, biokompatibel, dan biodegradable sangat terbatas dibandingkan polimer alamiah seperti selulosa, kitin, kitosan, dan turunannya. (Kumar,2000). Dalam penggunaannya, kitosan telah dievaluasi untuk beragam penggunaannya di dalam makanan, pengobatan, kosmetik, pertanian, dan industry kimia karena sifat-sifat tidak beracun, biokompatibel, adhesive, dan mudah terurai (Abugoch, 2011). Kehadiran pemlastis dibutuhkan untuk meningkatkan sifat-sifat mekanik dari edible film yang dibuat. Pemlastis yang pada umumnya digunakan untuk edible film adalah, gliserol, sorbitol, dan senyawa-senyawa polihidroksi dengan berat molekuler rendah. Biasanya gliserol dan sorbitol secara luas digunakan sebagai pemlastis karena kestabilan dan kelarutan (Cerqueira, 2011).
Adanya kemasan ramah lingkungan yaitu dengan mengguakan edible packaging. Salah satu pengembangannya adalah edible film. Edible film adalah lapisan tipis yang dibuat dari bahan yang dapat dimakan dan digunakan untuk melapisi makanan (coating) atau diletakkan antara komponen makanan (film) yg berfungsi sebagai penghalang terhadap perpindahan massa (misalnya kelmbapan oksigen, cahaya, lipida, zat terlarut) dan juga sebagai pembawa zat adiktif untuk meningkatkan suatu mutu makanan.
Berdasarkan penelitian Siti wafiroh (2010) yang berjudul “Pembuatan dan Karakterisasi Edible Film dari Komposit Kitosan-pati Garut (Maranta arundinaceae L). Dengan Pemlastis Asam Laurat” menjelaskan tentang penggunaan asam laurat sebagai pemlastis dan dengan komposisi pati garut 1% (w/v) dan asam laurat 1 gram memberikan hasil terbaik. Menurut maulana
karnawidjaja wahyu (2008) yang berjudul “Pemanfaatan pati singkong sebagai bahan baku Edible Film menjelaskan bahwa Edible film yang dibuat dari pati singkong dapat digunakan untuk mengemas apel potong sehingga dapat mempertahankan kecerahan warna apel. Menurut Evi Sulistiani (2011) yang berjudul “pembuatan Edible film dari campuran kanji dengan ekstrak wortel (Daucus Carota L.) dan Gliserin sebagai Bahan Pengemas” menghasilkan permukaan edible yang lentur dengan uji kuat tarik 0,015 KgF/mm2, kemuluran
24%, dan permukaan berpori-pori kecil,rapat dan halus. Menurut jimmy (2013) yang berjudul “Karakterisasi Edible Film Dari Campuran Tepung Tapioka, Kitosan, Gliserin, dan Ekstrak Mangga (Mangifera Indica L) menghasilkan permukaan edible yang lentur dengan uji kuat tarik sebesar 0,2285 KgF/mm2. Dan berpori-pori rapat. Menurut Arini Aulia (2012) yang berjudul “pembuatan Edible Film Dari Ekstrak Buah Pepaya (carica papaya L) Dangan Campuran Tepung Tapioca, Tepung Terigu, dan Gliserin”menghasilkan permukaan edible dengan perbandingan 7,5 gram tepung tapioca dan 2,5 g tepung terigu yang optimalkan dibuktikan dari uji kuat tarik 0,1442 KgF/mm2, kemuluran 48,82 %, dan permukaan
yang rata serta kompatibel. Menurut Zoraya Masithah (2012) yang berjudul “KarakterisasiEdible Film dari Campuran Ekstrak Wortel (Daucus Carota L.) Dengan Tepung Tapioka, Tepung terigu, Dan Gliserin” menghasilkan permukaan Edible dengan perbandingan 5 g tepung tapioca dan 5 g tepung terigu yang optimal dibuktikan dari uji kuat tarik 0,1028 KgF/mm2, kemuluran 39,83 %, dan
hal ini disebabkan karena proses pencampuran yang lebih stabil sehingga permukaan film yang dihasilkan merata dan tidak mudah patah jika di tarik serta pada penambahan 3,5 g tepung tapioca,2% kitosan, 10 g Ekstark jambu biji dan 2 ml gliserin dihasilkan Edible Film pada titik jenuh. Menurut loisa Lorensia sinaga (2013) yang berjudul “Karakterisasi Edible Film Dari Ekstrak Kacang Kedelai Dengan Penambahan Tepung Tapioka Dan Gliserol Sebagai Bahan Pengemas Makanan” menghasilkan edible film yang terbaik pada ketebalan edible film 0,228 mm. Berdasarkan uraian diatas, maka penulis ingin melakukan penelitian dengan judul :”Karakterisasi Edible Film Dari Campuran Tepung Tapioka, Kitosan, Gliserin, Dan Ekstrak Buah Naga Merah (Hylocereus Costaricencis) Sebagai Pengemasan sosis”.
1.2 Perumusan Masalah
1. Bagaimana karakterisasi edible film dari campuran tepung tapioka, kitosan, gliserin, ekstrak buah naga merah (Hylocereus Costaricencis) meliputi ketebalan, kuat tarik, keregangan, uji SEM, uji FTIR
2. Apakah edible film yang dihasilkan dapat bersifat sebagai antibakteri.
1.3 Pembatasan Masalah
Untuk menghindari meluasnya permasalahan, dalam penelitian ini, masalah dibatasi sebagai berikut:
1. Buah naga merah yang digunakan berasal dari jenis dan varietas buah naga merah dengan nama latin (Hylocereus Costaricencis) berasal dari pasar buah medan
5. Ekstrak buah naga merah yang ditambahkan adalah sebanyak 10 g, 20 g. 30 g, 40 g, 50 g, kitosan yang ditambahkan adalah sebanyak 2%, gliserin yang ditambahkan adalah sebanyak 2 g .
6. Parameter yang diteliti adalah sifat mekanik (ketebalan, persen pemanjangan film/ elongation dan kuat tarik/ tensile strength), dan sifat fisik (analisa scanning electron microscope/ SEM dan analisa Spectroscopy FT-IR.
7. Analisa sifat edible film sebagai antibakteri dengan metode kirby bauer dan TPC
1.4 Tujuan Penelitian
Adapun yang menjadi tujuan penelitian ini adalah:
1. Untuk mengetahui karakteristik dari edible film yang dihasilkan. 2. Untuk mengetahui sifat edible film sebagai antibakteri.
1.5 Manfaat Penelitian
Menghasilkan edible film sebagai bahan pengemas makanan yang bersifat mudah terdegradasi secara alami serta ramah lingkungan
1.6 Metodologi Penelitian
Penelitian bersifat eksperimental laboratorium, dengan langkah-langkah sebagai berikut:
penambahan gliserin, kemudian didiamkan hingga mengental, dicetak di atas plat akrilik, dikeringkan didalam oven pada suhu ± 300C selama ± 2 hari.
- Edible Film yang dihasilkan dilakukan pengukuran ketebalan dengan menggunakan jangka sorong.
- Edible Film yang dihasilkan dilakukan pengukuran massa edible film sebelum dan sesudah direndam dalam gelas beaker yang berisi akuades. - Edible Film yang dihasilkan kemudian dilakukan pengujian kuat tarik dan
kemuluran