ABSTRACT
BANJAR ARSI PURBO SEJATI (B04070090). Parasitic Worm and Leukocyte Profile of Goldfish (Carassius auratus). Under direction Dr. drh. Risa Tiuria, Ms. And Dr. drh. Damiana Rita Ekastuti, Ms.
This research was conducted to observe the parasitic worms on the goldfish and see the relationship between the infestation of worms with the hematology of goldfish. The organs which examined were the gills and the intestines. This research used 30 samples. Ten samples were taken from the Pasar Anyar Bogor Tengah, ten samples from Batu Tulis Bogor Selatan and ten samples from Baranang Siang Bogor Timur. The results showed that the gills of goldfish were 100% infected with parasitic worms. The intestines were not infected with parasitic worms. Parasites that identificated in goldfish’s gills were Monopisthocotylea and Dactylogyrus sp.. Leukocyte profile of the goldfish showed an increase in the neutrophils and the eosinophils.
CACING PARASITIK DAN GAMBARAN LEUKOSIT PADA
IKAN MASKOKI (Carassius auratus)
BANJAR ARSI PURBO SEJATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
ABSTRACT
BANJAR ARSI PURBO SEJATI (B04070090). Parasitic Worm and Leukocyte Profile of Goldfish (Carassius auratus). Under direction Dr. drh. Risa Tiuria, Ms. And Dr. drh. Damiana Rita Ekastuti, Ms.
This research was conducted to observe the parasitic worms on the goldfish and see the relationship between the infestation of worms with the hematology of goldfish. The organs which examined were the gills and the intestines. This research used 30 samples. Ten samples were taken from the Pasar Anyar Bogor Tengah, ten samples from Batu Tulis Bogor Selatan and ten samples from Baranang Siang Bogor Timur. The results showed that the gills of goldfish were 100% infected with parasitic worms. The intestines were not infected with parasitic worms. Parasites that identificated in goldfish’s gills were Monopisthocotylea and Dactylogyrus sp.. Leukocyte profile of the goldfish showed an increase in the neutrophils and the eosinophils.
RINGKASAN
BANJAR ARSI PURBO SEJATI (B04070090). Cacing Parasitik dan Gambaran Leukosit Ikan Maskoki (Carassius auratus). Dibawah Bimbingan Dr. drh. Risa Tiuria, Ms. Sebagai Pembimbing I dan Dr. drh. Damiana Rita Ekastuti, Ms. Sebagai Pembimbing II.
Penelitian ini bertujuan untuk mengamati cacing parasitik yang berada pada ikan maskoki serta melihat pengaruh kecacingan terhadap gambaran leukosit ikan. Organ yang diperiksa berupa insang dan usus. Penelitian ini menggunakan 30 sampel ikan. Sepuluh sampel ikan diambil dari Pasar Anyar Bogor Tengah, sepuluh sampel Batu Tulis Bogor Selatan dan sepuluh sampel Baranang Siang Bogor Timur.
Hasil penelitian menunjukkan bahwa insang ikan maskoki 100% terinfeksi cacing parasitik. Usus ikan tidak terinfeksi cacing parasitik. Parasit yang menyerang insang ikan maskoki teridentifikasi berupa cacing dari sunkelas Monopisthocotylea dan Dactylogyrus sp.. Gambaran leukosit ikan maskoki menunjukkan adanya peningkatan sel neutrofil dan sel eosinofil.
CACING PARASITIK DAN GAMBARAN LEUKOSIT PADA
IKAN MASKOKI (Carassius auratus)
SKRIPSI
Sebagai Salah Satu Syarat Untuk memperoleh Gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut PertanianBogor
Oleh:
BANJAR ARSI PURBO SEJATI
B04070090
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
CACING PARASITIK DAN GAMBARAN LEUKOSIT IKAN MASKOKI (Carassius auratus)
Adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skirpsi ini.
Bogor, November 2011
Banjar Arsi Purbo Sejati
© Hak Cipta Milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencatumkan dan menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar IPB.
LEMBAR PENGESAHAN
Judul Penelitian : Cacing parasitik dan gambaran darah pada ikan maskoki (Carassius auratus)
Nama : Banjar Arsi Purbo Sejati
NIM : B04070090
Disetujui
Pembimbing I Pembimbing II
Dr.drh. Risa Tiuria, M.S. Dr.drh. Damiana Rita Ekastuti,M.S. NIP: 196304301987032001 NIP: 1962021219862001
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan IPB
Dr. Nastiti Kusumorini NIP: 196212051987032001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia-Nya sehingga skripsi ini mampu terselesaikan dengan baik.
Dalam kesempatan ini penulis menyampaiksn penghargaan dan ucapan terimakasih setinggi-tingginya kepada orang-orang yang telah berperan dalam penyusunan tugas akhir ini. Ucapan terimakasih tersebut disampaikan kepada: 1. Dr. Drh. Risa Tiuria, MS selaku dosen pembimbing pertama dan Dr. drh.
Damiana Rita Ekastuti, MS selaku dosen pembimbing kedua atas kesempatan, bimbingan, petunjuk, masukan dan dorongan yang sangat membantu penulis dalam penelitian dan penulisan skripsi ini.
2. Drh. H Muchidin Noordin selaku dosen penguji yang telah memberikan masukan bagi kesempurnaan skripsi ini.
3. My Beloved Family: Papa, Mama, kak Putri Indonesia Sejati, Kak Gati, adek Anjar dan seluruh keluarga besar serta eyang atas dukungan yang diberikan selama ini.
4. Rekan satu penelitian, Amalia Mukhlis Rahman dan David Kusmawan atas kerjasama dan dukungan selama penelitian.
5. Pak Eman (staf bagian Helminthologi), Bu Wiwik dan Pak Engkos atas bantuannya.
6. Adi N, Wulan, Ati, Sheila, Mega, dan Tami atas bantuan, koreksian, dukungan, dan saran berharga yang diberikan.
7. Teman-teman Gianuzi 44 atas kebersamaannya selama ini.
8. Semua pihak yang telah banyak membantu dan tidak mungkin disebutkan satu persatu, penulis mengucapkan terimakasih.
Terlepas dari kekurangan yang ada penulis berharap semoga tulisan ini bermanfaat bagi mereka yang memerlukan.
Bogor, November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Abepura pada tanggal 19 Juni 1989 sebagai anak Kedua dari empat bersaudara, dari Pasangan Sudarmo Di Suryo dan Wahtu Kustiarini.
Pendidikan dasar ditempuh di SDN Perumnas 1 Waena, kemudian dilanjutkan pada SMP Negeri 11 Jayapura, lalu dilanjutkan pada Sekolah Menengah Atas (SMA) Negeri 1 Abepura. Penulis diterima sebagai mahasiswi IPB pada Fakultas Kedokteran Hewan tahun 2007 melalui jalur Undangan Seleksi Masuk IPB (USMI).
i
Tujuan Penelitian ….………..………..….…...
Manfaat Penelitian ………..………..…...…
TINJAUAN PUSTAKA ………..………
Ikan Maskoki (Carassius auratus) ………..…… Darah Ikan Maskoki ………...…..………..….…
Cacing Parasitik Pada insang dan Usus ……….………
ii Saran ………..
DAFTAR PUSTAKA ………..…….… 25
iii
DAFTAR GAMBAR
Halaman
1 Oranda Fancy Goldfish ………...…. 4
2 Saluran Pencernaan Ikan Maskoki ………. 5
3 Gambaran Sel Darah Putih Ikan ……… 7
4 Gyrodactylus sp. ………...………… 10
5 Dactylogyrus ………...……….. 10
6 Diplectanum Collinsi ……… 12
iv
DAFTAR TABEL
Halaman
Tabel 1 Gambaran Leukosit Normal Ikan Maskoki ………. 6
Tabel 2 Kondisi Pemeliharaan Ikan Maskoki .………. 17
Tabel 3 Tingkat prevalensi kecacingan pada ikan maskoki (Carassius auratus) di Bogor ………..….. 17
Tabel 4 Jumlah cacing pada ikan di Bogor ……… 21
1
PENDAHULUAN
Latar Belakang
Ikan hias air tawar merupakan salah satu komoditas perikanan Indonesia
yang mempunyai peluang besar untuk menghasilkan devisa negara di sektor non
migas. Ikan hias air tawar memiliki keindahan yang menjadi daya tarik tersendiri
bagi penghobi maupun untuk pembudidaya ikan hias. Salah satu jenis ikan hias air
tawar yang populer adalah ikan maskoki (Carassius auratus). Ikan ini memiliki kemampuan yang cukup adaptif terhadap kondisi lingkungan. Namun di dalam
pemeliharaannya, ikan maskoki tetap tidak lepas dari masalah kesehatan seperti
terserang penyakit.
Penyakit dapat disebabkan oleh berbagai agen. Menurut Gusrina (2008), ada
dua jenis agen yang dapat menyebabkan terjadinya penyakit yaitu agen patogen
dan agen non patogen. Kehadiran agen patogen dapat mempengaruhi pemilik ikan
dan individu ikan itu sendiri. Penyakit pada ikan menyebabkan penurunan kualitas
ikan, kematian ikan, kerugian materiil, kegagalan budidaya, dan dapat berujung
pada bangkrutnya usaha (Prayitno 2002). Kehadiran agen patogen tertentu dalam
tubuh inang dapat menyebabkan timbulnya kerusakan, stres bahkan kematian.
Menurut Gusrina (2008), contoh agen non patogen berupa keracunan dan
kekurangan gizi, sedangkan contoh agen patogen berupa virus, bakteri, dan cacing
parasit.
Ikan maskoki merupakan anggota dari famili Cyprinidae. Menurut Anshary
(2008), ikan dari famili tersebut termasuk jenis ikan yang paling rentan terhadap
berbagai infeksi parasit. Kehadiran cacing parasit menyebabkan adanya respon
pada tubuh, salah satunya berupa perubahan gambaran leukosit ikan.
Tujuan
Penelitian ini dilakukan untuk mengidentifikasi cacing parasitik pada ikan
maskoki dan untuk melihat pengaruh kecacingan terhadap gambaran leukosit pada
2
Manfaat Penelitian
Hasil penelitian ini diharapkan mampu memberikan informasi mengenai
jenis cacing parasitik yang menyerang insang dan saluran pencernaan ikan
3
TINJAUAN PUSTAKA
Ikan Maskoki (Carassius auratus)
Ikan Maskoki (Carassius auratus) pertama kali dibudidayakan oleh masyarakat Cina pada tahun 960-1729. Awalnya bentuk ikan maskoki seperti ikan
Mas (Cyprinus carpio L), bedanya ikan maskoki tidak memiliki sepasang sungut di mulutnya
popularitas ikan maskoki mulai menanjak. Di sinilah bermunculan ikan maskoki
dengan bentuk tubuh yang bervariasi dan unik. Perkembangan ikan maskoki
kemudian merambah hingga ke negeri Jepang.
Di negeri matahari terbit ikan maskoki terus mengalami perkembangan
pesat sehingga menghasilkan bentuk yang lebih bervariatif seperti saat ini. Dari
negeri Sakura, ikan maskoki mulai menyebar ke seluruh dunia, termasuk
Indonesia
besar agak menonjol ke luar dan warna sisik yang menarik. Ikan maskoki
tergolong mudah dipelihara karena sifatnya cukup adaptif terhadap lingkungan
yang baru. Tak mengherankan jika ikan maskoki dengan berbagai varietasnya
tersebar di seluruh dunia
Ikan maskoki masuk ke dalam Kingdom Animalia, Subkingdom Eumetazoa,
Filum Chordata, Subfilum Vertebrata, Infrafilum Gnathostomata, Kelas
Actinopterygii, Subkelas Neopterygii, Superordo Teleostei, Ordo Clupeiformes,
Family Cyprinidae, Genus Carassius dan Spesiesnya berupa Carassius auratus
(Freyhof 2004).
Salah satu jenis ikan maskoki yang populer adalah Ikan maskoki varietas
Oranda (Spencer). Ikan ini memiliki keunikan yang terletak pada kepalanya yang
berjambul dan memiliki sirip punggung (Iskandar dan Sitanggang 2003), hal
tersebut dapat diamati pada Gambar 1.
Ikan maskoki merupakan ikan hias air tawar yang hidup di perairan dengan
air yang mengalir tenang serta berudara sejuk
hewan omnivora (Watson et al 2004) dan bukan hewan kanibal sehingga dapat dipelihara secara koloni dalam satu lingkungan pemeliharaan (Iskandar dan
4 Suhu optimal air untuk hidup ikan maskoki adalah 18-24ºC.
Mempertahankan suhu untuk terus berada dalam kisaran suhu optimal perlu
dilakukan. Karena pemeliharaan di luar suhu optimal dapat menekan sistem
kekebalan tubuh ikan dan akan menyebabkan penurunan nafsu makan serta
gangguan pada pertumbuhan ikan. Ikan maskoki dapat hidup dalam air yang
memiliki kandungan oksigen minimal 5 mg/L, pH 7-7.8, tingkat amoniak terlarut
maksimal 0,05 mg/L dan tingkat nitrit terlarut maksimal 0,05 mg/L (Watson et al
2004).
Ikan maskoki dianggap sebagai ikan yang tangguh karena dapat bertahan
hidup di air berkualitas buruk. Walaupun demikian, kualitas air penting di
perhatikan agar pertumbuhan, reproduksi dan kesehatan ikan berjalan optimal
(Watson et al 2004). Ikan maskoki dapat hidup hingga umur 30 tahun dengan panjang mencapai 23 inches (58 cm) dan berat mencapai 2,7 kg .
Ikan maskoki memiliki organ interna dan eksterna yang keseluruhan organ
tersebut memiliki ciri dan fungsi tertentu untuk mendukung kelangsungan hidup
ikan (Yanong 2003). Insang merupakan salah satu organ interna ikan maskoki
yang memiliki peranan penting bagi kelangsungan hidup ikan. Peranan penting
tersebut adalah sebagai media pertukaran gas (Campbell et al 2004). Insang terdiri dari lamela insang primer, lamela insang sekunder dan tulang rawan insang.
Lamela primer adalah lamela yang bersentuhan langsung dengan tulang rawan
insang dan lamela sekunder merupakan percabangan dari lamela primer (Yanong
2003).
Insang akan mengoptimalkan ekstraksi oksigen dari air dan merupakan
5 keluar diantara celah insang lewat gerakan terkoordinasi dari rahang dan
operculum (penutup insang), agar terjadi ventilasi. Ventilasi yang dimaksudkan berupa aktivitas inhalasi dan ekshalasi atau proses mengambil oksigen dan
melepaskan karbon dioksida lewat pernafasan. Ketika ventilasi terjadi, darah
mengalir dengan arah yang berlawanan dengan aliran air yang mengalir, oksigen
akan masuk ke dalam aliran darah dan CO2 akan dibuang ke air (Campbell et al 2004).
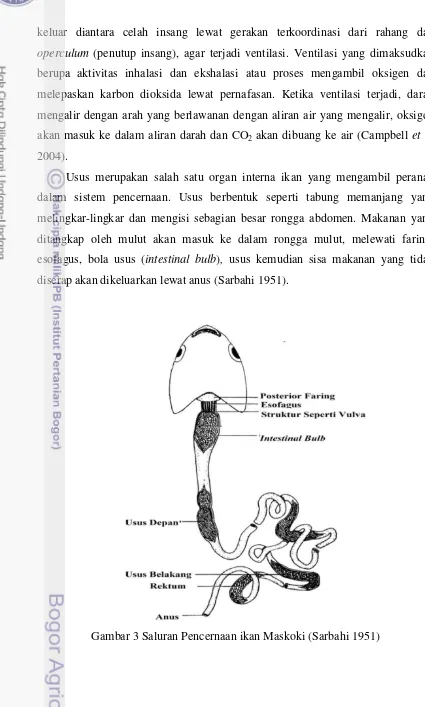
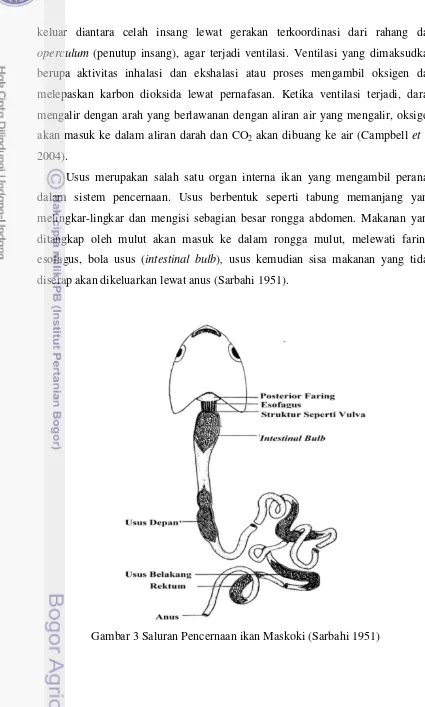
Usus merupakan salah satu organ interna ikan yang mengambil peranan
dalam sistem pencernaan. Usus berbentuk seperti tabung memanjang yang
melingkar-lingkar dan mengisi sebagian besar rongga abdomen. Makanan yang
ditangkap oleh mulut akan masuk ke dalam rongga mulut, melewati faring,
esofagus, bola usus (intestinal bulb), usus kemudian sisa makanan yang tidak diserap akan dikeluarkan lewat anus (Sarbahi 1951).
6 Bola usus merupakan kantung hasil pembengkakan anterior usus yang
berfungsi untuk menyimpan makanan. Bola usus tidak memiliki kelenjar lambung
dan memiliki mukosa yang mirip dengan mukosa usus (Khanna dan Yadav 2004).
Usus ikan maskoki sendiri terbagi atas usus depan, usus belakang dan rektum.
Perbedaan antara usus depan, usus belakang, dan rektum terletak pada pola lipatan
dari membran mukosa. Usus depan memiliki pola lipatan berupa garis dan sudut
sedangkan usus belakang memiliki pola lipatan berupa garis yang berbelit-belit.
Pola lipatan rektum ikan maskoki berupa pola miring melintang (Sarbahi 1951).
Darah Ikan Maskoki
Seperti pada mamalia, ikan memiliki komponen darah berupa sel darah
merah atau eritrosit dan sel darah putih atau leukosit. Setiap spesies pada hewan,
baik itu mamalia, reptil maupun ikan memiliki kisaran nilai parameter hematologi
yang berbeda. Gambaran leukosit normal pada ikan maskoki dapat terlihat pada
Tabel 1.
Tabel 1 Gambaran leukosit normal ikan maskoki
No Diferensial leukosit (%)
Leukosit Normal Ikan Maskoki
Watson (1963) Loventhal (1930) Lewbart (2006)
1. Limfosit 92 73 70
Limfosit merupakan sel leukosit berbentuk bulat, tidak teratur dengan inti
yang besar (Gao et al. 2007). Limfosit merupakan sel leukosit yang paling umum ada dalam darah ikan, berupa 85% dari seluruh total populasi sel leukosit
(V´azquez dan Guererro 2007). Limfosit berfungsi memediasi respon imun
humoral dan respon imun seluler. Ketika sel limfosit berkontak dengan bahan
asing (antigen), akan terjadi proliferasi sel limfosit yang kemudian akan
menyebabkan dikeluarkannya antibodi imunoglobulin oleh sistem imun. Respon
imun humoral merupakan respon kekebalan tubuh yang dimediasi oleh antibodi
7 Monosit merupakan sel-sel besar dengan nukleus besar dan sitoplasmanya
berisi granul-granul kecil yang tersebar. Monosit berfungsi dengan menanggapi
infeksi dan merupakan prekursor dari makrofag. Hal ini menyebabkan sel
monosit memainkan peran penting dalam imunitas non spesifik dan respon
inflamasi (AMC 2008).
Eosinofil, neutrofil dan basofil pada ikan termasuk dalam granulosit leukosit
atau sel leukosit yang memiliki granul-granul (V´azquez dan Guererro 2007).
Granulosit terlibat dalam mekanisme pertahanan non-spesifik, yaitu mereka
menanggapi adanya bahan asing dalam tubuh tetapi tidak mengenali antigen
tertentu. Sel-sel ini bermigrasi ke bagian tubuh di mana invasi terjadi dan
menghancurkan partikel asing dengan fagositosis atau dengan membunuh
langsung yang dikenal sebagai respon sitotoksik (AMC 2008).
.
Gambar 3. Gambaran sel darah Putih ikan: A) l adalah Limfosit; B) m adalah Monosit; C) eo adalah Eosinofil; D) Neutrofil; E) eosinofil (V´azquez dan Guererro 2007); F) Monosit; G) Limfosit (Gao et al. 2007).
Pada ikan sehat, yang paling umum ditemukan diantara ketiga granulosit
tersebut adalah sel neutrofil dan granulosit leukosit yang sangat jarang ditemukan
adalah sel basofil (V´azquez dan Guererro 2007). Neutrofil umumnya memiliki
8 berbentuk elips tidak teratur. Memiliki inti yang dapat diamati seperti berbentuk
pita, bentuk tapal kuda, membentuk segmen terhadap sumbu dan tidak simetris.
Eosinofil merupakan sel darah putih khusus (leukosit PMN) yang dapat
diwarnai dengan pewarna asam seperti eosin, namun sel eosinofil dapat pula di
identifikasi dengan pewarnaan sederhana seperti pewarnaan giemsa (AMC 2008).
Eosinofil memiliki sitoplasma yang besar berbentuk bola dengan granul-granul
yang hampir menutupi. Inti sel eosinofil biasanya berbentuk bulat, kadang
berbentuk seperti ginjal atau tapal kuda tetapi lebih teratur (Gao et al. 2007). Sel-sel ini terlibat dalam penghancuran parasit internal dan dalam modulasi inflamasi
reaksi alergi (AMC 2008).
Cacing Parasitik Pada Insang dan Usus
Ikan Cyprinidae termasuk jenis ikan yang paling rentan terhadap berbagai
infeksi parasitik (Anshary 2008). Menurut FAO (1991), Metazoa yang bersifat
parasit seperti cacing parasit pada kelas tertentu (monogenea, cestoda dan
digenea) merupakan agen-agen yang memegang peranan pada penyakit ikan.
Monogenea merupakan salah satu kelas dari hewan yang tak bertulang
belakang yang termasuk dalam phylum Platyhelminthes. Monogenea memiliki arti
sebagai dilahirkan sekali, hal ini mengacu pada siklus hidupnya yang sederhana
(Williams dan Williams 1994) dan tanpa inang perantara (Lasee 2004). Pada
infeksi yang berat, cacing dari kelas monogenea dapat membunuh ikan yang
menjadi inangnya. Umumnya monogenea memiliki bentuk tubuh panjang dan
transparan (Williams dan Williams 1994).
Monogenea memiliki organ lampiran berbeda pada bagian belakang tubuh
mereka (haptor) yang dilengkapi dengan kait atau klem khusus. Kait atau klem
khusus ini dapat dipakai untuk menusuk epitel dan berpegangan pada inang.
Sebagian besar monogenea berkembang biak dengan meletakkan telur yang
menetaskan larva bersilia (onchomiracidia) dan cepat menjadi dewasa dan
melekat pada inang (William dan William 1994).
Ikan air tawar yang terserang monogenea akan terlihat lesu, berenang di
dekat permukaan, mencari sisi kolam dan nafsu makan menjadi menurun. Insang
9 toleran terhadap oksigen yang rendah. Infeksi monogenea yang parah pada kulit
dan insang dapat menyebabkan kerusakan hebat bahkan kematian. Investasi
monogenea yang besar juga akan memicu terjadinya infeksi sekunder oleh bakteri
dan jamur (Klinger dan Floyd 2009). Monogenea memiliki dua sub kelas yaitu
Monopisthocotylea dan Polyopisthocotylea.
Monopisthocotylea merupakan salah satu subkelas dari monogenea. Cacing
dari subkelas Monopisthocotylea memiliki organ tubuh sederhana dan biasanya
satu haptor dengan 1-2 jangkar dengan lingkaran yang interkoneksi. Umumnya
parasit cacing dari subkelas ini memiliki ukuran yang jauh lebih kecil daripada
cacing dari subkelas Polyopisthocotylea. Parasit ini dapat ditemukan di kerokan
permukaan kulit atau di insang yang diamati dengan menggunakan mikroskop
(Wiliams dan Wiliams 1994).
Pada infeksi cacing yang berat, kait cacing dapat menyebabkan iritasi pada
kulit dan insang serta meningkatkan produksi lendir. Kulit mungkin memiliki
bercak putih terutama di belakang sirip. Ikan akan menunjukkan kebiasaan berupa
menggosokkan tubuh mereka pada sisi kolam dan berenang dengan terlalu liar
atau dengan lesu (Wiliams dan Wiliams 1994). Monopisthocotylea memiliki tiga
ordo yaitu Capsalidea, Dactylogridea dan Gyrodactylidea (David 2010a), namun
Monopisthocotylea yang menyerang insang ikan air tawar biasanya berasal dari
ordo Dactylogridea dan Gyrodactylidea (Wiliams dan Wiliams 1994).
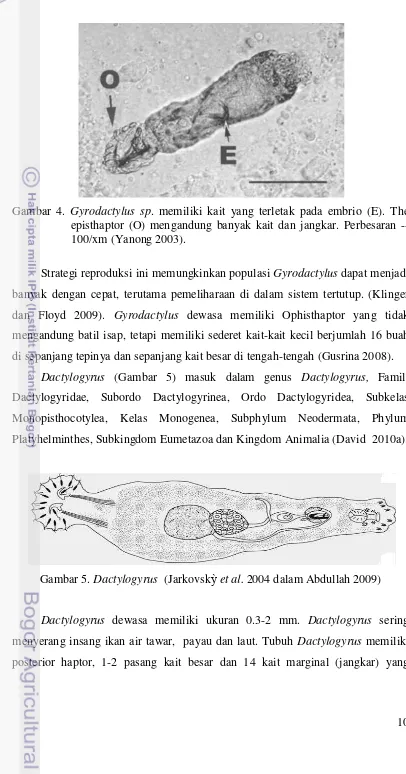
Cacing parasitik pada Gambar 4 masuk ke dalam genus Gyrodactylus,
Famili Gyrodactylidae, Ordo Gyrodactylidea, Sub Kelas
Kelas Monogenea, Subphylum
Subkingdom Gyrodactylus
merupakan salah satu genus cacing parasit yang menginfeksi insang dari ikan air
tawar. Cacing ini memiliki embrio yang sedang berkembang yang dapat terlihat di
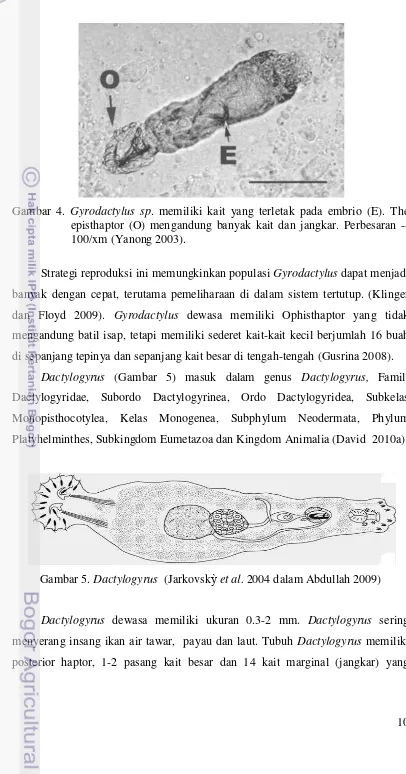
10 Gambar 4. Gyrodactylus sp. memiliki kait yang terletak pada embrio (E). The episthaptor (O) mengandung banyak kait dan jangkar. Perbesaran -- 100/xm (Yanong 2003).
Strategi reproduksi ini memungkinkan populasi Gyrodactylus dapat menjadi banyak dengan cepat, terutama pemeliharaan di dalam sistem tertutup. (Klinger
dan Floyd 2009). Gyrodactylus dewasa memiliki Ophisthaptor yang tidak mengandung batil isap, tetapi memiliki sederet kait-kait kecil berjumlah 16 buah
di sepanjang tepinya dan sepanjang kait besar di tengah-tengah (Gusrina 2008).
Dactylogyrus (Gambar 5) masuk dalam genus Dactylogyrus, Famili Dactylogyridae, Subordo Dactylogyrinea, Ordo Dactylogyridea, Subkelas
Monopisthocotylea, Kelas Monogenea, Subphylum Neodermata, Phylum
Platyhelminthes, Subkingdom Eumetazoa dan Kingdom Animalia (David 2010a).
Gambar 5. Dactylogyrus (Jarkovskỳet al. 2004 dalam Abdullah 2009)
11 terdapat pada bagian posterior. Kepala Dactylogyrus memiliki 4 lobe dengan dua pasang mata yang terletak di daerah pharynx (Gusrina 2008).
Cacing dari subkelas Polyopisthocotylea memiliki ukuran tubuh yang jauh
lebih besar daripada cacing parasit Monopisthocotylea dan biasanya dapat dengan
mudah dilihat dengan mata telanjang. Cacing dari subkelas ini memiliki haptor
sederhana dengan organ perlekatan atau pengisap yang kompleks dan umumnya
cacing ini memakan darah. Cacing parasit dari subkelas Polyopisthocotylea
menghasilkan telur yang lebih sedikit dari pada cacing dari subkelas
Monopisthocotylea. Namun cacing parasit dari subkelas Polyopisthocotylea lebih
patogen dibandingkan cacing parasit dari subkelas Monopisthocotylea (Wiliams
dan Wiliams 1994).
Cacing parasit dari subkelas Polyopisthocotylea cenderung lebih umum
hidup di lingkungan laut. Beberapa spesies dari subkelas Polyopisthocotylea yang
berada di air tawar biasanya memiliki inang alami yang berasal dari laut.
Peningkatan jumlah cacing yang menginfeksi inang yang sama tidak cepat namun
kebiasaan memakan darah menyebabkan kerusakan serius pada inang (Wiliams
dan Wiliams 1994).
Diplectanum collinsi (Gambar 6) merupakan salah satu spesies yang berasal dari ordo Diplectanum collinsi berasal dari genus
Fa
filum
Cacing parasit ini ditemukan di air tawar. Inang asli cacing parasit ini berasal dari
laut, namun ia dapat hidup dengan menjadi parasit di beberapa ikan air tawar.
Cacing ini memiliki Squamodisks yang menempati sebagian besar haptor. Lingkaran haptor berbentuk seperti bumerang dan memiliki dua pasang jangkar.
Cacing ini memiliki ukuran panjang sekitar 635-675 mm (Wiliams dan Wiliams
1994).
Secara garis besar, Ikan dapat terjangkit dan tertular penyakit melalui air
yang tercemar oleh penyakit, melalui gesekan atau kontak badan (mekanik)
dengan ikan yang sakit, melalui peralatan yang digunakan dalam menangani ikan,
terbawa oleh pakan hidup atau tumbuhan ke kolam baru (Afrianto dan Liviawati
12 Gambar 6. Diplectanum Collinsi (Wiliams dan Wiliams 1994).
Cestoda atau cacing pita memiliki bentuk tubuh pipih seperti pita dan
bersifat parasit pada saluran pencernaan vertebrata (Natadisastra dan Agoes
2005). Cestoda memiliki scolex yang dilengkapi dengan kait-kait, organ
penghisap, atau keduanya. Skolex tersebut terdiri atas proglotida dengan tingkat
kematangan yang berbeda pada tiap segmen. Semakin jauh proglotida dari leher
maka proglotida itu semakin matang atau dewasa (Levine 1990).
Cestoda merupakan cacing hemafrodit yaitu memiliki kelamin jantan juga
kelamin betina. Cestoda memiliki siklus hidup yang kompleks sebab
membutuhkan inang antara dalam siklus hidupnya. Ikan dapat menjadi inang
perantara kedua atau dapat pula menjadi inang definitif tergantung pada jenis
cestoda yang menyerang.
Jika ikan adalah inang perantara, larva akan menembus keluar dari sistem
pencernaan untuk pengembangan lebih lanjut dan menunggu sampai inang
tersebut (ikan) dimakan oleh inang berikutnya (inang definitif). Jika ikan adalah
inang definitif, cacing dewasa akan hidup dalam sistem pencernaan inang akhir
tanpa melakukannya banyak kerugian (Aquafarmer 2004). Kehadiran cacing
dewasa pada saluran cerna dapat menyebabkan penurunan berat badan dan perut
menjadi kurus (Afrianto dan Liviawaty 1992). Sebab cacing akan menyerap
nutrisi yang berada di usus ikan.
Menurut Noble dan Noble (1989) digenea merupakan cacing parasit yang
memiliki batil hisap berbentuk mangkuk dan lubang ekskretoris posterior. Batil
hisap digenea ada dua yaitu batil hisap anterior atau batil hisap mulut dan
asetabulum yang terletak di tengah tubuh cacing. Telur digenea yang menetas
menjadi larva bersilia (mirasidium) akan dimakan oleh inang perantara pertama
13 Setiap sporosist parasit aseksual menghasilkan banyak larva (rediae) yang pada
gilirannya menghasilkan larva infektif (serkaria) yang akan berenang
meninggalkan siput. Serkaria ini akan menginfeksi inang perantara kedua, encyst, dan menjadi metaserkaria. Jika menemukan inang yang tepat (inang definitif),
metasersaria akan berkembang menjadi cacing dewasa.
Digenea merupakan parasit permanen pada banyak ikan laut, ikan air tawar,
amfibi, reptil, mamalia dan burung. Tahap larva terjadi pada berbagai invertebrata
dan vertebrata. Digenea dapat berada di dalam usus, perut, atau mulut, atau
kadang-kadang paru-paru dan organ lainnya. Bentuk larva terjadi di hampir semua
14
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli sampai dengan Agustus 2010 di
laboratorium Helmintologi Bagian Parasitologi dan Entomologi Kesehatan,
Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas
Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah ikan maskoki,
akuades, NaCl fisiologis, Giemsa 10%, gliserol, etanol, xylol, dan pewarna
Acetocarmine. Alat-alat yang digunakan dalam penelitian ini adalah aquarium, timbangan, alas bedah berupa gabus yang dilapisi plastik berwarna hitam,
penggaris, tissue, gelas objek, gelas penutup, kertas label, botol plastik, alat bedah (gunting, pinset, dan skalpel), cawan petri, lemari pendingin bersuhu 4 ⁰C, pipet,
mikroskop stereo, mikroskop cahaya, video mikrometer, dan jarum.
Metode Penelitian
1. Isolasi Cacing
Penelitian ini diawali dengan melakukan pemilihan lokasi pengambilan
sampel ikan (di Pasar Anyar Bogor Tengah, di Batu Tulis Bogor Selatan dan
Baranang Siang Bogor Timur) yang dilakukan secara acak dengan jumlah 10 ekor
dari tiap lokasi. Ikan-ikan yang telah dipilih secara acak dimasukkan ke dalam
kantong plastik yang telah diberi air dan oksigen secukupnya lalu dibawa ke
laboratorium.
Sesampainya di laboratorium Helmintologi Fakultas Kedokteran Hewan
IPB, ikan dimasukkan ke dalam aquarium dan dibiarkan semalaman dengan
tujuan mengurangi stres. Keesokan harinya, satu demi satu ikan sampel ditimbang
berat badannya menggunakan timbangan digital dan diukur panjang tubuhnya.
Setelah diukur, ekor ikan digunting lalu dibuat ulas darah. Kemudian dibunuh
15 insang dan saluran pencernaan dipisahkan dari tubuh lalu dimasukkan ke dalam
cawan petri yang telah diisi NaCl Fisiologis. Cawan petri tersebut dimasukkan ke
dalam lemari pendingin bersuhu 4 ⁰C minimal selama 10 jam dengan tujuan agar
cacing tersebut dapat berelaksasi dan mengeluarkan kaitnya agar dapat terlepas
dari organ insang dan saluran pencernaan. Cacing yang telah diisolasi dari sampel
organ, dimasukkan ke dalam botol plastik berisi alkohol 70% dan ditambahkan 2
tetes gliserin dengan tujuan untuk mengurangi penguapan di dalam botol. Tahap
selanjutnya yaitu dilakukan proses pewarnaan terhadap cacing parasitik.
2. Pewarnaan darah
Pewarnaan darah ikan maskoki diawali dengan pembuatan preparat ulas
darah lalu dilanjutkan dengan pewarnaan Giemsa. Pembuatan preparat ulas darah
dilakukan dengan cara meneteskan darah pada gelas objek. Gelas objek kedua
diletakkan dengan sudut 45º di atas gelas objek pertama, kemudian digeser ke
belakang menyentuh darah sehingga darah menyebar. Gelas objek kedua
kemudian digeser ke arah yang berlawanan sehingga membentuk suatu lapisan
tipis darah. Preparat ulas darah dibiarkan kering. Setelah itu dilanjutkan dengan
proses fiksasi dengan cara merendam preparat di dalam larutan metanol selama 5
menit, kemudian dikeringkan. Preparat kemudian dimasukkan ke dalam larutan
Giemsa selama 30 menit setelah itu dicuci dan dikeringkan. Selanjutnya preparat
diamati di bawah mikroskop dengan pembesaran 1000x (dengan minyak imersi),
dan dilakukan penghitungan masing-masing jenis leukosit hingga mencapai
jumlah 100 sel leukosit (AMC 2008).
3. Pewarnaan Cacing
Spesimen cacing direndam dengan pewarnaan Acetocarmine selama 30 menit sampai 3 jam hingga spesimen berwarna merah cerah. Setelah perendaman,
spesimen dibilas dengan etanol 70% dan direndam dengan larutan asam alkohol
yang merupakan 99 bagian etanol 70% dan 1 bagian HCl selama 5-7 menit.
Kemudian spesimen tersebut direndam dengan etanol secara bertingkat yaitu
16 Larutan Acetocarmine diperoleh dari 100 ml aquades dicampur dengan 100 ml asam asetat glasial. Kemudian ditambahkan bubuk lithium carmine ke dalam larutan tersebut hingga menjadi jenuh. Selanjutnya larutan tersebut dipanaskan
pada suhu 900C selama 15 menit dan ditambahkan etanol 70% sebanyak 200 ml ke dalam larutan tersebut (Yamaguti 1958).
Spesimen cacing dibilas dengan etanol 70% dan direndam dengan larutan
asam alkohol yang merupakan 99 bagian etanol 70% dan 1 bagian HCl selama 5-7
menit hingga menjadi warna merah. Kemudian spesimen tersebut direndam
dengan etanol secara bertingkat yaitu etanol 70%, 85%, 95%, dan absolute selama 5 menit. Hal ini bertujuan untuk dehidratasi. Kemudian dilanjutkan dengan
clearing yang terdiri dari lactophenol dan xylol untuk membuat spesimen transparan dan di’mounting’ dengan Entellan. (Yamaguti 1958).
Analisis Data Tingkat Infeksi
Analisis data kecacingan dilakukan dengan penghitungan prevalensi
(pendugaan proporsi) dari cacing parasit di sampel dan menggunakan rumus
penghitungan statistik berupa jumlah ikan yang terinfeksi cacing parasitik dibagi
dengan jumlah ikan yang diperiksa lalu hasil pembagian tersebut dikalikan dengan
17
HASIL DAN PEMBAHASAN
Kondisi Pemeliharaan Ikan Maskoki (Carassius auratus)
Pengambilan sampel ikan maskoki dilakukan di tiga tempat berbeda di
daerah bogor, yaitu Pasar Anyar Bogor Tengah, Batu Tulis Bogor Selatan dan
Baranang Siang Bogor Timur. Dari ketiga lokasi pengambilan sampel ikan
maskoki tersebut diketahui bahwa ikan maskoki dipelihara pada kondisi yang
tidak berbeda jauh (Tabel 2). Namun ikan maskoki di Bogor Tengah ditempatkan
di satu akuarium tanpa diberi tanaman hias, sedangkan ikan maskoki di Bogor
Timur dan Bogor Selatan ditempatkan pada satu akuarium bersama ikan hias jenis
lain.
Tabel 2 Kondisi pemeliharaan ikan maskoki
No Parameter Bogor Tengah Bogor Selatan Bogor Timur 1.
Prevalensi Kecacingan Pada Ikan Maskoki
Tingkat prevalensi kecacingan pada ikan maskoki di Bogor disajikan pada
Tabel 3.
Tabel 3 Tingkat prevalensi kecacingan pada ikan maskoki (Carassius auratus) di Bogor
No. Lokasi Pengambilan Jumlah Ikan yang diperiksa
Ikan maskoki di Pasar Anyar Bogor Tengah, Batu Tulis Bogor Selatan dan
Baranang Siang Bogor Timur memiliki nilai prevalensi kecacingan sebesar 100%
di insang dan 0% di usus. Berdasarkan kategori yang dikembangkan oleh
Williams dan Williams (1996), tingkat prevalensi kecacingan pada insang ikan
18 tingkat prevalensi kecacingan pada usus ikan maskoki masuk kedalam kategori
infeksi almost never (<0.01).
Tingkat prevalensi kecacingan yang tinggi di insang mungkin dikarenakan
insang ikan bersentuhan langsung dengan lingkungan luar (air), sehingga
kemungkinan cacing parasit insang yang ada di lingkungan dapat menempel pada
insang. Nilai prevalensi ini dipengaruhi oleh beberapa faktor yaitu faktor intrinsik
dan faktor eksterinsik. Faktor intrinsik berupa kekebalan individu, jenis kelamin,
dan ukuran tubuh ikan. Sementara itu, faktor eksterinsik berupa kualitas air,
kualitas sanitasi kolam, dan populasi ikan yang terlalu padat (Noble & Noble
1989).
Identifikasi Cacing Parasitik pada Ikan Maskoki (Carassius auratus)
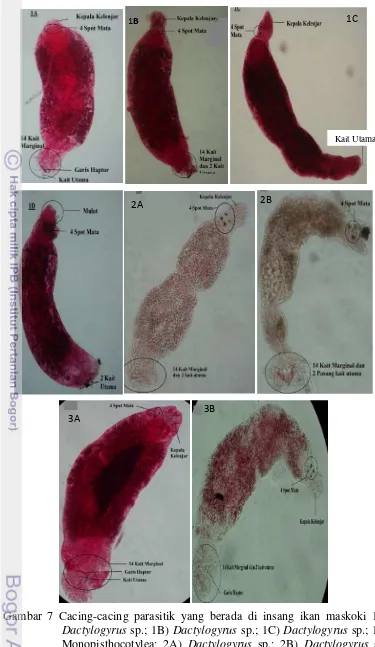
Hasil dari identifikasi cacing Parasitik Pada Ikan Maskoki adalah insang
ikan maskoki dari Pasar Anyar Bogor Tengah terinfeksi oleh cacing parasitik dari
kelas Monogenea yaitu Dactylogyrus sp. (gambar 1A, 1B, 1C) dan cacing dari subkelas Monophytochotylea (1D). Sedangkan insang ikan maskoki dari Batu
Tulis Bogor Selatan dan Baranang Siang Bogor Timur terinfeksi oleh
Dacytylogyrus sp. (gambar 2A dan 2B untuk Batu Tulis Bogor Selatan, Gambar 3A dan 3B untuk Baranang Siang Bogor Timur).
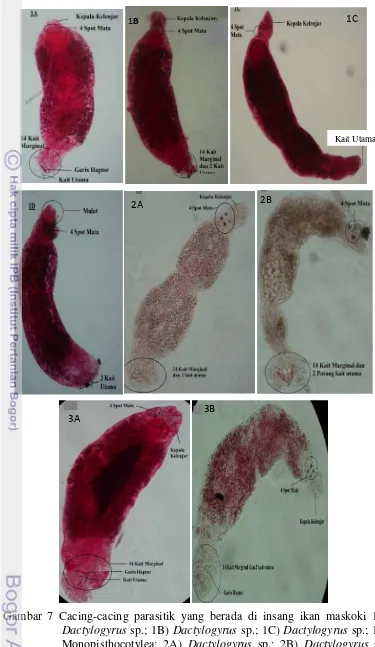
Cacing cacing parasit (Cacing gambar 1A, 1B,1C, 2A, 3A, 3B)
teridentifikasi sebagai Dacytylogyrus sp. karena memiliki seperti kepala kelenjar, 2 pasang spot mata, garis haptor, 1-2 pasang kait utama dan beberapa pasang
jangkar (kait marginal) di bagian opishaptor seperti Dacytylogyrus sp. pada umumnya. Cacing parasitik (Gambar 2B) awalnya sulit teridentifikasi dikarenakan
bagian anterior cacing tersebut terlipat. Namun, adanya dua pasang kait, dua
pasang spot mata, dan bagian anterior yang diperkirakan memiliki kepala kelenjar
menyebabkan cacing ini teridentifikasi sebagai Dactylogyrus sp.. Cacing-cacing yang ditemukan memiliki bentuk anterior dan posterior yang mirip satu sama lain
yang membedakan adalah bentuk kait, ukuran panjang dan lebar tubuh. Hal
tersebut mungkin dikarenakan cacing-cacing yang ditemukan merupakan spesies
yang berbeda. Identifikasi cacing parasit belum dapat dilakukan hingga tingkat
19 Gambar 7 Cacing-cacing parasitik yang berada di insang ikan maskoki 1A)
Dactylogyrus sp.; 1B) Dactylogyrus sp.; 1C) Dactylogyrus sp.; 1D) Monopisthocotylea; 2A) Dactylogyrus sp.; 2B) Dactylogyrus sp.; 3A) Dactylogyrus sp.; 3B) Dactylogyrus sp..
1C
2A
Kait Utama 1B
2B
3A
20 Cacing pada gambar 1D memiliki haptor serta kait pada bagian ujung
posterior tubuh seperti pada cacing-cacing pada kelas monogenea. Cacing tersebut
juga memiliki satu pasang kait dan 2 pasang spot mata seperti cacing dari genus
Dactylogyrus namun karena bentuk mulut penghisap yang berbeda menyebabkan cacing ini tidak dapat digolongkan ke dalam genus Dactylogyrus. Walaupun begitu, cacing parasitik ini (Gambar 1D) masih masuk ke dalam subkelas
Monopisthocotylea karena memiliki posisi mulut di ventral.
Infeksi yang berat dari Monogenea baik itu Dactylogyrus sp. maupun cacing dari subkelas Monophytochotylea dapat menyebabkan hiperplasia epitel,
hancurnya epitel insang dan hipersekresi lendir yang menyebabkan terganggunya
pertukaran oksigen sehingga menyebabkan terjadinya kematian karena sesak
nafas. Selain itu, keberadaan parasit Monogenea juga dapat meyebabkan
terjadinya lesi sekunder oleh jamur, bakteri, dan mikroorganisme lain. Infestasi
yang berat biasanya disebabkan oleh sanitasi yang buruk, kualitas air yang buruk,
atau aliran air yang tidak memadai. Walaupun demikian, cacing parasit
Monogenea trematoda tidak bersifat zoonosis (Kent dan Fournie 2007).
Dactylogyrus sp. merupakan cacing parasit yang melekat pada insang ikan air tawar. Cacing parasit tersebut dapat menyerang insang dari ikan maskoki, ikan
mas, Fundulus grandis, dan spesies lainnya. Ikan yang terinfeksi dalam jumlah besar dapat menunjukkan tanda-tanda klinis berupa gerakan pernapasan yang
cepat, menjadi lesu, berenang di dekat permukaan, dan menolak makanan. Infeksi
oleh Dactylogyrus sp. dengan jumlah cacing parasit yang tinggi akan mempengaruhi kesehatan ikan dan dapat menyebabkan kematian (Kent dan
Fournie 2007). Keadaan tersebut menyebabkan gangguan contohnya kerugian
pada budidaya ikan.
Jumlah Cacing Parasitik pada Ikan Maskoki (Carassius auratus)
Jumlah cacing parasitik pada ikan maskoki dari Pasar Anyar Bogor tengah,
Batu Tulis Bogor Selatan dan Baranang Siang Bogor Timur dapat diamati pada
21 Tabel 4 Jumlah cacing pada ikan di Bogor
No Lokasi Berat Badan
Tabel 4 menunjukkan bahwa ikan maskoki yang berasal dari Bogor Tengah
memiliki ukuran tubuh yang paling besar dan memiliki rata-rata jumlah cacing
paling banyak jika dibandingkan dengan ikan sampel dari Bogor Selatan dan
Bogor Timur. Menurut Ozer dan Ozturk (2005), ikan berukuran besar memiliki
jumlah parasit yang lebih banyak. Ukuran tubuh yang besar akan memberikan
area permukaan insang yang lebih luas untuk parasit, peningkatan aliran air yang
lebih tinggi dan ketersediaan makanan yang lebih banyak.
Keberadaan cacing parasit di ikan juga bergantung pada tingkat stres dan
imunitas dari tiap individu ikan. Timbulnya stres akan mempengaruhi kemampuan
ikan untuk secara efektif melindungi diri terhadap infeksi parasit. Imunitas ikan
yang rendah akan menyebabkan ikan dapat terinfeksi parasit dalam jumlah
banyak. Selain stres dan imunitas, faktor intrinsik seperti umur ikan juga akan
mempengaruhi kecacingan. Menurut Noble dan Noble (1989), semakin tua inang
akan semakin resisten. Inang yang lebih tua dapat mengandung jumlah parasit
yang lebih besar. Ikan muda memiliki respon antibodi yang lebih lambat karena
imunitas bawaan pada hewan muda belum cukup untuk menghadapi ektoparasit
yang ada di lingkungan karena belum cukup berkembang (Abdulghani et al 2009). Menurut Reed et al. (2009) salah satu pencegahan yang efektif untuk menghilangkan parasit patogen pada ekspor dan impor ikan hidup adalah dengan
dilakukannya karantina. Saat karantina, perlu dilakukan biopsi pada ikan hidup
tersebut untuk mengidentifikasi cacing parasit. Untuk mengurangi atau
meminimalkan jumlah cacing parasitik monogenea pada ikan air tawar, ikan dapat
dimasukkan ke dalam air garam selama 30 menit. Perlakuan tersebut akan
menyebabkan pengurangan jumlah parasit bahkan kematian parasit karena
ketidakmampuan parasit dalam mentoleransi salinitas. Dengan adanya adaptasi
22
Sel Leukosit Ikan Maskoki (Carassius auratus)
Leukosit pada ikan maskoki terdiri dari sel limfosit, sel neutrofil, sel
eosinofil, sel monosit, dan sel basofil. Pengamatan terhadap diferensial sel
leukosit dilakukan untuk mengetahui komposisi dari leukosit.
Tabel 5 Diferensial Leukosit ikan maskoki
No Diferensial
Leukosit Normal Ikan Maskoki
(%) Watson
Menurut Loewenthal (Loewenthal 1930, diacu dalam Stoskopf 1993),
persentase leukosit normal ikan maskoki berupa 10.5% neutrofil, 0.5% basofil,
73% Limfosit, 8.6% monosit dan 8% eosinofil. Menurut Watson (Watson 1930,
diacu dalam Stoskopf 1993), ikan maskoki memiliki kisaran leukosit normal
berupa 5% neutrofil, 0.2% basofil, 92% limfosit dan 2% eosinofil. Sedangkan
menurut Lewbart (2006) ikan maskoki memiliki 29% neutrofil, nilai limfosit
sebesar 70% dan nilai monosit sebesar 1%.
Jumlah sel limfosit sampel ikan maskoki dari Bogor Tengah sebesar 31.7%,
49.5% untuk sampel ikan dari Bogor Selatan, dan 34.9% untuk sampel ikan dari
Bogor Timur. Persentase tersebut dinilai jauh lebih rendah dari persetase sel
limfosit ikan maskoki normal baik menurut Loewenthal (Loewenthal 1930, diacu
dalam Stoskopf 1993) yaitu 73%, Watson (Watson 1930, diacu dalam Stoskopf
1993) yaitu 92%, dan menurut Lewbart (2006) yaitu 70%. Ikan maskoki dari
Bogor Tengah memiliki jumlah sel eosinofil sebesar 24.9%, ikan dari Bogor
Selatan memiliki jumlah sel eosinofil 20.2%, dan ikan dari Bogor Timur memiliki
jumlah sel eosinofil sebesar 23.6%. Jumlah sel eosinofil tersebut lebih tinggi jika
23 Jumlah sel neutrofil ikan maskoki dari Bogor Tengah sebesar 32.5%, 23.1%
untuk ikan dari Bogor Selatan, dan 36.5% untuk ikan dari Bogor Timur.
Persentase tersebut dinilai lebih tinggi dari persetase sel neutrofil ikan maskoki
normal menurut Loewenthal (Loewenthal 1930, diacu dalam Stoskopf 1993)
yaitu 10.5% dan menurut Watson (Watson 1930, diacu dalam Stoskopf 1993)
yaitu 5%.
Ikan maskoki dari Bogor Tengah memiliki 10% sel monosit, ikan dari
Bogor Selatan memiliki jumlah sel monosit 4.4%, dan ikan dari Bogor Timur
memiliki jumlah sel monosit sebesar 5%. Dari hasil penelitian didapatkan 0%
untuk semua sel basofil baik dari ikan maskoki Bogor Tegah, Bogor Selatan
maupun Bogor Timur. Menurut Hrubec dan Smith (2010). Kehadiran sel basofil
jarang dilaporkan. Hal ini dikarenakan jumlah sel basofil yang rendah atau
dikarenakan morfologi sel basofil yang tidak terawetkan dengan baik pada
preparat yang difiksasi dengan alkohol. Identifikasi sel basofil paling baik dengan
menggunakan acid toluidine blue stain.
Jika dibandingkan antara hasil penelitian dengan diferensial sel leukosit
normal menurut Loewenthal (Loewenthal 1930, diacu dalam Stoskopf 1993) serta
Watson (Watson 1930, diacu dalam Stoskopf 1993) dan Lewbart (2006)
ditemukan bahwa diferensial sel leukosit sampel ikan mengalami peningkatan sel
eosinofil dan peningkatan sel neutrofil. Hal tersebut dapat dikarenakan ikan
maskoki terinfestasi cacing parasit (Tabel 3).
Kecacingan dapat memberikan pengaruh pada leukosit berupa peningkatan
persentase sel eosinofil. Kecacingan juga dapat menyebabkan stres yang akan
meningkatkan persentase sel neutrofil serta akan menurunkan persentase sel
limfosit dari kisaran normal. Hal tersebut sejalan dengan apa yang diungkapkan
oleh Martins et al. (2004) bahwa infestasi cacing parasitik dapat menyebabkan terjadinya neutrofilia dan eosinofilia pada ikan yang terinfeksi.
Kehadiran cacing parasit dapat menyebabkan kerusakan pada lamela insang
dan menimbulkan stres. Menurut Menurut Hrubec dan Smith (2010), stres dan
inflamasi dapat menyebabkan peningkatan jumlah sel neutrofil. Hal ini mungkin
didukung oleh fungsi sel neutrofil sebagai pertahanan pertama tubuh terhadap
24 bahan mikrobisidal untuk membunuh parasit yang terlalu besar untuk dimakan.
Banyak juga cacing yang memiliki lapisan permukaan yang tebal sehinga resisten
terhadap mekanisme sitosidal neutrofil dan makrofag (Baratawidjaja 2006). Hal
tersebut diantisipasi tubuh dengan memunculkan sel eosinofil sebagai pertahanan
tubuh spesifik terhadap kecacingan.
Cacing dapat merangsang produksi antibodi nonspesifik. Selanjutnya
eosinofil diaktifkan dan mensekresikan granul enzim yang menghancurkan
parasit. sel Eosinofil lebih efektif dibandingkan leukosit lain karena sel eosinofil
memiliki granul yang lebih toksik jika dibandingkan dengan enzim proteoilitik
25
SIMPULAN DAN SARAN
Simpulan
Sampel ikan maskoki yang diperiksa positif mengalami kecacingan pada
insang dengan nilai prevalensi kecacingan yaitu 100%. Tingkat infestasi parasit
cacing di usus ikan maskoki adalah 0%. Jenis cacing parasitik yang menyerang
insang berasal dari subkelas monogenea berupa Dactylogyrus sp. dan cacing dari subkelas Monopisthocotylea. Hasil perhitungan leukosit menunjukkan bahwa telah terjadi peningkatan jumlah sel eosinofil dan sel neutrofil yang disebabkan
oleh adanya infeksi cacing parasit.
Saran
1. Pembudidayaan ikan maskoki perlu dilakukan dalam lingkungan yang
terjaga kebersihan lingkungan pemeliharaannya. Hal tersebut dilakukan
agar terhindar dari cacing parasit yang dapat mengganggu kesehatan dari
ikan maskoki.
2. Perlu dilakukan penelitian lebih lanjut untuk mengetahui hubungan
kepadatan populasi ikan maskoki terhadap infeksi cacing parasitik.
3. Perlu dilakukan penelitian lebih lanjut untuk mengetahui pengaruh
lingkungan pemeliharaan seperti kualitas air, jenis makanan terhadap
26
DAFTAR PUSTAKA
Abdulghani N, Nurhayati APD, Nugraha MA. 2009. Derajat infeksi Argulus sp.
Pada ikan maskoki (Carassius auratus) di desa Bangoan kecamatan Kedungwaru kabupaten Tulungagung. BSS 1:1-8.
Abdullah SMA. 2009. Additional Records of Dactylogyrus (Monogenea) from Some Cyprinid Fishes From Darbandikhan Lake Iraq. Jordan Journal of Biological Sciences 2:145-150.
Afrianto E, Liviawaty E. 1992. Pengendalian Hama dan Penyakit Ikan. Yogyakarta: Penerbit Kanisius.
[AMC] Aqualex Multimedia Consortium. 2008. Basic Techniques in Fish Haematology. [terhubung berkala]
Anshary H. 2008. Tingkat infeksi parasit pada ikan mas koi (Cyprinus carpio) pada beberapa lokasi budidaya ikan hias di Makassar dan Gowa (Parasitic Infections Of Koi Carp Cultured In Makassar And Gowa). K. Sains & Teknologi 8:139-147.
Aquafarmer. 2004. Tapeworms (Cestoda). [Terhubung berkala] http://www.holar. is/ ~aquafarmer/node1. html [13 Oktober 2011]
Bachtiar Y, Tim Lentera. 2002. Mencegah Maskoki Mudah Mati. Jakarta: Agromedia Pustaka.
Baratawidjaja KG. 2006. Imonologi Dasar Edisi Ke-7. Jakarta: Fakultas Kedokteran Universitas Indonesia.
Brooker C. 2005. Churchill Livingstone’s Mini Encyclopaedia Of Nursing 1st
edition. Elsevier Ltd: Singapura.
Campbell NAReece JB, MitchellLG. 2004. Biologi Jilid 3 EdisiKelima. Jakarta: Erlangga.
David G. 2010a. Dactylogyrus. Fauna europaea versi 2.4 . [terhubung berkala]
David G. 2010b. Gyrodactilus. Fauna europaea versi 2.4. [terhubung berkala]
FAO. 1991. Diagnostics, Prevention And Therapy Of Fish Diseases And Intoxications. [Terhubung berkala]. http://www.fao.org/docrep/field/
003/AC160E/AC160E03.htm [14 Mei 2011].
27 Gao Z et al. 2007. Haematological characterization of loach Misgurnus
anguillicaudatus: Comparison among diploid, triploid and tetraploid specimens. Elsevier 147:1001–1008.
Gusrina. 2008. Budidaya Ikan Jilid 3. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan Direktorat Jenderal Manajemen Pendidikan Dasar dan Menengah Departemen Pendidikan Nasional.
Hrubec TC, Smith SA. 2010. Hematology of Fishes. Di dalam: Weiss DJ dan Wardrop KJ, editor. Schalm’s Veterinary Hematology Sixth Edition: Hematology of fishes. Singapure: Wiley-Blackwell. Hlm 994-1003.
Iskandar, SitanggangM. 2003. Memilih dan merawat Maskoki Impor Berkualitas. Jakarta: Agromedia Pustaka.
Kent ML, Fournie JW. 2007. Parasites of fishes. Di dalam Baker ED, editor:
Flynn’s Parasites Of Laboratory Animals. Ed ke-2. State avenue: Blackwell publishing.
Khanna DR, Yadav PR. 2004. Biology of Fishes. New delhi: Discovery Publishing House.
Klinger RE, Floyd RF. 2009. Introduction to Freshwater Fish Parasites 1.
University of Florida IFAS Extension; CIR716.
Lasee B. 2004. Parasitology Capter 8 on Laboratory NWFHS Procedures Manual. Ediki ke-2. [terhubung berkala]
Levine ND. 1990. Buku Ajar Protozoologi Verteriner. Ashadi G, Penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Textbook of Veterinary Parasitology.
[Marine Biological Laboratory]. 2003. Universal Biological Indexer and Organizer. [terhubung berkala] Mei 2011].
Martins ML, Dias MT, Fujimoto RY, Onaka EM, Nomura DT. 2004. Hematological alteration of Leporinus macrocephalus (Osteichtyes: Anostomidae) naturally infected by Goezia leporini (Nematoda: Anisakidae) in fish pond. Arq. Bras Med Vet Zootec 56(5):640-646.
Natadisastra D, Agoes R. 2005. Parasitologi kedokteran. EGC: Jakarta
28 Ozer A, Ozturk T. 2005. Dactylogyrus cornu Linstow, 1878 (Monogenea)
infestations on Vimba (Vimba vimba tenella (Nordmann, 1840)) caught in the sinop region of Turkey in relation to the host factors. Turk J Vet Anim Sci 29:1119-1123.
Prayitno BI. 2002. Peran Budidaya Perairan Khususnya Penanganan Penyakit Ikan dalam Pengelolaan Sumber Perikanan.[terhubung berkala]. http//www.eprints.undip.ac.id/287/1/S._Budi_Prayitno.pdf. [9 Feb 2011].
Reed P, Floyd RF, Klinger R. 2009. Monogenean Parasites of Fish. University of Florida IFAS Extension; FA28.
Sarbahi DS. 1951. Studies Of The Digestive Tracts And The Digestive Enzymes Of The Goldfish, Carassius Auratus (Linnaeus) And The Largemouth Black Bass, Micropterus Salmoides (Lacepede). Biological Bulletin 100:224-257
Sarkar S. 2010. Oranda Fancy Goldfish. [terhubung berkala]
Stoskopf MK. 1993. Fish Medicinal. Philadelphia:W.B. Saunders Company.
Street, R. 2002. Carassius auratus, Animal Diversity Web. [terhubung berkala]
V´azquez GR, Guerrero GA. 2007. Characterization of blood cells and hematological parameters in Cichlasoma dimerus (Teleostei, Perciformes).
Elsevier 39:151–160.
Watson A, Craig H, Pouder EJ, Debora B. 2004. Species Profile: Koi and Goldfish. SRAC Publication; 7201.
Wiliams LB, Wiliams EH. 1994. Parasites of Puerto Rican Freswater Sport Fishes. Antillean College Press: Mayaguez.
Williams EH, Williams LB. 1996. Parasites Of Offshore Big Game Fishes Of Puerto Rico And The Western Atlantic. Mayaguez: Antillean College Press.
Yamaguti S. 1958. Systema Helminthum. Volume ke-1: Protozoa and Metazoan Infections Second Edition. Canada.
1
PENDAHULUAN
Latar Belakang
Ikan hias air tawar merupakan salah satu komoditas perikanan Indonesia
yang mempunyai peluang besar untuk menghasilkan devisa negara di sektor non
migas. Ikan hias air tawar memiliki keindahan yang menjadi daya tarik tersendiri
bagi penghobi maupun untuk pembudidaya ikan hias. Salah satu jenis ikan hias air
tawar yang populer adalah ikan maskoki (Carassius auratus). Ikan ini memiliki kemampuan yang cukup adaptif terhadap kondisi lingkungan. Namun di dalam
pemeliharaannya, ikan maskoki tetap tidak lepas dari masalah kesehatan seperti
terserang penyakit.
Penyakit dapat disebabkan oleh berbagai agen. Menurut Gusrina (2008), ada
dua jenis agen yang dapat menyebabkan terjadinya penyakit yaitu agen patogen
dan agen non patogen. Kehadiran agen patogen dapat mempengaruhi pemilik ikan
dan individu ikan itu sendiri. Penyakit pada ikan menyebabkan penurunan kualitas
ikan, kematian ikan, kerugian materiil, kegagalan budidaya, dan dapat berujung
pada bangkrutnya usaha (Prayitno 2002). Kehadiran agen patogen tertentu dalam
tubuh inang dapat menyebabkan timbulnya kerusakan, stres bahkan kematian.
Menurut Gusrina (2008), contoh agen non patogen berupa keracunan dan
kekurangan gizi, sedangkan contoh agen patogen berupa virus, bakteri, dan cacing
parasit.
Ikan maskoki merupakan anggota dari famili Cyprinidae. Menurut Anshary
(2008), ikan dari famili tersebut termasuk jenis ikan yang paling rentan terhadap
berbagai infeksi parasit. Kehadiran cacing parasit menyebabkan adanya respon
pada tubuh, salah satunya berupa perubahan gambaran leukosit ikan.
Tujuan
Penelitian ini dilakukan untuk mengidentifikasi cacing parasitik pada ikan
maskoki dan untuk melihat pengaruh kecacingan terhadap gambaran leukosit pada
2
Manfaat Penelitian
Hasil penelitian ini diharapkan mampu memberikan informasi mengenai
jenis cacing parasitik yang menyerang insang dan saluran pencernaan ikan
3
TINJAUAN PUSTAKA
Ikan Maskoki (Carassius auratus)
Ikan Maskoki (Carassius auratus) pertama kali dibudidayakan oleh masyarakat Cina pada tahun 960-1729. Awalnya bentuk ikan maskoki seperti ikan
Mas (Cyprinus carpio L), bedanya ikan maskoki tidak memiliki sepasang sungut di mulutnya
popularitas ikan maskoki mulai menanjak. Di sinilah bermunculan ikan maskoki
dengan bentuk tubuh yang bervariasi dan unik. Perkembangan ikan maskoki
kemudian merambah hingga ke negeri Jepang.
Di negeri matahari terbit ikan maskoki terus mengalami perkembangan
pesat sehingga menghasilkan bentuk yang lebih bervariatif seperti saat ini. Dari
negeri Sakura, ikan maskoki mulai menyebar ke seluruh dunia, termasuk
Indonesia
besar agak menonjol ke luar dan warna sisik yang menarik. Ikan maskoki
tergolong mudah dipelihara karena sifatnya cukup adaptif terhadap lingkungan
yang baru. Tak mengherankan jika ikan maskoki dengan berbagai varietasnya
tersebar di seluruh dunia
Ikan maskoki masuk ke dalam Kingdom Animalia, Subkingdom Eumetazoa,
Filum Chordata, Subfilum Vertebrata, Infrafilum Gnathostomata, Kelas
Actinopterygii, Subkelas Neopterygii, Superordo Teleostei, Ordo Clupeiformes,
Family Cyprinidae, Genus Carassius dan Spesiesnya berupa Carassius auratus
(Freyhof 2004).
Salah satu jenis ikan maskoki yang populer adalah Ikan maskoki varietas
Oranda (Spencer). Ikan ini memiliki keunikan yang terletak pada kepalanya yang
berjambul dan memiliki sirip punggung (Iskandar dan Sitanggang 2003), hal
tersebut dapat diamati pada Gambar 1.
Ikan maskoki merupakan ikan hias air tawar yang hidup di perairan dengan
air yang mengalir tenang serta berudara sejuk
hewan omnivora (Watson et al 2004) dan bukan hewan kanibal sehingga dapat dipelihara secara koloni dalam satu lingkungan pemeliharaan (Iskandar dan
4 Suhu optimal air untuk hidup ikan maskoki adalah 18-24ºC.
Mempertahankan suhu untuk terus berada dalam kisaran suhu optimal perlu
dilakukan. Karena pemeliharaan di luar suhu optimal dapat menekan sistem
kekebalan tubuh ikan dan akan menyebabkan penurunan nafsu makan serta
gangguan pada pertumbuhan ikan. Ikan maskoki dapat hidup dalam air yang
memiliki kandungan oksigen minimal 5 mg/L, pH 7-7.8, tingkat amoniak terlarut
maksimal 0,05 mg/L dan tingkat nitrit terlarut maksimal 0,05 mg/L (Watson et al
2004).
Ikan maskoki dianggap sebagai ikan yang tangguh karena dapat bertahan
hidup di air berkualitas buruk. Walaupun demikian, kualitas air penting di
perhatikan agar pertumbuhan, reproduksi dan kesehatan ikan berjalan optimal
(Watson et al 2004). Ikan maskoki dapat hidup hingga umur 30 tahun dengan panjang mencapai 23 inches (58 cm) dan berat mencapai 2,7 kg .
Ikan maskoki memiliki organ interna dan eksterna yang keseluruhan organ
tersebut memiliki ciri dan fungsi tertentu untuk mendukung kelangsungan hidup
ikan (Yanong 2003). Insang merupakan salah satu organ interna ikan maskoki
yang memiliki peranan penting bagi kelangsungan hidup ikan. Peranan penting
tersebut adalah sebagai media pertukaran gas (Campbell et al 2004). Insang terdiri dari lamela insang primer, lamela insang sekunder dan tulang rawan insang.
Lamela primer adalah lamela yang bersentuhan langsung dengan tulang rawan
insang dan lamela sekunder merupakan percabangan dari lamela primer (Yanong
2003).
Insang akan mengoptimalkan ekstraksi oksigen dari air dan merupakan
5 keluar diantara celah insang lewat gerakan terkoordinasi dari rahang dan
operculum (penutup insang), agar terjadi ventilasi. Ventilasi yang dimaksudkan berupa aktivitas inhalasi dan ekshalasi atau proses mengambil oksigen dan
melepaskan karbon dioksida lewat pernafasan. Ketika ventilasi terjadi, darah
mengalir dengan arah yang berlawanan dengan aliran air yang mengalir, oksigen
akan masuk ke dalam aliran darah dan CO2 akan dibuang ke air (Campbell et al 2004).
Usus merupakan salah satu organ interna ikan yang mengambil peranan
dalam sistem pencernaan. Usus berbentuk seperti tabung memanjang yang
melingkar-lingkar dan mengisi sebagian besar rongga abdomen. Makanan yang
ditangkap oleh mulut akan masuk ke dalam rongga mulut, melewati faring,
esofagus, bola usus (intestinal bulb), usus kemudian sisa makanan yang tidak diserap akan dikeluarkan lewat anus (Sarbahi 1951).
6 Bola usus merupakan kantung hasil pembengkakan anterior usus yang
berfungsi untuk menyimpan makanan. Bola usus tidak memiliki kelenjar lambung
dan memiliki mukosa yang mirip dengan mukosa usus (Khanna dan Yadav 2004).
Usus ikan maskoki sendiri terbagi atas usus depan, usus belakang dan rektum.
Perbedaan antara usus depan, usus belakang, dan rektum terletak pada pola lipatan
dari membran mukosa. Usus depan memiliki pola lipatan berupa garis dan sudut
sedangkan usus belakang memiliki pola lipatan berupa garis yang berbelit-belit.
Pola lipatan rektum ikan maskoki berupa pola miring melintang (Sarbahi 1951).
Darah Ikan Maskoki
Seperti pada mamalia, ikan memiliki komponen darah berupa sel darah
merah atau eritrosit dan sel darah putih atau leukosit. Setiap spesies pada hewan,
baik itu mamalia, reptil maupun ikan memiliki kisaran nilai parameter hematologi
yang berbeda. Gambaran leukosit normal pada ikan maskoki dapat terlihat pada
Tabel 1.
Tabel 1 Gambaran leukosit normal ikan maskoki
No Diferensial leukosit (%)
Leukosit Normal Ikan Maskoki
Watson (1963) Loventhal (1930) Lewbart (2006)
1. Limfosit 92 73 70
Limfosit merupakan sel leukosit berbentuk bulat, tidak teratur dengan inti
yang besar (Gao et al. 2007). Limfosit merupakan sel leukosit yang paling umum ada dalam darah ikan, berupa 85% dari seluruh total populasi sel leukosit
(V´azquez dan Guererro 2007). Limfosit berfungsi memediasi respon imun
humoral dan respon imun seluler. Ketika sel limfosit berkontak dengan bahan
asing (antigen), akan terjadi proliferasi sel limfosit yang kemudian akan
menyebabkan dikeluarkannya antibodi imunoglobulin oleh sistem imun. Respon
imun humoral merupakan respon kekebalan tubuh yang dimediasi oleh antibodi
7 Monosit merupakan sel-sel besar dengan nukleus besar dan sitoplasmanya
berisi granul-granul kecil yang tersebar. Monosit berfungsi dengan menanggapi
infeksi dan merupakan prekursor dari makrofag. Hal ini menyebabkan sel
monosit memainkan peran penting dalam imunitas non spesifik dan respon
inflamasi (AMC 2008).
Eosinofil, neutrofil dan basofil pada ikan termasuk dalam granulosit leukosit
atau sel leukosit yang memiliki granul-granul (V´azquez dan Guererro 2007).
Granulosit terlibat dalam mekanisme pertahanan non-spesifik, yaitu mereka
menanggapi adanya bahan asing dalam tubuh tetapi tidak mengenali antigen
tertentu. Sel-sel ini bermigrasi ke bagian tubuh di mana invasi terjadi dan
menghancurkan partikel asing dengan fagositosis atau dengan membunuh
langsung yang dikenal sebagai respon sitotoksik (AMC 2008).
.
Gambar 3. Gambaran sel darah Putih ikan: A) l adalah Limfosit; B) m adalah Monosit; C) eo adalah Eosinofil; D) Neutrofil; E) eosinofil (V´azquez dan Guererro 2007); F) Monosit; G) Limfosit (Gao et al. 2007).
Pada ikan sehat, yang paling umum ditemukan diantara ketiga granulosit
tersebut adalah sel neutrofil dan granulosit leukosit yang sangat jarang ditemukan
adalah sel basofil (V´azquez dan Guererro 2007). Neutrofil umumnya memiliki
8 berbentuk elips tidak teratur. Memiliki inti yang dapat diamati seperti berbentuk
pita, bentuk tapal kuda, membentuk segmen terhadap sumbu dan tidak simetris.
Eosinofil merupakan sel darah putih khusus (leukosit PMN) yang dapat
diwarnai dengan pewarna asam seperti eosin, namun sel eosinofil dapat pula di
identifikasi dengan pewarnaan sederhana seperti pewarnaan giemsa (AMC 2008).
Eosinofil memiliki sitoplasma yang besar berbentuk bola dengan granul-granul
yang hampir menutupi. Inti sel eosinofil biasanya berbentuk bulat, kadang
berbentuk seperti ginjal atau tapal kuda tetapi lebih teratur (Gao et al. 2007). Sel-sel ini terlibat dalam penghancuran parasit internal dan dalam modulasi inflamasi
reaksi alergi (AMC 2008).
Cacing Parasitik Pada Insang dan Usus
Ikan Cyprinidae termasuk jenis ikan yang paling rentan terhadap berbagai
infeksi parasitik (Anshary 2008). Menurut FAO (1991), Metazoa yang bersifat
parasit seperti cacing parasit pada kelas tertentu (monogenea, cestoda dan
digenea) merupakan agen-agen yang memegang peranan pada penyakit ikan.
Monogenea merupakan salah satu kelas dari hewan yang tak bertulang
belakang yang termasuk dalam phylum Platyhelminthes. Monogenea memiliki arti
sebagai dilahirkan sekali, hal ini mengacu pada siklus hidupnya yang sederhana
(Williams dan Williams 1994) dan tanpa inang perantara (Lasee 2004). Pada
infeksi yang berat, cacing dari kelas monogenea dapat membunuh ikan yang
menjadi inangnya. Umumnya monogenea memiliki bentuk tubuh panjang dan
transparan (Williams dan Williams 1994).
Monogenea memiliki organ lampiran berbeda pada bagian belakang tubuh
mereka (haptor) yang dilengkapi dengan kait atau klem khusus. Kait atau klem
khusus ini dapat dipakai untuk menusuk epitel dan berpegangan pada inang.
Sebagian besar monogenea berkembang biak dengan meletakkan telur yang
menetaskan larva bersilia (onchomiracidia) dan cepat menjadi dewasa dan
melekat pada inang (William dan William 1994).
Ikan air tawar yang terserang monogenea akan terlihat lesu, berenang di
dekat permukaan, mencari sisi kolam dan nafsu makan menjadi menurun. Insang
9 toleran terhadap oksigen yang rendah. Infeksi monogenea yang parah pada kulit
dan insang dapat menyebabkan kerusakan hebat bahkan kematian. Investasi
monogenea yang besar juga akan memicu terjadinya infeksi sekunder oleh bakteri
dan jamur (Klinger dan Floyd 2009). Monogenea memiliki dua sub kelas yaitu
Monopisthocotylea dan Polyopisthocotylea.
Monopisthocotylea merupakan salah satu subkelas dari monogenea. Cacing
dari subkelas Monopisthocotylea memiliki organ tubuh sederhana dan biasanya
satu haptor dengan 1-2 jangkar dengan lingkaran yang interkoneksi. Umumnya
parasit cacing dari subkelas ini memiliki ukuran yang jauh lebih kecil daripada
cacing dari subkelas Polyopisthocotylea. Parasit ini dapat ditemukan di kerokan
permukaan kulit atau di insang yang diamati dengan menggunakan mikroskop
(Wiliams dan Wiliams 1994).
Pada infeksi cacing yang berat, kait cacing dapat menyebabkan iritasi pada
kulit dan insang serta meningkatkan produksi lendir. Kulit mungkin memiliki
bercak putih terutama di belakang sirip. Ikan akan menunjukkan kebiasaan berupa
menggosokkan tubuh mereka pada sisi kolam dan berenang dengan terlalu liar
atau dengan lesu (Wiliams dan Wiliams 1994). Monopisthocotylea memiliki tiga
ordo yaitu Capsalidea, Dactylogridea dan Gyrodactylidea (David 2010a), namun
Monopisthocotylea yang menyerang insang ikan air tawar biasanya berasal dari
ordo Dactylogridea dan Gyrodactylidea (Wiliams dan Wiliams 1994).
Cacing parasitik pada Gambar 4 masuk ke dalam genus Gyrodactylus,
Famili Gyrodactylidae, Ordo Gyrodactylidea, Sub Kelas
Kelas Monogenea, Subphylum
Subkingdom Gyrodactylus
merupakan salah satu genus cacing parasit yang menginfeksi insang dari ikan air
tawar. Cacing ini memiliki embrio yang sedang berkembang yang dapat terlihat di
10 Gambar 4. Gyrodactylus sp. memiliki kait yang terletak pada embrio (E). The episthaptor (O) mengandung banyak kait dan jangkar. Perbesaran -- 100/xm (Yanong 2003).
Strategi reproduksi ini memungkinkan populasi Gyrodactylus dapat menjadi banyak dengan cepat, terutama pemeliharaan di dalam sistem tertutup. (Klinger
dan Floyd 2009). Gyrodactylus dewasa memiliki Ophisthaptor yang tidak mengandung batil isap, tetapi memiliki sederet kait-kait kecil berjumlah 16 buah
di sepanjang tepinya dan sepanjang kait besar di tengah-tengah (Gusrina 2008).
Dactylogyrus (Gambar 5) masuk dalam genus Dactylogyrus, Famili Dactylogyridae, Subordo Dactylogyrinea, Ordo Dactylogyridea, Subkelas
Monopisthocotylea, Kelas Monogenea, Subphylum Neodermata, Phylum
Platyhelminthes, Subkingdom Eumetazoa dan Kingdom Animalia (David 2010a).
Gambar 5. Dactylogyrus (Jarkovskỳet al. 2004 dalam Abdullah 2009)