KARAKTERISASI PLANTARICIN ASAL EMPAT GALUR
Lactobacillus plantarum BERDASARKAN
SENSITIVITASNYA TERHADAP
ENZIM TRIPSIN
SKRIPSI
GILANG AYUNINGTYAS
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
ii
RINGKASAN
GILANG AYUNINGTYAS. D14070143. 2012. Karakterisasi Plantaricin Asal Empat Galur Lactobacillus plantarum Berdasarkan Sensitivitasnya terhadap Enzim Tripsin. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Irma Isnafia Arief, S.Pt., M.Si. Pembimbing Anggota : Tuti Suryati, S.Pt., M.Si.
Bakteri asam laktat (BAL) memiliki peran yang sangat penting dalam pengolahan pangan. Bakteri asam laktat berperan aktif dalam proses fermentasi pangan. BAL pada perkembangannya saat ini diharapkan dapat diaplikasikan sebagai agen pengawet pangan alami. Hal tersebut disebabkan oleh kemampuan BAL dalam memproduksi substansi-substansi antimikrob selama metabolismenya. Bakteriosin merupakan salah satu substansi antimikrob yang diproduksi BAL. Supernatan bebas sel netral isolat Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 yang diisolasi dari daging sapi lokal diketahui memiliki aktivitas antimikrob melawan bakteri indikator. Zat aktif pada senyawa antimikrob ini diduga sebagai bakteriosin yang dihasilkan oleh Lactobacillus plantarum atau disebut plantaricin, sehingga perlu dilakukan proses purifikasi untuk mendapatkan plantaricin murni 1A5, 1B1, 2B2, dan 2C12.
Penelitian ini dilakukan untuk mempelajari karakteristik plantaricin tersebut terhadap degradasi enzim proteolitik. Sensitivitas plantaricin terhadap enzim proteolitik merupakan kriteria utama dalam karakterisasi plantaricin, karena komponen utama dalam plantaricin adalah peptida yang harus sensitif terhadap enzim proteolitik. Enzim proteolitik yang digunakan dalam penelitian ini adalah enzim tripsin. Pengujian ini sekaligus untuk membuktikan bahwa plantaricin akan terdegradasi dalam saluran pencernaan manusia, tempat terjadinya proses proteolitik oleh enzim tripsin, sehingga plantaricin dapat digunakan sebagai agen pengawet pangan alami. Proses karakterisasi diawali dengan memproduksi plantaricin 1A5, 1B1, 2B2, dan 2C12, melalui tahapan purifikasi.
Keempat galur Lactobacillus plantarum ditumbuhkan pada media De Man Rogosa and Sharpe broth (MRSb) yang ditambah yeast extract (YE) 3%, diinkubasi selama 20 jam, kemudian disentrifugasi pada kecepatan 10.000 rpm untuk mendapatkan supernatan antimikrob. Supernatan antimikrob disaring menggunakan membran saring sartorius untuk mendapatkan supernatan bebas sel, yang kemudian dinetralkan pH-nya menjadi 5,8 – 6,2. Proses purifikasi parsial dilakukan dengan menjenuhkan larutan menggunakan amonium sulfat hingga penjenuhan mencapai 80%. Presipitat plantaricin didapat dan didialisis menggunakan membran dialisis. Proses dialisis menghasilkan plantaricin kasar, kemudian plantaricin kasar dimurnikan dengan teknik kromatografi kolom pertukaran kation.
iii sebanyak tiga kali. Faktor perlakuan pertama adalah penggunaan enzim tripsin, dan faktor perlakuan kedua adalah plantaricin asal galur L. plantarum yang berbeda.
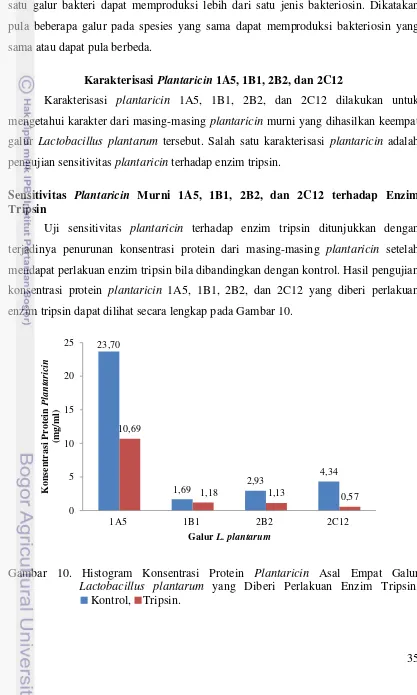
Hasil karakterisasi plantaricin 1A5, 1B1, 2B2, dan 2C12 terhadap enzim tripsin, memperlihatkan bahwa plantaricin tersebut sensitif terhadap enzim tripsin. Hal tersebut diindikasikan oleh terjadinya penurunan konsentrasi protein plantaricin, serta terjadinya penurunan aktivitas penghambatan plantaricin terhadap bakteri indikator pada uji antagonistik. Persentase penurunan konsentrasi protein terbesar dimiliki oleh plantaricin 2C12 yaitu sebesar 74,27 %. Perlakuan enzim tripsin berbeda nyata (p≤0,05) terhadap diameter zona hambat plantaricin pada uji antagonistik dengan bakteri indikator. Aktivitas antimikrob dari plantaricin tidak sepenuhnya diinaktivasi oleh enzim tripsin. Hal ini terlihat dari masih terbentuknya zona hambat dan masih cukup tingginya nilai activity unit pada uji antagonistik plantaricin 1A5, 1B1, 2B2, dan 2C12 terhadap bakteri indikator Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 14028, Bacillus cereus, Salmonella enteritidis ser. Thypimurium ATCC 14028, dan Escherichia coli ATCC 25922.
iv
ABSTRACT
Plantaricin Characterization from Four Strains of Lactobacillus plantarum Based on Sensitivity to Tripsin Enzyme
Ayuningtyas, G., I.I. Arief, dan T. Suryati
Lactic acid bacteria (LAB) has been used as biological preservative for thousands years in food processing. LAB produces many antimicrobial substances, one of them is bacteriocin. Four strains of Lactobacillus plantarum (1A5, 1B1, 2B2, and 2C12) were isolated from Indonesia local beef and have identified producing bacteriocin called plantaricin 1A5, 1B1, 2B2, and 2C12. The pure plantaricins were obtained from purification steps, consisted of purification partial using ammonium sulphate precipitation, dialysis, and purification using chromatographi cation exchange. The objective of this research was to study characteristic plantaricin from Lactobacillus plantarum 1A5, 1B1, 2B2, and 2C12 to proteolytic enzyme degradation. The characterization was determined by sensitivity assay to tripsin enzyme with antagonistic assay againt indicator bacterias (Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923, Bacillus cereus, Salmonella enteritidis ser. Thypimurium ATCC 14028, and Escherichia coli ATCC 25922). The result showed that plantaricin 1A5, 1B1, 2B2, and 2C12 could inhibit the indicators bacterias consisted of Gram positive bacteria and Gram negative bacteria. Tripsin enzyme treatment caused the declining of plantaricin protein concentration, and plantaricin 2C12 has the highest declining percentage of protein concentration. The activities of the plantaricin 1A5, 1B1, 2B2, and 2C12 decreased after treatment with tripsin enzyme. The declining of plantaricin activities were determined by the inhibition zone as result from antagonistic assay.
v
KARAKTERISASI PLANTARICIN ASAL EMPAT GALUR
Lactobacillus plantarum BERDASARKAN
SENSITIVITASNYA TERHADAP
ENZIM TRIPSIN
GILANG AYUNINGTYAS
D14070143
Skripsi ini merupakan salah satu syarat untuk Memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
vi
Judul : Karakterisasi Plantaricin Asal Empat Galur Lactobacillus plantarum Berdasarkan Sensitivitasnya terhadap Enzim
Tripsin
Nama : Gilang Ayuningtyas
NIM : D14070143
Menyetujui,
PembimbingUtama,
(Dr. Irma Isnafia Arief, S.Pt., M.Si.) NIP: 19750304 199903 2 001
PembimbingAnggota,
(Tuti Suryati, S.Pt., M.Si.) NIP: 19720516 199702 2 001
Mengetahui: Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. NIP: 19591212 198603 1 004
vii
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 7 November 1988 di Bogor, Jawa Barat. Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Drs. Ade Sutisna, M.MPd. dan Lelih Sondari. Riwayat pendidikan penulis dimulai pada tahun 1995 di Sekolah Dasar Negeri Panaragan 1 Bogor dan diselesaikan pada tahun 2001. Pendidikan dilanjutkan di Sekolah Menengah Pertama Negeri 4 Bogor dari tahun 2001 hingga 2004, dan Sekolah Menengah Atas Negeri 5 Bogor dari tahun 2004 dan selesai pada tahun 2007.
Penulis diterima di Institut Pertanian Bogor pada tahun 2007 melalui jalur Undangan Seleksi Masuk IPB (USMI) dan ditempatkan di Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan. Penulis aktif dalam organisasi Dewan Perwakilan Mahasiswa Fakultas Peternakan pada dua periode 2008-2009 dan 2009-2010, serta kepanitiaan kegiatan kampus lainnya. Selama mengikuti pendidikan, penulis pernah menjadi asisten praktikum mata kuliah Teknik Pengolahan Daging, Teknik Pengolahan Susu, serta Metodelogi Penelitian dan Rancangan Percobaan. Penulis berkesempatan menjadi penerima beasiswa BBM (Bantuan Belajar Mahasiswa) dan PPA (Peningkatan Prestasi Akademik) selama tiga tahun pendidikannya di IPB, serta menerima Beasiswa Unggulan Kementrian Pendidikan Nasional Republik Indonesia pada tahun 2011.
Penulis pernah mengikuti kegiatan Program Kreativitas Mahasiswa bidang penelitian tahun 2010-2011 dengan judul “Aplikasi Bakteriosin Sebagai
Preservatif Alami pada Produk Bakso untuk Meningkatkan Keamanan Pangan
Produk Olahan Daging” dan berhasil didanai. Penelitian tersebut juga
KATA PENGANTAR
Segala puji dan syukur bagi Allah SWT pencipta alam raya, yang berkat rahmat dan karunia-Nya sehingga akhirnya penulisan skripsi ini dapat terselesaikan dengan baik. Shalawat dan salam semoga selalu tersampaikan pada Nabi Muhammad SAW. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah memberi dukungan dalam penyelesaian penelitian tugas akhir dan skripsi yang berjudul “Karakterisasi Plantaricin Asal Empat Galur Lactobacillus plantarum Berdasarkan Sensitivitasnya terhadap Enzim Tripsin”. Penulisan skripsi ini dilakukan guna memenuhi salah satu syarat memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan, Institut Pertanian Bogor.
Semakin meningkatnya permintaan akan pangan sehat bebas bahan pengawet sintetis menjadikan peran preservative biologis semakin dibutuhkan. Bakteriosin merupakan salah satu senyawa antimikrob yang dihasilkan oleh bakteri asam laktat (BAL), berupa peptida atau komplek peptida aktif. Banyak negara telah menggunakan bakteriosin sebagai agen pengawet pangan alami, karena kemampuannya dalam menghambat bakteri patogen dan pembusuk makanan. Semenjak diketahui bahwa komponen utama dalam bakteriosin adalah peptida, maka kriteria utama dalam karakterisasi bakteriosin adalah sensitivitasnya terhadap protease. Penelitian ini dilakukan untuk mengkaji lebih lanjut mengenai karakterisasi dari bakteriosin yang dihasilkan oleh Lactobacillus plantarum (plantaricin) terhadap enzim proteolitik yaitu tripsin. Hasil yang diperoleh pada penelitian ini diharapkan dapat memberikan informasi mengenai karakteristik plantaricin 1A5, 1B1, 2B2, dan 2C12 terhadap enzim tripsin. Disamping itu, dapat memberikan informasi plantaricin mana yang memiliki sensitivitas tertinggi terhadap enzim tripsin, sehingga nantinya akan lebih direkomendasikan untuk digunakan dalam aplikasi pengolahan pangan.
Penulis berharap agar skripsi ini dapat bermanfaat bagi para pembaca dan seluruh pihak, serta dapat digunakan sebagai penambah ilmu pengetahuan bagi ranah pangan pada umumnya, dan ranah mikrobiologi pada khususnya.
Bogor, Januari 2012
x Purifikasi Kromatografi Pertukaran Kation ...
Sensitifitas terhadap Enzim Proteolitik ... Uji Antagonistik Plantaricin ... Rancangan dan Analisis Data ... HASIL DAN PEMBAHASAN ... Karakteristik Galur L.plantarum dan Bakteri Indikator ... Produksi Plantaricin ... Uji Antagonistik Supernatan Bebas Sel Netral ... Purifikasi Plantaricin ... Karakterisasi Plantaricin 1A5, 1B1, 2B2, dan 2C12 ...
Sensitivitas Plantaricin Murni terhadap Enzim
xi
DAFTAR TABEL
Nomor Halaman
1. Kategori Aktivitas Antimikrob ... 2. Penggunaan Padatan Amonium Sulfat (Penjenuhan) ... 3. Karakteristik BAL Lactobacillus plantarum 1A5, 1B1, 2B2, 2C12, dan Bakteri Indikator ... 4. Kondisi pH Supernatan Bebas Sel Asal Empat Galur Lactobacillus
plantarum pada Media MRS broth dengan Inducer Yeast Extract (YE) 3% ... 5. Diameter Zona Hambat Supernatan Netral Asal Empat Galur Lactobacillus plantarum terhadap Bakteri Indikator ... 6. Diamater Zona Hambat Plantaricin Asal Empat Galur Lactobacillus
plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Pseudomonas aeruginosa ATCC 27853 ... 7. Diamater Zona Hambat Plantaricin Asal Empat Galur Lactobacillus
plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Bacillus cereus ... 8. Diamater Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 9. Diamater Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Escherichia coli ATCC 25922 ... 10. Diamater Zona Hambat Plantaricin Asal Empat Galur Lactobacillus
plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Salmonella enteritidis ser. Thpimurium ATCC 14028 ...
xii
DAFTAR GAMBAR
Nomor Halaman
1. Bakteri Pseudomonas ... 2. Bakteri Staphylococcus aureus ... 3. Bakteri Bacillus cereus ... 4. Bakteri Salmonella typhimurium ... 5. Bakteri Escherichia coli ... 6. Metode Pengukuran Zona Hambat ... 7. Morfologi dan Hasil Pewarnaan Gram Bakteri Lactobacillus
plantarum ………
8. Morfologi dan Hasil Pewarnaan Gram Bakteri Indikator ………… 9. Histogram Konsentrasi Protein Plantaricin Asal Empat Galur
Lactobacillus plantrum pada Tahap Proses Purifikasi Plantaricin ... 10. Histogram Konsentrasi Protein Plantaricin Asal Empat Galur
Lactobacillus plantarum yang Diberi Perlakuan Enzim Tripsin 11. Histogram Persentase (%) Penurunan Konsentrasi Protein
Plantaricin Murni setelah Didegradasi Enzim Tripsin ………... 12. Histogram Activity Unit Plantaricin Asal Empat Galur Lactobacillus
plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Pseudomonas aeruginosa ATCC 27853 ………...
13. Histogram Activity Unit Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri
Bacillus cereus………..
14. Histogram Activity Unit Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 15. Histogram Activity Unit Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri
Escherichia coli ATCC 25922 ………...
16. Histogram Activity Unit Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Salmonella enteritidis ser. Thypimurium ATCC 14028 ……….
xiii
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Sidik Ragam Persentase Penurunan Protein Plantaricin Asal Empat Galur Lactobacillus plantarum Setelah Didegradasi Enzim Tripsin... 2. Hasil Sidik Ragam Diameter Zona Hambat Plantaricin Asal Empat
Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Pseudomonas aeruginosa ATCC 27853 ... 3. Uji Tukey Diameter Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Pseudomonas aeruginosa ATCC 27853 ... 4. Hasil Sidik Ragam Diameter Zona Hambat Plantaricin Asal Empat
Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Bacillus cereus ... 5. Uji Tukey Diameter Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Bacillus cereus ... 6. Hasil Sidik Ragam Diameter Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 7. Uji Tukey Diameter Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 8. Hasil Sidik Ragam Diameter Zona Hambat Plantaricin Asal Empat Galur Lactobacillus plantarum dengan Perlakuan Enzim Tripsin terhadap Bakteri Escherichia coli ATCC 25922 ... 9. Hasil Uji Kruskal-Wallis Zona Hambat Plantaricin yang Diberi Perlakuan Enzim Tripsin terhadap Bakteri Salmonella enteritidis ser. Thypimurium ATCC 14028 ... 10. Uji All-Pairwise Comparisons Kruskal-Wallis Zona Hambat
Plantaricin yang Diberi Perlakuan Enzim Tripsin terhadap Bakteri Salmonella enteritidis ser. Thypimurium ATCC 14028 ... 11. Hasil Uji Kruskal-Wallis Zona Hambat Plantaricin yang Berasal dari
Galur Lactobacillus plantarum yang berbeda terhadap Bakteri Salmonella enteritidis ser. Thypimurium ATCC 14028 ... 12. Tahapan Pembuatan Buffer Potassium Phosphate 0,1 M ... 13. Pembuatan buffer tris hidroklorida (Tris HCl) 0,05 M ...
xiv 14. Dosis Penggunaan Enzim Tripsin ...
15. Gambar Zona Hambat Plantaricin terhadap Berbagai Bakteri Indikator ... 16. Gambar Zona Hambat Supernatan Antimikrob Netral pada Uji
Aktivitas Antimikrob Awal ... 17. Gambar Proses Purifikasi Plantaricin 1A5, 1B1, 2B2, dan 2C12 ... 18. Gambar Presipitat Plantaricin¸ Plantaricin Kasar, dan Plantaricin
Murni ...
60
60
61 61
1
PENDAHULUAN Latar Belakang
Penggunaan bakteri asam laktat (BAL) dalam industri pangan telah diaplikasikan sejak lama, khususnya sebagai kultur starter untuk produk-produk pangan fermentasi. Bakteri asam laktat memiliki peran yang penting pada pengolahan pangan. Hal tersebut dikarenakan BAL dapat memberikan karakteristik yang diinginkan pada produk pangan fermentasi dan juga dapat meningkatkan kesehatan masyarakat yang mengkonsumsi produk-produk fermentasi, melalui perannya sebagai faktor pertahanan alami melawan kolonisasi bakteri-bakteri patogen didalam usus.
Selama proses fermentasi bakteri asam laktat memproduksi berbagai substansi antimikrob yaitu, asam organik, hidrogen peroksida, bakteriosin dan substansi seperti bakteriosin. Bakteriosin merupakan peptida yang dihasilkan dari metabolisme anaerobik bakteri asam laktat (BAL) baik Gram positif maupun Gram negatif. Bakteriosin memiliki aktivitas antimikrob terhadap mikroorganisme yang memiliki kedekatan secara filogenik dengan mikroorganisme penghasil bakteriosin tersebut.
Penggunaan bakteri asam laktat juga diharapkan dapat diaplikasikan sebagai agen pengawet pangan alami atau food biopreservation agent untuk mencegah kerusakan pangan akibat keberadaan bakteri patogen dan bakteri pembusuk makanan. Hal tersebut karena pada kondisi saat ini permintaan akan produk pangan alami bebas bahan pengawet kimia semakin meningkat. Bakteriosin merupakan senyawa antimikrob yang aman untuk dikosumsi karena substansi utama dalam bakteriosin adalah peptida yang dapat didegradasi oleh enzim proteolitik, dan tidak membahayakan bagi mikroflora usus. Berdasarkan hal tersebut, bakteriosin berpotensi sebagai bahan pengawet pangan alami, dan berpotensi untuk mengganti-kan penggunaan antibiotik.
2 2C12, 1A5,1B1, dan 2B2 yang diisolasi dari daging sapi lokal Indonesia menghasilkan suatu senyawa antimikrob sebagai bakteriosin. Bakteriosin yang berasal dari berbagai galur Lactobacillus plantarum dapat memiliki karakteristik dan spektrum penghambatan yang berbeda-beda.
Plantaricin diperoleh melalui proses yang disebut purifikasi, yaitu me-misahkan plantaricin dari sel bakteri Lactobacillus plantarum dan dari komponen antimikrob lainnya yang dihasilkan sel bakteri pada proses fermentasi. Plantaricin sebagai substansi proteinaceous harus sensitif paling tidak terhadap satu jenis enzim proteolitik (Moreno et al., 2000), oleh karena itu sensitivitas plantaricin terhadap enzim proteolitik merupakan kriteria utama dalam karakterisasi plantaricin. Enzim proteolitik yang digunakan untuk melakukan karakterisasi plantaricin adalah enzim tripsin. Pengujian sensitivitas plantaricin terhadap enzim proteolitik pun perlu dilakukan untuk menunjukkan bahwa plantaricin akan terdegradasi di dalam saluran pencernaan manusia, tempat terjadi proses proteolisis oleh enzim tripsin. Penelitian ini dimaksudkan untuk mengkarakterisasi plantaricin dari empat galur Lactobacillus plantarum terhadap degradasi enzim tripsin. Karakterisasi dilakukan melalui pengukuran konsentrasi protein yang terkandung di dalam plantaricin sebelum dan setelah didegradasi oleh enzim tripsin, serta melalui uji antagonistik plantaricin yang diberi perlakuan enzim tripsin dengan bakteri indikator yaitu bakteri patogen dan bakteri pembusuk makanan.
Tujuan
3
TINJAUAN PUSTAKA Bakteri Asam Laktat
Bakteri asam laktat secara umum termasuk dalam bakteri Gram positif, tidak berspora, berbentuk bulat maupun batang, dan menghasilkan asam laktat sebagai mayoritas produk akhir selama memfermentasi karbohidrat (Axelsson, 2004). Grup bakteri yang termasuk bakteri asam laktat adalah spesies yang berasal dari genus Lactococcus, Steptococcus (hanya satu spesies), Enterococcus, Pediococcus, Tetragenococcus, Aerococcus, Alloiococcus, Oenococcus, Vagococcus, Lactospera, Leuconostoc, Weisella, Lactobacillus, Dolosigranulum, Globicatella, dan Carno-bacterium (Ray dan Bhunia, 2007). Saat ini hanya beberapa spesies dari Lacto-coccus, Lactobacillus, Leuconostoc, dan Pediococcus yang digunakan dalam proses fermentasi pangan, dan beberapa spesies dari Lactobacillus serta Bifidobacterium memiliki efek yang menguntungkan bagi kesehatan dan bagi saluran pencernaan (Ray and Miller, 2003).
Sifat yang terpenting dari bakteri asam laktat adalah kemampuannya untuk memfermentasi gula menjadi asam laktat. Sifat ini penting dalam pembuatan produk-produk fermentasi seperti fermentasi sayur-sayuran, fermentasi susu, dan fermentasi ikan (Fardiaz, 1989a). Hal penting lainnya dari karakteristik bakteri asam laktat adalah kemampuannya untuk memproduksi bermacam-macam metabolit antimikrob, diantaranya asam organik, hidrogen peroksida, karbon dioksida, dan bakteriosin, yang dapat mengambat bakteri patogen dan bakteri pembusuk, memperpanjang masa simpan produk pangan, serta meningkatkan keamanan produk pangan (Jeevaratnam et al., 2005). Beberapa dari agen antimikrob telah diketahui karakteristiknya, tapi beberapa masih diidentifikasi (Ray and Miller, 2003).
4 Bakteri asam laktat juga disebut sebagai biopreservatif karena berkontribusi dalam menghambat pertumbuhan bakteri lainnya khususnya patogen dan mampu membawa dampak positif bagi kesehatan manusia (Smid dan Gorris, 2007). Preservatif yang dilakukan oleh bakeri asam laktat disebabkan oleh asam laktat yang dihasilkan oleh bakteri tersebut selama fermentasi pangan akan menurunkan nilai pH dari lingkungan pertumbuhannya dan menimbulkan rasa asam, hal ini juga menghambat pertumbuhan dari beberapa jenis mikroorganisme lainnya (Buckle et al. 1987). Beberapa strain bakteri asam laktat berkontribusi dalam pengawetan pangan karena kemampuannya memproduksi bakteriosin (Savadogo et al., 2004). Kemam-puan bakteriosin dalam melakukan aktivitas sebagai biopresevatif dicapai oleh efek penghambatannya terhadap mikroorganisme patogen yang berbahaya (Savadogo et al., 2006).
Lactobacillus
5
Lactobacillus plantarum
Lactobacillus plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, famili Lactobacillaceae dan genus Lactobacillus.
Lactobacillus plantarum mempunyai kemampuan untuk menghambat
mikroorganisme patogen pada bahan pangan dengan daerah penghambatan tersbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini, 1995). Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 merupakan isolat indigenus yang diisolasi dari daging sapi lokal Indonesia yang dijual di tiga pasar yang berbeda di Bogor. Karakteristik morfologi keempat galur Lactobacillus plantarum tersebut adalah berbentuk batang, susunan tunggal maupun susunan rantai pendek. Hasil pewarnaan Gram menunjukkan bahwa bakteri tersebut adalah bakteri Gram positif, serta hasil uji katalasenya menunjukkan negatif (Firmansyah, 2009). Arief et al. (2011) melaporkan bahwa suatu senyawa antimikrob diproduksi oleh bakteri asam laktat Lactobacillus plantarum 1A5, 1B1,2B2, dan 2C12, yang diisolasi dari daging sapi lokal. Senyawa antimikrob tersebut dapat menghambat pertumbuhan bakteri patogen Escherichia coli enterotoksigenik (ETEC) ATCC 25922, Escherichia coli enteropatogenik (EPEC) K11, Salmonella typhimurium ATCC 14028 dan Staphylococcus aureus ATCC 25923.
Antimikrob
Antimikrob adalah sifat suatu senyawa kimia atau biologi yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikrob tersebut terdapat dalam makanan melalui salah satu dari beberapa cara yaitu, terdapat secara alamiah di dalam bahan pangan, ditambahkan dengan sengaja ke dalam makanan, terbentuk selama pengolahan atau jasad renik yang tumbuh selama fermentasi makanan. Senyawa antimikrob dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), dan germisidal (menghambat germinasi spora bakteri) (Fardiaz, 1989a).
6 pangan dan selama penyimpanan pangan, mampu menghambat pada konsentrasi yang rendah, dan economic viability (Jeevaratnam et al., 2005). Kemampuan suatu zat antimikrob dalam menghambat pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain konsentrasi zat pengawet, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis, konsentrasi, umur, dan keadaan mikroba), sifat-sifat fisik dan kimia makanan, termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya (Davidson dan Branen, 1993). Karakteristik bakteri asam laktat adalah kemampuannya untuk memproduksi bermacam-macam metabolit antimikrob. Antimikrob ini mampu menghambat dan membunuh mikroorganisme yang menjadi target seperti khamir, kapang, bakteri vegetatif, spora bakteri, dan bahkan virus. Spektrum dari aktivitas antimikrob bervariasi berdasarkan metabolit spesifiknya (Ray and Miller, 2003).
Bakteriosin
Bakteriosin merupakan salah satu senyawa antimikrob yang dihasilkan oleh bakteri asam laktat. Bakteriosin didefinisikan sebagai peptida-peptida aktif atau kompleks peptida yang disintesis di ribosom, serta memiliki aktivitas bakteriostatik dan bakterisidal (Jeevaratnam et al., 2005). Aktivitas bakterisidal dan bakteriostatik pada banyak kasus, dilakukan terhadap bakteri yang memiliki kedekatan secara filogenik dengan bakteri penghasil bakteriosin tersebut. Beberapa bakteriosin yang berasal dari bakteri Gram positif, memiliki spektrum penghambatan yang cukup luas, dan dapat digunakan sebagai antibakterial agen untuk berbagai aplikasi pengolahan pangan (Hata et al., 2010).
7 proteolitik yang berbeda dapat menghidrolisis peptidanya, menyebabkan hilangnya keefektifan dari bakteriosin (Ray dan Bhunia, 2007).
Saat ini penggunaan bakteri asam laktat sebagai penghasil bakteriosin di bidang peternakan semakin bertambah luas, diantaranya sebagai biopreservatif (Wiryawan dan Tjakradidjaja, 2001). Bakteriosin dari bakteri asam laktat telah menjadi perhatian penting karena potensinya untuk digunakan sebagai bahan tambahan makanan yang aman sebagai preservatif alami dan non-toxic, serta mencegah terjadinya kebusukan pangan oleh bakteri patogen Gram positif (Hata et al., 2010).
Bakteriosin berakumulasi di dalam media kultur selama fase pertumbuhan eksponensial hingga fase pertumbuhan stasioner (Vuyst dan Vandamme, 1994). Menurut Driber et al. (2006), pada awal fase stasioner bakteri asam laktat mengalami modifikasi enzimatis pada proses pascatranslasi yang akan mengubah prebakteriosin menjadi bakteriosin yang aktif. Inkubasi yang terlalu lama menyebabkan aktivitas bakteriosin menurun, hal ini karena pengaruh inaktivator bakteriosin yang spesifik atau sifat reabsorpsi bakteriosin oleh sel produsen. Jika waktu inkubasi diperpanjang maka aktivitas bakteriosin menurun karena terbebasnya protease dari sel autolisis, bakteriosin juga merupakan molekul proteaneus sehingga molekulnya mudah terdegradasi (Jo et al., 1996). Produksi bakteriosin dipengaruhi oleh tipe dan level karbon, sumber nitrogen dan fosfat, surfaktan kation dan penghambat (Savadogo et al., 2006).
8 Contoh bakteriosin yang berasal dari kelas I adalah nisin yang diproduksi oleh Lactocoocus lactis subsp. Lactis. Kelas I dibagi menjadi Ia dan Ib. Kelas Ia termasuk nisin didalamnya terdiri dari peptida hidrofobik dan kationik yang dapat membentuk pori di membran sel targetnya, serta memiliki struktur yang lebih fleksibel dibandingkan dengan bakteriosin kelas Ib. Bakteriosin kelas Ib merupakan peptida globular, bermuatan negatif atau sama sekali tidak bermuatan (Altena et al., 2000). Bakteriosin kelas II dibedakan menjadi kelas IIa dan IIb. Peptida-peptida bakteriosin kelas IIa aktif dalam menghambat Listeria. Bakteriosin kelas IIb mengandung dua peptida yang berbeda, dan membutuhkan kedua peptida ini untuk aktivitas antimikrobial yang optimal (Cleveland et al., 2001).
Penggunaan bakteriosin sebagai biopreservative memiliki beberapa keun-tungan, yaitu 1) tidak toksik dan mudah mengalami biodegradasi karena merupakan senyawa protein, 2) tidak membahayakan mikroflora usus karena mudah dicerna oleh enzim-enzim dalam saluran pencernaan, 3) aman bagi lingkungan dan dapat mengurangi penggunaan bahan kimia sebagai bahan pengawet, serta 4) dapat digunakan dalam kultur bakteri unggul yang mampu menghasilkan senyawa antimikrob terhadap bakteri patogen atau dapat digunakan dalam bentuk senyawa antimikrob yang telah dimurnikan (Nurliana, 1997).
Bakteriosin diproduksi oleh bakteri asam laktat Gram positif maupun Gram negatif. Strain bakteri yang berbeda bahkan spesies bakteri yang berbeda dapat memproduksi bakteriosin yang sama (Ray and Miller, 2003). Beberapa strain pada spesies yang sama dapat memproduksi bakteriosin yang sama dan dapat pula yang berbeda, namun diketahui juga bahwa satu strain bakteri dapat memproduksi lebih dari satu bakteriosin (Ray dan Bhunia, 2007).
Purifikasi Bakteriosin
menye-9 babkan protein meninggalkan larutan dan membentuk partikel tidak larut dalam endapan (Tokuyasu et al. 1996). Proses pengendapan protein dengan garam ammonium sulfat dapat dikelompokan menjadi dua bagian yaitu salting in dan salting out. Englard dan Seifter (1990) menyatakan pada konsentrasi garam ammonium sulfat yang tinggi, garam dapat lebih mengikat molekul air. Menurunya jumlah air yang terikat pada protein menyebabkan gaya tarik menarik antara molekul protein lebih kuat dibandingkan dengan gaya tarik menarik antara molekul protein dengan air (mempertinggi interaksi hidrofobik), sehingga protein akan mengendap dari larutan atau berikatan dengan kolom hidrofobik. Proses pengendapan harus dilakukan dalam kondisi dingin sehingga protein akan mengendap tanpa mengalami denaturasi. Keuntungan menggunakan garam ammonium sulfat karena mempunyai kelarutan tinggi, pH moderat, relatif lebih murah, non toksik, dan tidak mempengaruhi enzim (Tokuyasu et al., 1996). Proses pengendapan ini mempunyai dua tujuan yaitu sebagai awal proses pemurnian dan meningkatkan konsentrasi protein (Day dan Underwood, 2002).
10
Mekanisme Penghambatan Senyawa Antimikrob
Mekanisme aktivitas penghambatan oleh senyawa antimikrob dipengaruhi oleh struktur dan komposisi sel mikroorganisme target. Terdapat beberapa mekanisme, diantaranya kerusakan pada dinding sel, perubahan permeabilitas sel, perubahan molekul protein dan asam nukleat, penghambatan kerja enzim, serta penghambatan sintesis asam nukleat dan protein (Dwidjoseputro, 1990). Aksi penghambatan bakteriosin terhadap bakteri yang sensitif terjadi secara cepat pada konsentrasi yang rendah, serta efisiensis bakterisidalnya akan meningkat pada kondisi pH yang asam, dan pada temperatur yang lebih tinggi. Sel penghasil bakteriosin akan mengalami ketahanan terhadap bakteriosin yang dihasilkannya sendiri, disebabkan ketahanan protein yang spesifik. Terdapatnya sebuah struktur amfipatik α-helical dengan sisi polar dan nonpolar yang berlawanan pada bakteriosin, membuat bakteriosin dapat berinteraksi dengan kedua fase air dan lipid ketika terikat dengan permukaan membran sel bakteri yang sensitif, sehingga sel mengalami destabilisasi fungsional dan sel tersebut mati (Ray dan Bhunia, 2007).
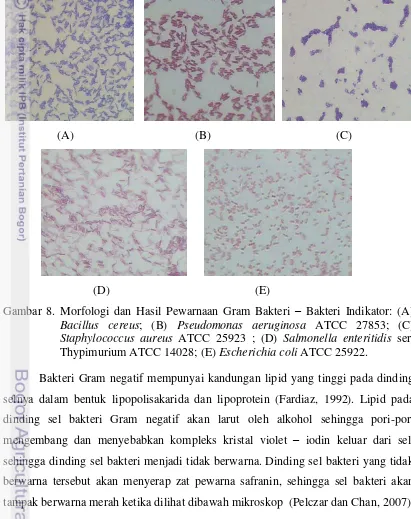
Umumnya bakteri Gram positif lebih sensitif terhadap bakteriosin sedangkan bakteri Gram negatif resisten terhadap bakteriosin. Hal tersebut dikarenakan permukaan membran sitoplasma bakteri Gram negatif mengandung molekul lipopolisakarida (LPS), yang secara normal berperan sebagai pembatas untuk mencegah terjadinya kontak antara molekul bakteriosin dengan fosfolipid anionik di membran sitoplasma bagian dalam. Molekul LPS ini juga yang menyebabkan bakteri Gram negatif tahan terhadap garam empedu. Namun bakteri Gram negatif dapat menjadi sensitif terhadap bakteriosin apabila mendapat perlakuan fisik maupun kimia, contohnya dengan memberikan perlakuan tekanan tinggi terhadap sel (Ray dan Bhunia, 2007).
11 melewati membran, akibatnya proses metabolisme sel akan terganggu, seperti penghambatan sintesis ATP dan terganggunya sistem transport sel. Hal tersebut akan menyebabkan kematian sel dan akhirnya sel akan mengalami lisis.
Reseptor bakteriosin di sel sensitif adalah polimer anionik yaitu asam teikoat yang hanya dihasilkan oleh bakteri Gram positif. Molekul-molekul kationik dari bakteriosin akan berinteraksi dengan polimer-polimer anionik dipermukaan membran sel. Sifat hidrofobik dari bakteriosin juga berpengaruh saat aktivitas penghambatan bakteri sensitif. Hal ini dikarenakan inaktivasi mikroorganisme oleh bakteriosin tergantung pada interaksi hidrofobik antara sel-sel bakteri dengan molekul bakteriosin (Ray dan Miller, 2003). Membran terluar bakteri Gram negatif bersifat hidrofilik, akibatnya bakteriosin asal bakteri asam laktat tidak efisien dalam menghambat bakteri Gram negatif (Ray dan Bhunia, 2007). Davis dan Stout (1971), mengkategorikan aktivitas antimikrob berdasarkan diameter zona hambat yang dihasilkan pada uji antagonistik seperti tercantum pada Tabel 1 berikut.
Tabel 1. Kategori Aktivitas Antimkirob
Daerah Hambat Kategori
> 6 mm Kuat
3 – 6 mm Baik
0 – 3 mm Lemah
Sumber : Pan et al. (2009)
Bakteri Patogen
12 (Buckle et al.,1987). Beberapa bakteri yang merupakan bakteri patogen diantaranya adalah famili Enterobacteriaceae yaitu Salmonella, Escherichia. Bakteri patogen lainnya adalah Staphylococcus aureus, Bacillus cereus, dan Pseudomonas yang merupakan jenis bakteri penyebab kebusukan pada makanan atau bakteri pembusuk (Fardiaz, 1989a).
Bakteri dibedakan menjadi bakteri Gram positif dan Gram negatif berdasarkan susunan dinding selnya yang mengakibatkan perbedaan dalam sifat-sifat pewarnaannya (Fardiaz, 1989a). Susunan dinding sel bakteri Gram positif terdiri atas 90% lapisan peptidoglikan dan lapisan tipis lainnya yaitu asam teikoat. Susunan dinding sel Bakteri Gram negatif terdiri atas 5-20% lapisan peptidoglikan, sedangkan lapisan lainnya terdiri dari protein, lipopolisakarida dan lipoprotein (Fardiaz, 1989b). Bakteri Gram positif akan memberikan respon berwarna biru keunguan jika dilakukan uji pewarnaan Gram, sedangkan bakteri Gram negatif memberikan respon warna merah (Tortora et al., 2006). Staphylococcus aureus dan Bacillus cereus merupakan bakteri Gram positif sedangkan Salmonella, Escherichia coli merupakan bakteri Gram negatif (Buckle et al., 1987).
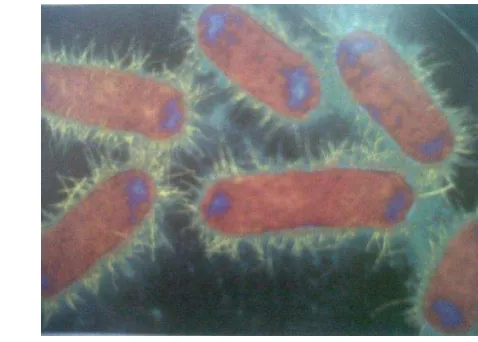
Pseudomonas
Pseudomonas merupakan salah satu jenis bakteri Gram negatif berbentuk batang kecil dan dapat bergerak, umumya berflagella polar tunggal dan mempunyai tipe metabolisme yang bersifat oksidatif. Bakteri ini merupakan penyebab berbagai jenis kerusakan bahan pangan yang sebagian besar berhubungan dengan kemampuan spesies ini dalam memproduksi enzim yang dapat memecah baik komponen lemak maupun protein dari bahan pangan (Buckle et al., 1987). Sifat-sfat Pseudomonas yang penting mempengaruhi pertumbuhannya pada makanan adalah sebagai berikut :
1. umumnya mendapatkan sumber karbon dari senyawa yang bukan karbohidrat 2. dapat menggunakan senyawa-senyawa sumber nitrogen sederhana
3. kebanyakan spesies tumbuh baik pada suhu rendah, kecuali P.aeruginosa dan P. fluorescens yang dapat tumbuh pada suhu 37oC
4. memproduksi senyawa-senyawa yang menimbulkan bau busuk 5. dapat mensintesa faktor-faktor pertumbuhan dan vitamin
6. beberapa spesies bersifat proteolitik dan lipolitik, atau pektinolitik
13 8. beberapa spesies memproduksi pigmen, misalnya P. fluorescens
mempro-duksi pigmen flouresein yang bersifat fluorosens dan larut air, P. nigrifaciens memproduksi pigmen hitam, dan P. aeruginosa memproduksi pigmen piosianin yang berwarna biru
9. kebanyakan Pseudomonas, kecuali P. syringe, bersifat oksidase positif, dan akan membentuk warna biru jika ditambah senyawa dimetil-p-fenilenediamin dihidrokhlorida
10.tidak tahan terhadap panas dan keadaan kering, oleh karena itu mudah dibunuh dengan proses pemanasan dan pengeringan (Fardiaz, 1989a).
Gambar 1. Pseudomonas (Rehm, 2008)
Staphylococcus aureus
Staphylococcus merupakan bakteri berbentuk bulat yang terdapat dalam bentuk tunggal, berpasangan, tetrad, atau berkelompok seperti buah anggur. Staphylococcus aureus memproduksi pigmen berwarna kuning sampai oranye. Bakteri ini membutuhkan nitrogen organik (asam amino) untuk pertumbuhannya dan bersifat aerobik fakultatif (Fardiaz, 1989a). Hemolisin merupakan salah satu toksin penting yang dibentuk oleh . Staphylococcus aureus merupakan bakteri Gram positif berbentuk kokus dengan diameter 0,7 - 0,9 m, dan termsuk dalam family Micrococcaceae. Staphylococcus aureus tahan garam dan tumbuh baik pada medium yang mengandung 7,5% NaCl, serta dapat memfermentasikan manitol (Fardiaz, 1989b). Suhu pertumbuhan minimum dari Staphylococcus aureus adalah 5-13oC sedangkan untuk Staphylococcus aureus penghasil enterotoksin lebih tinggi yaitu 10-19 oC (Fardiaz, 1989a).
14 vegetatifnya, dan waktu generasi dari bakteri ini adalah 27-30 menit pada medium broth (Fardiaz, 1989a). Bakteri ini juga tahan terhadap aktivitas pemecahan oleh enzim-enzim pencernaan, dan relatif resisten terhadap pengeringan. Selain enterotoksin, dia juga memproduksi hemolisin (toksin yang dapat merusak dan memecah sel-sel darah merah). Substrat yang baik untuk pertumbuhan dan produksi enterotoksin ialah substrat atau makanan yang mengandung protein seperti daging, ikan, susu dan produk olahannya. Sementara itu keberadaan bakteri Staphylococcus aureus dan toksin yang dihasilkan pada makanan tidak dapat dideteksi secara visual karena tidak menimbulkan perubahan yang nyata pada makanan (Syamsir, 2010). Staphylococcus aureus adalah bakteri patogen utama pada manusia yang menyebabkan berbagai penyakit secara luas yang berhubungan dengan toxic schock syndrome sebagai akibat dari keracunan pangan. Uji MSA, uji koagulase, dan uji clumping factor dapat membedakan Staphylococcus aureus dengan spesies Staphylococcus lainnya jika hasil uji tersebut positif (Salasia et al., 2005).
Gambar 2 . Staphylococcus aureus (Cook dan Cook, 2008)
Bacillus cereus
15 pertumbuhan Bacillus cereus adalah 10 oC. Ray dan Bhunia (2007), menyebutkan sel bakteri ini sensitif terhadap pasteurisasi, namun sporanya dapat bertahan terhadap suhu tinggi. Suhu untuk pertumbuhannya berkisar antara 4 oC hingga 50oC, dengan suhu optimum pertumbuhannya adalah 35-40 oC. Parameter pertumbuhan lainnya adalah bakteri ini dapat tumbuh pada pH 4,9 hingga 9,3 dengan aw minimum 0,95 serta konsentrasi NaCl adalah 10%. Spora dan sel Bacillus cereus terdapat pada tanah serta debu, juga dapat diisolasi dari sebagian kecil makanan.
Gambar 3. Bacillus cereus (Cowan dan Talaro, 2009)
Salmonella enteritidis ser. Thypimurium
16 Bahan pangan rentan terhadap kontaminasi Salmonella, khususnya bahan pangan asal ternak yang memiliki angka tertinggi terjangkit oleh Salmonella. Bahan pangan ini diantaranya daging sapi, daging ayam, daging kalkun, daging babi, telur, susu, dan produk olahan bahan pangan tersebut (Ray dan Bhunia, 2007).
Gambar 4. Salmonella typhimurium (Brands, 2006)
Escherichia coli
Merupakan bakteri Gram negatif yang berbentuk batang, dan metabolismenya adalah anaerobik fakultatif. Escherichia coli disebut juga koliform fekal karena ditemukan di dalam saluran usus hewan dan manusia, sehingga sering terdapat di dalam feses. Bakteri ini sering digunakan sebagai indikator kontaminasi kotoran Escherichia coli dapat tumbuh pada medium sederhana pada kisaran pH dan suhu yang luas, yaitu mulai suhu kurang dari 10oC sampai lebih dari 40 oC. Bakteri ini memiliki waktu generasi 17 menit pada medium Broth dan 12,5 menit pada medium susu (Fardiaz, 1989b).
17
Enzim Protease
Enzim terdapat pada semua sel hidup, tergolong protein dan penting dalam sistem biologis. Suatu senyawa kompleks yang berfungsi sebagai biokatalisator pada reaksi-reaksi biokimia di dalam sel dan mempunyai cara kerja yang unik dan spesifik (Soedarmo et al., 1988). Enzim proteolitik adalah enzim yang dapat menguraikan atau memecah protein. Enzim proteolitik terbagi atas dua kelompok besar yaitu golongan eksopeptidase (memecah peptida dari arah luar) dan golongan endopeptidase (memecah peptida dari arah dalam). Enzim-enzim ini meliputi protease-protease pankreas, khimotripsin, dan tripsin, bromelin, papain, fungal proteases dan Serratia peptidase (Winarno, 1989). Protease atau enzim proteolitik adalah enzim yang memiliki daya katalitik yang spesifik dan efisien terhadap ikatan peptida dari suatu molekul polipeptida atau protein. Protease dapat diisolasi dari tumbuhan (papain dan bromelin), hewan (tripsin, kimotripsin, pepsin, dan renin), mikroorganisme seperti bakteri, kapang, virus.
18
MATERI DAN METODE Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi dan Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor, pada bulan April hingga Agustus 2011.
Materi
Bahan-bahan yang digunakan dalam penelitian ini diantaranya adalah, isolat indigenus bakteri asam laktat dari daging sapi lokal Indonesia, yaitu Lactobacillus plantarum 2C12, 1A5, 1B1, dan 2B2, bakteri indikator (Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923, Bacillus cereus, Salmonella enteritidis ser. Thypimurium ATCC 14028, dan Escherichia coli ATCC 25922). Selain itu digunakan media De Man Rogosa and Sharpe broth (MRSB), Mueller Hinton agar (MHA), yeast extract (YE) 3%, NaCl 1%, NaOH 1 N, amonium sulfat, buffer potassium phosphate, resin SP sepharose –Fast flow, enzim protease tripsin (Sigma Life Science, activity ≥ 10000 BAEE units/ mg protein), tris hydrochloride 0,05 M, kristal violet, lugol, safranin, alkohol, akuades dan larutan Mc. Farlan no. 0,5.
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas antara lain tabung reaksi, labu erlenmeyer, botol schott, cawan petri, gelas ukur, pipet pasteur, pipet tetes, gelas objek, dan cover glass. Selain itu digunakan alat-alat seperti ose, membran saring sartorius, mikro pipet, spoit, sentrifuse, incubator, refrigerator, magnetic stirrer, hot plate, spektrofotometer UV-Vis, mikroskop, membran dialisis, alumunium foil, kapas, oven, otoklaf, timbangan analitik, bunsen, laminar air flow, vortex,cork borer, pH meter, jangka sorong, dan kamera digital.
Prosedur Pewarnaan Gram (Waluyo, 2008)
19 menggunakan akuades dan dikeringkan. Tahap selanjutnya, olesan bakteri ditetesi logul dan diratakan kembali, dikeringkan selama satu menit, kemudian dibilas kembali dengan akuades lalu dikeringkan. Preparat dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik, kemudian dicuci segera dengan akuades dan ditiriskan. Preparat selanjutnya ditetesi safranin dan didiamkan selama 30 detik, kemudian dibilas dengan akuades dan ditiriskan. Preparat bakteri ditetesi minyak imersi, dan diamati dibawah mikroskop pembesaran 100x untuk mengetahui hasil dari pewarnaan Gram serta mengamati morfologinya. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna ungu atau gelap sedangkan kelompok bakteri Gram negatif akan menunjukkan warna merah.
Uji Antagonistik Supernatan Bebas Sel Netral Lactobacillus plantarum
Kultur Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 masing-masing diinokulasi ke dalam media de Man Ragosa Sharp Broth (MRSB) dan diinkubasikan pada suhu 37 °C selama 24 jam. Supernatan bebas sel diperoleh melalui sentrifugasi pada kecepatan 10.000 rpm pada suhu 4 oC selama 20 menit dan disaring menggunakan membrane saring sartorius. Supernatan bebas sel dinetralkan pH nya menjadi 5,8 – 6,2 dengan penambahan NaOH 1 N. Supernatan bebas sel netral siap diuji aktivitas antimikrobnya terhadap bakteri indikator dengan metode difusi sumur.
Purifikasi Plantaricin
Purifikasi plantaricin untuk mendapatkan plantaricin murni meliputi beberapa tahap, dan dijelaskan sebagai berikut.
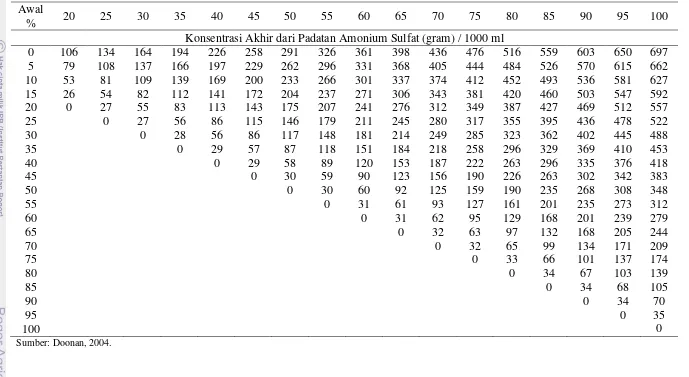
20 Tabel 2. Penggunaan Padatan Amonium Sulfat (% Penjenuhan)
Awal
% 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Konsentrasi Akhir dari Padatan Amonium Sulfat (gram) / 1000 ml
0 106 134 164 194 226 258 291 326 361 398 436 476 516 559 603 650 697
5 79 108 137 166 197 229 262 296 331 368 405 444 484 526 570 615 662
10 53 81 109 139 169 200 233 266 301 337 374 412 452 493 536 581 627
15 26 54 82 112 141 172 204 237 271 306 343 381 420 460 503 547 592
20 0 27 55 83 113 143 175 207 241 276 312 349 387 427 469 512 557
25 0 27 56 86 115 146 179 211 245 280 317 355 395 436 478 522
30 0 28 56 86 117 148 181 214 249 285 323 362 402 445 488
35 0 29 57 87 118 151 184 218 258 296 329 369 410 453
40 0 29 58 89 120 153 187 222 263 296 335 376 418
45 0 30 59 90 123 156 190 226 263 302 342 383
50 0 30 60 92 125 159 190 235 268 308 348
55 0 31 61 93 127 161 201 235 273 312
60 0 31 62 95 129 168 201 239 279
65 0 32 63 97 132 168 205 244
70 0 32 65 99 134 171 209
75 0 33 66 101 137 174
80 0 34 67 103 139
85 0 34 68 105
90 0 34 70
95 0 35
100 0
21 sartorius diameter 0,22 µm dan selanjutnya supernatan bebas sel dari setiap galur Lactobacillus plantarum dinetralkan pH nya menjadi 5,8 – 6,2 dengan menggunakan NaOH 1N diikuti dengan pengukuran pH menggunakan pH meter. Seluruh tahap ini dilakukan pada suhu dingin. Setiap supernatan antimikrob yang telah disaring steril diberi penambahan serbuk amonium sulfat hingga 80% penjenuhan secara bertahap (20%, 40%, 60%, dan 80%) untuk menghasilkan endapan protein, kemudian dihomogenkan secara perlahan pada suhu 4 oC selama 2 jam. Tabel penggunaan padatan amonium sulfat ditampilkan secara lengkap pada Tabel 1. Supernatan selanjutnya dipisahkan dan didapatkan presipitat bakteriosin. Presipitat dikoleksi pada labu erlenmeyer steril. Pengecekan protein bakteriosin hasil purifikasi diamati menggunakan Spektrofotometer UV-Vis pada λ= 280 nm.
Dialisis. Presipitat bakteriosin yang masih bercampur dengan ammonium sulfat didialisis dengan menggunakan membran dialisis berdiamater 20 µm dan buffer yang digunakan adalah potassium phosphate selama 12 jam, selanjutnya dilakukan penggantian buffer sebanyak dua kali di awal proses (2 jam dan 4 jam) pada suhu 4oC sehingga akan didapat ekstrak kasar bakteriosin yang berasal dari Lactobacillus plantarum selanjutnya disebut plantaricin. Pengecekan protein plantaricin hasil dialisis diamati menggunakan Spektrofotometer UV-Vis pada λ= 280 nm.
Purifikasi dengan Menggunakan Kromatografi Pertukaran Kation. Kolom terlebih dahulu diisi dengan resin SP Sepahrose-fast flow. Kolom dipasang penjepit bunsen kemudian buffer potassium phosphate pH 6,8 dituangkan ke dalam kolom. Buffer dibuang secara perlahan. Resin SP Sepahrose dimasukkan ke dalam kolom secara perlahan-lahan dengan menggunakan pipet pasteur dan dijaga agar tidak ada udara (gas) yang masuk ke dalam kolom. Resin akan menjadi gel. Diatas resin diberikan buffer dan kolom disimpan pada suhu dingin sampai siap untuk digunakan.
22 tabung koleksi didapatkan eluat yang berisikan plantaricin murni. Plantaricin murni disimpan pada suhu dingin (4oC) dan selanjutnya siap untuk dianalisis sifat dan karakteristiknya serta dilakukan pengecekan protein plantaricin hasil kromatografi kolom dengan menggunakan spektrofotometer UV-Vis pada λ= 280 nm (Hata, 2010).
Karakterisasi Plantaricin
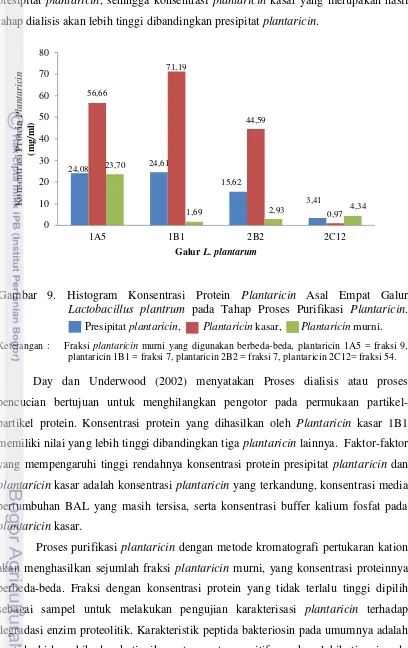
Sensitivitas terhadap Enzim Tripsin. Karakterisasi plantaricin dilakukan melalui uji sensitivitas plantaricin terhadap enzim tripsin. Enzim dan buffernya yang digunakan yaitu tripsin dalam 0,05 M Tris Hydrochloride (pH 7,0). Sampel-sampel plantaricin sebanyak 1 ml dihomogenkan dengan enzim tripsin (0,5 mg/ml). kemudian diinkubasi pada suhu 25 oC selama 60 menit. (Savadogo et al., 2004). Keberadaan protein plantaricin setelah mendapat perlakuan enzim proteolitik diukur absorbansinya pada λ= 280 nm.
23 merupakan luas daerah hambatan per satuan volum contoh bakteriosin yang diuji (mm2/ml). Aktivitas bakteriosin dapat dihitung menggunakan persamaan berikut :
Keterangan :
Lz = Luas zona bening (mm2) Ls = Luas sumur (mm2) V = Volume contoh (ml)
Keterangan :
A = Luang sumur (5mm)
B = Zona hambat / zona bening yang terbentuk C = Cawan petri (MHA dan bakteri indikator) Garis = Pengukuran diameter zona hambat pada 3
posisi yang berbeda
Gambar 6. Metode Pengukuran Zona Hambat
Rancangan dan Analisis Data
Rancangan dan analisis data meliputi rancangan atau metode statistik yang digunakan pada penelitian ini, perlakuan, model statistik yang digunakan, peubah yang diamati, dan analisis data yang digunakan. Rancangan dan analisis data pada penelitian ini meliputi produksi plantaricin, sensitivitas plantaricin murni1A5, 1B1, 2B2, dan 2C12 terhadap enzim tripsin, dan uji antagonistik plantaricin murni 1A5, 1B1, 2B2, dan 2C12 terhadap bakteri indikator.
Produksi Plantaricin
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan ulangan sebanyak tiga kali. Faktor perlakuan adalah galur Lactobacillus plantarum, dengan empat taraf perlakuan (galur 1A5, 1B1, 2B2, dan 2C12). Analisis data dilakukan secara deskriptif. Peubah yang diamati adalah nilai pH supernatan bebas sel, zona hambat hasil uji antagonistik supernatan bebas sel netral Lactobacillus plantarum, serta absorbansi dan konsentrasi protein plantaricin. Model statistik rancangan acak lengkap (RAL) adalah sebagai berikut.
C
24 Yij = µ + Pi+ €ij
Keterangan :
Yij = Variabel respon akibat pengaruh galur Lactobacillus plantraum ke-i pada ulangan ke-j.
µ = Nilai tengah umum.
Pi = Pengaruh perlakuan galur lactobacillus plantarum ke-i (i = 1A5, 1B1, 2B2, dan 2C12).
€ij = Pengaruh galat perlakuan ke-i pada ulangan ke-j (j = 1, 2, 3).
Sensitivitas Plantaricin Murni 1A5, 1B1, 2B2, dan 2C12 terhadap Enzim Tripsin
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan ulangan sebanyak tiga kali. Faktor perlakuan adalah galur Lactobacillus plantarum, dengan empat taraf perlakuan (galur 1A5, 1B1, 2B2, dan 2C12). Peubah yang diamati adalah persentase penurunan konsentrasi protein plantaricin. Model statistik rancangan acak lengkap (RAL) adalah sebagai berikut.
Yij = µ + Pi+ €ij Keterangan :
Yij = Variabel respon akibat pengaruh galur Lactobacillus plantraum ke-i pada ulangan ke-j.
µ = Nilai tengah umum.
Pi = Pengaruh perlakuan galur lactobacillus plantarum ke-i (i = 1A5, 1B1, 2B2, dan 2C12).
€ij = Pengaruh galat perlakuan ke-i pada ulangan ke-j (j = 1, 2, 3).
Data yang persentase penurunan konsentrasi protein plantaricin diuji asumsi, apabila hasilnya memenuhi uji asumsi maka data dianalisis dengan analisis ragam (anova). Bila hasil yang diperoleh nyata maka dilanjutkan dengan uji Tukey (Mattjik dan Sumertajaya, 2002).
Uji Antagonistik Plantaricin Murni 1A5, 1B1, 2B2, dan 2C12 terhadap Bakteri Indikator
25 adalah plantaricin asal galur Lactobacillus plantarum, dengan empat taraf perlakuan (galur 1A5, 1B1, 2B2, dan 2C12). Ulangan dilakukan sebanyak tiga kali. Peubah yang diamati adalah diameter zona hambat hasil uji antagonistik plantaricin murni 1A5, 1B1, 2B2, dan 2C12 terhadap bakteri indikator. Model statistik rancangan acak lengkap faktorial adalah sebagai berikut.
Yijk = µ + Pi + Yj + PYij+ €ijk Keterangan :
Yijk = Variabel respon akibat pengaruh enzim tripsin ke-i dan galur Lactobacillus plantarum ke- j pada ulangan ke-k.
µ = Nilai tengah umum.
Pi = Pengaruh perlakuan enzim proteolitik ke-i (i = tanpa tripsin, tripsin).
Yj = Pengaruh perlakuan galur Lactobacillus plantarum ke-j (j = 1A5, 1B1, 2B2, dan 2C12).
PYij = Pengaruh interaksi antara enzim proteolitik ke-i dengan galur Lactobacillus plantarum ke-j.
€ij = Pengaruh galat perlakuan ke-i dan ke-j, terhadap ulangan ke-k, k = 1, 2, 3.
26
HASIL DAN PEMBAHASAN
Karakteristik Galur Lactobacillus plantarum dan Bakteri Patogen
Karakteristik dari keempat bakteri asam laktat Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 serta bakteri patogen dapat dilihat pada Tabel 3. Hasil karakteristik morfologi dari keempat bakteri asam laktat Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 menunjukkan bahwa sel bakteri berbentuk batang, dengan susunan tunggal maupun berkoloni berbentuk rantai pendek. Ray dan Bhunia (2007) menyatakan, Lactobacillus plantarum tergolong dalam bakteri Gram positif, berbentuk batang tunggal maupun rantai pendek, tidak berspora, katalase negatif, dan anaerob fakultatif.
Hasil yang diperoleh pada penelitian ini sesuai dengan penelitian sebelumnya yang menyatakan bahwa kultur Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 memiliki morfologi berbentuk batang dengan susunan tunggal maupun rantai pendek (Firmansyah, 2009). Karakteristik morfologi yang dihasilkan menunjukkan bahwa kultur Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 yang digunakan murni atau tidak tercemar. Pengujian karakteristik kultur bakteri menurut Hidayati (2006) dapat didasarkan pada fenotipnya, seperti berdasarkan dinding selnya melalui pewarnaan Gram, serta bentuk atau morfologi dari masing-masing kultur tersebut.
27 Tabel 3. Karakteristik BAL Lactobacillus plantarum 1A5, 1B1, 2B2, 2C12, dan
Bakteri Indikator
Bakteri Pewarnaan Gram Morfologi Bentuk dan Susunan
L. plantarum 1A5 Positif Batang tunggal dan koloni berantai
L. plantarum 2C12 Positif Batang tunggal dan koloni berantai
pendek P. aeruginosa
ATCC 27853
Negatif Batang tunggal dan koloni berantai pendek
S. aureus ATCC 25923
Positif Bulat tunggal dan koloni seperti buah anggur
B. cereus Positif Batang tunggal dan berkoloni, terdapat
kantung spora S. Thypimurium
ATCC 14028
Negatif Batang tunggal dan berkoloni
E. coli
ATCC 25922
Negatif Batang tunggal dan bekoloni
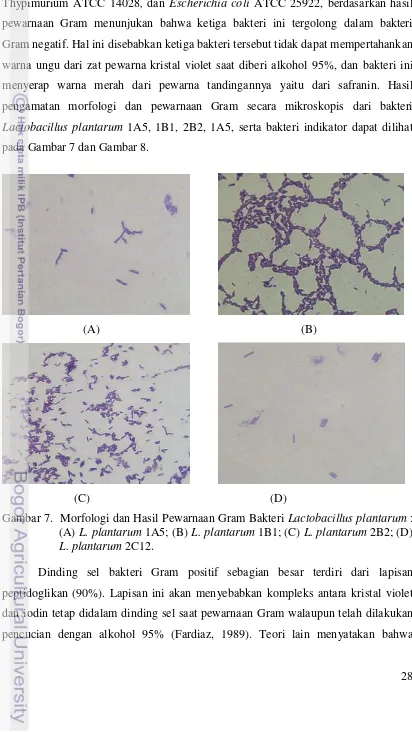
28 Bakteri Pseudomonas aeruginosa ATCC 27853, Salmonella enteritidis ser. Thypimurium ATCC 14028, dan Escherichia coli ATCC 25922, berdasarkan hasil pewarnaan Gram menunjukan bahwa ketiga bakteri ini tergolong dalam bakteri Gram negatif. Hal ini disebabkan ketiga bakteri tersebut tidak dapat mempertahankan warna ungu dari zat pewarna kristal violet saat diberi alkohol 95%, dan bakteri ini menyerap warna merah dari pewarna tandingannya yaitu dari safranin. Hasil pengamatan morfologi dan pewarnaan Gram secara mikroskopis dari bakteri Lactobacillus plantarum 1A5, 1B1, 2B2, 1A5, serta bakteri indikator dapat dilihat pada Gambar 7 dan Gambar 8.
(A) (B)
(C) (D)
Gambar 7. Morfologi dan Hasil Pewarnaan Gram Bakteri Lactobacillus plantarum : (A) L. plantarum 1A5; (B) L. plantarum 1B1; (C) L. plantarum 2B2; (D) L. plantarum 2C12.
29 bakteri Gram positif mempertahankan warna ungu disebabkan dinding sel mengalami dehidrasi saat ditetesi alkohol 95%, sehingga pori-pori menciut, daya rembes dinding sel dan membran menurun. Keadaan ini membuat kompleks kristal violet - iodin tidak dapat keluar dari sel, dan saat ditetesi degan safranin zat pewarna ini tidak dapat masuk ke dalam dinding selnya (Pelczar dan Chan, 2007).
(A) (B) (C)
(D) (E)
Gambar 8. Morfologi dan Hasil Pewarnaan Gram Bakteri – Bakteri Indikator: (A) Bacillus cereus; (B) Pseudomonas aeruginosa ATCC 27853; (C) Staphylococcus aureus ATCC 25923 ; (D) Salmonella enteritidis ser. Thypimurium ATCC 14028; (E) Escherichia coli ATCC 25922.
30
Produksi Plantaricin
Tabel 4 menunjukkan kondisi pH awal dari supernatan bebas sel dan kondisi pH setelah supernatan bebas sel dinetralkan menggunakan NaOH 1 N. Berdasarkan data pH pada Tabel 4, supernatan antimikrob yang dihasilkan berada dalam kondisi asam pada semua galur Lactobacillus plantarum. Kondisi asam ini disebabkan oleh adanya asam-asam organik yang merupakan metabolit primer bakteri asam laktat selama proses metabolismenya.
Asam organik tersebut adalah asam laktat, karena Lactobacillus plantarum merupakan bakteri asam laktat homofermentatif yang hanya menghasilkan asam laktat dari proses fermentasi karbohidrat (Ray dan Bhunia, 2007). Fardiaz (1989), menyatakan terbentuknya asam laktat dan asam organik oleh bakteri asam laktat dapat menyebabkan penurunan pH. Akibatnya mikroba yang tidak tahan terhadap pH yang relatif rendah akan terhambat pertumbuhannya. Data pH supernatan pada keempat galur Lactobacillus plantarum memiliki pH yang hampir sama, dan berkisar di pH 4. Roller (2003) menyatakan, asam organik dengan nilai pH 4 dapat menghambat pertumbuhan bakteri, sedangkan jika berada pada kisaran pH 5 dapat menghambat kapang dan khamir.
Tabel 4. Kondisi pH Supernatan Bebas Sel asal Empat Galur Lactobacillus plantarum pada Media MRS broth dengan inducer yeast extract (YE) 3% Galur Lactobacillus
plantarum
pH Supernatan Bebas Sel
Awal Netral
1A5 4,01 ± 0,04 6,11 ± 0,34
1B1 3,94 ± 0,11 5,87 ± 0,12
2B2 4,00 ± 0,02 6,17 ± 0,31
2C12 3,98 ± 0,01 6,04 ± 0,16
31 keempat galur Lactobacillus plantarum berada pada kisaran pH 5,8 hingga pH 6,2. Kisaran pH 5,8 – 6,2 digunakan karena pada kondisi tersebut aktivitas bakteriosin yang terkandung dalam supernatan bebas sel dapat optimal. Plantaricin PASM1 asal Lactobacillus plantarum A-1 yang diisolasi dari tortilla tanpa proses fermentasi, menunjukan aktivitas antimikrob yang optimal (90-100%) pada kisaran pH 5,5 hingga pH 7 (Hata et al., 2010).
Uji Antagonistik Supernatan Bebas Sel Netral Lactobacillus plantarum
Hasil uji antagonistik supernatan bebas sel netral asal empat galur Lactobacillus plantarum terhadap bakteri indikator disajikan secara lengkap pada Tabel 5. Uji antagonistik terhadap bakteri indikator ditunjukkan dengan adanya zona hambat yang terbentuk di sekitar sumur.
Tabel 5 . Diameter Zona Hambat Supernatan Netral Asal Empat Galur Lactobacillus plantarum terhadap Bakteri Indikator
Bakteri Indikator Galur Lactobacillus plantarum
1A5 1B1 2B2 2C12
Keterangan : Diameter lubang sumur (5 mm) termasuk ke dalam diameter zona hambat.
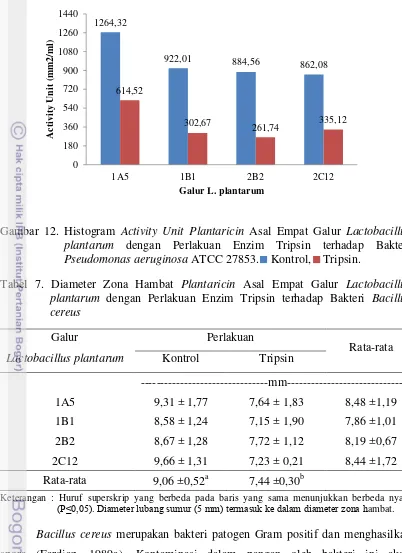
32 bakteri indikator yang digunakan. Besarnya diameter zona hambat dari keempat plantaricin terhadap bakteri indikator berkisar antara 7,46 mm hingga 18,00 mm.
Perbedaan ukuran zona hambat yang dihasilkan dapat dipengaruhi oleh beberapa faktor, diantaranya adalah konsentrasi bakteriosin yang terkandung di dalam supernatan bebas sel netral dari seriap galur berbeda-beda. Terlalu rendahnya konsentrasi bakteriosin yang terbentuk, maka akan menyebabkan aktivitas penghambatan untuk melawan bakteri indikator akan relatif rendah (Syahniar, 2009). Hal ini juga didukung oleh Todorov et al. (2004) yang menyatakan bahwa rendahnya aktivitas penghambatan pada media perlakuan dapat disebabkan oleh berkurangnya aktivitas antimikrob dari bakteriosin akibat sensitifnya peranan asam organik. Faktor lainnya adalah karakteristik dari bakteri indikator yang berbeda-beda. Bakteri indikator terdiri atas bakteri Gram negatif dan bakteri Gram positif. Tingkat sensitivitas kedua bakteri ini terhadap zat antimikrob sangat berbeda. Bakteri Gram positif lebih sensitif, sedangkan bakteri Gram negatif lebih resisten.
Aktivitas antimikrob supernatan netral ini menunjukkan adanya aktivitas bakteriosin dalam menghambat bakteri indikator. Aksi penghambatan bakteriosin terutaman efek bakterisidal terhadap bakteri sensitif diawali dengan destabilisasi fungsi membran sitoplasma. Destabilisasi ini berupa peningkatan permeabilitas membran, sehingga mengganggu keseimbangan barier dan dapat mengakibatkan kematian sel (Jack et al., 1995). Berdasarkan hasil uji antagonistik supernatan antimikrob netral terhadap bakteri indikator yang menunjukkan adanya aktivitas penghambatan, maka perlu dilakukan proses lanjutan yaitu purifikasi bakteriosin asal Lactobacillus plantarum 1A5, 1B1, 2B2, dan 2C12 yang selanjutnya disebut plantaricin. Purifikasi plantaricin meliputi purifikasi parsial dengan menggunakan presipitasi amonium sulfat, dialisis, dan purifikasi dengan menggunakan kromatografi pertukaran kation.
Purifikasi Plantaricin
33 tidak larut dalam endapan. Prinsip penambahan garam amonium sulfat 80% ke dalam supernatan bebas sel dari setiap galur Lactobacillus plantarum adalah untuk mengendapkan plantaricin yang merupakan protein, sehingga dapat dipisahkan dari substansi lainnya yang terkandung di dalam supernatan bebas sel netral. Keuntungan menggunakan garam ammonium sulfat karena mempunyai kelarutan tinggi, pH moderat, relatif lebih murah, non toksik, dan tidak mempengaruhi enzim (Tokuyasu et al., 1996). Hasil yang didapatkan pada purifikasi parsial ini disebut presipitat plantaricin.
Tahap purifikasi berikutnya adalah dialisis dalam kondisi dingin (4 oC). Proses ini dilakukan untuk menghilangkan garam amonium sulfat dan molekul berukuran kecil lainnya yang masih terkandung dalam presipitat plantaricin. Molekul plantaricin yang berukuran lebih besar akan terperangkap didalam membran dialisis, sedangkan garam amonium sulfat akan berdifusi keluar melewati membran dialisis. Hasil yang diperoleh dari tahap purifikasi ini disebut plantaricin kasar. Tahap purifikasi terakhir untuk mendapatkan plantaricin murni adalah purifikasi dengan menggunakan kromatografi pertukaran kation.
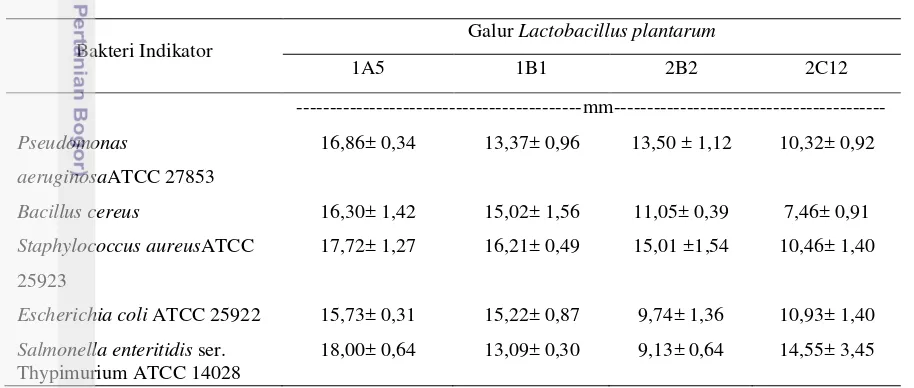
Pemisahan komponen secara kromatografi kolom dilakukan dalam suatu kolom yang diisi dengan fase stasioner dan cairan (pereaksi) sebagai fase mobil untuk mengetahui banyaknya komponen contoh yang keluar melalui kolom (Adnan, 1997). Purifikasi dengan kromatografi kolom menghasilkan sejumlah fraksi plantaricin murni dengan konsentrasi protein yang berbeda-beda. Pengecekan protein presipitat plantaricin, plantaricin kasar, dan plantaricin murni 1A5, 1B1, 2B2, serta 2C12 dilakukan menggunakan spektrofotometer UV-Vis. Hasil pengecekan protein disajikan secara lengkap pada Gambar 9.
34 presipitat plantaricin, sehingga konsentrasi plantaricin kasar yang merupakan hasil tahap dialisis akan lebih tinggi dibandingkan presipitat plantaricin.
Gambar 9. Histogram Konsentrasi Protein Plantaricin Asal Empat Galur Lactobacillus plantrum pada Tahap Proses Purifikasi Plantaricin. plantaricin
Keterangan : Fraksi plantaricin murni yang digunakan berbeda-beda, plantaricin 1A5 = fraksi 9, plantaricin 1B1 = fraksi 7, plantaricin 2B2 = fraksi 7, plantaricin 2C12= fraksi 54.
Day dan Underwood (2002) menyatakan Proses dialisis atau proses pencucian bertujuan untuk menghilangkan pengotor pada permukaan partikel-partikel protein. Konsentrasi protein yang dihasilkan oleh Plantaricin kasar 1B1 memiliki nilai yang lebih tinggi dibandingkan tiga plantaricin lainnya. Faktor-faktor yang mempengaruhi tinggi rendahnya konsentrasi protein presipitat plantaricin dan plantaricin kasar adalah konsentrasi plantaricin yang terkandung, konsentrasi media pertumbuhan BAL yang masih tersisa, serta konsentrasi buffer kalium fosfat pada plantaricin kasar.
Proses purifikasi plantaricin dengan metode kromatografi pertukaran kation akan menghasilkan sejumlah fraksi plantaricin murni, yang konsentrasi proteinnya berbeda-beda. Fraksi dengan konsentrasi protein yang tidak terlalu tinggi dipilih sebagai sampel untuk melakukan pengujian karakterisasi plantaricin terhadap degradasi enzim proteolitik. Karakteristik peptida bakteriosin pada umumnya adalah peptida hidropobik dan kationik, serta muatan positifnya akan lebih tinggi pada