ISOLASI, IDENTIFIKASI DAN KARAKTERISASI Lactobacillus
plantarum ASAL DAGING SAPI DAN APLIKASINYA PADA
KONDISI PEMBUATAN SOSIS FERMENTASI
SKRIPSI
NENY HIDAYATI
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
RINGKASAN
NENY HIDAYATI. D14201014. 2006 Isolasi, Identifikasi dan Karakterisasi Lactobacillus plantarum Asal Daging Sapi dan Aplikasinya pada Kondisi Pembuatan Sosis Fermentasi. Skripsi. Program Studi Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Rarah R.A. Maheswari, DEA. Pembimbing Anggota : Irma Isnafia Arief, S.Pt., M.Si.
Minat masyarakat terhadap makanan yang bermanfaat bagi kesehatan atau pangan fungsional yang semakin meningkat akhir-akhir ini mendorong industri pengolahan daging untuk memperbaiki kualitas produknya dengan mengembangkan kultur starter yang terbukti mampu mengontrol proses fermentasi. Salah satu contoh bakteri yang sering digunakan sebagai kultur starter adalah Lactobacillus plantarum. Kultur starter L. plantarum yang diisolasi dari dadih ternyata mampu meningkatkan kualitas sosis fermentasi dari daging DFD, walaupun masih kurang adaptif dan kurang optimal. L. plantarum yang diisolasi dari daging diharapkan mampu memberikan hasil yang lebih baik daripada kultur starter yang diisolasi dari bahan non-daging. Penelitian ini juga bermaksud mengetahui pertumbuhan L. plantarum
hasil isolasi pada pH dan kadar NaCl yang digunakan pada proses pembuatan sosis fermentasi.
Penelitian dilaksanakan dari bulan Agustus 2005 sampai Juli 2006 di Laboratorium Ruminansia Besar dan Laboratorium Ilmu Produksi Ternak Perah Bagian Mikrobiologi Hasil Ternak, Fakultas Peternakan Institut Pertanian Bogor. Daging sapi disimpan pada suhu kamar selama 12 dan 34 jam postmortem, kemudian diuji kualitasnya yang meliputi nilai pH, daya mengikat air, angka lempeng total bakteri (ALTB) dan total bakteri asam laktat (TBAL). Isolasi dilakukan untuk memperoleh BAL berdasarkan karakteristik morfologi dan biokimiawinya. Identifikasi menggunakan program PIBWin. L. plantarum hasil isolasi dikarakterisasi pertumbuhannya pada kondisi pembuatan sosis fermentasi yaitu pH 6,5, 6,0 dan 5,0 serta NaCl 2% dan 1,5%. Rancangan penelitian untuk persiapan sampel menggunakan Rancangan Acak Lengkap, sedangkan untuk karakterisasi menggunakan Rancangan Faktorial 2x3 dengan 3 kali ulangan kemudian dianalisis ragam. Hasil yang berbeda nyata pada karakterisasi dilanjutkan dengan uji kontras polinomial ortogonal.
Isolasi BAL dari daging sebanyak 45 isolat diidentifikasi sebagai
Lactobacillus fermentum, L. brevis, L. lactis dan L. plantarum. Isolat 1B1
yang dapat dicapai oleh kultur 1B1 (P<0,05). Kondisi media dengan pH 5 lebih sesuai untuk pertumbuhan L. plantarum 1B1 selama pembuatan sosis fermentasi karena mampu mengontrol laju fermentasi.
Kata-kata kunci: daging, daging sapi, Lactobacillus plantarum, sosis fermentasi,
ABSTRACT
Isolation, Identification and Characterization of Lactobacillus plantarum from Meat and Its Application in Condition of Fermented Sausage Production
Hidayati, N., R.R.A. Maheswari, and I.I. Arief
Nowadays, people are more concern in what they’re eating. High demand of functional food led meat-processing industry to enhance the quality of their product by using starter culture that is able to control the whole fermentation process.
Lactobacillus plantarum is a species of lactic acid bacteria that generally used as
starter culture in sausage fermentation. L. plantarum isolated from dadih tends to be able to increase quality of DFD meat fermented sausage, but its growth was not quite adaptive. The objective of this research was to isolate, identify and characterize L.
plantarum from meat, which is hoped that it will be more adaptable and giving a
better result than using L. plantarum isolated from non-meat products. It was also studied the characteristic of isolated Lactobacillus plantarum in different pH level and salt concentration based on fermentation sausage production. The research took place in Dairy Production Laboratory and Large Ruminant Laboratory, Department of Animal Production Science and Technology, IPB from August 2005 until July 2005. Meat used are collected from four traditional market in Bogor. After evaluated their pH, released mgH2O, TPC and TLAB, meat was isolated and identified by morfology and biochemical characteristics. Sample preparation used Complete Randomized Design and analized by Analysis of Variant. They were identified for their strain by using PIBWin software. L. plantarum which is found then characterized for their growth in pH 6,5, 6,0, 5,0 with 2% and 1,5% salt concentration. It used 2x3 Factorial Design and it’s growth rate and maximum population were analyzed by Analysis of Variant. Different result was continued to Contrast Polynomial Orthogonal Test. The 45 isolates that had been isolated from meat samples identified as Lactobacillus lactis, L. plantarum, L. fermentum dan L.
brevis. Isolate 1B1 identified as L. plantarum, which is short rod, round end, occur in
short chain, Gram positive and catalase negative. It was able to ferment L-arabinose, galactose, glucose, sorbitol, raffinose, maltose, lactose, sucrose, salicin, trehalose but was not able to ferment D-xylose and rhamnose. L. plantarum 1B1 could grow well in pH 5 to 6,5 with 2% and 1,5% NaCl concentration. Its population doubled in 1 hour and 5 minutes at MRSB media. Its growth rate was affected by pH media (P<0,01), but was not affected by NaCl concentration in the level of 1,5 and 2% (P<0,05). Maximum population of L. plantarum 1B1 was 4,0x109 cfu/ml. Both of pH media and NaCl concentration gave no effect in maximum population of L.
plantarum 1B1 (P<0,05). Media with pH 5 gave a better result in the growth of L.
plantarum if it applied to fermented sausage production because it was able to
control fermentation.
Keywords: meat, beef meat, Lactobacillus plantarum, fermented sausage, starter
ISOLASI, IDENTIFIKASI DAN KARAKTERISASI Lactobacillus
plantarum ASAL DAGING SAPI DAN APLIKASINYA PADA
KONDISI PEMBUATAN SOSIS FERMENTASI
NENY HIDAYATI
D14201014
Sripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
ISOLASI, IDENTIFIKASI DAN KARAKTERISASI Lactobacillus
plantarum ASAL DAGING SAPI DAN APLIKASINYA PADA
KONDISI PEMBUATAN SOSIS FERMENTASI
Oleh
NENY HIDAYATI
D14201014
Skripsi ini telah disidangkan di hadapan Komisi Ujian Lisan pada Tanggal 4 September 2006
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Rarah R.A. Maheswari, DEA Irma Isnafia Arief, S.Pt., M.Si.
NIP. 131 671 595 NIP. 132 243 330
Mengetahui
Dekan Fakultas Peternakan
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 23 Januari 1984 di Kudus, Jawa Tengah.
Penulis adalah anak kedua dari tiga bersaudara dari pasangan Bapak Suhadi dan Ibu
Amirin.
Penulis menyelesaikan pendidikan dasar pada tahun 1995 di SDN Kajar 2,
dilanjutkan dengan sekolah menengah pertama di SLTPN I Dawe Kudus selama
tahun 1995 – 1998. Penulis melanjutkan pendidikan menengah di SMUN 1 Bae
Kudus sampai tahun 2001. Penulis diterima sebagai mahasiswa Teknologi Hasil
Ternak, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur USMI
(Undangan Seleksi Masuk IPB) pada tahun 2001.
Selama mengikuti pendidikan di IPB, penulis menjadi pengurus Forum
Aktivitas Mahasiswa Muslim Al An’aam (FAMM Al An’aam) selama tahun 2002 –
2004. Penulis juga aktif sebagai pengurus UKM Forum for Scientific Studies IPB
(FORCES IPB) pada tahun 2004. Selain itu, penulis pernah terlibat dalam beberapa
kepanitiaan-kepanitiaan yang diadakan oleh DKM Al Hurriyyah IPB, Badan
Eksekutif Mahasiswa (BEM) Fakultas Peternakan dan kegiatan-kegiatan lain di luar
kampus. Penulis pernah menjadi asisten praktikum mata kuliah Dasar-Dasar
Teknologi Hasil Ternak (2004), Dasar Mikrobiologi Hasil Ternak (2004),
Mikrobiologi Hasil Ternak (2004), Metodologi dan Perancangan Percobaan (2005)
KATA PENGANTAR
Puji syukur kepada Allah SWT yang telah melimpahkan berbagai nikmat dan
karunia sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang
berjudul “Isolasi, Identifikasi dan Karakterisasi Lactobacillus plantarum Asal Daging Sapi dan Aplikasinya pada Kondisi Pembuatan Sosis Fermentasi”.
Salah satu perhatian masyarakat dunia sekarang ini adalah peningkatan
kualitas bahan pangan. Masyarakat menginginkan makanan yang tidak hanya
mengenyangkan, namun juga mempunyai nilai tambah dalam mencukupi kebutuhan
gizi dan juga menjaga kesehatan. Makanan-makanan tersebut kemudian dikenal
sebagai pangan fungsional yang umumnya berkaitan dengan proses fermentasi yang
melibatkan mikroorganisme-mikroorganisme menguntungkan.
Produk fermentasi dari daging yang dapat dikategorikan sebagai pangan
fungsional salah satunya adalah sosis fermentasi. Pembuatan sosis fermentasi
membutuhkan starter kultur yang diisolasi dari banyak sumber. Lactobacillus
plantarum merupakan bakteri asam laktat yang sering digunakan sebagai starter
kultur dalam fermentasi makanan. Isolasi Lactobacillus plantarum dari daging
diharapkan mampu memberikan alternatif starter kultur untuk sosis yang telah ada.
Penelitian ini juga berupaya memberikan informasi tentang karakteristik
Lactobacillus plantarum hasil isolasi dari daging pada media yang berbeda.
Pelaksanaan penelitian ini telah melibatkan banyak pihak dari dalam dan luar
IPB. Penulis mengucapkan terimakasih kepada semua pihak tersebut. Semoga tulisan
ini dapat menjadi sumber ilmu bagi siapa saja yang ingin mengetahui dan tertarik
dalam bidang pengolahan pangan dan peternakan.
Bogor, September 2006
DAFTAR ISI
Halaman
RINGKASAN ………... i
ABSTRACT ... iii
RIWAYAT HIDUP ………... vi
KATA PENGANTAR………... vii
DAFTAR ISI ……….. viii
Lactobacillus plantarum ……… 7
Pertumbuhan bakteri ... 9
METODE ………... 11
Seleksi dan Identifikasi ………... 20
Karakterisasi ………... 24
Kurva Pertumbuhan ………. 25
Waktu Generasi ... 29
KESIMPULAN DAN SARAN……… 32
Kesimpulan………...………. . 32 Saran ... 32
UCAPAN TERIMAKASIH………... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Nomor Halaman
1. Ciri-ciri Lactobacillus plantarum Berdasarkan Kemampuan
Memfermentasi Gula dari Berbagai Sumber ... 8
2. Kualitas Fisiko-kimia dan Mikrobiologi Daging Sebelum
Diisolasi ... 17
3. Hasil Identifikasi Isolat Asal Daging Sapi ... 21
4. Karakteristik Biokimiawi 1B1 dan Spesies Lain Hasil Isolasi
Berdasarkan Program PIBWin ... 23
5. Respon Waktu Generasi dan Populasi Maksimal terhadap
DAFTAR GAMBAR
Nomor Halaman
1. Kurva Pertumbuhan Bakteri ... 10
2. Bagan Alir Prosedur Isolasi, Identifikasi dan Karakterisasi Lactobacillus plantarum...………... 16
3. Isolat 1B1 dengan Perbesaran 1000x ... 24
4. Lactobacillus plantarum WCFS1 ... 24
5. Kurva Pertumbuhan 1B1 (kontrol) ... 25
6. Kurva Pertumbuhan 1B1 dalam Media MRSB dengan Nilai pH dan Konsentrasi NaCl yang Berbeda ... 28
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Sidik Ragam Nilai pH Daging Sapi pada Masa Simpan 12
dan 34 Jam ... 39
2. Hasil Sidik Ragam %mgH2O Daging Sapi pada Masa Simpan 12
dan 34 Jam ...……… 39
3. Hasil sidik Ragam ALTB Daging Sapi pada Masa Simpan 12 dan
34 Jam ...………... 39
4. Hasil sidik Ragam TBAL Daging Sapi pada Masa Simpan 12 dan
34 Jam ..………... 39
5. Daftar Nama Isolat Hasil Isolasi dari Daging Sapi ... 40
6. Gambar Hasil Pewarnaan Gram Beberapa Isolat Hasil Isolasi dari
Daging Sapi ... 41
7. Hasil Sidik Ragam Waktu Generasi dengan Perlakuan pH Awal
Media 6,5, 6, 5 dan Konsentrasi NaCl 2% serta 1,5% ... 42
8. Hasil Uji Kontras Polinomial Ortogonal Waktu Generasi Isolat 1B1 dengan Perlakuan pH Awal Media 6,5, 6, 5 dan Konsentrasi
NaCl 2% serta 1,5% ... 42
9. Hasil Sidik Ragam Populasi Maksimal Isolat 1B1 dengan Perlakuan pH Awal Media 6,5, 6, 5 dan Konsentrasi NaCl 2%
PENDAHULUAN
Latar Belakang
Perkembangan teknologi pengolahan daging mengalami kemajuan pesat
beberapa dekade terakhir, salah satunya adalah aplikasi teknologi fermentasi daging
dan produk-produk turunannya. Kemajuan ini semakin terpacu dengan meningkatnya
minat masyarakat dalam mengkonsumsi makanan yang termasuk pangan fungsional,
yaitu pangan yang melibatkan mikroorganisme-mikroorganisme yang aman
dikonsumsi dan bermanfaat bagi kesehatan. Mikroorganisme-mikroorganisme
tersebut dikenal sebagai generally recognized as safe (GRAS) organisms. Selain itu,
proses fermentasi dapat meningkatkan umur simpan produk dengan cara
menghambat mikroorganisme-mikroorganisme yang merugikan.
Industri pengolahan daging selalu berusaha memenuhi permintaan
masyarakat dengan terus menerus melakukan usaha peningkatan kualitas,
memperoleh hasil produksi yang seragam dan memperkuat karakteristik organoleptik
produk. Hal ini sulit didapat pada proses fermentasi spontan. Oleh karena itu, kultur
starter telah berusaha dikembangkan sejak 40 tahun terakhir. Bakteri-bakteri yang
umum digunakan sebagai starter sosis fermentasi berasal dari golongan
Streptococcus (Fardiaz, 1992), Micrococcus (Varnam dan Sutherland, 1995),
Lactobacillus plantarum, Lactobacillus sake, L. curvatus, Pediococcus lacidactici
dikombinasikan dengan Pediococcus pentosaceus (ErdoTMrul et al., 2002). Di
Indonesia, Lactobacillus plantarum banyak ditemukan pada sosis tradisional asal
Bali (urutan) (Arief et al., 2003).
Sekarang ini kultur starter untuk sosis dapat dikategorikan menjadi dua
kelompok. Generasi pertama mengandung bakteri asam laktat yang berasal dari
materi tumbuhan. Generasi kedua berasal dari materi daging yang secara khusus
diadaptasikan pada ekologi fermentasi daging. Lactobacillus sake dan L. curvatus
dari starter kultur generasi kedua (berasal dari materi daging) mampu mengontrol
keseluruhan fermentasi dan proses penguraian, serta menghambat pertumbuhan
bakteri asam laktat spontan (Hugas dan Monfort, 1997).
Lactobacillus plantarum mampu menghambat bakteri-bakteri patogen seperti
sehubungan dengan kemampuannya memproduksi asam laktat, H2O2 dan bakteriosin
seperti plantaricin. Selain itu L. plantarum merupakan bakteri probiotik yang
mampu bertahan sampai saluran pencernaan dan menciptakan keseimbangan
mikroflora usus. Kultur starter L. plantarum yang diisolasi dari dadih ternyata
mampu meningkatkan kualitas sosis fermentasi dari daging DFD, walaupun masih
kurang adaptif dan kurang optimal ditandai dengan berfluktuasinya viabilitas L.
plantarum selama proses (Arief et al., 2003 dan Hapsari et al., 2003). Penggunaan
kultur starter L. plantarum yang diisolasi dari daging diharapkan mampu
memberikan hasil yang lebih baik daripada L. plantarum yang diisolasi dari bahan
non-daging selama proses fermentasi sosis.
Kultur starter yang diperoleh diharapkan mampu diterapkan pada daging PSE
(pH di bawah 5,1), daging normal (pH 5,5-5,9) maupun daging DFD (pH di atas 6,5).
Selain itu kultur starter diharapkan mampu hidup pada kadar garam yang sering
ditambahkan dalam pembuatan sosis, yaitu 1,5% sampai 3,5%, sehingga perlu
diketahui karakteristik L. plantarum yang didapat pada media dengan kisaran pH dan
kadar garam tersebut.
Tujuan
Penelitian ini merupakan penelitian dasar yang bertujuan untuk mengisolasi,
mengidentifikasi dan mengkarakterisasi L. plantarum yang terdapat pada daging sapi.
Penelitian ini juga bermaksud mempelajari pertumbuhan L. plantarum yang didapat
pada pH dan kadar NaCl media yang berbeda sehingga dapat diterapkan dalam
TINJAUAN PUSTAKA
Daging dan Kualitasnya
Menurut Lawrie (1998), daging didefinisikan sebagai daging mentah (flesh)
dari hewan yang digunakan sebagai makanan. Pada praktiknya, definisi ini terbatas
pada beberapa lusin dari 3000 spesies mamalia; namun terkadang meluas meliputi
organ-organ seperti hati, ginjal, otak dan jaringan lain yang dapat dimakan.
Kualitas daging diartikan sebagai sejumlah sifat yang menentukan pada
daging itu yang berpengaruh terhadap penerimaan konsumen (Mountney, 1976).
Beberapa sifat/atribut indrawi lebih berkesan dibandingkan beberapa sifat yang lain.
Warna, daya mengikat air, dan beberapa aroma daging terdeteksi sebelum dan
sesudah pemasakan dan akan memberikan sensasi yang lebih lama terhadap
konsumen dibandingkan dengan juiciness, tekstur, keempukan, rasa dan kebanyakan
aroma yang terdeteksi saat pengunyahan (Lawrie, 1998)
Warna daging ditentukan oleh jumlah dan tipe myoglobin, status kimianya
dan kondisi fisik dan kimiawi komponen lain dalam daging (Lawrie, 1998).
Konsumen umumnya menyukai warna merah cerah akibat terjadinya oksimioglobin
pada permukaan daging yang terkena udara (Buckle et al., 1987).
Daya mengikat air oleh protein daging atau water holding capacity atau water
binding capacity (WHC atau WBC) merupakan kemampuan daging untuk mengikat
airnya atau air yang ditambahkan selama ada pengaruh kekuatan dari luar, misalnya
pemotongan daging, pemanasan, pendinginan dan pengolahan (Soeparno, 1994).
Daging dengan pH ultimat (nilai pH setelah 24 jam pemotongan) yang tinggi
mempertahankan kemampuan proteinnya dalam menahan air secara elektrostatis,
sementara pada pH normal, protein mendekati titik isoelektriknya dan tidak mengikat
air terlalu kuat. WHC berkurang pada daging PSE (pale, soft, exudative), yang dapat
menyebabkan keluarnya banyak cairan (Gregory dan Grandin, 1998).
Setelah pemotongan, aliran oksigen akan terhenti dan mitokondria tidak
berfungsi, sehingga glikogen otot terdegradasi menjadi asam laktat dan kandungan
ATP turun. Filamen-filamen aktin dan miosin kemudian saling bertaut, yang
kemudian disebut sebagai rigormortis. Glikogenolisis berlangsung sempurna setelah
sampai 5,8 sementara suhu daging masih berkisar 40oC, daging akan berubah
menjadi pucat, lunak dan berair (PSE) (Lücke, 1997). Menurut Hammes et al.
(2003), pH daging yang normal berkisar dari 5,6 sampai 5,8. Daging yang secara
alami mengandung sedikit glikogen atau kekurangan glikogen akibat kesalahan
penanganan, pH akhirnya dapat mencapai lebih dari 6,0 (Lücke, 1997).
Keempukan daging dipengaruhi oleh faktor antemortem, meliputi genetik
termasuk bangsa, spesies dan fisiologi, umur, manajemen, jenis kelamin, stress; dan
faktor postmortem yang meliputi pelayuan, pembekuan, temperatur penyimpanan
dan metode pengolahan (termasuk pemasakan dan penambahan bahan pengempuk).
Keempukan daging juga dapat disebabkan kasar halusnya tekstur daging. Semakin
halus tekstur daging, maka daging menjadi empuk. Selain itu juga dapat disebabkan
oleh kandungan lemak di dalam daging. Kadar lemak yang relatif tinggi akan
melarutkan atau menurunkan kandungan kolagen, sehingga daging menjadi empuk
(Soeparno, 1994).
Mikrobiologi Daging
Daging sangat memenuhi persyaratan untuk perkembangan mikroorganisme,
termasuk mikroorganisme perusak atau pembusuk. Hal ini disebabkan oleh: (1)
mempunyai kadar air yang tinggi (kira-kira 68% - 75%), (2) kaya akan zat yang
mengandung nitrogen dengan kompleksitas yang berbeda, (3) mengandung sejumlah
karbohidrat yang dapat difermentasikan, (4) kaya akan mineral dan kelengkapan
faktor untuk pertumbuhan mikroorganisme, dan (5) mempunyai pH yang
meng-untungkan bagi sejumlah mikroorganisme (5,3 – 6,5) (Soeparno, 1994).
Kebanyakan bakteri tumbuh di permukaan daging, namun tidak tertutup
kemungkinan ditemukan bakteri di dalam daging. Bakteri dapat mencapai jaringan
dalam karkas dengan berbagai cara, diantaranya melalui mekanisme berikut: (1)
jaringan ternak sehat dapat mengandung sebuah populasi kecil bakteri namun
dinamis bila bakteri secara terus-menerus memperoleh akses ke dalam jaringan
ternak hidup, dengan penetrasi membran mukosa saluran respirasi dan pencernaan,
untuk mengganti yang telah dibasmi oleh mekanisme ketahanan tubuh ternak, (2)
bakteri dari usus dapat menyerang jaringan karkas, baik selama pemotongan (agonal
invasion) maupun setelah pemotongan (postmortem invasion), (3) bakteri dapat
mengkontaminasi permukaan karkas dapat mempenetrasi ke lapisan jaringan otot
yang lebih dalam (Gill, 1982).
Umumnya, mikroorganisme tumbuh dengan baik pada pH sekitar 7,0
(6,6-7,0), beberapa mampu tumbuh di bawah 4,0 (Jay et al., 2000). Daging mentah secara
alam terkontaminasi dengan berbagai mikroorganisme, diantaranya Lactobacillus,
Carnobacterium, Micrococcus, Staphylococcus, Pseudomonas, Corynobacterium,
Enterococcus, Arthrobacter, Acinobacter, Brochothrix dan Listeria, serta
Enterobacteriaceae, kapang dan khamir (Rose, 1982). Enterobacteriaceae
psikro-tropik dapat juga ditemukan, sementara organisme Gram positif termasuk bakteri
asam laktat dijumpai dalam jumlah kecil (Lücke, 1997).
Sosis Fermentasi
Sosis fermentasi diartikan sebagai campuran daging dan lemak dengan garam,
nitrat dan atau nitrit, gula dan rempah-rempah yang diisikan pada casing dan melalui
masa fermentasi kemudian mengalami proses pengeringan (Hugas dan Monfort,
1997). Proses produksi sosis fermentasi pada prinsipnya adalah penggilingan dan
pencampuran (cutter), pengisian pada casing, fermentasi dan pemeraman (Hammes
et al., 2003).
Perbedaan sosis fermentasi dengan sosis lainnya adalah sosis fermentasi
mengalami proses pemeraman/fermentasi. Rahman (1989) menyebutkan fermentasi
merupakan pemanfaatan aktivitas mikroorganisme untuk menghasilkan
produk-produk tertentu. Produk utama dalam fermentasi sosis adalah asam laktat yang
dihasilkan oleh bakteri asam laktat. Molin (2003) menyatakan bahwa fermentasi
asam laktat memiliki beberapa manfaat, antara lain meningkatkan rasa dan
konsistensi produk dan juga memiliki efek-efek yang menguntungkan bagi kesehatan
yang dihasilkan dari konsumsi bakteri asam laktat yang masih hidup.
Sosis fermentasi umumnya diproduksi dalam bentuk produk kering atau
semi-kering, walaupun beberapa yang lain berada di antaranya. Sosis kering
mempunyai kelembaban 30-40%, secara umum tidak diasap dan dimakan tanpa
pemasakan, sedangkan sosis semi-kering mempunyai kelembaban sampai 50% dan
dipanaskan pada suhu 60-68oC (Jay, 2000).
Klasifikasi yang diterapkan untuk sosis kering atau semi-kering didasarkan
varietas Jerman banyak diproduksi di daerah Eropa Utara dan seringkali melalui
proses pengasapan dan dimasak secara tradisional. Sosis ini dibuat dari daging sapi
atau campuran daging sapi dan babi serta memakai bumbu-bumbu yang ringan.
Varietas Italia atau sosis kering berasal dari Eropa Selatan, dibuat dari daging babi,
penuh bumbu dan tidak dimasak maupun diasap. Bologna Lebanon merupakan
produk semua daging sapi yang diasap dengan kuat tetapi tidak dimasak (Bacus,
1984).
Spesies bakteri asam laktat yang umum digunakan sebagai kultur starter
adalah Lactobacillus sakei, L. curvatus, L. plantarum, Pediococcus lacidactici dan
Pediococcus pentosaceus. Kultur starter mungkin juga mengandung Micrococcus
varians, Staphylococcus carnosus subspp. carnosus dan utilis serta S. xylosus (Rose,
1982). Bakteri asam laktat bersama dengan mikrokokus dan khamir sebagai starter
memberikan dampak pada kualitas sensoris dan aroma sosis fermentasi. Starter
non-laktat berkontribusi dalam beberapa hal seperti reduktase nitrat dan nitrit, katalase
dan lipase (Hugas dan Monfort, 1997).
Syarat-syarat yang harus dimiliki oleh mikroorganisme agar dapat digunakan
sebagai kultur starter menurut Varnam dan Sutherland (1995) adalah: (1) mampu
berkompetisi dengan bakteri asam laktat yang secara alami terdapat dalam bahan
yang akan difermentasi, (2) menghasilkan asam laktat dalam jumlah yang cukup, (3)
toleran terhadap NaCl minimal sampai 6%, (4) toleran terhadap NaNO2 (min
100mg/kg), (5) hidup dalam suhu 15-40oC, (6) homofermentatif, (7) tidak proteolitik,
(8) tidak menghasilkan H2O2 dalam jumlah besar, (9) sebaiknya katalase positif, (10)
sebaiknya mampu mengurangi nitrat, (11) sebaiknya menguatkan cita rasa hasil akhir,
(12) sebaiknya tidak memproduksi senyawa biogenic amines, (13) sebaiknya tidak
menghasilkan lendir, (14) sebaiknya antagonis dengan bakteri patogen atau
mikroorganisme lain, dan (15) sebaiknya toleran atau sinergetik dengan komponen
starter lain.
Bakteri Asam Laktat
Bakteri asam laktat sering ditemukan secara alamiah dalam bahan pangan.
Bakteri ini hidup pada susu, daging segar, dan sayur-sayuran dalam jumlah yang
kecil (Jenie dan Rini, 1995). Bakteri asam laktat yang berasal dari bahan mentah atau
asam laktat dari penggunaan karbohidrat dan menurunkan nilai pH (5,9 – 4,6)
(Hugas dan Monfort, 1997).
Bakteri asam laktat (BAL) terdiri dari sejumlah genera dalam filum
Firmicutes. Genera-genera tersebut adalah Carnobacterium, Enterococcus,
Lactobacillus, Lactococcus, Lactosphaera, Leuconostoc, Melissococcus, Oenococcus,
Pediococcus, Streptococcus, Tetragenococcus, Vagococcus, dan Weisella (Beasley,
2004). Genus yang paling sering digunakan sebagai starter kultur dalam sosis
fermentasi adalah Lactobacillus, Pediococcus dan Streptococcus (Bacus, 1984).
Gevers (2002) menyebutkan bahwa BAL banyak digunakan dalam pangan
dan pakan, termasuk kultur starter untuk fermentasi, kultur probiotik dan kultur
pelindung untuk menghambat organisme tertentu yang bersifat perusak. Kemampuan
penghambatan yang dimiliki BAL dikarenakan BAL mampu merubah karbohidrat
menjadi asam-asam organik seperti asam laktat atau asam asetat (Erdo™rul, et al.
2002), selain itu BAL juga memiliki senyawa bakteriosin yang bersifat antagonistik
dengan bakteri lain (Bomberg et al., 2004).
Lactobacillus plantarum
Lactobacillus plantarum termasuk bakteri dalam filum Firmicutes, ordo
Lactobacillales, famili Lactobacillaceae, dan genus Lactobacillus. Lactobacillus
dicirikan dengan bentuk batang, biasanya panjang tetapi terkadang hampir berbentuk
bulat, umumnya dalam rantai-rantai pendek. Lactobacillus merupakan bakteri Gram
positif, tidak menghasilkan spora, anaerob fakultatif, koloninya dalam media agar
berukuran 2-5 mm, konfeks, opak/sedikit transparan dan tak berpigmen. Genus ini
tumbuh baik pada suhu 30-40oC dan tersebar luas di lingkungan terutama dalam
produk-produk pangan asal hewan dan sayuran. Mereka menetap dalam saluran
pencernaan unggas dan mamalia (Holt et al., 1994).
Lactobacillus plantarum merupakan bakteri berbentuk batang, umumnya
berukuran 0,7 – 1,0 sampai 3,0 – 8,0 mikron, tunggal atau dalam rantai-rantai pendek,
dengan ujung yang melingkar. Organisme ini cenderung berbentuk batang pendek
dalam kondisi pertumbuhan yang sesuai dan akan cenderung lebih panjang di bawah
kondisi yang tidak menguntungkan. Bakteri ini termasuk homofermentatif dengan
sedangkan menurut Costilow (1981), L. plantarum merupakan bakteri anaerob
fakultatif yang tumbuh dengan baik pada suhu 37oC.
Bakteri ini dapat dibedakan dengan bakteri lain berdasarkan kemampuannya
memfermentasi karbohidrat atau gula-gula tertentu. Ciri-ciri Lactobacillus
plantarum menurut beberapa sumber dapat dilihat pada Tabel 1.
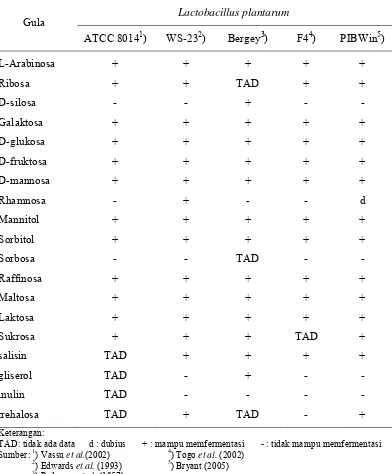
Tabel 1. Ciri – Ciri Lactobacillus plantarum Berdasarkan Kemampuannya Memfermentasi Gula dari Berbagai Sumber
Gula Lactobacillus plantarum
Lactobacillus plantarum telah berhasil diisolasi dari berbagai sumber.
Beberapa peneliti melaporkan telah berhasil mengisolasi bakteri ini dari anggur dan
wine (Edwards et al., 1993), fermentasi green-olive (Diaz et al., 1995),sosis kering
terfermentasi spontan Spanyol (Hugas dan Monfort, 1996), sosis sapi asam Thailand
(Sittimonchai dan Noonpakdee, 2001), bir opaque/Chibuku (Togo et al., 2002), sosis
fermentasi trasisional Bali/urutan (Antara et al., 2002), keju (Coeuret et al., 2003),
sourdough (Todorov et al., 2004) dan silo (Emanuel et al., 2005).
Lactobacillus plantarum umumnya lebih tahan terhadap keadaan asam dan
oleh karenanya menjadi lebih banyak terdapat pada tahapan terakhir dari fermentasi
tipe asam laktat. Bakteri ini sering digunakan dalam fermentasi susu, sayuran dan
daging (sosis). L. plantarum nampaknya paling banyak berperan dalam fermentasi,
karena suhu fermentasi yang digunakan lebih tinggi. Selain itu, fermentasi dari
Lactobacillus plantarum bersifat homofermentatif sehingga tidak menghasilkan gas
(Buckle et al., 1987).
Pertumbuhan Bakteri
Istilah pertumbuhan umum digunakan untuk bakteri dan mikroorganisme lain
dan biasanya mengacu pada perubahan di dalam hasil panen sel (pertambahan total
massa sel) dan bukan perubahan individu organisme (Pelczar dan Chan, 1986).
Pertumbuhan mikroorganisme dipengaruhi oleh faktor intrinsik dan ekstrinsik.
Faktor-faktor intrinsik meliputi pH, kandungan kelembaban/aktivitas air, potensial
oksidasi-reduksi, kandungan nutrisi, antimikroba dan struktur biologis, sedangkan
yang termasuk faktor-faktor ekstrinsik yaitu suhu, kelembaban relatif, konsentrasi
dan keberadaan gas di lingkungan serta keberadaan dan aktivitas mikroorganisme
lain (Jay, 2000).
Kisaran pH tempat mikroorganisme hidup diterangkan dalam tiga titik
kardinal: pH minimum, berada di bawah batas kemampuan tumbuh organisme; pH
maksimum, berada diatas batas kemampuan tumbuh dan pH optimum, dimana
organisme dapat tumbuh dengan baik. Tingkat pertumbuhan meningkat dengan
teratur diantara pH minimum dan optimum, dan menurun diantara pH optimum dan
maksimum (Todar, 2004).
Aktivitas air (aw) didefinisikan sebagai rasio tekanan uap air substrat dengan
kebutuhan air mikroorganisme. Bakteri pada umumnya hidup pada kisaran aw 0,9,
sedangkan khamir dan kapang masing-masing 0,88 dan 0,80 (Jay, 2000).
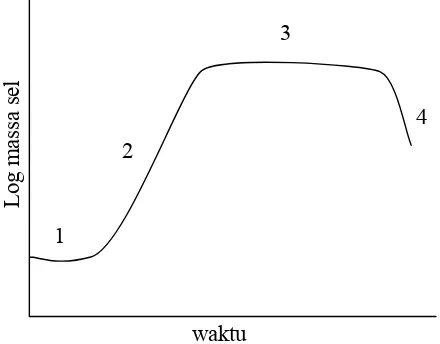
Menurut Gill (1982) daur pertumbuhan normal bakteri membentuk kurva
sigmoid yang terdiri dari empat fase, yaitu fase lamban atau lag phase, diikuti
periode pertumbuhan yang cepat (fase log), kemudian mendatar (fase statis atau
stationary phase), dan akhirnya diikuti oleh suatu penurunan populasi sel-sel hidup
(fase kematian atau death phase) (Gambar 1). Selama fase log, populasi bertambah
secara teratur, menjadi dua kali lipat pada interval waktu tertentu atau disebut waktu
generasi. Waktu generasi dapat juga dikatakan sebagai selang waktu yang
dibutuhkan bagi sel untuk membelah diri atau untuk populasi menjadi dua kali lipat
(Pelczar dan Chan, 1986).
Keterangan: 1. fase lamban 2. fase logaritmik 3. fase statis 4. fase kematian
Gambar 1. Kurva Pertumbuhan Bakteri Sumber: Gill (1982)
4 3
1
waktu
Log massa sel
METODE
Waktu dan Lokasi
Penelitian dilaksanakan dari bulan Agustus 2005 sampai Juni 2006.
Laboratorium yang digunakan adalah Laboratorium Ruminansia Besar dan
Laboratorium Ilmu Produksi Ternak Perah Bagian Mikrobiologi Hasil Ternak,
Departemen Ilmu Produksi dan Teknologi Peternak, Fakultas Peternakan, Institut
Pertanian Bogor.
Materi
Sampel daging sapi diperoleh dari lima lokasi di empat pasar tradisional di
Bogor yaitu Pasar Anyar, Pasar Cibeureum, Pasar Ciampea dan Pasar Gunung Batu.
Daging diambil secara acak (bukan berasal dari bagian-bagian karkas tertentu).
Media tumbuh yang digunakan adalah deMan Rogosa Sharpe Agar dan Broth
(MRSA dan MRSB). Bahan lain yang dibutuhkan adalah NaCl, aquades, alkohol,
H2O2 3%, Buffer Peptone Water (BPW), Plate Count Agar (PCA), NaOH 10%, HCl
1% dan bahan-bahan kimia untuk pewarnaan Gram (ungu kristal, yodium, alkohol
95%, safranin). Sejumlah gula murni yang diperlukan untuk pengujian kemampuan
fermentasi karbon oleh L. plantarum adalah arabinosa, galaktosa, glukosa, laktosa,
maltosa, manitol, raffinosa, rhamnosa, trehalosa, sukrosa, salisin, dan silosa.
Peralatan yang digunakan adalah alat penekan modifikasi Hamm, kertas
saring Whatmann no. 41, plannimeter, pH meter dan timbangan. Alat-alat yang
diperlukan dalam tahap pengisolasian starter kultur adalah waring blender, tabung
reaksi, cawan petri, ose, mikroskop, gelas objek, pH meter, inkubator, refrigerator,
hockey stick, autoklaf, spektrofotometer dan sterilisator. Pengidentifikasian isolat
menggunakan piranti lunak PIBWin (Probabilistic Identification Bacteria for
Windows) .
Rancangan
Penelitian menggunakan dua rancangan, yaitu rancangan untuk persiapan
sampel dan rancangan untuk karakterisasi L. plantarum. Persiapan sampel untuk
mengetahui kualitas fisiko-kimia dan mikrobiologi daging sebelum diisolasi
menggunakan Rancangan Acak Lengkap lima kali ulangan dengan perlakuan
Yij = µ + Ai + εij
Yij = respon kualitas yang diamati pada perlakuan taraf ke-i ulangan ke-j
µ = nilai tengah umum
Ai = pengaruh taraf perlakuan ke-i (masa simpan daging 12 dan 34 jam)
εij = galat percobaan
Karakterisasi L. plantarum pada media MRSB pada pH dan media yang
berbeda menggunakan Rancangan Faktorial 2x3 dengan 3 kali ulangan (Gomez dan
Gomez, 1995). Parameter waktu generasi dan populasi maksimal dianalisis ragam
dilanjutkan uji kontras polinomial ortogonal. Rancangan tersebut dapat ditulis
dengan rumus sebagai berikut:
Yij = µ + Ai + Bj + (AB)ij + εij
Keterangan:
Yij = respon parameter yang diamati
µ = nilai tengah umum
Ai = pengaruh taraf ke-i faktor A (pH media; 6,5, 6,0 dan 5,0)
Bj = pengaruh taraf ke-j faktor B (Kadar NaCl; 2% dan 1,5%)
ABij = pengaruh interaksi taraf ke-i faktor A dan taraf ke-j faktor B
εij = galat percobaan
Prosedur
Persiapan Sampel
Daging sapi segar sebagian disimpan selama 12 jam, terhitung dari masa
pemotongan pada suhu kamar dan sisanya dilanjutkan sampai 22 jam untuk sampel
hari kedua (34 jam setelah pemotongan). Daging sapi dibeli dari pasar setelah 6 jam
masa pemotongan kemudian daging disimpan pada plastik tertutup. Hal ini
dimaksudkan untuk meminimalkan kontaminasi dari lingkungan luar, sehingga
bakteri yang terisolasi merupakan bakteri alami yang terdapat dalam daging. Daging
kemudian diukur nilai pH, daya mengikat air, angka lempeng total bakteri (ALTB)
dan total bakteri asam laktatnya (TBAL).
Nilai pH Daging (AOAC, 1995).Pengukuran pH menggunakan pH-meter Corning.
Sebanyak 5 g sampel diblender bersama 45 ml akuades. Sebelumnya pHmeter
Daya Mengikat Air (Soeparno, 1994). Daya mengikat air (DMA) diukur
berdasarkan metode tekanan sesuai petunjuk Hamm. Sampel sebanyak 0.3 g
diletakkan diantara dua kertas saring, kemudian ditekan dengan beban seberat 35 kg
selama 5 menit. Daerah yang tertutup sampel daging dan daerah yang tertutup air
daging ditandai dan diukur dengan planimeter. Selisih kedua daerah disebut daerah
basah. Daya ikat air berbanding terbalik dengan mg H2O. mg H2O menyatakan
jumlah air bebas yang keluar dari daging dan dapat dihitung dengan rumus :
0
Analisis Kuantitatif Angka Lempeng Total Bakteri dan Jumlah Bakteri Asam
Laktat (APHA, 1992). Daging sebanyak 5 g diblender bersama 45 ml BPW sebagai
pengenceran pertama (P-1). Pengenceran selanjutnya dilakukan dengan memindahkan
1 ml pengenceran sebelumnya ke dalam 9 ml pengencer menggunakan pipet steril
sampai P-5. Tiap pengenceran dari P-2 sampai P-5 diambil sebanyak 0,1 ml ke dalam
cawan petri yang telah berisi ± 15 ml agar padat (PCA untuk ALTB dan MRSA
untuk TBAL). Sampel diratakan dengan stick hockey (metode spread plate)
kemudian diinkubasi pada suhu 37oC selama 48±2 jam.
Isolasi (Ogunbanwo et al., 2003 dan Reque et al., 2000).
Sebanyak 5 g sampel dihancurkan dalam waring blender selama 30 detik
bersama 45 ml MRSB, kemudian diinkubasi selama 48 jam pada suhu 37oC. Satu
ose kultur cair digoreskan pada cawan petri yang berisi agar padat menggunakan
metode kuadran lalu diinkubasi selama 48 jam pada suhu 37oC. Tiap koloni terpisah
diambil dan ditumbuhkan pada MRSB. Pemurnian kultur dilakukan dengan
menggoreskan kembali koloni yang terpisah serta pengamatan mikroskopik sel-sel
bakteri yang dihasilkan.
Isolasi dilakukan setelah pengayaan (enrichment) yang dimaksudkan untuk
memberi kesempatan kepada bakteri-bakteri yang terdapat dalam jumlah kecil atau
yang pertumbuhannya lambat dapat tetap hidup bersama spesies lain yang ada.
Media dibuat seoptimal mungkin bagi organisme-organisme yang diinginkan untuk
tumbuh sekaligus menghambat bakteri lain yang tidak diinginkan (Rahn, 1974).
Media yang digunakan dalam penelitian adalah deMan Rogosa Sharpe Broth
asam laktat yang meliputi spesies dari genus Lactobacillus, Streptococcus,
Pediococcus dan Leuconostoc (Oxoid, 2005). Masa dan suhu inkubasi yang dipilih
adalah 24 jam dan suhu 37oC yang merupakan kondisi yang optimal bagi L.
plantarum untuk hidup.
Identifikasi
Seleksi dilakukan dengan pewarnaan Gram (Hadioetomo, 1990) dan uji katalase
(Lay, 1994). Identitas kultur diketahui dari uji biokimiawi berdasarkan
kemampuannya memfermentasi beberapa jenis gula melalui bantuan program
PIBWin (Bryant, 2005).
Pewarnaan Gram (Hadioetomo, 1990). Sampel bakteri dari koloni yang homogen
dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri kemudian
digenangi dengan pewarna primer yaitu ungu kristal selama 1 menit, kemudian
dibuang kelebihan ungu kristal, dibilas dengan air suling dan ditiriskan. Setelah
kering, olesan bakteri digenangi dengan iodium Gram selama 2 menit, kemudian
dibuang kelebihan iodium, dibilas dengan air suling dan ditiriskan. Preparat
kemudian dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30
detik atau sampai zat warna ungu kristal tidak terlihat lagi mengalir dari kaca objek,
lalu dicuci segera dengan air suling dan ditiriskan. Preparat selanjutnya digenangi
pewarna tandingan yaitu safranin selama 30 detik, dibilas dengan air suling dan
ditiriskan. Preparat kemudian diamati di bawah mikroskop. Lactobacillus plantarum
akan menunjukkan warna biru gelap atau ungu (Gram positif) dengan sel bentuk
batang dan tersusun dalam rantai-rantai pendek.
Uji Katalase (Lay, 1994). Isolat diambil sebanyak satu ose, dioleskan pada gelas
objek yang telah disterilkan dengan alkohol. Gelas objek kemudian ditetesi larutan
H2O2 3%. Preparat diamati, bila terjadi gelembung gas maka menunjukkan bakteri
dengan katalase positif. Sampel yang sesuai dengan ciri-ciri L. plantarum yaitu Gram
positif dan katalase negatif kemudian diuji kemampuannya dalam memfermentasi
gula.
Uji Biokimiawi (Bryant, 2005). Jenis gula yang digunakan dalam uji ini adalah
arabinosa, galaktosa, glukosa, laktosa, maltosa, manitol, raffinosa, rhamnosa,
dalam tabung steril. Sampel berumur 48 jam sebanyak 4 tetes pipet Pasteur (±100μl)
dimasukkan ke dalam media uji, kemudian diinkubasi. Pengamatan dilakukan setelah
inkubasi 48 dan 72 jam pada suhu 37oC. Apabila warna larutan tetap merah (tidak
terjadi perubahan) maka menunjukkan tidak adanya fermentasi (-). Jika larutan
berubah menjadi kuning maka respon fermentasi (+), dan warna diantara merah dan
kuning berarti dubious (d).
Karakterisasi
Lactobacillus plantarum yang berhasil diisolasi dari daging dikarakterisasi
berdasarkan kemampuan tumbuhnya pada MRSB dengan pH sebesar 6,5, 6,0 dan 5,0
serta NaCl 2% dan 1,5%. Taraf perlakuan pada nilai pH dipilih berdasarkan pH
daging yang dapat digunakan sebagai bahan awal pembuatan sosis fermentasi, yaitu
daging DFD (pH 6,5), daging normal (pH 6,0) dan daging PSE (pH 5,0). Taraf
pemberian perlakuan NaCl diambil berdasarkan formulasi yang biasa digunakan
dalam pembuatan sosis, yaitu antara 1,5% sampai 3,5% (Bacus, 1984). Grafik
pertumbuhan akan dilihat melalui nilai kerapatan optis/optical density (OD)
disesuaikan dengan standar McFarlan II (populasi 8,0x108 cfu/ml).
Koloni dari media agar setelah 48 jam inkubasi, dilarutkan dalam MRSB
sampai nilai absorbansinya sama dengan standar McFarlan II (MRSB dijadikan
blanko). Kultur tersebut kemudian diencerkan sampai pengenceran 10-2, dan
ditumbuhkan pada 100 ml media perlakuan. Nilai absorbansi diukur lagi sebagai t0
(media perlakuan dijadikan blanko). Pengukuran dilakukan tiap dua jam sampai
bakteri mengalami fase stasioner. Selama masa pengukuran, bakteri diinkubasi pada
suhu 37oC.
Hasil absorbansi dikonversikan terhadap standar McFarlan II untuk
mengetahui jumlah populasi bakteri (cfu/ml). Pembuatan kurva pertumbuhan
dilakukan dengan membandingkan log populasi terhadap waktu (jam). Waktu
generasi, masa permulaan fase logaritmik, dan populasi maksimum dibandingkan
antar perlakuan. Waktu generasi ditulis dengan rumus sebagai berikut:
Keterangan:
G = waktu generasi
t = selang waktu pengukuran jumlah sel dalam populasi pada suatu saat dalam
fase log (B) dan kemudian lagi pada suatu titik waktu kemudian (t)
B = populasi awal
b = populasi setelah waktu t
log = log10
3,3 = faktor konversi log2 menjadi log10
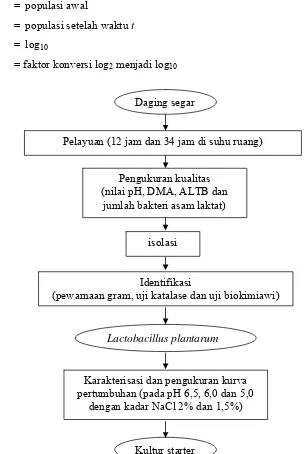
Gambar 2. Bagan Alir Prosedur Isolasi, Identifikasi dan Karakterisasi L. plantarum
Daging segar
Pelayuan (12 jam dan 34 jam di suhu ruang)
Pengukuran kualitas (nilai pH, DMA, ALTB dan
jumlah bakteri asam laktat)
isolasi
Identifikasi
(pewarnaan gram, uji katalase dan uji biokimiawi)
Karakterisasi dan pengukuran kurva pertumbuhan (pada pH 6,5, 6,0 dan 5,0
dengan kadar NaCl 2% dan 1,5%)
Kultur starter
HASIL DAN PEMBAHASAN
Persiapan Sampel
Nilai pH, mgH2O yang keluar, Angka Lempeng Total Bakteri (ALTB) dan
Total Bakteri Asam Laktat (TBAL) dari daging yang akan diisolasi diukur untuk
mengetahui kualitas fisiko-kimia dan mikrobiologinya (Tabel 2).
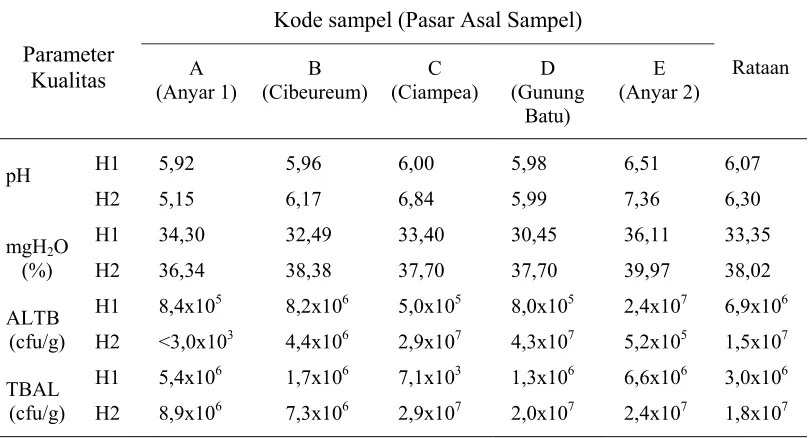
Tabel 2. Kualitas Fisiko-Kimia dan Mikrobiologi Daging Sebelum Diisolasi
Parameter Kualitas
Kode sampel (Pasar Asal Sampel)
Rataan
H1 : sampel dengan masa simpan 12 jam postmortem H2 : sampel dengan masa simpan 34 jam postmortem
Hasil pengukuran menunjukkan bahwa daging umumnya mengalami
peningkatan nilai di semua parameter kualitas yang diamati setelah 34 jam
penyimpanan. Perkecualian terdapat pada nilai pH dan ALTB daging A (Pasar
Anyar 1) serta ALTB daging E (Pasar Anyar 2). Berdasarkan perbedaan masa
simpan daging, respon mgH2O dan TBAL menunjukkan hasil yang berbeda nyata
pada selang kepercayaan 1%, sedangkan pada nilai pH dan ALTB berbeda nyata
pada selang kepercayaan 5% (Lampiran 1 s/d 4). Meningkatnya nilai pH, % mgH2O
yang keluar, dan jumlah mikroorganisme menunjukkan bahwa daging mengalami
penurunan kualitas setelah disimpan dalam suhu ruang selama 34 jam.
Kadar pH daging pada umumnya berkisar antara 5,5 – 5,9 (Lücke,1997) atau
menurut Hammes (2003) antara 5,6 dan 5,8. Daging dari kelima pasar tersebut
daging DFD (dark firm dry), yaitu daging yang memiliki pH antara 6,5 – 6,8
(Lawrie, 1998). Kebanyakan bakteri tumbuh di kisaran pH 6,5 – 7,5 dan tidak dapat
tumbuh dengan baik di bawah pH 5,0 dan di atas pH 8,5 (Fardiaz,1992). Sampel
daging yang diukur mempunyai pH yang memungkinkan bakteri untuk tumbuh
dengan baik.
Setelah penyimpanan selama 34 jam, pH daging mengalami peningkatan.
Hal ini disebabkan bakteri telah mendegradasi asam amino daging menjadi senyawa
NH3 yang menyebabkan lingkungan/daging menjadi basa. Bakteri-bakteri daging
pada awalnya menggunakan glukosa atau karbohidrat sebagai sumber energi
kemudian setelah gula habis, bakteri akan mulai menggunakan asam amino atau
protein (Gill, 1982). Glukosa dalam daging terdapat dalam jumlah yang sangat kecil,
yaitu sekitar 1,08% dari seluruh komponen penyusun daging, sementara yang
lainnya adalah air (75,5%), protein (18%), lemak (3 %) dan bahan-bahan lain
non-protein terlarut (2,5%) (Lawrie, 1998). Senyawa NH3 yang dihasilkan
bakteri-bakteri ini juga menyebabkan bau busuk dan citarasa yang tidak sedap. Hasil yang
berbeda didapat pada sampel daging A yang mengalami penurunan pH setelah
penyimpanan hari kedua. Hal ini mungkin terjadi bila bakteri baru akan
mendegradasi asam amino, sedangkan asam laktat yang terbentuk akibat penguraian
karbohidrat sebelumnya terdapat dalam jumlah yang signifikan, sehingga
menurunkan nilai pH daging.
Nilai mgH2O yang keluar berbanding terbalik dengan daya mengikat air
(DMA). Menurut Bacus (1984), kapasitas mempertahankan air minimal pada daging
adalah pada pH 5,0-5,01, yang merupakan rata-rata titik isoelektrik protein fibrillar
daging pada lingkungan ionik yang normal. Di bawah dan di atas pH tersebut,
kemampuan daging dalam mempertahankan air terikat (DMA) mulai meningkat.
Setelah satu hari penyimpanan ternyata lebih banyak air yang keluar. Air tersebut
mungkin berasal dari fermentasi glukosa pada hari sebelumnya karena salah satu
produk fermentasi yang dihasilkan oleh bakteri-bakteri heterofermentatif adalah air.
Angka lempeng total bakteri untuk keseluruhan sampel pada hari pertama
mempunyai nilai di atas standar yang ditetapkan oleh SNI, yaitu 5,0x105 cfu/g
kecuali dari pasar Ciampea, sehingga dapat dikatakan sanitasi penanganan daging
setelah 34 jam penyimpanan karena bakteri-bakteri tersebut terus berkembang biak.
Penurunan ALTB dijumpai pada sampel A yang kemungkinan terjadi akibat
terhambatnya beberapa mikroorganisme karena pH daging yang asam.
Bakteri-bakteri yang sering dijumpai dalam daging umumnya berasal dari golongan
Acinobacter,Aeromonas,Enterococcus,Moraxella,PseudomonasdanPsychrobacter
(Jay, 2000).
Bakteri asam laktat (BAL) terdapat pada daging dalam jumlah yang kecil.
BAL mempunyai senyawa-senyawa antimikroba selain juga menghasilkan asam
laktat dan peroksida yang mampu menghambat spesies lain (Gill, 1982), sehingga
BAL mampu berkompetisi dan dapat tetap tumbuh dalam daging. Selain itu,
peningkatan pH pada daging akibat penyimpanan masih dalam batas toleransi BAL
untuk tetap hidup. Menurut Togo, et al. (2002) beberapa spesies BAL masih dapat
hidup sampai pH 9,6.
Data mengenai kualitas daging sebelum isolasi perlu diketahui sebagai bahan
pertimbangan dalam penerapan kultur starter dalam sosis fermentasi. Bacus (1984)
menyebutkan bahwa L. plantarum, L. casei dan L. leichmanii yang diisolasi dari
daging fermentasi mempunyai kemampuan adaptasi yang tinggi terhadap
lingkungan tempat ia diisolasi dan akan mampu menunjukkan hasil yang baik jika
diterapkan kembali pada lingkungan sosis.
Isolasi
Prinsip isolasi adalah mengencerkan organisme sedemikian rupa sehingga
individu spesies dapat dipisahkan dari yang lainnya, dengan anggapan bahwa setiap
koloni yang terpisah yang tampak pada cawan petri setelah inkubasi berasal dari satu
sel tunggal. Metode isolasi yang digunakan adalah metode penggoresan (streak
plate) empat kuadran. Metode ini dipilih karena mempunyai dua keuntungan yaitu
menghemat bahan dan waktu (Hadioetomo, 1990). Setiap koloni tunggal yang
tampak diambil dan diinkubasikan kembali dalam media MRSB. Pemurnian kultur
dilakukan dengan mengulang penggoresan sampai didapat penampakan koloni yang
seragam. Sampel masa penyimpan 12 jam menghasilkan 29 isolat, sedangkan dari
sampel penyimpanan 34 jam diperoleh 16 isolat. Daftar nama-nama isolat
Seleksi dan Identifikasi
Seleksi dan identifikasi dilakukan untuk mengetahui ciri-ciri yang lebih
khusus atas isolat-isolat yang telah ditemukan. Uji-uji yang dilakukan adalah
pewarnaan Gram, uji katalase dan uji fermentasi beberapa jenis gula. Jika isolat
menunjukkan hasil yang negatif pada pewarnaan Gram dan positif pada uji katalase
maka uji fermentasi tidak dilakukan. Hal ini disebabkan L. plantarum merupakan
bakteri asam laktat yang bercirikan Gram positif dan katalase negatif (Pederson et
al., 1957). Seluruh isolat menunjukkan hasil Gram positif dan katalase negatif.
Melalui uji Gram dapat diketahui bahwa semua isolat berbentuk batang.
Beberapa diantaranya berukuran pendek dan memiliki ujung yang melingkar/round
end, sehingga menyerupai kokus. Sebagian isolat menampakkan diri dalam sel-sel
berantai panjang, namun terdapat juga yang muncul dalam rantai-rantai pendek
maupun diplobasil (Lampiran 6). Selama beberapa dekade, pembedaan antar genera
didasarkan pada karakter fenotipiknya. Lactobacilli secara umum merupakan bakteri
non-motil, bukan pembentuk spora, batang, dan Gram positif. Morfologi selnya
sangat variatif, dari yang berbentuk basil panjang, lurus, setengah melengkung
sampai berbentuk coryneform coccobacilli (Coeuret et al., 1984).
Identifikasi isolat menuju tingkat spesies semakin sulit karena adanya
variasi-variasi dalam atribut biokimia. Uji fermentasi karbohidrat/gula adalah salah
satu uji biokimia tersebut. Walaupun tiap spesies memiliki kemampuan yang
berbeda dalam memfermentasi gula, namun terkadang terdapat juga perbedaan di
dalam satu spesies, apalagi beberapa spesies tidak dapat dikenali karakteristik
fenotipnya dengan cepat. Hal ini berlaku pada kelompok Lactobacillus plantarum
(Lactobacillus plantarum, L. paraplantarum, dan L. pentosus), kelompok
Lactobacillus casei dan L. paracasei (Lactobacillus casei, L. rhamnosus, L. zeae dan
L. paracasei)(Coeuret et al., 2003).
Identifikasi isolat-isolat dalam penelitian ini menggunakan bantuan piranti
lunak PIBWin yang dikembangkan oleh Bryant (2005). Berdasarkan pengolahan
data diketahui bahwa isolat terbanyak adalah L. fermentum (90,24%), sedangkan
spesies yang lain adalah L. brevis, L. lactis dan L. plantarum (Tabel 3).
Lactobacillus fermentum dan L. plantarum juga ditemukan pada sosis fermentasi
menghasilkan sembilan grup isolat Lactobacillus tiga grup diantaranya adalah
Lactobacillus plantarum, empat grup dekat hubungannya dengan L. farciminis, dua
grup L. fermentum dan dua grup yang mirip dengan L. hilgardii.
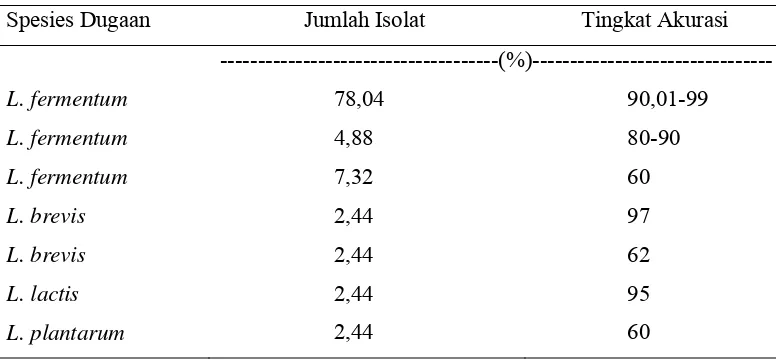
Tabel 3. Hasil Identifikasi Isolat Asal Daging Sapi
Spesies Dugaan Jumlah Isolat Tingkat Akurasi
---(%)---
L. fermentum 78,04 90,01-99
L. fermentum 4,88 80-90
Tingkat akurasi dalam program PIBWin dinyatakan sebagai ID score yaitu
nilai yang menentukan apakah program mampu mengidentifikasi tiap takson (strain).
Prosedur ini mempertimbangkan tiap takson berurutan dan memperlakukan
persentase probabilitas sebagai nilai positif atau negatif, membentuk Hypothetical
Median Organism (HMO) yang kemudian dikalkulasi menggunakan probabilitas
Willcox. Semakin tinggi nilai akurasi, maka isolat semakin mendekati ciri-ciri
bakteri yang disebutkan oleh program. Program ini juga menunjukkan
kemungkinan-kemungkinan spesies lain yang mungkin dengan nilai probabilitasnya
selain menyarankan uji-uji lain yang seharusnya dilakukan untuk memastikan
ketepatan pendugaan. Karakteristik spesies-spesies yang berhasil diisolasi
berdasarkan kemampuannya memfermentasi gula menurut PIBWin dapat dilihat
pada Tabel 4.
Metode pengidentifikasian spesies bakteri menggunakan kemampuannya
memfermentasi gula telah banyak dikembangkan melalui berbagai peralatan yang
praktis dan cepat. Selain program PIBWin, terdapat pula API 50 CH, LRA Zym dan
API Zym. Program-program ini telah digunakan pada pengidentifikasian laktobasili
dalam fermentasi green-olive Spanyol (Diaz, 1993), daging ayam (Reque, 2000), ubi
Kihal, 2004), dan beberapa penelitian lainnya. Namun, menurut Coeuret et al.
(2003), keabsahan tes-tes ini mulai dipertanyakan, beberapa spesies temuannya
masih meragukan dan terjadi beberapa kesalahan identifikasi yang patut
diperhitungkan. Hal ini disebabkan database pembuatnya tidak diperbaharui dan
terdapat beberapa spesies Lactobacillus yang tidak tercantum.
Metode taksonomi modern yang sekarang ini lebih tepat digunakan,
didasarkan pada metode pencetakan molekuler dan meliputi baik analisis fenotipik
maupun genotipik (Pérez et al., 2000). Beberapa metode-metode tersebut adalah
identifikasi Lactobacillus melalui protein-protein yang dihasilkan bakteri (protein
fingerprinting), enzim-enzim (multilocus enzyme electrophoresis), periwayatan
lemak oleh kromatografi gas (lipid profiling), hibridisasi fragmen asam nukleat
(hybridisation), pembandingan sekuensial gen rRNA (sequencing), reaksi rantai
polimerase (polymerase chain reaction/PCR), transfer DNA (ribotyping) dan
polimorfisme panjang fragmen PCR-restriction (restriction fragment length
polymorphism analysis/PCR-RFLP). Di antara metode-metode tersebut yang lebih
efektif dalam membedakan L. plantarum dengan spesies lainnya adalah multilocus
enzyme electrophoresis, sequencing, PCR, ribotyping dan PCR-RFLP (Coeuret et al.,
2003). Pengidentifikasian untuk tingkat strain membutuhkan metode lanjutan yang
lebih spesifik. Kebanyakan metode-metode di atas memerlukan biaya yang mahal,
sehingga belum dapat dilakukan dalam penelitian ini.
Kelemahan program PIBWin adalah program ini hanya memperhitungkan
nilai fermentasi yang pasti positif dan negatif, sedangkan nilai dubius/ragu-ragu
akan dianggap sebagai data hilang atau dianggap positif atau negatif. Hasil
identifikasi menggunakan PIBWin masih memerlukan penelitian lebih lanjut,
sehingga isolat-isolat yang ditemukan masih dinyatakan sebagai dugaan. Sebanyak
45 isolat yang berhasil diisolasi, hanya 1 isolat atau 2,44% yang memiliki ciri-ciri
mendekati L. plantarum (tingkat akurasi 60%), yaitu isolat 1B1.Hal ini dapat berarti
L. plantarum memang terdapat dalam jumlah sedikit dalam daging atau media
pengayaan yang kurang tepat sehingga pertumbuhannya tidak sebaik bakteri lain.
Program ini menyarankan untuk menambah pengujian fermentasi gula α
-Methyl-D-mannoside, melibiose dan uji homo/heterofermentasi, tetapi hal ini belum dapat
kemampuannya memfermentasi gula dibandingkan dengan karakteristik L.
plantarum dari database PIBWin dapat dilihat pada Tabel 4.
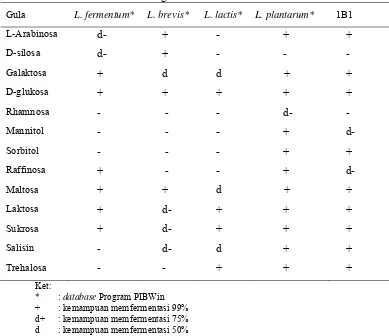
Tabel 4. Karakteristik Biokimiawi 1B1 dan Spesies Lain Hasil Isolasi Berdasarkan Program PIBWin + : kemampuan memfermentasi 99% d+ : kemampuan memfermentasi 75% d : kemampuan memfermentasi 50% d- : kemampuan memfermentasi 25% - : kemampuan memfermentasi 1% 1B1 : isolat hasil penelitian
Isolat 1B1 diisolasi dari daging yang berasal dari pasar Cibeureum dengan
masa simpan 12 jam postmortem. Bakteri ini tidak mempunyai kemampuan katalase,
Gram positif, berbentuk batang dan cenderung membentuk rantai-rantai pendek
(Gambar 2). Ciri-ciri ini sesuai dengan ciri-ciri L. plantarum dalam Bergey’s Manual
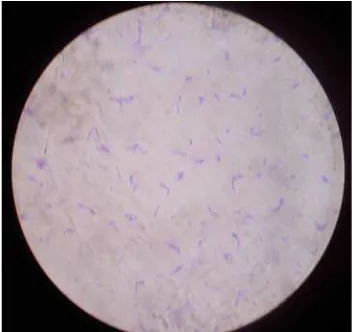
Gambar 3. Isolat 1B1 dengan Perbesaran 1000x
(a) (b)
Keterangan: (a) Lactobacillus plantarum WCFS1 dilihat dalam mikroskop biasa
(b) Lactobacillus plantarum WCFS1 dilihat dengan metode fluorescent in situ hybridisation (FISH).
Gambar 4. Lactobacillus plantarum WCFS1 Sumber: Vries (2005)
Karakterisasi
Isolat 1B1 kemudian diikuti pertumbuhannya dalam media MRSB tanpa
perlakuan (kontrol) yaitu NaCl 0% dan pH media MRSB tanpa perubahan serta dalam
media MRSB yang mempunyai kadar NaCl 1,5% dan 2% dikombinasikan dengan pH
5,0, 6,0 dan 6,5. Karakteristik 1B1 dalam media yang berbeda ditentukan melalui
kurva pertumbuhan, waktu generasi, waktu permulaan fase log dan populasi
maksimalnya.
Lactobacillus plantarum memiliki pH optimal 5,0-7,0 (Vassu, 2002) dengan
7
dianggap sebagai media yang tepat bagi 1B1 untuk hidup, sehingga kurva
pertumbuhan 1B1 dalam media tanpa perlakuan akan dijadikan sebagai pembanding
bagi perlakuan lainnya.
Kurva Pertumbuhan
Daur pertumbuhan 1B1 dalam media tanpa perlakuan menunjukkan bahwa
bakteri mengalami fase logaritmik saat memasuki jam kedua (Gambar 5). Bakteri
tidak mengalami fase adaptasi, karena media yang digunakan tidak berbeda dari
media tumbuh sebelumnya (MRSA dan MRSB). Menurut Fardiaz (1992), lamanya
fase adaptasi dipengaruhi oleh medium dan lingkungan pertumbuhan, serta jumlah
inokulum. Beberapa hal yang mungkin akan memperlambat fase adaptasi adalah
kultur yang dipindahkan kedalam media yang kandungan nutrisinya terbatas, mutant
yang baru terbentuk menyesuaikan diri dengan lingkungannya, dan kultur yang
dipindahkan dari fase statis ke medium baru dengan komposisi sama seperti
sebelumnya. Wassenaar (2003) menyatakan bahwa pemindahan kultur (pengambilan
sampel dengan pipet), sentrifugasi atau prosedur-prosedur penanganan sederhana juga
mampu memperlambat fase adaptasi karena proses-proses tersebut mengakibatkan
tekanan singkat. Bakteri-bakteri bahkan dapat merasakan jika kerapatan selularnya
berubah, sebuah proses yang dinamakan quorum sensing.
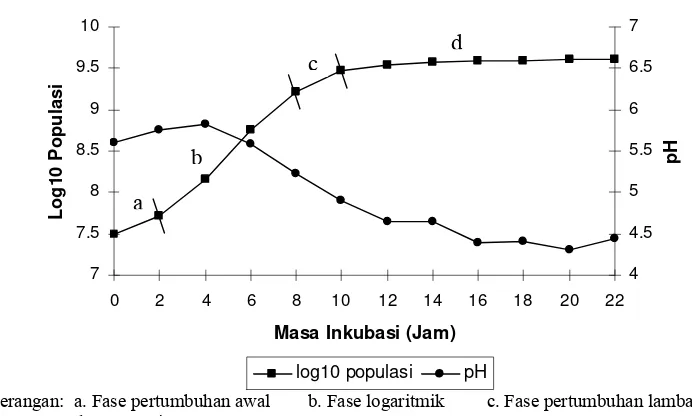
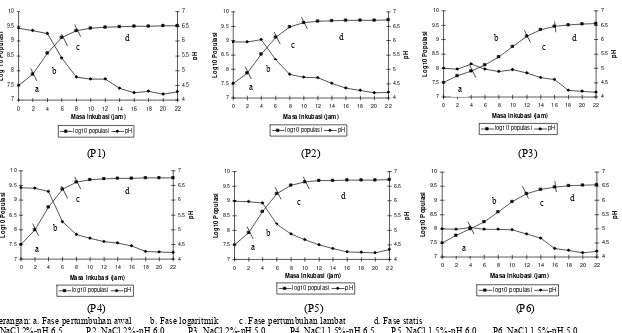
Keterangan: a. Fase pertumbuhan awal b. Fase logaritmik c. Fase pertumbuhan lambat d. Fase statis
Isolat 1B1 langsung memasuki fase pertumbuhan awal, yaitu fase saat sel
mulai membelah dengan kecepatan rendah karena baru memasuki tahap penyesuaian
diri. Fase logaritmik 1B1 berlangsung selama ± 6 jam. Selama fase ini, jumlah
populasi meningkat dua kali lipat sejalan dengan terjadinya pembelahan biner. Waktu
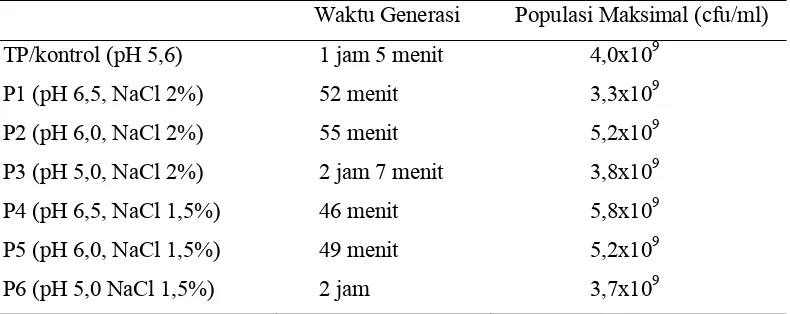
yang diperlukan 1B1 untuk membelah menjadi dua adalah 1 jam 5 menit (Tabel 5).
Waktu generasi umumnya berkisar dari 20 menit sampai 20 jam tergantung dengan
spesies/strain bakteri dan kondisi selama fase log pertumbuhan (Abedon, 1999).
Bakteri tidak selamanya mengalami peningkatan populasi. Jam ke-8, kultur
mulai mengalami fase pertumbuhan lambat, yaitu jumlah sel yang lahir mulai
seimbang dengan jumlah sel yang mati. Setelah itu, jumlah bakteri yang lahir akan
sama dengan jumlah sel yang mati atau disebut sebagai pertumbuhan stasioner. Saat
bakteri berada pada jumlah yang tetap, maka akan diketahui populasi maksimal yang
dapat dicapai. Populasi awal kultur saat perhitungan adalah 3,2x107 cfu/ml, setelah 10
jam jumlah maksimal populasi mencapai 4,2x109 cfu/ml. Jika dilanjutkan, populasi
akan mengalami penurunan atau masuk dalam fase kematian. Pengukuran kurva
pertumbuhan dalam penelitian ini menggunakan metode perbandingan kerapatan
optis bakteri dengan standar, yang memiliki kelemahan yaitu jumlah partikel baik
materi hidup maupun mati yang terukur dianggap sebagai jumlah sel sehingga tidak
dapat diketahui kapan bakteri masuk fase kematian.
Kurva pertumbuhan ini berkebalikan dengan laju perubahan pH. Selama fase
pertumbuhan awal dan dua jam pertama dari fase logaritmik, bakteri memfermentasi
sumber karbon dengan jumlah yang stabil. Seiring dengan bertambahnya jumlah
populasi, maka karbon yang dimetabolisme pun semakin banyak. Hal ini
menyebabkan bertambahnya jumlah asam yang terbentuk. Jam ke-16, kadar pH
media mulai stabil, yaitu sekitar 4,39. Kondisi asam yang diciptakan oleh bakteri
pada akhirnya mulai menghambat laju pertumbuhan dan menyebabkan kematian.
Lactobacillus umumnya dapat hidup dengan baik pada kisaran pH 5,5 – 5,8, sehingga
media dengan pH di bawah nilai tersebut akan menghambat pertumbuhan.
Nilai pH akhir kultur masih lebih asam jika dibandingkan dengan pH akhir
kebanyakan sosis fermentasi European-style. Keasaman sosis jenis ini yang disukai
oleh konsumen memiliki pH sekitar 4,8 – 5,0 (Lücke, 1997). Di bawah nilai itu, sosis
untuk beberapa jenis sosis seperti summer sausages, German cervelat dan Bologna
sausages pH sekitar 4,4 – 5 masih dapat diterima (Rose, 1982).
Sodium klorida (NaCl) atau garam ditambahkan dalam produk daging
fermentasi untuk mendapatkan ikatan yang diinginkan (yaitu ekstraksi miosin),
penambah citarasa dan juga sebagai pengawet. Garam adalah komponen utama yang
mengijinkan bakteri asam laktat untuk mendominasi dan menghambat banyak
mikroorganisme yang tidak diinginkan. Umumnya sosis fermentasi diformulasi
dengan garam 1,5% sampai 3,5% (Bacus, 1984). Penggunaan NaCl sebagai pengawet
berkaitan dengan kemampuan NaCl menurunkan aw NaCl 1,7% (w/v) setara dengan
aw 0,99 dan NaCl 3,5% setara dengan aw 0,98 (Jay, 2000), sehingga perlakuan NaCl
dalam penelitian ini kira-kira setara dengan aw 0,99. Fardiaz (1992) menyatakan
bahwa aw minimal yang dibutuhkan bakteri untuk hidup adalah 0,91, sedangkan
khamir dan kapang secara berturut-turut adalah 0,88 dan 0,80. Pertumbuhan isolat
1B1 dalam berbagai kombinasi perlakuan dapat dilihat pada Gambar 6.
Kurva pertumbuhan 1B1 dengan pH 6,5 memasuki fase pertumbuhan
logaritmiknya pada jam ke-2 dan mulai melambat pada jam ke-6. Fase pertumbuhan
lambat berlangsung lebih lama pada perlakuan garam 2%. Isolat 1B1 memasuki fase
stasioner dengan sempurna pada jam ke-10. Nilai pH akhir isolat pada perlakuan pH
awal 6,5 ini tidak jauh berbeda baik pada garam 1,5% maupun 2%, yaitu 4,28 dan
4,22.
Perlakuan pH awal 6 memberikan hasil yang tidak terlalu berbeda dengan
kurva pertumbuhan 1B1 pada pH 6,5. Isolat 1B1 mengalami fase pertumbuhan
logaritmik dari jam 2 sampai jam 6, dan memasuki fase stasioner pada jam
ke-10. Nilai pH pada akhir pengukuran adalah 4,2 pada konsentrasi garam 2% dan 4,34
pada konsentrasi garam 1,5%.
Kurva pertumbuhan 1B1 dengan pH 5,0 menunjukkan perbedaan yang nyata
dengan kurva kontrol dan kurva-kurva yang lain. Fase pertumbuhan awal berlangsung
selama 4 jam dan fase logaritmik selesai pada jam ke-12. Isolat 1B1 membutuhkan
waktu sekitar 18 jam untuk masuk ke dalam fase stasioner. Kurva yang cenderung
melandai ini disebabkan oleh media yang lebih asam dibandingkan dengan pH media
kontrol, sehingga bakteri membutuhkan masa penyesuaian yang lebih lama. Menurut
7
mengurangi jumlah awal sel, memperpanjang adaptasi semaksimal mungkin,
memperlambat fase pertumbuhan logaritmik dan mempercepat fase kematian sel.
Perlakuan pH 5,0 tidak mempercepat fase kematian maupun memperlambat
fase pertumbuhan, walaupun waktu generasi 1B1 pada media pH 5,0 lebih lama.
Kurva ini dapat berguna dalam proses fermentasi sosis karena tingkat fermentasi yang
lebih lambat pada suhu yang lebih rendah biasanya lebih disukai dan diinginkan
dalam mengkontrol pH akhir dan perkembangan citarasa, warna dan karakteristik
produk yang lain (Bacus, 1984). Populasi akhir sebanyak 3,8x109 cfu/ml juga tidak
jauh berbeda dengan populasi akhir 1B1 pada media yang lain. Nilai pH akhir kultur
pada kadar NaCl 2% dan 1,5% adalah 4,16 dan 4,2. Menurut Jay (2000), pH akhir
sosis yang difermentasi menggunakan kultur starter berkisar pada nilai 4,0 sampai 4,5.
Pemberian perlakuan penambahan garam sebanyak 2% dan 1,5% sepertinya
tidak banyak memberi pengaruh pada kurva pertumbuhan. Hal ini dapat disebabkan
selang taraf yang terlalu dekat. Bacus (1984) menyatakan bahwa garam dengan
konsentrasi 2% pada sosis fermentasi merupakan konsentrasi minimal untuk
mendapatkan ikatan (ekstraksi miosin) yang disukai sedangkan konsentrasi garam di
atas 3% akan mulai memperpanjang waktu fermentasi sosis.
Waktu Generasi
Perbedaan dalam sifat-sifat sel suatu organisme dan pertumbuhannya
menyebabkan perbedaan dalam kecepatan pertumbuhan. Semakin kompleks suatu
organisme, semakin lama waktu yang dibutuhkan sel untuk membelah. Waktu
generasi dan populasi maksimal kultur 1B1 berdasarkan perlakuan yang diberikan
ditampilkan pada Tabel 5.
Tabel 5. Respon Waktu Generasi dan Populasi Maksimal terhadap Perlakuan Waktu Generasi Populasi Maksimal (cfu/ml)
y = 0,82x2 - 10,24x + 32,76
Hasil sidik ragam menyatakan bahwa perlakuan pH sangat mempengaruhi
lama waktu generasi (P<0,01), sedangkan penambahan NaCl pada taraf 1,5% dan 2%
tidak memberikan pengaruh yang nyata (Lampiran 6). Kedua perlakuan tidak saling
berinteraksi dalam memberikan pengaruh kepada waktu generasi. Ketiga taraf pH
memberikan hasil yang berbeda, pola respon dari faktor pH membentuk pola
kuadratik dengan taraf pH 5% memberikan penghambatan paling tinggi terhadap
waktu generasi dibandingkan dengan taraf yang lain.
Gambar 7. Pola Hubungan pH dengan Waktu Generasi Isolat 1B1
Faktor-faktor pertumbuhan saling berhubungan dalam memberikan kondisi
tumbuh bagi mikroorganisme. Kadar pH dan aw merupakan faktor yang dapat
menghambat pertumbuhan, jika keduanya berada di bawah taraf minimum
mikroorganisme untuk tumbuh. Kedua faktor ini tidak saling berinteraksi pada taraf
NaCl 1,5% dan 2% karena taraf ini masih dalam batas toleransi bakteri untuk hidup
(aw ± 0,99). Perlakuan NaCl dalam taraf ini juga tidak memberikan hasil yang
berbeda pada waktu generasi. Hal ini menunjukkan bahwa 1B1 dapat hidup dalam
kadar pH 2%. L. plantarum masih dapat hidup dengan baik pada kadar garam 5,5%
(Pederson, et al., 1957) atau sekitar 4% - 8% menurut Vassu (2002). Hasil yang tidak
berbeda nyata juga dapat disebabkan pemilihan taraf yang terlalu dekat. Diperlukan
penelitian lebih lanjut untuk mengetahui kemampuan tumbuh 1B1 pada selang yang
lebih luas.
Pola respon perlakuan pH mengikuti kurva kuadratik. Melalui persamaan
yang didapat, dapat diketahui kadar pH yang diperlukan untuk mendapatkan waktu
menyatakan bahwa frekuensi waktu generasi bakteri berkisar dari 20 menit sampai
140 menit, dengan rata-rata terbanyak pada kisaran 45 menit.
Populasi Maksimal
Populasi maksimal adalah populasi kultur terbanyak setelah melewati fase
logaritmik dan sebelum mengalami fase kematian. Populasi maksimal 1B1 berada
pada kisaran 109 dengan hasil tertinggi yaitu 5,8x109 cfu/ml pada perlakuan pH 6,5
dan NaCl 2% (Tabel 5). Hasil sidik ragam menunjukkan bahwa keenam kombinasi
perlakuan tidak memberikan hasil yang berbeda (P<0,05), sehingga baik faktor pH
maupun NaCl tidak mempengaruhi populasi akhir bakteri (Lampiran 7). Di antara
kedua faktor ini juga tidak menunjukkan adanya interaksi.
Lactobacillus plantarum 1B1 sepertinya merupakan bakteri halofilik ringan
(mampu hidup pada kadar NaCl 1% - 6%), karena menurut Barba et al. (1994) bakteri
Lactobacillus plantarum dapat hidup dengan baik pada NaCl 6%, dan dapat
menghasilkan bakteriosin dengan maksimal pada kadar 2,3% - 2,5% (Sanchez, 2002).
Salah satu syarat suatu mikroorganisme dapat digunakan sebagai kultur starter
adalah kemampuannya mentoleransi garam minimal sampai 6% (Varnam dan
Sutherland, 1995). Para produsen kultur komersial untuk fermentasi daging biasa
menyimpan kulturnya pada konsentrasi garam minimal 0,5%. Hal ini dimaksudkan