PENGUJIAN MUTU BENTUK SEDIAAN NATRIUM
DIKLOFENAK YANG BEREDAR DI APOTEK KOTA MEDAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Unta
OLEH:
Yanti Juliatri
NIM 101501001
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGUJIAN MUTU BENTUK SEDIAAN NATRIUM
DIKLOFENAK YANG BEREDAR DI APOTEK KOTA MEDAN
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
YANTI JULIATRI
NIM 101501001
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENGUJIAN MUTU BENTUK SEDIAAN NATRIUM
DIKLOFENAK YANG BEREDAR DI APOTEK KOTA MEDAN
OLEH:
YANTI JULIATRI
NIM 101501001
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 13 Agustus 2015
Pembimbing I, Panitia Penguji,
Drs. Agusmal Dalimunthe, MS., Apt. Prof. Dr. Karsono, Apt.
NIP 195406081983031005 NIP 195409091982011001
Pembimbing II, Drs. Agusmal Dalimunthe, MS., Apt.
NIP 195406081983031005
Dra. Juanita Tanuwijaya, M.Si., Apt.
NIP 195111021977102001 Dra. Djendakita Purba, M.Si., Apt.
NIP 195107031977102001
Drs. Suryanto, M.Si., Apt.
NIP 196106191991031001
Medan, September 2015 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan
iv
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan
anugerah dan karuniaNya kepada penulis sehingga dapat menyelesaikan
penyusunan skripsi ini yang berjudul “Pengujian Mutu Bentuk Sediaan Natrium
Diklofenak Yang Beredar Di Apotek Kota Medan” sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini, penulis hendak menyampaikan rasa hormat dan
terima kasih yang sebesar-besarnya kepada Ibu Dr. Masfria, MS., Apt., selaku
Pejabat Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah
memberikan bantuan dan fasilitas selama pendidikan. Ucapan terima kasih juga
disampaikan kepada Bapak Drs. Agusmal Dalimunthe, M.Si., Apt., dan Ibu Dra.
Juanita Tanuwijaya, M.Si., Apt., selaku pembimbing yang telah memberikan
waktu, bimbingan dan nasehat selama penelitian hingga selesainya penyusunan
skripsi ini. Ucapan terima kasih juga disampaikan kepada Bapak Prof. Dr.
Karsono., Apt., Ibu Dra. Djendakita Purba, M.Si., Apt., dan Bapak Drs. Suryanto,
M.Si., Apt. selaku dosen penguji yang telah memberikan saran, arahan, kritik dan
masukan kepada penulis dalam penyelesaian skripsi ini. Ibu Dwi Lestari P, S.Si.,
M.Si., Apt., selaku penasehat akademik yang telah memberikan arahan dan
bimbingan kepada penulis selama ini serta Bapak dan Ibu staf pengajar Fakultas
Farmasi USU yang telah mendidik penulis selama masa perkuliahan.
Penulis juga tidak lupa mengucapkan terima kasih dan penghargaan yang
tulus kepada orangtua tersayang Ayahanda (Alm) Budiman Lubis dan Ibunda
v
tersayang Zul Fadlan Lubis, Lutfi Rahman Lubis, dan Andi Arsali Putra Lubis,
Abang-kakak senior dan adik-adik junior, serta teman-teman tersayang Dianita
Harahap, Linda Mulyana, Astri Novia, Yusnawati, Ferra Zu’Ami, asisten
Laboratorium Teknologi Sediaan Farmasi II dan yang tidak dapat disebutkan satu
persatu yang selalu memberikan doa, dorongan dan pengorbanan baik moril
maupun materil dalam penyelesaian bahan skripsi ini.
Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan,
oleh karena itu dengan segala kerendahan hati penulis bersedia menerima kritik
dan saran yang membangun pada skripsi ini. Akhirnya, penulis berharap semoga
bahan skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 13 Agustus 2015 Penulis,
vi
PENGUJIAN MUTU BENTUK SEDIAAN NATRIUM DIKLOFENAK YANG BEREDAR DI APOTEK KOTA MEDAN
ABSTRAK
Latar belakang: sediaan lepas lambat akhir-akhir ini cukup banyak digunakan
atau diproduksi dengan pertimbangan bahwa sediaan tersebut memiliki keuntungan yaitu dapat mengurangi frekuensi pemakaian obat sehingga dapat menghindari adanya ketidakpatuhan menggunakan obat, menghindari pemakaian obat pada malam hari dan dapat mengurangi efek samping obat. Salut selaput (film) merupakan bagian terpadu dari proses pengembangan bentuk sediaan dengan tujuan untuk memperbaiki stabilitas kimia dan fisik; menutupi cita rasa, tekstur dan aroma yang tidak menyenangkan dan untuk mengendalikan atau memodifikasi pelepasan zat aktif (misalnya salut enterik dan lepas lambat).
Tujuan: untuk mengetahui kadar dari sediaan sustained release (Voltaren SR 75
mg dan Deflamat CR 75 mg) dan sediaan salut enterik (Voltaren 50 mg, Klotaren 50 mg dan Natrium Diklofenak Generik 50 mg), dan perbedaan pelepasan obat dari sediaan sustained release dan sediaan salut enterik.
Metode: pengujian evaluasi sediaan meliputi uji kekerasan, friabilitas, waktu
hancur, penetapan kadar, keseragaman kandungan, dan disolusi.
Hasil: pada uji evaluasi kekerasan yaitu Voltaren SR 75 mg (13,05 kg), Voltaren
50 mg (14,77 kg), Klotaren 50 mg (16,91 kg), Natrium Diklofenak Generik (13,39 kg). Hasil uji friabilitas untuk semua sediaan adalah 0%. Hasil uji waktu hancur in
vitro yaitu Voltaren SR 75 mg (45,45 menit), Deflamat CR 75 mg (37,45 menit),
Voltaren 50 mg (18,15 menit), Klotaren 50 mg (15,30 menit), Natrium Diklofenak Generik (12,2 menit). Hasil uji penetapan kadar yaitu Voltaren SR 75 mg (99,96%), Deflamat CR 75 mg (102,12%), Voltaren 50 mg (98,09%), Klotaren 50 mg (97,66%), Natrium Diklofenak Generik 50 mg (102,44%). Hasil uji keseragaman kandungan yaitu Voltaren SR 75 mg (87,13%), deflamat CR 75 mg (88,64%), Voltaren 50 mg (88,86%), Klotaren 50 mg (87,74%), Natrium Diklofenak Generik 50 mg (95,45%). Hasil uji disolusi yaitu pada menit ke-30 Voltaren SR 75 mg (31,71%), Deflamat CR 75 mg (46,16%), pada menit ke-360 Voltaren SR 75 mg (77,91%), Deflamat CR 75 mg (91,67%). Hasil uji disolusi pada menit ke-5 Voltaren 50 mg (34,75%), Klotaren 50 mg (56,91%), Natrium Diklofenak Generik (67,45%), pada menit ke-60 Voltaren 50 mg (126,91%), Klotaren 50 mg (117,74%), Natrium Diklofenak Generik (125,77%).
Kesimpulan: semua sediaan memenuhi syarat uji evaluasi yang meliputi uji
kekerasan, friabilitas, waktu hancur, penetapan kadar, keseragaman kandungan dan disolusi. Sediaan yang memiliki waktu pelepasan obat yang paling baik adalah Deflamat CR 75 mg dan Natrium Diklofenak Generik 50 mg.
vii
QUALITY TEST DICLOFENAC SODIUM FROM IN MEDAN MEDICINE STORE
ABSTRACT
Background: sustained release from was usely or producted with review that the
from will have the profit which to reduce useless medicine and than reduce omission medicine use, so that useless night medicine and to reduce adverse drug reaction. Coated tablet film is the best product development to repair stability, chemical and physical, repair the taste, tekstur and the bad aromatic so that will manage or modificated release that drug (example enteric coated tablet or sustained release).
Purpose: to know the content of sustained release from (Voltaren SR 75 mg and
Deflamat CR 75 mg) and enteric coated tablets from (Voltaren 50mg, Klotaren 50 mg and Generic Sodium Diclofenak 50 mg). And the different release from sustained release and enteric coated tablets.
Methode: evaluation test from are the hardest test, friability test, desintegration
test, the determination test, uniformity of content test and disolution test.
Result: the result of the hardest test are Voltaren SR 75 mg (13.05 kg), Voltaren
50 mg (14.77 kg), Klotaren 50 mg (16.91 kg), Generic Diclofenac Sodium (13.39 kg). The friability result test to all from are 0%. Time destroyed result test are Voltaren SR 75 mg (45.45 minute), Deflamat CR 75 mg (37.45 minute), Voltaren 50 mg (18.15 minute), Klotaren 50 mg (15.30 minute), Generic Diclofenac Sodium (12.2 minute). The determination result test are Voltaren SR 75 mg (99.96%), Deflamat CR 75 mg (102.12%), Voltaren 50 mg (98.09%), Klotaren 50 mg (97.66%), Generic Diclofenac Sodium 50 mg (102.44%). The uniformity result test are Voltaren SR 75 mg (87.13%), deflamat CR 75 mg (88.64%), Voltaren 50 mg (88.86%), Klotaren 50 mg (87.74%), Generic Diclofenac Sodium (95.45%). The disolution result test on 30 minute are Voltaren SR 75 mg (31.71%), Deflamat CR 75 mg (46.16%), on 360 minute are Voltaren SR 75 mg (77.91%), Deflamat CR 75 mg (91.67%). The disolution result test on 5 minute Voltaren 50 mg (34.75%), Klotaren 50 mg (56.91%), Generic Diclofenac Sodium (67.45%), on 60 minute are Voltaren 50 mg (126.91%), Klotaren 50 mg (117.74%), Generic Diclofenac Sodium (125.77%).
Conclusion: all the from eligible evaluation test which are the hardest test,
friability, time destroyed, determination, uniformity of content and disolution. The form who has the best extendedtime release are Deflamat CR 75 mg and Generic Diclofenac Sodium 50 mg.
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2Perumusan Masalah ... 4
1.3Hipotesis ... 4
1.4Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Natrium Diklofenak ... 6
2.1.1 Uraian bahan ... 6
2.1.2 Farmakologi natrium diklofenak ... 7
2.1.3 Efek samping ... 8
2.1.4 Dosis ... 8
ix
2.2 Sustained Release ... 8
2.2.1 Pengertian ... 8
2.2.2 Kelebihan dan kekurangan sediaan sustained release . 10
2.2.3 Mekanisme pelepasan sediaan lepas lambat ... 11
2.2.3.1 Difusi ... 11
2.2.3.2 Disolusi ... 12
2.2.3.3 Osmosis ... 12
2.2.3.4 Swelling ... 13
2.2.3.5 Proses erosi ... 13
2.3 Salut Selaput (film) ... 13
2.3.1 Pengertian ... 13
2.3.2 Tujuan salut selaput (film) ... 14
2.3.3 Komponen salut selaput (film) ... 14
2.3.3.1 Polimer ... 14
2.3.3.2 Plasticizer ... 15
2.3.3.3 Pewarna (opacifier) ... 15
2.4 Salut Enterik ... 16
2.4.1 Pengertian ... 16
2.4.2 Tujuan salut enterik ... 16
2.5 Evaluasi Sediaan ... 17
2.5.1 Uji keseragaman kandungan ... 17
2.5.2 Uji penetapan kadar ... 17
2.5.3 Uji kekerasan tablet ... 18
x
2.5.5 Uji waktu hancur ... 19
2.5.6 Uji disolusi ... 20
BAB III METODE PERCOBAAN ... 22
3.1 Alat ... 22
3.2 Bahan ... 22
3.3 Pembuatan Pereaksi ... 22
3.3.1 Akua bebas CO2 ... 22
3.3.2 Natrium hidroksida (NaOH) 0,1 N ... 22
3.3.3 Natrium hidroksida (NaOH) 0,2 N ... 22
3.3.4 Asam klorida (HCl) 0,1 N ... 23
3.3.5 Kalium dihidrogen fosfat (KH2PO4) 0,2 M ... 23
3.3.6 Dapar fosfat pH 6,8 ... 23
3.4 Penentuan Kadar Serapan Dan Linieritas Kurva Kalibrasi Natrium Diklofenak Dalam Larutan NaOH 0,1 N ... 23
3.4.1 Pembuatan larutan induk baku I (LIB I) ... 23
3.4.2 Pembuatan larutan induk baku II (LIB II) ... 23
3.4.3 Penentuan kurva serapan natrium diklofenak dalam larutan NaOH 0,1 N ... 24
3.4.4 Penentuan linieritas kurva kalibrasi natrium diklofenak dalam larutan NaOH 0,1 N ... 24
3.5 Evaluasi Tablet ... 24
3.5.1 Uji penetapan kadar natrium diklofenak ... 24
3.5.2 Uji kekerasan tablet ... 25
xi
3.5.4 Uji waktu hancur ... 25
3.5.5 Uji keseragaman kandungan ... 26
3.5.6 Uji disolusi ... 27
3.5 7 Analisa data secara statistik ... 28
3.5.7.1 Uji statistik terhadap evaluasi waktu hancur . 29
3.5.7.2 Uji statistik terhadap profil pelepasan obat ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Hasil Evaluasi Sediaan Natrium Diklofenak ... 30
4.1.1 Kekerasan ... 30
4.1.2 Friabilitas ... 31
4.1.3 Waktu hancur in vitro ... 32
4.1.4 Hasil uji ANOVA dan Duncan waktu hancur in vitro sediaan natrium diklofenak ... 34
4.1.5 Penentuan kuva serapan dan linieritas kurva kalibrasi natrium diklofenak dalam larutan NaOH 0,1 N ... 34
4.1.5.1 Hasil penentuan panjang gelombang maksimum dalam NaOH 0,1 N ... 34
4.1.5.2 Hasil penentuan linieritas kurva kalibrasi NaOH 0,1 N ... 35
4.1.6 Penentuan kadar natrium diklofenak dalam sediaan . 35
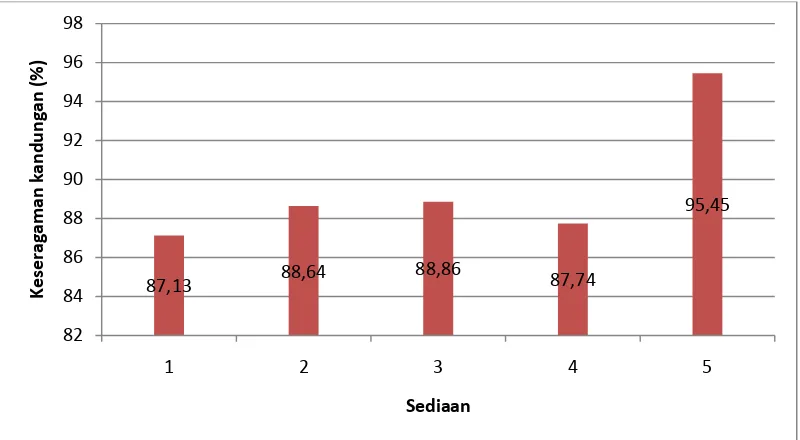
4.1.7 Keseragaman kandungan ... 36
4.1.8 Disolusi ... 37
4.1.8.1 Hasil uji disolusi pada menit ke-5 berdasarkan uji statistik ANOVA dan Duncan ... 37
xii
4.1.8.2 Hasil uji disolusi pada menit ke 15 berdasarkan uji statistik ANOVA
dan Duncan ... 37
4.1.8.3 Hasil uji disolusi pada menit ke-60 berdasarkan uji statistik ANOVA dan Duncan ... 43
4.1.8.4 Hasil uji disolusi pada menit ke-30, 60, 120, 240, 360 berdasarkan uji statistik T TEST dan Tukey ... 44
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
xiii
DAFTAR TABEL
Tabel Halaman
3.1 Kriteria penerimaan zat aktif yang larut dengan disolusi ... 28
4.1 Hasil evaluasi masing-masing sediaan natrium diklofenak ... 30
4.2 Hasil uji ANOVA waktu hancur sediaan natrium diklofenak ... 33
4.3 Hasil uji Duncan waktu hancur sediaan natrium diklofenak ... 34
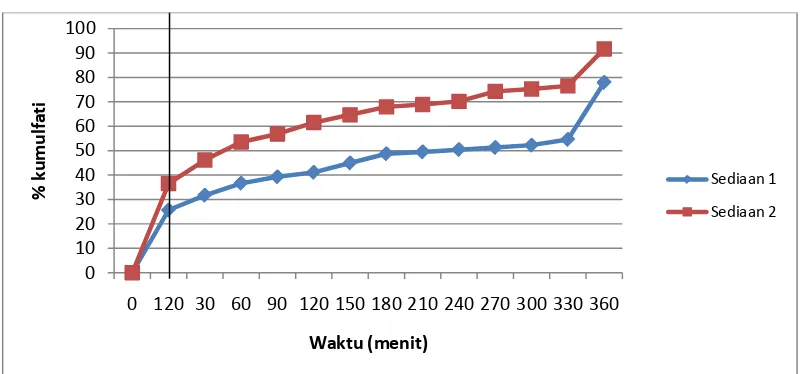
4.4 Hasil persen kumulatif rata-rata uji disolusi sediaan sustained release ... 38
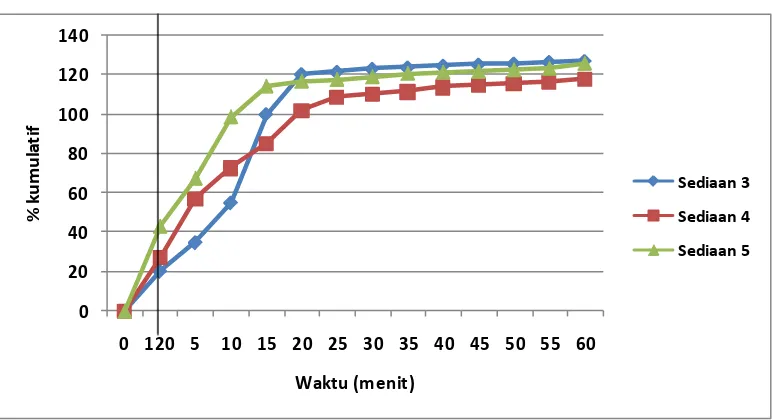
4.5 Hasil persen kumulatif rata-rata uji disolusi sediaan salut enterik ... 39
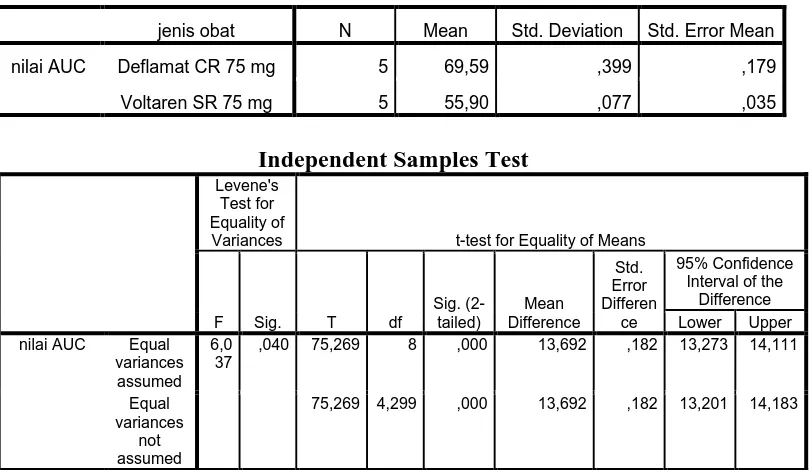
4.6 Hasil uji T TEST nilai AUC sediaan susteined release ... 40
4.7 Hasil uji ANOVA nilai AUC ssediaan salut enterik ... 40
4.8 Hasil uji Duncan nilai AUC sediaan salut enterik ... 41
4.9 Hasil uji ANOVA menit ke-5 ... 41
4.10 Hasil uji Duncan menit ke-5 ... 42
4.11 Hasil uji ANOVA menit ke -15 ... 42
4.12 Hasil uji Duncan menit ke-15 ... 43
4.13 Hasil uji ANOVA menit ke-60 ... 43
4.14 Hasil uji Duncan menit ke-60 ... 43
4.15 Hasil uji T TEST disolusi menit ke-30, 60, 90, 120, 240, 360 ... 44
4.16 Hasil uji TUKEY disolusi menit ke-30, 60, 90, 120, 240, 360 .... 44
xiv
DAFTAR GAMBAR
Gambar Halaman
4.1 Diagram batang hasil uji kekerasan ... 31
4.2 Diagram batang hasil uji waktu hancur ... 33
4.3 Diagram batang hasil uji penetapan kadar ... 35
4.4 Diagram batang hasil uji keseragaman kandungan ... 36
4.5 Grafik hasil persen kumulatif rata-rata disolusi sediaan sustained release natrium diklofenak ... 38
xvi
15 Sertifikat Analisis Natrium Diklofenak ... 99
16 Daftar distribusi nilai t ... 100
17 Gambar Sediaan Natrium Diklofenak ... 101
vi
PENGUJIAN MUTU BENTUK SEDIAAN NATRIUM DIKLOFENAK YANG BEREDAR DI APOTEK KOTA MEDAN
ABSTRAK
Latar belakang: sediaan lepas lambat akhir-akhir ini cukup banyak digunakan
atau diproduksi dengan pertimbangan bahwa sediaan tersebut memiliki keuntungan yaitu dapat mengurangi frekuensi pemakaian obat sehingga dapat menghindari adanya ketidakpatuhan menggunakan obat, menghindari pemakaian obat pada malam hari dan dapat mengurangi efek samping obat. Salut selaput (film) merupakan bagian terpadu dari proses pengembangan bentuk sediaan dengan tujuan untuk memperbaiki stabilitas kimia dan fisik; menutupi cita rasa, tekstur dan aroma yang tidak menyenangkan dan untuk mengendalikan atau memodifikasi pelepasan zat aktif (misalnya salut enterik dan lepas lambat).
Tujuan: untuk mengetahui kadar dari sediaan sustained release (Voltaren SR 75
mg dan Deflamat CR 75 mg) dan sediaan salut enterik (Voltaren 50 mg, Klotaren 50 mg dan Natrium Diklofenak Generik 50 mg), dan perbedaan pelepasan obat dari sediaan sustained release dan sediaan salut enterik.
Metode: pengujian evaluasi sediaan meliputi uji kekerasan, friabilitas, waktu
hancur, penetapan kadar, keseragaman kandungan, dan disolusi.
Hasil: pada uji evaluasi kekerasan yaitu Voltaren SR 75 mg (13,05 kg), Voltaren
50 mg (14,77 kg), Klotaren 50 mg (16,91 kg), Natrium Diklofenak Generik (13,39 kg). Hasil uji friabilitas untuk semua sediaan adalah 0%. Hasil uji waktu hancur in
vitro yaitu Voltaren SR 75 mg (45,45 menit), Deflamat CR 75 mg (37,45 menit),
Voltaren 50 mg (18,15 menit), Klotaren 50 mg (15,30 menit), Natrium Diklofenak Generik (12,2 menit). Hasil uji penetapan kadar yaitu Voltaren SR 75 mg (99,96%), Deflamat CR 75 mg (102,12%), Voltaren 50 mg (98,09%), Klotaren 50 mg (97,66%), Natrium Diklofenak Generik 50 mg (102,44%). Hasil uji keseragaman kandungan yaitu Voltaren SR 75 mg (87,13%), deflamat CR 75 mg (88,64%), Voltaren 50 mg (88,86%), Klotaren 50 mg (87,74%), Natrium Diklofenak Generik 50 mg (95,45%). Hasil uji disolusi yaitu pada menit ke-30 Voltaren SR 75 mg (31,71%), Deflamat CR 75 mg (46,16%), pada menit ke-360 Voltaren SR 75 mg (77,91%), Deflamat CR 75 mg (91,67%). Hasil uji disolusi pada menit ke-5 Voltaren 50 mg (34,75%), Klotaren 50 mg (56,91%), Natrium Diklofenak Generik (67,45%), pada menit ke-60 Voltaren 50 mg (126,91%), Klotaren 50 mg (117,74%), Natrium Diklofenak Generik (125,77%).
Kesimpulan: semua sediaan memenuhi syarat uji evaluasi yang meliputi uji
kekerasan, friabilitas, waktu hancur, penetapan kadar, keseragaman kandungan dan disolusi. Sediaan yang memiliki waktu pelepasan obat yang paling baik adalah Deflamat CR 75 mg dan Natrium Diklofenak Generik 50 mg.
vii
QUALITY TEST DICLOFENAC SODIUM FROM IN MEDAN MEDICINE STORE
ABSTRACT
Background: sustained release from was usely or producted with review that the
from will have the profit which to reduce useless medicine and than reduce omission medicine use, so that useless night medicine and to reduce adverse drug reaction. Coated tablet film is the best product development to repair stability, chemical and physical, repair the taste, tekstur and the bad aromatic so that will manage or modificated release that drug (example enteric coated tablet or sustained release).
Purpose: to know the content of sustained release from (Voltaren SR 75 mg and
Deflamat CR 75 mg) and enteric coated tablets from (Voltaren 50mg, Klotaren 50 mg and Generic Sodium Diclofenak 50 mg). And the different release from sustained release and enteric coated tablets.
Methode: evaluation test from are the hardest test, friability test, desintegration
test, the determination test, uniformity of content test and disolution test.
Result: the result of the hardest test are Voltaren SR 75 mg (13.05 kg), Voltaren
50 mg (14.77 kg), Klotaren 50 mg (16.91 kg), Generic Diclofenac Sodium (13.39 kg). The friability result test to all from are 0%. Time destroyed result test are Voltaren SR 75 mg (45.45 minute), Deflamat CR 75 mg (37.45 minute), Voltaren 50 mg (18.15 minute), Klotaren 50 mg (15.30 minute), Generic Diclofenac Sodium (12.2 minute). The determination result test are Voltaren SR 75 mg (99.96%), Deflamat CR 75 mg (102.12%), Voltaren 50 mg (98.09%), Klotaren 50 mg (97.66%), Generic Diclofenac Sodium 50 mg (102.44%). The uniformity result test are Voltaren SR 75 mg (87.13%), deflamat CR 75 mg (88.64%), Voltaren 50 mg (88.86%), Klotaren 50 mg (87.74%), Generic Diclofenac Sodium (95.45%). The disolution result test on 30 minute are Voltaren SR 75 mg (31.71%), Deflamat CR 75 mg (46.16%), on 360 minute are Voltaren SR 75 mg (77.91%), Deflamat CR 75 mg (91.67%). The disolution result test on 5 minute Voltaren 50 mg (34.75%), Klotaren 50 mg (56.91%), Generic Diclofenac Sodium (67.45%), on 60 minute are Voltaren 50 mg (126.91%), Klotaren 50 mg (117.74%), Generic Diclofenac Sodium (125.77%).
Conclusion: all the from eligible evaluation test which are the hardest test,
friability, time destroyed, determination, uniformity of content and disolution. The form who has the best extendedtime release are Deflamat CR 75 mg and Generic Diclofenac Sodium 50 mg.
1
BAB I
PENDAHULUAN
1.1 Latar belakang
Sediaan dalam bentuk lepas lambat dibuat untuk meningkatkan efek
farmaseutik dari pengobatan agar mencapai aksi selektifitas yang lebih baik dan
durasi yang lebih panjang. Kebanyakan bentuk sustained release dirancang
supaya pemakaian untuk dosis tunggal yang menyajikan pelepasan sejumlah obat
segera setelah pemakaiannya, secara tepat menghasilkan efek terapeutik yang
diinginkan secara berangsur-angsur dan terus-menerus melepaskan sejumlah obat
lainnya untuk memelihara tingkat pengaruhnya selama periode waktu yang
diperpanjang, biasanya 8 sampai 12 jam. Keunggulan tipe bentuk sediaan ini
menghasilkan kadar obat dalam darah yang merata tanpa perlu mengulangi
pemberian unit dosis. Alasan bagi kualitas yang diinginkan pada bentuk aksi
diperlama ini yaitu obat-obat yang laju absorbsi dan ekskresinya lambat, biasanya
sifat kerjanya panjang dan tidak diperlukan perubahan sediaannya menjadi bentuk
sediaan aksi diperlama (Ansel., 2008).
Sediaan lepas lambat akhir-akhir ini cukup banyak digunakan atau
diproduksi dengan pertimbangan bahwa sediaan tersebut memiliki keuntungan
sebagai berikut (1) meningkatkan kenyamana pasien dalam menggunakan obat,
karena dapat mengurangi frekuensi pemakaian obat sehingga dapat menghindari
adanya ketidakpatuhan menggunakan obat seperti pada pengobatan dengan
sediaan konvensional dan dapat menghindari pemakaian obat pada malam hari,
(2) mengurangi fluktuasi kadar obat dalam darah, (3) tidak adanya puncak dan
2
dihindari fluktuasi kadar obat dalam darah, (4) kontrol pemberian dosis terapeutik
dapat dibuat pada kecepatan penghantaran yang diinginkan, (5) memelihara
konsentrasi obat dalam rentang terapeutik optimum untuk pengobatan jangka
panjang, (6) memaksimalkan hubungan antara efektivitas dan dosis, (7)
mengurangi efek samping obat karena konsentrasi obat dalam darah yang berada
pada dosis terapeutik (Hadisoewignyo dan Fudholi., 2013).
Mikroenkapsulasi merupakan suatu salut selaput termodifikasi yang
berbeda hanya dalam ukuran partikel yang disalut dan metode mengerjakannya.
Proses ini didasarkan pada salah satu metode berikut, yakni metode mekanik,
seperti salut panci, teknik suspensi udara, teknik sentrigufa multi lubang
(multiorifice), dan teknik semprot kering termodifikasi, atau teknik fisikokimia
yang meliputi pemisahan fase koaservasi ketika bahan yang disalut disuspensikan
di dalam suatu larutan polimer bukan pelarut yang inkompatibel atau garam
anorganik atau dengan mengubah suhu sistem (Charles dan Wikarsa., 2010).
Salut selaput (film) merupakan bagian terpadu dari proses pengembangan
bentuk sediaan. Proses salut selaput meliputi penyalutan salut polimer tipis yang
seragam pada permukaan substrat solida. Substrat dapat berupa tablet, kaplet,
pelet, granul, atau pertikel-partikel (Charles dan Wikarsa., 2010).
Tablet kompresi ini disalut dengan selaput tipis dari polimer yang larut
atau tidak larut dalam air maupun membentuk lapisan yang meliputi tablet.
Biasanya lapisan ini berwarna, kelebihannya dari penyalutan dengan gula ialah
lebih tahan lama, lebih sedikit untuk penggunaannya. Selaput ini pecah dalam
3 Tujuan salut selaput
Walaupun penggunaan baru dari salut selaput secara kontinu dikembangkan,
keterangan berikut meliputi penggunaan salut selaput yang paling mutakhir, yaitu:
1. Melindungi zat aktif dari substrat dari faktor lingkungan seperti cahaya,
kelembaban, udara, dan untuk memperbaiki stabilitas kimia dan fisik.
2. Memodifikasi penampilan produk untuk meningkatkan nilai jual dan memberi
identitas produk atau menutup perubahan warna substrat yang tidak
dikehendaki.
3. Menutup cita rasa, tekstur atau aroma yang tidak menyenangkan.
4. Meningkatkan kemampuan pasien untuk menelan (memudahkan substrat untuk
ditelan).
5. Menjadi perintang mekanik tarhadap interaksi bahan-bahan yang tidak
tercampurkan dengan menyalut satu atau lebih bahan tersebut.
6. Memperbaiki penanganan selama pelaksanaan pengemasan dengan
mengurangi pembentukan debu dan kejadian sompel pada salut.
7. Mengendalikan atau memodifikasi pelepasan zat aktif (misalnya salut enterik
dan lepas lambat).
8. Memperbaiki ketahanan (resistensi) terhadap kejadian sompel pada salut
(Charles dan Wikarsa., 2010).
Natrium diklofenak secara resmi terdapat di Martindale Extra Pharmacopoeia.
Natrium diklofenak temasuk golongan anti inflamasi non steroid, yang digunakan
untuk berbagai macam kondisi luka dan radang. Obat ini memiliki waktu paruh
biologis yang sangat singkat yaitu 1-2 jam dan diberikan dalam dosis 150 mg 2-3
4
dosis yang dapat meningkatkan efek klinis dan menurunkan frekuensi pemberian
obat dan minim efek samping. Di kalangan dunia medis natrium diklofenak
digunakan sebagai salah satu terapi rheumatoid arthritis, osteoarthritis, ankilosa
spondilitis, dan pirai. Pada penggunaan peroral, natrium diklofenak menyebabkan
efek samping antara lain nyeri gastrointestinal, pendarahan gastrointestinal, dan
ulserasi gastrik. Selain itu, pada penggunaan peroral, natrium diklofenak
mengalami first-pass metabolism, sehingga hanya 50% dari obat yang mencapai
sirkulasi sistemik dalam bentuk unchanged (Brunton., 2008).
1.2Perumusan masalah
Berdasarkan latar belakang di atas, maka perumusan masalah dalam penelitian
ini adalah:
a. Apakah kadar natrium diklofenak dalam tablet Voltaren SR 75 mg,
Voltaren 50 mg, Klotaren 50 mg, Natrium Diklofenak Generik 50 mg dan
kapsul Deflamat CR 75 mg memenuhi persyaratan
b. Apakah terdapat perbedaan hasil uji disolusi antara tablet Voltaren SR 75
mg dengan kapsul Deflamat CR 75 mg dan antara Voltaren 50 mg,
Klotaren 50 mg dan Natrium Diklofenak Generik 50 mg
1.3Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis pada penelitian ini
adalah:
a. Kadar natrium diklofenak dalam tablet Voltaren SR 75 mg, Voltaren 50
mg, Klotaren 50 mg, Natrium Diklofenak Generik 50 mg dan kapsul
5
b. Terdapat perbedaan hasil uji disolusi antara tablet Voltaren SR 75 mg
dengan kapsul Deflamat CR 75 mg dan antara Voltaren 50 mg, Klotaren
50 mg dan Natrium Diklofenak Generik 50 mg
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah:
a. Untuk mengetahui kadar natrium diklofenak dalam tablet Voltaren SR
75 mg, Voltaren 50 mg, Klotaren 50 mg, Natrium Diklofenak Generik
50 mg dan kapsul Deflamat CR 75 mg
b. Untuk mengetahui perbedaan hasil uji disolusi antara tablet Voltaren SR
75 mg dengan kapsul Deflamat CR 75 mg dan antara Voltaren 50 mg,
Klotaren 50 mg dan Natrium Diklofenak Generik 50 mg
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah:
1. Untuk memberikan informasi mengenai kadar natrium diklofenak dalam
tablet Voltaren SR 75 mg, Voltaren 50 mg, Klotaren 50 mg, Natrium
Diklofenak Generik 50 mg dan kapsul Deflamat CR 75 mg
2. Untuk memberikan informasi mengenai perbedaan hasil uji disolusi
antara tablet Voltaren SR 75 mg dengan kapsul Deflamat CR 75 mg dan
antara Voltaren 50 mg, Klotaren 50 mg dan Natrium Diklofenak
6
BAB II
TINJAUAN PUSTAKA
2.1 Natrium Diklofenak
2.1.1 Uraian bahan
Rumus bangun :
Rumus molekul : C14H10Cl2NNaO2
Berat molekul : 318,13
Nama kimia : asam benzeneasetat, 2 -[(2,6- diklorofenil) amino]
monosodium
Nama lain : Sodium [o-(dikloroanilino)fenil]asetat
Pemerian : serbuk hablur, berwarna putih, tidak berasa
(USP 30, 2007).
Kelarutan : Sedikit larut dalam air, larut dalam alkohol; praktis tidak
larut dalam kloroform dan eter; bebas larut dalam
alcohol metal pH larutan 1% dalam air adalah antara
7.0 dan 8 (USP 30, 2007).
7
2.1.2 Farmakologi natrium diklofenak
Diklofenak adalah turunan asam fenilasetat sederhana yang menyerupai
fluorbiprofen maupun meklofenamat. Obat ini adalah penghambat
siklooksigenase yang kuat dengan efek anti inflamasi, analgesik dan antipiretik.
Diklofenak cepat diabsorbsi setelah pemberian oral dan mempunyai waktu paruh
yang pendek. Seperti fluorbiprofen, obat ini berkumpul di cairan sinovial. Potensi
diklofenak lebih besar dari pada naproksen. Obat ini dianjurkan untuk kondisi
peradangan kronis seperti artritis rematoid dan osteoartritis serta untuk
pengobatan nyeri otot rangka akut (Katzung, 2007).
Mekanisme kerjanya, bila membran sel mengalami kerusakan oleh suatu
rangsangan kimiawi, fisik, atau mekanis, maka enzim fosfolipase diaktifkan untuk
mengubah fosfolipida menjadi asam arachidonat. Asam lemak poli-tak jenuh ini
kemudian untuk sebagian diubah oleh ezim cyclo-oksigenase menjadi
endoperoksida dan seterusnya menjadi prostaglandin. Cyclo-Oksigenase terdiri
dari dua iso-enzim, yaitu COX-1 (tromboxan dan prostacyclin) dan COX-2
(prostaglandin). Kebanyakan COX-1 terdapat di jaringan, antara lain dipelat-pelat
darah, ginjal dan saluran cerna. COX-2 dalam keadaan normal tidak terdapat di
jaringan tetapi dibentuk selama proses peradangan oleh sel-sel radang.
Penghambatan COX-2 lah yang memberikan efek anti radang dari obat NSAIDs.
NSAID yang ideal hanya menghambat COX-2 (peradangan) dan tidak COX-1
(perlindungan mukosa lambung) (Katzung, 2007).
Diklofenak merupakan obat NSAIDs (Non Steroidal Anti Inflammatory
Drugs) yang bersifat tidak selektif dimana kedua jenis COX di blokir. Dengan
8
melindungi mukosa lambung-usus (Tan dan Rahardja, 2007).
2.1.3 Efek samping
Efek samping yang dapat terjadi meliputi distress gastrointestinal,
pendarahan gastrointestinal dan timbulnya ulserasi lambung, sekalipun timbulnya
ulkus lebih jarang terjadi daripada dengan beberapa antiinflamasi non-steroid
(AINS) lainnya. Peningkatan serum aminotransferases lebih umum terjadi dengan
obat ini daripada dengan AINS lainnya (Katzung, 2014).
2.1.4 Dosis
Oral 3 kali sehari 25 - 50 mg garam-Na/K, rektal 1 kali sehari 50 - 100 mg,
i.m. pada nyeri kolik atau serangan encok: 1 - 2 kali sehari 75 mg selama 1 - 3
hari. Pra dan pasca bedah dalam tetes mata 0,1% 3 - 5x 1 tetes, juga dalam
krem/gel 1% (Tan dan Rahardja, 2007).
2.1.5 Sediaan
Dalam perdagangan natrium diklofenak tersedia dalam bentuk tablet setara
25 mg, 50 mg dan 100 mg, tablet salut enterik setara 50 mg, injeksi setara 25
mg/ml, 75 mg/ml, supositoria setara 50 mg, 100 mg (ISO, 2007).
2.2 Sustained Release (SR)
2.2.1 Pengerian
Sediaan lepas lambat merupakan bentuk sediaan yang dirancang untuk
melepaskan obatnya ke dalam tubuh secara perlahan-lahan atau bertahap supaya
pelepasannya lebih lama dan memperpanjang aksi obat. Rute pemberian obat
secara oral adalah rute paling umum dan nyaman digunakan oleh pasien. Tablet
dan kapsul merupakan bentuk sediaan obat solid (padat) yang paling banyak
9
terkontrol hingga kapsul gelatin keras dan lunak (hard and soft gelatin capsules)
(Sharma, et al, 2011).
Namun di antara penggunaan keduanya tablet merupakan bentuk sediaan
yang paling disukai karena mudah diproduksi, mudah pengemasan begitu juga
penggunaannya. Bentuk sediaan padat banyak digunakan karena mudahnya
pemberian, memiliki dosis yang akurat dan dapat digunakan sendiri tanpa adanya
rasa sakit. Bentuk sedian padat yang umum adalah tablet dan kapsul, bentuk
sediaan ini bagi beberapa pasien sulit untuk ditelan. Pasien harus minum air untuk
dapat menelan bentuk sediaan tersebut. Pasien sering sekali merasa kesulitan dan
tidak nyaman dalam menelan tablet konvensional (Parmar, et al, 2009).
Istilah yang digunakan untuk sediaan lepas lambat ada bermacam-macam.
Sediaan lepas lambat sering disebut dengan “susteined-release”, “controlled
release”, “time release” dan “extended action”.Secara umum sediaan lepas
lambat yang digunakan secara peroral dapat digolongkan menjadi tiga golongan:
1. Tablet aksi berulang (repeat action tablet)
Repeat action tablet dimaksud sebagai sediaan lepas lambat, yang terdiri
dari dua bagian, pertama mempunyai bentuk dosis yang dapat dilepaskan dengan
cepat (immediate release) dan bagian kedua merupakan bagian yang dosisnya
baru dapat dilepaskan setelah beberapa waktu berlangsung. Beberapa produk
bahkan memiliki bagian ketiga, yaitu dosis yang baru dilepaskan setelah bagian
kedua dilepaskan. Pelepasan obat yang berurutan ini dikontrol dengan suatu “time
10
2. Tablet lepas lambat (sustained release tablet)
Bentuk sediaan ini memiliki dua macam dosis, yaitu “initial dose” yang
mirip dengan bagian pertama dan repeat action tablets dan “maintained dose”
yang memiliki karakteristik pelepasan lambat. Tujuan dari penggunaan bentuk
sediaan ini adalah dosis pertama (initial dose) untuk mendapatkan konsentrasi
obat dalam darah pada rentang terapeutiknya dan selanjutnya konsentrasi
terapeutik ini dipertahankan oleh bentuk kedua (maintained dose). Konsentrasi
obat dalam darah pada bentuk sediaan ini berbeda dengan sediaan repeat action
tablets karena tidak dijumpai adanya puncak dan lembah.
3. Tablet aksi diperlama (prolonged action tablets)
Sediaan ini mirip dengan sustained release dosage form, hanya tidak
mempunyai dosis muatan untuk mendapatkan kadar terapi pada awal pemakaian
obat. Pelepasan obat berlangsung lambat dan memberikan cadangan obat secara
terus-menerus dalam waktu tertentu (Charles dan Wikarsa, 2010).
2.2.2 Kelebihan dan kekurangan sediaan sustained release
Sustained release memiliki beberapa kelebihan dan kekurangan. Kelebihan
dari sediaan sustained release diantaranya:
a. Meningkatkan kenyamanan pasien dalam menggunakan obat, karena dapat
mengurangi frekuensi pemakaian obat sehingga dapat menghindari adanya
ketidakpatuhan menggunakan obat seperti pada pengobatan dengan sediaan
konvensional dan dapat menghindari pemakaian obat pada malam hari;
b. Mengurangi fluktuasi kadar obat dalam darah;
c. Tidak adanya puncak dan lembah pada kurva konsentrasi obat dalam darah
11
d. Kontrol pemberian dosis terapeutik dapat dibuat pada kecepatan penghantaran
yang diinginkan;
e. Memelihara konsentrasi obat dalam rentang terapeutik optimum untuk
pengobatan jangka panjang;
f. Memaksimalkan hubungan antara efektivitas-dosis;
g. Mengurangi efek samping obat karena konsentrasi obat dalam darah yang
berada pada dosis terapeutik (Charles dan Wikarsa, 2010).
Kekurangan dari sediaan sustained release diantaranya adalah:
a. Biaya pembuatan lebih mahal dibandingkan dengan sediaan konvensional;
b. Terdapat kemungkinan terjadinya dose dumping, yaitu adanya sejumlah besar
zat aktif lepas secara cepat dari sediaan, hal ini dapat menimbulkan keracunan
karena pasien melakukan sesuatu yang seharusnya tidak dilakukan, misalnya
mengunyah sediaan yang seharusnya ditelan;
c. Sering memiliki korelasi in vitro-in vivo yang buruk;
d. Mengurangi fleksibilitas pemberian dosis;
e. Efektivitas pemberian obat dipengaruhi oleh lama tinggal di saluran pencernaan
(gastrointestinal residence time) (Charles dan Wikarsa, 2010).
2.2.3 Mekanisme pelepasan sediaan lepas lambat
2.2.3.1 Difusi
Pada mekanisme ini, obat dapat berdifusi keluar melalui sistem matriks..
Pada sistem reservoir, inti obat dienkapsulasi dalam membran polimer, sehingga
difusi obat melalui membran dapat dikendalikan kecepatan pelepasannya.
Mekanisme pelepasan obat yang terjadi berawal dari terlarutnya obat di dalam
12
lain dari membran. Jika polimer tidak larut air, maka kelarutan obat dalam
membran merupakan faktor penting yang mendorong terjadinya difusi melintas
membran. Sedangkan jika membran merupakan polimer larut air, sebagian
polimer akan terlarut membentuk saluran-saluran yang merupakan panjang
lintasan difusi yang bersifat konstan (Charles dan Wikarsa, 2010).
2.2.3.2 Disolusi
Obat disalut dalam bahan polimerik dan kecepatan disolusi polimer
menentukan kecepatan pelepasan obat. Sistem ini dapat digunakan untuk menahan
pelepasan obat melalui cara yang berbeda-beda. Salah satunya dengan
menempatkan partikel-partikel obat ke dalam penyalut yang masing-masing
memiliki ketebalan yang bervariasi, akibatnya pelepasan obat akan terjadi secara
bertahap. Partikel obat yang memiliki lapisan penyalut yang paling tipis akan
memberikan pelepasan yang segera, sehingga dapat memenuhi konsentrasi obat
yang dibutuhkan pada tahap awal pemberian dosis, sedangkan lapisan penyalut
yang lebih tebal akan memenuhi kadar obat yang dibutuhkan utuk menjaga agar
konsentrasi obat tetap konstan di dalam tubuh (Charles dan Wikarsa, 2010).
2.2.3.3 Osmosis
Penempatan membran semipermeabel di sekeliling tablet, partikel atau
larutan obat, menyebabkan adanya pembentukan perbedaan tekanan osmotik
antara bagian dalam dan bagian luar tablet sehingga memompa larutan obat keluar
dari tablet melalui celah kecil dan memberikan sifat pelepasan obat yang
diperlama. Pada sistem ini, membran semipermeabel digunakan untuk
13
2.2.3.4 Swelling
Ketika suatu polimer kontak dengan air, maka terjadi penyerapan air yang
menyebabkan polimer dapat mengembang, sehingga obat yang terdispersi di
dalam polimer akan berdifusi keluar. Akibatnya, pelepasan obat bergantung pada
dua proses kecepatan yang simultan yaitu antara proses berdifusinya air ke dalam
polimer dan peregangan rantai polimer (Charles dan Wikarsa, 2010).
2.2.3.5 Proses erosi
Pada sistem ini, polimer pada matriks akan mengalami erosi atau
pengikisan karena terbentuk ikatan labil akibat reaksi yang terjadi secara hidrolisis
maupun enzimatis. Seiring dengan terkikisnya polimer, maka obat akan
dilepaskan ke dalam medium di sekitarnya (Charles dan Wikarsa, 2010).
2.3 Salut Film
2.3.1 Pengertian
Dalam penyalutan lapis film pada tablet biasanya mengandung jenis-jenis
bahan seperti polimer (pembentukan selaput), plasticizer, surfaktan, pewarna,
pemanis/perasa/pengharum, pengkilap, dan pelarut. Bahan polimer yang
digunakan adalah hidroksipropil metilselulosa (HPMC). Polimer ini merupakan
suatu bahan pilihan untuk sistem suspensi udara dan sistem panci penyalut dengan
penyemprotan (Lachman, et al, 1994).
Tablet salut selaput merupakan bagian terpadu dari proses pengembangan
bentuk sediaan. Proses salut selaput meliputi penyalutan salut polimer tipis yang
seragam pada permukaan substrat solid. Substrat dapat berupa tablet, kaplet
14
mikrometer dan disalutkan untuk menyempurnakan sifat-sifat fisik dan kimia
substrat (Charles dan Wikarsa, 2010).
Penyalutan adalah proses dimana lapisan luar yang kering dari bahan
penyalut melapisi permukaan dari bentuk sediaan untuk mencapai tujuan tertentu.
Tablet salut dapat menutupi rasa, bau maupun warna obat. Tablet salut dapat
mengatur laju pelepasan obat dari tablet. Selain itu, penyalutan tablet juga dapat
memberikan perlindungan fisik dan kimia, serta dapat melindungi obat dari
suasana asam di gastrointestinal (dengan pembuatan tablet salut enterik).
Penyalutan juga dapat menghindari inkompantibilitas dalam formulasi sediaan.
Salut film ini berfungsi untuk memperbaiki tampilan tablet, memperlama waktu
release tablet/waktu disolusi (Ankit, et al, 2012).
2.3.2 Tujuan salut film
Beberapa tujuan penggunaan salut film (selaput) dibandingkan tablet
standart antara lain:
1. Melindungi zat aktif dalam substrat dari faktor lingkungan, seperti cahaya,
kelembaban dan udara serta memperbaiki stabilitas kimia dan fisika.
2. Memodifikasi penampilan produk
3. Menutupi cita rasa, tekstur dan aroma yang tidak menyenangkan
4. Mengendalikan atau memodifikasi pelepasan zat aktif (Ansel, 2008)
2.3.3 Komponen salut film
2.3.3.1 Polimer
Polimer adalah zat yang membentuk lapisan pada penyalutan film. Polimer
15
selulosa dan polimer akrilik yang banyak ditemui seperti polietilen glikol dengan
berat molekul besar, polivinil pirolidon, polivinil alkohol dan lain-lain.
2.3.3.2 Plasticizer
Plasticizer pada umumnya adalah zat dengan berat molekul rendah yang
punya kapasitas merubah sifat fisik polimer sehingga dapat berfungsi lebih baik
sebagai bahan dalam proses salut film. Mekanisme kerja plasticizer pada
umumnya dengan menginterposemolekul plasticizer pada helaian polimer
sehingga memecah interaksi polimer-polimer. Contoh plasticizer yang standart
digunakan adalah polyol seperti gliserol (gliserin), propilen glikol, polietilen
glikol, ester organik seperti ester phthalate, ester sitrat, gliserida seperti minyak
jarak, monogliserida terasetilasi, dan minyak kelapa terfraksionasi. Pada salut
film, plasticizer memiliki kemampuan untuk stress internal pada salut film, selain
itu pada salut film yang bertujuan memiliki efekmodifikasi pelepasan pada
sediaan, harus kuat secara mekanik supaya lapisan film tidak rusak pada saat
proses penyalutan.
2.3.3.3 Pewarna / opacifier
Kelompok bahan ini digunakan untuk meningkatkan penampilan produk yang
dihasilkan namun juga bermanfaat dalam beberapa hal lain diantaranya:
1. Identifikasi produk oleh produsen yang standard digunakan pada GMP (Good
Manufacturing Practice) serta membantu mengidentifikasi obat pada pasien
dengan pengobatan lebih dari 1 obat.
2. Meningkatkan kesan merek suatu produk sehingga menghindari kesempatan
16
3. Pewarna pada batasan tertentu memiliki efek opacifiying yang dapat
menentukan hasil optimal yang dapat melindungi bahan obat dari cahaya
pada saat penyalutan (Hogan, 2002).
2.4 Salut Enterik
2.4.1 Pengertian
Tablet salut salut enterik merupakan tablet yang disalut dengan lapisan
yang tidak melarut atau hancur dilambung melainkan di usus, supaya tablet dapat
diabsorbsi di usus.Polimer yang banyak digunakan dengan tujuan salut enterik
adalah selulosa asetil ptalat, polivinil asetil ptalat, dan akrilat (Aulton, 1988).
Keinginan untuk mengubah salut enterik dengan pelarut organik menjadi
pelarut air disebabkan karena farktor toksisitas mudah terbakar, serta faktor
lingkungan dan ekonomi mulai dipertimbangkan. Polimer yang sering digunakan
untuk penyalut enterik ialah turunan akrilat, beberapa diantaranya dapat
menggunakan air sebagai pelarut dan pembawa (Goeswin, 1983).
2.4.2 Tujuan salut enterik
Tujuan dari tablet dibuat salut enterik antara lain:
1. Menunda pelepasan obat di tempat aksi yang dituju, umumnya di usus halus.
2. Melindungi lambung dari obat-obat yang bersifat iritan.
3. Melindungi obat-obatan yang tidak stabil dalam saluran cerna.
4. Menghindari bau dan rasa obat yang tidak enak.
Dalam penyusunan formula tablet enteric coating, perlu diperhatikan
fisiologi tubuh terutama lambung dan usus halus. Lambung mempunyai pH 1-4.
Dalam keadaan lapar, pH lambung sekitar 1,4 dan saat setelah makan pH lambung
17
6.5-7 sedangkan di ileum 7.5 / 8. Dari pH fisiologis itu dapat dicari penyalut yang
sesuai yang dapat larut dalam pH di tempat tujuan tersebut. Tablet salut enterik
tidak pecah saat di lambung. Namun bisa pecah apabila ada substansi yang dapat
menaikkan atau menetralkan pH asam lambung misalnya antasida atau makanan.
Oleh karena itu, penggunaan enteric coating tablet tidak boleh bersamaan dengan
antasida dan makanan (Goeswin, 1983).
2.5 Evaluasi Sediaan
2.5.1 Uji keseragaman kandungan
Sediaan yang diuji adalah tablet natrium diklofenak dengan berat satu tablet
230 mg dan kapsul natrium diklofenak dengan berat satu kapsul 280 mg dan
mengandung natrium diklofenak 75 mg, berarti bobot zat berkhasiat lebih kecil
dari 50% bobot sediaan, karena itu penetapan keseragaman sediaan dilakukan
dengan menetapkan keseragaman kandungan.
Satu tablet digerus lalu dimasukkan kedalam labu tentukur 100 ml dan
dilarutkan dan diencerkan dengan larutan NaOH 0,1 N hingga garis tanda.
Kemudian disaring, 10 ml filtrat pertama dibuang. Dipipet 0,4 ml filtrat,
dimasukkan ke dalam labu tentukur 25 ml, diencerkan dengan NaOH 0,1 N
hingga garis tanda, lalu dikocok sampai homogen hingga diperoleh konsentrasi.
Larutan ini lalu diukur serapannya dengan menggunakan spektrofotometer UV
pada panjang gelombang 276 nm (Ditjen POM, 1995).
2.5.2 Uji penetapan kadar
Timbang dan serbukkan tidak kurang dari 20 tablet. Timbang seksama
sejumlah serbuk setara dengan 75 mg natrium diklofenak (penimbangan serbuk
18
ml. Kemudian ditambahkan NaOH 0,1 N, dikocok hingga larut dan dicukupkan
dengan NaOH 0,1 N hingga garis tanda. Disaring, 10 ml filtrat pertama dibuang.
Dipipet 0,6 ml filtrat, dimasukkan ke dalam labu tentukur 25 ml, diencerkan
dengan NaOH 0,1 N hingga garis tanda, lalu dikocok sampai homogen. Diukur
serapannya pada panjang gelombang maksimum yang diperoleh. Tablet natrium
diklofenak mengandung zat berkhasiat tidak kurang dari 90,0% dan tidak lebih
dari hingga 110,0% dari yang tertera pada etiket (USP 30, 2007).
2.5.3 Uji kekerasan tablet
Sebanyak 6 tablet, masing-masing diletakkan pada tempat yang
tersedia pada alat dengan posisi tidur, alat diatur, kemudian ditekan tombol
start. Pada saat tablet pecah angka yang tertera pada layar digital dicatat.
Syarat kekerasan tablet salut 10-20 kg (Abu-Izza, et al, 2004).
Kekerasan tablet mencerminkan kekuatan tablet secara keseluruhan,
diukur dengan cara memberi tekanan terhadap diameter tablet. Kekerasan
merupakan parameter yang menggambarkan ketahanan tablet dalam melawan
tekanan mekanik seperti goncangan, benturan dan keretakan selama pengemasan,
penyimpanan, transportasi, dan sampai ke tangan pengguna. Faktor-faktor yang
mempengaruhi kekerasan tablet adalah tekanan kompresi dan sifat bahan yang
dikempa. Peningkatan jumlah bahan pengikat akan meningkatkan kekerasan tablet
meskipun tekanan kompresinya sama. Kekerasan tablet berhubungan langsung
dengan waktu hancur dan disolusi (Hadisoewignyo dan Fudholi, 2013).
2.5.4 Uji friabilitas
Sebanyak 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
19
menit (100 kali putaran). Setelah batas waktu yang telah ditentukan tablet
dikeluarkan dan dibersihkan dari debu, lalu ditimbang beratnya (b gram). Tablet
yang baik mempunyai friabilitas kurang dari 1% (Charles dan Wikarsa, 2010).
F = (a – b)/a x 100%.
Keterangan:
F = friabilitas (%)
a = bobot tablet sebelum diuji (g)
b = bobot tablet setelah diuji (g)
Kerapuhan tablet merupakan parameter yang menggambarkan kekuatan
permukaan tablet dalam melawan berbagai perlakuan yang menyebabkan abrasi
pada permukaan tablet. Uji kerapuhan/keregasan tablet berhubungan dengan
kehilangan bobot akibat abrasi yang terjadi pada permukaan tablet. Semakin besar
nilai persentase kerapuhan, semakin besar pula masa tablet yang hilang.
2.5.5 Uji waktu hancur
Pengujian dilakukan terhadap 6 tablet. Dimasukkan 1 tablet pada masing-masing
tabung dari keranjang. Tanpa menggunakan cakram jalankan alat, gunakan cairan
lambung buatan LP bersuhu 370 + 20 sebagai media. Setelah alat dijalankan
selama 1 jam, angkat keranjang dan amati semua tablet, tablet tidak hancur, retak
atau menjadi lunak. Kemudian masukkan satu cakram pada tiap tabung dan
jalankan alat, gunakan cairan usus buatan LP bersuhu 370 + 20 sebagai media
selama jangka waktu 2 jam ditambah dengan batas waktu yang dinyatakan
masing-masing monografi atau bila dalam monografi dinyatakan hanya tablet
salut enterik, maka hanya selama batas waktu yang dinyatakan dalam monografi.
20
Bila 1 tablet atau 2 tablet tidak hancur sempurna, ulangi pengujian dengan
12 tablet lainnya. Tidak kurang 16 dari 18 tablet yang diuji harus hancur
sempurna (Ditjen POM., 1995). Waktu yang diperlukan untuk menghancurkan
tablet SR < 2 jam dan untuk tablet salut enterik < 1 jam.
Agar dapat diabsorpsi setelah pemberian peroral, tablet harus dapat
hancur, larut, dan tersedia dalam bentuk molekulnya. Waktu hancur tablet adalah
waktu yang diperlukan sejumlah tablet untuk hancur menjadi granul/partikel
penyusunnya yang mampu melewati ayakan nomor mesh 4, yang terdapat pada
bagian bawah alat uji. Hasil uji waktu hancur yang baik tidak menjamin bahwa
disolusi dan ketersediaan hayati tablet juga akan baik, karena waktu hancur bukan
parameter yang dapat menggambarkan/berkaitan dengan ketersediaan hayati. Uji
ini penting untuk kontrol variasi dari lot ke lot, sehingga menjamin mutu tablet.
Faktor-faktor yang dapat mempengaruhi waktu hancur, antara lain bahan
tambahan yang digunakan, metode pembuatan tablet, jenis dari konsentrasi
pelicin, tekanan mesin pada saat pentabletan, dan sifat fisika kimia bahan
penyusun tablet ((Hadisoewignyo dan Fudholi, 2013).
2.5.6 Uji disolusi
Uji disolusi secara in vitro dilakukan untuk mengetahui pelepasan natrium
diklofenak dari tablet. Uji dilakukan dengan menggunakan alat uji disolusi tablet.
Satu tablet dimasukkan ke dalam alat uji tablet dengan menggunakan dayung
berisi medium 900 ml. Pengujian dilakukan dalam medium asam klorida 0,1 N
selama 2 jam dan larutan dapar fosfat pH 6,8 selama 1 jam untuk tablet salut
enterik dan 6 jam untuk sediaan sustained release pada suhu 370 + 0,50 C.
21
tablet salut enterik dan pada waktu 10, 30, 60, 90, 120, 240, 360 menit untuk
sediaan sustained release dengan volume 5 ml setiap kali pengambilan sampel.
Volume medium diganti dengan larutan medium baru dengan volume dan suhu
yang sama. Masing-masing sampel yang diambil dianalisa menggunakan
spektrofotometer UV-vis pada panjang gelombang maksimum 276 nm untuk
22
BAB III
METODOLOGI PENELITIAN
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah Disintegration Tester
(Copley), Dissolution Tester (Veego), Strong Cobb Hardness Tester (Erweka),
Roche Friabilator (Erweka), Spektrofotometer UV (Shimadzu), Stopwatch,
Neraca listrik (Boeko), sejumlah alat gelas lainnya.
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Natrium
Diklofenak (BPFI), Voltaren SR 75 mg (Novartis), Deflamat CR 75 mg (Actavis),
Voltaren 50 mg (Novartis), Klotaren 50 mg (Kimia Farma), Natrium Diklofenak
Generik 50 mg (Kimia Farma), NaOH, HCl, KH2PO4, Dapar Fosfat pH 6,8.
3.3 Pembuatan Pereaksi
3.3.1 Akua bebas CO2
Akuades yang telah didihkan selama 5 menit atau lebih dan didiamkan
sampai dingin dan tidak boleh menyerap CO2 dari udara (Ditjen POM., 1995).
3.3.2 Natriun hidroksida (NaOH) 0,1 N
Dilarutkan 4 g NaOH dalam akua bebas CO2 secukupnya hingga 1000 ml
(Ditjen POM., 1995).
3.3.3 Natrium hidroksida (NaOH) 0,2 N
Dilarutkan 8 g NaOH dalam akua bebas CO2 secukupnya hingga 1000 ml
23
3.3.4 Asam klorida (HCl) 0,1 N
Encerkan 8 ml HClp dalam akua bebas CO2 secukupnya hingga 1000 ml
(Ditjen POM., 1995).
3.3.5 Kalium dihidrogen fosfat (KH2PO4) 0,2 M
Larutkan 27,218 g kalium dihidrogen fosfat dalam akua bebas CO2 dan
encerkan sampai 1000 ml (Ditjen POM., 1995).
3.3.6 Dapar fosfat pH 6,8
Dimasukkan 50,0 ml kalium dihidrogen fosfat 0,2 M kedalam labu
tentukur 200 ml, kemudian ditambahkan dengan NaOH 0,2 N sebanyak 22,4 ml
lalu diencerkan dengan akua bebas CO2 hingga 200 ml (Ditjen POM., 1995).
3.4 Penentuan Kurva Serapan Dan Linieritas Kurva Kalibrasi Natrium Diklofenak Dalam Larutan NaOH 0,1 N
3.4.1 Pembuatan larutan induk baku I (LIB I)
Ditimbang natrium diklofenak baku sebanyak 75 mg, dimasukkan
kedalam labu 100 ml. Ditambahkan larutan NaOH 0,1 N, dikocok sampai larut
dan ditambahkan lagi larutan NaOH 0,1 N sampai garis tanda. Konsentrasi teoritis
750 μg/ml.
3.4.2 Pembuatan larutan induk baku II (LIB II)
Dipipet 10 ml LIB I dimasukkan kedalam labu 50 ml, ditambahkan larutan
NaOH 0,1 N, dikocok sampai larut dan ditambahkan lagi larutan NaOH 0,1 N
24
3.4.3 Penentuan kurva serapan natrium diklofenak dalam larutan NaOH 0,1N
Dipipet 6 ml LIB II dimasukkan ke dalam labu 50 ml, ditambahkan larutan
NaOH 0,1 N, dikocok sampai larut dan ditambahkan lagi dengan NaOH 0,1 N
sampai garis tanda. Konsentrasi teoritis 18 μg/ml.
3.4.4 Penentuan linieritas kurva kalibrasi natrium diklofenak dalam larutan NaOh 0,1 N
Pipet LIB II (150 μg/ml) berturut-turut 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, masing-masing masukkan kedalam labu tentukur 50 ml ditambahkan larutan
NaOH 0,1 N sampai garis tandasehingga diperoleh konsentrasi berturut-turut 6
μg/ml, 8 μg/ml, 10 μg/ml, 12 μg/ml, 14 μg/ml. Masing-masing larutan diukur serarpannya menggunakan spektrofotoneter UV pada panjang gelombang
maksimum.
3.5 Evaluasi Tablet
3.5.1 Uji penetapan kadar natrium diklofenak
Timbang dan serbukkan tidak kurang dari 20 tablet. Timbang seksama
sejumlah serbuk setara dengan 75 mg natrium diklofenak (penimbangan serbuk
dilakukan sebanyak 6 kali pengulangan), dimasukkan ke dalam labu tentukur 100
ml. Kemudian ditambahkan NaOH 0,1 N, dikocok hingga larut dan dicukupkan
dengan NaOH 0,1 N hingga garis tanda. Kemudian disaring, 10 ml filtrat pertama
dibuang. Dipipet 0,6 ml filtrat, dimasukkan ke dalam labu tentukur 25 ml,
diencerkan dengan NaOH 0,1 N hingga garis tanda, lalu dikocok sampai
homogen. Diukur serapannya pada panjang gelombang maksimum yang
25
90,0% dan tidak lebih dari hingga 110,0% dari yang tertera pada etiket (USP 30,
2007). Pengujian pada sediaan lainnya dilakukan dengan cara yang sama.
3.5.2 Uji kekerasan tablet
Alat : Hardness Tester (Copley)
Cara : Diambil 6 tablet, masing-masing diletakkan pada tempat yang tersedia pada
alat dengan posisi tidur, alat diatur, kemudian ditekan tombol start. Pada saat
tablet pecah angka yang tertera pada layar digital dicatat. Syarat kekerasan tablet
salut 10-20 kg (Abu-Izza, et al, 2004).
3.5.3 Uji friabilitas
Alat : Roche Friabilator (Erweka)
Cara : Ditimbang 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
gram). Tablet dimasukkan ke dalam alat friabilator, lalu alat dijalankan selama 4
menit (100 kali putaran). Setelah batas waktu yang telah ditentukan tablet
dikeluarkan dan dibersihkan dari debu, lalu ditimbang beratnya (b gram).
Friabilitas (F) = (a – b)/a x 100%
Ketetuan umum : Kehilangan berat < 1%.
3.5.4 Uji waktu hancur
Alat : Disintegration Tester (Copley)
Cara : Pengujian dilakukan terhadap 6 tablet. Dimasukkan 1 tablet masing-masing
tabung dari keranjang. Tanpa menggunakan cakram jalankan alat, gunakan cairan
lambung buatan LP bersuhu 370 + 20 sebagai media. Setelah alat dijalankan
selama 1 jam, angkat keranjang dan amati semua tablet, tablet tidak hancur, retak
atau menjadi lunak. Kemudian masukkan satu cakram pada tiap tabung dan
26
selama jangka waktu 2 jam ditambah dengan batas waktu yang dinyatakan
masing-masing monografi atau bila dalam monografi dinyatakan hanya tablet
salut enterik, maka hanya selama batas waktu yang dinyatakan dalam monografi.
Angkat keranjang dan amati semua tablet, semua tablet harus hancur sempurna.
Bila 1 tablet atau 2 tablet tidak hancur sempurna, ulangi pengujian dengan 12
tablet lainnya. Tidak kurang 16 dari 18 tablet yang diuji harus hancur sempurna
(Ditjen POM, 1995).
Persyaratan : waktu yang diperlukan untuk menghancurkan tablet SR < 2 jam dan
untuk tablet salut enterik < 1 jam. Pengujian pada tablet yang lain dilakukan
dengan cara yang sama.
3.5.5 Uji keseragaman kandungan
Satu tablet digerus lalu dimasukkan kedalam labu tentukur 100 ml dan
dilarutkan dan diencerkan dengan larutan NaOH 0,1 N hingga garis tanda.
Kemudian disaring, 10 ml filtrat pertama dibuang. Dipipet 0,4 ml filtrat,
dimasukkan ke dalam labu tentukur 25 ml, diencerkan dengan NaOH 0,1 N
hingga garis tanda, lalu dikocok sampai homogen hingga diperoleh konsentrasi.
Larutan ini lalu diukur serapannya dengan menggunakan spektrofotometer UV
pada panjang gelombang 276 nm. Tablet memenuhi persyaratan dalam
keseragaman kandungan jika kadarnya terletak antara 85% hingga 115% dari
yang tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan
6,0%. Jika tidak memenuhi syarat maka dilakukan uji 20 satuan tambahan, dan
persyaratan dipenuhi jika tidak lebih dari 1 satuan dari 30 yang terletak diluar
rentang 85% hingga 115% dari yang tertera pada etiket dan tidak ada satuan yang
27
simpangan baku relatif dari 30 satuan sediaan tidak lebih dari 7,8 % (Ditjen POM,
1995). Pengujian pada sediaan lainnya dilakukan dengan cara yang sama.
3.5.6 Uji disolusi
Tahap asam
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester.
Medium : 900 ml asam klorida 0,1N
Alat : tipe 2 (metode dayung)
Kecepatan putaran : 50 rpm
Cara : Prosedur setelah 2 jam, angkat tiap tablet (bagian terbesar tablet jika tablet
tidak utuh lagi) dari masing-masing wadahnya. Lakukan uji seperti terterapada
tahap dapar. Tambahkan 20 ml natrium hidroksida 5 N pada asam klorida 0,1 N
yang tersisa dalam tiap wadah, aduk selama 5 menit. Tentukan jumlah
C14H10Cl2NnaO2 yang terlarut dengan mengukur serapan alikuot dan serapan
Larutan baku pada panjang gelombang serapan maksimum lebih kurang 276 nm.
Tahap dapar
Medium : 900 ml dapar posfat pH 6,8
Alat : tipe 2 (metode dayung)
Kecepatan putaran : 50 rpm
Cara : Prosedur setelah 45 menit lakukan penetapan jumlah C14H10Cl2NnaO2,
yang terlarut dengan mengukur serapan alikuot, jika perlu encerkan dengan media
disolusi, dan bandingkan dengan serapan larutan baku pada panjang gelombang
28
Toleransi harus larut tidak kurang dari 75% (Q) C14H10Cl2NnaO2, dari jumlah
yang tertera pada etiket ( Ditjen POM, 2014).
Pengujian pada mikro kapsul dilakukan dengan menggunakan metode keranjang.
Kriteria penerimaan zat aktif yang larut dengan disolusi dapat di lihat pada Tabel
3.1 sebagai berikut :
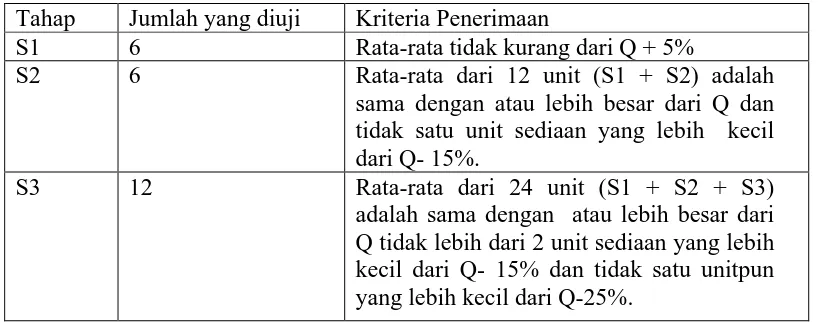
Tabel 3.1. Kriteria penerimaan zat aktif yang larut dengan disolusi
Tahap Jumlah yang diuji Kriteria Penerimaan
S1 6 Rata-rata tidak kurang dari Q + 5%
S2 6 Rata-rata dari 12 unit (S1 + S2) adalah
sama dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q- 15%.
S3 12 Rata-rata dari 24 unit (S1 + S2 + S3)
adalah sama dengan atau lebih besar dari Q tidak lebih dari 2 unit sediaan yang lebih kecil dari Q- 15% dan tidak satu unitpun yang lebih kecil dari Q-25%.
3.5.7 Analisis data secara statistik
Kadar zat aktif sebenarnya yang terkandung dalam sampel dapat diketahui
menggunakan uji distribusi t. Data diterima atau ditolak dihitung dengan
menggunakan metode standar deviasi dengan rumus:
SD = Σ( X – χ )²
Ƞ - 1
Keterangan: X = nilai dari masing-masing pengukuran
χ = rata-rata dari pengukuran
Untuk mencari thitungdigunakan rumus :
thitung= X – χ
29
Parmar, (2009) mengatakan sebagai dasar penolakan data hasil uji analisis
adalah thitung ≥ tTabel atau thitung < = tTabel. Untuk menentukan kadar zat aktif dalam
sampel dengan taraf kepercayaan 99%, α = 0.01, dk= n-1, dapat digunakan rumus:
Kadar sebenarnya : µ = χ ± t0,5αdk x (SD/ √n )
Keterangan ;
χ = Interval kepercayaan kadar sampel
�� = Kadar rata-rata sampel
SD = Standar Deviasi
dk = derajat kebebasan (dk = n-1)
α = taraf kepercayaan
n = jumlah perlakuan
3.5.7.1 Uji statistik terhadap evaluasi waktu hancur
Evaluasi dari sediaan tablet natrium diklofenak dibandingkan secara in
vitro. Data dibandingkan menggunakan uji anova dengan signifikansi (p< 0,05).
Analisis statistik dilakukan menggunakan program SPSS 18.0.
3.5.7.2 Uji statistik terhadap profil pelepasan obat
Profil pelepasan obat sediaan tablet natrium diklofenak dibandingkan
secara in vitro. Data dibandingkan menggunakan uji anova dengan signifikansi (p
30
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Evaluasi Sediaan Natrium Diklofenak
Evaluasi sediaan natrium diklofenak yang meliputi: kekerasan, friabilitas,
waktu hancur, keseragaman kandungan, uji disolusi, dan penetapan kadar zat
berkhasiat. Hasil evaluasi sediaan natrium diklofenak yang diperoleh dapat
dilihat pada Tabel 4.1.
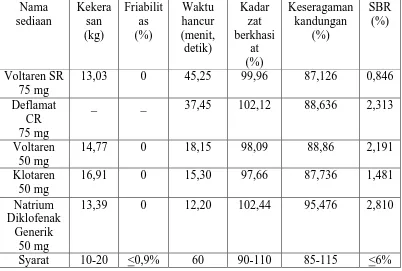
Tabel 4.1. Hasil evaluasi pada masing-masing sediaan natrium diklofenak
Nama
Nilai kekerasan tablet dapat dilihat dari Tabel 3.1 diatas dan Gambar 4.1
yaitu pada masing-masing sediaan, dimana kekerasan tablet pada Voltaren SR 75
mg sebesar 13,03 kg, Voltaren 50 mg sebesar 14,77 kg, Klotaren 50 mg sebesar
31
Kekuatan tablet ditentukan dengan cara mengukur kekerasan dan
keregasan tablet. Uji kekerasan tablet merupakan salah satu parameter penting
dalam pembuatan tablet, untuk menjamin agar tablet tetap utuh sampai ke tangan
konsumen baik selama proses pengemasan maupun selama proses pendistribusian.
Walaupun hasil uji kekerasan tablet pada setiap formula bervariasi tapi semua
masih memenuhi syarat kekerasan untuk tablet salut. Syarat kekerasan tablet
konvensional adalah 4 - 8 kg, namun pada tablet salut syarat kekerasannya 10-20
kg (Hadisoewignyo dan Fudholi, 2013).
Diagram batang hasil uji evaluasi kekerasan tablet salut natrium diklofenak dapat
dilihat pada Gambar 4.1 sebagai berikut:
Gambar 4.1. Diagram batang hasil uji kekerasan
Keterangan:
Sediaan 1 = Voltaren SR 75 mg = 13,03 kg
Sediaan 2 = Voltaren 50 mg = 14,77 kg
Sediaan 3 = Klotaren 50 mg = 16,91 kg
Sediaan 4 = Natrium Diklofenak Generik 50 mg = 13,39 kg
32
Friabilitas memberi gambaran ketahanan tablet terhadap benturan mekanis
pada saat pengemasan dan pendistribusian (Lachman, 1994). Nilai friabilitas yang
besar menunjukkan tablet yang rapuh. Hasil evaluasi friabilitas tablet dari Tabel
3.1 yaitu Voltaren SR 75 mg sebesar 0%, Voltaren 50 mg sebesar 0 %, Klotaren
50 mg sebesar 0%, dan Natrium Diklofenak Generik sebesar 0%. Hal ini
menunjukkan bahwa hasil evaluasi friabilitas tablet dari semua sediaan memenuhi
persyaratan yang telah ditetapkan. Dan hasil yang ditunjukkan memiliki nilai yang
sama dan berada dalam batas penerimaan evaluasi friabilitas tablet. Friabilitas
(kehilangan bobot) dari tablet yang diperbolehkan ≤ 1% (Sharma, et al, 2011).
4.1.3 Waktu hancur in vitro
Hasil uji waktu hancur secara in vitro dapat dilihat pada Tabel 4.1 dan
diagram waktu hancur secara in vitro pada Gambar 4.2. Dari data tersebut dapat
dilihat bahwa waktu hancur dari semua sediaan memiliki waktu hancur yang
cepat, yaitu Voltaren SR 75 mg sebesar 45,25 menit; Deflamat CR 75 mg sebesar
37,45 menit; Voltaren 50 mg sebesar 18,15 menit, Klotaren 50 mg sebesar 15,30
menit, dan Natrium Diklofenak Generik sebesar 12,20 menit. Waktu hancur dari
sediaan salut selaput (film) jauh lebih lama dibandingkan dengan sediaan salut
enterik. Walaupun hasil yang ditunjukkan bervariasi tetapi masih berada dalam
batas penerimaan evaluasi waktu hancur tablet. Waktu untuk menghancurkan
tablet tidak lebih dari 15 menit untuk tablet tidak bersalut dan tidak lebih dari 60
menit untuk tablet bersalut (Hadisoewignyo dan Fudholi, 2013).
Diagram batang hasil uji evaluasi waktu hancur in vitro sediaan natrium
33
Gambar 4.2. Diagram batang hasil uji waktu hancur
Keterangan:
Sediaan 1 = Voltaren SR 75 mg = 42,45 menit
Sediaan 2 = Deflamat CR 75 mg = 37,45 menit
Sediaan 3 = Voltaren 50 mg = 18,15 menit
Sediaan 4 = Klotaren 50 mg = 15,3 menit
Sediaan 5 = Natrium Diklofenak Generik 50 mg = 12,2 menit
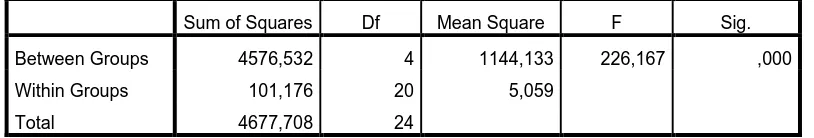
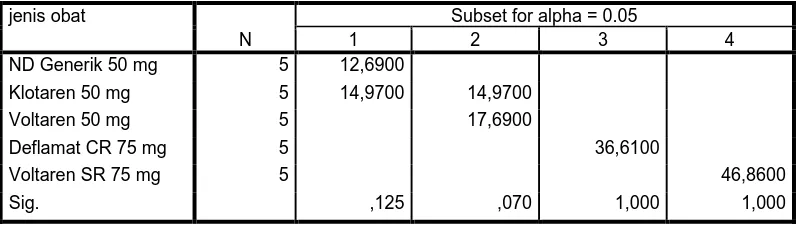
4.1.4 Hasil uji ANOVA dan Duncan waktu hancur in vitro sediaan natrium diklofenak
Data waktu hancur yang telah diperoleh dari berbagai sediaan digunakan
untuk mengetahui apakah ada perbedaan yang signifikan atau bermakna,maka
dilakukan uji statistik ANOVA dengan menggunakan program SPSS 18.0 dengan
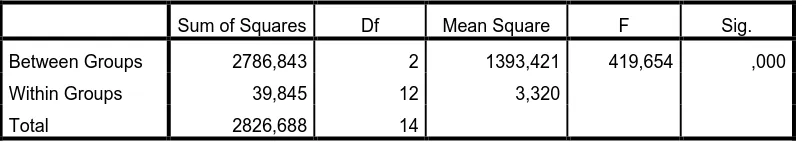
p < 0,05 pada Tabel 4.2.
Tabel 4.2 Hasil uji ANOVA waktu hancur sediaan natrium diklofenak