ABSTRAK
OSY YOSTIA UTAMI
.
Komponen Minyak Atsiri Daun Sirih (
Piper Betle
L.)
dan Potensinya dalam Mencegah Ketengikan Minyak Kelapa. Dibimbing oleh Dr.
LAKSMI AMBARSARI, MS dan WARAS NURCHOLIS, M.Si.
ABSTRACT
OSY YOSTIA UTAMI. Composition of Essential Oil Betel Leaf
(Piper betle
L.
)
and Potential to Tackling Rancidty in Coconut Oil.
Under the direction of Dr.
LAKSMI AMBARSARI, MS dan WARAS NURCHOLIS, M.Si.
1
PENDAHULUAN
Pengembangan produk minyak kelapa untuk memenuhi kebutuhan pangan dalam negeri memiliki prospek yang baik untuk jangka panjang. Hal tersebut karena Indonesia memiliki potensi area perkebunan kelapa yang luas bila dibandingkan dengan negara-negara penghasil kelapa yang lainnya. Menurut data Coconut Statistical Yearbook (2006) luas area perkebunan kelapa di Indonesia yaitu 3.701 Ha.
Minyak merupakan salah satu bahan pangan yang penting bagi kebutuhan tubuh manusia. Selain itu minyak juga merupakan sumber energi, yaitu satu gram minyak dapat menghasilkan 9 kkal (Winarno 2002). Masalah yang sangat menentukan terhadap mutu minyak kelapa adalah ketengikan. Minyak (nabati) mengandung asam lemak tak jenuh dan beberapa asam lemak esensial seperti asam oleat, linoleat dan linolenat (Sulistyoet al.2006).
Besarnya kandungan asam oleat dan asam linoleat pada minyak sangat mempengaruhi stabilitas minyak. Minyak kelapa sawit mengandung senyawa karotenoida yang mampu menghambat proses oksidasi, namun kadar karotenoida yang terdapat pada minyak kalapa tergolong rendah sehingga lebih mudah teroksidasi. Oksidasi adalah faktor yang sangat penting sebab dapat menghasilkan senyawa-senyawa yang menyumbangkan terjadinyaoff flavour dan kondisi ini lazim disebut tengik (rancid). Produk pangan olahan yang tengik dapat mengalami perubahan warna dan kehilangan nilai gizi karena oksidasi vitamin dan asam lemak tak jenuh. Selanjutnya mutu produk akan menurun, selain itu hasil oksidasi lipid akan menghasilkan senyawa peroksida, aldehid dan keton yang dapat membahayakan kesehatan manusia, sehingga perlu dilakukan upaya untuk mengatasinya. Salah satu cara adalah menambahkan senyawa antioksidan pada minyak kelapa agar tidak mudah teroksidasi. Antioksidan adalah senyawa yang secara alami terdapat dalam hampir semua bahan makanan, karena bahan makanan dapat mengalami degradasi baik secara fisik maupun kimia sehingga fungsinya berkurang. Antioksidan diperlukan untuk mengawetkan makanan yang mengandung minyak atau lemak dengan nilai gizi dari makanan itu tidak berkurang (Susiloningsih 2009).
Penggunaan antioksidan sintestis seperti BHA (Butil Hidroksi Anisol) dan BHT (Butil Hidroksi Toulene) sangat efektif untuk menghambat minyak atau lemak agar tidak terjadi oksidasi, namun penggunaan BHA dan BHT banyak menimbulkan kekhawatiran akan efek sampingnya. Hasil uji yang telah dilakukan tehadap penggunaan BHT didapatkan bahwa BHT dapat menyebabkan pembengkakan organ hati dan mempengaruhi aktifitas enzim di dalam hati. Selain itu juga menyebabkan pendarahan yang fatal pada dan pankreas (Komayaharti 2006). Kekhawatiran akan efek samping antioksidan sintetis mendorong untuk mencari antioksidan alami yang lebih aman. Salah satu bahan alam yang berpotensi sebagai antioksidan adalah daun sirih.
Berdasarkan uji pendahuluan yang dilakukan Komaharyati (2006) menunjukkan bahwa penambahan ekstrak daun sirih pada minyak kelapa dihasilkan bilangan peroksida yang kecil setelah penyimpanan 25 hari. Penelitian lain membuktikan bahwa minyak atsiri daun sirih dapat meredam radikal bebas pada difenilpikril hidrazil (DPPH) sebesar 81,91% (Parwataet all2009).
Tujuan penelitian ini adalah menguji potensi kimiawi minyak atsiri daun sirih dalam mencegah oksidasi yang dapat menghasilkan senyawa-senyawa radikal bebas sebagai penyebab off flavour atau tengik (rancid) pada minyak kelapa yang lazim di sebut dengan kenaikan bilangan peroksida. Hipotesis penelitian ini adalah kandungan senyawa fenol pada minyak atsiri daun sirih yang berfungsi sebagai antioksidan dan dapat mencegah kenaikan bilangan peroksida pada minyak kelapa, sehingga didapatkan minyak kelapa yang mempunyai daya simpan lebih lama.
TINJAUAN PUSTAKA
Daun Sirih (Piper betleL.)
-1
PENDAHULUAN
Pengembangan produk minyak kelapa untuk memenuhi kebutuhan pangan dalam negeri memiliki prospek yang baik untuk jangka panjang. Hal tersebut karena Indonesia memiliki potensi area perkebunan kelapa yang luas bila dibandingkan dengan negara-negara penghasil kelapa yang lainnya. Menurut data Coconut Statistical Yearbook (2006) luas area perkebunan kelapa di Indonesia yaitu 3.701 Ha.
Minyak merupakan salah satu bahan pangan yang penting bagi kebutuhan tubuh manusia. Selain itu minyak juga merupakan sumber energi, yaitu satu gram minyak dapat menghasilkan 9 kkal (Winarno 2002). Masalah yang sangat menentukan terhadap mutu minyak kelapa adalah ketengikan. Minyak (nabati) mengandung asam lemak tak jenuh dan beberapa asam lemak esensial seperti asam oleat, linoleat dan linolenat (Sulistyoet al.2006).
Besarnya kandungan asam oleat dan asam linoleat pada minyak sangat mempengaruhi stabilitas minyak. Minyak kelapa sawit mengandung senyawa karotenoida yang mampu menghambat proses oksidasi, namun kadar karotenoida yang terdapat pada minyak kalapa tergolong rendah sehingga lebih mudah teroksidasi. Oksidasi adalah faktor yang sangat penting sebab dapat menghasilkan senyawa-senyawa yang menyumbangkan terjadinyaoff flavour dan kondisi ini lazim disebut tengik (rancid). Produk pangan olahan yang tengik dapat mengalami perubahan warna dan kehilangan nilai gizi karena oksidasi vitamin dan asam lemak tak jenuh. Selanjutnya mutu produk akan menurun, selain itu hasil oksidasi lipid akan menghasilkan senyawa peroksida, aldehid dan keton yang dapat membahayakan kesehatan manusia, sehingga perlu dilakukan upaya untuk mengatasinya. Salah satu cara adalah menambahkan senyawa antioksidan pada minyak kelapa agar tidak mudah teroksidasi. Antioksidan adalah senyawa yang secara alami terdapat dalam hampir semua bahan makanan, karena bahan makanan dapat mengalami degradasi baik secara fisik maupun kimia sehingga fungsinya berkurang. Antioksidan diperlukan untuk mengawetkan makanan yang mengandung minyak atau lemak dengan nilai gizi dari makanan itu tidak berkurang (Susiloningsih 2009).
Penggunaan antioksidan sintestis seperti BHA (Butil Hidroksi Anisol) dan BHT (Butil Hidroksi Toulene) sangat efektif untuk menghambat minyak atau lemak agar tidak terjadi oksidasi, namun penggunaan BHA dan BHT banyak menimbulkan kekhawatiran akan efek sampingnya. Hasil uji yang telah dilakukan tehadap penggunaan BHT didapatkan bahwa BHT dapat menyebabkan pembengkakan organ hati dan mempengaruhi aktifitas enzim di dalam hati. Selain itu juga menyebabkan pendarahan yang fatal pada dan pankreas (Komayaharti 2006). Kekhawatiran akan efek samping antioksidan sintetis mendorong untuk mencari antioksidan alami yang lebih aman. Salah satu bahan alam yang berpotensi sebagai antioksidan adalah daun sirih.
Berdasarkan uji pendahuluan yang dilakukan Komaharyati (2006) menunjukkan bahwa penambahan ekstrak daun sirih pada minyak kelapa dihasilkan bilangan peroksida yang kecil setelah penyimpanan 25 hari. Penelitian lain membuktikan bahwa minyak atsiri daun sirih dapat meredam radikal bebas pada difenilpikril hidrazil (DPPH) sebesar 81,91% (Parwataet all2009).
Tujuan penelitian ini adalah menguji potensi kimiawi minyak atsiri daun sirih dalam mencegah oksidasi yang dapat menghasilkan senyawa-senyawa radikal bebas sebagai penyebab off flavour atau tengik (rancid) pada minyak kelapa yang lazim di sebut dengan kenaikan bilangan peroksida. Hipotesis penelitian ini adalah kandungan senyawa fenol pada minyak atsiri daun sirih yang berfungsi sebagai antioksidan dan dapat mencegah kenaikan bilangan peroksida pada minyak kelapa, sehingga didapatkan minyak kelapa yang mempunyai daya simpan lebih lama.
TINJAUAN PUSTAKA
Daun Sirih (Piper betleL.)
-3
terpen perlu dipisahkan untuk tujuan tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri yang bebas terpen. Pemisahan minyak atsiri dilakukan dengan cara isolasi. Isolasi minyak atsiri dapat dilakukan dengan beberapa cara, yaitu penyulingan (distillation), pengepresan (pressing), ekstraksi dengan pelarut menguap (solvent extraction), ekstraksi dengan lemak (Sostaric 2000).
Menurut Hermawan (2007) daun sirih mengandung 4.2% minyak atsiri yang sebagian besar terdiri dari betephenol yang
merupakan isomer Euganol
allypyrocatechine, Cineol methil euganol, Caryophyllen (siskuiterpen), kavikol, kavibekol, estragol dan terpinen. Senyawa fenol, kavikol, eugenol, dan sineol, dilihat dari strukturnya senyawa-senyawa tersebut tidak atau kurang larut dalam pelarut polar, sehingga pada fraksinasi digunakan pelarut non polar dan semi polar. Senyawa fenol ini memiliki potensi sebagi antioksidan. Berdasarkan uji pendahuluan yang dilakukan diketahui bahwa minyak atsiri dapat meredam radikal bebas (pada difenilpikril hidrazil) sebesar 81,91% (Parwata et all 2009). Selain itu, menurut Mursito (2000) ekstrak heksana:etanol daun sirih ternyata masih mengandung β-karoten sebanyak 0.219 mg/100 g tepung daun bebas lemak, atau 0.219 mg/4 ml ekstrak. Minyak atsiri termasuk dalam golongan senyawa organik terpena dan terpenoid yang bersifat larut dalam minyak/lipofil (Prawitaet al.2009).
Minyak Kelapa
Menurut Ketaren (2006) berdasarkan kandungan asam lemak, minyak kelapa digolongkan ke dalam minyak asam laurat, karena kandungan asam lauratnya paling besar bila dibandingkan dengan asam lemak lainnya. Berdasarkan tingkat kejenuhannya yang dinyatakan dengan bilangan Iod yang berkisar antara 7.5-10.5.
Bentuk minyak kelapa yang beredar di pasar ada tiga jenis yaituRBD-Coconut Oil (minyak kelapa RBD),Traditional Coconut Oil (minyak kelapa tradisional) dan Virgin Coconut Oil(minyak kelapa murni). Minyak kelapa RBD merupakan minyak yang diproses dengan penambahan bahan kimia dalam pemurnian minyak (refined), pemutihan minyak (bleaching) dan penghilangan bau yang tidak sedap (deodorized). Traditional Coconut Oil (minyak kelapa tradisional) adalah minyak
kelapa yang diolah secara tradisional yang mulai dari penghancuran buah kelapa segar hingga pemanasan yang menghasilakan minyak dan ampas atau blondo (Budiarso 2004).
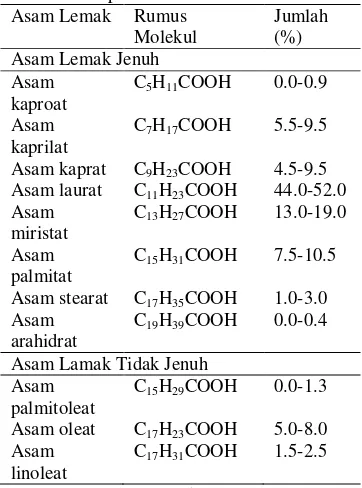
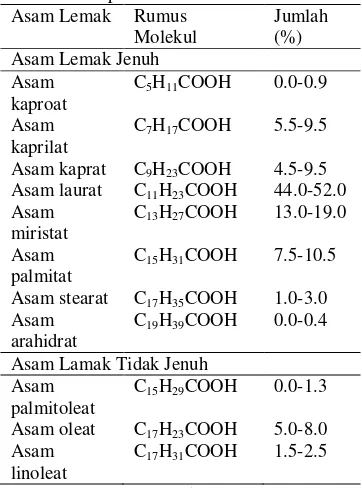
Stiaji (2005) juga menyebutkan bahwa ada beberapa metode pemrosesan minyak kelapa berbeda, diantaranya dengan pemanasan, fermentasi dan pengeringan di bawah sinar matahari yang kita sebut kopra. Metode pemrosesan minyak kelapa akan mempengaruhi kualitas, penampilan, rasa dan aroma dari produk jadi. Komposisi yang paling banyak terkandung pada minyak kelapa adalah asam lemak. Komposisi asam lemak minyak kelapa secara kasar dapat dilihat pada Tabel 1.
Tabel 1 Komposisi asam lemak minyak kelapa kasar
Asam Lemak Rumus Molekul
Jumlah (%) Asam Lemak Jenuh
Asam kaproat
C5H11COOH 0.0-0.9
Asam kaprilat
C7H17COOH 5.5-9.5
Asam kaprat C9H23COOH 4.5-9.5 Asam laurat C11H23COOH 44.0-52.0 Asam
miristat
C13H27COOH 13.0-19.0
Asam palmitat
C15H31COOH 7.5-10.5
Asam stearat C17H35COOH 1.0-3.0 Asam
arahidrat
C19H39COOH 0.0-0.4
Asam Lamak Tidak Jenuh Asam
palmitoleat
C15H29COOH 0.0-1.3
Asam oleat C17H23COOH 5.0-8.0 Asam
linoleat
C17H31COOH 1.5-2.5
Sumber : Sulistyo (2006).
Tabel 1 menunjukkan bahwa asam lemak jenuh minyak kelapa kurang lebih 90 persen. Minyak kelapa mengandung 84 persen trigliserida dengan tiga molekul asam lemak jenuh, 12 persen trigliserida dengan dua asam lemak jenuh, dan 4 persen trigliserida dengan satu asam lemak jenuh (Ketaren 2006).
4
minyak juga memberikan keuntungan. Sterol tidak berwarna, tidak berbau, stabil dan berfungsi sebagai stabilizer dalam minyak. Adapun tokoferol mempunyai tiga isomer yaitu -tokoferol, -tokoferol, dan -tokoferol, bersifat tidak tersabunkan. Namun berbeda dengan kelapa sawit, pada minyak kelapa hanya mengandung sedikit senyawa karotenoida yang dapat berfungsi secara antioksidan (Ketaren 2006). Minyak kelapa layak dipakai dan tidak mudah tengik apabila memenuhi standar mutu yang telah ditentukan untuk menjaga kualitasnya. Standar mutu berdasarkan sifat fisik dan kimia yang digunakan sebagai acuan adalah SNI 01-3394-1998 (Tabel 2).
Tabel 2 Mutu fisiko-kimia minyak kelapa berdasarkan SNI 01- 3394- 1998
Karakteristik SNI
01-3394- 1998 Kadar air maksimum (%) 0.3 Kadar cemaran logam
(mg/kg)
0.1
Bilangan iod (g iod/100 g contoh)
8.0-10.0
Bilangan penyabunan (mg oksigen/100 g)
255-265
Bilangan peroksida maksimum (meq/kg minyak)
≤ 3.0
Asam lemak bebas maksimum (% asam laurat)
≤5.0
Warna dan bau Normal
Minyak pelican Negatif Logam-logam berbahaya
dan arsen
Negatif
Tingginya kadar asam lemak tidak jenuh pada minyak menyebabkan minyak dapat dengan mudah dioksidasi oleh molekul oksigen membentuk hidroperoksida. Proses oksidasi ini dapat menyebabkan hilangnya nilai gizi dan terbentuknya rasa, warna dan bau yang tidak diinginkan, bahkan dapat menyebabkan terbentuknya zat racun. Panas, cahaya, logam dan spesies oksigen reaktif dapat memfasilitasi pembentukan radikal dari lemak (Raharjo 2006).
Sumber oksigen dalam reaksi oksidasi adalah oksigen di atmosfer. Keadaan dasar oksigen di atmosfer berbentuk triplet (3O2). Namun oksigen triplet dapat tereksitasi membentuk oksigen singlet (O2), dan dalam keadaan gas, oksigen singlet ini cukup stabil. dalam keadaan tereksitasi. Oksigen singlet bisa mempercepat reaksi oksidasi (Min 2002).
Oksigen singlet bisa terbentuk oleh reaksi fotokimia terhadap oksigen triplet dengan adanya fotosensitizer. Di alam banyak terdapat senyawa yang berfungsi sebagai fotosensitizer seperti klorofil, porpirin, riboflavin, dan mioglobin yang bisa menyerap energi dari cahaya dan memindahkannya kepada oksigen triplet untuk membentuk oksigen singlet (Liedias 2000).
Oksidasi lemak oleh spesies oksigen reaktif melibatkan tiga langkah, yaitu inisiasi, propagasi, dan terminasi. Pada tahap inisiasi terjadi pembentukan radikal asam lemak, yaitu suatu senyawa turunan asam lemak yang bersifat tidak stabil dan sangat reaktif akibat dari hilangnya satu atom hidrogen (reaksi 1). Pada tahap selanjutnya, yaitu propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi (reaksi 2). Radikal peroksi lebih lanjut akan menyerang asam lemak menghasilkan hidroperoksida dan radikal asam lemak baru (reaksi 3). Terminasi terjadi dengan bereaksinya radikal peroksil dengan antioksidan penangkap radikal. Selain itu setiap radikal alkil atau radikal pada rantai karbon asam lemak (R*) dapat bereaksi dengan peroksida lemak (ROO*) menghasilkan produk senyawa seperti dimer ROOR yang relatif stabil (Raharjo 2006). Inisiasi : RH R*+ H Propagasi : R*+ O2 ROO*
ROO*+ RH ROOH + R*
Terminasi : R*+ R* R-R R*+ROO* ROOR Adanya ikatan rangkap pada asam lemak memperlemah ikatan C-H pada atom karbon yang dekat dengan ikatan rangkap tersebut sehingga atom H pada ikatan tersebut dapat dengan mudah diambil oleh spesies oksigen reaktif menghasilkan radikal bebas dari asam lemak tidak jenuh (Gambar 2). (Raharjo 2006).
8
Metode
Ekstraksi Minyak Atsiri dari Daun Sirih
Daun sirih yang digunakan adalah daun segar dengan umur panen 6 bulan dan merupakan daun ketiga dari tunas muda. Daun sirih yang sudah dipotong-potong sebanyak 10 kg, dimasukkan ke dalam alat destilasi yang telah diisi dengan air. Alat destilasi uap kemudian dirangkai dengan merangkaikan pendingin (kondensor), kemudian dipanaskan dan dijaga agar tidak menggunakan temperatur yang tinggi. Air dialirkan ke kondensor dan dijaga agar air terus mengalir. Temperatur kondensor dijaga tetap dingin sehingga minyak yang menguap semuanya terembunkan dan tidak lepas ke udara. Destilat yang diperoleh merupakan campuran minyak dengan air. Selanjutnya destilat ditambahkan natrium klorida (NaCl) agar minyak yang teremulsi terpisah.
Fase air ditampung dengan labu Erlenmeyer, untuk dipisahkan lagi karena kemungkinan masih mengandung sedikit minyak yang teremulasi. Fase air ini ditambahkan lagi dengan NaCl. Pekerjaan ini dilakukan berulang-ulang sampai semua minyak terpisahkan. Setelah diperoleh minyak atsiri, selanjutnya diidentifikasi kandungan kimianya dengan menggunakan GC MS.
Uji Bilangan Peroksida (Metode Iodometri)
Pertama-tama dilakukan preparasi sampel. Minyak kelapa dimasukkan ke dalam labu Erlenmeyer kemudian dipanaskan di atas hot plate dengan magnetic stired untuk menguapkan sisa air yang masih terkandung pada minyak kelapa, kecepatan 1000 rpm pada suhu 90oC sesuai dengan percobaan Komarhayati (2006). Selanjutnya ditambahkan 2 gram minyak atsiri dalam 88 gram minyak kelapa untuk konsentrasi 2%, ditambahkan 3 gram minyak atsiri dalam 87 gram minyak kelapa untuk konsentrasi 3%, ditambahkan 5 gram minyak atsiri dalam 85 gram minyak kelapa untuk konsentrasi 5%, serta kontrol tanpa penambahan minyak atsiri.
Uji bilangan peroksida dilakukan dengan cara sebanyak 5 g sampel minyak (liquid) ditimbang lalu dimasukkan ke dalam Erlenmeyer dan ditambah dengan 30 ml campuran pelarut yang terdiri dari 60% asam asetat glasial dan 40% CHCl3. Setelah minyak larut, ditambahkan sebanyak 50 ml
KI 10% sambil dikocok selama 2 menit. Kemudian ditambahkan 30 ml akuades. Kelebihan Iod akan dititrasi dengan Na2S2O3 0,1N, demikian juga pada kontrol. Pengukuran dilakukan pada hari ke-0, hari ke-5, hari ke-10, hari ke-15, hari ke-20 , hari ke-25 dan hari ke-30. Masing-masing pengujian dilakukan secara triplo.
Standarisasi larutan Na2S2O3 (Metode Iodometri)
Sebanyak 278 mg KIO3 ditimbang dan dimasukkan ke dalam beaker glass, selanjutnya dilarutkan dengan akuades secukupnya, pindahkan ke dalam labu takar 100 ml kemudian diencerkan dengan akuades hingga batas. Larutan tersebut dipindahkan ke dalam Erlenmeyer 250 ml kemudian ditambahkan 0.5 gram KI dan 2 ml HCl 4 N.
Larutan sampel segera dititrasi dengan larutan Na2S2O3 0.1N yang sudah dipersiapkan hingga warna berubah menjadi kuning pucat. Selanjutnya diencerkan dengan 50 ml akuades kemudian tambahkan 2 ml indikator amilum dan dilanjutkan titrasi hingga warna biru hilang. Standarisasi larutan dilakukan tiga kali
Analisis Minyak Atsiri Daun Sirih dengan
Gas Chromatography- Mass Spectroscopy
(GC-MS)
Analisis GC-MS dilakukan meng-gunakan GCMS-QP2010S Shimadzu dengan kondisi analisis sebagai berikut : Sampel dimasukkan, kemudian masuk ke kolom Rtx-5MS 30 meter, diameter 0,25 mm, suhu terprogram dari 80oC sampai 300oC dengan kenaikan suhu 10oC/menit, dan gas pembawa Helium, sedangkan untuk tekanannya sebesar 22 kPa. Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram, sedangkan nama/jenis senyawa yang ada diinterpretasikan berdasarkan data spektra dari setiap puncak tersebut dengan digunakan metode pendekatan pustaka pada database (Pringgenis 2010).
HASIL DAN PEMBAHASAN
Minyak Atsiri Daun Sirih
8
Metode
Ekstraksi Minyak Atsiri dari Daun Sirih
Daun sirih yang digunakan adalah daun segar dengan umur panen 6 bulan dan merupakan daun ketiga dari tunas muda. Daun sirih yang sudah dipotong-potong sebanyak 10 kg, dimasukkan ke dalam alat destilasi yang telah diisi dengan air. Alat destilasi uap kemudian dirangkai dengan merangkaikan pendingin (kondensor), kemudian dipanaskan dan dijaga agar tidak menggunakan temperatur yang tinggi. Air dialirkan ke kondensor dan dijaga agar air terus mengalir. Temperatur kondensor dijaga tetap dingin sehingga minyak yang menguap semuanya terembunkan dan tidak lepas ke udara. Destilat yang diperoleh merupakan campuran minyak dengan air. Selanjutnya destilat ditambahkan natrium klorida (NaCl) agar minyak yang teremulsi terpisah.
Fase air ditampung dengan labu Erlenmeyer, untuk dipisahkan lagi karena kemungkinan masih mengandung sedikit minyak yang teremulasi. Fase air ini ditambahkan lagi dengan NaCl. Pekerjaan ini dilakukan berulang-ulang sampai semua minyak terpisahkan. Setelah diperoleh minyak atsiri, selanjutnya diidentifikasi kandungan kimianya dengan menggunakan GC MS.
Uji Bilangan Peroksida (Metode Iodometri)
Pertama-tama dilakukan preparasi sampel. Minyak kelapa dimasukkan ke dalam labu Erlenmeyer kemudian dipanaskan di atas hot plate dengan magnetic stired untuk menguapkan sisa air yang masih terkandung pada minyak kelapa, kecepatan 1000 rpm pada suhu 90oC sesuai dengan percobaan Komarhayati (2006). Selanjutnya ditambahkan 2 gram minyak atsiri dalam 88 gram minyak kelapa untuk konsentrasi 2%, ditambahkan 3 gram minyak atsiri dalam 87 gram minyak kelapa untuk konsentrasi 3%, ditambahkan 5 gram minyak atsiri dalam 85 gram minyak kelapa untuk konsentrasi 5%, serta kontrol tanpa penambahan minyak atsiri.
Uji bilangan peroksida dilakukan dengan cara sebanyak 5 g sampel minyak (liquid) ditimbang lalu dimasukkan ke dalam Erlenmeyer dan ditambah dengan 30 ml campuran pelarut yang terdiri dari 60% asam asetat glasial dan 40% CHCl3. Setelah minyak larut, ditambahkan sebanyak 50 ml
KI 10% sambil dikocok selama 2 menit. Kemudian ditambahkan 30 ml akuades. Kelebihan Iod akan dititrasi dengan Na2S2O3 0,1N, demikian juga pada kontrol. Pengukuran dilakukan pada hari ke-0, hari ke-5, hari ke-10, hari ke-15, hari ke-20 , hari ke-25 dan hari ke-30. Masing-masing pengujian dilakukan secara triplo.
Standarisasi larutan Na2S2O3 (Metode Iodometri)
Sebanyak 278 mg KIO3 ditimbang dan dimasukkan ke dalam beaker glass, selanjutnya dilarutkan dengan akuades secukupnya, pindahkan ke dalam labu takar 100 ml kemudian diencerkan dengan akuades hingga batas. Larutan tersebut dipindahkan ke dalam Erlenmeyer 250 ml kemudian ditambahkan 0.5 gram KI dan 2 ml HCl 4 N.
Larutan sampel segera dititrasi dengan larutan Na2S2O3 0.1N yang sudah dipersiapkan hingga warna berubah menjadi kuning pucat. Selanjutnya diencerkan dengan 50 ml akuades kemudian tambahkan 2 ml indikator amilum dan dilanjutkan titrasi hingga warna biru hilang. Standarisasi larutan dilakukan tiga kali
Analisis Minyak Atsiri Daun Sirih dengan
Gas Chromatography- Mass Spectroscopy
(GC-MS)
Analisis GC-MS dilakukan meng-gunakan GCMS-QP2010S Shimadzu dengan kondisi analisis sebagai berikut : Sampel dimasukkan, kemudian masuk ke kolom Rtx-5MS 30 meter, diameter 0,25 mm, suhu terprogram dari 80oC sampai 300oC dengan kenaikan suhu 10oC/menit, dan gas pembawa Helium, sedangkan untuk tekanannya sebesar 22 kPa. Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram, sedangkan nama/jenis senyawa yang ada diinterpretasikan berdasarkan data spektra dari setiap puncak tersebut dengan digunakan metode pendekatan pustaka pada database (Pringgenis 2010).
HASIL DAN PEMBAHASAN
Minyak Atsiri Daun Sirih
10
minyak dengan penambahan minyak atsiri daun sirih 5% merupakan penambahan dengan kadar terbaik karena mampu menghambat pembentukan peroksida paling tinggi. Bilangan peroksida yang dihasilkan terendah dibandingkan perlakuan yang lainnya, yaitu sebesar 2.33 Meq/kg bahan dan masih memenuhi kriteria SNI yaitu lebih kecil dari 3 Meq/kg bahan.
Kadar minyak atsiri yang ditambahkan pada minyak kelapa mempengaruhi aktivitas antioksidan dan daya simpannya. Minyak kelapa tanpa penambahan minyak atsiri hanya bertahan sampai hari ke-15, sedangkan penambahan minyak atsiri dengan kadar 2% dan 3% bisa bertahan sampai hari ke-20. Penambahan minyak atsiri 5% dapat meredam kenaikan bilangan peroksida paling lama, sampai hari ke-30 bilangan peroksidanya masih dibawah 3 Meq/kg bahan. Senyawa antioksidan yang terdapat pada minyak atsiri daun sirih di duga bereaksi sebagai pengikat radikal peroksil (ROO*) dan merupakan pengikat yang kuat terhadap radikal hidroksil (OH*) (Aruomaet al.,2007).
Penelitian Komahayarti (2006) dengan menambahkan ekstrak daun sirih 2% pada minyak kelapa menunjukkan bilangan peroksida pada hari ke-25 sebesar 7.33 Meq/kg bahan, sedangakan pada penambahan ekstrak daun sirih 3% menunjukkan bilangan peroksida 6.51 Meq/kg bahan, dan penambahan ekstrak daun sirih 5% menunjukkan bilangan peroksida 5.03 Meq/kg bahan. Nilai bilangan peroksida minyak kelapa pada penambahan ekstrak daun sirih lebih tinggi dibandingkan dengan penambahan minyak atsiri daun sirih dan melebihi standar SNI yang di tentukan untuk standar bilangan peroksida minyak kelapa. Data penelitian tersebut menunjukkan bahwa penambahan minyak atsiri daun sirih pada minyak kelapa lebih efektif mengurangi kenaikan bilangan peroksida minyak kelapa dibandingkan dengan penambahan ekstrak daun sirih pada minyak kelapa.
Penelitian Yudhaningtyas (2008) menunjukkan bahwa penambahan BHT pada minyak kelapa sebanyak 1.82 % dapat menghambat ketengikan minyak kelapa yang disimpan 28 hari. Hal tersebut menunjukkan bahwa penambahan minyak atsiri daun sirih pada minyak kelapa memiliki kemampuan sebagai antioksidan
hampir setara dengan penambahan 1.82% BHT pada minyak kelapa.
Hasil penelitian ini menunjukkan bahwa antioksidan yang terdapat pada minyak atsiri daun sirih berpotensi untuk mencegah atau menghambat autooksidasi lemak minyak yang dapat menyebabkan ketengikan pada minyak kelapa, sama seperti BHT. Namun berdasarkan efek sampingnya, penambahan BHT pada bahan pangan sebagai antioksidan dapat mempengaruhi kesehatan, yaitu dalam jangka waktu panjang dapat menyebabkan pembengkakan dalam hati dan mempengaruhi aktifitas enzim dalam hati. Berdasarkan potensinya, penambahan minyak atsiri daun sirih sebagai pengganti BHT untuk antioksidan pada minyak kelapa bisa menjadi salah satu alternatif, karena minyak atsiri daun sirih merupakan bahan alam dan lebih aman terhadap kesehatan.
Komponen Minyak Atsiri Daun Sirih
Hasil analisis minyak atsiri daun sirih dengan menggunakan GC-MS ditunjukkan pada Gambar 7. Secara keseluruhan teridentifikasi 20 komponen (Lampiran 6) yang diekspresikan dalam bentuk puncak/peak. Setiap puncak mewakili senyawa yang berbeda. Masing-masing puncak kemudian dianalisis dalam spektometer massa dan dibandingkan dengan The National Institute of Standard and Technology database (NIST) yang sudah terintegrasi dalam GC-MS. Hasil analisis dengan GC-MS sesuai dengan penelitian Moeljatno (2003) yang menunjukkan bahwa minyak atsiri daun sirih mengandung senyawa turunan fenol.
11
Gambar 7 Identifikasi komponen minyak atsiri daun sirih dengan GC-MS.
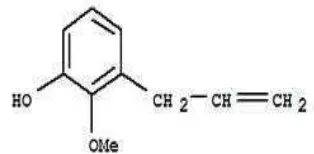
Kandungan minyak atsiri daun sirih hasil identifikasi menggunakan GC-MS secara umum terdiri dari senyawa golongan fenol. Senyawa kimia yang teridentifikasi dengan konsentrasi tinggi yaitu, 2-metoksi-3-(2-propenil) (17.41%), kavikol (16.62%), dan asetil eugenol (13.17%) dengan waktu retensi dapat dilihat pada Lampiran 6.
Golongan fenol dicirikan oleh adanya cincin aromatik dengan satu atau dua gugus hidroksil (Gambar 8). Kelompok fenol terdiri dari ribuan senyawa, meliputi flavonoid, fenilpropanoid, asam fenolat, antosianin, pigmen kuinon, melanin, lignin, dan tanin, yang tersebar luas di berbagai jenis tumbuhan (Harbone 2006).
Gambar 8 Struktur kimia senyawa fenol-2-metksi-3-(2-propenil).
Kadar total fenol dari minyak atsiri daun sirih mempengaruhi hasil aktivitas antioksidannya. Antioksidan fenolik pada minyak atsiri daun sirih bereaksi sebagai scavenger radikal peroksil (ROO*) dan merupakan scavenger yang kuat terhadap radikal hidroksil (OH*). Mekanisme reksi radikal peroksil (ROO*) dan hidroksil
(OH*) dengan antioksidan pada minyak atsiri mirip dengan α-tokoferol (Schuler 2002), yaitu sebagai berikut:
OH* + AH2 H2O + AH* ROO* + AH2 ROOH +AH*
OH* yang terperangkap antioksidan pada daun sirih (AH2) diregenerasi menjadi H2O dan ROO* yang tertangkap AH diregenerasi menjadi ROOH. Hasil penelitian ini menunjukkan bahwa antioksidan fenolik pada minyak atsiri daun sirih dapat digunakan untuk mencegah atau menghambat autooksidasi minyak. Antiokidan ini dapat menangkap radikal bebas yang dihasilkan selama tahap propagasi dari minyak dengan cara mendonasikan radikal hidrogen sehingga radikal lemak tidak aktif melakukan tahap propagasi yang akan merusak lemak. Kemampuan antioksidan untuk mendonasikan hidrogen mempengaruhi aktivitasnya. Hasil penelitian menunjukkan bahwa senyawa fenol-2-metoksi-3-(2-propenil) mempunyai peran sebagai antioksidan pada minyak kelapa sehingga dapat meredam peningkatan bilangan peroksida pada minyak kelapa.
Aroma khas dari minyak atsiri daun sirih itu karena kandungan chavycol acid yang merupakan salah satu senyawa dengan kadar yang besar pada penelitian (16,62%). Senyawa ini memiliki daya antiseptik yang kuat. Senyawa lain yang terkandung pada minyak atsiri daun sirih adalah kelompok terpenoid khususnya golongan monoterpen dan sisquiterpen (Heldt 2005).
Senyawa fenol
Kavikol
13
Biotecnology, Marcel Dekker, Inc. New York.
Direktorat Jenderal Perkebunan. 2006. Statistika Perkebunan Indonesia 2003-3005. Jakarta: Sekretariat Direktorat Jendreal Perkebunan.
Fritsch CW. 2004. Lipid oxidation the other dimensions.Infor. 5 : 423-436.
Gitter RJ, Robbitt JM, Scwarting AE. 2001. Pengantar Kromatografi. Padmawinata Kosasih, penerjemah. Bandung: ITB. Terjemahan dari:Introduction to Chromagography.
Gohike, McLafferty. 2003. Journal of American Society for Spektrometri Massa.Arizona: Academic Press.
Gunawan D, Mulyani. 2004. Ilmu Obat Alam (Farmakognosi) Jilid 1. Jakarta: Penebar Swadaya.
Harbone JB. 2004. Phytocemical methods. London: Champman and Hall Ltd.
Heldt. 2005. New reds in sample preparation for clinical and pharmaceutical analysis. Trends in Analytical Chemistry. 22: 232-243.
Hermawan. 2007. Pengaruh Ekstrak Daun Sirih (Piper Betle L.) terhadap Pertumbuhan Staphylococcus Aureus dan Escherichia Coli dengan Metode Difusi Disk.Artikel Ilmiah. Universitas Airlangga.
Indah N. 2008. Perbandingan sifat fisika dan kimia minyak kelapa(cocoa nuciferaL) yang diperoleh dari proses penguapan dan fermentasi.Biodiversitas. 12: 109-113.
Kardinan A. 2005.Kiat Mengatasi Masalah Praktis : Tanaman Penghasil Minyak Atsiri Komoditas Wangi Penuh Potensi. Jakarta : Agro Media Pustaka.
Ketaren S. 2006. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UIPress
Komahayarti A, Dwi P. 2006. Ekstrak daun sirih sabagai antioksidan pada minyak kelapa.Kimia Pangan.37: 102-107.
Lachance. 2000. Nutrition and phylogeny of predacious yeasts. J. Microbiol. 46: 495–505.
Liedias 2000. Catalase Modification as a Marker for Singlet Oxygen : Methods Enzymol. New York: Academic Press.
Maz A, Pamme N, Lossifidis D. 2004. Bioanalytical Chemistry. London: Imperial College Pr.
Mcfadden W. 2003. Techniques of Combined Gas Chromatography/ Mass Spectrometry: Application in Organic Analysis.Canada: John & Sons, Inc.
McNair HM, Bonelli EJ. 1988. Dasar Kromatografi Gas. Padmawinata Kosasih, penerjemah. Bandung: ITB. Terjemahan dari: Basic Gas Chromatography.
Min. 2002. Lipid oxidation of edible oil, In : Akoh CC. and Min DB. Editor : Food Lipids : Chemistry, Nutrition and Biotechnology, Marcel Dekker, Inc. New York, Basel.
Moeljatno.2003.Khasiat dan Manfaat Daun Sirih Obat Mujarab dari Masa ke Masa. Jakarta: Agromedia Pustaka.
Mukhtar MH. 2007. Uji Sitotoksisitas Minyak Atsiri Daun Kemangi (Ocimum basilicum L) dengan Metode Brine Shrimp Lethality Bioassay. J Sains Tek.Far. 12:12-15.
Mulyono HAM. 2001.Kamus Kimia. PTG. Bandung: Gresindo.
Mursito B. 2006.Karakterisasi Antioksidan Alami dari Daun Sirih (Piper betleL.): Pemisahan Komponen dalam Oleosin Daun Sirih dengan Kromatografi Lapis Tipis. Bul Tek dan Industri Pangan. 7: 75-78.
Palungkun R. 2004. Aneka Produk Olahan Kelapa.Jakarta: Penebar Swadaya.
Paryanti. 2006. Kandungan Organik Tumbuhan Tinggi.Bandung : ITB Press.
Parwata et al. Isolasi dan Uji Aktivitas Antibakteri Minyak Atsiri dari Rimpang Lengkuas (Alpinia galanga L). Jurnal Kimia.2: 100-104.
Pelczar, M.J. and E.C.S. Chan. 2006. Dasar-dasar Mikrobiologi. Penerjemah Hadiutomo, R.S.. Jakarta: UI Press.
14
Politeo O, Jukic M, Milos M. 2007. Chemical composition and antioxidant capacity of free volatile
aglycones from basil (Ocimum basilicum L.) compared with its
essential oil. Food Chemistry. 101: 379–
385.
Prakash B et al. Efficacy of chemically characterized Piper betle L. essential oil against fungal andaflatoxin contamination of some edible commodities and its antioxidant activity.Food Microbiology.142 : 114-119.
Pratt. 2002. Natural Antioxidant from Plant Material. Washington: ADS.
Proctor PH. 2004. Free radicals and disease in man.Physiol Chem Phys Med. 16:175-95.
Raharjo. 2006.Aktivitas Antioksidan pada minyak kelapa. Teknologi dan Industri Pangan. Bogor: IPB Press.
Regianto S. 2009. Perbandingan Komposisi Kimia Penyusun Minyak Atsiri Pala Wegio (Myristica fatua l) dengan GCMS.Biodiversitas.14: 121-123.
Sastrohamidjojo H. 2004. Spektroskopi Yogyakarta: Liberty.
Schuler P. 2002. Natural Antioxidant Exploited commercially. London: Marcel Dekker Inc.
Schwitzer. 2007. Composition of Essential oil of Ocimum canum. New York: Library Medicine.
Setiaji B. dan Sugiharto, E. 2005, Pembuatan Minyak Kelapa Dengan Cara Fermentasi,Warta Pergizi Pangan 2: 108-118.
Silverstein. 2006. Spectrometic Identification of Organic Compounds. New York: John Wiley &Sons.
Soenanto H. 2005. Musnahkan Penyakit dengan Tanaman Obat. Jakarta : Puspa Swara.
Stiaji AHB. 2005. Menyikap Keajaiban Minyak Kelapa Virgin. Jogjakarta: Kifika.
Sudarmaji S. 2006.Analisis Bahan Pangan Makanan dan Pertanian. Yogyakarta: Loberty.
Sudaryani. 2008.Analisa BahanMakanan dan Pertanian. Jakarta: Liberty.
Sulistyo et al. 2006. Analisis biokimia minyak kelapa hasil ekstraksi secara fermentasi.Biodiversitas: 9:91-95.
SNI 01-2891-1992. 1992. Cara Uji Makanan dan Minuman. Jakarta: Departemen Perindustrian Republik Indonesia.
Susiloningsih 2009. Efek penambahan asam sitrat dan lama pemanasan terhadap mutu minyak kacang tanah selama penyimpanan.Teknologi Technoscientia. 2: 90-97.
Sotaric T. 2000. Analysis of the Atsiri Components in Vanilla Extracts and Flavorings by Solid-Phase Microexraction and Gas Chromatography. J Food Agri Chem. 48: 5802-5807.
Tambun. 2006.Minyak Atsiri di Indonesia. Jakarta: Departemen Perindustrian.
Tepe B et al. 2007. Chemical composition and antioxidant activity of the essential oil of Clinopodium vulgare L. Food Chemistry.103 : 766–770.
Tobing. 2009. Kimia Bahan Alam. Jakarta: Mendiknas.
Winarni. 2001. Efektivitas Vitamin E dan BHT Sebagai Penghambat Oksidasi Asam Lemak Omega-3 Jenis EPA dan DHA pada Daging Ikan Manyung (Arius thalassinus). Tesis. Yogyakarta: FMIPA UGM.
Winarno. 2002. Kimia Pangan dan Gizi. Jakarta: Gramedia Utama.
ABSTRAK
OSY YOSTIA UTAMI
.
Komponen Minyak Atsiri Daun Sirih (
Piper Betle
L.)
dan Potensinya dalam Mencegah Ketengikan Minyak Kelapa. Dibimbing oleh Dr.
LAKSMI AMBARSARI, MS dan WARAS NURCHOLIS, M.Si.
ABSTRACT
OSY YOSTIA UTAMI. Composition of Essential Oil Betel Leaf
(Piper betle
L.
)
and Potential to Tackling Rancidty in Coconut Oil.
Under the direction of Dr.
LAKSMI AMBARSARI, MS dan WARAS NURCHOLIS, M.Si.
KOMPONEN MINYAK ATSIRI DAUN SIRIH (
Piper betle
L.) DAN
POTENSINYA DALAM MENCEGAH KETENGIKAN
MINYAK KELAPA
OSY YOSTIA UTAMI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Komponen Minyak Atsiri Daun Sirih (
Piper betle
L.)
dan Potensinya dalam Mencegah Ketengikan Minyak Kelapa
Nama
: Osy Yostia Utami
NIM
: G84062357
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS
Waras Nurcholis, M.Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika
,
M.App
.
, Sc
Ketua Departemen Biokimia
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan
rahmat dan hidayah-Nya sehingga penulis menyelesaikan dengan baik penelitian
dan penulisan karya ilmiah yang berjudul Kandungan Kimiawi Minyak Atsiri
Daun Sirih (
Piper Betle
L.) dan Potensinya dalam Menanggulangi Ketengikan
Minyak Kelapa
.
Karya ilmiah ini ditulis berdasarkan penelitian yang dilaksanakan
di Laboratotium Biokimia Institut Pertanian Bogor, Balai Penelitian Obat dan
Aromatik (BALITRO), dan Balai Penelitian Kehutanan (BALITHUT) selama
kurang lebih enam bulan yaitu pada bulan Juli-Desamber 2010 sebagai prasyarat
untuk memperoleh gelar Sarjana Sains dari Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Proses menuju keberhasilan yang harus dilalui penulis selama penelitian dan
penyusunan karya ilmiah ini tidak lepas dari bantuan berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih Ibu Dr. Laksmi Ambarsari, MS dan Bapak
Waras Nurcholis, M.Si selaku pembimbing atas segala kesabaran dan keikhlasan
dalam memberikan bimbingan, arahan, dan masukan bagi penulis. Ucapan terima
kasih penulis sampaikan pada Bu Tuti, Pak Nana, Bu Meri dan Bu Iis selaku
pranata laoratorium atas motivasi, masukan, dan bantuannya selama penelitian.
Ucapan terima kasih juga penulis sampaikan kepada ayah, ibu, Wini, Fina, dan
teman-teman
Senior Resident
Asrama TPB IPB atas segala dukungan dan doa
bagi penulis serta kepada teman-teman Biokimia 43 atas segala motivasi dan
bantuannya. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis, Jawa Barat pada tanggal 6 Mei 1988 dari
ayahanda Yoyo Saryadi, S.Pd dan Ibunda Teti Rukhaeti, S.Pd. Penulis merupakan
anak pertama dari tiga bersaudara. Tahun 2006 penulis lulus dari SMA negeri 2
Ciamis dan lolos seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis diterima di Departemen Biokimia Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan penulis aktif di berbagai organisasi dan
kepanitiaan. Tahun 2007 penulis aktif di divisi Sosial dan Lingkungan, Badan
Eksekutif Mahasiswa (BEM) FMIPA IPB dan sekretaris Paguyuban Mahasiswa
Ciamis (PMGC). Penulis juga menjadi Koordinator divisi kesekretariatan dalam
kepanitiaan Pesta Sains 2009. Tahun 2010 penulis menjadi asisten praktikum mata
kuliah Biokimia Umum S1 Departemen Biologi dan Kedokteran Hewan. Penulis
melakukan Praktik Lapangan di Laboratorium Rekayasa Genetik, LIPI-Bogor dari
bulan Juli sampai Agustus 2009 dengan judul Identifikasi Protein Cry dari
Bacillus thuringiensis
. Tahun 2010 penulis diterima sebagai
Senior Resident
Asrama Putri TPB IPB. Penulis juga merupakan penerima beasiswa BBM tahun
2009-2010.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR TABEL... ix
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Daun Sirih (
Piper betle
L) ... 1
Minyak Kelapa ... 3
Radikal Bebas ... 5
Antioksidan ... 6
Kromatografi Gas (GC-MS) ... 7
BAHAN DAN METODE
Alat dan Bahan... 7
Metode ... 8
HASIL DAN PEMBAHASAN
Minyak Atsiri Daun Sirih... 8
Uji Bilangan Peroksida pada Minyak Kelapa ... 9
Komponen Minyak Atsiri Daun Sirih... 10
SIMPULAN DAN SARAN
DAFTAR GAMBAR
Halaman
1 Daun sirih (
Piper betle
L) ...
2
2 Mekanisme kerusakan pada minyak ...
5
3 Mekanisme reaksi BHT sebagai antioksidan...
6
4 Bagian-bagian GC-MS ...
7
5
Gas Chomatography /Mass Spectroscopy
...
7
6 Hubungan antara bilangan peroksida dan penambahan minyak
atsiri daun sirih...
9
7 Identifikasi komponen minyak atsiri daun sirih dengan GC-MS ... 11
8 Struktur kimia senyawa fenol-2-metoksi-3-(2-propenil) ... 11
9 Struktur kimia senyawa kavikol... 12
DAFTAR LAMPIRAN
Halaman
1
PENDAHULUAN
Pengembangan produk minyak kelapa untuk memenuhi kebutuhan pangan dalam negeri memiliki prospek yang baik untuk jangka panjang. Hal tersebut karena Indonesia memiliki potensi area perkebunan kelapa yang luas bila dibandingkan dengan negara-negara penghasil kelapa yang lainnya. Menurut data Coconut Statistical Yearbook (2006) luas area perkebunan kelapa di Indonesia yaitu 3.701 Ha.
Minyak merupakan salah satu bahan pangan yang penting bagi kebutuhan tubuh manusia. Selain itu minyak juga merupakan sumber energi, yaitu satu gram minyak dapat menghasilkan 9 kkal (Winarno 2002). Masalah yang sangat menentukan terhadap mutu minyak kelapa adalah ketengikan. Minyak (nabati) mengandung asam lemak tak jenuh dan beberapa asam lemak esensial seperti asam oleat, linoleat dan linolenat (Sulistyoet al.2006).
Besarnya kandungan asam oleat dan asam linoleat pada minyak sangat mempengaruhi stabilitas minyak. Minyak kelapa sawit mengandung senyawa karotenoida yang mampu menghambat proses oksidasi, namun kadar karotenoida yang terdapat pada minyak kalapa tergolong rendah sehingga lebih mudah teroksidasi. Oksidasi adalah faktor yang sangat penting sebab dapat menghasilkan senyawa-senyawa yang menyumbangkan terjadinyaoff flavour dan kondisi ini lazim disebut tengik (rancid). Produk pangan olahan yang tengik dapat mengalami perubahan warna dan kehilangan nilai gizi karena oksidasi vitamin dan asam lemak tak jenuh. Selanjutnya mutu produk akan menurun, selain itu hasil oksidasi lipid akan menghasilkan senyawa peroksida, aldehid dan keton yang dapat membahayakan kesehatan manusia, sehingga perlu dilakukan upaya untuk mengatasinya. Salah satu cara adalah menambahkan senyawa antioksidan pada minyak kelapa agar tidak mudah teroksidasi. Antioksidan adalah senyawa yang secara alami terdapat dalam hampir semua bahan makanan, karena bahan makanan dapat mengalami degradasi baik secara fisik maupun kimia sehingga fungsinya berkurang. Antioksidan diperlukan untuk mengawetkan makanan yang mengandung minyak atau lemak dengan nilai gizi dari makanan itu tidak berkurang (Susiloningsih 2009).
Penggunaan antioksidan sintestis seperti BHA (Butil Hidroksi Anisol) dan BHT (Butil Hidroksi Toulene) sangat efektif untuk menghambat minyak atau lemak agar tidak terjadi oksidasi, namun penggunaan BHA dan BHT banyak menimbulkan kekhawatiran akan efek sampingnya. Hasil uji yang telah dilakukan tehadap penggunaan BHT didapatkan bahwa BHT dapat menyebabkan pembengkakan organ hati dan mempengaruhi aktifitas enzim di dalam hati. Selain itu juga menyebabkan pendarahan yang fatal pada dan pankreas (Komayaharti 2006). Kekhawatiran akan efek samping antioksidan sintetis mendorong untuk mencari antioksidan alami yang lebih aman. Salah satu bahan alam yang berpotensi sebagai antioksidan adalah daun sirih.
Berdasarkan uji pendahuluan yang dilakukan Komaharyati (2006) menunjukkan bahwa penambahan ekstrak daun sirih pada minyak kelapa dihasilkan bilangan peroksida yang kecil setelah penyimpanan 25 hari. Penelitian lain membuktikan bahwa minyak atsiri daun sirih dapat meredam radikal bebas pada difenilpikril hidrazil (DPPH) sebesar 81,91% (Parwataet all2009).
Tujuan penelitian ini adalah menguji potensi kimiawi minyak atsiri daun sirih dalam mencegah oksidasi yang dapat menghasilkan senyawa-senyawa radikal bebas sebagai penyebab off flavour atau tengik (rancid) pada minyak kelapa yang lazim di sebut dengan kenaikan bilangan peroksida. Hipotesis penelitian ini adalah kandungan senyawa fenol pada minyak atsiri daun sirih yang berfungsi sebagai antioksidan dan dapat mencegah kenaikan bilangan peroksida pada minyak kelapa, sehingga didapatkan minyak kelapa yang mempunyai daya simpan lebih lama.
TINJAUAN PUSTAKA
Daun Sirih (Piper betleL.)
-3
terpen perlu dipisahkan untuk tujuan tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri yang bebas terpen. Pemisahan minyak atsiri dilakukan dengan cara isolasi. Isolasi minyak atsiri dapat dilakukan dengan beberapa cara, yaitu penyulingan (distillation), pengepresan (pressing), ekstraksi dengan pelarut menguap (solvent extraction), ekstraksi dengan lemak (Sostaric 2000).
Menurut Hermawan (2007) daun sirih mengandung 4.2% minyak atsiri yang sebagian besar terdiri dari betephenol yang
merupakan isomer Euganol
allypyrocatechine, Cineol methil euganol, Caryophyllen (siskuiterpen), kavikol, kavibekol, estragol dan terpinen. Senyawa fenol, kavikol, eugenol, dan sineol, dilihat dari strukturnya senyawa-senyawa tersebut tidak atau kurang larut dalam pelarut polar, sehingga pada fraksinasi digunakan pelarut non polar dan semi polar. Senyawa fenol ini memiliki potensi sebagi antioksidan. Berdasarkan uji pendahuluan yang dilakukan diketahui bahwa minyak atsiri dapat meredam radikal bebas (pada difenilpikril hidrazil) sebesar 81,91% (Parwata et all 2009). Selain itu, menurut Mursito (2000) ekstrak heksana:etanol daun sirih ternyata masih mengandung β-karoten sebanyak 0.219 mg/100 g tepung daun bebas lemak, atau 0.219 mg/4 ml ekstrak. Minyak atsiri termasuk dalam golongan senyawa organik terpena dan terpenoid yang bersifat larut dalam minyak/lipofil (Prawitaet al.2009).
Minyak Kelapa
Menurut Ketaren (2006) berdasarkan kandungan asam lemak, minyak kelapa digolongkan ke dalam minyak asam laurat, karena kandungan asam lauratnya paling besar bila dibandingkan dengan asam lemak lainnya. Berdasarkan tingkat kejenuhannya yang dinyatakan dengan bilangan Iod yang berkisar antara 7.5-10.5.
Bentuk minyak kelapa yang beredar di pasar ada tiga jenis yaituRBD-Coconut Oil (minyak kelapa RBD),Traditional Coconut Oil (minyak kelapa tradisional) dan Virgin Coconut Oil(minyak kelapa murni). Minyak kelapa RBD merupakan minyak yang diproses dengan penambahan bahan kimia dalam pemurnian minyak (refined), pemutihan minyak (bleaching) dan penghilangan bau yang tidak sedap (deodorized). Traditional Coconut Oil (minyak kelapa tradisional) adalah minyak
kelapa yang diolah secara tradisional yang mulai dari penghancuran buah kelapa segar hingga pemanasan yang menghasilakan minyak dan ampas atau blondo (Budiarso 2004).
Stiaji (2005) juga menyebutkan bahwa ada beberapa metode pemrosesan minyak kelapa berbeda, diantaranya dengan pemanasan, fermentasi dan pengeringan di bawah sinar matahari yang kita sebut kopra. Metode pemrosesan minyak kelapa akan mempengaruhi kualitas, penampilan, rasa dan aroma dari produk jadi. Komposisi yang paling banyak terkandung pada minyak kelapa adalah asam lemak. Komposisi asam lemak minyak kelapa secara kasar dapat dilihat pada Tabel 1.
Tabel 1 Komposisi asam lemak minyak kelapa kasar
Asam Lemak Rumus Molekul
Jumlah (%) Asam Lemak Jenuh
Asam kaproat
C5H11COOH 0.0-0.9
Asam kaprilat
C7H17COOH 5.5-9.5
Asam kaprat C9H23COOH 4.5-9.5 Asam laurat C11H23COOH 44.0-52.0 Asam
miristat
C13H27COOH 13.0-19.0
Asam palmitat
C15H31COOH 7.5-10.5
Asam stearat C17H35COOH 1.0-3.0 Asam
arahidrat
C19H39COOH 0.0-0.4
Asam Lamak Tidak Jenuh Asam
palmitoleat
C15H29COOH 0.0-1.3
Asam oleat C17H23COOH 5.0-8.0 Asam
linoleat
C17H31COOH 1.5-2.5
Sumber : Sulistyo (2006).
Tabel 1 menunjukkan bahwa asam lemak jenuh minyak kelapa kurang lebih 90 persen. Minyak kelapa mengandung 84 persen trigliserida dengan tiga molekul asam lemak jenuh, 12 persen trigliserida dengan dua asam lemak jenuh, dan 4 persen trigliserida dengan satu asam lemak jenuh (Ketaren 2006).
4
[image:30.612.130.308.288.487.2]minyak juga memberikan keuntungan. Sterol tidak berwarna, tidak berbau, stabil dan berfungsi sebagai stabilizer dalam minyak. Adapun tokoferol mempunyai tiga isomer yaitu -tokoferol, -tokoferol, dan -tokoferol, bersifat tidak tersabunkan. Namun berbeda dengan kelapa sawit, pada minyak kelapa hanya mengandung sedikit senyawa karotenoida yang dapat berfungsi secara antioksidan (Ketaren 2006). Minyak kelapa layak dipakai dan tidak mudah tengik apabila memenuhi standar mutu yang telah ditentukan untuk menjaga kualitasnya. Standar mutu berdasarkan sifat fisik dan kimia yang digunakan sebagai acuan adalah SNI 01-3394-1998 (Tabel 2).
Tabel 2 Mutu fisiko-kimia minyak kelapa berdasarkan SNI 01- 3394- 1998
Karakteristik SNI
01-3394- 1998 Kadar air maksimum (%) 0.3 Kadar cemaran logam
(mg/kg)
0.1
Bilangan iod (g iod/100 g contoh)
8.0-10.0
Bilangan penyabunan (mg oksigen/100 g)
255-265
Bilangan peroksida maksimum (meq/kg minyak)
≤ 3.0
Asam lemak bebas maksimum (% asam laurat)
≤5.0
Warna dan bau Normal
Minyak pelican Negatif Logam-logam berbahaya
dan arsen
Negatif
Tingginya kadar asam lemak tidak jenuh pada minyak menyebabkan minyak dapat dengan mudah dioksidasi oleh molekul oksigen membentuk hidroperoksida. Proses oksidasi ini dapat menyebabkan hilangnya nilai gizi dan terbentuknya rasa, warna dan bau yang tidak diinginkan, bahkan dapat menyebabkan terbentuknya zat racun. Panas, cahaya, logam dan spesies oksigen reaktif dapat memfasilitasi pembentukan radikal dari lemak (Raharjo 2006).
Sumber oksigen dalam reaksi oksidasi adalah oksigen di atmosfer. Keadaan dasar oksigen di atmosfer berbentuk triplet (3O2). Namun oksigen triplet dapat tereksitasi membentuk oksigen singlet (O2), dan dalam keadaan gas, oksigen singlet ini cukup stabil. dalam keadaan tereksitasi. Oksigen singlet bisa mempercepat reaksi oksidasi (Min 2002).
Oksigen singlet bisa terbentuk oleh reaksi fotokimia terhadap oksigen triplet dengan adanya fotosensitizer. Di alam banyak terdapat senyawa yang berfungsi sebagai fotosensitizer seperti klorofil, porpirin, riboflavin, dan mioglobin yang bisa menyerap energi dari cahaya dan memindahkannya kepada oksigen triplet untuk membentuk oksigen singlet (Liedias 2000).
Oksidasi lemak oleh spesies oksigen reaktif melibatkan tiga langkah, yaitu inisiasi, propagasi, dan terminasi. Pada tahap inisiasi terjadi pembentukan radikal asam lemak, yaitu suatu senyawa turunan asam lemak yang bersifat tidak stabil dan sangat reaktif akibat dari hilangnya satu atom hidrogen (reaksi 1). Pada tahap selanjutnya, yaitu propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi (reaksi 2). Radikal peroksi lebih lanjut akan menyerang asam lemak menghasilkan hidroperoksida dan radikal asam lemak baru (reaksi 3). Terminasi terjadi dengan bereaksinya radikal peroksil dengan antioksidan penangkap radikal. Selain itu setiap radikal alkil atau radikal pada rantai karbon asam lemak (R*) dapat bereaksi dengan peroksida lemak (ROO*) menghasilkan produk senyawa seperti dimer ROOR yang relatif stabil (Raharjo 2006). Inisiasi : RH R*+ H Propagasi : R*+ O2 ROO*
ROO*+ RH ROOH + R*
Terminasi : R*+ R* R-R R*+ROO* ROOR Adanya ikatan rangkap pada asam lemak memperlemah ikatan C-H pada atom karbon yang dekat dengan ikatan rangkap tersebut sehingga atom H pada ikatan tersebut dapat dengan mudah diambil oleh spesies oksigen reaktif menghasilkan radikal bebas dari asam lemak tidak jenuh (Gambar 2). (Raharjo 2006).
8
Metode
Ekstraksi Minyak Atsiri dari Daun Sirih
Daun sirih yang digunakan adalah daun segar dengan umur panen 6 bulan dan merupakan daun ketiga dari tunas muda. Daun sirih yang sudah dipotong-potong sebanyak 10 kg, dimasukkan ke dalam alat destilasi yang telah diisi dengan air. Alat destilasi uap kemudian dirangkai dengan merangkaikan pendingin (kondensor), kemudian dipanaskan dan dijaga agar tidak menggunakan temperatur yang tinggi. Air dialirkan ke kondensor dan dijaga agar air terus mengalir. Temperatur kondensor dijaga tetap dingin sehingga minyak yang menguap semuanya terembunkan dan tidak lepas ke udara. Destilat yang diperoleh merupakan campuran minyak dengan air. Selanjutnya destilat ditambahkan natrium klorida (NaCl) agar minyak yang teremulsi terpisah.
Fase air ditampung dengan labu Erlenmeyer, untuk dipisahkan lagi karena kemungkinan masih mengandung sedikit minyak yang teremulasi. Fase air ini ditambahkan lagi dengan NaCl. Pekerjaan ini dilakukan berulang-ulang sampai semua minyak terpisahkan. Setelah diperoleh minyak atsiri, selanjutnya diidentifikasi kandungan kimianya dengan menggunakan GC MS.
Uji Bilangan Peroksida (Metode Iodometri)
Pertama-tama dilakukan preparasi sampel. Minyak kelapa dimasukkan ke dalam labu Erlenmeyer kemudian dipanaskan di atas hot plate dengan magnetic stired untuk menguapkan sisa air yang masih terkandung pada minyak kelapa, kecepatan 1000 rpm pada suhu 90oC sesuai dengan percobaan Komarhayati (2006). Selanjutnya ditambahkan 2 gram minyak atsiri dalam 88 gram minyak kelapa untuk konsentrasi 2%, ditambahkan 3 gram minyak atsiri dalam 87 gram minyak kelapa untuk konsentrasi 3%, ditambahkan 5 gram minyak atsiri dalam 85 gram minyak kelapa untuk konsentrasi 5%, serta kontrol tanpa penambahan minyak atsiri.
Uji bilangan peroksida dilakukan dengan cara sebanyak 5 g sampel minyak (liquid) ditimbang lalu dimasukkan ke dalam Erlenmeyer dan ditambah dengan 30 ml campuran pelarut yang terdiri dari 60% asam asetat glasial dan 40% CHCl3. Setelah minyak larut, ditambahkan sebanyak 50 ml
KI 10% sambil dikocok selama 2 menit. Kemudian ditambahkan 30 ml akuades. Kelebihan Iod akan dititrasi dengan Na2S2O3 0,1N, demikian juga pada kontrol. Pengukuran dilakukan pada hari ke-0, hari ke-5, hari ke-10, hari ke-15, hari ke-20 , hari ke-25 dan hari ke-30. Masing-masing pengujian dilakukan secara triplo.
Standarisasi larutan Na2S2O3 (Metode Iodometri)
Sebanyak 278 mg KIO3 ditimbang dan dimasukkan ke dalam beaker glass, selanjutnya dilarutkan dengan akuades secukupnya, pindahkan ke dalam labu takar 100 ml kemudian diencerkan dengan akuades hingga batas. Larutan tersebut dipindahkan ke dalam Erlenmeyer 250 ml kemudian ditambahkan 0.5 gram KI dan 2 ml HCl 4 N.
Larutan sampel segera dititrasi dengan larutan Na2S2O3 0.1N yang sudah dipersiapkan hingga warna berubah menjadi kuning pucat. Selanjutnya diencerkan dengan 50 ml akuades kemudian tambahkan 2 ml indikator amilum dan dilanjutkan titrasi hingga warna biru hilang. Standarisasi larutan dilakukan tiga kali
Analisis Minyak Atsiri Daun Sirih dengan
Gas Chromatography- Mass Spectroscopy
(GC-MS)
Analisis GC-MS dilakukan meng-gunakan GCMS-QP2010S Shimadzu dengan kondisi analisis sebagai berikut : Sampel dimasukkan, kemudian masuk ke kolom Rtx-5MS 30 meter, diameter 0,25 mm, suhu terprogram dari 80oC sampai 300oC dengan kenaikan suhu 10oC/menit, dan gas pembawa Helium, sedangkan untuk tekanannya sebesar 22 kPa. Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram, sedangkan nama/jenis senyawa yang ada diinterpretasikan berdasarkan data spektra dari setiap puncak tersebut dengan digunakan metode pendekatan pustaka pada database (Pringgenis 2010).
HASIL DAN PEMBAHASAN
Minyak Atsiri Daun Sirih
10
minyak dengan penambahan minyak atsiri daun sirih 5% merupakan penambahan dengan kadar terbaik karena mampu menghambat pembentukan peroksida paling tinggi. Bilangan peroksida yang dihasilkan terendah dibandingkan perlakuan yang lainnya, yaitu sebesar 2.33 Meq/kg bahan dan masih memenuhi kriteria SNI yaitu lebih kecil dari 3 Meq/kg bahan.
Kadar minyak atsiri yang ditambahkan pada minyak kelapa mempengaruhi aktivitas antioksidan dan daya simpannya. Minyak kelapa tanpa penambahan minyak atsiri hanya bertahan sampai hari ke-15, sedangkan penambahan minyak atsiri dengan kadar 2% dan 3% bisa bertahan sampai hari ke-20. Penambahan minyak atsiri 5% dapat meredam kenaikan bilangan peroksida paling lama, sampai hari ke-30 bilangan peroksidanya masih dibawah 3 Meq/kg bahan. Senyawa antioksidan yang terdapat pada minyak atsiri daun sirih di duga bereaksi sebagai pengikat radikal peroksil (ROO*) dan merupakan pengikat yang kuat terhadap radikal hidroksil (OH*) (Aruomaet al.,2007).
Penelitian Komahayarti (2006) dengan menambahkan ekstrak daun sirih 2% pada minyak kelapa menunjukkan bilangan peroksida pada hari ke-25 sebesar 7.33 Meq/kg bahan, sedangakan pada penambahan ekstrak daun sirih 3% menunjukkan bilangan peroksida 6.51 Meq/kg bahan, dan penambahan ekstrak daun sirih 5% menunjukkan bilangan peroksida 5.03 Meq/kg bahan. Nilai bilangan peroksida minyak kelapa pada penambahan ekstrak daun sirih lebih tinggi dibandingkan dengan penambahan minyak atsiri daun sirih dan melebihi standar SNI yang di tentukan untuk standar bilangan peroksida minyak kelapa. Data penelitian tersebut menunjukkan bahwa penambahan minyak atsiri daun sirih pada minyak kelapa lebih efektif mengurangi kenaikan bilangan peroksida minyak kelapa dibandingkan dengan penambahan ekstrak daun sirih pada minyak kelapa.
Penelitian Yudhaningtyas (2008) menunjukkan bahwa penambahan BHT pada minyak kelapa sebanyak 1.82 % dapat menghambat ketengikan minyak kelapa yang disimpan 28 hari. Hal tersebut menunjukkan bahwa penambahan minyak atsiri daun sirih pada minyak kelapa memiliki kemampuan sebagai antioksidan
hampir setara dengan penambahan 1.82% BHT pada minyak kelapa.
Hasil penelitian ini menunjukkan bahwa antioksidan yang terdapat pada minyak atsiri daun sirih berpotensi untuk mencegah atau menghambat autooksidasi lemak minyak yang dapat menyebabkan ketengikan pada minyak kelapa, sama seperti BHT. Namun berdasarkan efek sampingnya, penambahan BHT pada bahan pangan sebagai antioksidan dapat mempengaruhi kesehatan, yaitu dalam jangka waktu panjang dapat menyebabkan pembengkakan dalam hati dan mempengaruhi aktifitas enzim dalam hati. Berdasarkan potensinya, penambahan minyak atsiri daun sirih sebagai pengganti BHT untuk antioksidan pada minyak kelapa bisa menjadi salah satu alternatif, karena minyak atsiri daun sirih merupakan bahan alam dan lebih aman terhadap kesehatan.
Komponen Minyak Atsiri Daun Sirih
Hasil analisis minyak atsiri daun sirih dengan menggunakan GC-MS ditunjukkan pada Gambar 7. Secara keseluruhan teridentifikasi 20 komponen (Lampiran 6) yang diekspresikan dalam bentuk puncak/peak. Setiap puncak mewakili senyawa yang berbeda. Masing-masing puncak kemudian dianalisis dalam spektometer massa dan dibandingkan dengan The National Institute of Standard and Technology database (NIST) yang sudah terintegrasi dalam GC-MS. Hasil analisis dengan GC-MS sesuai dengan penelitian Moeljatno (2003) yang menunjukkan bahwa minyak atsiri daun sirih mengandung senyawa turunan fenol.
11
Gambar 7 Identifikasi komponen minyak atsiri daun sirih dengan GC-MS.
Kandungan minyak atsiri daun sirih hasil identifikasi menggunakan GC-MS secara umum terdiri dari senyawa golongan fenol. Senyawa kimia yang teridentifikasi dengan konsentrasi tinggi yaitu, 2-metoksi-3-(2-propenil) (17.41%), kavikol (16.62%), dan asetil eugenol (13.17%) dengan waktu retensi dapat dilihat pada Lampiran 6.
Golongan fenol dicirikan oleh adanya cincin aromatik dengan satu atau dua gugus hidroksil (Gambar 8). Kelompok fenol terdiri dari ribuan senyawa, meliputi flavonoid, fenilpropanoid, asam fenolat, antosianin, pigmen kuinon, melanin, lignin, dan tanin, yang tersebar luas di berbagai jenis tumbuhan (Harbone 2006).
Gambar 8 Struktur kimia senyawa fenol-2-metksi-3-(2-propenil).
Kadar total fenol dari minyak atsiri daun sirih mempengaruhi hasil aktivitas antioksidannya. Antioksidan fenolik pada minyak atsiri daun sirih bereaksi sebagai scavenger radikal peroksil (ROO*) dan merupakan scavenger yang kuat terhadap radikal hidroksil (OH*). Mekanisme reksi radikal peroksil (ROO*) dan hidroksil
(OH*) dengan antioksidan pada minyak atsiri mirip dengan α-tokoferol (Schuler 2002), yaitu sebagai berikut:
OH* + AH2 H2O + AH* ROO* + AH2 ROOH +AH*
OH* yang terperangkap antioksidan pada daun sirih (AH2) diregenerasi menjadi H2O dan ROO* yang tertangkap AH diregenerasi menjadi ROOH. Hasil penelitian ini menunjukkan bahwa antioksidan fenolik pada minyak atsiri daun sirih dapat digunakan untuk mencegah atau menghambat autooksidasi minyak. Antiokidan ini dapat menangkap radikal bebas yang dihasilkan selama tahap propagasi dari minyak dengan cara mendonasikan radikal hidrogen sehingga radikal lemak tidak aktif melakukan tahap propagasi yang akan merusak lemak. Kemampuan antioksidan untuk mendonasikan hidrogen mempengaruhi aktivitasnya. Hasil penelitian menunjukkan bahwa senyawa fenol-2-metoksi-3-(2-propenil) mempunyai peran sebagai antioksidan pada minyak kelapa sehingga dapat meredam peningkatan bilangan peroksida pada minyak kelapa.
Aroma khas dari minyak atsiri daun sirih itu karena kandungan chavycol acid yang merupakan salah satu senyawa dengan kadar yang besar pada penelitian (16,62%). Senyawa ini memiliki daya antiseptik yang kuat. Senyawa lain yang terkandung pada minyak atsiri daun sirih adalah kelompok terpenoid khususnya golongan monoterpen dan sisquiterpen (Heldt 2005).
Senyawa fenol
Kavikol
[image:37.612.139.296.499.576.2]13
Biotecnology, Marcel Dekker, Inc. New York.
Direktorat Jenderal Perkebunan. 2006. Statistika Perkebunan Indonesia 2003-3005. Jakarta: Sekretariat Direktorat Jendreal Perkebunan.
Fritsch CW. 2004. Lipid oxidation the other dimensions.Infor. 5 : 423-436.
Gitter RJ, Robbitt JM, Scwarting AE. 2001. Pengantar Kromatografi. Padmawinata Kosasih, penerjemah. Bandung: ITB. Terjemahan dari:Introduction to Chromagography.
Gohike, McLafferty. 2003. Journal of American Society for Spektrometri Massa.Arizona: Academic Press.
Gunawan D, Mulyani. 2004. Ilmu Obat Alam (Farmakognosi) Jilid 1. Jakarta: Penebar Swadaya.
Harbone JB. 2004. Phytocemical methods. London: Champman and Hall Ltd.
Heldt. 2005. New reds in sample preparation for clinical and pharmaceutical analysis. Trends in Analytical Chemistry. 22: 232-243.
Hermawan. 2007. Pengaruh Ekstrak Daun Sirih (Piper Betle L.) terhadap Pertumbuhan Staphylococcus Aureus dan Escherichia Coli dengan Metode Difusi Disk.Artikel Ilmiah. Universitas Airlangga.
Indah N. 2008. Perbandingan sifat fisika dan kimia minyak kelapa(cocoa nuciferaL) yang diperoleh dari proses penguapan dan fermentasi.Biodiversitas. 12: 109-113.
Kardinan A. 2005.Kiat Mengatasi Masalah Praktis : Tanaman Penghasil Minyak Atsiri Komoditas Wangi Penuh Potensi. Jakarta : Agro Media Pustaka.
Ketaren S. 2006. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UIPress
Komahayarti A, Dwi P. 2006. Ekstrak daun sirih sabagai antioksidan pada minyak kelapa.Kimia Pangan.37: 102-107.
Lachance. 2000. Nutrition and phylogeny of predacious yeasts. J. Microbiol. 46: 495–505.
Liedias 2000. Catalase Modification as a Marker for Singlet Oxygen : Methods Enzymol. New York: Academic Press.
Maz A, Pamme N, Lossifidis D. 2004. Bioanalytical Chemistry. London: Imperial College Pr.
Mcfadden W. 2003. Techniques of Combined Gas Chromatography/ Mass Spectrometry: Application in Organic Analysis.Canada: John & Sons, Inc.
McNair HM, Bonelli EJ. 1988. Dasar Kromatografi Gas. Padmawinata Kosasih, penerjemah. Bandung: ITB. Terjemahan dari: Basic Gas Chromatography.
Min. 2002. Lipid oxidation of edible oil, In : Akoh CC. and Min DB. Editor : Food Lipids : Chemistry, Nutrition and Biotechnology, Marcel Dekker, Inc. New York, Basel.
Moeljatno.2003.Khasiat dan Manfaat Daun Sirih Obat Mujarab dari Masa ke Masa. Jakarta: Agromedia Pustaka.
Mukhtar MH. 2007. Uji Sitotoksisitas Minyak Atsiri Daun Kemangi (Ocimum basilicum L) dengan Metode Brine Shrimp Lethality Bioassay. J Sains Tek.Far. 12:12-15.
Mulyono HAM. 2001.Kamus Kimia. PTG. Bandung: Gresindo.
Mursito B. 2006.Karakterisasi Antioksidan Alami dari Daun Sirih (Piper betleL.): Pemisahan Komponen dalam Oleosin Daun Sirih dengan Kromatografi Lapis Tipis. Bul Tek dan Industri Pangan. 7: 75-78.
Palungkun R. 2004. Aneka Produk Olahan Kelapa.Jakarta: Penebar Swadaya.
Paryanti. 2006. Kandungan Organik Tumbuhan Tinggi.Bandung : ITB Press.
Parwata et al. Isolasi dan Uji Aktivitas Antibakteri Minyak Atsiri dari Rimpang Lengkuas (Alpinia galanga L). Jurnal Kimia.2: 100-104.
Pelczar, M.J. and E.C.S. Chan. 2006. Dasar-dasar Mikrobiologi. Penerjemah Hadiutomo, R.S.. Jakarta: UI Press.
14
Politeo O, Jukic M, Milos M. 2007. Chemical composition and antioxidant capacity of free volatile
aglycones from basil (Ocimum basilicum L.) compared with its
essential oil. Food Chemistry. 101: 379–
385.
Prakash B et al. Efficacy of chemically characterized Piper betle L. essential oil against fungal andaflatoxin contamination of some edible commodities and its antioxidant activity.Food Microbiology.142 : 114-119.
Pratt. 2002. Natural Antioxidant from Plant Material. Washington: ADS.
Proctor PH. 2004. Free radicals and disease in man.Physiol Chem Phys Med. 16:175-95.
Raharjo. 2006.Aktivitas Antioksidan pada minyak kelapa. Teknologi dan Industri Pangan. Bogor: IPB Press.
Regianto S. 2009. Perbandingan Komposisi Kimia Penyusun Minyak Atsiri Pala Wegio (Myristica fatua l) dengan GCMS.Biodiversitas.14: 121-123.
Sastrohamidjojo H. 2004. Spektroskopi Yogyakarta: Liberty.
Schuler P. 2002. Natural Antioxidant Exploited commercially. London: Marcel Dekker Inc.
Schwitzer. 2007. Composition of Essential oil of Ocimum canum. New York: Library Medicine.
Setiaji B. dan Sugiharto, E. 2005, Pembuatan Minyak Kelapa Dengan Cara Fermentasi,Warta Pergizi Pangan 2: 108-118.
Silverstein. 2006. Spectrometic Identification of Organic Compounds. New York: John Wiley &Sons.
Soenanto H. 2005. Musnahkan Penyakit dengan Tanaman Obat. Jakarta : Puspa Swara.
Stiaji AHB. 2005. Menyikap Keajaiban Minyak Kelapa Virgin. Jogjakarta: Kifika.
Sudarmaji S. 2006.Analisis Bahan Pangan Makanan dan Pertanian. Yogyakarta: Loberty.
Sudaryani. 2008.Analisa BahanMakanan dan Pertanian. Jakarta: Liberty.
Sulistyo et al. 2006. Analisis biokimia minyak kelapa hasil ekstraksi secara fermentasi.Biodiversitas: 9:91-95.
SNI 01-2891-1992. 1992. Cara Uji Makanan dan Minuman. Jakarta: Departemen Perindustrian Republik Indonesia.
Susiloningsih 2009. Efek penambahan asam sitrat dan lama pemanasan terhadap mutu minyak kacang tanah selama penyimpanan.Teknologi Technoscientia. 2: 90-97.
Sotaric T. 2000. Analysis of the Atsiri Components in Vanilla Extracts and Flavorings by Solid-Phase Microexraction and Gas Chromatography. J Food Agri Chem. 48: 5802-5807.
T