SKRIPSI
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
Oleh :
EVANDA PUSPITA F24103051
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
EVANDA PUSPITA. F24103051. Studi Karakteristik Kitosanase dari Isolat
Bacillus licheniformis MB-2. Di bawah bimbingan Prof. Dr. Maggy T. Suhartono
RINGKASAN
Kitosan adalah polisakarida alami hasil dari proses deasetilasi kitin. Kitosanase merupakan enzim yang mendegradasi kitosan dan beberapa kitosanase diduga bersifat termostabil. Enzim kitosanase dapat dihasilkan oleh bakteri, fungi, dan tanaman. Pada penelitian ini, Bacillus licheniformis MB-2 yang diperoleh dari Tompaso (Manado) digunakan sebagai mikroba penghasil enzim kitosanase. Penelitian ini bertujuan untuk mempelajari pemurnian kitosanase dari isolat Bacillus lecheniformis MB-2 melalui kromatografi filtrasi gel dan menganalisa beberapa karakteristik dari enzim kitosanase yang dihasilkan.
Isolat Bacillus licheniformis MB-2 yang memperlihatkan zona bening diinokulasikan pada media thermus cair yang terdiri dari koloidal kitosan, K2HPO4, KH2PO4, MgSO4, ekstrak kamir, bacto agar, dan casiton untuk
mendapatkan kultur starter. Selanjutnya untuk produksi enzim kitosanase, kultur starter yang diperoleh diinokulasikan kedalam media yang sama dan difermentasi pada shaker waterbath selama 7 hari pada suhu 55°C dengan kecepatan 120 rpm. Supernatan bebas sel dari kitosanase diperoleh dengan cara sentrifugasi dingin selama 10 menit dengan kecepatan 8000 rpm. Selanjutnya presipitasi dengan amonium sulfat 80% dilakukan terhadap supernatan bebas sel untuk mendapatkan
crude enzyme (endapan protein). Enzim yang telah diendapkan selanjutnya dikarakterisasi suhu dan pH untuk mendapatkan suhu dan pH optimum crude enzyme. Sebelum dilakukan kromatografi, crude enzyme didialisis menggunakan kantong selofan yang dapat menahan molekul lebih dari 10.000 dalton sehingga garam-garam dan ion penggangu lainnya yang dapat menggangu kestabilan enzim dapat bermigrasi keluar membran.
Kromatografi filtrasi gel diawali dengan tahap pengembangan matriks (swelling) dengan melarutkan Sephadex G-100 kedalam air bebas ion sambil diaduk dengan magnetic stirrer perlahan selama 30 menit dan didiamkan selama 3 hari pada suhu dingin. Selanjutnya supernatan diganti dengan bufer fosfat 0.05 M pH 6. Matriks yang telah dikembangkan diaplikasikan kedalam kolom kemudian kolom diekuilibrasi dengan bufer yang sama dan sebanyak 2 ml endapan protein hasil presipitasi dimasukkan kedalam kolom diikuti dengan perhitungan laju aliran setiap 100 drop. Filtrasi gel dilakukan selama 25 jam dengan kecepatan elusi 0.22 ml/menit. Pengukuran aktivitas enzim dilakukan dengan mereaksikan enzim dan soluble kitosan sebagai substrat menggunakan teknik spektrofotometri pada panjang gelombang 420 nm dan pengukuran protein dengan metode bradford pada panjang gelombang 595 nm. Fraksi enzim hasil kromatografi yang menunjukkan adanya peak pada grafik kromatografi selanjutnya dikarakterisasi dan dilakukan analisis SDS-PAGE. Karakterisasi yang dilakukan yaitu penentuan pH dan suhu optimum serta pengaruh suhu dan pH terhadap stabilitas enzim. Sedangkan analisis SDS-PAGE dilakukan untuk menentukkan berat molekul enzim.
diendapkan dengan amonium sulfat aktivitas enzim meningkat menjadi 1.087 U/ml, namun menurunkan aktivitas spesifik enzim menjadi 1.433 U/mg. Dialisis menurunkan aktivitas enzim menjadi 1.086 U/ml namun meningkatkan aktivitas spesifiknya menjadi 2.045 U/mg. Selanjutnya setelah melewati tahap kromatografi terjadi penurunan aktivitas enzim menjadi 1.049 U/ml dan peningkatan aktivitas spesifik yang cukup besar menjadi 32.284 U/mg. Peningkatan aktivitas spesifik setelah tahap kromatografi menyebabkan tingkat kemurnian enzim meningkat. Adapaun tingkat kemurnian enzim berturut-turut dari hasil presipitasi, dialisat dan hasil kromatografi filtrasi gel adalah 0.32, 0.45, dan 7.11 kali.
Hasil karakterisasi menunjukkan bahwa crude enzyme optimum pada suhu 60 – 70oC dan optimum pada bufer Na-fosfat pH 6 – 7. Sedangkan enzim hasil kromatografi optimum pada suhu 70 – 80oC dan optimum pada pH 6. Uji stabilitas enzim hasil kromatografi dilakukan pada suhu 80oC dan 90oC. Dari hasil pengujian menunjukkan bahwa aktivitas relatif (sisa) enzim cukup stabil, dimana setelah melalui pemanasan selama 120 menit masih terdapat aktivitas relatif sebesar 59.61% (suhu 80oC) dan 58.53% (suhu 90oC). Selain dinyatakan dengan aktivitas relatif, stabilitas enzim pun dinyatakan dengan nilai k (konstanta deaktifasi), t1/2 (waktu paruh) dan energi aktifasi (Ea). Adapun nilai k untuk suhu
80oC dan 90oC adalah 0.0041 min-1 dan 0.0045 min-1, sedangkan waktu paruhnya adalah 169.06 menit (suhu 80oC) dan 154.03 menit (suhu 90oC). Sehingga didapatkan energi aktifasi sebesar 2371.48 kal/(gmol.oK). Pengaruh pH terhadap stabilitas enzim hasil kromatografi cenderung lebih stabil. Aktivitas relatif setelah pemanasan selama 120 menit masih tersisa sebesar 91.94%, nilai k yang diperoleh adalah 0.0007 min-1 dan waktu paruhnya sebesar 990.21 menit.
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
EVANDA PUSPITA F24103051
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
EVANDA PUSPITA F24103051
Dilahirkan pada tanggal 28 Desember 1985
Di Jakarta
Tanggal lulus: 08 Agustus 2007
Bogor, 15 Agustus 2007
Menyetuji,
Prof. Dr. Ir. Maggy T. Suhartono
Dosen Pembimbing Akademik
Mengetahui,
Dr. Ir. Dahrul Syah, MSc
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 Desember
198 1985, sebagai anak pertama dari tiga bersaudara dari
pas Cah pasangan Cahyan Sofyadi dan Evi Syofia. Penulis
memili memiliki dua orang adik perempuan yang bernama
Deviani Deviani Prima Dewi dan Citra Diani Putri.
Pendidikan Sekolah ditempuh dari tahun 1991 -
1997 di SDN Catihan, kemudian melanjutkan sekolah
menengah pertama di STPN I Pdg-Banten hingga tahun 2000. Pada tahun 2003
penulis telah berhasil menyelesaikan pendidikannya di SMUN I Pdg-Banten.
Penulis diterima sebagai mahasiswi Institut Pertanian Bogor pada tahun 2003
melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Ilmu dan
Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis merupakan anggota HIMITEPA
selama periode 2005 – 2006. Disamping itu pada tahun 2007, penulis pernah
menjadi asisten praktikum mata kuliah Biokimia Pangan. Pelatihan dan seminar
KATA PENGANTAR
Alhamdulillahirabbi’alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas Ridho-Nya serta atas rahmat dan karunian-Nya sehingga
penulis dapat menyelesaikan skripsi ini.
Skripsi disusun berdasarkan penelitian yang dilaksanakan di
Laboratorium Biokimia dan Mikrobiologi PAU dengan judul Studi Karakteristik Kitosanase dari Isolat Bacillus licheniformis MB-2 yang telah dilaksanakan dari bulan November 2006 sampai Juni 2007 di Departemen Ilmu dan Teknologi
Pangan, Fakultas Teknologi Pertanian-IPB.
Pada kesempatan ini, penulis ingin menyampaikan rasa terimakasih
yang tak terhingga kepada :
1. Prof. Dr. Ir. Maggy T. Suhartono, sebagai dosen pembimbing akademik
yang telah banyak memberi bimbingan dan dukungan selama penulis
menjalani pendidikan dan selama penulis melakukan tugas akhir sampai
penulisan skripsi ini.
2. Ir. Sutrisno Koswara, MSi dan Dr. Sukarno, MSc selaku dosen penguji
yang telah bersedia meluangkan waktu untuk menguji, membimbing dan
memberi saran kepada penulis.
3. Mamah, papah, dan adik penulis (Ima dan Citra) yang selalu memberi
bimbingan, dorongan (material, spiritual), kasih sayang kepada penulis
selama menjalani pendidikan di IPB dari awal hingga penulis
menyelesaikan tugas akhir ini.
4. My Big Family Bandung atas segala dukungan, kasih sayang, kebaikan,
dan doanya. Specially for enyunk, mamih, dan enin.
5. My best friends forever (Dian, Rucit, Ocha, Anis, Bohay, Iin, Abdy, Wate,
Ikoq, DinY, dan Indach) atas dukungannya, keceriannya, kasih sayang,
doa dan telah menjadi teman terbaik dan tempat curhat terbaik bagi
penulis. Terimakasih telah memberi kenangan indah bagi penulis.
6. Yuda Ganda Putera (terimakasi atas dukungan, perhatian dan doanya)
serta Jeniar, uwa, Indri, Didik, Jelita, dan yanti (terimakasih tetap menjadi
7. Rekan-rekan seperjuangan Laboratorium Mikrobiologi dan Biokimia PAU
(Dian, Rika, Prasna dan Usman). Terimakasih atas bantuannya dan
dukungannya selama penulis melaksanakan penelitian.
8. Tatan, Ican, Denang, Danang, dan Ari (terimakasih atas dukungan dan
bantuannya terutama disaat ujian sidang penulis). Widhi dan Acha
(terimakasih atas dukungannya).
9. Warga Laboratorium Mikrobiologi dan Biokimia PAU (Bu Sri, Mbak
Rika, Bu Indah, Bu Emma, Bu Ika, Bu Eni, Bu Dewi, Mbak Pepi, dan
Mbak Ida) yang telah banyak membantu, mengajari, dan membimbing
penulis selama melaksanakan penelitian.
10.Penghuni Wisma Karditha (Mbak Jenab, Mas Aga, Rucit, Ocha, Anis,
Bohai, Wati, Cici, Fitri, Lina, Mbak Nanin, Abdy, Iin, Mbak Rina dan Ibu
Warteg) yang telah memberikan dukungan dan menciptakan lingkungan
yang kondusif bagi penulis sehingga memudahkan dalam penyelesaian
skripsi ini.
11.Teman-teman TPG 40. Terimakasih atas dukungan, kasih sayang, dan
kenangan indah selama di Ilmu dan Teknologi Pangan IPB (2003-2007)
serta terimakasih atas kebaikan dan keceriaan dihari-hari praktikum,
penelitian, perkuliahan, dan di Lab komputernya. Specially for Golongan
B (Erik sebagai ketua golongan B, Tya, Aan, Ina, Tuti, Jeng Ye, Andin,
Anis, Hanifah, Novi, Ola, Idham, Kemal, Nunu, Marto, dan yang lainnya
yang tidak bisa disebutkan satu persatu).
12.Dosen IPB dan ITP-FATETA periode 2003-2007 atas segala pengajaran
dan pendidikan serta kasih sayang yang telah diberikan kepada penulis.
Semoga skripsi hasil penelitian akhir ini dapat memberikan banyak
manfaat bagi yang memerlukannya. Akhirnya kritik dan saran sangat
penulis harapkan demi perbaikan tulisan selanjutnya. Serta mohon ma’af
atas segala kesalahan dan kekurangan dalam skripsi ini.
Bogor, Agustus 2007
DAFTAR ISI
II. TINJAUAN PUSTAKA
A. KITOSAN ...
B. ENZIM KITOSANASE ...
C. MIKROBA TERMOFILIK ...
D. PEMURNIAN ENZIM
1. Pemurnian kitosanase ...
(a). Umum ...
(b). Kromatografi filtrasi gel ...
2. Pemurnian kitosanase yang telah dilakukan ...
E. SDS-PAGE ...
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT...
B. METODE PENELITIAN
1. Tahap Penyegaran dan Pembuatan
kultur Starter ...
2. Produksi Enzim ...
3. Pengendapan dengan amonium sulfat ...
4. Dialisis ...
5. Kromatografi filtrasi gel...
6. Analisa aktivitas enzim kitosanase ...
8. SDS-PAGE ...
9. Karakterisasi Enzim ...
IV. HASIL DAN PEMBAHASAN
A. PRODUKSI ENZIM ...
B. EKSTRAKSI
1. Presipitasi ...
2. Dialisis ...
C. PEMURNIAN (Kromatografi filtrasi gel) ...
D. KARAKTERISASI ENZIM KITOSANASE
1. Karakterisasi enzim kasar (crude enzyme)
(a). Suhu optimum ...
(b). pH Optimum ...
2. Karakterisasi enzim murni (pure enzyme)
(a). Suhu optimum ...
(b). pH optimum ...
(c). Stabilitas panas ...
SKRIPSI
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
Oleh :
EVANDA PUSPITA F24103051
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
EVANDA PUSPITA. F24103051. Studi Karakteristik Kitosanase dari Isolat
Bacillus licheniformis MB-2. Di bawah bimbingan Prof. Dr. Maggy T. Suhartono
RINGKASAN
Kitosan adalah polisakarida alami hasil dari proses deasetilasi kitin. Kitosanase merupakan enzim yang mendegradasi kitosan dan beberapa kitosanase diduga bersifat termostabil. Enzim kitosanase dapat dihasilkan oleh bakteri, fungi, dan tanaman. Pada penelitian ini, Bacillus licheniformis MB-2 yang diperoleh dari Tompaso (Manado) digunakan sebagai mikroba penghasil enzim kitosanase. Penelitian ini bertujuan untuk mempelajari pemurnian kitosanase dari isolat Bacillus lecheniformis MB-2 melalui kromatografi filtrasi gel dan menganalisa beberapa karakteristik dari enzim kitosanase yang dihasilkan.
Isolat Bacillus licheniformis MB-2 yang memperlihatkan zona bening diinokulasikan pada media thermus cair yang terdiri dari koloidal kitosan, K2HPO4, KH2PO4, MgSO4, ekstrak kamir, bacto agar, dan casiton untuk
mendapatkan kultur starter. Selanjutnya untuk produksi enzim kitosanase, kultur starter yang diperoleh diinokulasikan kedalam media yang sama dan difermentasi pada shaker waterbath selama 7 hari pada suhu 55°C dengan kecepatan 120 rpm. Supernatan bebas sel dari kitosanase diperoleh dengan cara sentrifugasi dingin selama 10 menit dengan kecepatan 8000 rpm. Selanjutnya presipitasi dengan amonium sulfat 80% dilakukan terhadap supernatan bebas sel untuk mendapatkan
crude enzyme (endapan protein). Enzim yang telah diendapkan selanjutnya dikarakterisasi suhu dan pH untuk mendapatkan suhu dan pH optimum crude enzyme. Sebelum dilakukan kromatografi, crude enzyme didialisis menggunakan kantong selofan yang dapat menahan molekul lebih dari 10.000 dalton sehingga garam-garam dan ion penggangu lainnya yang dapat menggangu kestabilan enzim dapat bermigrasi keluar membran.
Kromatografi filtrasi gel diawali dengan tahap pengembangan matriks (swelling) dengan melarutkan Sephadex G-100 kedalam air bebas ion sambil diaduk dengan magnetic stirrer perlahan selama 30 menit dan didiamkan selama 3 hari pada suhu dingin. Selanjutnya supernatan diganti dengan bufer fosfat 0.05 M pH 6. Matriks yang telah dikembangkan diaplikasikan kedalam kolom kemudian kolom diekuilibrasi dengan bufer yang sama dan sebanyak 2 ml endapan protein hasil presipitasi dimasukkan kedalam kolom diikuti dengan perhitungan laju aliran setiap 100 drop. Filtrasi gel dilakukan selama 25 jam dengan kecepatan elusi 0.22 ml/menit. Pengukuran aktivitas enzim dilakukan dengan mereaksikan enzim dan soluble kitosan sebagai substrat menggunakan teknik spektrofotometri pada panjang gelombang 420 nm dan pengukuran protein dengan metode bradford pada panjang gelombang 595 nm. Fraksi enzim hasil kromatografi yang menunjukkan adanya peak pada grafik kromatografi selanjutnya dikarakterisasi dan dilakukan analisis SDS-PAGE. Karakterisasi yang dilakukan yaitu penentuan pH dan suhu optimum serta pengaruh suhu dan pH terhadap stabilitas enzim. Sedangkan analisis SDS-PAGE dilakukan untuk menentukkan berat molekul enzim.
diendapkan dengan amonium sulfat aktivitas enzim meningkat menjadi 1.087 U/ml, namun menurunkan aktivitas spesifik enzim menjadi 1.433 U/mg. Dialisis menurunkan aktivitas enzim menjadi 1.086 U/ml namun meningkatkan aktivitas spesifiknya menjadi 2.045 U/mg. Selanjutnya setelah melewati tahap kromatografi terjadi penurunan aktivitas enzim menjadi 1.049 U/ml dan peningkatan aktivitas spesifik yang cukup besar menjadi 32.284 U/mg. Peningkatan aktivitas spesifik setelah tahap kromatografi menyebabkan tingkat kemurnian enzim meningkat. Adapaun tingkat kemurnian enzim berturut-turut dari hasil presipitasi, dialisat dan hasil kromatografi filtrasi gel adalah 0.32, 0.45, dan 7.11 kali.
Hasil karakterisasi menunjukkan bahwa crude enzyme optimum pada suhu 60 – 70oC dan optimum pada bufer Na-fosfat pH 6 – 7. Sedangkan enzim hasil kromatografi optimum pada suhu 70 – 80oC dan optimum pada pH 6. Uji stabilitas enzim hasil kromatografi dilakukan pada suhu 80oC dan 90oC. Dari hasil pengujian menunjukkan bahwa aktivitas relatif (sisa) enzim cukup stabil, dimana setelah melalui pemanasan selama 120 menit masih terdapat aktivitas relatif sebesar 59.61% (suhu 80oC) dan 58.53% (suhu 90oC). Selain dinyatakan dengan aktivitas relatif, stabilitas enzim pun dinyatakan dengan nilai k (konstanta deaktifasi), t1/2 (waktu paruh) dan energi aktifasi (Ea). Adapun nilai k untuk suhu
80oC dan 90oC adalah 0.0041 min-1 dan 0.0045 min-1, sedangkan waktu paruhnya adalah 169.06 menit (suhu 80oC) dan 154.03 menit (suhu 90oC). Sehingga didapatkan energi aktifasi sebesar 2371.48 kal/(gmol.oK). Pengaruh pH terhadap stabilitas enzim hasil kromatografi cenderung lebih stabil. Aktivitas relatif setelah pemanasan selama 120 menit masih tersisa sebesar 91.94%, nilai k yang diperoleh adalah 0.0007 min-1 dan waktu paruhnya sebesar 990.21 menit.
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
EVANDA PUSPITA F24103051
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
STUDI KARAKTERISTIK KITOSANASE DARI ISOLAT Bacillus licheniformis MB-2
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
EVANDA PUSPITA F24103051
Dilahirkan pada tanggal 28 Desember 1985
Di Jakarta
Tanggal lulus: 08 Agustus 2007
Bogor, 15 Agustus 2007
Menyetuji,
Prof. Dr. Ir. Maggy T. Suhartono
Dosen Pembimbing Akademik
Mengetahui,
Dr. Ir. Dahrul Syah, MSc
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 Desember
198 1985, sebagai anak pertama dari tiga bersaudara dari
pas Cah pasangan Cahyan Sofyadi dan Evi Syofia. Penulis
memili memiliki dua orang adik perempuan yang bernama
Deviani Deviani Prima Dewi dan Citra Diani Putri.
Pendidikan Sekolah ditempuh dari tahun 1991 -
1997 di SDN Catihan, kemudian melanjutkan sekolah
menengah pertama di STPN I Pdg-Banten hingga tahun 2000. Pada tahun 2003
penulis telah berhasil menyelesaikan pendidikannya di SMUN I Pdg-Banten.
Penulis diterima sebagai mahasiswi Institut Pertanian Bogor pada tahun 2003
melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Ilmu dan
Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis merupakan anggota HIMITEPA
selama periode 2005 – 2006. Disamping itu pada tahun 2007, penulis pernah
menjadi asisten praktikum mata kuliah Biokimia Pangan. Pelatihan dan seminar
KATA PENGANTAR
Alhamdulillahirabbi’alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas Ridho-Nya serta atas rahmat dan karunian-Nya sehingga
penulis dapat menyelesaikan skripsi ini.
Skripsi disusun berdasarkan penelitian yang dilaksanakan di
Laboratorium Biokimia dan Mikrobiologi PAU dengan judul Studi Karakteristik Kitosanase dari Isolat Bacillus licheniformis MB-2 yang telah dilaksanakan dari bulan November 2006 sampai Juni 2007 di Departemen Ilmu dan Teknologi
Pangan, Fakultas Teknologi Pertanian-IPB.
Pada kesempatan ini, penulis ingin menyampaikan rasa terimakasih
yang tak terhingga kepada :
1. Prof. Dr. Ir. Maggy T. Suhartono, sebagai dosen pembimbing akademik
yang telah banyak memberi bimbingan dan dukungan selama penulis
menjalani pendidikan dan selama penulis melakukan tugas akhir sampai
penulisan skripsi ini.
2. Ir. Sutrisno Koswara, MSi dan Dr. Sukarno, MSc selaku dosen penguji
yang telah bersedia meluangkan waktu untuk menguji, membimbing dan
memberi saran kepada penulis.
3. Mamah, papah, dan adik penulis (Ima dan Citra) yang selalu memberi
bimbingan, dorongan (material, spiritual), kasih sayang kepada penulis
selama menjalani pendidikan di IPB dari awal hingga penulis
menyelesaikan tugas akhir ini.
4. My Big Family Bandung atas segala dukungan, kasih sayang, kebaikan,
dan doanya. Specially for enyunk, mamih, dan enin.
5. My best friends forever (Dian, Rucit, Ocha, Anis, Bohay, Iin, Abdy, Wate,
Ikoq, DinY, dan Indach) atas dukungannya, keceriannya, kasih sayang,
doa dan telah menjadi teman terbaik dan tempat curhat terbaik bagi
penulis. Terimakasih telah memberi kenangan indah bagi penulis.
6. Yuda Ganda Putera (terimakasi atas dukungan, perhatian dan doanya)
serta Jeniar, uwa, Indri, Didik, Jelita, dan yanti (terimakasih tetap menjadi
7. Rekan-rekan seperjuangan Laboratorium Mikrobiologi dan Biokimia PAU
(Dian, Rika, Prasna dan Usman). Terimakasih atas bantuannya dan
dukungannya selama penulis melaksanakan penelitian.
8. Tatan, Ican, Denang, Danang, dan Ari (terimakasih atas dukungan dan
bantuannya terutama disaat ujian sidang penulis). Widhi dan Acha
(terimakasih atas dukungannya).
9. Warga Laboratorium Mikrobiologi dan Biokimia PAU (Bu Sri, Mbak
Rika, Bu Indah, Bu Emma, Bu Ika, Bu Eni, Bu Dewi, Mbak Pepi, dan
Mbak Ida) yang telah banyak membantu, mengajari, dan membimbing
penulis selama melaksanakan penelitian.
10.Penghuni Wisma Karditha (Mbak Jenab, Mas Aga, Rucit, Ocha, Anis,
Bohai, Wati, Cici, Fitri, Lina, Mbak Nanin, Abdy, Iin, Mbak Rina dan Ibu
Warteg) yang telah memberikan dukungan dan menciptakan lingkungan
yang kondusif bagi penulis sehingga memudahkan dalam penyelesaian
skripsi ini.
11.Teman-teman TPG 40. Terimakasih atas dukungan, kasih sayang, dan
kenangan indah selama di Ilmu dan Teknologi Pangan IPB (2003-2007)
serta terimakasih atas kebaikan dan keceriaan dihari-hari praktikum,
penelitian, perkuliahan, dan di Lab komputernya. Specially for Golongan
B (Erik sebagai ketua golongan B, Tya, Aan, Ina, Tuti, Jeng Ye, Andin,
Anis, Hanifah, Novi, Ola, Idham, Kemal, Nunu, Marto, dan yang lainnya
yang tidak bisa disebutkan satu persatu).
12.Dosen IPB dan ITP-FATETA periode 2003-2007 atas segala pengajaran
dan pendidikan serta kasih sayang yang telah diberikan kepada penulis.
Semoga skripsi hasil penelitian akhir ini dapat memberikan banyak
manfaat bagi yang memerlukannya. Akhirnya kritik dan saran sangat
penulis harapkan demi perbaikan tulisan selanjutnya. Serta mohon ma’af
atas segala kesalahan dan kekurangan dalam skripsi ini.
Bogor, Agustus 2007
DAFTAR ISI
II. TINJAUAN PUSTAKA
A. KITOSAN ...
B. ENZIM KITOSANASE ...
C. MIKROBA TERMOFILIK ...
D. PEMURNIAN ENZIM
1. Pemurnian kitosanase ...
(a). Umum ...
(b). Kromatografi filtrasi gel ...
2. Pemurnian kitosanase yang telah dilakukan ...
E. SDS-PAGE ...
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT...
B. METODE PENELITIAN
1. Tahap Penyegaran dan Pembuatan
kultur Starter ...
2. Produksi Enzim ...
3. Pengendapan dengan amonium sulfat ...
4. Dialisis ...
5. Kromatografi filtrasi gel...
6. Analisa aktivitas enzim kitosanase ...
8. SDS-PAGE ...
9. Karakterisasi Enzim ...
IV. HASIL DAN PEMBAHASAN
A. PRODUKSI ENZIM ...
B. EKSTRAKSI
1. Presipitasi ...
2. Dialisis ...
C. PEMURNIAN (Kromatografi filtrasi gel) ...
D. KARAKTERISASI ENZIM KITOSANASE
1. Karakterisasi enzim kasar (crude enzyme)
(a). Suhu optimum ...
(b). pH Optimum ...
2. Karakterisasi enzim murni (pure enzyme)
(a). Suhu optimum ...
(b). pH optimum ...
(c). Stabilitas panas ...
DAFTAR TABEL
Halaman
Tabel 1. Aplikasi kitosan ... 5
Tabel 2. Jenis enzim termostabil lain ... 6
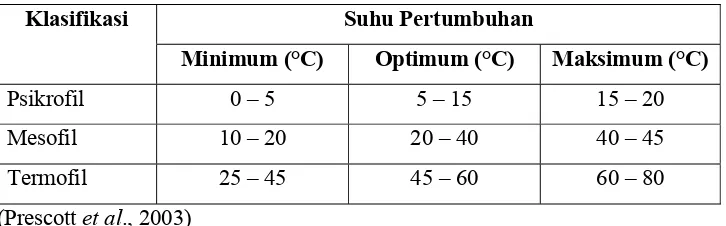
Tabel 3. Klasifikasi mikroba berdasarkan suhu ... 8
Tabel 4. Beberapa tipe dari gel sephadex ... 12
Tabel 5. Tahap pemurnian enzim kitosanase ... 13
Tabel 6. Beberapa karakteristik enzim murni kitosanase ... 16
Tabel 7. Prosedur analisis aktivitas enzim kitosanase ... 24
Tabel 8. Komposisi gel SDS-PAGE ... 26
Tabel 9. Komposisi komponen tipikal mikroorganisme ... 32
Tabel 10. Perbandingan aktivitas enzim dengan kitosanase lain ... 38
Tabel 11. Produksi enzim kitosanase dari isolat Bacllus licheniformis MB-2 ... 41 Tabel 12. Perbandingan tingkat kemurnian dengan kitosanase lain ... 42
Tabel 13 Kisaran pemisahan gel akrilamida pada berbagai konsentrasi.... 56
DAFTAR GAMBAR
Halaman
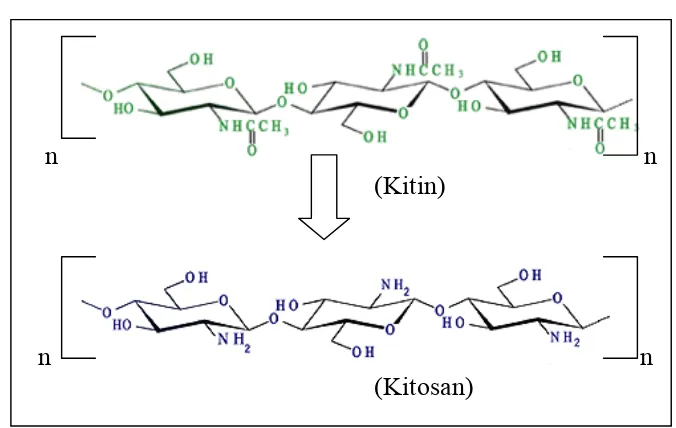
Gambar 1. Proses deasetilasi kitin ... 4
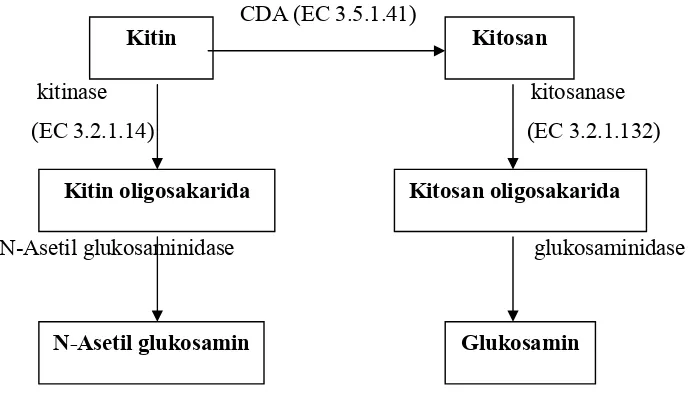
Gambar 2. Lintasan degradasi kitin ... 5
Gambar 3. Mekanisme pemisahan molekul pada kromatografi
filtrasi gel ... 11
Gambar 4. Struktur sephadex ... 12
Gambar 5. Pembentukan gel poliakrilamida ... 15
Gambar 6. Skema riset penelitian ... 20
Gambar 7. Areal bening dari isolat Bacillus licheniformis MB-2 yang
ditumbuhkan pada media thermus padat ... 30 Gambar 8 Aktivitas enzim kitosanase hasil ekstraksi ... 36
Gambar 9. Prinsip dialisis ... 37
Gambar 10.
Gambar 11a.
Gambar 11b.
Profil elusi aktif kitosanase pada filtrasi gel
(sephadex G-100) ...
Aktivitas crude kitosanase pada berbagai suhu ... Aktivitas spesifik crude kitosanase pada berbagai suhu ...
42
44
44
Gambar 12a.
Gambar 12b.
Aktivitas crude kitosanase pada berbagai pH ... Aktivitas spesifik crude kitosanase pada bebagai pH ...
46
46
Gambar 13a.
Gambar 13b.
Aktivitas kitosanase fraksi 9 pada berbagai kondisi
suhu ……….
Aktivitas spesifik kitosanase fraksi 9 pada berbagai kondisi
suhu ………. 48
48
Gambar 14a.
Gambar 14b.
Aktivitas kitosanase fraksi 9 pada berbagai pH ...
Aktivitas spesifik kitosanase fraksi 9 pada berbagai pH ... 49
49
Gambar 15. Pengaruhu suhu terhadap stabilitas kitosanase Bacillus
licheniformis MB-2 ... 51
Gambar 16. Kurva hubungan ln aktivitas kitosanase Bacillus licheniformis MB-2 terhadap waktu pemanasan ... 52
Gambar 18. Pengaruh pH terhadap stabilitas kitosanase Bacillus licheniformis MB-2 pada suhu 80oC ... 54
Gambar 19. Kurva hubungan ln aktivitas kitosanase Bacillus licheniformis
MB-2 terhadap waktu pemanasan pada suhu 80oC ... 55 Gambar 20. Mekanisme pembentukan kompleks SDS-Protein ... 57
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Pembuatan tepung kitosan ... 67
Lampiran 2. Pembuatan koloidal kitosan ... 68
Lampiran 3. Pembuatan soluble chitosan ... 69 Lampiran 4. Pembuatan kurva standar glukosamin ... 70
Lampiran 5. Pembuatan kurva standar protein (BSA) ... 71
Lampiran 6. Komposisi larutan bufer ... 72
Lampiran 7. Pembuatan pereaksi schales, pereaksi Bradford, dan pereaksi
untuk SDS-PAGE ... 74
Lampiran 8. Aktivitas dan kadar protein crude enzyme ... 76 Lampiran 9. Hasil Kromatografi filtrasi gel kitosanase dari isolat Bacillus
licheniformis MB-2 ... 77 Lampiran 10. Karakterisasi suhu Crude enzyme ………... 82 Lampiran 11. Karakterisasi pH crude enzyme ……….. 83 Lampiran 12. Karakterisasi suhu fraksi 9 (pure enzyme) ... 85 Lampiran 13. Karakterisasi pH fraksi 9 (pure enzyme) ... 86 Lampiran 14. Pengaruh suhu pemanasan fraksi 9 (pure enzyme) terhadap
stabilitas enzim ………... 87
Lampiran 15. Pengaruh pH fraksi 9 (pure enzyme) terhadap terhadap stabilitas enzim ……….. 88
I. PENDAHULUAN
A. LATAR BELAKANG
Kitosan merupakan produk terdeasetilasi (penghilangan gugus –
COCH3) dari kitin. Kitin merupakan polimer alami kedua terbanyak di alam
setelah selulosa yang banyak ditemukan pada kutikula serangga, crustacea,
klorofil alga (chlorella sp) dan dinding sel fungi (terutama kelas zygomycetes).
Selain itu kitosan bersifat larut asam dan tidak larut dalam media netral dan
campuran alkali serta merupakan polikation alami (Choi et al., 2004). Piza et
al., (1999) melaporkan kitosan merupakan suatu polisakarida linear yang
mempunyai ikatan β-(1,4) glukosamin.
Kitosanase adalah enzim yang menghidrolisis kitosan menjadi
oligomer kitosan dan beberapa kitosanase diduga bersifat termostabil (enzim
yang masih dapat aktif diatas suhu optimal pertumbuhan mikroorganisme
yang menghasilkannya). Sebagai negara yang memiliki kekayaan hayati
tinggi, Indonesia merupakan salah satu habitat bagi mikroorganisme penghasil
enzim kitosanase. Kawasan sumber air panas, kawah gunung berapi, dan
sumur hydrothermal dimana suhunya dapat mencapai 100°C merupakan
wilayah Indonesia yang belum banyak digali potensinya. Kawasan ini adalah
habitat bagi mikroorganisme termofilik, dimana mikroorganisme ini
merupakan mikroorganisme penghasil enzim termostabil. Oleh karena itu
peluang untuk mendapatkan mikroorganisme penghasil enzim kitosanase
termostabil sangat tinggi.
Isolasi bakteri penghasil enzim kitosanase termostabil dari
bakteri termofilik telah berhasil dilakukan oleh Chasanah (2004). Hasil isolasi
yaitu isolat Bacillus licheniformis MB-2 dari sumber air panas Tompaso-
Manado digunakan untuk produksi, pemurnian, elektroforesis, dan
karakterisasi enzim kitosanase. Selain itu isolat Bacillus coagulans LH 28.38
asal Lahendong-Sulawesi Utara pun telah berhasil diisolasi dan diaplikasikan
untuk menghasilkan enzim kitosanase (Haliza, 2003).
Pada beberapa dekade terakhir, enzim yang stabil pada kondisi
industri. Maka dari itu pencarian terhadap mikroorganisme termofil yang
menghasilkan enzim termostabil pun terus dilakukan karena memberikan
banyak keuntungan, seperti enzim termostabil sangat berguna sebagai
biokatalis dalam penelitian dan proses industri. Selain itu menyebabkan
peningkatan reaksi karena adanya peningkatan suhu, yang tentunya hal ini
akan berdampak pada penghematan waktu, tenaga, dan biaya operasi. Enzim
termostabil pun dapat meminimalkan kontaminasi dan lebih tahan terhadap
berbagai senyawa atau keadaan penyebab denaturasi sehingga lebih tahan
untuk disimpan serta dapat menekan kehilangan aktivitas selama produksi
dan penyimpanan (Suwanto, 1991).
Usaha untuk memurnikan enzim dan menentukkan berat molekul
dari enzim telah banyak dilakukan terutama secara analitik. Dimana
pemurnian enzim merupakan proses pemisahan protein enzim dari protein non
enzim dan elektroforesis merupakan suatu cara yang digunakan untuk
menentukkan berat molekul protein enzim. Adapun teknik pemurnian yang
umum dilakukan untuk enzim adalah metode kromatografi filtrasi gel
menggunakan matriks tertentu sehingga terjadi pemisahan protein berdasarkan
ukuran molekulnya, kromatografi ion exchange, kromatografi afinitas, dan
kromatografi interaksi hidrofobik. Tahap kromatografi dilakukan setelah
melalui beberapa tahap ekstraksi enzim yang meliputi tahap pengendapan
dengan amonium sulfat (presipitasi) dan dialisis.
B. TUJUAN DAN SASARAN
Penelitian ini bertujuan untuk mempelajari pemurnian enzim
kitosanase dari isolat Bacillus licheniformis MB-2 melalui kromatografi
filtrasi gel dan menganalisa beberapa karakteristik dari enzim kitosanase yang
C. MANFAAT PENELITIAN
Informasi beberapa karakteristik enzim termostabil kitosanase dari
isolat Bacillus licheniformis MB-2 bermanfaat untuk penggunaan enzim
II. TINJAUAN PUSTAKA
A. KITOSAN
Kitosan merupakan polimer yang tersusun atas monomer
D-glukosamin melalui ikatan glikosidik β-1,4 dan diperoleh dari hasil deasetilasi
kitin (penghilangan gugus –COCH3) (Piza et al., 1999). Kitin merupakan
polimer yang disusun dari monomer N-asetil glukosamin
(2-asetamido-2-deoksi-D-glukopiranosa). Proses deasetilasi kitin menjadi kitosan terdapat pada
gambar 1.
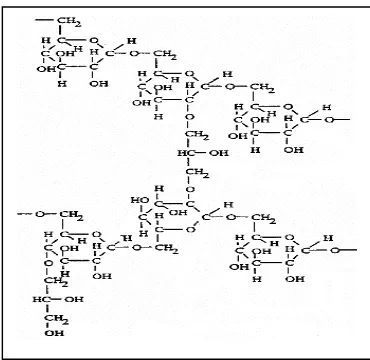
Gambar 1. Proses Deasetilasi Kitin (Piza et al., 1999)
Selain menghilangkan gugus asetil, proses deasetilasi kitin menjadi
kitosan menyisakan gugus amino yang bermuatan positif sehingga kitosan
bersifat polikationik. Proses desetilasi kitin menjadi kitosan dibagi menjadi dua
proses yaitu secara kimiawi dan enzimatis (Emmawati, 2005). Proses
deasetilasi secara kimiawi dilakukan dengan perlakuan alkali NaOH 50%
dengan pemanasan. Sedangkan proses deasetilasi secara enzimatis terjadi
karena aktivitas katalitik CDA (gambar 2).
n
n
(Kitin)
n
n
CDA (EC 3.5.1.41)
kitinase kitosanase
(EC 3.2.1.14) (EC 3.2.1.132)
N-Asetil glukosaminidase glukosaminidase
Gambar 2. Lintasan degradasi kitin dan kitosan (Rochima, 2005)
Tabel 1. Aplikasi Kitosan
Aplikasi Contoh
Pangan • Edible film pada produk sayur dan buah
• Pengawet alami produk pangan
Kedokteran • Agen pengurang kolesterol, lemak, dan pelangsing
tubuh
Kosmetik • Skin care (moisturizer), lipstics, foundation, lotion, dan
shampo
Tekstil • Bermanfaat pada pembuatan underwear, bantal, dan
sarung tangan
Lainnya • Penanggulangan limbah (kitosan bisa mengkelat
tembaga, timah, mercury, dan uranium)
• Digunakan untuk pelapisan benih sehingga bisa menghambat patogen dan membuat tanaman jadi
resistan terhadap penyakit
(http://www.uspto.gov) Kitin
N-Asetil glukosamin
Kitosan oligosakarida Kitosan
Kitin oligosakarida
B. ENZIM KITOSANASE
Kitosanase merupakan enzim yang menghidrolisis ikatan
GIcN-GIcN, GIcN-GIcNAc dan GIcN-GIcN, bukan pada ikatan
GIcNAc-GIcNAc (Piza et al., 1999). Beberapa kitosanase diduga bersifat termostabil,
yaitu enzim yang masih stabil dan masih dapat aktif pada suhu diatas suhu
pertumbuhan mikroorganisme yang menghasilkannya selama waktu tertentu.
Enzim termostabil pada umumnya dihasilkan oleh mikroorganisme termofilik
yang hidup pada lingkungan dengan temperatur lebih besar dari 50°C,
misalnya perairan air panas, kawah, dan sedimen geotermal lainnya. Dimana
stabilitas dari enzim termostabil disebabkan oleh interaksi van der wals, ikatan
hidrogen, interaksi hidrofobik, interaksi elektrostatik, dan jembatan disulfida
di antara asam amino penyusun protein.
Bakteri penghasil kitosanase diantaranya adalah Bacillus circulans
MH-K1 (Yabuki, 1989), Bacillus licheniformis UTK (Uchida et al., 1992),
Bacillus cereus (Piza et al., 1999), Bacillus megaterium P1 (Pelletier dan
Syugsch, 1992), Bacillus sp. Strain KCTC 0377 BP (Choi et al., 2004),
Matsuebacter chitosanotabidus 3001 (Park et al, 1999),dan genus Aspergillus
(Arcidiacono et al., 1989) dilaporkan juga sebagai mikroba penghasil enzim
kitosanase. Beberapa enzim termostabil yang telah dimanfaatkan dalam
industri dapat dilihat pada tabel 2.
Tabel 2. Jenis Enzim termostabil lain
Mikroba Enzim Termostabil Aplikasi
Bacillus subtilis α-amilase
Aktivitas enzim dipengaruhi oleh berbagai faktor lingkungan
seperti pH, suhu, pelarut, kekuatan ion dan adanya inhibitor atau aktivator.
Oleh karena itu sangat penting untuk mengetahui sifat-sifat/karakteristik
enzim yang meliputi pH optimum, suhu optimum, pengaruh penambahan ion
logam, dan ketahanan enzim terhadap panas. Namun dalam penelitian ini
hanya ditentukan pH optimum, suhu optimum, dan stabilitas panas (hanya
pada enzim murni).
Pengaruh suhu pada reaksi enzimatis merupakan suatu fenomena
yang kompleks. Pada umumnya semakin tinggu suhu, laju reaksi kimia
semakin naik dan inaktifasi enzim semakin naik pula baik yang dikatalis
maupun yang tidak dikatalis oleh enzim (Winarno, 1983). Suhu optimum
merupakan suhu dimana enzim menunjukkan aktivitas yang maksimum.
Meningkatnya aktivitas enzim sampai pada suhu optimum tertentu disebabkan
oleh bertambahnya energi kinetik yang mempercepat gerak vibrasi, translasi,
serta rotasi enzim dan substrat sehingga memperbesar peluang keduanya untuk
saling berinteraksi. Pada suhu yang tinggi protein akan cepat mengalami
kerusakan (denaturasi) (Suhartono, 1989).
Pada umumnya enzim bersifat amfolitik, yaitu enzim mempunyai
konstanta disosiasi pada gugus asam dan basanya terutama pada residu
terminal karboksil dan gugus terminal aminonya. Tidak semua enzim
menunjukkan pH optimum dengan puncak yang tajam. Beberapa enzim
menunjukkan sebuah kisaran pH, dimana kecepatan reaksi tidak berubah. Hal
ini disebabkan beberapa asam amino yang merupakan sisi aktif enzim dapat
terionisasi pada kisaran pH tertentu. Menurut Lehninger (1993) enzim
memiliki pH optimum yang khas, yaitu pH yang menyebabkan aktivitasnya
maksimum. Umumnya enzim optimum pada pH 4.5 – 8 (Winarno, 1983).
Nilai pH optimum enzim tidak selalu sama dengan pH lingkungan normalnya
(dapat sedikit berada di atas atau di bawah pH lingkungan normalnya).
Kestabilan (ketahanan) enzim dapat diartikan sebagai kestabilan
aktivitas enzim selama penyimpanan enzim, selama penggunaan enzim
tersebut, dan kestabilan terhadap berbagai senyawa yang bersifat merusak
misalnya suhu (panas) dan pH ekstrim. Penentuan daya tahan enzim terhadap
panas umumnya dilakukan pada suhu optimum dan pH optimum enzim
tersebut (Suhartono, 1989). Adanya perbedaan sumber atau asal enzim dapat
menyebabkan perbedaan terhadap daya tahan panas enzim tersebut meskipun
jenis enzimnya sama (Winarno, 1983). Tabel 6 menunjukkan beberapa
karakteristik dari enzim kitosanase.
C. MIKROBA TERMOFILIK
Mikroba termofilik merupakan mikroba yang mampu tumbuh
optimal pada lingkungan ekstrim panas yaitu daerah-daerah geotermal di darat
maupun di laut dalam. Mikroba termofil dapat lebih tahan pada suhu tinggi
disebabkan oleh keistimewaan yang dimiliki pada membran selnya yang
berhubungan dengan lingkungan luar. Diduga asam lemak penyusun komponen
membran lebih jenuh sehingga membuat membran ini lebih stabil dan tahan
pada suhu tinggi. Mengingat beraneka ragam kehidupan mikroba, maka
mikroba diklasifikasikan berdasarkan suhu pertumbuhan optimalnya pada tabel
3.
Tabel 3. Klasifikasi mikroba berdasarkan suhu
Klasifikasi Suhu Pertumbuhan
Minimum (°C) Optimum (°C) Maksimum (°C)
Psikrofil 0 – 5 5 – 15 15 – 20
Mesofil 10 – 20 20 – 40 40 – 45
Termofil 25 – 45 45 – 60 60 – 80
(Prescott et al., 2003)
Bacillus licheniformis MB-2 merupakan salah satu jenis mikroba
termofil yang menghasilkan enzim kitosanase. Berdasarkan identifikasi
mikroba yang telah dilakukan oleh Chasanah (2004), Bacillus licheniformis
MB-2 merupakan jenis bakteri gram positif dan bersifat aerobik atau
reaksi katalase serta hasil negatif pada reaksi indole, methyl red, dan voges
preusker.
D. PEMURNIAN ENZIM
1. Pemurnian Kitosanase
(a). Umum
Pemurnian merupakan suatu usaha untuk mengisolasi enzim
tertentu dari ekstrak enzim kasar yang masih mengandung sel
mikroorganisme ataupun komponen lainnya (Hooper & Homes, 2000).
Walsh (2002) menggolongkan metode kromatografi menjadi empat yaitu
kromatografi ion exchange, kromatografi interaksi hidrofobik,
kromatografi afinitas, dan kromatografi filtrasi gel.
Kromatografi ion exchange adalah pemisahan protein yang
memanfaatkan perbedaan afinitas molekul bermuatan di dalam larutan
dengan senyawa pengisi kolom yang muatannya berlawanan (Harris dan
Angal, 1989). Suhartono (1989) berpendapat bahwa ada dua macam
bahan penukar ion yaitu bahan penukar kation dan bahan penukar anion.
Contoh penukar kation adalah Dowex 50, IRC-150, CM-selulosa,
sephadex, dan sulfoetil selulosa. Sedangkan contoh penukar anion adalah
aminoetil, DEAE (dietil-aminoetil), dan quartener-aminoetil.
Kromatografi interaksi hidrofobik merupakan pemisahan protein
berdasarkan adanya perbedaan interaksi hidrofobik antara larutan protein
dan matriks gel sebagai fase diamnya. Jenis matriks yang biasa
digunakan adalah turunan dari sepharose seperti fenil sepharose
(Suhartono, 1989).
Kromatografi afinitas merupakan tipe kromatografi adsorpsi
(Scouten, 1942). Dalam hal ini molekul yang akan dimurnikan secara
khusus dan bersifat reversibel diadsorpsi oleh ikatan komplemen (ligan)
yang terikat pada matrik. Sedangkan Kromatografi gel filtrasi
merupakan jenis metode pemurnian yang memisahkan larutan protein
beberapa tahap pemurnian enzim kitosanase yang dihasilkan dari
berbagai sumber (mikroba) yang berbeda.
(b). Kromatografi filtrasi gel
Kromatografi filtrasi gel digunakan untuk memisahkan protein
yang mempunyai berat molekul tinggi dari protein atau molekul lain
dengan berat molekul rendah, jadi bekerja sebagai suatu penyaring
molekul. Prinsip dari filtrasi gel yaitu digunakanya bahan pengisi berupa
gel yang berpori-pori, dimana pori-pori pada permukaan gel ini cukup
untuk mencegah molekul-molekul besar masuk kedalamnya tetapi hanya
dapat menampung molekul-molekul kecil. Pada filtrasi gel, campuran
protein di dalam larutan dialirkan kedalam kolom butiran kecil berpori
dari polimer hidrofilik, sehingga molekul besar akan terelusi keluar
kolom lebih cepat daripada molekul kecil karena molekul besar tidak
dapat berpenetrasi ke dalam granula-granula filtrasi gel tetapi hanya
melalui sisi granula saja. Sedangkan molekul kecil dapat berpenetrasi ke
dalam granula-granula filtrasi gel sehingga molekul kecil terperangkap
didalamnya, menyebabkan molekul kecil terelusi keluar lebih lambat
daripada molekul besar. Akan tetapi protein yang memiliki berat
molekul menengah akan mengalir kebawah dengan kecepatan antara
tergantung pada tingkat kemampuan menembus butiran (Lehninger,
1993). Filtrasi gel merupakan metoda pemurnian yang dipilih pada
penelitian ini. Mekanisme pemisahan molekul di dalam kolom filtrasi gel
Gambar 3. Mekanisme pemisahan molekul pada kolom gel filtrasi
(http://www.imb-jena.de/.../proteins_purification.html)
Menurut Darwis dan Sukara (1989) beberapa jenis gel yang dapat
dipakai dalam filtrasi gel antara lain dekstran, poliakrilamida,
polistirena, agarosa, selulosa, silikat, serta pore glass. Jenis gel yang
paling umum digunakan adalah dekstran yang secara komersial dikenal
dengan nama sephadex. Sephadex merupakan polisakarida dekstran yang
berikatan silang dengan epiklorohidrin yang mengandung sejumlah besar
gugus hidroksil. Gel ini mempunyai sifat tahan terhadap garam atau
basa, namun rusak oleh asam (di bawah pH 2) dan oksidator kuat
(Suhartono, 1989). Tipe dari sephadex menentukkan kisaran ukuran
yang dapat dipisahkan. Beberapa tipe gel sephadex dan ukuran molekul
yang dapat dipisahkan dapat dilihat pada tabel 4.
(250 kDa) 125 kDa 75 kDa Campuran protein
Volume elusi Pori matriks
Tabel 4. Beberapa tipe dari gel sephadex
Tipe
Gel
Nilai pengikatan
air g/g sephadex
kering
Batas
pengeluaran / BM
(Dalton)
Kisaran
fraksinasi
(Dalton)
G-10 1.0 700 - 700
G-25 2.5 5000 100 – 5000
G-50 5.0 10.000 500 – 10.000
G-75 7.5 50.000 1000 – 50.000
G-100 10.0 100.000 5000 – 100.000
G-200 20.0 200.000 5000 – 200.000
Mangunwidjaja (1988)
Huruf G dibelakang nama sephadex menunjukkan bahwa sephadex
tersebut dikembangkan dengan air. Sedangkan nomor dibelakangnya
menunjukkan besarnya pengembangan tersebut. Misalnya, 25 kali, 50
kali, dan sebagainya (Suhartono, 1989). Gambar 4 menunjukkan struktur
dari sephadex.
Gambar 4. Struktur sephadex
2. Pemurnian Kitosanase yang telah dilakukan
Tahapan pemurnian kitosanase yang telah berhasil dilakukan
tertera pada tabel 5.
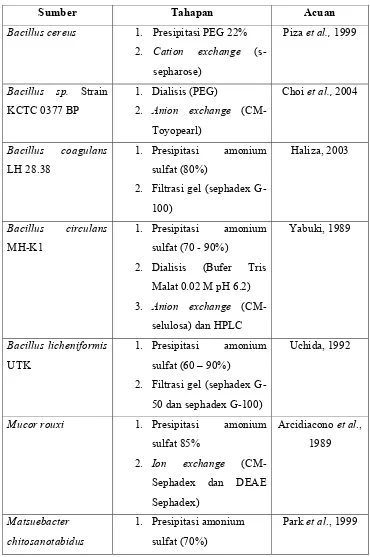
Tabel 5. Tahap pemurnian enzim kitosanase
Sumber Tahapan Acuan
Bacillus cereus 1. Presipitasi PEG 22%
2. Cation exchange
(s-sepharose)
Piza et al., 1999
Bacillus sp. Strain
KCTC 0377 BP
1. Dialisis (PEG)
2. Anion exchange
(CM-Toyopearl)
2. Filtrasi gel (sephadex
G-100)
2. Dialisis (Bufer Tris
Malat 0.02 M pH 6.2)
3. Anion exchange
(CM-selulosa) dan HPLC
2. Filtrasi gel (sephadex
G-50 dan sephadex G-100)
Uchida, 1992
Mucor rouxi 1. Presipitasi amonium
3001 2. Dialisis (Bufer Tris-HCl
1. Dialisis (Bufer sodium
asetat 10 mM pH 5.0)
2. Kromatografi anion
exchange
Eom dan Kang,
2003
E. SDS-PAGE (PAGE dengan Sodium dodesil sulfat)
Teknik SDS-PAGE merupakan metode yang sudah lama
digunakan secara luas untuk menentukkan berat molekul. Selain itu SDS-PAGE
pun digunakan untuk memonitor pemurnian protein dan mendeteksi
penggunanaan pemalsuan bahan-bahan (Nur dan Adijuwana, 1987).
SDS-PAGE adalah metoda yang murah, mudah dibuat, dan cepat untuk
menentukkan, membandingkan, dan mengkarakterisasi protein (Bollag dan
Edelstein, 1991).
SDS-PAGE merupakan pemisahkan fraksi-fraksi suatu zat
berdasarkan migrasi partikel bermuatan atau ion-ion makromolekul dibawah
pengaruh medan listrik, dimana migrasi partikel bermuatan dapat terjadi karena
perbedaan ukuran, bentuk, dan muatan (Harris & Angal, 1989).
SDS (CH3-(CH2)10-CH2OSO3-Na+) merupakan detergen anionik
dan merupakan grup ion sulfat. Disamping itu SDS pun sebagai bahan
pendenaturasi protein bila dipanaskan bersama dengan β-merkaptoetanol
selama 100°C selama 3 menit. Pemanasan menyebabkan rusaknya struktur tiga
dimensi protein menjadi konfigurasi random coil. Hal ini disebabkan oleh
terpecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus-gugus
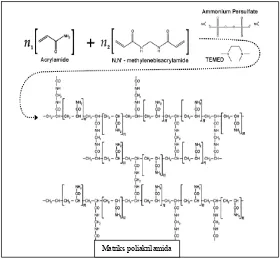
sulfihidril. Gel poliakrilamida diperoleh dengan cara polimerisasi akrilamida
dengan sejumlah cross linking agent metilena bis akrilamida dan amonium
akan terjadi penyimpanan radikal bebas di dalam molekul akrilamid sehingga
terbentuk akrilamid aktif. Akrilamid aktif ini dapat bereaksi dengan cara yang
sama dengan molekul akrilamid yang lain sehingga dihasilkan suatu rantai
polimer yang panjang. Larutan dari rantai polimer ini meskipun kental
(viscous), tapi tidak membentuk gel. Untuk membentuk gel diperlukan N,
N’-metilen-bis-akrilamida yang bertindak sebagai cross linking agent. Polimerisasi
menyebabkan jala dari rantai akrilamida. Ukuran pori jala tersebut ditentukkan
oleh jumlah akrilamida yang dipergunakan per unit volume medium reaksi
(%T) dan derajat ikatan silangnya (%C) (Nur dan Adijuwana, 1988). Adapun
mekanisme dari pembentukan gel poliakrilamida dapat dilihat pada gambar 5.
Gambar 5. Pembentukan gel poliakrilamida
(http://www.davidson.edu/.../Molbio/SDSPAGE/SDSPAGE.html)
Analisa hasil elektroforesis SDS-PAGE pada umumnya didasarkan
pada elektroforetik protein. Mobilitas suatu partikel adalah kecepatan yang
dicapai oleh partikel tersebut pada suatu medan listrik dan mobilitas relatif
suatu protein merupakan perbandingan jarak antara titik awal ke pita protein
dengan titik awal ke titik akhir elektroforesis (Suhartono, 1989 dan Nur &
dengan membuat hubungan antara log berat molekul dan mobilitasnya (Nur dan
Adijuwana, 1988).
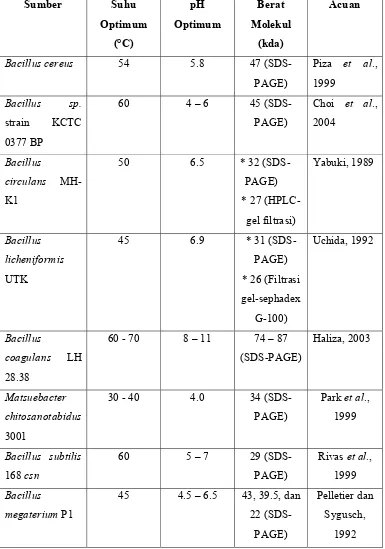
Tabel 6. Beberapa karakteristik enzim murni kitosanase
Bacillus sp.
Strain CK4
60 6.5 29
(SDS-PAGE)
Yoon et al.,
2000
Aspergillus
fumigatus KB-1
60 dan 70 5.5 – 6.5 25.5
(SDS-PAGE)
Eom dan
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
1. Bahan
Bahan-bahan yang digunakan pada penelitian ini terdiri dari : (1)
isolat bakteri Bacillus licheniformis MB-2 yang merupakan koleksi
Laboratorium Mikrobiologi dan Biokimia PAU Institut Pertanian Bogor. (2)
Tepung kitin Rajungan dan substrat terdiri dari : kitosan dan koloidal kitosan
(Haliza, 2003) (lampiran 1 dan 2), soluble kitosan disiapkan dari metoda
Chasanah (2004) (lampiran 3). (3) Bahan-bahan kimia untuk media padat
(Chasanah, 2004) dan thermus media cair yang disiapkan dari metoda Park et
al., (1999) yaitu K2HPO4, KH2PO4, MgSO4, ekstrak khamir, casiton, bacto
agar, dan gelrite (4) Reagen terdiri dari larutan schales dan larutan bradford
(lampiran 7) (5) Bahan kimia untuk pembuatan kurva standar adalah
glukosamin, BSA (Bovine serum Albumin) (6) Amonium sulfat, Na-karbonat,
dan EDTA digunakan untuk tahap presipitasi dan dialisis (7) Sephadex G-100
digunakan untuk kolom kromatografi metode filtrasi gel (8) Bufer terdiri dari
bufer asetat, bufer fosfat, bufer universal, bufer sitrat, bufer fosfat sitrat, bufer
tris (lampiran 6), bufer elektroforesis dan bufer sampel (lampiran 7) (9)
Bahan-bahan kimia yang digunakan untuk SDS-PAGE terdiri dari larutan A,
larutan B, larutan C, larutan fiksasi, silver nitrat, Na2CO3, APS (amonium
persulfat), TEMED (N,N,N’,N’-tetrametil diamin), aquabidestilata, etanol
(30% dan 50%), formaldehida, larutan enhancer, marker (pharmacia)
(lampiran 7). (semua bahan yang digunakan dalam penelitian ini
berspesifikasi pro-analisis (p.a).
2. Alat
Peralatan yang digunakan pada penelitian ini adalah peralatan yang
berada di Laboratorium Mikrobiologi dan Biokimia PAU Institut Pertanian
Bogor antara lain: neraca analitik, ruang dingin (cool room), bunsen, oven,
autoklaf, mesin pengering beku, spektrofotometer, kantong dialisis dari
46,5 cm dengan diameter 1 cm, AC 26 adaptor (pharmacia), redifrac fraction
collector (pharmacia), mini Vertical Electrophoresis (Bio-rad), hamilton
syinges, pH meter, shaker waterbath suhu 55oC, kapas, glass wool, magnetic
stirrer, alumunium foil, sudip, jarum ose, eppendorf, kertas lakmus, kertas
B. METODA
Skema riset penelitian dapat dilihat pada gambar 6 :
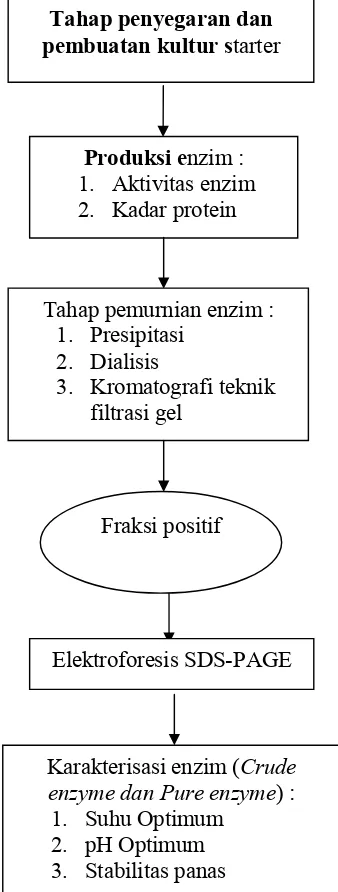
Gambar 6. Skema Riset Penelitian
1. Tahap penyegaran dan pembuatan kultur starter (Rianti, 2003)
Isolat bakteri Bacillus licheniformis MB-2 yang disimpan dalam
freezer, didiamkan selama lima menit pada suhu ruang. Sebanyak satu ose Tahap penyegaran dan
pembuatan kultur starter
Produksi enzim : 1. Aktivitas enzim 2. Kadar protein
Tahap pemurnian enzim : 1. Presipitasi
2. Dialisis
3. Kromatografi teknik filtrasi gel
Elektroforesis SDS-PAGE
Karakterisasi enzim (Crude enzyme dan Pure enzyme) :
1. Suhu Optimum 2. pH Optimum 3. Stabilitas panas
hari pada suhu pertumbuhan 55oC. Setelah itu dilihat areal bening/zona
bening. Hasil goresan (zona bening) diambil satu ose kemudian ditumbuhkan
pada 150 ml media cair dan diinkubasi dalam shaker waterbath suhu 55oC
selama 24 jam dengan kecepatan 120 rpm. Media padat yang digunakan
adalah 1.0% koloidal kitosan, 0.7% K2HPO4, 0.3% KH2PO4, 0.5% MgSO4,
0.25% yeast extract, 0.25% casiton, 1.5% bacto agar, dan 0.4% gelrite dengan
pH media 6.0 (Chasanah, 2004). Sedangkan media yang digunakan untuk
pembuatan kultur starter adalah 0.4% koloidal kitosan, 0.5% MgSO4, 0.3%
KH2PO4, 0.7% K2HPO4, 0.25% yeast extract, dan 0.25% casiton dengan pH
media 7.0 (Park et al., 1999).
2. Produksi enzim (Chasanah, 2004)
Sebanyak 15 ml kultur starter dari media starter diinokulasikan ke
dalam 85 ml media cair. Kemudian diinkubasikan ke dalam shaker waterbath
pada suhu 55oC dengan kecepatan 120 rpm selama 7 hari. Media yang
digunakan untuk produksi enzim sama dengan media yang digunakan untuk
membuat kultur starter. Pemisahan biomassa dilakukan dengan cara
sentrifugasi dengan kecepatan 10.000 rpm pada suhu 4oC selama 20 menit,
selanjutnya filtrat yang berisi enzim diukur aktivitas dan kadar proteinnya.
3. Pengendapan protein dengan amonium sulfat (Rianti, 2003)
Pada tahap ini, enzim yang telah diproduksi diendapkan semalam
pada suhu 4°C dengan amonium sulfat jenuh 80%. Kemudian disentrifugasi
selama 20 menit dengan kecepatan 10.000 rpm. Endapan yang dihasilkan
diambil dengan melarutkannya pada bufer fosfat 0.05 M pH 6, dengan
perbandingan 1 : 1. Presipitat yang dihasilkan diukur aktivitasnya dan kadar
proteinnya.
4. Dialisis (Rianti, 2003)
Kantong dialisis dipotong sesuai dengan ukuran yang diinginkan.
Kemudian direndam dengan larutan 2% (b/v) Na-Karbonat dan 0.05% (b/v)
kembali direbus selama 10 menit (hal ini dilakukan dua kali). Kantong
dibiarkan terendam dalam larutan bufer yang akan digunakan dalam proses
dan disimpan dalam ruang dingin.
Salah satu ujung kantong diikat dengan benang jahit, lalu sebanyak
4 ml enzim hasil presipitasi dimasukkan ke dalam kantong. Karena selama
dialisis volume larutan dapat meningkat, maka pengisian kantong tidak boleh
terlalu penuh. Udara dikeluarkan dari kantong dan ujung yang lain diikat erat.
Kantong berisi enzim ini kemudian dimasukkan dalam larutan bufer fosfat
0.025 M pH 6 dengan volume 100x volume filtrat. Dialisis dilakukan diruang
dingin selama semalam dan dilengkapi dengan stirrer. Selanjutnya hasil
dialisis diukur aktivitas dan kadar proteinnya.
5. Kromatografi filtrasi gel (Haliza, 2003)
a. Persiapan bahan pengepak
Tahapan awal dalam kromatografi filtrasi gel adalah melakukan
persiapan gel matriks dan kolom yang akan digunakan. Agar memperoleh gel
yang bagus maka semua peralatan harus bersih dan kering, bufer dan air yang
digunakan harus disaring terlebih dahulu. Matriks yang digunakan dalam
filtrasi gel adalah sephadex G-100. Matriks terlebih dahulu harus
dikembangkan (swelling) sebelum digunakan. Tahap pengembangan adalah
dengan menimbang sebanyak 2,5 gram sephadex G-100 dilarutkan dalam 300
ml air bebas ion sambil diaduk dengan magnetic stirer perlahan selama 30
menit, kemudian didiamkan selama 3 hari pada suhu dingin atau selama 3 jam
pada suhu 90°C. Kemudian matriks dicuci dengan bufer enzim dan diagitasi
sampai gelembung udara hilang.
b. Pembuatan kolom
Pembuatan kolom dilakukan dengan cara menuangkan matriks gel
sephadex G-100 secara perlahan tapi kontinyu. Jika terbentuk rongga udara,
bagian luar kolom diketuk sehingga rongga udara tersebut hilang. Jika tinggi
kolom gel yang diinginkan telah tercapai, bahan pengepak dibiarkan
dengan mengalirkan sejumlah bufer fosfat 0.05 M pH 6 untuk mencuci kolom.
Semua kegiatan pengepakan kolom dilakukan di ruang dingin.
c. Separasi contoh
Sebelum diaplikasikan ke dalam kolom, sampel enzim hasil dialisis
dipekatkan terlebih dahulu. Selanjutnya 2 ml sampel enzim diaplikasikan di
bagian atas kolom, kemudian didiamkan beberapa saat agar contoh
mempunyai kesempatan untuk memasuki kolom. Kemudian secara perlahan
bufer elusi yang berupa bufer fosfat 0.05 M pH 6 ditambahkan sampai
memenuhi atas kolom dan diikuti dengan perhitungan laju elusi. Fraksi-fraksi
yang keluar ditampung ke dalam 100 buah tabung reaksi dengan volume 3 ml
dengan menggunakan fraction collector.
d. Analisa fraksi
Fraksi-fraksi yang telah ditampung, kemudian dianalisis
kandungan protein dan aktivitas enzimnya. Kemudian fraksi yang memiliki
aktivitas tinggi dikumpulkan dan dianalisa karakteristiknya, yaitu suhu
optimum, pH optimum, dan stabilitas panas. Selain itu fraksi dengan aktivitas
relatif tinggi dipersiapkan untuk tahap SDS-PAGE.
6. Analisa aktivitas enzim kitosanase (Meidina, 2003)
Analisis aktivitas enzim kitosanase didasarkan pada perhitungan
gula reduksi yang diproduksi selama hidrolisis soluble kitosan. Campuran
reaksi yang terdiri dari 100 µl soluble chitosan 1%, 100 µl 0.05 M bufer fosfat
pH 6.0 dan 100 µl larutan enzim diinkubasi selama 30 menit pada suhu 70oC.
Reaksi enzimatis dihentikan dengan membekukan campuran reaksi pada suhu
-20oC selama 15 menit. Sebanyak 200 µl dari campuran diatas direaksikan
dengan 1 ml pereaksi schales dan 800 µl air bebas ion dalam tabung reaksi.
Tabung ditutup dengan alumunium foil dan dipanaskan dalam air mendidih
selama 15 menit. Setelah didinginkan , larutan disentrifugasi dengan kecepatan
8000 rpm selama 10 menit pada suhu 4oC, kemudian diukur absorbansinya
pada panjang gelombang 420 nm. Prosedur analisis aktifitas kitosanase dapat
Tabel 7. Prosedur analisa aktivitas enzim kitosanase
Bahan Substrat (µl) Kontrol (µl) Blanko (µl)
Bufer fosfat 0.05
M pH 6.0
100 100 -
Soluble chitosan
1%
100 100 -
Enzim kitosanase 100 - -
Inkubasi 30 menit 70oC
Freeze -20oC selama 15 menit
Campuran 200 133 -
Enzim - 67 -
Air bebas ion 800 800 1000
Pereaksi schales 1000 1000 1000
Dididihkan 15 menit
Sentrifugasi 8000 rpm selama 10 menit pada 4oC
Ukur absorbansi pada panjang gelombang 420 nm
Untuk pengukuran kontrol dilakukan dengan prosedur yang sama
seperti diatas, hanya saja penambahan 67 µl enzim dilakukan setelah reaksi
enzimatis dihentikan, dan campuran reaksi yang diambil adalah sebanyak 133
µl. Sebagai blanko digunakan 1 ml air bebas ion direaksikan dengan 1 ml
pereaksi schales. Untuk standar digunakan larutan standar glukosamin dengan
konsentrasi 0 – 275 µg/ml dan dilakukan dengan prosedur yang sama seperti
pada pengukuran sampel. Nilai absorbansi dari sampel, kontrol, dan blanko
dimasukan ke dalam kurva standar sehingga dapat ditentukan jumlah
glukosamin yang terkandung didalam sampel. Selanjutnya nilai glukosamin
tersebut dimasukan ke dalam rumus untuk menentukkan unit aktivitas enzim,
sedangkan penentuan aktivitas spesifik enzim dilakukan dengan cara membagi
unit aktivitas dengan konsentrasi protein. Satu unit aktivitas kitosanase
didefinisikan sebagai jumlah enzim yang dapat menghasilkan 1µmol gula
Unit aktivitas = 300 x Glc x 1 x 1000 x 1
(Unit/ml) 200 BM 100 30
GIc = [(Absorbansi (B-S) – Absorbansi (B-K)) – b]/a
Unit/mg kitosan = Unit aktivitas
[Protein]
Keterangan :
300 : Volume sampel hasil reaksi enzimatis (µl)
200 : Volume sampel untuk reaksi schales (µl)
GIc : Jumlah glukosamin sampel (µg)
BM : Berat molekul glukosamin, yaitu 215,6 (gram/mol)
1000 : Faktor konversi dari µl ke ml
100 : Volume larutan enzim/volume larutan soluble chitosan (µl)
1/100 : Konsentrasi soluble chitosan (mg/µl)
30 : Waktu inkubasi (menit)
a : Slope dari persamaan kurva standar glukosamin
b : Intercept dari persamaan kurva standar glukosamin
7. Pengukuran konsentrasi protein (Bradford, 1976)
Sebanyak 100 µl sampel ditambahkan dengan 2 ml larutan
bradford, kemudian diinkubasi pada suhu ruang selama lima menit. Protein
akan diikat oleh Coomassie Brilliant Blue G-250 yang terdapat pada pereaksi
bradford membentuk kompleks warna biru. Absorbansi larutan diukur pada
panjang gelombang 595 nm. Konsentrasi protein sampel dihitung berdasarkan
kurva standar yang dibuat dari Bovine Serum Albumin (BSA).
8. SDS-PAGE (Bollag dan Edelstein, 1991)
Elektroforesis dilakukan dengan menggunakan piranti
elektroforesis (mini vertikal). Tahapan dari elektroforesis SDS-PAGE adalah
sebagai berikut :
a. Pembuatan gel elektroforesis
Cetakan gel berupa dua lempeng kaca berukuran 10,1 x 7,5 cm
pemisah (spacer) pada bagian tepi cetakan. Susunan ini dijepit dengan klip
sehingga dapat diberdirikan. Klip tidak boleh melewati batas pemisah.
Cetakan ini diletakkan di atas lempeng kaca yang datar. Selanjutnya dibuat
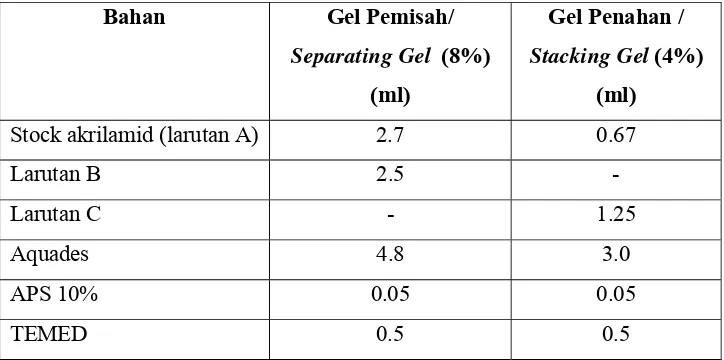
larutan gel penahan dan gel pemisah dengan komposisi sebagai berikut :
Tabel 8. Komposisi gel SDS-PAGE
(Bollag dan Edelstein, 1991)
Bahan untuk gel pemisah (separating gel) dicampur satu persatu
dengan memasukkan TEMED pada akhir campuran lalu diaduk dan dipipet
perlahan kedalam lapisan kaca sambil diusahakan agar tidak terbentuk
gelembung udara sampai 1.5 cm dari permukaan kaca lalu dibiarkan memadat
sekitar ± 30 menit. Setelah gel memadat, perlahan dimasukkan campuran gel
penahan (stacking gel) lalu masukkan sisir (10 sumur) sebagai tempat sampel
protein dan dibiarkan selama ± 30 menit hingga memadat. Setelah semua
campuran diaplikasikan pada pelat kaca, dilakukan pengecekan apakah pelat
kaca bocor atau tidak.
b. Pelarian Sampel
Sebelum diinjeksikan, sampel enzim hasil pemurnian dan crude
enzyme dipekatkan kemudian dipanaskan terlebih dahulu selama ± 3 menit,
begitu pula dengan larutan marker (standar protein). Bufer sampel 5 μl
direaksikan dengan 20μl sampel enzim yang telah dipanaskan, kemudian
Bahan Gel Pemisah/
Separating Gel (8%) (ml)
Gel Penahan /
Stacking Gel(4%) (ml)
Stock akrilamid (larutan A) 2.7 0.67
Larutan B 2.5 -
Larutan C - 1.25
Aquades 4.8 3.0
APS 10% 0.05 0.05
sumur yang terdapat pada pelat kaca sampel menggunakan hamilton syinges,
disertai dengan penginjeksian 10 μl marker (standar protein). Marker yang
digunakan adalah LMW (low moleculer weight) yang terdiri dari phosphorilase
b (97 kD), albumin (66 kD), ovalbumin (45 KD), carbonic anhydrase (30 kD),
tripsin inhibitor (20.1 kD), dan α-lactalbumin (14.4 kD).
Setelah semua sampel diinjeksikan pada sumur-sumur pelat kaca,
rangkailah alat elektroforesis dengan cara meletakkan alat elektroforesis pada
wadah yang berisi es batu. Sebelum running masukkan bufer elektroforesis
kedalam chamber. Running elektroforesis dilakukan pada 100 volt, 50 mA
atau hingga sampel hampir memasuki bagian gel pemisah. Elektroforesis
berlangsung sekitar 1,5 jam dan dilakukan sampai warna biru dari bromphenol
blue mencapai ± 1 cm dari bagian bawah gel.
c. Fiksasi dan pewarnaan
Setelah elektroforesis selesai, gel dilepaskan dari pelat kaca dan
direndam dalam larutan fiksasi (12% asam asetat dan 25% metanol) selama 1
jam, kemudian direndam dalam 50% etanol selama 20 menit dan diganti
dengan 30% etanol selama 2 x 20 menit, direndam dalam larutan enhancer
selama 1 menit dan dicuci dengan aquabidestilata selama 3 x 20 menit. Setelah
dicuci kemudian ditambahkan dengan larutan silver nitrat selama 30 menit
kemudian dicuci dengan aquabidestilata selama 2 x 20 detik dan ditambahkan
dengan larutan campuran Na2CO3 dan formaldehida sampai terlihat pita-pita
pada gel. Setelah itu untuk menghentikan reaksi pembentukan pita, gel
direndam dalam larutan fiksasi.
9. Karakterisasi Kitosanase
a. Suhu Optimum (Chasanah, 2004)
Enzim kitosanase (crude dan pure enzyme) dianalisis pada berbagai
suhu untuk menentukkan suhu optimum. Aktivitas enzim dianalisis pada suhu
b. pH Optimum (Chasanah, 2004)
Enzim kitosanase (crude enzyme) dianalisa dengan menggunakan
0.05 M bufer sitrat (pH 3), 0.05 M bufer asetat (pH 4, 5, 6), 0.05 M bufer
fosfat sitrat (pH 5), 0.05 M bufer sodium fosfat (pH 6, 7, 8), dan 0.05 M bufer
tris (pH 8). Sedangkan enzim kitosanase (pure enzyme) dianalisis pada
menggunakan bufer universal 0.05 M pada pH 4 sampai 12. Dimana crude
dan pure enzyme dianalisa pada masing-masing suhu optimumnya.
c. Stabilitas panas (Haliza, 2003)
Stabilitas panas dianalisa pada pure enzyme, berupa pengaruh suhu
dan pH terhadap stabilitas enzim. Pengaruh suhu terhadap stabilitas enzim
dilakukan dengan memanaskan enzim (tanpa substrat dan bufer) pada suhu
80oC (selama 0, 30, 60, 90, dan 120 menit) dan pada suhu 90oC (selama 0, 60
dan 120 menit) kemudian dianalisa menggunakan bufer fosfat 0.05 M pH 6.
Sedangkan pengaruh pH terhadap stabilitas enzim dilakukan dengan
memanaskan enzim dengan bufer universal pH 6.0 (tanpa substrat) pada suhu
optimum enzim selama 0, 30, 60, 90, dan 120 menit.
Pengukuran stabilitas enzim dinyatakan dalam nilai k, t1/2, dan Ea.
Nilai k suatu enzim adalah konstanta laju deaktifasi enzim dari model
eksponensial perubahan konsentrasi dan merupakan slope dari plot ln [C]
terhadap waktu.
ln [C] = -K [t] + ln [Co] ... (1)
[Co] = aktivitas enzim pada awal inkubasi
[t] = waktu inkubasi
Nilai t1/2 suatu enzim adalah waktu inkubasi pada suhu tertentu
yang menyebabkan aktivitas enzim tinggal 50% dari aktivitas semula.
t1/2 = - ln (0.5) ... (2)
k
Energi aktifasi (Ea) dapat ditetapkan secara grafik berdasarkan
persamaan Arrhenius. Persamaan ini merupakan hubungan laju reaksi
terhadap suhu absolut. Ea merupakan slope dari ln k terhadap suhu absolut
K = Ao [e]-Ea/RT (Persamaan Arrhenius)
ln k = -Ea [1/T] + ln ko ... (3)
R
Keterangan :
K : Konstanta laju deaktifasi
T : Suhu absolut (oK)
Ea : Energi aktifasi (kkal/(gmol.oK)
R : Tetapan gas (1.987 kal/(gmol.oK)